-
Medical journals
- Career
Toxická hepatitída po Polygonum multiflorum
Authors: A. Baňárová; T. Koller; J. Payer
Authors‘ workplace: V. interná klinika Lekárskej fakulty UK a UN Bratislava, Slovenská republika, prednosta prof. MUDr. Juraj Payer, CSc.
Published in: Vnitř Lék 2012; 58(12): 958-962
Category: Case Report
Overview
Toxické poškodenie pečene je častou príčinou akútnej hepatitídy. Prezentujeme kazuistiku 33-ročnej pacientky s toxickým poškodením pečene spôsobeným nezvyčajným agensom – extraktom z čínskej rastliny Polygonum multiflorum. Pacientka bola prijatá s laboratórnym obrazom hepatocelulárneho poškodenia a klinickým obrazom nauzey a ikteru nasledujúcimi 2-mesačné užívanie tabletových extraktov Polygonum multiflorum. Iné príčiny hepatocelulárneho poškodenia boli vylúčené. Kauzalita medzi hepatocelulárnym poškodením a užívaním Polygonum multiflorum bola podporená skorou úpravou stavu po vysadení agensu, medzinárodným skórovacím systémom kauzality lieku a hepatotoxicity a rovnako údajmi z literatúry. Berúc do úvahy rastúcu popularitu rastlinných preparátov ako doplnkov výživy vyzývame k opatrnosti pri ich užívaní.
Kľúčové slová:
toxická hepatitída – Polygonum multiflorumÚvod
Rastlinné preparáty patria v súčasnosti medzi populárne doplnky výživy. Sľubujú celkové zlepšenie fyzického a psychického stavu a alternatívnu liečbu rôznych druhov ochorení. Na druhej strane pribúdajú údaje o riziku ich užívania [1,2]. Polygonum multiflorum, známe tiež ako Fallopia multiflora alebo pod slovenským názvom stavikrv mnohokvetý, je ázijská popínavá bylina dosahujúca výšky 2–4 m, ktorej koreň sa používa na výrobu vodných, alkoholových alebo tabletových extraktov (obr. 1). V Ázii sa často stretávame s užívaním prírodnej, „surovej“ formy v podobe vodného alebo alkoholového extraktu. Prípravky začínajú byť populárne aj v západných krajinách. Pripisujú sa im viaceré pozitívne účinky, najmä zaručenie dlhovekosti, či zabránenie šedivenia a vypadávania vlasov (obchodný názov prípravku Shou-Wu-Pian znamená „čierna hlava“). Prinášame prípad pacientky, u ktorej dlhodobé užívanie prípravku viedlo k toxickému poškodeniu pečene.
Image 1. Polygonum multiflorum. 
Popis prípadu
33-ročná pacientka bola prijatá na V. internú kliniku LF UK a UN Bratislava pre asi 3 týždne trvajúce dyspeptické ťažkosti a nechutenstvo, ku ktorým sa posledný týždeň pridružil ikterus a tmavý moč. V osobnej anamnéze pacientka prekonala gastritídu Helicobacter pylori 4 mesiace pred prijatím, pacientka vtedy nepodstúpila štandardnú eradikačnú liečbu antibiotikami a inhibítormi protónovej pumpy. Ďalšia osobná anamnéza ako aj lieková anamnéza boli negatívne. Pacientka neužívala hormonálnu antikoncepciu, udávala len užívanie „vitamínov“. Podrobnejším rozborom sme zistili že sa jednalo o 200 mg tablety obsahujúce výťažok z koreňa Polygonum multiflorum. Tieto pacientka užívala spolu 4 mesiace a vysadila ich 3 dni pred prijatím do nemocnice. Počas 4-mesačného užívania udávala mesačnú pauzu 6 týždňov po začatí užívania (nemala prípravok aktuálne k dispozícii). Z patologických vitálnych funkcií udávala pacientka nechutenstvo a tmavší moč. Priznávala príležitostný konzum alkoholu, ktorý bol intenzívnejší v priebehu vianočných sviatkov, čo zodpovedalo dobe 3 týždne pred objavením sa ikteru. Vtedy udávala v priebehu asi 2 týždňov 5krát konzum alkoholu v množstve asi 3–4 jednotky denne. Posledný deň pila alkohol týždeň pred objavením sa prvých príznakov v zmysle nechutenstva a 3 týždne pred objavením sa ikteru.
Pri príjme sme v objektívnom fyzikálnom vyšetrení konštatovali ikterus kože a sklér a raš na dorze pravej ruky pripomínajúci atopický ekzém. Vo vstupných odberoch sme zistili zvýšené hodnoty celkového a konjugovaného bilirubínu, niekoľkonásobne zvýšené aminotransferázy a ľahko zvýšené cholestatické enzýmy (tab. 1). Ostatné laboratórne výsledky, vrátane parametrov syntetickej funkcie pečene (koagulačné parametre, cholínesteráza, albumín, celkové bielkoviny) a krvného obrazu boli v medziach normy. Sonografické vyšetrenie brucha bolo bez patológie, na MRCP bola konštatovaná zväčšená pečeň, bez inej patológie v oblasti hepatobiliárneho systému. U pacientky sme vylúčili vírusové hepatitídy, metabolické ochorenia pečene (hemochromatóza, Wilsonova choroba) a autoimunitné ochorenia hepatobiliárneho systému. Pacientka netrpela nadváhou, v lipidovom spektre mala len ľahko zvýšenú hodnotu HDL-cholesterolu, na základe čoho sme nepredpokladali podiel steatohepatitídy. Etyltoxický pôvod hepatitídy bol nepravdepodobný vzhľadom na laboratórny nález (pomer aminotransferáz zvýšený v prospech ALT, len minimálne elevované GMT) a rovnako subjektívna a objektívna anamnéza tomu nenasvedčovali. Vyšetrenia realizované v rámci diferenciálnej diagnostiky sú zhrnuté v tab. 2. Per exclusionem sme suponovali diagnózu toxického poškodenia pečene prípravkom Polygonum multiflorum s eventuálnou potenciáciou alkoholom. 4. deň po vysadení prípravku pozorujeme spontánny pokles bilirubínu aj aminotrasferáz, ktorý sa pozvoľna upravil na takmer fyziologické hodnoty do mesiaca (graf 1 a 2). Biopsiu pečene sme vzhľadom na rýchly ústup ťažkostí a spontánny pokles bilirubínu a aminotransferáz neindikovali.
Table 1. Vstupné hodnoty bilirubínu a „hepatálnych enzýmov“. 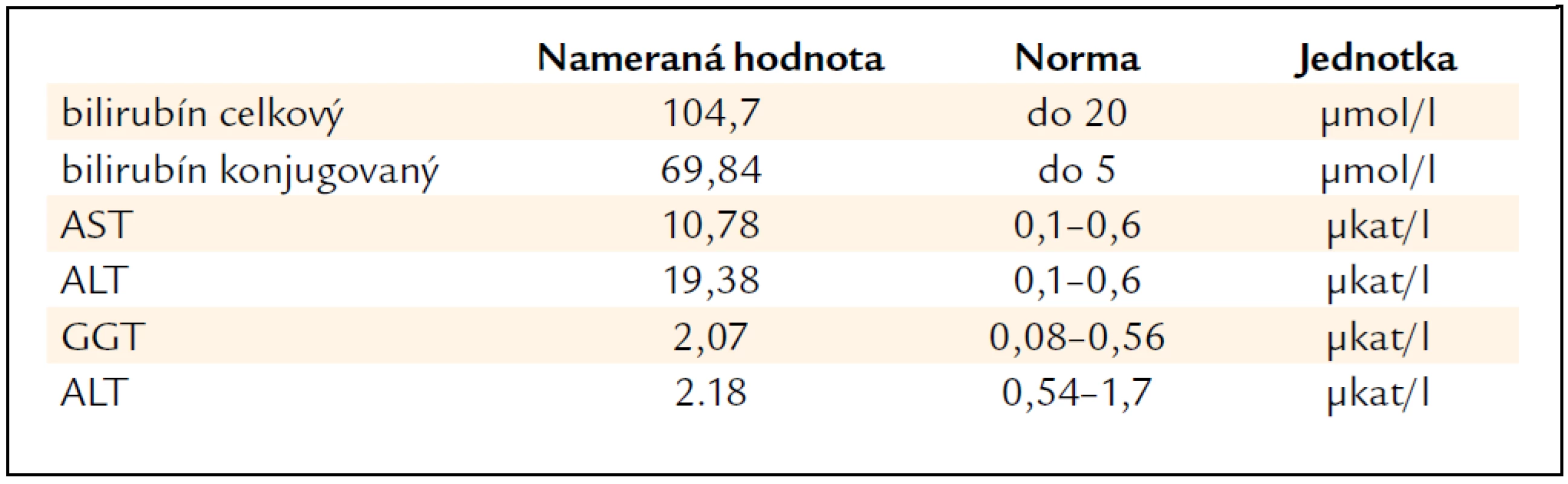
Table 2. Vyšetrenia realizované v rámci diferenciálnej diagnostiky. 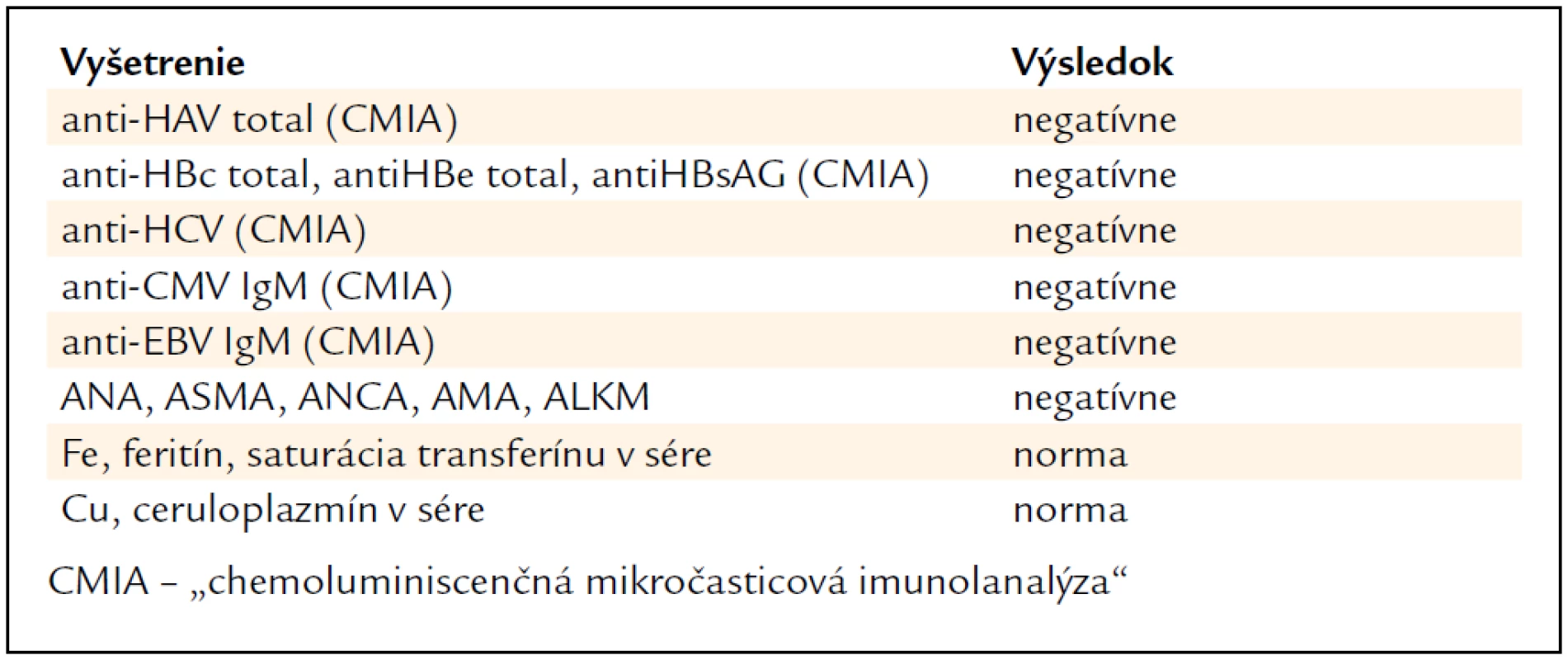
Graph 1. Dynamika aminotransferáz a cholestatických enzýmov čase. 
Graph 2. Dynamika celkového a konjugovaného bilirubínu v čase. 
Diskusia
V literatúre je popisovaných niekoľko prípadov hepatálneho poškodenia po prípravkoch obsahujúcich Polygonum multiflorum. Najviac prípadov bolo popísaných v ázijských krajinách [3–5]. Spektrum prípadov vzhľadom na ľahkú dostupnosť koreňa zahŕňa v týchto krajinách najmä hepatitídu po požití prírodnej formy, najčastejšie ako vodný alebo alkoholový extrakt. Ojedinelé ďalšie prípady boli zaznamenané v Európe [6,7], Austrálii [8] a Kolumbii [9]. V západných krajinách sa stretávame skôr s prípadmi po požití tabletových extraktov – najčastejšie ako 200 mg tablety pod názvom Shen Min, Shou-Wu-Pian, Fo-Ti alebo Lifestar. Všetky spomínané prípravky sa dajú nájsť i v slovenských alebo českých webových predajniach. Doporučené dávkovanie je od 2 do 15 tabliet denne, pričom cena prípravkov nebýva malá. Len ojedinele je uvedené upozornenie o možných nežiaducich účinkoch. Prípravky patria pod rastlinné produkty, ktoré sú voľno predajné, nie sú registrované v medicínskych databázach a nepodliehajú tak povinnému hláseniu o nežiaducich účinkoch. Okrem zabránenia šediveniu a vypadávaniu vlasov sú im pripisované viaceré priaznivé účinky, predovšetkým na neurokognitívny systém (zlepšovanie pamäte, koncentrácie), zmierňovanie klimakterického syndrómu a dokonca hepatoprotektívny a renoprotektívny účinok. Polygonum multiflorum – jeho zloženie a účinky – však zostávajú zatiaľ na patofyziologickej a farmakodynamickej úrovni otáznikom. Farmaceutický výskum sa v posledných rokoch intenzívne zaoberá analýzou jednotlivých zložiek koreňa rastliny a ich účinkami. Jedným z predmetov výskumu je aj rozdiel v zložkách surovej a upravenej rastliny. Hlavné zložky koreňa sú antrachinóny – emodín, fyscoín a TSG (2,3,5,4’-tetrahydroxy-stilbene-2-O--β-D-glukozid). Po spracovaní koreňa sa mení obsah zložiek: stúpa hladina emodínu a fyscoínu a klesá TSG [10]. Keďže sa za rizikovejšiu pokladá surová forma [11], logicky sa dedukuje, že potenciálnym kauzálnym činiteľom bude TSG. Iné štúdie na ľudských L02 hepatocytoch in vitro favorizujú ako hepatotoxický agens naopak emodín (indukcia apoptózy hepatocytu), ale predpokladajú, že TSG a fyscoín môžu mať potencujúci efekt [12]. Alkoholové extrakty sa považujú za rizikovejšie ako vodné [12]. Uvedené hypotézy sú v štádiu skúmania a presný mechanizmus zostáva zatiaľ neznámy. Vyskytli sa úvahy o možnom idiosynkratickom efekte zložiek Polygonum multiflorum [3,9]. Vychádzajú z faktu, že niekoľko prípadov sa vyskytlo u jedného z dvojice užívateľov, ktorí výťažok užívali v rovnakej frekvencii, dávke a dĺžke, avšak len u jedného z nich sa pri rovnakej životospráve vyskytlo hepatálne poškodenie [4]. Ďalšie podporné fakty tejto teórie sú kožný raš ako sprevádzajúci klinický príznak a výskyt eozinofílie u niektorých pacientov [9]. Skupina čínskych vedcov zistila, že etanolový extrakt Polygonum multiflorum aktivuje PXR signalizujúcu dráhu a indukuje CYP3A4 (súčasť CYP450) [13]. Následné metabolizéry CYP3A4 (v našom prípade alkohol) môžu prispieť k hepatocelulárnemu poškodeniu. To mohol byť i prípad našej pacientky. Podobnou úvahou sa zaoberal aj autor najväčšieho doposiaľ publikovaného prehľadu s analýzou 25 prípadov poškodenia pečene po Polygonum multiflorum [3]. V uvedenom prehľade pacient, ktorý užíval Polygonum multiflorum v teréne alkoholovej cirhózy pečene (avšak dlhodobo abstinujúci), zomrel na akútne hepatálne zlyhanie 30 dní po začatí užívania prípravkov Polygonum multiflorum. Iný pacient bol dlhodobo warfarinizovaný a následné užívanie Polygonum multiflorum viedlo po 90 dňoch k akútnemu hepatocelulárnemu poškodeniu. Hepatálne testy sa začali významnejšie upravovať až po vysadení warfarínu. Preto autor predpokladá interakciu medzi pôsobením Polygonum multiflorum a inými potenciálne hepatotoxickými látkami (alkohol, warfarín). Rovnako ako v našom prípade je charakter poškodenia pečene u väčšiny pacientov hepatocelulárny. Ojedinele sa vyskytlo i zmiešané [3] alebo cholestatické poškodenie [6]. Nástup ťažkostí je niekoľko dní až mesiacov od začiatku užívania. Ťažkosti sa prejavia ikterom, nešpecifickými bolesťami brucha, nechutenstvom a slabosťou. Predpokladá sa, že mnoho pacientov je asymptomatických, preto môže byť reálny výskyt hepatotoxicity vyšší [3].
Stanovenie diagnózy liekmi indukovanej hepatotoxicity nemusí byť vždy jednoduché. Najčastejšie je stanovená per exclusionem a za najvýznamnejšie diagnostické kritéria sa považuje časová asociácia začiatku užívania a nástupu ťažkostí (5–90 dní), úprava stavu po vynechaní lieku a v literatúre dokumentované údaje o hepatotoxicite [14]. Hepatoxicitu liekov a rastlinných prípravkov môžeme rozdeliť na predvídateľnú a nepredvídateľnú [15]. Predvídateľná hepatotoxicita je spôsobená priamo liekom alebo jeho metabolitom, je závislá od dávky a časový nástup od začiatku užívania do nástupu ťažkostí býva krátky (niekoľko dní). Typickým príkladom je paracetamol. Podstatne náročnejšie je stanovenie vzťahu lieku a hepatálneho poškodenia v prípade nepredvídateľnej hepatotoxicity. V patomechanizme sa uplatňujú imunopatologické reakcie: hypersenzitívne a idiosynkratické. Sprevádzané môžu byť rašom a eozinofíliou. Nástup býva typicky po dlhšej dobe užívania (niekoľko týždňov až mesiacov) a sú od dávky nezávislé. Na posúdenie kauzality lieku a hepatálneho poškodenia sa používajú skórovacie systémy. Klasickým je tzv. CIOM/RUCAM (Council for International Organizations of Medical Sciences/Roussel Uclaf Causality Assessment Method) skórovací systém. Zahŕňa viacero faktorov vrátane času nástupu príznakov od začiatku užívania lieku, času do ústupu príznakov po vysadení lieku, dynamiku hepatálnych testov po vysadení, súčasné užívanie alkoholu, vek pacienta, prvé vs. opakované užitie lieku, inú súčasnú liečbu, exklúziu iných príčin hepatálneho poškodenia, typ hepatálneho poškodenia, reakciu na znovunasadenie prípravku a predchádzajúce údaje o hepatotoxicite [16]. Ak v škále pacient dosiahne viac ako 8 bodov, je pravdepodobnosť kauzality lieku a hepatálneho poškodenia „definitívna alebo vysokopravdepodobná“. Naša pacientka mala podľa tohto skórovacieho systému 8 bodov, čiže pravdepodobnosť hepatotoxicity Polygonum multiflorum je „pravdepodobná“ (tab. 3).
Table 3. Hodnotenie kauzality pomocou CIOM/RUCAM skórovacieho systému (pre hepatocelulárne poškodenie). 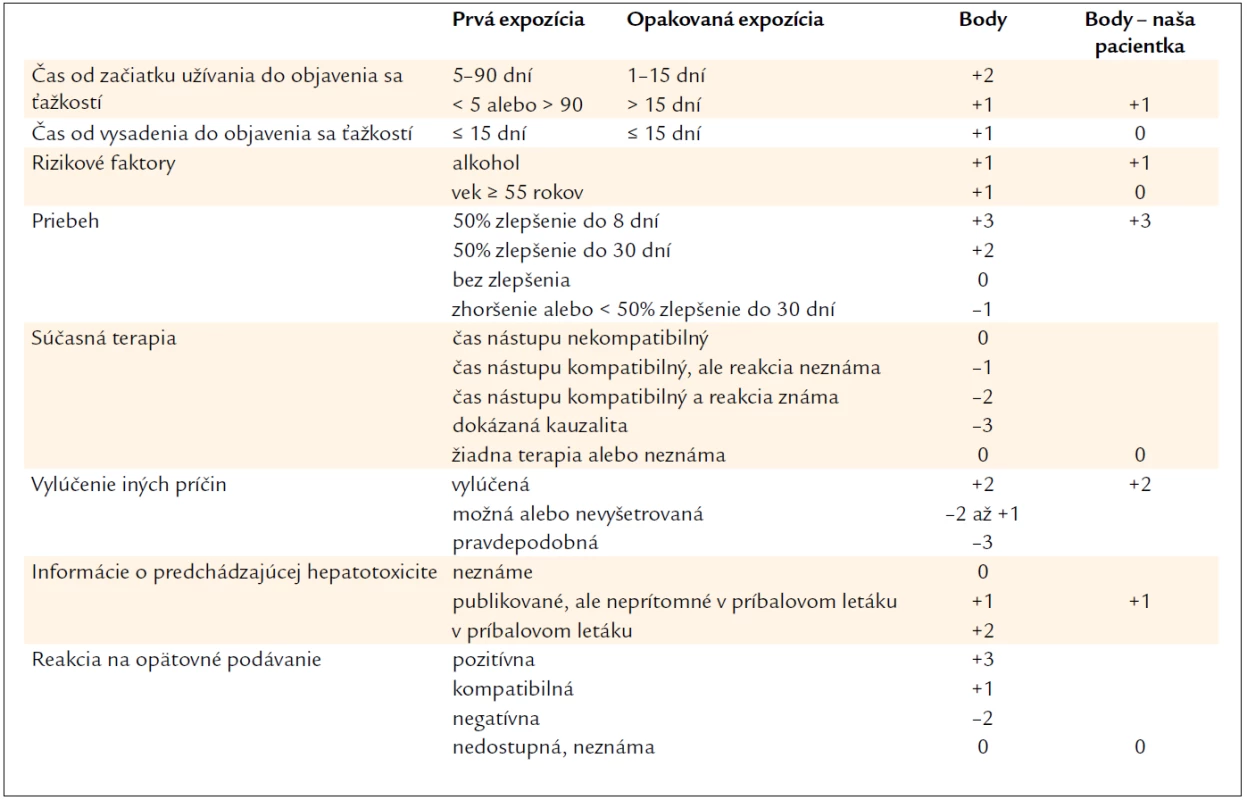
Veľmi silným faktorom vzťahu kauzality lieku/rastlinného prípravku a hepatálneho poškodenia je reakcia na znovunasadenie. Vo vyššie spomínanom kórejskom prehľade 25 prípadov hepatotoxicity Polygonum multiflorum sa u 61-ročného muža, ktorý mal hepatotoxicitu po Polygonum multiflorum v anamnéze pred 10 mesiacmi, vyskytla opakovaná hepatotoxicita po užití jedinej dávky prípravku so spontánnou úpravou aminotransferáz po vysadení [3].
Biopsia pečene by nesporne predstavovala významnú aditívnu hodnotu pre našu kazuistiku. Vyšetrenie však nie je bez rizika a pozorujúc promptnú úpravu laboratórnych parametrov po vysadení prípravku sme od tejto indikácie upustili. Obdobne v sumári 25 prípadov akútnej hepatitídy po Polygonum multiflorum nebola biopsia pečene realizovaná u 13 pacientov pre rýchly ústup ťažkostí [3].
V našom prípade vzhľadom na to, že mechanizmus toxicity Polygonum multiflorum nie je známy, neexistuje ani kauzálna liečba. Základom je odstrániť vyvolávajúcu noxu. Glukokortikoidy sa v liečbe toxickej a medikamentmi indukovanej hepatitídy neosvedčili, preto sa ich podávanie v týchto prípadoch neodporúča. Jedným z dôvodov je aj riziko infekcie pri imunosupresii. Rovnako neúčinné sú hepatoprotektíva. U pacientov s toxickou hepatitídou je potrebné sledovať syntetickú funkciu pečene, predovšetkým hladinu faktora V. Ak dôjde k jeho poklesu pod 50 %, jedná sa o hepatitídu ťažkého stupňa a pacienta je potrebné odoslať do transplantačného centra. Ak dôjde k poklesu faktora V pod 30 % u ľudí nad 30 rokov a pod 20 % u ľudí pod 30 rokov a pacient má znaky encefalopatie, tak hovoríme o fulminantnom priebehu (do 1 mesiaca) alebo subfulminantnom priebehu (do 3 mesiacov). Vtedy pacient spĺňa tzv. Clichy kritéria indikácie transplantácie pečene. Za týmto účelom je možné monitorovať aj MELD skóre vypočítané z aktuálneho INR, sérového bilirubínu a kreatinínu [17]. Do doby transplantácie liečime akútne hepatálne zlyhanie najmä prevenciou komplikácií – stabilizáciou krvného obehu, prevenciou infekcie, eliminačnými metódami (MARS) a čakáme buď na darcu, alebo na znaky spontánnej regenerácie pečene (vzostup faktora V).
Záver
V sumári naša kazuistika prináša prvý publikovaný prípad hepatotoxicity Polygonum mutliflorum na území Slovenskej a Českej republiky a jeden z mála publikovaných prípadov v Európe. Ponúka úvahu o možnej potenciácii sa hepatotoxického účinku výťažkov Polygonum multiflorum a alkoholu. Prízvukuje dôležitosť anamnézy v pátraní po príčinách hepatálneho poškodenia. Jej hlavným cieľom zostáva upozorniť na opatrnosť pri užívaní voľnopredajných rastlinných preparátov a snáď i snaha o docielenie povinnosti informovať predajcov o možných nežiaducich účinkoch.
MUDr. Adriana Baňárová
www.fmed.uniba.sk
e-mail: adriana.banarova@gmail.com
Doručeno do redakce: 17. 7. 2012
Přijato po recenzi: 23. 9. 2012
Sources
1. Estes JD, Stolpman D, Olyaei A et al. High prevalence of potentially hepatotoxic herbal supplement use in patients with fulminant hepatic failure. Arch Surg 2003; 138; 852–858.
2. Stedman C. Herbal hepatotoxicity. Semin Liver Dis 2002; 22 : 195–206.
3. Kyoung AJ, Hyun JM, Seung SY et al. Drug-Induced Liver Injury: Twenty Five Cases of Acute Hepatitis Following Ingestion of Polygonum multiflorum Thunb. Gut and Liver 2011; 5/4 : 493–499.
4. Furukawa M, Kasajima S, Nakamura Y et al. Toxic hepatitis induces by show-wu-pian, a chinese herbal preparation. Intern Med 2010; 49 : 1537–1540.
5. But PP, Tomlinson B, Lee KL et al. Hepatitis related to the Chinese medicine Shou-wu-pian manufactured from Polygonum multiflorum. Vet Hum Toxicol 1996; 38 : 280–282.
6. Mazzanti G, Battinelli L, Daniele C et al. New case of acute hepatitis following the consumption of ShouWuPian, a Chinese herbal product derived from Polygonum multiflorum. Ann Intern Med 2004; 140: W30.
7. Panis B, Wong DR, Hooymans PM et al. Recurrent toxic hepatitis in a Caucasian girl related to the use of Shou-Wu-Pian, a Chinese herbal preparation. J Pediatr Gastroenterol Nutr 2005; 41 : 256–258.
8. Park GJ, Mann SP, Ngu MC et al. Acute hepatitis induced by Shou-Wu-Pian, a herbal product derived from Polygonum multiflorum. J Gastroenterol 2001; 16 : 115–117.
9. Cárdenas A, Restrepo JC, Sierra F et al. Acute hepatitis due to shen-min: a herbal product derived from Polygonum multiflorum. J Clin Gastroenterol 2006; 40 : 629–632.
10. Liang Z, Chen H, Yu Z et al. Comparison of raw and processed Radix Polygoni Multiflori (Heshouwu) by high performance liquid chromatography and mass spectrometry. Chin Med 2010; 12 : 29.
11. Wu X, Chen X, Huang Q et al. Toxicity of raw and processed roots of Polygonum multiflorum. Fitoterapia 2012; 83 : 469–475.
12. Yu J, Xie J, Mao XJ et al. Hepatoxicity of major constituents and extractions of Radix Polygoni Multiflori and Radix Polygoni Multiflori Praeparata. J Ethnopharmacol 2011; 137 : 1291–1299.
13. Yu C, Chai X, Yu L et al. Identification of novel pregnane X receptor activators from traditional Chinese medicines. J Ethnopharmacol 2010; 136 : 137–143.
14. Maddrey WC. Drug-Induced Hepatotoxicity. J Clin Gastroenterol 2005; 39 : 83–89.
15. Kaplowitz N. Drug-Induced Liver Injury. Clin Infect Dis 2004; 38: S44–S48.
16. Andrade RJ, Robles M, Fernández-Castaner A et al. Assessment of drug-induced hepatotoxicity in clinical practice: A challenge for gastroenterologists. World J Gastroenterol 2007; 13 : 329–340.
17. Yantorno SE, Kremers WK, Ruf AE et al. MELD is superior to King’s college and Clichy’s criteria to assess prognosis in fulminant hepatic failure. Liver Transpl 2007; 13 : 822–828.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 12-
All articles in this issue
- Výsledky léčby AL-amyloidózy léčebnými režimy obsahujícími bortezomib, dexametazon a dále cyklofosfamid anebo doxorubicin
- Je protidoštičková liečba vždy účinná?
- Naše zkušenosti s léčbou primárních lymfomů centrálního nervového systému
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Primární řasinky buněk kardiovaskulárního aparátu
- Změny na úrovni populace zaměřené na podporu kardiovaskulárního zdraví
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Toxická hepatitída po Polygonum multiflorum
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Je protidoštičková liečba vždy účinná?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

