-
Medical journals
- Career
Výsledky léčby AL-amyloidózy léčebnými režimy obsahujícími bortezomib, dexametazon a dále cyklofosfamid anebo doxorubicin
Authors: Z. Adam 1; M. Štork 1; L. Pour 1; M. Krejčí 1; L. Zahradová 1; V. Sandecká 1; R. Hájek 1; Z. Čermáková 2; Y. Pospíšilová 1; M. Navrátil 1; Z. Král 1; J. Mayer 1
Authors‘ workplace: Interní hematologická a onkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Milan Dastych, CSc., MBA 2
Published in: Vnitř Lék 2012; 58(12): 896-903
Category: Original Contributions
Overview
Systémovou AL-amyloidózu lze rozdělit dle kritérií pro mnohočetný myelom na primární systémovou AL-amyloidózu, kdy sice je přítomna monoklonální gamapatie, ale nejsou naplněna kritéria mnohočetného myelomu, a dále na systémovou AL-amyloidózu při mnohočetném myelomu. Mezi oběma jednotkami je kontinuální přechod. V naší práci popisujeme léčbu pacientů s prokázanou systémovou AL-amyloidózou, u nichž byla naplněna kritéria symptomatického mnohočetného myelomu International Myeloma Working Group z roku 2003 (prokázaný monoklonální imunoglobulin, v kostní dřeni prokázané klonální plazmocyty a alespoň jeden z klinických příznaků myelomu – průkaz amyloidu). Od roku 2009 bylo na našem pracovišti léčeno kombinovanou léčbou s bortezomibem celkem 10 pacientů, kteří měli AL-amyloidózu při mnohočetném myelomu. Soubor se skládá z 5 žen a 5 mužů. Medián věku těchto pacientů s AL-amyloidózou v době diagnózy byl 65,5 let. Všech 10 pacientů bylo léčeno kombinací 3 léků, bortezomib, cyklofosfamid a dexametazon, anebo bortezomib, doxorubicin a dexametazon. Ze souboru 10 pacientů 2 zemřeli v 1. měsíci léčby. U těchto pacientů nelze hodnotit léčebnou odpověď. Hematologickou léčebnou odpověď jsme mohli hodnotit pouze u 8 pacientů. U 6 z 8 pacientů došlo k vymizení monoklonálního imunoglobulinu s negativní imunofixací v moči a v séru a k normalizaci hodnot volných lehkých řetězů imunoglobulinů. Léčebnou odpověď dle současných kritérií IMWG musíme hodnotit jako velmi dobrou parciální remisi (very good partial remission – VGPR), neboť jsme neprovedli vyšetření kostní dřeně po ukončení léčby s cílem potvrdit kompletní remisi dle současných kritérií. Jeden z 8 hodnocených pacientů zemřel při progresi nemoci ve 3. měsíci léčby a u jednoho nedošlo k žádné hematologické léčebné odpovědi, stav jsme u něho hodnotili jako stabilní choroba. Orgánová léčebná odpověď byla hodnocena jen u pacientů, kteří byli sledováni déle než 3 měsíce léčby. Orgánovou léčebnou odpověď (zmenšení poškození srdce) nebylo možné hodnotit u pacienta, který měl napřed transplantováno srdce a pak teprve dostával chemoterapii. Celkem 5 (83 %) ze 6 hodnocených pacientů splnilo kritérium orgánové léčebné odpovědi.
Závěr:
V našem malém souboru jsme prokázali vysoký počet hematologických léčebných odpovědí (VGPR u 75 % léčených) i orgánových léčebných odpovědí u pacientů se systémovou AL-amyloidózou, kteří byli léčeni léčebnými režimy obsahujícími bortezomib.Klíčová slova:
AL-amyloidóza – mnohočetný myelom – bortezomibÚvod
Amyloidóza je termín pro choroby způsobné depozity patologických bílkovin ve formě amyloidu v orgánech a v tkáních. Existuje mnoho patologických proteinů, které mohou vytvářet amyloidová depozita. Nejčastější ze všech existujících amyloidóz je AL-amyloidóza, nemoc způsobená ukládáním amyloidotvorných monoklonálních volných lehkých řetězců imunoglobulinů, jak uvádí Ščudla [1] a Merlini [2].
O AL-amyloidóze toho bylo v české a slovenské literatuře již hodně napsáno [3–19]. Smrt nemocného způsobují amyloidotvorné volné lehké řetězce, které se deponují v tkáních a poškozují je. Biologická (proliferační) charakteristika plazmocytů, které tvoří amyloidogenní volné lehké řetězce, může mít jak benigní, tak maligní charakter.
V některých případech AL-amyloidózy odpovídá biologická, proliferační (a tedy i početní) charakteristika patologických klonálních plazmocytů v kostní dřeni stavu, který se dříve nazýval benigní monoklonální gamapatie, nyní nese název monoklonální gamapatie nejistého významu (MGUS – monoclonal gammopathy of undetermined significance). MGUS má ve své definici nízký počet plazmocytů v kostní dřeni a podmínku, že monoklonální imunoglobulin nepoškozuje tělo člověka.
V jiných případech odpovídá biologická a proliferační (i početní) charakteristika klonálních plazmocytů v kostní dřeni mnohočetnému myelomu.
Mezi výše uvedenými formami však neexistuje ostrá hranice, jde o kontinuální přechod.
Z ryze formálního hlediska lze AL-amyloidózu rozčlenit do 2 skupin:
- A) častější systémová AL-amyloidóza. Tato forma způsobuje difuzní depozita amyloidových hmot v jednom či více orgánech;
- B) vzácnější ložisková AL-amyloidóza. Zde se předpokládá lokální produkce a deponování amyloidotvorných lehkých řetězců imunoglobulinů. Tato forma tvoří 1 či více izolovaných ložisek [20].
Systémovou AL-amyloidózu lze pak formálně členit do následujících kategorií:
- primární systémová AL-amyloidóza, což je popisný název pro systémovou depozici amyloidu v 1 či více orgánech bez naplnění kritérií mnohočetného myelomu;
- systémová AL-amyloidóza při mnohočetném myelomu, neboli též mnohočetný myelom se systémovou AL-amyloidózou. U těchto pacientů jsou naplněna kritéria mnohočetného myelomu, a tedy systémová AL-amyloidóza je vlastně projevem mnohočetného myelomu.
Léčba AL-amyloidózy má 3 základní specifika:
- a) vzhledem k své vzácnosti je nemoc diagnostikována často hodně pozdě (někdy až při pitvě) a léčba u velmi pokročilých forem je neúspěšná či nemožná;
- b) léčba dle protokolů, které jsou stejné jak pro léčbu AL-amyloidózy, tak pro léčbu mnohočetného myelomu, mívá u AL-amyloidózy mnohem více komplikací, protože pacienti s AL-amyloidózou mají poškozené životně důležité orgány depozity amyloidu;
- c) cílem léčby je dosáhnout kompletního vymizení tvorby amyloidotvorných klonálních volných lehkých řetězců, protože pak teprve mohou nastoupit reparační pochody, které vedou k ústupu depozit amyloidu a ke zlepšení funkce orgánů, neboli k orgánové léčebné odpovědi [21].
V posledních letech se objevily četné publikace, které v rámci klinických studií fáze I a II popisují velmi dobré výsledky léčebných postupů obsahujících bortezomib. Sitia uvádí hypotézu, že pro AL-amyloidózu představuje bortezomib cílenou léčbu [22]. V následujících odstavcích shrnujeme naše zkušenosti s bortezomibem u této diagnózy.
Soubor nemocných a léčba
Soubor nemocných a klinické příznaky, které byly indikací k léčbě
V posledních 3 letech (od roku 2009) bylo na našem pracovišti léčeno kombinovanou léčbou s bortezomibem celkem 10 pacientů (tab. 2), kteří měli AL-amyloidózu při mnohočetném myelomu.
Soubor se skládá z 5 žen a 5 mužů. Medián věku těchto pacientů s AL-amyloidózou v době diagnózy byl 65,5 let. U 6 pacientů bylo diagnostikováno postižení ledvin s nefrotickým syndromem. Celkem u 6 pacientů bylo podezření či prokázané postižení srdce depozity amyloidu. Pouze 1 pacient z této skupiny s postižením srdce absolvoval napřed transplantaci srdce od kadaverózního dárce a pak léčbu AL-amyloidózy.
Diagnóza AL-amyloidózy byla stanovena na základě histologického průkazu amyloidu (případně imunohistochemického potvrzení AL-amyloidu) ve tkáni nejméně jednoho orgánu při současném biochemickém průkazu monoklonální gamapatie s klonálními volnými lehkými řetězci imunoglobulinů λ nebo κ.
Následovalo standardní vyšetření s cílem prokázat případný mnohočetný myelom, tak jak jej definují kritéria International Myeloma Working Group z roku 2003 [23] (tab. 1a a 1b). Tato kritéria vyžadují pro splnění definice mnohočetného myelomu průkaz klonality plazmocytů v kostní dřeni, bez početní specifikace.
Tab. 1a. Kritéria symptomatického myelomu (International Myeloma Working Group, 2003 [23]). ![Tab. 1a. Kritéria symptomatického myelomu (International Myeloma Working Group, 2003 [23]).](https://pl-master.mdcdn.cz/media/image/1bc80dcf089781dace740a2ba502fdb3.png?version=1537790367)
Tab. 1b. Kritéria poškození orgánů či tkání myelomem (CRAB; nebo též M-ROTI – Myeloma Releated Organ and Tissue Impariment, International Myeloma Working Group, 2003 [23]). ![Tab. 1b. Kritéria poškození orgánů či tkání myelomem (CRAB; nebo též M-ROTI – Myeloma Releated Organ and Tissue Impariment, International Myeloma Working Group, 2003 [23]).](https://pl-master.mdcdn.cz/media/image/31ab5fde2e3e94ef218f0094e883010a.png?version=1537790367)
Léčba
Všech 10 pacientů bylo léčeno kombinací 3 léků, cyklofosfamid, bortezomib – Velcade® a dexametazon (užívaný akronym je CVD), anebo bortezomib – Velcade®, doxorubicin a dexametazon (užívaný akronym je BDD).
Obvyklé dávkování u režimu CVD je: cyklofosfamid (buď perorálně 50 mg denně dlouhodobě, nebo 500 mg/m2 i.v. infuze ve 14denních intervalech), bortezomib (1,3 mg/m2 i.v. 1., 4., 8. a 15. den ve 28denním cyklu) a dále dexametazon (20 mg p.o. 1.–4. den a 15.–18. den 28denního cyklu).
Obvyklé dávkování u režimu BDD je bortezomib (1,3 mg/m2 i.v.), doxorubicin (9 mg/m2 i.v.) a dexametazon (20 nebo 40 mg i.v.) Všechny 3 uvedené léky jsou podávány nitrožilně 1., 4., 8. a 15. den 28denního cyklu.
Léčbu jsme zahajovali za hospitalizace a při dobré toleranci ji pak podávali ambulantně.
Výsledky léčby
Hematologickou léčebnou odpověď jsme hodnotili dle kritérií z roku 2009. Tato kritéria již vyžadují hodnocení kostní dřeně u pacientů, u nichž má být léčebná odpověď vyhodnocena jako kompletní remise [24], zatímco u starších kritérií byla kompletní remise definována pouze biochemicky negativní imunofixací.
Orgánovou léčebnou odpověď jsme hodnotili dle kritérií z roku 2005 [25], a to jenom u těch pacientů, kteří byli sledováni nejméně 3 měsíce po ukončení léčby.
Ze souboru 10 pacientů zemřeli 2 pacienti v 1. měsíci léčby, důvodem bylo pokročilé poškození organizmu amyloidem a infekční komplikace. U těchto pacientů nelze vůbec hodnotit léčebnou odpověď. Hematologickou léčebnou odpověď jsme mohli hodnotit pouze u 8 pacientů. Z těchto 8 pacientů zemřel 1 ve 3. měsíci léčby, stav jeho nemoci jsme hodnotili jako progresi. Jeden pacient dokončil plánovaný počet cyklů chemoterapie CVD, nesplnil však kritéria parciální remise, takže jsme účinek léčby hodnotili jako no response neboli stabilní choroba.
U 6 z 8 pacientů došlo k normalizaci hodnot volných lehkých řetězců v séru, koncentrace monoklonálního imunoglobulinu v séru a v moči nebyla metodou denzitometrického stanovení prokazatelná. Všech 6 pacientů mělo po ukončení léčby také negativní výsledek imunofixační elektroforézy v séru a v moči. Vstupně byla všech pacientů provedena trepanobiopsie kostní dřeně. Pokud bychom po léčbě chtěli dokumentovat vývoj počtu klonálních plazmocytů před léčbou a po léčbě, museli bychom zopakovat opět stejný způsob odběru kostní dřeně, tedy trepanobiopsii. Toto vyšetření je spojeno vždy s určitým rizikem a jeho provedení pouze pro splnění klasifikačních kritérií se nám nezdálo etické. Proto nemůžeme žádného pacienta klasifikovat jako kompletní remise.
Dosažené léčebné odpovědi u 6 z 8 (75 %) splňují platná kritéria velmi dobré parciální remise (very good partial response – VGPR). Vzhledem k tomu, že jde o retrospektivní studii, nemáme zhodnocenou rychlost nástupu kompletní remise.
Orgánovou léčebnou odpověď nebylo možné stanovit u 3 pacientů zemřelých v průběhu léčby. Orgánovou léčebnou odpověď nebylo také možné stanovit u pacienta s amyloidózou srdce, kterému bylo napřed transplantováno srdce, čímž se zásadně zlepšil celkový stav. Chemoterapie obsahující bortezomib byla zahájena až po transplantaci srdce, a proto není možné hodnotit u tohoto pacienta kardiální léčebnou odpověď. Celkem 5 z 6 (83 %) hodnotitelných pacientů splnilo kritérium orgánové léčebné odpovědi.
Pouze u 1 pacienta nefrotický syndrom nevymizel, i když u něj došlo k hematologické léčebné odpovědi, takže pacient má normální hodnoty volných lehkých řetězců a negativní imunofixace. Tento pacient trpěl ale již více let diabetes mellitus. Biopsii ledvin jsme u něj neprováděli.
Po ukončení léčby zemřel pouze 1 pacient v LDN na zápal plic, 9 měsíců od ukončení léčby. Šest pacientů z 10 v době hodnocení žije, medián sledování je 16 měsíců (9–36). Výsledky léčby shrnuje tabulka 2.
Table 1. Dominující příznaky AL-amyloidózy, léčba, hematologická a orgánová léčebná odpověď a délka sledování. 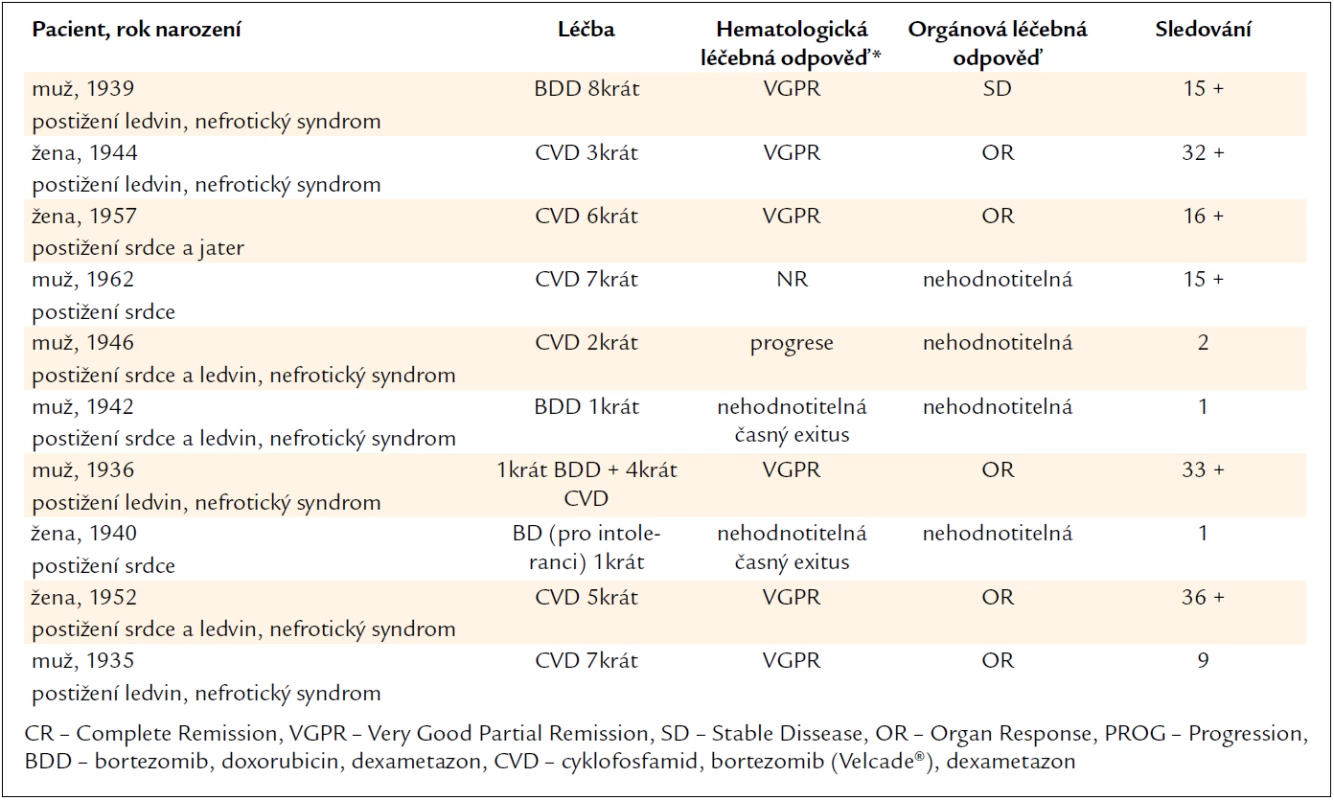
Nežádoucí účinky léčby
Nejzávažnějším nežádoucím účinkem léčby je bezesporu retence tekutin po aplikaci dexametazonu. K retenci tekutin dochází i u pacientů s mnohočetným myelomem, nicméně u pacientů s AL-amyloidózou je o to závažnější, že pacienti mají často nízkou koncentraci albuminu při nefrotickém syndromu a mohou mít také poškozené srdce amyloidem. Proto je zřejmě retence tekutin u pacientů s AL-amyloidózou výraznější než u pacientů s mnohočetným myelomem bez AL-amyloidózy. Retence tekutin v jednom případě pacientky s nefrotickým syndromem vedla až ke vzniku plicního edému s nutností přijetí na jednotku intenzivní péče.
Běžnou komplikací je dekompenzace případného diabetes mellitus vlivem dexametazonu. Četnost závažnějších neuropatií je stejná jako u mnohočetného myelomu. Při pečlivém sledování intenzity neuropatických potíží ošetřujícím lékařem a včasném upravování dávky bortezomibu nepředstavuje neuropatie pro nemocného riziko. U žádného z 10 pacientů nedospěla neuropatie do závažnosti stupně III a IV dle WHO klasifikace nežádoucích účinků léků.
Diskuze
Základními kameny standardní léčby je již po mnoho let alkylační cytostatikum a dexametazon, případně chemoterapie VAD (vinkristin, adriamycin a dexametazon). Pro vhodné pacienty s nevelkým orgánovým postižením a biologických věkem do 65 let lze použít vysokodávkovanou chemoterapii s autologní transplantací [1,2]. Hodnocení léčebné odpovědi se dříve odvíjelo od elektroforézy bílkovin v moči a v séru a senzitometrického stanovení monoklonálních lehkých řetězců, v posledních letech se hodnocení léčebné odpovědi dominantně zakládá na vyšetření koncentrace volných lehkých řetězců [26].
Přínos bortezomibu pro léčbu AL-amyloidózy
První klinické zkušenosti s bortezomibem přinesly pozitivní překvapení, Kastritis aplikoval bortezomib a dexametazon skupině 18 pacientů (z toho 7 bylo relabujících) a dosáhl 94 % léčebných odpovědí, z toho 44 % kompletních remisí, přičemž medián intervalu do dosažení léčebné odpovědi bylo jen 0,9 měsíce. Při mediánu sledování 11,2 měsíce zaznamenali již 28 % orgánových léčebných odpovědí [27,28]. Tak vysoký počet léčebných odpovědí po klasické léčbě zatím nebyl zaznamenán. Hypotetickým vysvětlením je velmi vysoká citlivost amyloidotvorných plazmocytů na bortezomib. Úlohou proteasomu je regulovaná degradace proteinů. Degradovány jsou nesprávně složené proteiny, aberantní proteiny nebo proteiny, které regulují např. buněčný cyklus nebo apoptózu. Proteasom hraje klíčovou roli v regulaci aktivity NF-κB (nukleární faktor κ B), a to degradací jeho inhibitoru I-κB (inhibitor κ B).
Účinek inhibitorů proteasomu (včetně bortezomibu) na myelomové buňky souvisí především s jejich dopadem na funkci faktoru NF-κB, který, je-li aktivní, zprostředkovává přežití MM buněk a jejich rezistenci k chemoterapii a radioterapii. V důsledku inhibice degradace proteinů nedochází k degradaci I-κB a tím k aktivaci NF-κB. Působením bortezomibu je tedy I-κB stabilizován, tím je NF-κB inhibován a nemůže tak zajistit přežití MM buněk.
Mechanizmus účinku bortezomibu na amyloidogenní plazmatické buňky zahrnuje stejný mechanizmus jako u myelomových buněk, tedy inhibici NF-κB, ale navíc ještě další. Degradace proteasomem je spřažena s uvolňováním proteinů určených k degradaci z lumen endoplazmatického retikula (ER). Pokud je tento proces zastaven, v ER se proteiny hromadí a to způsobuje stres ER. Stres ER představuje stav, při kterém je porušena metabolická a redoxní rovnováha a buňka se stává citlivější k apoptóze, např. v důsledku stabilizace některých proapoptotických proteinů. Dlouhodobý stres ER pak vede k apoptóze.
V případě amyloidózy je v ER postižených buněk velké množství aberantních imunoglobulinů. Inhibice proteasomu působením bortezomibu vede k další akumulaci proteinů v ER, způsobí tak stres ER, který následně indukuje apoptózu [22].
Dávky bortezomibu byly u AL-amyloidózy testovány jako monoterapie v eskalační studii 0,7–1,3 mg/m2 2krát týdně a pak dávka 1,6 mg/m2 1krát týdně. Celkem bylo dosaženo 20 % kompletních remisí opět s krátkým mediánem pro dosažení léčebné odpovědi 1,2 měsíce. Autoři konstatují, že při dávce bortezomibu 1,3 mg/m2 při klasickém dávkování 1., 4., 8., 11. den, a nebo 1,6 mg/m2 při podávání ve dnech 1, 8, 15, 22 v 35denních cyklu, se neliší tolerance od pacientů s myelomem a dosahuje vysokého počtu léčebných odpovědí. V dalších studiích budou tedy používat stejné dávky [29].
Zkušenosti z Velké Británie sumarizuje Wachelaker. V souboru 20 intenzivně předléčených pacientů (medián předchozích léčebných linií 3), kteří dostávali bortezomib v monoterapii nebo v kombinaci s dexametazonem, dosáhlo 15 % léčených kompletní remisi, 65 % léčených parciální remisi. Orgánová léčebná odpověď byla dosažena u 38 % léčených [30].
Doposud největší soubor pacientů je obsažen v souhrnném hodnocení italských, britských a řeckých center věnujících se léčbě amyloidózy – 94 pacientů. Tito pacienti byli léčeni bortezomibem v kombinaci s dexametazonem. Celkem bylo dosaženo 71 % léčebných odpovědí, z toho 25 % kompletních. V podskupině, která tuto léčbu dostala jako iniciální, bylo dokonce dosaženo 47 % kompletních remisí, zatímco ve skupině pacientů, jejichž nemoc byla refrakterní či relabovala po jiné iniciální léčbě, to bylo jenom 20 % kompletních remisí. Orgánové léčebné odpovědi bylo dosaženo u 30 % pacientů (22 % kardiálních, 17 % renálních a 19 % hepatálních léčebných odpovědí). Opět byl potvrzen krátký interval pro dosažní léčebné odpovědi (medián 1,2 měsíce) a medián intervalu pro dosažení kompletní remise 2,3 měsíce. Autoři svoje pozorování uzavírají slovy: kombinovaná léčba amyloidózy, obsahující bortezomib a dexametazon, je velmi účinná a má zvladatelné nežádoucí účinky [31]. Pro srovnání, u dříve používaných léčebných postupů byl medián do dosažení léčebné odpovědi 3,5 měsíce a medián do dosažení kompletní remise 6,2 měsíce.
První zkušenosti s bortezomibem v léčbě AL-amyloidózy shrnujeme v tab. 3. V posledních 3 letech se objevilo mnoho dalších publikací, které potvrzují účinnost bortezomibu v této indikaci [32–51] a v běhu jsou klinické studie fáze III, které srovnávají dvojkombinaci alkylačního cytostatika a dexametazonu s trojkombinací alkylačního cytostatika, dexametazonu a bortezomibu. Jejich výsledky však v době psaní tohoto textu nebyly zveřejněny. Léčba založena na bortezomibu je však také zásadním přínosem pro pacienty s light chain deposition disease (s nemocí z ukládání volných lehkých řetězců v neamyloidové formě), jak popsali olomoučtí autoři [52,53].
Table 2. Přehled zveřejněných zkušenosti s léčbou AL-amyloidózy bortezomibem v monoterapii nebo v kombinaci s dalšími léky. 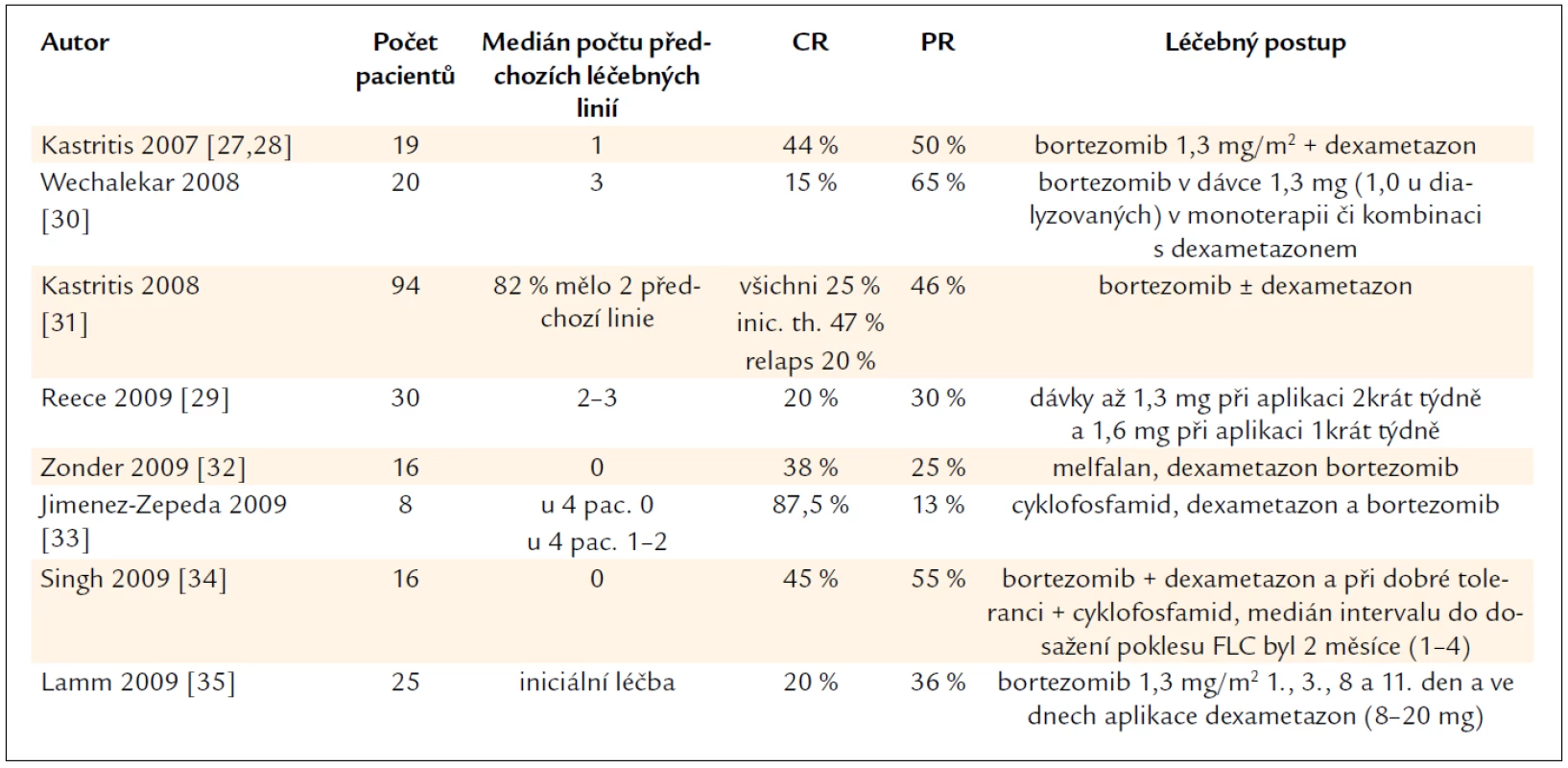
V našem souboru jsme léčbou založenou na bortezomibu dosáhli u 6 z 8 pacientů, kteří dokončili léčbu, velmi dobré parciální remise (VGPR) s negativní imunofixací a normálními hodnotami volných lehkých řetězců. U 5 z 6 hodnotitelných pacientů byla dosažena orgánová léčebná odpověď. Naše výsledky tedy korespondují s výsledky zahraničních center.
Nicméně, i když uvedená léčba má výbornou účinnost, její provedení u pacientů s AL-amyloidózou vyžaduje pečlivé sledování ošetřujícím lékařem a obvykle zahájení za hospitalizace. Na rozdíl od běžných pacientů s mnohočetným myelomem mají pacienti s AL-amyloidózou poškozeny životně důležité orgány (srdce, ledviny a další), proto je u nich tolerance stejné léčby horší než u pacientů s mnohočetným myelomem.
Nejvíce nežádoucích účinků uvedené léčby způsobují vysoké dávky dexametazonu.
Nejzávažnější u pacientů s nefrotickým syndromem či s poškozením srdce amyloidem je retence tekutin způsobená dexametazonem. Proto pacienty denně vážíme a při nárůstu hmotnosti (neboli při retenci tekutiny) ihned upravujeme dávky diuretik tak, aby se udržela pokud možno stabilní hmotnost. Za hospitalizace se lékaři snaží edukovat pacienty či jejich příbuzné o tom, jak doma upravovat dávky furosemidu dle hmotnosti pacienta. To znamená, že tuto léčbu lze bezpečně provádět jen u spolupracujících pacientů či jejich blízkých. Bez těchto opatření může dojít u pacientů s AL-amyloidózou k retenci až 10 l tekutiny, což může vést k plicnímu edému.
Dalším problémem je vznik steroidního diabetes mellitus. Po ranní aplikaci dexametazonu se nejvyšší odchylky glykemie objevují večer [54–57]. Proto při zahájení léčby uvedenými léčebnými protokoly je nutno sledovat večerní glykemie a pak dle výsledku a schopnosti pacienta si doma měřit glykemie a upravovat si léčbu diabetu buď dávky dexametazonu ponecháme, přičemž je na pacientovi, aby si dle glukometru upravil doma léčbu diabetu, anebo, pokud regulace antidiabetik dělá pacientovi problémy, raději redukujeme dávky dexametazonu.
Nicméně zásadní pro úspěch léčby je včas rozpoznat tuto diagnózu a začít léčbu již při nevelkém orgánovém poškození [58–64]. Z našich i dalších publikovaných dat vyplývá, že bortezomibové režimy jsou pro AL-amyloidózu velmi vhodné.
Závěry pro praxi
- Úspěch léčby záleží na míře poškození organizmu amyloidem, při malém poškození organizmu a věku do 65 let lze použít vysokodávkovanou chemoterapii s transplantací autologních kmenových krvetvorných buněk. V případě pozdní diagnózy a velkého poškození orgánů, zvláště pak srdce, obvykle pacient již léčbu netoleruje a umírá dříve, než by mohl nastoupit případný léčebný efekt.
- V případech, kdy nelze použít vysokodávkovanou chemoterapii, se považuje za vhodné podat léčebnou kombinaci obsahující dexametazon, alkylační cytostatikum a bortezomib.
- Při léčbě AL-amyloidózy je nutno mít vždy na paměti, že cílem léčby musí být dosažení kompletní hematologické remise (vymizení amyloidotvorných lehkých řetězců).
- Řádově měsíce od dosažení hematologické kompletní remise může dojít k orgánové léčebné odpovědi (vymizení depozit amyloidu v orgánech) a tím ke zlepšení funkce poškozených orgánů.
- Vyšetřování volných lehkých řetězců v séru umožňuje monitorovat účinnost léčby AL-amyloidózy, 90% pokles jejich koncentrace je spojen se signifikantně delším přežitím.
Práce byla vypracována v rámci aktivity následujících grantů: výzkumného záměru MŠMT MSM0021622434, specifického výzkumu MUNI/A/0784/2011 a grantů IGA MZd NT11154, NT12130 a NT12215, a pak nově také podpořeno „Projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno)“
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 10. 7. 2012
Přijato po recenzi: 1. 10. 2012
Sources
1. Ščudla V, Pika T. Současné možnosti léčby systémové AL amyloidózy. Vnitř Lék 2009; 55 (Suppl 1): 77–87.
2. Merlini G, Bellotti V. Molecular mechanisms of amyloidosis. N Engl J Med 2003; 349 : 583–596.
3. Adam Z, Ščudla V. Klinické projevy a diagnostika AL-amyloidózy a některých dalších typů amyloidóz. Vnitř Lék 2001; 47 : 36–45.
4. Bauerová L, Honsová E, Ryšavá R, Povýšil C. Systemová amyloidóza v renalní biopsii. Čes Patol 2009; 45 : 64–68.
5. Brychta T, Pařenica J, Zatočil T et al. Restriktivní karciomyopatie jako příznak primární amyloidózy. Vnitř Lék 2004; 50 : 66–71.
6. Gregor P. Amyloidóza srdce. Vnitř Lék 2008; 54 : 948–949.
7. Honsová E. How to improve diagnosis of systemic amyloidosis in clinical practice. Česk Patol 2009; 45 : 85–87.
8. Jankovec Z, Rušavý Z, Tĕsínský P, Lacigová S. Systémová amyloidóza s postižením ledvin. Čas Lék Česk 1999; 138 : 699–700.
9. Krejčí J. Amyloidóza srdce, podceňovaná hrozba? Vnitř Lék 2008; 54 : 950–951.
10. Kroupa R, Dastych M, Šenkyřík M et al. Systémové amyloidóza s dominující klinickou manifestací v trávicím traktu. Vnitř Lék 2005; 51 : 588–592.
11. Kuchyňka P, Paleček T, Šimek S et al. Izolovaná forma srdeční amyloidózy. Vnitř Lék 2008; 54 : 1010–1013.
12. Mach J. Problémy léčby primární amyloidózy. Vnitř Lék 1995; 41 : 286–287.
13. Ryšavá R, Špička I, , Merta M, Tesař V, Trněný M. Je současná léčba primární a sekundární amyloidózy efektivní. Čas Lék Česk 2003; 142 : 370–372.
14. Ryšavá R. Amyloidóza ledvin. Postgrad Med 2006; 8 : 207–212.
15. Ryšavá R. Léčba paraproteinemické nefropatie a primární amyloidózy ledvin. Aktual Nefrol 2005; 11 : 62–65.
16. Špička I, Merta M, Cieslar P et al. Poškození ledvin u monoklonální gamapatie. Čas Lék Česk 1995; 134 : 478–481.
17. Šroubková R, Meisnerová E, Vítková I. Vzácné příčiny malabsorbčního syndromu. Čas Lék Česk 2003; 142 : 300–302.
18. Tichý M. Primární amyloidóza. Lék Zpr UK Hradec Králové 1999; 44 : 99–107.
19. Tošovský M, Soukup T, Bradna P et al. Myopatie a hyperlipoproteinemie jako první příznak systémové AL-amyloidózy. Vnitř Lék 2008; 54 : 1014–1019.
20. Adam Z, Elleder M, Moulis M et al. Přínost PET-CT pro rozhodování o léčbě lokalizované nodulární plicní formy AL-amyloidosy. Vnitř Lék 2012; 58 : 241–252.
21. Adam Z, Ščudla V, Tomíška M. Léčba AL--amyloidózy and některých dalších typů amyloidóz. Vnitř Lék 2001; 47 : 46–52.
22. Sitia R, Palladini G, Merlini G. Bortezomib in the treatment of AL amyloidosis: targeted therapy? Haematologica 2007; 92 : 1302–1307.
23. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myelom and releated disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749–457.
24. Kyle RA. Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia 2009; 23 : 3–9.
25. Gertz MA, Comenzo R, Falk RH. Definition of organ involvement and treatment response in immunoglobulin light chain amyloidosis. A consensus opinion from the 10th international symposium on amyloid and amyloidosis, Tours, France, 18-22 April 2004. Amer J Hematol 2005; 79 : 319–328.
26. Ščudla V, Minařík J, Schneiderka P et al. Význam sérových hladin volných lehkých řetězců imunoglobulinu v diagnostice a hodnocení aktivity mnohočetného myelomu a vybraných monoklonálních gamapatií. Vnitř Lék 2005; 51 : 1249–1259.
27. Kastritis E, Anagnostopoulos A, Roussou M et al. Treatment of light chain deposition disease with the combination of bortezomibe and dexamethasone. Blood 2007; 110 (N.11 Suppl.): abstr. 64.
28. Kastritis E, Anagnostopoulos A, Roussou M et al. Treatment of light chain (AL) amyloidosis with the combination of bortezomib and dexamethasone. Haematologica 2007; 92 : 1351–1358.
29. Reece DE, Sanchorawala V, Hegenbart U et al. Weekly and twice-weekly bortezomib in patients with systemic AL-amyloidosis: results of a phase 1 dose-escalation study. Blood 2009; 114 : 1489–1497.
30. Wechalekar AD, Lachmann HJ, Offer, Hawkins PN, Gillmore JD. Efficacy of bortezomib in systemic AL amyloidosis with relapsed/refractory clonal disease. Haematologica 2008; 93 : 295–298.
31. Kastritis E, Wechalekar AD, Dimopoulos H et al. Significant activity of bortezomib-based therapy in patients with primary systemic AL--amyloidosis. Blood 2008; 112 : 321, abstr. 869.
32. Zonder JA, Sanchorawala V, Snyder RM et al. Melphalan, dexamethosone plus bortezomib induces hematologic and organ response in AL-amylolidosis with tolerable neurotoxicity. Blood 2009; 114: (Suppl. N 22): 310, abstr. 746.
33. Jimenez-Zepeda VH, Reeder CB, Mikhael JR et al. Cyclophophamide, bortezomib and dexamethasone induces rapid and complete response in patients with amyloidosis non eligible for peripheral stem cell transplant. Blood 2009; 114: (Suppl. N 22): 737, abstr. 1857.
34. Singh V, Saad A, Palmer J et al. Response to bortezomib based induction therapy in newly diagnosed light chain (AL) amyloidosis. Blood 2009; 114 (Suppl. N 22): 740, abstr. 1867.
35. Lamm W, Willenbacher W, Zojer N et al. Efficacy of the combination of bortezomib and dexamethasone in systemic AL amyloidosis. Blood 2009; 114: (Suppl. N 22): 1121, abstr. 2871.
36. Kastritis E, Anagnostopoulos A, Rossou M et al. Treatment of light chain (AL) amyloidosis with the combination of bortezomib and dexamethasone. Haematologica 2007; 92 : 1351–1358.
37. Moscetti A, Saltarelli F, Bianchi MP et al. Quick response to bortezomib plus dexamethasone in a patient with AL amyloidosis in first relapse. Amyloid. 2011; 18: (Suppl 1): 147–149.
38. Abonour R, Kramer G, Suvannasankha A, Benson MD. Bortezomib (Velcade) treatment of AL amyloidosis: Indiana University experience. Amyloid 2011; 18: (Suppl 1): 146.
39. Coriu D, Badelita S, Talmaci R et al. Bortezomib in systemic AL amyloidosis: a single center experience. Amyloid 2011; 18: (Suppl 1): 143–145.
40. Landau H, Hassoun H, Bello C et al. Consolidation with bortezomib and dexamethasone following risk-adapted melphalan and stem cell transplant in systemic AL amyloidosis. Amyloid 2011; 18: (Suppl 1): 130–131.
41. Dimopoulos MA, Kastritis E. Bortezomib for AL amyloidosis: moving forward. Blood 2011; 118 : 827–828.
42. Dubrey SW, Reece DE, Sanchorawala V et al. Velcade Can2007 Study Group. Bortezomib in a phase 1 trial for patients with relapsed AL amyloidosis: cardiac responses and overall effects. QJM 2011; 104 : 957–970.
43. Reece DE, Hegenbart U, Sanchorawala V et al. Efficacy and safety of once-weekly and twice-weekly bortezomib in patients with relapsed systemic AL amyloidosis results of a phase 1/2 study. Blood 2011; 118 : 865–873.
44. Palladini G, Foli A, Russo P et al. Treatment of IgM-associated AL amyloidosis with the combination of rituximab, bortezomib, and dexamethasone. Clin Lymphoma Myeloma Leuk 2011; 11 : 143–145.
45. Palladini G, Merlini G. Transplantation vs. conventional-dose therapy for amyloidosis. Curr Opin Oncol 2011; 23 : 214–220.
46. Lamm W, Willenbacher W, Lang A et al. Efficacy of the combination of bortezomib and dexamethasone in systemic AL amyloidosis. Ann Hematol 2011; 90 : 201–206.
47. Gertz MA, Zeldenrust SR. Treatment of immunoglobulin light chain amyloidosis. Curr Hematol Malig Rep 2009; 4 : 91–98.
48. Ghose A, Tariq Z, Taj A, Chaudhary R. Acute dyspnea from treatment of AL amyloidisis with bortezomib. Am J Ther 2011; 18: e123–e125.
49. Michael M, Kastritis E, Delimpassi S et al. Greek Myeloma Study Group. Clinical characteristics and outcome of primary systemic light--chain amyloidosis in Greece. Clin Lymphoma Myeloma Leuk 2010; 10 : 56–61.
50. Kastritis E, Wechalekar AD, Dimopoulos MA et al. Bortezomib with or without dexamethasone in primary systemic (light chain) amyloidosis. J Clin Oncol 2010; 28 : 1031–1037.
51. Shah AD, Watts AJ, Mehta AB, Wechalekar AD. An unusual case of transient dermatological reaction to bortezomib in AL amyloidosis. Int J Hematol 2010; 91 : 121–123.
52. Ščudla V, Minařík J, Pika T. Light chain deposition disease. Vnitř Lék 2012; 58 : 38–43.
53. Minařík J, Šcudla V, Tichý T et al. Induction treatment of light chain deposition disease with bortezomib: rapid hematological response with persistence of renal involvement. Leuk Lymphoma 2012; 53 : 330–331.
54. Issa ZA, Zantout MS, Azar ST. Multiple myeloma and diabetes. ISRN Endocrinol 2011; 2011 : 815013.
55. Pospíšilová Y, Adam Z. Poruchy glukózového metabolizmu a regulace u pacientů s mnohočetným myelomem, kteří jsou léčeni vysokými dávkami glukokortikoidů na naší klinice. Vnitř Lék 2007; 53 : 18–23.
56. Pathak RD, Jayaraj K, Blonde L. Thalidomide-associated hyperglycemia and diabetes: case report and review of literature. Diabetes Care 2003; 26 : 1322–1323.
57. Volgi JR, Baldwin jr. D Glucocorticoid therapy and diabetes management. Nurs Clin North Am 2001; 36 : 333–339.
58. Ščudla V, Petrová P, Minařík J, Pika T, Bačovský J. Analysis of the serum levels of selected biological parameters in monoclonal gammopathy of undetermined significance and different stages of multiple myeloma. Neoplasma 2011; 58 : 499–506.
59. Ščudla V, Heřman M, Minařík J et al. Přínos celotělové magnetické rezonance pro diagnózu monoklonalní gamapatie nejistého významu, mnohočetného myelomu a vyšetření Durie-Salmon Plus staging systému. Vnitř Lék 2011; 57 : 52–60.
60. Mysliveček M, Bačovský J, Ščudla V et al. 18F-FDG PET/CT a 99mTc-MIBI scintigrafie při hodnocení pacientů s mnohočetným myelomem a s monoklonální gamapatií nejistého významu. Klin Onkol 2010; 23 : 325–331.
61. Ščudla V, Budíková M, Petrová P et al. Analýza sérových hladin vybraných biologických parametrů u monoklonální gamapatie a mnohočetného myelomu. Klin Onkol 2010; 23 : 171–181.
62. Ščudla V, Pika T, Budíková M et al. The importance of serum levels of selected biological parameters in the diagnosis, staging and prognosis of multiple myeloma. Neoplasma 2010; 57 : 102–110.
63. Pika T, Minařík J, Schneiderka P et al. The correlation of serum immunoglobulin free light chain levels and selected biological markers in multiple myeloma. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2008; 152 : 61–64.
64. Vytřasová M, Ščudla V, Nekula J et al. Magnetická rezonance při vyšetření páteře u mnohočetného myelomu.Vnitř Lék 2001; 47 : 694–698.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 12-
All articles in this issue
- Výsledky léčby AL-amyloidózy léčebnými režimy obsahujícími bortezomib, dexametazon a dále cyklofosfamid anebo doxorubicin
- Je protidoštičková liečba vždy účinná?
- Naše zkušenosti s léčbou primárních lymfomů centrálního nervového systému
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Primární řasinky buněk kardiovaskulárního aparátu
- Změny na úrovni populace zaměřené na podporu kardiovaskulárního zdraví
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Toxická hepatitída po Polygonum multiflorum
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Je protidoštičková liečba vždy účinná?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

