-
Medical journals
- Career
Způsoby hodnocení krevní perfuze tkání pomocí intersticiální mikrodialýzy – přehled současných znalostí
Authors: N. Cibiček1 ,2
Authors‘ workplace: Ústav lékařské chemie a biochemie Lékařské fakulty UP Olomouc, přednostka prof. RNDr. Jitka Ulrichová, CSc. 1; Oddělení klinické biochemie Nemocnice Hranice, a. s., Hranice, přednostka prim. RNDr. Pavla Horová 2
Published in: Vnitř Lék 2012; 58(1): 44-51
Category: Reviews
Overview
Mikrodialýza je dynamicky se rozvíjející technika využívaná k monitorování tkáňového metabolizmu, bariérové funkce a k farmakologickým studiím a odhadům lokální krevní perfuze in situ. Předkládaný souhrnný článek přibližuje čtenáři poslední z uvedených aplikací, přičemž popisuje a srovnává 2 využívané přístupy – mikrodialyzační diluční techniky s využitím průtokových indikátorů a kontinuální metabolické sledování. V současné době je upřednostňováno využití metabolických indikátorů, pomocí nichž lze citlivěji a komplexněji hodnotit perfuzí navozené změny ve tkáních. Přes mnohé výhody zůstává měření tkáňové perfuze pomocí mikrodialýzy zatím soustředěno v oblasti klinického výzkumu. Pro širší přijetí a uplatnění v rutinních klinických postupech bude nutné provést více validačních studií a identifikovat situace, kde by mikrodialýza mohla nahradit stávající metody.
Klíčová slova:
mikrodialýza – tkáňový metabolizmus – lokální krevní perfuze – diluční techniky – průtokové indikátory – kontinuální metabolické sledováníMikrodialýza – princip metody a její současné využití
Intersticiální mikrodialýza (dále jen mikrodialýza) je in vivo metoda vyvinutá začátkem 70. let minulého století Ungerstedtem a Pycockem původně pro neurovědu [1]. Její hlavní výhodou je možnost kontinuálně monitorovat, resp. ovlivňovat metabolizmus, funkční stav buněk a farmakokinetiku in situ (bez nutnosti odběrů tkáně) a významně tím přispět k časnému záchytu lokálních změn a personalizaci léčby. Metoda pracuje na principu tzv. „umělé cévy“. To znamená, že získávání látek (metabolitů, xenobiotik, ukazatelů bariérové funkce nebo průtokových indikátorů) z tkáňového intersticia, nebo naopak dodávání těchto látek do extracelulární tekutiny je založeno na jejich obousměrné prosté difuzi skrze selektivně permeabilní membránu sterilní sondy implantované do tkáně (obr. 1). Tato sonda má většinou tvar jehly a dvojího, koncentrického lumen, které je pomocí tenké trubice kontinuálně perfundováno roztokem („perfuzátem“) imitujícím intersticiální tekutinu. Po kontaktu s mikrodialyzační membránou se perfuzát ve vnějším lumen obohatí o některé z látek, které se nacházejí v intersticiu, resp. ztratí část molekul, které se zde nenacházejí. Takto modifikovaný perfuzát (nazývá se „dialyzát“) se sbírá a analyzuje.
Image 1. Princip mikrodialýzy spočívá v napodobení funkce krevní kapiláry. Šipky ukazují směr toku perfuzního roztoku a znázorňují výměnu látek mezi sondou, intersticiem, buňkou a krevní kapilárou (upraveno podle: www.microdialysis.se). 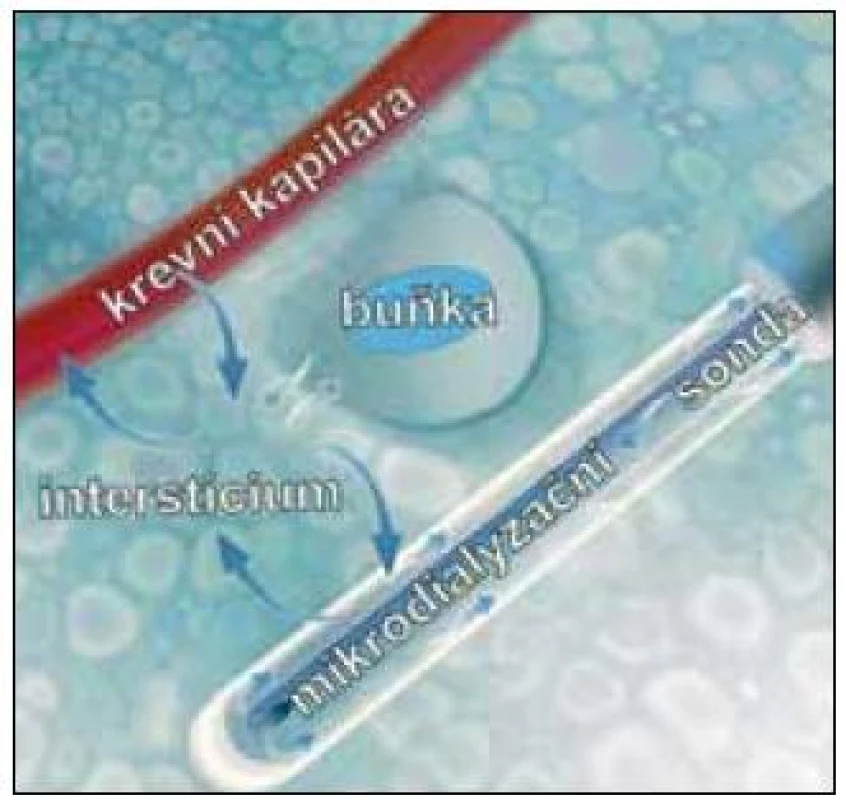
Ve většině aplikací jsou využívány mikrodialyzační membrány, které jsou prakticky nepropustné pro makromolekuly typu proteinů nebo polysacharidů, což má zásadní klinicko-farmakologické i klinicko-biochemické výhody – sledování volné frakce léčiv a zkrácení, resp. usnadnění preanalytické fáze laboratorního měření. Jistou nevýhodou je využívání velmi nízkých perfuzních rychlostí (v desetinách až jednotkách mikrolitrů za minutu) nutných pro dosažení co nejvyšší efektivity dialýzy, což vyžaduje použití speciálních precizních pump (viz rozšiřující poznámka 1 na konci tohoto článku).
Díky své relativně malé invazivitě srovnatelné s injekčním vpichem nacházela mikrodialýza zpočátku své těžiště zejména v krátkodobých farmakologických a metabolických studiích centrálního nervového systému (CNS), podkožní tukové tkáně a kosterního svalu. Postupem času však našla uplatnění ve výzkumu celé řady dalších tkání a orgánů nevyjímaje orgány dutiny břišní, myokard, plíce, kost, kůži, oko nebo krevní řečiště [2–4]. V dnešní době už jen stěží najdeme kompartment, který by touto technikou nebyl badatelsky zasažen, a to především na úrovni zvířecích modelů. Své místo si však mikrodialýza intenzivně hledá i v oblasti humánní medicíny, přičemž se neomezuje jen na rovinu klinického výzkumu s využitím krátkého (několikahodinového) sledování. Snahy o její prosazení v rutinní neurointenzivní péči [5], diabetologii [6], klinické farmakologii [7], rekonstrukční chirurgii [8] a dalších oborech si kromě intenzivistů a farmakologů zaslouží pozornost i široké klinické obce. Přes dynamický rozvoj mikrodialýzy zůstává nejlépe prozkoumanou oblastí jejího využití v klinice sledování metabolizmu, tkáňové perfuze a poškození buněk CNS. Na pracovištích, kde se mikrodialýza rutinně používá, jsou standardem systémy poskytující informace o metabolizmu a krevním průtoku přímo u lůžka pacienta (v rámci tzv. POCT diagnostiky, kam patří např. i analyzátory krevních plynů). Vyžadují však odběr dialyzátu do mikrozkumavek, čímž vzniká riziko záměny vzorků (obr. 2).
Image 2. Schéma diskontinuálního systému, zleva: klinická pumpa, trubice, sonda, mikrozkumavka, transmembránová difuze, POCT analyzátor s dotekovým displejem a tiskárnou (zdroj: www.microdialysis.se). 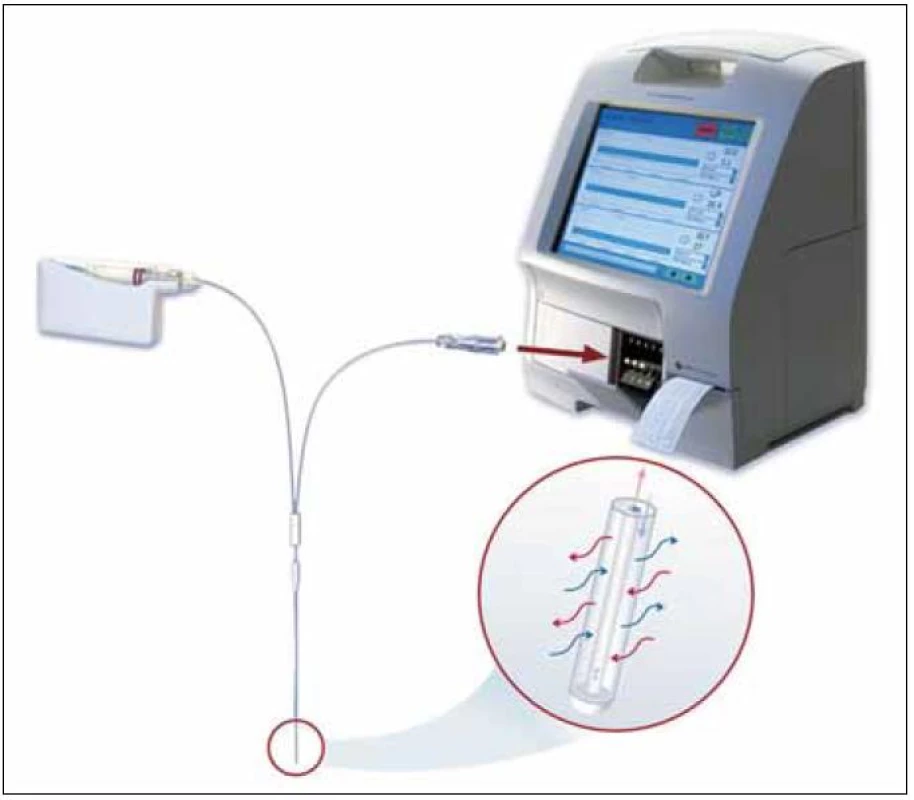
Nejnovější komerční diagnostické přístroje nabízí tzv. on-line systémy měřící „v reálném čase“ (zpoždění kolem 5 min) na bázi biosenzorů, které odběr do mikrozkumavek nevyžadují (obr. 3).
Image 3. Systém Eirus<sup>TM</sup> od firmy CMA Microdialysis ke kontinuálnímu sledování glykemie a laktatemie na JIP. Sonda je zavedena cestou centrálního žilního katétru (zdroj: www.microdialysis.se). 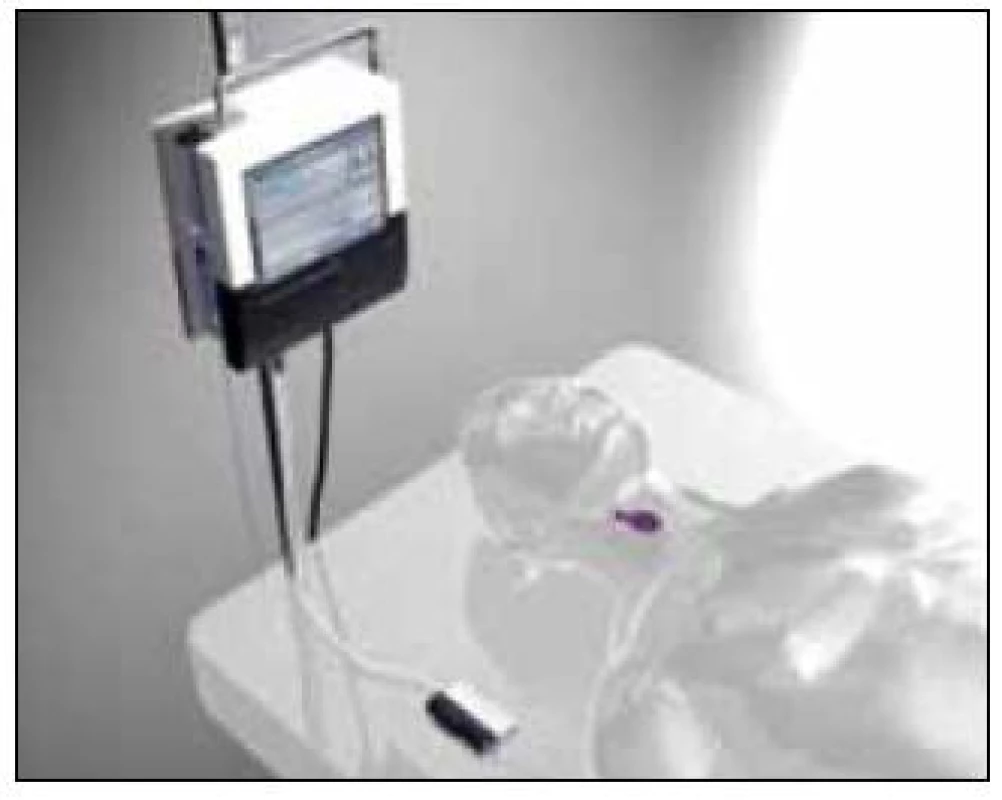
Současné trendy směřující k miniaturizaci laboratorní techniky vedou k vytváření tkáňových biosenzorů využívajících spojení mikrodialýzy, mikrofluidiky a elektrochemie (tzv. „lab-on-a-chip“) s bezdrátovým přenosem dat, které intenzivistům do budoucna umožní telemetrické sledování metabolizmu a krevní perfuze paralelně v různých tělesných kompartmentech [9–11]. Ve stadiu zkoumání jsou rovněž možnosti léčebného využití mikrodialýzy, např. se současnou aplikací nanotechnologií [12].
Ačkoli se český čtenář již mohl s mikrodialýzou setkat i v domácí literatuře, údajů v češtině bylo dle databáze Pubmed publikováno zatím velmi málo [13–17] a obecné klinické povědomí o této metodě a jejích aplikacích je v českých zemích poměrně chatrné. Předkládaný přehledový článek si klade za cíl přiblížit výzkumně zaměřeným klinikům některé výhody i úskalí aplikace mikrodialýzy pro hodnocení tkáňové krevní perfuze, a to na základě srovnání 2 přístupů – dilučních technik a metabolického monitorování.
Techniky využívající průtokové indikátory (diluční techniky)
Jako průtokový indikátor se označuje látka, která je přidávána do perfuzátu za účelem difuze do vyšetřované tkáně. Může se jednat o látku tělu cizí nebo o (značený, případně neznačený) metabolit, který je v perfuzátu v několikanásobně vyšší koncentraci než v intersticiální tekutině. Principem metody je pozitivní, byť nelineární vztah mezi difuzním tokem průtokového indikátoru (flow-markeru) ze sondy do intersticia a následně do krevního řečiště a krevní perfuzí tohoto řečiště. Průkopníkem metody byli Hickner et al, který ji aplikovali v kosterním svalu [18]. Protože se difuzí v intersticiu průtokový indikátor do různé míry „ředí“, stala se Hicknerova technika prototypem všech tzv. dilučních neboli indikátorových technik („efflux techniques“, viz rozšiřující poznámka 2 na konci tohoto článku).
Pokud má být průtokový indikátor využitelný v klinice, musí splňovat několik důležitých podmínek. Jeho molekula musí být netoxická, apyrogenní, dobře popsaná co do svých biologických účinků, bez prokazatelného vlivu na průsvit cév, krevní průtok a lokální metabolizmus, musí mít rovněž dobré difuzní vlastnosti v extracelulární tekutině (rozpustnost ve vodě, malou molekulovou hmotnost), jednoduchou přípravu v roztoku za sterilních podmínek, nekomplikovanou preanalytiku (stabilitu v získaném vzorku) včetně dostupného analytického zázemí a v neposlední řadě také příznivou cenu. Původní, Hicknerem navržený průtokový indikátor etanol téměř všechny tyto podmínky splňoval. Vzhledem k nesnadnému analytickému stanovení (optimálně pomocí plynové chromatografie s hmotnostně spektrometrickou detekcí) a své těkavosti však byl později modifikován značením molekuly pomocí 14C, nebo spíše nahrazován jinými molekulami, zejména 3H2O, přičemž odpověď metody nebyla touto změnou zásadně ovlivněna [19]. Slibných výsledků bylo recentně dosaženo i s močovinou [20], kterou lze snadno stanovit u lůžka pacienta pomocí mikrodialyzačního analyzátoru ISCUS firmy CMA Microdialysis (obr. 2). Protože sérovou i tkáňovou koncentraci močoviny lze v horizontu několika hodin považovat za konstantní a koncentrace močoviny v perfuzátu několikanásobně převyšuje koncentraci ve tkáni, lze ji v této souvislosti použít. Jak močovina, tak další navržené indikátory (gentamycin, lithium) však na svojí validaci doposud čekají [14,21,22].
Vliv etanolu na lokální mikrocirkulaci nebo metabolizmus glukózy nebyl prokázán ani v poměrně širokém rozmezí koncentrací na vstupu do sondy (od 5 × 10–3 do 1 mol l–1) [18]. Při kontrolovaných perfuzích lýtkového svalu kočky v rozsahu adekvátním průtoku lidským kosterním svalem za bazálních podmínek (zhruba 1–10 ml 100 g tkáně–1 min–1) vyslovil Hickner předpoklad nelineární, rychlé odpovědi své metody na redukci krevní perfuze, přičemž lineární závislost bychom nalezli až při několikanásobném zvýšení krevního průtoku. K objasnění teoretických základů metody a otázek ohledně její robustnosti přispěl Wallgren, který poskytl její matematické zpracování za modelových podmínek. Počítal přitom se splněním několika zásadních předpokladů. K nim patří rovnoměrná distribuce kapilár ve svalu a jejich homogenní a v čase konstantní perfuze, homogenní prostředí svalové tkáně pro difuzi etanolu a dosažení ustálených rozdílů mezi koncentracemi v sondě, v intersticiu svalu a v kapilárách (tzv. „steady-state“ podmínky). Přestože splnění těchto předpokladů si lze v živé tkáni představit jen velmi obtížně, nalezl Wallgren přijatelnou shodu mezi teoretickým modelem a výsledky Hicknerových in vivo experimentů. Tím se podařilo demonstrovat možnost existence nejenom kvalitativního, ale i kvantitativního charakteru vztahu mezi krevním průtokem kosterním svalem a poměrem koncentrací etanolu v dialyzátu a perfuzátu [23]. Nadšení z Wallgrenových výsledků se projevilo v širší aplikaci mikrodialýzy k měření tkáňové krevní perfuze ve svalu a podkožním tuku, a to nejenom v experimentálních, ale i v klinických studiích. Výsledky etanolové diluční techniky měření krevní perfuze je přesto potřeba interpretovat opatrně – s přihlédnutím na možnost jejich ovlivnění pohybem sondy ve tkáni nebo změnou difuze indikátoru v důsledku svalové kontrakce [24]. Vzhledem ke specifickému vlivu jednotlivých tkání na hodnotu difuzního koeficientu látky, a tím i na její transport do krevního řečiště, nelze výsledky dilučních metod aplikovaných v různých kompartmentech jednoduše srovnávat. Dalším faktorem, který je potřeba vzít do úvahy, je čas k dosažení „plató“ koncentrací průtokového indikátoru neboli bazálních steady-state podmínek. Tato doba může v závislosti na charakteru tkáně a na její krevní perfuzi překročit 2 hod [19,25]. Nejdůležitějším faktorem ovlivňujícím interindividuální variabilitu je však kvalita techniky zavedení sondy do tkáně (implantační mikrotrauma, viz rozšiřující poznámka 3 na konci tohoto článku). Potížím s nesourodou implantační technikou lze předejít „odloženou“ mikrodialýzou, při které dojde k resorpci mikrohematomu a částečné úpravě architektury tkáně v okolí sondy. Samotný odběr vzorků pak probíhá až 4. den po implantaci sondy [26]. Jinou alternativou je vyřazení špatně zavedených sond. V akutní medicíně, ke které vzhledem k charakteru mikrodialýzy směřuje většina snah o její klinické využití, však lze uvedené postupy aplikovat jen velmi omezeně. Pro sledování dynamiky tkáňové krevní perfuze v klinických studiích je většinou dostačující dosažení steady-state podmínek (stabilita odpovědi ve 2 po sobě následujících měřeních), které závisí na odplavení uvolněných intracelulárních, resp. intravaskulárních hmot. K tomu dochází přibližně po 60 (30–90) min od implantace. Nejlepší praktickou pomůckou pro hodnocení interindivi-duálních odlišností pak zůstává vyjádření výsledků mikrodialýzy v procentech vstupní neboli bazální hodnoty (subjekt je sám sobě kontrolou) [27]. V důsledku obecně nízké schopnosti dilučních technik detektovat malé změny krevního průtoku jsou poměry indikátorů v dialyzátu a perfuzátu považovány pouze za kvalitativní ukazatele. Z těchto důvodů chybí diluční techniky měření tkáňové perfuze ve většině recentních klinických studií a také v doporučeních expertů na mikrodialýzu pro implementaci do multimodální klinické monitorace v neurointenzivní péči [5].
Techniky využívající metabolické indikátory
Metabolické indikátory jsou, na rozdíl od průtokových indikátorů, vesměs látky tělu vlastní, které vznikají v buňkách a difundují do intersticiální tekutiny v rámci časných metabolických změn způsobených nedostatečným prokrvením a/nebo dodávkou kyslíku. Techniky využívající metabolické indikátory jsou tudíž založeny na difuzi metabolitů ze tkání do mikrodialyzační sondy.
Využití metabolických indikátorů v detekci poruch lokální mikrocirkulace má mnohé výhody.
Za prvé, jejich změny jsou relativně specifické jak pro tkáňovou hypoperfuzi (glukóza [28], glutamát [29] nebo hypoxantin [30]), tak pro hypoxii s posunem redoxního stavu buněk (poměr laktát/pyruvát [31]), přičemž v některých případech můžou pomoci při odlišení arteriální a venózní okluze [32] nebo mitochondriální dysfunkce (poměr laktát/glukóza) [33].
Za druhé, ischemií navozené tkáňové poškození, jako je např. ztráta střevní bariérové funkce, rozpad mozkových buněk nebo netěsnost střevní anastomózy, se může projevit v absolutních hodnotách glycerolu, laktátu a/nebo laktát/pyruvátového (la/py) poměru [34–36]. Tyto změny korelují s tkáňovou tenzí kyslíku a nálezy na pozitronové emisní tomografii [37]. Metabolické indikátory můžou předcházet změnám krevního průtoku diagnostikovaným dopplerovskými metodami i o řadu hodin (obr. 4) [38]. Naopak systémové parametry (laktatemie) nemusí lokální ischemické změny reflektovat vůbec [39].
Image 4. Lokální metabolické indikátory jsou časnou známkou incipientního vazospazmu a buněčného poškození u pacientů se subarachnoidálním krvácením (SAH). Upraveno podle [38]. ![Lokální metabolické indikátory jsou časnou známkou incipientního vazospazmu a buněčného poškození u pacientů se subarachnoidálním krvácením (SAH). Upraveno podle [38].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b60ce6cd485422ebc0e57f0893390ff0.png)
Za třetí, metabolické indikátory můžou odrážet intenzitu stresové reakce v důsledku sympatikotonie na JIP (elevace glycerolu v podkožní tukové tkáni), nebo můžou jednoduše korelovat se svými systémovými protějšky (jako např. podkožní tkáňová glukóza, která je substrátem senzorů v diabetologii) [6,40].
Za čtvrté, lokální metabolické změny můžou korelovat s klinickými symptomy, morbiditou i mortalitou – sledování změn glukózy a la/py poměru v mozkové tkáni může mít význam jak pro krátkodobou, tak i pro dlouhodobou predikci dalšího vývoje stavu pacientů po traumatu mozku nebo subarachnoidálním krvácení [41–44].
Za páté, využití kombinace několika metabolických indikátorů závislých na tkáňové perfuzi zvyšuje senzitivitu i specificitu metody pro záchyt změn mikrocirkulace (obr. 5).
Image 5. Typická dynamika základních metabolických indikátorů v mikrodialyzátu při tkáňové ischemii. Paralelní měření glykemie umožňuje odlišit systémové změny od lokální hypoperfuze nebo mitochondriální dysfunkce. 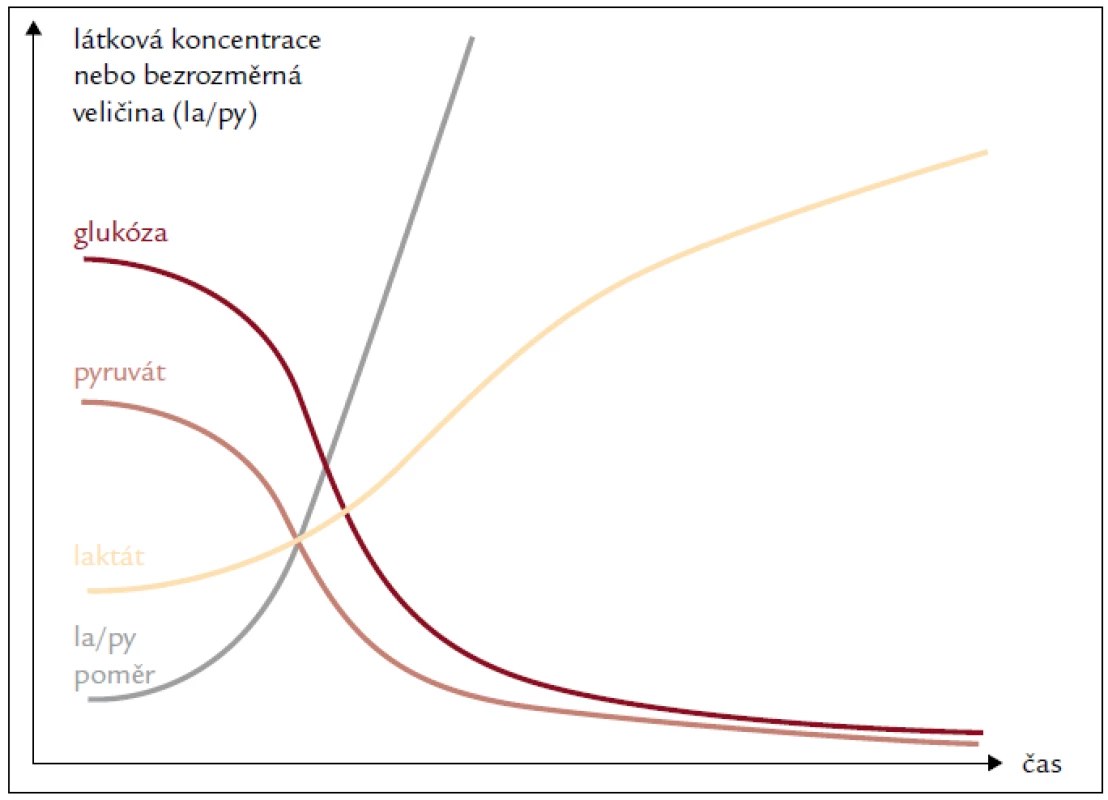
Za šesté, v koncentračních poměrech (jako je např. la/py poměr) jsou podmínky pro difuzi dvou fyzikálněchemicky příbuzných molekul ovlivněny podobně, tj. jejich poměr je více závislý na lokálním metabolizmu než na možných nepredikovatelných změnách funkce sondy. Z výše uvedených důvodů autoři při hodnocení mikrocirkulace pomocí mikrodialýzy v posledních letech v převážné míře upřednostňují metabolické indikátory [29,45–47].
Úskalí interpretace metabolických indikátorů se týkají především tkáňově specifických metabolických reakcí na ischemii (mozek vs játra, „nepoškozený“ mozek vs penumbra vs nekrotická tkáň, peritoneum vs místo anastomózy apod.) [40,48]. Přes publikovaná doporučení [5] se dodnes můžeme mezi experty setkat s nejednotným postupem ohledně počtu cerebrálních katetrů a míst implantace. Mezi další úskalí patří změny koncentrací indikátorů v systémové cirkulaci a vyplavení tkáňových metabolitů (např. glycerolu) v důsledku implantačního mikrotraumatu a nikoli následkem ischemie [49,50]. Jak v případě průtokových, tak v případě metabolických indikátorů je proto potřeba dbát na kvalitu implantační techniky a funkci sondy v čase monitorovat. Doba nutná pro tkáňovou stabilizaci a zahájení měření však zde bývá kratší (většinou do 1 hod). Podobně jako v případě průtokových indikátorů lze implantační mikrotrauma částečně řešit výpočtem relativních hodnot (% z bazální hodnoty). Nejvýhodnějším a v klinické praxi nejvíce používaným přístupem je však minimalizace mikrodialyzační perfuzní rychlosti (k řádu desetin μl × min–1) s dosažením téměř 100% transmembránové koncentrační ekvilibrace indikátoru. V takovém případě lze koncentraci indikátoru v dialyzátu považovat za identickou s koncentrací v intersticiu. Pro většinu aplikací v klinické praxi je tento přístup zcela dostačující. Hůře je použitelný pouze v případech, kdy je cílem sledování velmi rychlé dynamiky změn v čase (v řádu desítek sekund nebo několika minut), protože klade vysoké nároky na citlivost analytické metody, resp. vyžaduje on-line zapojení [51], které zatím není ani v mikrodialyzačních centrech běžné. Kompromisním řešením může v takové situaci být kontinuální ředění dialyzátu [52].
Metabolické indikátory přinášejí do experimentu i klinické medicíny kromě informace o stavu mikrocirkulace i další důležité patofyziologické a prognostické údaje. Unikátní software (ICU Pilot firmy CMA Microdialysis) přizpůsobený podmínkám multimodálního monitorování na JIP umožňuje srovnávat historické i aktuální trendy vývoje všech měřených parametrů (včetně farmakoterapie) jak v rámci jednoho pacienta, tak se zprůměrovanými daty získanými ze souboru podobných pacientů. Hlavním smyslem sledování metabolických indikátorů není zcela nahradit, ale spíše vhodně doplnit stávající metody využívané na JIP (měření intrakraniálního tlaku a teploty, transkraniální Doppler, saturace krve kyslíkem v jugulárním bulbu a tkáňová tenze kyslíku atd.). Využití mikrodialýzy tak umožňuje lépe pochopit vývoj stavu pacienta, stratifikovat jeho riziko a personalizovat farmakologickou a/nebo nutriční terapii s cílem zmírnit nebo předejít rozvoji sekundárního poškození, případně časně odhalit selhání (chirurgické) léčby. Srovnání obou mikrodialyzačních přístupů poskytuje tab. 1.
Table 1. Semikvantitativní srovnání mikrodialyzačních technik využívaných k hodnocení tkáňové mikrocirkulace. 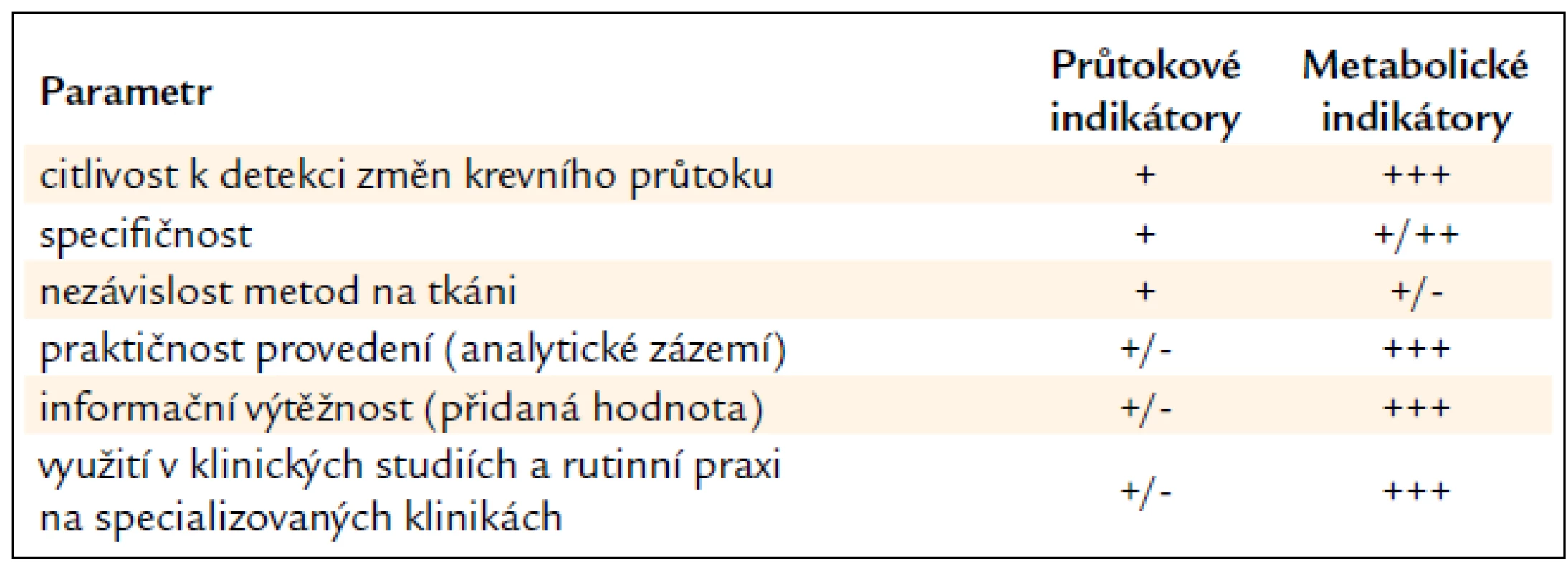
Přes tyto výhody si mikrodialýza zatím nezískala postavení standardní monitorovací techniky v neurointenzivní péči [53]. Při stávajícím světovém trendu zavádění multimodálních měřících postupů na JIP se však jeví jako velmi pravděpodobné, že s přibývajícími klinickými zkušenostmi tuto pozici obhájí.
Vlastní zkušenosti
Ve výzkumu na našem pracovišti jsme se zaměřili na srovnání indikátorové techniky pomocí 3H2O a metabolického sledování pomocí mikrodialýzy na malých laboratorních zvířatech. Na rozdíl od jiných autorů, kteří techniky srovnávali na modelu hemoragického šoku v jaterní tkáni a kosterním svalu [54], jsme prokázali, že při kritických změnách krevního průtoku (ischemie/reperfuze) žaludeční stěny je možné zachytit velmi významnou odpověď obou přístupů již 30 min po změně průtoku. Potvrdili jsme přitom předpoklad, že jak bazální hodnoty, tak i dynamika změn průtokového indikátoru 3H2O (tj. citlivost metody k záchytu změn mikrocirkulace) nezávisí jenom na charakteru tkáně, ale také velmi významně na kvalitě implantace sondy. Nejtěsnější vztah mezi oběma technikami jsme nalezli mezi laktát/glukózovým poměrem (resp. glukózou samotnou) a poměrem aktivit (dialyzát/perfuzát) indikátoru 3H2O, a to jak v absolutních, tak relativních vyjádřeních [50].
Závěr
Oba mikrodialyzační přístupy k odhadům stavu mikrocirkulace mají své výhody i nedostatky, jejichž detailní znalost je zásadní pro správnou interpretaci výsledků. Pro většinu klinických aplikací je výhodnější využití metabolických indikátorů, které kromě změn mikrocirkulace umožňují posoudit i míru hypoxie či velikost tkáňového poškození se sekundárními změnami fyziologických procesů, stratifikovat riziko pacienta a personalizovat jeho léčbu. Přes mnohé výhody zůstává měření tkáňové perfuze pomocí mikrodialýzy soustředěno na klinický výzkum. Pokud se mají mikrodialyzační techniky měření tkáňové perfuze prosadit v rutinních klinických postupech, bude do budoucna nutné provést více ověřovacích studií a identifikovat situace, kde by mohly nahradit stávající metody, případně je obohatit o svůj unikátní metabolicko-farmakologický potenciál.
Rozšiřující poznámky
1. Pro hlubší pochopení některých vztahů je vhodné definovat základní pojmy a parametry, se kterými mikrodialýza pracuje.
Absolutní výtěžek (absolute recovery – AR) látky konkrétní sondou ze tkáně je definován vztahem:
AR [mol s–1] = cd Vd/t {1},
kde: cd [mol l–1] je koncentrace látky v dialyzátu, tj. na výstupu z mikrodialyzační sondy, Vd [l] je objem dialyzátu, t [s] je čas (perioda) sběru dialyzátu.
Relativní výtěžek (relative recovery – RR neboli extrakční frakce) studované látky ze tkáně je pro danou mikrodialyzační sondu definován následujícími vztahy:
RR = (cd–cp)/(ct–cp) × 100 (%) {2},
kde: cp [mol l–1] je koncentrace látky v perfuzátu (infuzátu), tj. na vstupu do sondy, cd [mol l–1] je koncentrace látky v dialyzátu, ct [mol l–1] je koncentrace látky v extracelulární tekutině v těsné blízkosti sondy;
respektive v případě nulových koncentrací dané látky v perfuzním médiu:
RR = cd/ct × 100 (%) {3}.
Rozdílnou závislost AR a RR na rychlosti průtoku mikrodialyzačního perfuzátu znázorňuje obr. 6.
Image 6. AR a RR dopaminu vyjádřena jako funkce rychlosti průtoku mikrodialyzačního perfuzátu sondou CMA/10. Upraveno dle www.microdialysis.se. 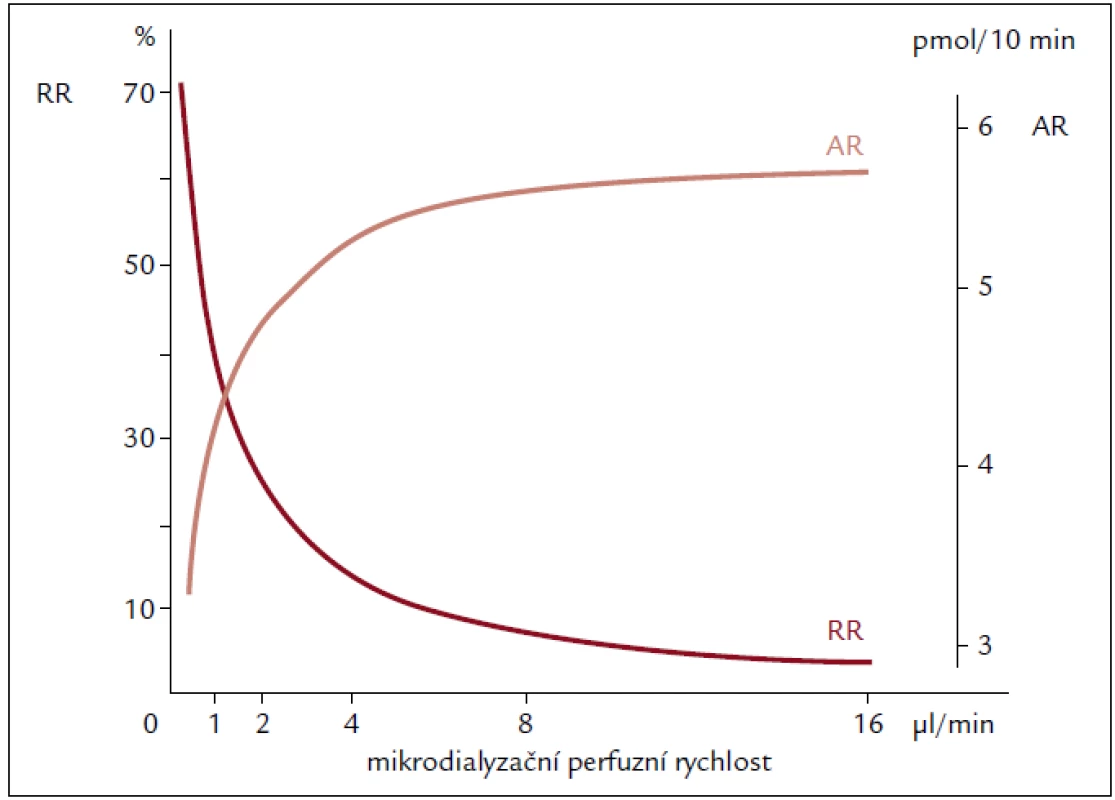
Relativní únik látky z mikrodialyzační sondy do tkáně (relative delivery – RD) je při tzv. retrodialýze roven:
RD = (cp–cd)/(cp–ct) × 100 (%) {4},
respektive v případě předpokladu nulových tkáňových koncentrací dané látky:
RD = (cp–cd)/cp × 100 (%) {5}.
2. V citované Hicknerově práci byl difuzní tok průtokového indikátoru vyjádřen pomocí poměru cd/cp jako tzv. „outflow-to-inflow ratio“. Vzhledem k tomu, že součet RD (viz {5}) a cd/cp je roven 1, je vztah mezi cd/cp a krevní perfuzí obrácený, tj. se snižujícím se průtokem ve tkáni koncentrační poměr průtokového indikátoru na výstupu a vstupu do sondy stoupá. Rychlost perfuze mikrodialyzační sondy však s poměrem cd/cp koreluje pozitivně. Nelinearitu těchto vztahů demonstruje výraz {6} a obr. 7.
cd/cp ~ 1/F ~ R {6},
kde F je normalizovaný krevní průtok tkání (bezrozměrná veličina), R je normalizovaná rychlost perfuze mikrodialyzační sondy (bezrozměrná veličina).
Image 7. Teoretický graf závislosti poměru c<sub>d</sub>/c<sub>p</sub> pro etanol na normalizovaném krevním průtoku kosterním svalem (F) a normalizované rychlosti perfuze mikrodialyzační sondy (R). Vesměs bezrozměrné veličiny. Upraveno podle [23]. ![Teoretický graf závislosti poměru c<sub>d</sub>/c<sub>p</sub> pro etanol na normalizovaném krevním průtoku kosterním svalem (F) a normalizované rychlosti perfuze mikrodialyzační sondy (R). Vesměs bezrozměrné veličiny. Upraveno podle [23].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/73feb89bc685b31bbb2c9583b5916402.png)
Veličinu definovanou poměrem cd/cp lze tudíž chápat jako „relativní zůstatek“ průtokového indikátoru v sondě. Hodnoty, které může nabývat, se pohybují v rozmezí 0–1.
3. Implantační mikrotrauma způsobí z krátkodobého hlediska uvolnění lipidových i proteinových složek plazmatických membrán, vyplavení buněčného obsahu i složek krve, což zvýší viskozitu okolního média a sníží koeficient difuze studované látky. Vyjádřením nepřímo úměrné závislosti koeficientu difuze látky (D) na viskozitě média je Stokes-Einsteinova rovnice:
D [m2 s–1] = kBT/6πησ {7},
kde: T [K] je absolutní teplota média (extracelulární tekutiny), kB je Boltzmannova konstanta (= 1,38 × 10–23 m2 kg s–2 K–1), η [kg s–1 m–1] je viskozita média (extracelulární tekutiny), σ [m] je poloměr sledované molekuly.
Pokud je v různých experimentech vstupní koncentrační gradient mezi perfuzátem sondy a okolní tkání konstantní, je koeficient difuze hlavní determinantou permeability prostředí (extracelulární tekutiny) a difuzního toku látky (J), jak lze odvodit z 1. Fickova zákona difuze:
J [mol s–1 m–2] = Δn/ΔtA = PΔc = = (D/Δx)Δc {8},
kde: Δn [mol] je látkové množství dané látky, které se účastní difuze, Δt [s] je čas, po který difuze látky probíhá, P [m s–1] je permeabilita prostředí (extracelulární tekutiny) pro danou látku, D [m2 s–1] je koeficient difuze dané látky v daném prostředí, A [m2] je plocha difuze, Δx [m] je tloušťka difuzního regionu, Δc [mol l–1] je koncentrační gradient.
Pokles permeability média a difuzního toku látky v důsledku většího implantačního traumatu vyústí ve zpomalení úniku průtokového indikátoru ze sondy, který se projeví zvýšením bazálního koncentračního poměru cd/cp. V případě masivnější lokální hemoragie se tento poměr může blížit hodnotě 1. Vzhledem k tomu, že poměr cd/cp je funkcí obrácené hodnoty tkáňového průtoku (vztah {6}, obr. 7), vede vzestup bazálních hodnot poměru cd/cp ke snížení citlivosti metody zejména ve smyslu znesnadnění záchytu ischemie. Pokud se tento problém zkombinuje s relativně malou difuzní plochou některých typů mikrodialyzačních sond, může při detekci změn krevního průtoku diluční metodou dojít až k jejímu selhání.
Velikost prostorové heterogenity (tj. rozdílů ve funkci identických, paralelně měřících sond) lze posoudit pomocí variačního koeficientu iniciálních hodnot poměru cd/cp pro daný typ sondy a tkáň. Tyto hodnoty se běžně pohybují v procentech až desítkách procent, přičemž mají negativní vztah k mikrodialyzační perfuzní rychlosti. Pokud jde o etanol, tak snižování perfuzní rychlosti ve snaze maximalizovat RR, resp. RD, a tím i citlivost metody ke změnám krevního průtoku se částečně balancuje zvýšenou variabilitou výsledků v důsledku zhoršených preanalytických podmínek (zejména odpařování). Teoretickou hodnotu RD vyplývající z charakteristik selektivně-permeabilní membrány, okolní tkáně a průtokové rychlosti mikrodialyzační sondou popisuje vztah {9}.
RD = (1 – e –PA/F) x 100 {9},
kde: e je Eulerovo číslo (2,718), P [m s–1] je permeabilita mikrodialyzační membrány a extracelulární tekutiny pro danou látku, A [m2] je difuzní plocha mikrodialyzační membrány, F [m3 s–1] je průtok perfuzátu mikrodialyzační sondou.
Poděkování
Práce byla podpořena Výzkumným záměrem MSM 6198959216.
MUDr. Norbert Cibiček, Ph.D.
www.medchem.upol.cz
e-mail: cibicek@seznam.cz
Doručeno do redakce: 7. 10. 2010
Přijato po recenzi: 19. 5. 2011
Sources
1. Ungerstedt U, Pycock C. Functional correlates of dopamine neurotransmission. Bull Schweiz Akad Med Wiss 1974; 30 : 44–55.
2. Lee GJ, Park JH, Park HK. Microdialysis applications in neuroscience. Neurol Res 2008; 30 : 661–668.
3. De la Peña A, Liu P, Derendorf H. Microdialysis in peripheral tissues. Adv Drug Deliv Rev 2000; 45 : 189–216.
4. Plock N, Kloft C. Microdialysis – theoretical background and recent implementation in applied life-sciences. Eur J Pharm Sci 2005; 25 : 1–24.
5. Bellander BM, Cantais E, Enblad P et al. Consensus meeting on microdialysis in neurointensive care. Intensive Care Med 2004; 30 : 2166–2169.
6. McGarraugh G. The chemistry of commercial continuous glucose monitors. Diabetes Technol Ther 2009; 11 (Suppl 1): S17–S24.
7. Höcht C, Opezzo JA, Bramuglia GF et al. Application of microdialysis in clinical pharmacology. Curr Clin Pharmacol 2006; 1 : 163–183.
8. Setälä L, Koskenvuori H, Gudaviciene D et al. Cost analysis of 109 microsurgical reconstructions and flap monitoring with microdialysis. J Reconstr Microsurg 2009; 25 : 521–526.
9. Baldini F. Microdialysis-based sensing in clinical applications. Anal Bioanal Chem 2010; 397 : 909–916.
10. Mecker LC, Martin RS. Integration of microdialysis sampling and microchip electrophoresis with electrochemical detection. Anal Chem 2008; 80 : 9257–9264.
11. Van Gompel JJ, Chang SY, Goerss SJ et al. Development of intraoperative electrochemical detection: wireless instantaneous neurochemical concentration sensor for deep brain stimulation feedback. Neurosurg Focus 2010; 29: E6.
12. Tai LA, Tsai PJ, Wang YC et al. Thermosensitive liposomes entrapping iron oxide nanoparticles for controllable drug release. Nanotechnology 2009; 20 : 135101.
13. Nedvídková J, Nedvídek J, Koska J et al. Využití mikrodialyzační techniky in vivo v základním a klinickém výzkumu. Čas Lék Čes 2003; 142 : 307–310.
14. Manďák J, Živný P, Lonský V et al. Sledování průtoku krve kosterním svalem a vybraných metabolických ukazatelů v průběhu operace v mimotělním oběhu. Rozhl Chir 2003; 82 : 460–468.
15. Pojar M, Manďák J. Intersticiální mikrodialýza v klinické a experimentální medicíně. Čas Lék Čes 2006; 145 : 766–770; diskuse 770–771.
16. Kremen J, Bláha J, Matias M et al. Monitorování glykemie u kriticky nemocných pacientů: srovnání arteriálních a intersticiálních hladin glukózy měřených pomocí mikrodialýzy tukové tkáně. Vnitř Lék 2006; 52 : 777–781.
17. Rybka J. Monitorování glykemie u kriticky nemocných pacientů – editorial. Vnitř Lék 2006; 52 : 765–767.
18. Hickner RC, Rosdahl H, Borg I et al. The ethanol technique of monitoring local blood flow changes in rat skeletal muscle: implications for microdialysis. Acta Physiol Scand 1992; 146 : 87–97.
19. Stallknecht B, Donsmark M, Enevoldsen LH et al. Estimation of rat muscle blood flow by microdialysis probes perfused with ethanol, 14C ethanol, and 3H2O. J Appl Physiol 1999; 86 : 1054–1061.
20. Farnebo S, Samuelsson A, Henriksson J et al. Urea clearance: a new method to register local changes in blood flow in rat skeletal muscle based on microdialysis. Clin Physiol Funct Imaging 2010; 30 : 57–63.
21. Hrubá P, Živný P, Živná H et al. Muscle, liver and kidney interstitium blood flow changes in rats measured by microdialysis with flow marker added. Klin Biochem Metab 2004; 12 : 9–13.
22. Cibiček N, Mičuda S, Chládek J et al. Lithium microdialysis and its use for monitoring of stomach and colon submucosal blood perfusion – a pilot study using ischemic preconditioning in rats. Acta Medica (Hradec Kralove) 2006; 49 : 227–231.
23. Wallgren F, Amberg G, Hickner RC et al. A mathematical model for measuring blood flow in skeletal muscle with the microdialysis ethanol technique. J Appl Physiol 1995; 79 : 648–659.
24. Râdegran G, Pilegaard H, Nielsen JJ et al. Microdialysis ethanol removal reflects probe recovery rather than local blood flow in skeletal muscle. J Appl Physiol 1998; 85 : 751–757.
25. Clough GF, Boutsiouki P, Church MK et al. Effects of blood flow on the in vivo recovery of a small diffusible molecule by microdialysis in human skin. J Pharmacol Exp Ther 2002; 302 : 681–686.
26. Kitano M, Norlén P, Håkanson R. Gastric submucosal microdialysis: a method to study gastrin - and food-evoked mobilization of ECL-cell histamine in conscious rats. Regul Pept 2000; 86 : 113–123.
27. Rosdahl H, Lind L, Millgård J et al. Effect of physiological hyperinsulinemia on blood flow and interstitial glucose concentration in human skeletal muscle and adipose tissue studied by microdialysis. Diabetes 1998; 47 : 1296–1301.
28. Krejci V, Hiltebrand L, Büchi C et al. Decreasing gut wall glucose as an early marker of impaired intestinal perfusion. Crit Care Med 2006; 34 : 2406–2414.
29. Liu Z, Vuohelainen V, Tarkka M et al. Glutamate release predicts ongoing myocardial ischemia of rat hearts. Scand J Clin Lab Invest 2010; 70 : 217–224.
30. Ostman B, Michaelsson K, Rahme H et al. Tourniquet-induced ischemia and reperfusion in human skeletal muscle. Clin Orthop Relat Res 2004; 418 : 260–265.
31. Harken AH. Lactic acidosis. Surg Gynecol Obstet 1976; 142 : 593–606.
32. Setälä LP, Korvenoja EM, Härmä MA et al. Glucose, lactate and pyruvate response in an experimental model of microvascular flap ischemia and reperfusion: a microdialysis study. Microsurgery 2004; 24 : 223–231.
33. Clausena T, Zaunera A, Levasseura JE et al. Induced mitochondrial failure in the feline brain: implications for understanding acute post-traumatic metabolic events. Brain Research 2001; 908 : 35–48.
34. Juel IS, Solligård E, Skogvoll E et al. Lactate and glycerol released to the intestinal lumen reflect mucosal injury and permeability changes caused by strangulation obstruction. Eur Surg Res 2007; 39 : 340–349.
35. Matthiessen P, Strand I, Jansson K et al. Is early detection of anastomotic leakage possible by intraperitoneal microdialysis and intraperitoneal cytokines after anterior resection of the rectum for cancer? Dis Colon Rectum 2007; 50 : 1918–1927.
36. Hillered L, Valtysson J, Enblad P et al. Interstitial glycerol as a marker for membrane phospholipid degradation in the acutely injured human brain. J Neurol Neurosurg Psychiatry 1998; 64 : 486–491.
37. Lieutaud T, Dailler F, Artru F et al. Neurochemical monitoring in neurointensive care using intracerebral microdialysis. In: Cremers TIFH, Westerink BHC (eds). Handbook of Microdialysis – Methods, Applications and Perspectives. In: Huston JP (ed.). Handbook of Behavioral Neuroscience. Amsterdam: Academic press, Elsevier Science 2007; 16 : 659–673.
38. Nilsson OG, Brandt L, Ungerstedt U et al. Bedside detection of brain ischemia using intracerebral microdialysis: subarachnoid hemorrhage and delayed ischemic deterioration. Neurosurgery 1999; 45 : 1176–1184.
39. Klaus S, Staubach KH, Eichler W et al. Clinical biochemical tissue monitoring during ischaemia and reperfusion in major vascular surgery. Ann Clin Biochem 2003; 40 : 289–291.
40. Ståhl N, Mellergård P, Hallström A et al. Intracerebral microdialysis and bedside biochemical analysis in patients with fatal traumatic brain lesions. Acta Anaesthesiol Scand 2001; 45 : 977–985.
41. Vespa PM, McArthur D, O’Phelan K et al. Persistently low extracellular glucose correlates with poor outcome 6 months after human traumatic brain injury despite a lack of increased lactate: a microdialysis study. J Cereb Blood Flow Metab 2003; 23 : 865–877.
42. Sarrafzadeh A, Haux D, Küchler I et al. Poor-grade aneurysmal subarachnoid hemorrhage: relationship of cerebral metabolism to outcome. J Neurosurg 2004; 100 : 400–406.
43. Oddo M, Schmidt JM, Carrera E et al. Impact of tight glycemic control on cerebral glucose metabolism after severe brain injury: a microdialysis study. Crit Care Med 2008; 36 : 3233–3238.
44. Marcoux J, McArthur DA, Miller C et al. Persistent metabolic crisis as measured by elevated cerebral microdialysis lactate-pyruvate ratio predicts chronic frontal lobe brain atrophy after traumatic brain injury. Crit Care Med 2008; 36 : 2871–2877.
45. Jansson K, Ungerstedt J, Jonsson T et al. Human intraperitoneal microdialysis: increased lactate/pyruvate ratio suggests early visceral ischaemia. A pilot study. Scand J Gastroenterol 2003; 38 : 1007–1011.
46. Solligård E, Juel IS, Bakkelund K et al. Gut luminal microdialysis of glycerol as a marker of intestinal ischemic injury and recovery. Crit Care Med 2005; 33 : 2278–2285.
47. Setälä L, Papp A, Romppanen EL et al. Microdialysis detects postoperative perfusion failure in microvascular flaps. J Reconstr Microsurg 2006; 22 : 87–96.
48. Jansson K, Strand I, Redler B et al. Results of intraperitoneal microdialysis depend on the location of the catheter. Scand J Clin Lab Invest 2004; 64 : 63–70.
49. Emmertsen KJ, Wara P, Soerensen FB et al. Intestinal microdialysis – applicability, reproducibility and local tissue response in a pig model. Scand J Surg 2005; 94 : 246–251.
50. Cibiček N, Živná H, Vrublová E et al. Gastric submucosal microdialysis in the detection of rat stomach ischemia – a comparison of the 3H2O efflux technique with metabolic monitoring. Physiol Meas 2010; 31 : 1355–1368.
51. Deeba S, Corcoles EP, Hanna GB et al. Use of rapid sampling microdialysis for intraoperative monitoring of bowel ischemia. Dis Colon Rectum 2008; 51 : 1408–1413.
52. Korf J, Huinink KD, Posthuma-Trumpie GA. Ultraslow microdialysis and microfiltration for in-line, on-line and off-line monitoring. Trends Biotechnol 2010; 28 : 150–158.
53. Andrews PJ, Citerio G, Longhi L et al. Neuro-Intensive Care and Emergency Medicine (NICEM) Section of the European Society of Intensive Care Medicine. NICEM consensus on neurological monitoring in acute neurological disease. Intensive Care Med 2008; 34 : 1362–1370.
54. Sitina M, Cerny V. Evaluating tissue perfusion using labelled water indicator microdialysis in a rat model of haemorrhagic shock. Physiol Meas 2007; 28 : 689–696.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 1-
All articles in this issue
- Význam globálnej kontraktilnej rezervy u pacientov s resynchronizačnou liečbou
- Podrobná studie o polypech tlustého střeva
- Endokrinné zmeny pri chorobách pečene
- Běžné, standardizované a doporučené postupy v diagnostice a monitorování paroxysmální noční hemoglobinurie průtokovou cytometrií
- Nemoc z ukládání lehkých řetězců imunoglobulinu (light chain deposition disease)
- Způsoby hodnocení krevní perfuze tkání pomocí intersticiální mikrodialýzy – přehled současných znalostí
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Doporučený postup k posouzení kardiovaskulárního rizika a prevenci kardiovaskulárních onemocnění a diabetes mellitus 2. typu u žen se syndromem polycystických ovarií
- Septický šok v dôsledku infekčnej endokarditídy stimulačného systému implantabilného kardioverter defibrilátora
- Lenalidomid indukoval léčebnou odpověď u pacienta s agresivní multisystémovou formou histiocytózy z Langerhansových buněk (LCH), rezistentní ke 2-chlorodeoxyadenosinu a časně relabující po vysokodávkované chemoterapii BEAM s autologní transplantací kmenových hemopoetických buněk
- Hyponatrémia – komplikácia liečby karbamazepínom
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endokrinné zmeny pri chorobách pečene
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Podrobná studie o polypech tlustého střeva
- Hyponatrémia – komplikácia liečby karbamazepínom
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

