-
Medical journals
- Career
Účinnost anti‑TNF‑α léčiv v běžné klinické praxi a náklady na tato léčiva
Authors: M. Prokeš
Authors‘ workplace: INFOPHARM a. s., Praha, ředitel PharmDr. Josef Suchopár
Published in: Vnitř Lék 2009; 55(1): 45-53
Category: Reviews
Overview
Byla porovnávána účinnost jednotlivých anti‑TNF‑α léčiv adalimumab, infliximab a etanercept u revmatoidní artritidy (RA), která byla zjištěna v zahraničních studiích provedených v běžné klinické praxi. Dále byl na základě údajů nizozemského registru DREAM (Kiewit et al, 2008) proveden výpočet ekonomické náročnosti léčby jednotlivými anti‑TNF‑α léčivy v ČR. Bylo zjištěno, že cena léčby všemi 3 léčivy je u pacienta s průměrnou hmotností 1. rok velmi podobná, 2. rok je infliximab levnější, avšak toto platí pouze v případě, že dávky není třeba zvyšovat na 4 ampule na jednu dávku a více. Klinická efektivita byla vyjádřena v jednotkách DAS28 a HAQ. Nákladová efektivita všech 3 anti‑TNF‑α léčiv byla podobná pro všechny 3 anti‑TNF‑α léčiva při dávkách infliximabu do 2 ampulí na jednu dávku, při vyšším dávkování infliximabu byla pozorována tendence ke snižování jeho nákladové efektivity ve srovnání s adalimumabem a etanerceptem.
Klíčová slova:
anti‑TNF‑α léčiva – revmatoidní artritis – nákladová efektivitaÚvod
Cíle této práce jsou následující: V prvé části sdělení seznámit čtenáře s kritérii účinnosti jednotlivých anti‑TNF‑α léčiv u RA a přehledným způsobem porovnat jejich účinnost na základě sledování pacientů v běžné klinické praxi. Cílem druhé části sdělení je porovnat ekonomickou náročnost léčby RA jednotlivými anti‑TNF‑α léčivy v ČR a diskutovat o významnosti údajů, které jsou v tomto směru dostupné.
Revmatoidní artritida (RA) je chronické zánětlivé autoimunitní onemocnění, které postihuje až 1 % populace. Jde většinou o progresivní onemocnění, které zhoršuje funkci pacientova lokomočního aparátu, vyvolává disabilitu, invaliditu a zkracuje život pacientů o 7–10 let. Základem léčby každé aktivní RA je aplikace tzv. chorobu modifikujících léků (DMARDs), z nichž nejčastěji je užíván metotrexát (MTX). V posledních 10 letech byl prokázán dobrý účinek protilátek proti tumor nekrotizujícímu faktoru a (anti‑TNF‑α) léčiv na průběh onemocnění RA, proto jsou tato stále častěji indikována u pacientů, kde podávání klasických léků modifikujících chorobu (DMARDs) nepřineslo očekávaný efekt (schéma 1, které bylo sestaveno dle údajů uvedených v publikaci Pavelky et al [1]). Biologická léčiva (k nimž anti‑TNF‑α patří) jsou významná tím, že zpomalují až zastavují strukturální progresi RA, která jinak pacienty invalidizuje.
Schéma 1. Strategie léčby revmatoidní artritidy DMARDs. Podle [1]. ![Schéma 1. Strategie léčby revmatoidní artritidy DMARDs. Podle [1].](https://pl-master.mdcdn.cz/media/image/8c60c750512d488b5f4f3b0cd542e17d.jpg?version=1537795180)
Mechanizmus účinku anti‑TNF‑α léčiv vychází z patolofyziologie RA a je následující: v chorobou zasaženém kloubu se hromadí zánětlivé buňky, v synoviální membráně dochází k novotvorbě cév. Vzniká bohatě vaskularizovaná tkáň – panus, jejíž buňky jsou zdrojem proteolytických enzymů, které vedou k destrukci kloubu. Na této destrukci se podílejí i Th-1 lymfocyty a aktivované buňky monocyto-makrofágového systému. Tyto buňky produkují cytokiny, jako jsou tumor nekrotizující faktor a (TNF‑α), interleukin‑1, interleukin‑6 a další, které dále zvyšují aktivitu zánětu v kloubu. Účinek TNF‑α (tedy aktivitu zánětu) lze snížit dvojím způsobem: buď TNF‑α inaktivujeme monoklonálními protilátkami, nebo jej „zaslepíme“ velkým množstvím solubilních specifických receptorů tak, že TNF‑α se nebude moci připojit na konkrétní vazebné místo na cílových buňkách, a spustit tak kaskádu zánětlivých jevů.
TNF‑α blokátory, které počítáme mezi tzv. biologická léčiva, jsou následující:
Infliximab (REMICADE) – chimerická monoklonální protilátka, která se váže na TNF‑α, čímž jej inaktivuje. Podává se v kombinaci s metotrexátem. Dávky infliximabu jsou 3–10 mg/kg hmotnosti i.v. v nultém týdnu, poté ve 2. a 6. týdnu a poté dlouhodobě vždy s odstupem 8 týdnů.
Etanercept (ENBREL) – solubilní IG TNF‑α receptor, který je vázaný na Fc-část imunoglobulinové molekuly. Podává se samotný nebo v kombinaci s metotrexátem. Dávky etanerceptu jsou 25 mg s.c. 2krát týdně nebo 50 mg 1krát týdně (což je užíváno častěji).
Adalimumab (HUMIRA) je lidská monoklonální protilátka, která se specificky váže na TNF‑α, čímž jej inaktivuje. Může být podávána samotná nebo v kombinaci s metotrexátem. Dávky adalimumabu jsou 40 mg s.c. 1krát za 2 týdny.
Při nedostatečné účinnosti některého z výše uvedených TNF‑α blokátorů je možno nasadit jiné anti‑TNF‑α léčivo nebo jiný biologický lék.
Rituximab (MABTHERA) je chimerická monoklonální protilátka, která po navázání na povrh B‑lymfocytů s CD20 pozitivitou působí jejich lýzu. Podává se spolu s MTX v pomalých infuzích po premedikaci antihistaminika, antipyretika a ev. i glukokortikoidů, a to ve 2 dávkách 1 000 mg i.v. podaných ve 14denním intervalu.
Abatacept (ORENCIA) je fúzní protein, který selektivně moduluje kostimulační signál potřebný pro plnou aktivaci T‑lymfocytů CD28+. Snižuje tvorbu antigen-specifického TNF‑α, interferonu g a IL‑2 v T‑lymfocytech. Dávky abataceptu jsou asi 10 mg i.v. v nultém týdnu, poté ve 2. a 4. týdnu a poté dlouhodobě vždy s odstupem 4 týdnů.
Účinnost léčiv anti‑TNF‑α
Optimálním výsledkem léčby RA je docílení remise, což se v praxi většinou nezdaří [1]. Protože určitá míra aktivity nemoci u pacientů přetrvává, je třeba DMARDs včetně léčiv anti‑TNF‑α podávat kontinuálně, někdy i po celý život. Ve vybraných studiích byla účinnost léčby hodnocena buď kritérii ACR pro zlepšení, nebo tzv. DAS28, disease activity score (kritérium doporučené EULAR). Výpočet DAS28 je prováděn na základě následujících údajů: počet oteklých kloubů, počet bolestivých kloubů, FW a hodnocení aktivity onemocnění pacientem na VAS (0 až 100 mm). Výpočet je možno provést automaticky na http://www.das-score.nl/www.das-score.nl/DAS28--ne.xls .
Stratifikace hodnocení aktivity dle DAS28: remise DAS28 < 2,6, nízká aktivita 2,8 < DAS28 < 3,2, střední aktivita 3,2 < DAS28 < 5,1, vysoká aktivita 5,1 ≤ DAS28.
Podle kritérií EULAR je terapeutická odpověď označována za pozitivní v případě, že DAS28 poklesne o více než 1,2 jednotky.
Účinnost léčby je vhodné též hodnotit prostřednictvím standardních dotazníků, které vyhodnocují údaje, jak pacient vnímá nemoc a jaká omezení aktivit denního života pociťuje. Jsou to dotazníky HAQ, SF-36 a EuroQol (EQ-5D). Interpretace výsledků HAQ je následující: od 0 do 1,0 se jedná o malé až střední obtíže, od 1,0 do 2,0 o střední až vážné omezení a při hodnotách od 2 do 3 se jedná o vážné až velmi vážné omezení [2].
V samostatných klinických studiích byla prokázána dobrá účinnost i snášenlivost jak infliximabu [3], tak etanerceptu [4] i adalimumabu [5]. Bylo též prokázáno, že po vysazení jednoho anti‑TNF‑α léčiva je s velkou pravděpodobností možno očekávat úspěch druhého, resp. třetího anti‑TNF‑α léčiva [6].
Kliničtí lékaři pro své rozhodování potřebují znát odpovědi na tyto otázky:
Jaká je účinnost léčiv anti‑TNF‑α v běžné klinické praxi? Které z nich je nejúčinnější, nejlevnější, nejvíce nákladově efektivní?
Protože neexistují randomizované klinické studie porovnávající léčebné efekty přímo (head-to-head), můžeme odpovědi získat ze studií, které byly provedeny nadnárodními registry pacientů s RA. Na rozdíl od klinických studií v běžné klinické praxi bývají pacienti starší, nemocní více chorobami, aktivita onemocnění bývá nižší a nižší bývá i compliance pacientů. Lékaři rozhodují o léčebném postupu nikoli podle protokolu studie, ale podle svého nejlepšího vědomí individuálně. Mohou se přitom opírat o guidelines, jejichž dikce bývá v různých zemích podobná: anti‑TNF‑α léčivo se nasadí k léčbě RA s alespoň střední aktivitou (DAS28 ≥ 3,2), pokud selžou dvě jiná DMARDs včetně metotrexátu. Záleží však na jednotlivých lékařích, jaké anti‑TNF‑α léčivo zvolí u kterého pacienta a do jaké míry budou guidelines i dávkování uvedené v SPC dodržovat.
Zink et al [7] sledovali zdravotní stav u 1 458 pacientů s RA zapsaných do registru RABBIT, který sdružuje pacienty léčené anti‑TNF‑α léčivy v Německu. Vyhodnoceny byly údaje u pacientů, jimž byl nasazen infliximab (n = 372), etanercept (n = 647) nebo adalimumab (n = 439). Pacienti byli rozděleni do skupin nejen podle podávaného léku, ale též podle toho, zda by teoreticky splňovali kritéria zařazení do klasických klinických studií (např. ATTRACT, TEMPO nebo ARMADA), nebo nikoliv. Stav pacientů byl vyhodnocen po 6 měsících léčby. Výsledky jsou uvedeny v tab. 1. Je zřejmé, že účinnost anti‑TNF‑α léčiv je v podstatě srovnatelná a že výsledky ve skupině pacientů, kteří by nesplnili kritéria pro vstup do klinických studií, jsou poněkud méně výrazné než u podstatně menší skupiny pacientů, kteří by pečlivě definovaná kritéria do klasických klinických studií splnili. Ukázalo se, že běžná klinická praxe se od klinických studií může výrazně lišit.
Rozdíly mezi účinností jednotlivých anti‑TNF‑α léčiv nenalezl ani Duclos se spolupracovníky v roce 2006 [8] ve francouzském registru, avšak Finckh et al [9] u pacientů s RA ve Švýcarsku identifikovali nepřímé indicie naznačující, že účinnost jednotlivých léčiv nemusí být zcela stejná. Podrobnější vyhodnocení výsledků nebylo možné, neboť pacienti léčení jednotlivými léčivy se navzájem lišili jak výchozí aktivitou onemocnění, tak i výčtem současně užívaných léků (např. glukokortikoidy) a tím, zda u nich v minulosti již bylo aplikováno jiné anti‑TNF‑α léčivo, či nikoliv.
Lepší homogenitu pacientů než Finckh nalezli Kievit et al v Dutch Rheumatoid Arhtritis Monitoring (DREAM) registru. Na základě těchto údajů pak roce 2008 zveřejnili studii, ve které srovnávají výsledky léčby jednotlivými anti‑TNF‑α léčivy v Nizozemsku [10]. Primárním cílem bylo zjištění, jak se u pacientů po nasazení prvého léčiva anti‑TNF‑α během 12 měsíců změní aktivita onemocnění měřená DAS28a jaké procento pacientů vykazuje zlepšení dle EULAR kritérií. Sekundárními cíli byla zjištění, jak je ovlivněn funkční stav pacientů a kvalita života [11] a jaké jsou náklady na léčbu RA. Pacienti byli rozděleni do skupin podle toho, které anti‑TNF‑α léčivo bylo podáno jako první: adalimumab 267 pacientů, etanercept 289 pacientů a infliximab 151 pacient.
Medián dávky pro adalimumab byl 40 mg za 2 týdny, pro etanercept 50 mg za týden a pro infliximab 3,3 mg/kg za 8 týdnů (po úvodní sekvenci v 1., 2. a 6. týdnu v dávce 3 mg/kg).
Výsledky jsou znázorněny na grafech 1–3. Rozdíl mezi infliximabem a adalimumabem a mezi infliximabem a etanerceptem byl pro každé čtvrtletí statisticky významný (p < 0,05, v případě DAS28 p < 0,0001), mezi adalimumabem a etanerceptem byl rozdíl statisticky významný v případě hodnocení DAS28 (p = 0,031), v případě hodnocení HAQ nikoliv. Je zřejmé, že léčba infliximabem dosahovala nejmenších úspěchů. K nižšímu dosaženému DAS28u infliximabu přispěl i fakt, že tuto léčbu vysadilo během jednoho roku 31 % pacientů, přičemž adalimumab vysadilo jen 22 % pacientů a etanercept pouze 21 % pacientů. Příčiny vysazení uvedených léků se navzájem nelišily: 48 % pro nežádoucí účinky, 33 % pro nedostatek účinnosti a 18 % pro blíže nespecifikované příčiny.
Image 1. DAS28 a její změny u pacientů s RA během 12 měsíců léčby [10]. Pozn.: DAS28 – Disease Activity Score, které popisuje klinickou aktivitu onemocnění (vysvětlení viz text). ![DAS28 a její změny u pacientů s RA během 12 měsíců léčby [10].
Pozn.: DAS28 – Disease Activity Score, které popisuje klinickou aktivitu onemocnění (vysvětlení viz text).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/548684cf86e178d1683977ec887f392f.jpg)
Image 2. Procento odpovědi dle EULAR kritérií na léčbu anti-TNF-α léčivy [10]. Pozn.: EULAR – Europe an League Against Rheumatism; za pozitivní odpověď je podle této organizace považován pokles DAS28 o 1,2 jednotky. ![Procento odpovědi dle EULAR kritérií na léčbu anti-TNF-α léčivy [10].
Pozn.: EULAR – Europe an League Against Rheumatism; za pozitivní odpověď je podle této organizace považován pokles DAS28 o 1,2 jednotky.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/90b55190f59aab23524f3c5d6bbc1e6a.jpg)
Image 3. Funkční schopnost pacientů a její změny během 12 měsíců léčby (hodnoceno HAQ, dle [10]) Pozn.: HAQ – Health Assessment Questionarie (vysvětlení viz text). ![Funkční schopnost pacientů a její změny během 12 měsíců léčby (hodnoceno HAQ, dle [10])
Pozn.: HAQ – Health Assessment Questionarie (vysvětlení viz text).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/dc0374aa4a9af3a127e209bcfd6ef122.jpg)
Náklady na antirevmatické léky jsou znázorněny na grafu 4. Je zřejmé, že léčba infliximabem byla v Nizozemsku nejdražší (pro anti‑TNF‑α léčiva: p < 0,0001, pro všechna antirevmatika užívaná pacienty p < 0,008). Podobně jako dotazník HAQ identifikovaly i EQ-5D a SF-36 infliximab jako nejméně účinný, avšak pro EQ-5D nebyly rozdíly statisticky významné.
Image 4. Medián nákladů na antirevmatika u jednotlivých skupin pacientů léčených různými anti-TNF-α léčivy [10] v Nizozemsku. Pozn.: NSA – nester idní antiflogistika. DMARDS – chorobu modifikující léky (Disease Modifying Anti Rheumatic Drugs). ![Medián nákladů na antirevmatika u jednotlivých skupin pacientů léčených různými anti-TNF-α léčivy [10] v Nizozemsku.
Pozn.: NSA – nester idní antiflogistika. DMARDS – chorobu modifikující léky (Disease Modifying Anti Rheumatic Drugs).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6a0bdd20ef6845c1606dfb1b357465fc.jpg)
Modelace nákladů na anti‑TNF‑α léčiva v ČR
Finanční náklady na léčbu jsou dalším z kritérií, které ve vyspělých zemích ovlivňují volbu léčebné metody. Zatímco údaje o účinnosti a bezpečnosti lze bez problémů přijímat ze studií prováděných v zahraničí, údaje o nákladovosti je třeba přepočítat na poměry v každé jednotlivé zemi, což platí i pro ČR [11].
Kalkulace nákladů pro ČR byla provedena z hlediska plátce, kterým jsou zdravotní pojišťovny.
Základní předpoklady naší kalkulace:
- Náklady na další antirevmatickou medikaci (NSA, jiná DMARDs i glukokortikoidy) jsou zanedbatelné [10], nebyly tedy do kalkulací zahrnuty.
- Dávky léků budou shodné s dávkami uvedenými ve studii Kiewit [10]. U infliximabu bylo zohledněno, že počáteční dávky jsou 3 mg/kg 1. týden, 2. týden a 6. týden, poté je kalkulováno navýšení dávky na 3,3 mg/kg, přičemž tyto jsou aplikovány každých 8 týdnů (tedy 3 ampule na 1 dávku).
- Výsledky léčby budou shodné s výsledky uvedenými ve studii Kiewit [10].
- Časová perspektiva: prvý rok léčby a druhý rok léčby.
Ceny výkonů jsou kalkulovány s tím, že 1 bod = 1 Kč a že cena režie za 1 minutu je 2 Kč. Před aplikací infuze infliximabu je kalkulováno kontrolní vyšetření revmatologem. Je počítáno s tím, že pacient je k infuzní aplikaci převezen do ordinace revmatologa sanitním vozem, přičemž průměrná vzdálenost je 20 km. Pro aplikaci etanerceptu a adalimumabu je kalkulován pouze výkon subkutánní injekce, žádné vyšetření ani převoz sanitou kalkulován není. Výsledky jsou znázorněny v tab. 2 a v obr. 5.
Image 5. Náklady zdravotních pojišťoven na anti-TNF-α léčiva v ČR: modelace pro první a druhý rok léčby. 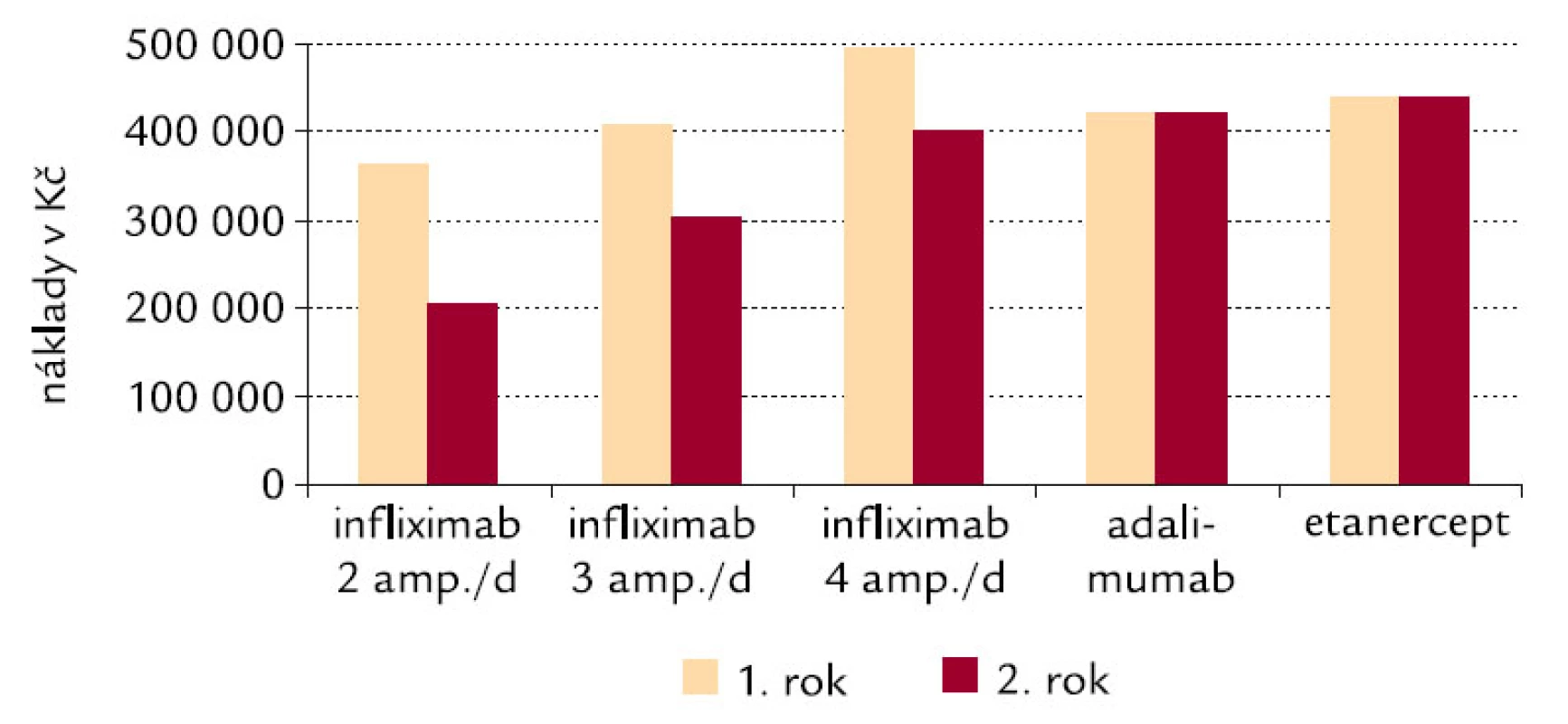
Vyšší náklady na infliximab v prvním roce oproti rokům následujícím jsou způsobeny tím, že úvodní dávky jsou podávány častěji (v týdnu č. 1, č. 2 a č. 6) a že teprve poté je dodržován interval 8 týdnů, který je zachován i ve druhém roce léčby. Množství infliximabu 3 ampule na 1 dávku při 3,3 mg/kg je podáváno pacientům nad 60 kg do 90 kg.
Nákladová efektivita anti‑TNF‑α léčiv v ČR
Tato analýza je provedena z hlediska veřejného zdravotního pojištění a hodnotí pouze přímé zdravotní náklady zdravotních pojišťoven na léčbu. Analýza nákladové efektivity dává do vztahu komplexní náklady na léčbu a výsledky této léčby. Výsledky přebíráme ze studie Kievita et al [10], základem je plocha pod křivkou hodnocení DAS28, resp. HAQ pro jednotlivé skupiny pacientů v průběhu 1. roku (obr. 1 a 3). Pro 2. rok byla provedena extrapolace hodnoty zjištěná na konci 1. roku. Kalkulace nákladů je provedena pro ČR (tab. 2). Pro infliximab je kalkulace provedena pro pacienta s hmotností 61–90 kg, a to za předpokladu, že dávky infliximabu budou po úvodní sekvenci 3 mg/kg zvýšeny na 3,3 mg/kg. Výpočet byl proveden pro 1,2 jednotky DAS28 (kritérium EULAR) a 0,22 jednotky HAQ, neboť tyto hodnoty představují minimální klinicky významné zlepšení stavu ([2], volně ke stažení na www.hqlo.com/content/I/I/20).
Údaje uvedené v tab. 3 a 4 však platí pouze tehdy, pokud pacient v jedné dávce užívá 3 ampule infliximabu. Pacienti s hmotností 60 kg a méně však při dávkování 3,3 mg/kg budou užívat pouze 2 ampule v jedné dávce a pacienti s hmotností 90 kg a více 4 ampule v jedné dávce. Naopak hmotnost pacienta nemá vliv na dávku etanerceptu ani adalimumabu. Vliv rozdílného dávkování infliximabu na nákladovou efektivitu u různých hmotností pacientů je znázorněn na obr. 6 a 7.
Image 6. Náklady na dosažení a udržení poklesu o 1,2 DAS28 u pacientů s RA po dobu 2 let v ČR. Pozn.: DAS28 – Disease Activity Score, které popisuje klinickou aktivitu onemocnění (vysvětlení viz text). 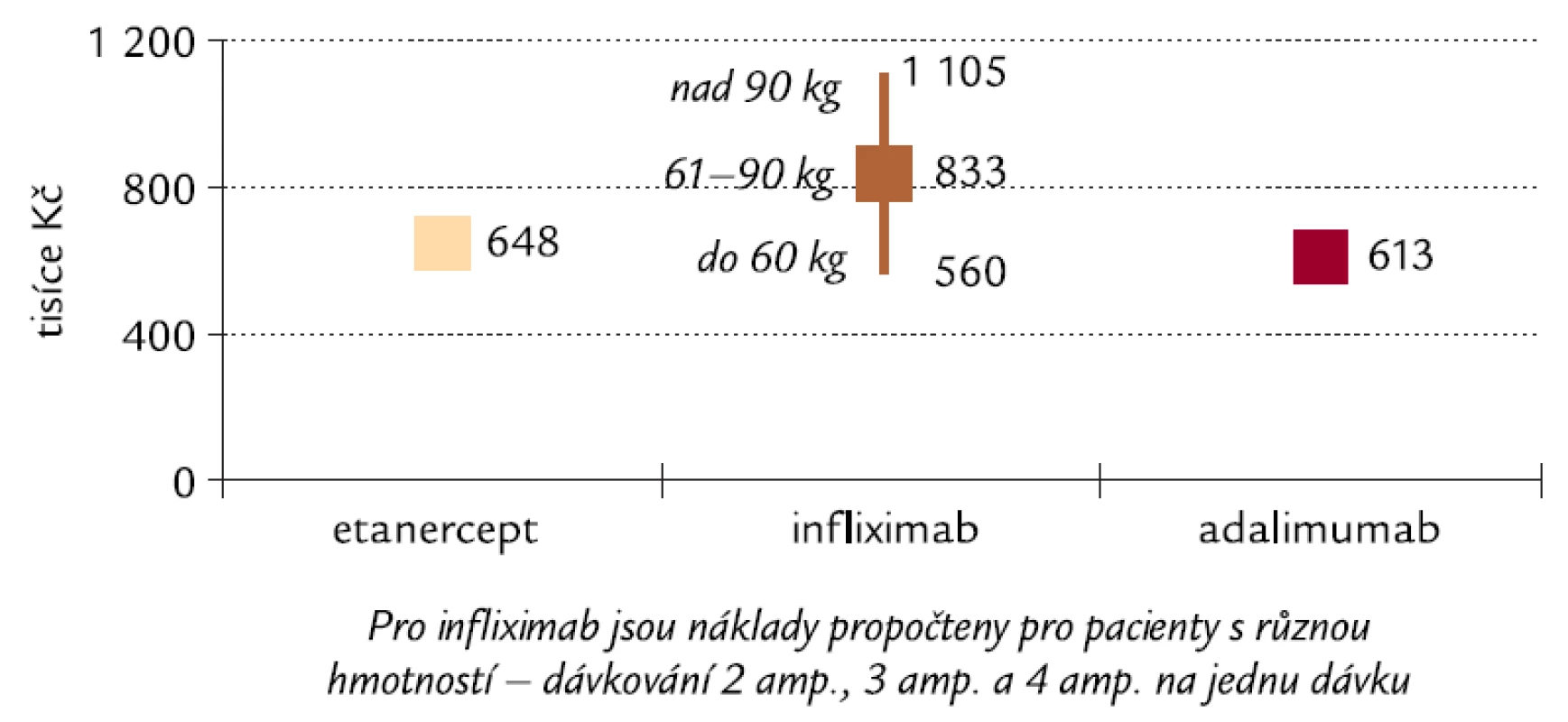
Image 7. Náklady na dosažení a udržení zřetelného zlepšení funkce vnímaného pacienty s RA (pokles o 0,22 HAQ) po dobu 2 let v ČR. Pozn.: HAQ – Health Assessment Questionarie, který vyjadřuje, jak choroba ovlivňuje kvalitu života pacienta (vysvětlení viz text). 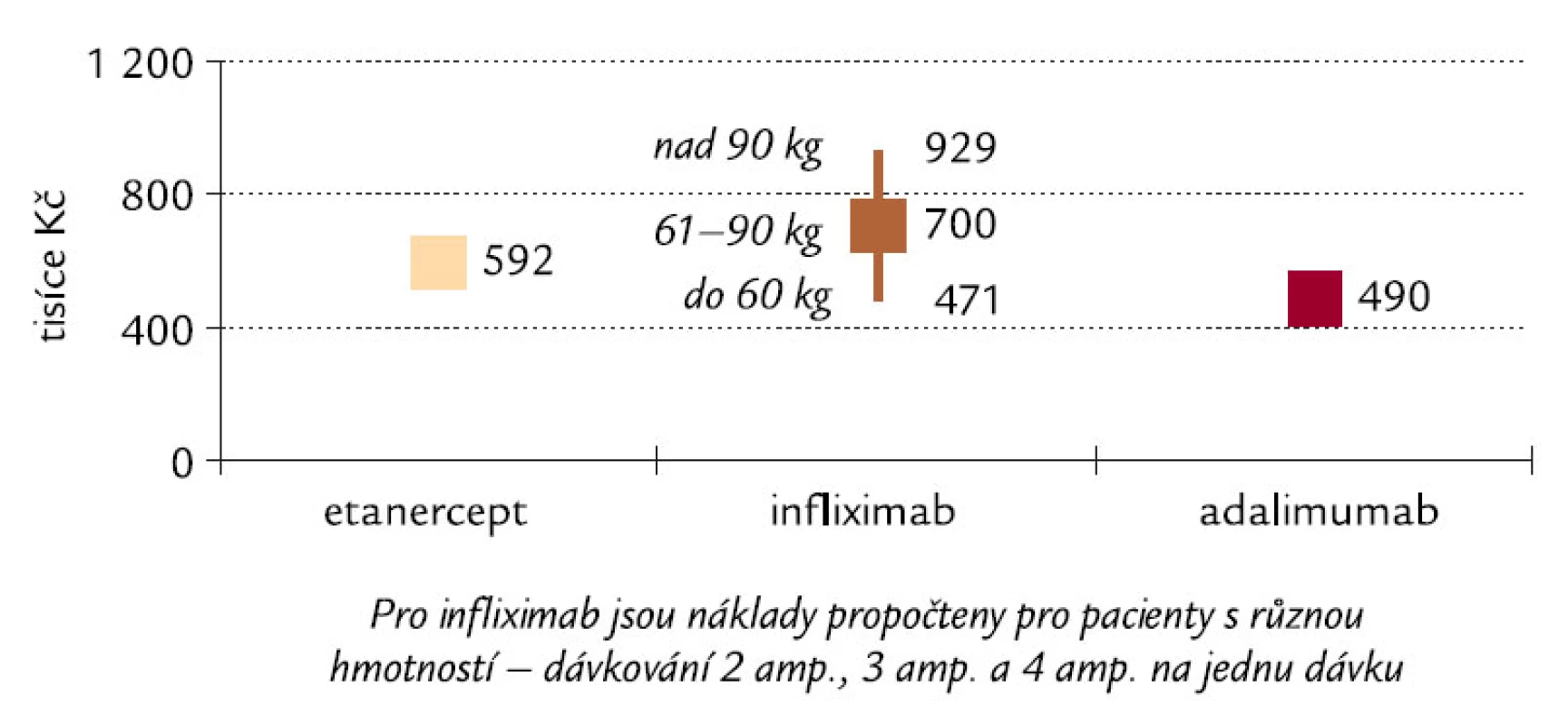
ICER – přírůstková nákladová efektivita adalimumabu oproti infliximabu
Tato analýza byla provedena pro pacienta s hmotností 70 kg a dávkou infliximabu 3,3 mg/kg. Výsledky jsou uvedeny v tab. 5 a 6.
Důležitost nákladové efektivity a správné alokace financí vyplývá z toho, že roční náklady na anti‑TNF‑α léčiva v ČR činí téměř 1 miliardu Kč, jak lze odhadnout z obr. 8.
Image 8. Náklady na etanercept, infliximab a adalimumab v 1. čtvrtletí 2008 v ČR (zdroj – SÚKL). 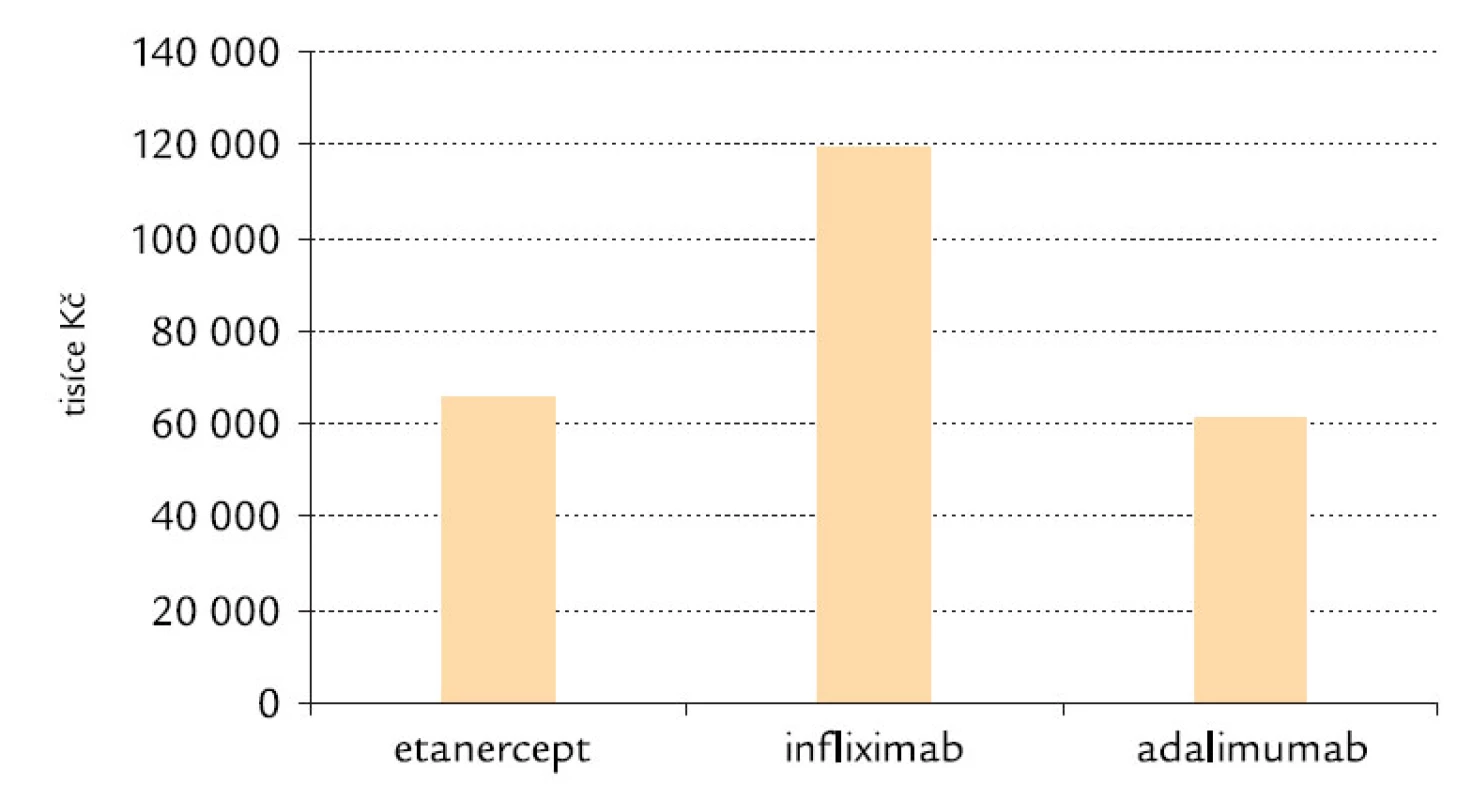
Diskuze
Z přehledu studií vyplývá, že anti‑TNF‑α léčiva jsou k léčbě RA ve vyspělých zemích běžně užívána. Lze předpokládat, že účinnost konkrétních léčiv je v různých zemích srovnatelná, avšak nákladová efektivita je odlišná, neboť se liší ceny léků i ceny zdravotních výkonů.
Předložená farmakoekonomická analýza je provedena z hlediska veřejného zdravotního pojištění, nepřímé zdravotnické náklady ani ostatní náklady zohledněny nebyly. Ze studie Kievit et al [10] nad databází DREAM, která je základem předložené farmakoekonomické analýzy, vyplývá, že míra účinnosti adalimumabu i etanerceptu je srovnatelná, účinnost infliximabu je poněkud nižší.
Z údajů z číselníků léčiv v ČR vyplývá, že léčba infliximabem je levnější než léčba adalimumabem nebo etanerceptem, pokud nejsou podávány zvýšené dávky infliximabu 4 a více ampulí na jednu dávku, tj. u pacientů s hmotností 70 kg > 4,2 mg/kg. Rozdíl v ceně léčiv se výrazněji uplatní až po uplynutí jednoho roku.
K dosažení srovnatelného účinku vztaženého na jednotku DAS28 je při započetí léčby infliximabem třeba vynaložit více peněz než u adalimumabu nebo etanerceptu. Toto platí u osob s hmotností nad 60 kg při běžném dávkování infliximabu.
Náklady na zlepšení funkčního stavu pacienta měřeného HAQ jsou nejnižší u adalimumabu a nejvyšší u infliximabu. Toto platí u osob s hmotností nad 60 kg při běžném dávkování infliximabu.
Zřetelného klinického zlepšení RA (rozdíl výsledného DAS28 o 1,2 jednotky) ve smyslu ICER při léčbě adalimumabem vzhledem k léčbě infliximabem dosáhneme v prvním roce za 27 708 Kč, ve druhém roce za 237 622 Kč.
Zřetelné zlepšení funkčního stavu pacienta s RA (výsledný rozdíl skóre HAQ 0,22 jednotky) ve smyslu ICER při léčbě adalimumabem vzhledem k léčbě infliximabem dosáhneme v prvním roce za 21 389 Kč, ve druhém roce za 163 365 Kč.
Dva poslední údaje platí pro osoby s hmotností 61–90 kg.
Jak silné důkazy přináší studie Kievita et al [10] a naše farmakoekonomická analýza? Je třeba si uvědomit, že dosud nebyla provedena žádná randomizovaná studie porovnávající současně 2, nebo dokonce všechna 3 anti‑TNF‑α léčiva, účinnost těchto léků byla prokázána v samostatných RCT, kde komparátorem bylo placebo. V posledních letech bylo publikováno několik studií, které byly provedeny nad databázemi národních registrů pacientů, kteří byli léčeni anti‑TNF‑α léčivy. Výběr konkrétního léčiva u jednotlivých pacientů však nebyl náhodný, záležel na řadě faktorů, které interpretaci výsledného efektu značně ztížily. Jednotlivé skupiny pacientů léčených konkrétními léčivy se lišily v délce trvání nemoci, aktivitě nemoci, v současné medikaci NSA i kortikoidy i v předchozí medikaci anti‑TNF‑α léčivy. Protože nebylo možno provést přesnější porovnávání účinnosti léčby, bylo konstatováno, že účinek všech 3 léků je zhruba stejný. Toto je v současnosti názor obecně přijímaný revmatology po celém světě, se kterým studie Kievita et al [10] polemizuje. Na druhou stranu nelze zcela opominout výsledek studie Wailoo et al 2008 [12], kteří na základě dat programu Medicare prokázali, že v USA je nákladová efektivita infliximabu s velkou pravděpodobností nižší než efektivita etanerceptu nebo adalimumabu, což by mohlo podporovat naše zjištění. Předností Kievitovy studie [10] oproti dříve zmíněným studiím je srovnatelnost všech 3 skupin pacientů léčených jednotlivými anti‑TNF‑α léčivy, což umožňuje vzájemné porovnání účinku. Navíc tato studie popisuje výsledky léčby v reálné klinické praxi, která se, jak ukázala Zink [7], liší od pečlivě připravených klinických studií. O to více je možné propočty nákladové efektivity považovat za relevantní a cenné. Současně je však nutno upozornit na určité poddávkování infliximabem, neboť průměrná výše dávky 3,3 mg/kg, podávaná v této studii, je oproti všeobecně uznávané praxi značně nízká. Lze se domnívat, že při vyšším dávkování by byl účinek infliximabu vyšší, zcela jistě by však byly vyšší i náklady.
Kalkulace nákladové efektivity pro ČR je založena na předpokladu, že klinická účinnost infliximabu v léčbě RA je nižší než účinnost adalimumabu a etanerceptu, a to měrou, kterou prokázal ve své observační studii Kievit [10]. Výsledky jedné velké, avšak otevřené a nerandomizované studie však nelze absolutizovat, při hodnocení je třeba postupovat obezřetně. Pro definitivní potvrzení kalkulací je třeba čekat na výsledky dalších studií a nejlépe i na výsledky studie, která by byla provedena v našem českém prostředí. Při přebírání výsledků zahraničních studií totiž mlčky předpokládáme, že čeští lékaři budou rozhodovat o nasazení, změně dávek i o vysazení uvedených léčiv v zásadě stejně jako jejich kolegové v zahraničí a že i skladba pacientů bude stejná. Takový předpoklad však nemusí být stoprocentně správný. Ve skutečnosti se mohou projevit určité odlišnosti, které mohou způsobit změnu ve výši až desítek procent. V průběhu let lze očekávat také změny v nákladech na léky, a to zejména ve smyslu snížení cen léků, i získání větších zkušeností s užíváním též jiných biologických léků, které zřejmě povede k upřesnění dikce guidelines. Lze se však domnívat, že údaje uvedené v tomto článku přináší zajímavý pohled na současnou problematiku léčby RA a že určitým dílem mohou přispět i k rozhodování o léčbě v ČR.
Na závěr je třeba zdůraznit, že účelnost nákladů vynaložených na léčbu anti‑TNF‑α léčivy, které jsou podány po selhání dvou jiných DMARDS, byla prokázána ve Velké Británii [13]. V současné době se daří dosahovat klinické remise revmatoidní artritidy mnohem častěji než dříve, např. ve studii PREMIER [14], kde po 2 letech podávání kombinace adalimumabu s MTX bylo dosaženo remise ve 49 % pacientů. Podobných výsledků bylo dosaženo ve studii COMET s enbrelem [15]. Důvod tak dobrých výsledků zřejmě spočívá v časném podání uvedených anti‑TNF‑α léčiv (nikoli až po selhání dvou jiných DMARDS). Proto je nyní zkoumáno, zda by nebylo vhodné podávat anti‑TNF‑α léčiva u určitých forem RA dříve než podle současných doporučení (která jsou znázorněna ve schématu 1), aby aktivita onemocnění byla potlačena včas u co nejvyššího procenta pacientů. Do budoucna lze očekávat nárůst pacientů léčených anti‑TNF‑α léčivy, proto je vhodné, aby se s těmito léky alespoň rámcově seznámili všichni lékaři, kteří budou u pacientů s RA léčit jiná, např. infekční onemocnění.
Použité zkratky
ACR American College of Rheumatology
DAS28 Disease Activity Score
DMARDs chorobu modifikující léky
EULAR European League Against Rheumatism
FW hodnota sedimentace krve
HAQ Health Assessment Questionarie
HCQ hydroxychlorochin
ICER přírůstková nákladová efektivita (Incremental Cost‑Effectivness Ratio)
MTX metotrexát
NSA nesteroidní antiflogistika
RA revmatoidní artritida
RCT randomizovaná kontrolovaná klinická studie (randomized clinical trial)
SAS sulfasalazin
SPC souhrn údajů o přípravku
TNF‑α tumor nekrotizující faktor alfa
VAS vizuální analogová škála; fakticky je to 10 cm dlouhá úsečka, na kterou pacient nakreslí křížek v té vzdálenosti, která nejvíce charakterizuje sílu bolesti nebo jiného pocitu mezi nulou a maximem (zde maximum je 10 cm).
Doručeno do redakce: 28. 7. 2008
Přijato po recenzi: 15. 10. 2008
MUDr. Michal Prokeš
www.drugagency.cz
e‑mail: prokes@drugagency.cz
Sources
1. Pavelka K, Rovenský J et al. Farmakoterapie revmatických onemocnění. Praha: Grada Publishing 2005 : 181–215.
2. Bruce B, Fries JF. The Stanford Health Assessment Questionnaire: Dimensions and Practical Applications. Health Qual Life Outcomes 2003; I: 20. http://www.hqlo.com/content/1/1/20.
3. Lipsky PE, van der Heijde DM, St Clair EW et al. Infliximab and methotrexate in the treatment of rheumatoid artritis. N Eng J Med 2000; 343 : 1594–1600.
4. Moreland LW, Weinblatt ME, Keystone EC et al. Etanercept Treatment in Adults with Established Rheumatoid Artritis: 7 Years of Clinical Experience. J Rheumatol 2006; 33 : 854–861.
5. Weinblatt ME, Keystone EC, Furst DE et al. Long term efficacy and safety of adalimumab plus methotrexate in patients with rheumatoid arthritis: ARMADA 4 year extended study. Ann Rheum Dis 2006; 65 : 753–759.
6. Hyrich KM, Lung M, Watson KD et al. Outcomes After Switching From One Anti‑Tumor Nectrosis Factor α Agent in Patients With Rheumatoid Arthritis. Arthritis Rheum 2007; 56 : 13–20.
7. Zink A, Strangfeld A, Schneider M et al. Effectiveness of Tumor Necrosis Factor Inhibitors in Rheumatoid Arthritis in an Observational Cohort Study. Arthritis Rheumatism 2006; 54 : 3399–3407.
8. Duclos M, Gossec L, Ruyssen-Witrand A et al. Retention Rates of Tumor Necrosis Factor Blockers in Daily Practice in 770 Rheumatic Patients. J Rheumatol 2006; 33 : 2433–2439.
9. Finckh A, Simard JF, Gabay C et al. Evidence for differential acquired drug resistance to anti‑tumour necrosis factor agents in rheumatoid arthritis. Ann Rheum Dis 2006; 65 : 746–752.
10. Kievit W, Adang EM, Fransen HH et al. The effectiveness and medication costs of three anti‑TNF‑α agents in the treatment of rheumatoid arthritis from prospective clinical practice data. ARD Online First, published on January 3, 2008, as 10.1136/ard.2007.083675.
11. Kolektiv autorů. Základy farmakoekonomiky pro lékaře, lékárníky a další pracovníky ve zdravotnictví. ČFES 2007.
12. Wailoo AJ, Bansback N, Brennan A et al. Biologic drugs for rheumatoid arthritis in the Medicare program: a cost‑effectiveness analysis. Arhtritis Rheum 2008; 58 : 939–946.
13. Brennan A, Bansback N, Noxon R et al. Modelling the cost effectiveness of THF‑alpha antagonists in the management of rheumatoid arthritis: results from the British Society for Rheumatology Biologics Registry. Rheumatology (Oxford) 2007; 46 : 1345–1354.
14. Breedveld FC, Weisman MH, Kavanaugh AF et al. A multucenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheumatism 2006; 54 : 26–37.
15. Emery B, Breedveld FC, Hall S et al. Comparison of methotrexate monotherapy with combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): a randomised, double-blind, parallel treatment trial. Lancet 2008; 372 : 375–382.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 1-
All articles in this issue
- Léčba Waldenströmovy makroglobulinemie – zkušenosti jednoho pracoviště
- Incidence pankreatického karcinomu u osob s chronickou pankreatitidou
- Kardiovaskulární rehabilitace v současnosti
- Ovlivnění hemostázy při terapii náhradními roztoky
- Infarkt myokardu, remodelace levé komory a buněčná terapie
- Účinnost anti‑TNF‑α léčiv v běžné klinické praxi a náklady na tato léčiva
- Karcinom kůry nadledvin
- Koronární ektazie v kombinaci s nemocí tří tepen
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom kůry nadledvin
- Koronární ektazie v kombinaci s nemocí tří tepen
- Kardiovaskulární rehabilitace v současnosti
- Léčba Waldenströmovy makroglobulinemie – zkušenosti jednoho pracoviště
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career







