-
Medical journals
- Career
Idiopatická retroperitoneální fibróza - Ormondova choroba: kazuistiky
: M. Průcha 1; P. Beňo 2; M. Bartůněk 2; J. Votrubová 3; Lenka Sedláčková 1; R. Kříž 4
: Oddělení klinické biochemie hematologie a imunologie Nemocnice Na Homolce, Praha, přednosta prim. MUDr. Miroslav Průcha, Ph. D. 1; Chirurgické oddělení Nemocnice Na Homolce, Praha, prim. MUDr. Pavel Beňo 2; Oddělení nukleární medicíny Nemocnice Na Homolce, Praha, přednosta doc. MUDr. Otakar Bělohlávek, CSc. 3; Radiodiagnostické oddělení Nemocnice Na Homolce, Praha, přednostka prim. MUDr. Vladimíra Janoušková, CSc. 4
: Vnitř Lék 2008; 54(3): 282-286
: Case Reports
Ormondova choroba - idiopatická retroperitoneální fibróza - je relativně vzácné onemocnění charakterizované in situ novotvorbou fibrotické tkáně, která postihuje v klasických případech retroperitoneální prostor a s ním anatomicky související struktury. Postižení ureterů a s tím související hydronefróza ledvin jsou typickou klinickou manifestací. Jsou však možné také klinické manifestace s méně obvyklou lokalizací, kde je diagnostika tohoto onemocnění obtížnější. Laboratorní nálezy jsou nespecifické, z anatomických důvodů není možné vždy provést diagnostickou punkci, a tak určitou možnost poskytují nové zobrazovací metody, jako je např. PET/CT. Etiologicky je Ormondova choroba onemocnění většinou idiopatické, v menšině případů se vyskytuje jako sekundární - v důsledku používání léků, výskytu onkologického onemocnění, infekcí. Idiopatická retroperitoneální fibróza je dávána do souvislosti s klinickou manifestací systémových autoimunitních onemocnění. Léčba zahrnuje kombinaci chirurgické a imunosupresivní terapie s dobrou prognózou. V práci jsou uvedeny 2 kazuistiky, z toho jedna s méně obvyklou klinickou manifestací. Při jejich diagnostice byly využity novější diagnostické přístupy - použití PET/CT, při terapii kombinace chirurgické a imunosupresivní terapie.
Klíčová slova:
Ormondova choroba - idiopatická retroperitoneální fibróza - diagnostika - terapieÚvod
Retroperitoneální fibróza je poměrně raritní onemocnění s neznámou etiologií, charakterizované chronickou periaortitidou a fibrózou retroperitonea se sekundárním postižením zejména urogenitálního ústrojí. Jako první popsal onemocnění na počátku století francouzský urolog Albarran [1]. Popis choroby jako samostatné klinické jednotky pochází z roku 1948 od Johna K. Ormonda [21]. Ve většině případů je fibrotický proces lokalizován kolem břišní aorty a aa. iliacae, ale v 15 % se klinická manifestace fibrózy projevuje mimo retroperitoneum. Podle histologické charakteristiky se pod tímto pojmem vyskytuje více nozologických jednotek - chronická periaortitida, zánětlivé aneuryzma břišní aorty a perianeuryzmální retroperitoneální fibróza. Nejčastější přidružená onemocnění jsou Riedelova fibrotizující tyroiditida, sklerotizující cholangoitida, mediastinální fibróza a fibrotické orbitální pseudotumory. Přibližně 2/3 případů retroperitoneální fibrózy je idiopatických, tzn že není zjištěna primární specifická příčina. V tomto případě je onemocnění označováno jako Ormondova choroba. U 1/3 pacientů nacházíme projevy fibrózy při primárním maligním onemocnění, infekci nebo iatrogenním působení léků [7,13,26]. Retroperitoneální fibróza vykazuje prevalenci l/200 000. U 70 % pacientů jsou první symptomy choroby zachyceny mezi 30. a 60. rokem věku, u idiopatické retroperitoneální fibrózy převažují muži v poměru 2 : 1.
Klinická symptomatologie se odvíjí od lokalizace zánětlivého procesu. Může to být postižení urogenitálního ústrojí, dolní duté žíly, břišní aorty a jejich větví. Může být přítomna obturace ureterů s možností následného poškození ledvin včetně renálního selhání. Při kompresi dolní duté žíly můžeme pozorovat edém dolních končetin, popřípadě hluboké tromboflebitidy. V pokročilém stadiu choroby může dojít až ke gangréně dolních končetin [16]. Zřídka nalézáme známky biliární obstrukce nebo portální hypertenze. Fibrotická tkáň může být také lokalizována atypicky a klinická symptomatologie svědčí pro infekci nebo onkologické onemocnění. Pacienti si stěžují na bolest v zádech, únavu, váhový úbytek. Laboratorní nálezy jsou nespecifické. Častá je anémie, vysoká FW a C-reaktivní protein, v případě pokročilého onemocnění jsou přítomny známky renálního postižení [25]. U žen mohou být fibrózou postiženy vaječníky.
V naší práci uvádíme 2 kazuistiky idiopatické retroperitoneální fibrózy, v jednom případě se jednalo o klinickou symptomatologii ne zcela typickou pro dané onemocnění.
Kazuistika 1
Pacientka, žena (1952) byla přijata pro operační řešení rychle rostoucího myomu, s hraničními ovariálními tumorózními markery a s podezřením na další tumor v malé pánvi. Při koloskopii nebylo možné proniknout dále než do 18 cm pro zúžení způsobené útlakem zvenčí. Při následné operaci byla provedena revize pelvis minoris et abdominis, resectio omenti subtotalis, resectio intestini tenui a terminální sigmoideostomie se slepým uzávěrem rekta (Hartmannova operace). Popis operačního nálezu: makroskopicky přední stěna břišní tumorózně infiltrovaná v šíři asi 3-4 cm, tuhá. V dutině břišní nádorový konvolut tvořený kličkami střevními a omentem. Histologické vyšetření: nádorové bujení nebylo zastiženo, přítomny různé typy zánětu od akutních po chronické fibroproduktivní. Laboratorní výsledky: FW 88/92, CRP 40 mg/l, Hb 120 g/l, erytrocyty 4,6 × 1012/l, leukocyty 7,9 × 109/l, trombocyty 409 × 109/l, elektroforéza bílkovin: albumin 0,51 g/l, α-1 globulin 0,04 arb. j., α-2 globulin 0,14 arb. j., β-globulin 0,12 arb. j., γ-globulin 0,19 arb. j., močovina, kreatinin, glukóza, kyselina močová, AST, ALT - vše v mezích normy, alkalická fosfatáza 4,16 mmol/l, IgA 5,63 g/l, IgG 18,1 g/l, IgM 2,98g/l, C3 1,77 g/l, C4 0,37 g/l, transferin 1,58 g/l, α-1-antitrypsin 2,41 g/l, orosomukoid 1,29 g/l, antinukleární protilátky, protilátky proti cytoplazmě neutrofilů (ANCA) a antimitochondriální protilátky negativní. CT břicha a malé pánve: játra a slezina nezvětšeny, bez ložiskových změn, žlučník a pankreas bez morfologických změn, retropankreatický prostor je volný. Ledviny v obvyklé poloze, nezvětšeny. Kalichopánvičkovitý systém je oboustranně rozšířen, uretery jsou v celém průběhu až do malé pánve široké. Je patrný stav po provedené kolostomii. V úrovni bikristální čáry je v podkoží hypodenzní ložisko široce nasedající na m. rectus abdominis, který je oboustranně nápadně ztluštěn. Těsně pod ním intraperitoneálně jsou pruhovité a ložiskové hypodenzní struktury zasahující k provedené kolostomii a mezi střevní kličky, které jsou zčásti nenaplněné. Denzní struktury vyplňují z větší části malou pánev, propagují se až ke zvětšené děloze a do paravezikulárního prostoru. Močový měchýř je částečně deformován a vysunut doleva. Na základě klinického a histologického nálezu byl stav uzavřen jako Ormondova choroba - idiopatická retroperitoneální fibróza (IRF) s atypickou lokalizací. Byla zahájena terapie prednizonem v dávce 60 mg s pomalou redukcí dávky. Při terapii došlo k postupné regresi fibrotických změn prokázané CT vyšetřením s normalizací laboratorních parametrů. 6 měsíců později při dávce 10 mg prednizonu chirurg zvažoval zrušení stomie. Došlo však k exacerbaci onemocnění se vzestupem FW, parametrů zánětu, s progresí fibrotických změn zasahující m. psoas a retroperitoneum. Proto byla zahájena kombinovaná imunosupresivní léčba v počáteční dávce 48 mg Medrolu a 100 mg Azamunu. Při této terapii došlo k regresi zánětlivých i fibrotických změn prakticky k normálnímu stavu. Dávka imunosupresiv byla redukována, po 16 měsících byl vysazen Azamun, ponechána dávka 4 mg Medrolu 2krát týdně, a byla provedena sigmoideorektoanastomóza se zrušením stomie. Peroperačně byly zjištěny nepatrné fibrotické projevy v břišní dutině a nevelké srůsty lehce rozrušitelné. Terapie Medrolem byla ukončena po dalších 4 měsících. Následné CT malé pánve po 2 měsících neprokázalo fibrotické změny v retroperitoneu. V současné době je pacientka bez terapie a subjektivních či objektivních obtíží.
Kazuistika 2
Pacient, muž (1962) byl poslán k urologickému vyšetření s podezřením na urolitiázu. Výsledek urologického vyšetření: před týdnem bolesti v oblasti lumbální páteře, které vystřelovaly do obou boků. Nefrogram bez patologického nálezu, sonografie: oboustranně bez známek městnání a přítomnosti konkrementu, sonografie močového měchýře bez patologického nálezu. Doporučena i.v. urografie. Intravenózní urografie: levá ledviny je zvětšená, po aplikaci kontrastní látky opacifikuje, dutý systém se nezobrazuje, močovod rovněž není patrný. Po 2 hod po aplikaci k.l. se dutý systém levé ledviny nezobrazuje. Následné CT vyšetření: afunkční levá ledvina se zavzetím pánevní části ureteru do infiltrátu v oblasti arteria a vena iliaca communis vlevo. Provedeno následně CT/PET vyšetření (obr. 1) se závěrem: ložisko hypermetabolizmu glukózy v nepravidelném infiltrátu parailicky vlevo může představovat retroperitoneální fibrózu, neoplazii nelze spolehlivě odlišit. Laboratoř: moč chemicky negativní, sediment bez patologického nálezu. Močovina, kreatinin, glykemie, ALT, AST - vše normální hodnoty. Imunologické nálezy: dysgamaglobulinemie se zvýšením IgA, atypický obraz fluorescence při průkazu anti-ds DNA protilátek, ANA a ANCA negativní. Biopsii tenkou jehlou nebylo možno provést pro nevhodnou lokalizaci zánětlivého procesu, nedostupnou pro perkutánní biopsii pod CT kontrolou. Urolog řešil akutní stav zavedením pig-tailu. Diagnóza stanovena jako idiopatická retroperitoneální fibróza - Ormondova choroba. Byla nasazena imunosupresivní terapie v kombinaci 40 mg Medrol a 2krát 50 mg Imuranu. Po 3 měsících terapie bylo provedeno kontrolní CT, kde byla konstatována obnovená plná funkčnost postižené ledviny. Imunosupresivní terapie byla postupně redukována s vysazením po 12 měsících. Kontrolní PET/CT prokazuje téměř normální nález v retroperitoneu (obr. 2). Chirurg odstranil pig-tail, pacient je v současné době ve stabilizovaném stavu bez imunosuprese, bez klinických projevů onemocnění.
1. PET/CT pacienta – kazuistika 2. Stav před léčbou. Vysoká akumulace FDG se promítá do hypodenzní masy v retroperitoneu. Masou prochází ureter, do kterého je zaveden ureterální stent. 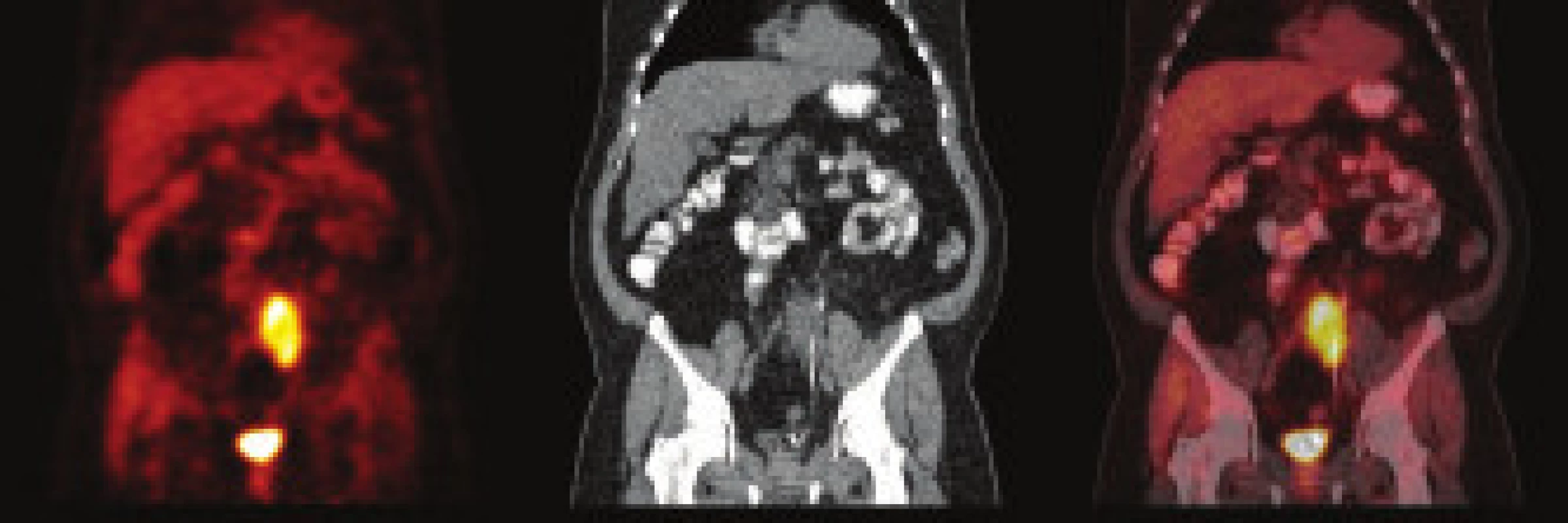
2. Kontrolní PET/CT pacienta – kazuistika 2. Za 12 měsíců po zahájení léčby je PET/CT obraz téměř normalizován. Retroperitoneální masa se významně zmenšila. Zbývá pouze nepatrný proužek parailicky vlevo, který již zvýšený metabolizmus glukózy nevykazuje. Ureterální cévka extrahována, spontánní odtok moči obnoven. 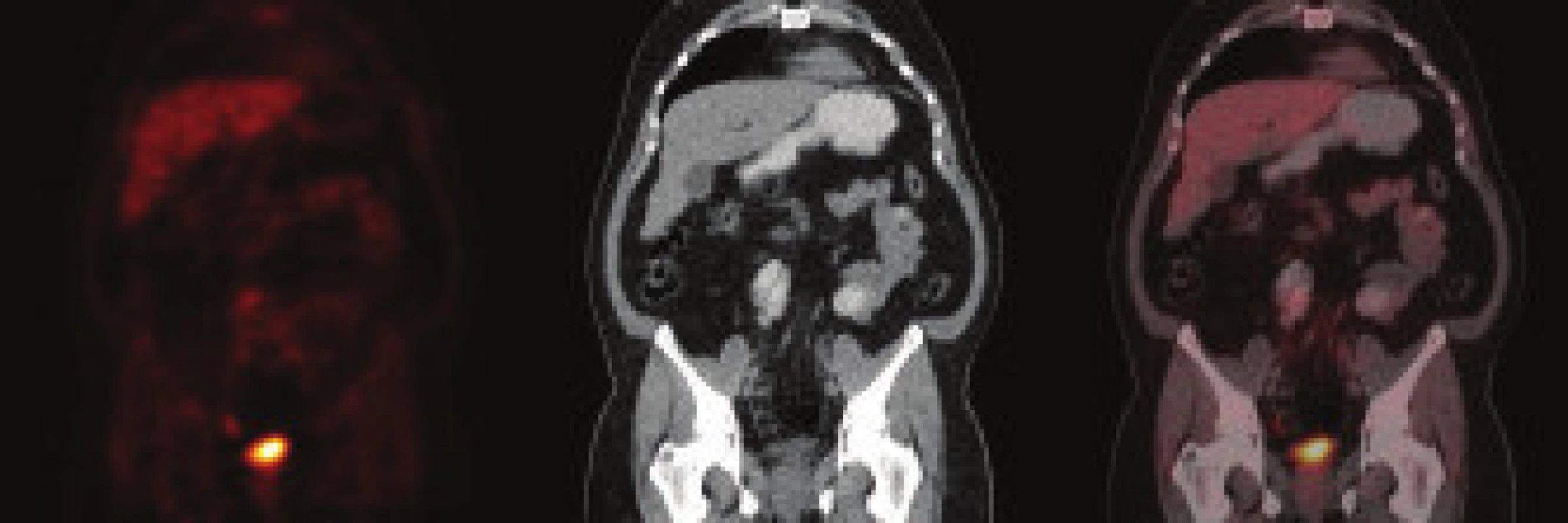
Diskuse
Idiopatická retroperitoneální fibróza je relativně vzácně se vyskytující onemocnění s nejasnou etiologií. Obecný konsenzus panuje v úvaze o IRF jako autoimunitním onemocnění. Nejčastěji uváděným autoantigenem je aterosklerotický plát [18,22]. K této úvaze vede charakteristická perivaskulární distribuce fibrózy a její histologická charakteristika, ve které jsou dominantní lymfocyty, plazmatické buňky, vzácněji eozinofily a žírné buňky [11]. Některé práce ale zpochybňují tento iniciační moment IRF [6]. Další přidružená onemocnění, jako je Riedelova tyroiditida, sklerotizující cholangoitida a orbitální pseudotumory, vedou k úvahám, že IRF je výrazem systémového onemocnění. Z hlediska patogeneze onemocnění je zajímavé nové zařazení idiopatické retroperitoneální fibrózy mezi tzv. hyper-IgG4 onemocnění [19]. Úloha nesprávné funkce imunitního systému se u tohoto onemocnění jeví jako nezpochybnitelná. Zánětlivě změněná tkáň cév stejně jako fibrotická tkáň jsou infiltrovány polyklonálními B-lymfocyty, CD4 pozitivními T-lymfocyty a plazmatickými buňkami. Většina lymfocytů, makrofágů a cévních endoteliálních buněk jsou v aktivovaném stavu - HLA-DR pozitivních. Také B-buňky a pomocné T-lymfocyty exprimují proliferační a aktivační markery - Ki67 a BerH2. V séru byly nalezeny protilátky proti ceroidu a low density lipoproteinu [22]. Genetické predispozice byly prokázány pouze v jedné menší studii, v níž autoři prokázali asociaci s HLA-DRB1 lokusem [25].
Klinická symptomatologie je v případě Ormondovy velice různorodá a nespecifická. Neexistuje specifický laboratorní parametr pro diagnostiku stejně jako pro úspěšně probíhající terapii. Klinické manifestace při primární a sekundární idiopatické fibróze se mohou překrývat. Jedním z lokálních příznaků jsou bolesti zad nebo břicha, které mají příčinu v mechanické kompresi orgánů fibrotickou masou. V případě pokročilého onemocnění při oboustranné ureterální obstrukci může dojít k rozvoji oligurie až anurie. Pro diagnózu onemocnění je nutné zdůraznit verifikaci pomocí biopsie, pokud je tuto možné provést. Z diferenciálně-diagnostického hlediska je nutné vyloučit sekundární typ onemocnění zejména při retroperitoneálních metastázách karcinomů prostaty, žaludku nebo střeva. Z hematologických onemocnění je nutné vyloučit Hodgkinův a non-Hodgkinův lymfom. Pokud biopsie pod CT nevede k jednoznačné verifikaci a existují klinické pochybnosti o povaze onemocnění, je nutné provést operační revizi s odběrem reprezentativního vzorku k histologické verifikaci. Z hlediska laboratorních parametrů je onemocnění charakterizováno pozitivitou zánětlivých markerů - FW a pozitivitou C-reaktivního proteinu. Tyto parametry jsou ovšem nespecifické. Někdy bývají pozitivní orgánově nespecifické autoprotilátky, revmatoidní faktor, protilátky proti dvouvláknové DNA [27].
Rozdílné názory jsou k úloze zobrazovacích metod v diagnostice onemocnění. U IRF - klinické, radiologické i mikroskopické nálezy, pokud jsou vyšetřeny a vyhodnoceny nezávisle na sobě, nejsou pro onemocnění specifické. Histologické vyšetření bioptického vzorku s použitím tenké jehly je možné, ale jeho provedení je někdy problematické až nemožné, jak tomu bylo i ve dvou našich případech. Významně senzitivní jsou zobrazovací metody - CT nebo magnetická rezonance [3,5,17]. Hybridní metoda PET/CT umožňuje zobrazení metabolických změn tkáně (PET) spolu s jejich přesnou anatomickou lokalizací a morfologickou specifikací na podkladě současně provedeného CT. 18F-fluorodeoxyglukóza je radiofarmakon hromadící se ve tkáni se zvýšeným metabolizmem glukózy, který je vykazují akutní záněty a většina maligních nádorů. Hromadění FDG je tedy nespecifické, jeho pokladem může být jak zánět tak nádor, a ložiska vysoké akumulace FDG na PET scanu je proto vhodné korelovat s morfologicko-anatomickým obrazem. Morfologické změny stěny cévní v CT obraze, jako jsou její zesílení, nehomogenita a tekutinové kolekce v okolí cév, jsou obrazem mnoha etiologických jednotek včetně zánětu a nejsou dostatečně specifické v odlišení akutních zánětlivých změn, chronických zánětlivých změn a fibrózy. Hybridní FDG PET/CT využívá výhod obou uvedených metod a zvyšuje senzitivitu i specificitu samostatně prováděného PET vyšetření a CT vyšetření. Další výhodou FDG PET/CT je standardní snímání pacienta v rozsahu od baze lební po horní polovinu stehen, které umožňuje zobrazit rozsah patologických změn v těle. Novou vyšetřovací modalitou je FGD PET/CT v diagnostice vaskulitid. Její přesná úloha ve vyhledávání vaskulitid je předmětem probíhajících studií. Již dnes je ale zřejmé, že u prokázaných vaskulitid je vhodnou metodou ke sledování odpovědi na léčbu na podkladě změn metabolizmu glukózy, které většinou předcházejí změny v obraze morfologickém [12,28].
Naši sestavu pacientů jsme uvedli z následujících důvodů: podobně jako v práci Radoňaka et al [24] jsme v prvním případě diagnostikovali neobvykle lokalizovanou formu retroperitoneální fibrózy. U první pacientky nebyla typická lokalizace hlavních fibrotických změn. Nedominovalo postižení urogenitálního ústrojí, ale novotvorbou vaziva byla postižena hlavně malá pánev včetně tlustého střeva. Dominantní tak byla fibróza intraperitoneální, ale zajímavé byly také některé laboratorní nálezy při exacerbaci onemocnění. Polyklonální hypergamaglobulinemie, která není obvyklým nálezem při IRF, není v kontextu uvažované autoimunitní etiopatogeneze tak překvapivá. Po celou dobu sledování byla vyšetření na přítomnost antinukleárních protilátek negativní a remise onemocnění byla provázena normalizací hypergamaglobulinemie.
Idiopatická retroperitoneální fibróza se často sdružuje s termínem chronická periaortitida. Tato nozologická jednotka popisuje skupinu zánětlivého postižení aorty v rámci několika onemocnění - idiopatické retroperitoneální fibrózy, zánětlivého aneuryzmatu břišní aorty a perianeuryzmální retroperitoneální fibrózy. Zatímco histologické nálezy jsou podobné ve všech 3 případech - adventiciální a periadventiciální zánět, ztluštění medie cév a pokročilá ateroskleróza, postižení samotné aorty je v těchto případech rozdílné. U idiopatické retroperitoneální fibrózy aorta není dilatována a není obligatorní výskyt fibrotického vaziva postihující další orgány. V případě zánětlivého aneuryzmatu břišní aorty je tato dilatována při nepřítomnosti její obstrukce. Perianeuryzmální retroperitoneální fibróza se manifestuje dilatací aorty a přítomností fibrotického procesu postihující přiléhající orgány - např. močovody. Je otázkou, nakolik jsou uvedené klinické manifestace známkou rozdílných nozologických jednotek. Nicméně zkušenosti studií retroperitoneální fibrózy z posledního desetiletí, asociace této jednotky s dalšími autoimunitními onemocněními svědčí spíše pro definici IRF jako systémového autoimunitního onemocnění. Při diagnostice onemocnění jsme učinili velice pozitivní zkušenost s použitím PET/CT. Druhý pacient představoval z hlediska klinické manifestace „typický příklad“. V rámci diagnostiky určitou komplikaci představovala nemožnost provést biopsii tenkou jehlou, která může přispět k definitivnímu stanovení diagnózy. Z hlediska terapeutického je nutné zdůraznit nutnost chirurgického řešení ureterální obstrukce, které bylo provedeno i u našeho pacienta. Chirurgická intervence je obligatorní ve všech případech Ormondovy choroby s rozvojem hydronefrózy. V našem případě se díky této terapeutické intervenci společně s agresivní imunosupresivní terapií podařilo zachránit funkčnost postižené ledviny.
V terapii IRF je obvyklá kombinace chirurgické a imunosupresivní léčby [8,9,20,23,29]. V současné době ale není definován obligatorní postup při uplatňované imunosupresivní terapii. Obvyklé je zahájení útočnou dávkou v monoterapii kortikosteroidy (1 mg/kg) nebo v kombinaci s jinými typy imunosupresiv - azatioprinu nebo cyklofosfamidu. Délka podání imunosuprese je různá, ale není výjimkou podání delší než 1 rok. Jednotlivé kazuistiky popisují použití mykofenolátu mofetilu nebo tamoxifenu [2,10]. Je nutné zdůraznit nutnost dlouhodobého sledování pacientů z důvodu možné rekurence onemocnění. Chybí relevantní studie s dostatečně dlouhodobým sledováním pacientů, nicméně je popisován relaps onemocnění u téměř 1/2 pacientů, kteří podstoupili pouze chirurgickou léčbu a přibližně u 10 % pacientů léčených steroidy [4,15]. Kombinaci imunosupresivní terapie jsme uplatnili u obou našich pacientů. U první pacientky monoterapie kortikosteroidy nebyla úspěšná a při snížení dávky došlo k exacerbaci onemocnění. Následovala kombinovaná imunosupresivní terapie s použitím prednizonu v kombinaci s azatioprinem. Tento způsob léčby již byl efektivní. Ve druhém případě byla použita kombinace chirurgické a imunosupresivní terapie. Vzhledem k rozsahu postižení jsme zvolili od počátku kombinovanou imunosupresi. Vedlejším účinkem imunosupresivní terapie u druhého pacienta bylo navození přechodné hypogamaglobulinemie (IgG mezi 5-6 g/l), která se po vysazení imunosuprese normalizovala.
Závěr
Idiopatická retroperitoneální fibróza je onemocnění s postižením zejména urogenitálního ústrojí, může se však také projevit v atypických lokalizacích. V diagnostice onemocnění se uplatňují nové možnosti zobrazovacích metod (PET/CT). Efektivní je kombinace chirurgické a imunosupresivní terapie. Při neúspěchu monoterapie kortikosteroidy je metodou volby kombinace s azatioprinem.
MUDr. Miroslav Průcha, Ph.D.
www.homolka.cz
e-mail: miroslav.prucha@homolka.cz
Doručeno do redakce: 12. 11. 2007
Přijato po recenzi: 31. 12. 2007
Sources
1. Albarran J. Retention renale per peri-ureterite: liberation externe de l’uretere. Assoc Fr Urol 1905; 9 : 511-517.
2. Al Musavi D, Mitchenere P, Al-Akraa M. Idiopathic retroperitoneal fibrosis treated with tamoxifen only. Br J Urol 1998; 82 : 442-443.
3. Bachmann G, Bauer T, Rau WS. MRT und CT in Diagnose und Verlaufskontrolle der idiopathischen (retroperitonealen) Fibrosen. Radiologie 1995; 35 : 200-207.
4. Baker LRI, Mallinson WJW, Gregory MC et al. Idiopathic retroperitoneal fibrosis: a retrospective analysis of 60 cases. Br J Urol 1988; 60 : 497-503.
5. Bangard C, Lotz J, Rosenthal H et al. Erdheim-Chester disease versus multifocal fibrosis and Ormond´s disease: a diagnostic dilemma. Clinical Radiology 2004; 59 : 1136-1141.
6. Breems DA, Haye H, van der Meulen J The role of advanced atherosclerosis in idiopathic retroperitoneal fibrosis. Analysis of nine cases. Neth J Med 2000; 56 : 38-44.
7. Brooks MT, Magill HL, Hanna SL et al. Pediatric case of a day idiopathic retroperitoneal fibrosis. Radio Graphics 1990; 10 : 1096-1100.
8. Cogan E, Fastrez R. Azathioprine an alternative treatment for recurrent idiopathic retroperitoneal fibrosis. Arch Intern Med 1985; 145 : 753-755.
9. Dvořáček J. The problem of retroperitoneal fibrosis. Rozhl Chir 1975; 54 : 467-471.
10. Grotz W, von Zedtwitz I, Andre M et al. Treatment of retroperitoneal fibrosis by mycophenolate mofetil and corticosteroids. Lancet 1998; 352 : 1195.
11. Hughes D, Buckley J. Idiopathic retroperitoneal fibrosis is a macrophage - rich process. Implications for its pathogenesis and treatment. Am J Surg Pathol 1993; 17 : 482-490.
12. Jarůšková M, Bělohlávek O. Role of FDG-PET and PET/CT in the diagnosis of prolonged febrile states. Eur J Nucl Med 2006; 33 : 1-6.
13. Koep L, Zuidema GD. The clinical significance of retroperitoneal fibrosis. Surgery 1977; 81 : 250-257.
14. Lepor H, Walsh PC. Idiopathic retroperitoneal fibrosis. J Urol 1979; 122 : 1-6.
15. Marcolongo R, Tavolini IM, Laveder F et al. Immunosuppressive therapy for idiopathic retroperitoneal fibrosis: a retrospective analysis of 26 cases. Am J Med 2004; 116 : 194-197.
16. Mathew CV, Shanabo A, Zyka I et al. Retroperitoneal fibrosis with large vessel obstruction, an uncommon vascular disorder. Acta Chirurg Scand 1985; 151 : 475-480.
17. Miniberger M, Kašpar M, Drechslerová J et al. Ormondův syndrom (Syndrom retroperitoneální fibrózy). Diagnostické obtíže u necharakteristické formy onemocnění při vyšetření výpočetní tomografií. Čes Radiol 1998; 4 : 214-220.
18. Menke DM, Griesse H, Araujo I et al. Inflammatory pseudo-tumors of lymph node origin show macrophage-derived spindle cells and lymphocyte-derived cytokines transcripts without evidence of T cell receptor gene rearrangements. Implications for pathogenesis and classification as an idiopathic retroperitoneal fibrosis-like sclerosing immune reaction. Am J Clin Pathol 1996; 105 : 430-439.
19. Neild GH, Justo MR, Wall C et al. Hyper-IgG4 disease: report and characterisation of a new disease. BMC Medicine 2006, 4 : 10.1186/741-7015/4/23.
20. Novák I, Morávek P, Baše J et al. Dlouhodobé výsledky léčby nemocných s retroperitoneální fibrózou. Rozhl Chir 1994; 6 : 287-290.
21. Ormond JK. Bilateral ureteral obstruction due to envelopment and compression by an inflammatory retroperitoneal process. J Urol 1948; 59 : 1072-1079.
22. Parums DV, Brown DL, Mitchinson MJ. Serum antibodies to oxidized low density lipoprotein and ceroid in chronic periaortitis. Arch Pathol Lab Med1990; 114 : 383-387.
23. Piegsa M, Fiegel P. Retroperitonealfibrose. Dtsch Med Wschr1993; 118 : 1759-1764.
24. Radoňak J, Vajó J, Toner I et al. Neobvyklá lokalizovaná forma retroperitoneálnej fibrózy. Rozhledy v chirurgii 1999; 78 : 378-380.
25. Rasmussen TE, Hallet JW, Metzger RL et al. Genetic risk factors in inflammatory abdominal aortic aneurysma: polymorphic residue 70 in the HLA-DR B1 gene as a key genetic element. J Vasc Surg 1997; 25 : 356-364.
26. Srinivas V, Dow D. Retroperitoneal fibrosis. Can J Surg 1984; 27 : 111-117.
27. Vaglio A, Corradi D, Maneti L et al. Evidence of autoimmunity in chronic periaortitis: a prospective study. Am J Med 2003; 114 : 454-462.
28. Votrubová J, Fencl P. Hybridní zobrazování PET/CT. Čes Radiol 2004; 56 : 333-337.
29. Warnatz K, Keskin AG, Uhl M et al. Immunosuppressive treatment of chronic periaortitis: a retrospective study of 20 patients with chronic periaortitis and a review of the literature. Ann Rheum Dis 2005; 64 : 828-833.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 3-
All articles in this issue
- Raloxifene in clinical practice. Results of non-interventional study CORAL (COmpliance with RALoxifene)
- The influence of rehabilitation on peak oxygen consumption in patients after myocardial infarction treated with beta-blockers
- Macrovascular and microvascular complications in type 2 diabetes patients
- Treatment of IgA nephropathy
- The options for preserving reproductive functions in women undergoing cytostatic therapy
- Glycated haemoglobin - is it its exclusive position in diabetology under threat?
- Von Willebrand disease
- Laboratory diagnostics of pleural effusion
- SIADH as only paraneoplastic cause of the small cell lung cancer: case report
- Purtscher-like retinopathy - a rare complication of acute pancreatitis
- Idiopathic retroperitoneal fibrosis - Ormond’s disease
- Reminiscences on the occasion of the Whipple’s disease centenary: a summary paper
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Idiopathic retroperitoneal fibrosis - Ormond’s disease
- Von Willebrand disease
- SIADH as only paraneoplastic cause of the small cell lung cancer: case report
- Treatment of IgA nephropathy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

