-
Medical journals
- Career
ZAP-70 u chronické B-lymfocytární leukemie: klinický význam a metody detekce
Authors: L. Smolej 1; L. Saudková 2; M. Špaček 2; T. Kozák 2
Authors‘ workplace: Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 1; Oddělení klinické hematologie 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta doc. MUDr. Tomáš Kozák, Ph. D. 2
Published in: Vnitř Lék 2006; 52(12): 1194-1199
Category: Review
Overview
Chronická B-lymfocytární leukmie (B-CLL) je heterogenní onemocnění s vysoce variabilní prognózou. Na základě systémů klinického stagingu (Rai, Binet) nelze přesně předpovědět prognózu jednotlivých pacientů zejména v časných stadiích tohoto onemocnění. Přesnější stratifikaci umožňují moderní prognostické ukazatele, zejména stanovení mutačního stavu pro variabilní části těžkých řetězců imunoglobulinů (IgVH) a cytogenetické aberace. Stanovení exprese nitrobuněčné tyrozinkinázy ZAP-70 představuje nejen možný zástupný ukazatel technicky náročného a rutinně nedostupného stanovení mutačního stavu IgVH, ale má význam i jako nezávislý ukazatel prognózy. Studium funkce ZAP-70 u B-lymfocytů významně posunuje naše znalosti o patogenezi B-CLL. Běžnému využití stanovení exprese ZAP-70 brání dosud nedostatečná harmonizace a validace jednotlivých kvantifikačních metod.
Klíčová slova:
chronická B-lymfocytární leukemie - ZAP-70 - průtoková cytometrie - imunohistochemie - Western blotting - PCR - metylační stavÚvod
Chronická B-lymfocytární leukemie (B-CLL), nejčastější leukemické onemocnění západního světa, je charakterizována akumulací maligních lymfocytů s typickým imunofenotypem (CD5+/19+/23+) v kostní dřeni, periferní krvi a dalších složkách lymfatického systému [1,2]. Zeta-asociovaný protein o molekulární hmotnosti 70 kilodaltonů (ZAP-70) je v současné době jednou z nejvíce zkoumaných molekul u této lymfoproliferace. ZAP-70 je v různé míře exprimován u subtypů B-CLL lišících se procentem hypermutací variabilní části pro těžký řetězec imunoglobulinu, tzv. mutačním stavem IgVH. Nemocní, jejichž IgVH geny se liší od sekvence odpovídající zárodečné linie o více než 2 % (tzv. mutované IgVH geny), mají výrazně lepší prognózu než pacienti s nemutovanými IgVH; v průkopnické práci Hamblina et al byl zjištěn medián celkového přežití 293 měsíců pro pacienty s mutovanými vs 117 měsíců pro nemocné s nemutovanými IgVH geny [3]. Stanovení mutačního stavu IgVH je technologicky, časově a finančně náročné a v současné době není použitelné v běžných laboratořích, neboť vyžaduje náročné zpracování materiálů včetně dvou polymerázových řetězových reakcí (PCR), izolace PCR produktů, jejich sekvenování atd. Proto se záhy po objevu důležitosti mutačního stavu IgVH začaly hledat zástupné ukazatele, které by jednak byly technicky a finančně dostupnější, ale zároveň umožnily nahradit stanovení mutačního stavu IgVH. ZAP-70 byl posléze identifikován na základě studií používajících stanovení profilu genové exprese metodou DNA mikročipů (microarrays) jako jeden z několika set genů, jejichž exprese vysoce koreluje s nemutovanými IgVH geny [4,5]. Jak se však později ukázalo ve studiích porovnávajících tyto dva parametry, existují nemocní s diskordancí mezi IgVH stavem a ZAP-70 [4]. Navíc analýza ZAP-70 přinesla určité metodické problémy, o kterých bude pojednáno v dalších částech článku. Stanovení mutačního stavu IgVH se také od roku 1999 stalo dostupnějším a vyšetření ZAP-70 je tedy nyní pokládáno za parametr spíše významným způsobem doplňující než nahrazující mutační stav IgVH.
Výskyt a funkce ZAP-70
Gen pro ZAP-70 je umístěn na dlouhém rameni 2. chromozomu a kóduje tyrozinkinázu složenou ze 3 funkčních jednotek [5]. Tato molekula je za normálních okolností exprimována T-lymfocyty a NK-buňkami [6]. Dříve se soudilo, že normální B-lymfocyty ZAP-70 neexprimují, používají totiž homologickou tyrozinkinázu Syk. Recentní studie však zjistily expresi ZAP-70 i normálními B-lymfocyty v tonzilách, slezině i periferní a pupečníkové krvi [7,28]. Za normálních okolností je ZAP-70 aktivován zeta podjednotkou T-lymfocytárního receptoru a fosforylací intermediárních proteinů (LAT, SLP-76, fosfolipáza-C γ a Vav-1) vede k aktivaci signálních drah včetně mitogenem aktivovaných protein kináz (MAPK) a fosfatidylinositol-3-kinázy (PI3K). Tyto signální dráhy jsou nezbytné k aktivaci T-lymfocytů. Kromě důležitého podílu na signálních drahách využívajících T-lymfocytární receptor je ZAP-70 potřebný pro správnou funkci chemokinu CXCL12 (významný chemoatraktant pro T-lymfocyty). U B-CLL pravděpodobně ZAP-70 zesiluje signální dráhy zprostředkované receptorem B-lymfocytů, což je proces přispívající k horší prognóze ZAP-70 pozitivních pacientů. Obdobně jako u T-lymfocytů má ZAP-70 význam pro chemokinovou stimulaci buněk B-CLL. Předpokládá se, že exprese ZAP-70 by mohla vést k migraci leukemických buněk do mikroprostředí výhodného pro přežití či proliferaci [8].
Metody stanovení ZAP-70
Průtoková cytometrie
Přes řadu úskalí představuje průtoková cytometrie v současné době nejčastěji užívanou metodu stanovení exprese ZAP-70. Jejími výhodami oproti ostatním metodám je velmi dobrá dostupnost, relativní snadnost a časová nenáročnost. Navíc pro ni není třeba separovaných B-lymfocytů a výsledek není ovlivněn mírou kontaminace T-lymfocyty ve vzorku (T-lymfocyty jsou identifikovány specifickými povrchovými protilátkami). Hlavní a dosud zásadní nevýhodu přestavuje absence jednotně užívané, standardizované metodiky, jejíž výsledky by byly vzájemně dobře porovnatelné. Ačkoliv většina prací (přehled metod - tab. 1) vychází ze separovaných mononukleárních buněk periferní krve, pomocí sekvenčního gatingu není problémem zpracování plné lyzované krve. V současné době je k dispozici málo dat o imunofenotypizačním stanovení exprese ZAP-70 na B-lymfocytech kostní dřeně a lymfatických uzlin od pacientů s B-CLL, nicméně na základě výsledků dosud publikovaných prací lze předpokládat, že míra exprese ZAP-70 je na populaci leukemických buněk uniformní [9,10]. Exprese ZAP-70 se jeví jako časově stálá [9-12] a oproti čerstvě získaným vzorkům se významně neliší při použití zamražených mononukleárních buněk [9,10]. Obecně je doporučováno časné zpracování vzorku (tentýž den, optimálně do 8 hodin od odběru, ev. časně po rozmražení), v práci Orchard et al [13] byla při sekvenčním měření 12 vzorků během 3 dnů zaznamenána změna ZAP pozitivity/negativity ve 3 případech. Ve dříve publikovaných studiích [10-12] bylo využíváno nekonjugované protilátky (klon 2F3.2 firmy Upstate), vyžadující ve druhém kroku konjugaci s fluorescenčně značenou sekundární protilátkou. Studie Rassenti et al [9] užívala přímé fluorescence pomocí protilátky značené Alexa Fluor 488 (klon 1E7.2 firmy Caltag). Při použití komerčního kitu pro fixaci a permeabilizaci vzorku bylo dosaženo v práci Gibbse et al [14] porovnávající různé postupy přípravy vzorku senzitivity 90 % a specificity 91,3 %. Protilátka téhož klonu značená fykoerytrinem (Caltag) je rovněž k dispozici, dosud však nebyly publikovány výsledky prací popisující její aplikaci. Jorgensen et al [15] s úspěchem použili novou přímou protilátku firmy Becton a Dickinson (J13-1164 PE). Lze shrnout, že při použití jednotlivých typů protilátek je (při užití obdobné metody gatingu) dosahováno srovnatelných výsledků, použití kitů pro permeabilizaci zvyšovalo dle práce Gibbse et al [14] specificitu metody. Klíčovým problémem a překážkou standardizace je ale především volba strategie gatingu, pozitivní a negativní kontroly a určení hranice pro pozitivitu ZAP-70 na B-lymfocytech, resp. B-CLL buňkách [8]. Všechny metody narážejí na překážku relativně nízké intenzity exprese ZAP-70 na buňkách B-CLL v porovnání s T - a NK-buňkami [8]. Hranice pro pozitivitu je volena dle statisticky zjištěné hodnoty nejlépe korelující s mutačním stavem IgVH [9-11,13] nebo s výsledky citlivějších metod [10]. Nejčastěji užívanou hodnotou je 20 % pozitivních B-lymfocytů. Protože se ale populace B-CLL buněk s ohledem na expresi ZAP-70 zdá být homogenní, je umísťování markeru positivity (ať už podle jakéhokoliv kritéria) arbitrární. Možné východisko představuje vyjádření exprese ZAP-70 B-lymfocyty dle střední intenzity fluorescence (MFI) celé populace, respektive jako poměr MFI T-lymfocytů/B-CLL buněk, B-CLL buněk/normálních B-lymfocytů, ev. B-CLL buněk/izotypové negativní kontroly. Poměrné vyjádření exprese ZAP-70 korelovalo ve studii Letestu et al [16] v porovnání s procentuálním vyjádřením lépe s výsledky real-time kvantitativní PCR a dle Orchard et al [13] vykazuje nižší variabilitu při hodnocení více pozorovateli. Alternativu přestavuje rovněž metoda kvantitativní cytometrie (vyjádření množství ZAP-70 v CLL buňkách dle kalibrační křivky jako množství molekul ekvivalentního rozpustného fluorochromu - MESF) [17]. Přes technické nesnáze provázející imunofenotypizační stanovení exprese ZAP-70 má tato metoda perspektivu zavedení do rutinního vyšetření pacientů s B-CLL především pro svoji dostupnost. Poměrné vyjádření exprese ZAP-70 pomocí MFI redukuje subjektivní variabilitu při hodnocení a pravděpodobně umožní srovnávat výsledky více laboratoří. Ke standardizaci metody bude zapotřebí více studií využívajících několika metod k verifikaci výsledku průtokové cytometrie.
Table 1. Přístupy použité v hlavních studiích [7–10,12] věnovaných stanovení exprese ZAP-70 průtokovou cytometrií. ![Přístupy použité v hlavních studiích [7–10,12] věnovaných stanovení exprese ZAP-70 průtokovou cytometrií.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3aad6b2d55a2acd57124b392d4d1962e.jpg)
FC – průtoková cytometrie, bb – buňky, PBMC – mononukleární buňky z periferní krve * Komparativní studie, testovány různé protilátky, metody permeabilizace a fixace, různé hranice pozitivity. Optimální senzitivitu a specificitu detekce poskytovala kombinace anti-ZAP-70 Alexa 488 (Caltag) a Fix and Perm kitu při cut-off 20 %. Image 1. a–b. Imunofenotypizační vyšetření periferní krve u B-CLL s pozitivní expresí ZAP-70 na B-lymfocytech. Trojbarevné značení: ZAP-70-Alexa 488, CD3-PE, CD19-PC5. 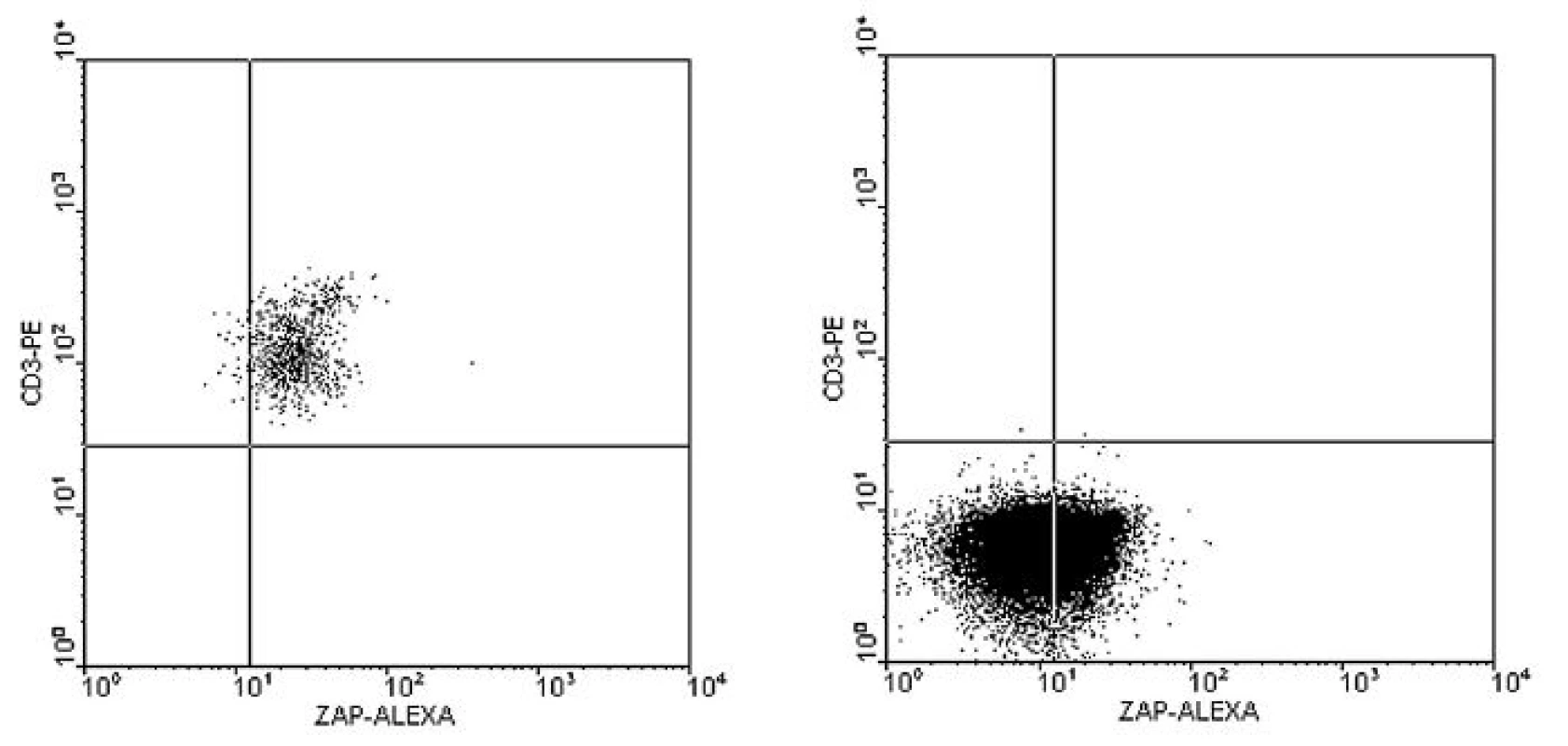
Obr. 1a. Pozitivní kontrola, určení hranice pozitivity dle pozice T-lymfocytů. ZAP-70 = 96,4 % v gate na CD3+ (sekvenční gating, nezobrazeno) Obr. 1b. Pozitivní exprese ZAP-70 na B-lymfocytech. ZAP-70 = 37 % v gate na CD19+3– (sekvenční gating, nezobrazeno) Image 2. a–b. Imunofenotypizační vyšetření periferní krve u B-CLL s negativitou exprese ZAP-70 na B-lymfocytech. 3-barevné značení (obr. 1). 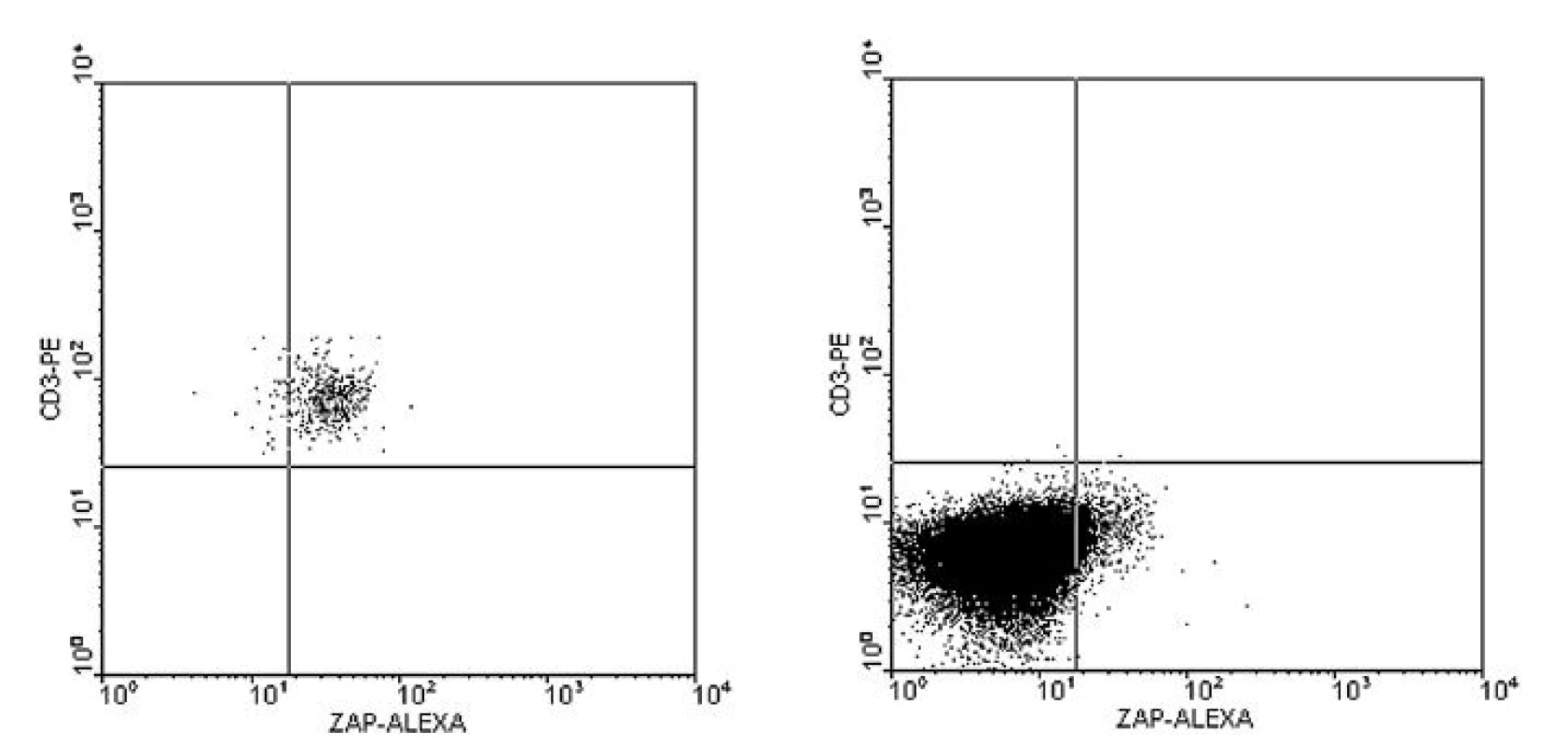
Obr. 2a. Pozitivní kontrola, určení hranice pozitivity viz obr. 1. Obr. 2b. Negativní exprese ZAP-70 na B-lymfocytech. ZAP-70 = 6,6 % CD 19+3– (sekvenční gating, nezobrazeno). Image 3. a–b. Imunohistochemická detekce ZAP-70 v preparátu z exstirpované lymfatické uzliny u nemocného s B-CLL. Použita monoklonální protilátka anti-ZAP-70 (klon 2F3.2, Upstate), vizualizace pomocí LSAB2 kitu (DakoCytomation). 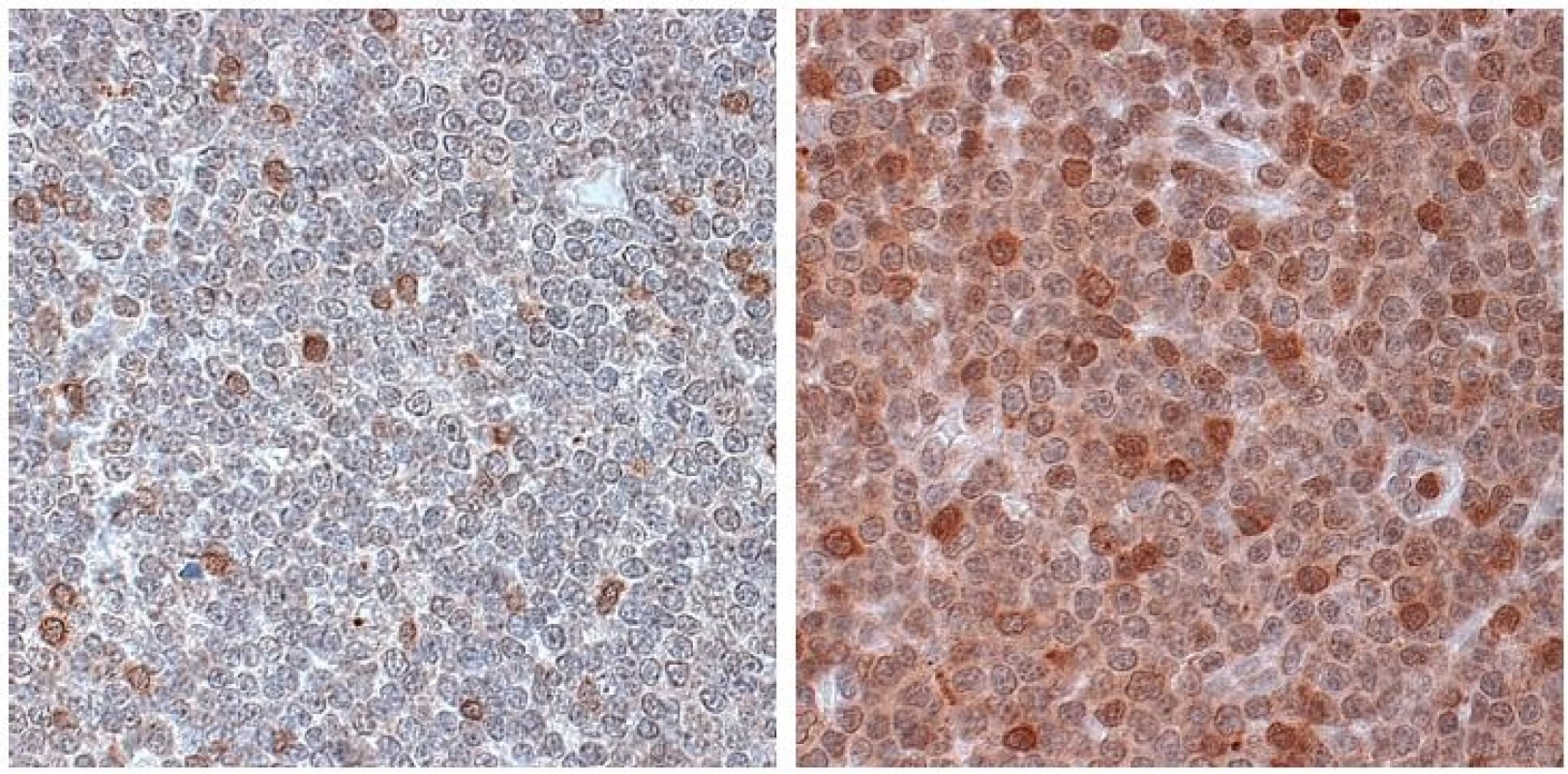
Obr. 3a. ZAP-70 negativní vzorek (pozitivní pouze rozptýlené T-lymfocyty, sloužící jako vnitřní kontrola) Obr. 3b. ZAP-70 pozitivní vzorek (nejsilněji jsou zbarvené T-lymfocyty) Imunohistochemie
Imunohistochemie (IHC), jako dobře zavedená metoda v hematopatologii, byla využita v několika studiích i k detekci ZAP-70 v bioptickém materiálu [4,11,18-22]. Přes technické problémy některých autorů se značením biopsií kostní dřeně [18,20] představuje IHC analýza efektivní metodu stanovení exprese ZAP-70 u CLL i u jiných B-lymfoproliferativních onemocnění [18-21]. Při použití metod demaskování antigenu ji lze použít na běžně fixovaných a v parafínu zalitých preparátech. Výhodou je standardní silná ZAP-70 pozitivita T-buněk, které tak slouží jako vnitřní kontrola. Vener et al [22] s dosud nejpřesněji publikovaným popisem IHC detekce ZAP-70 hodnotil vzorek jako ZAP-70 pozitivní, pokud se značilo více než 20 % nádorových buněk (v 98 % případů hodnocených jako pozitivní bylo více než 80 % buněk pozitivních). Pozitivní případy dále dělil na slabě pozitivní (s intenzitou značení slabší než u vnitřní kontroly) a silně pozitivní (s intenzitou téměř shodnou s vnitřní kontrolou). V práci Wiestnera et al [4] se v 86 % případů (37 ze 43) shodoval stav mutace IgVH s IHC značením ZAP-70, další autoři s menšími soubory dosáhli stejné [19] či vyšší korelace [11,18]. Při porovnání IHC detekce ZAP-70 s analýzou průtokovou cytometrií dospěl Carreras et al [20] ke shodě v 92 % případů (48 z 52). Recentní data [20] získaná dlouhodobým sledováním 108 pacientů ukazují, že ZAP-70 imunoreaktivita je spolehlivým prognostickým markerem u B-CLL, a že ZAP-70 pozitivita silně koreluje s dobou do zahájení terapie, krátkým zdvojovacím časem lymfocytů, abnormálním karyotypem, vyššími klinickými stádii dle Raie a dle Bineta i dalšími prognosticky závažnými parametry, a to i v závislosti na stupni pozitivity. IHC detekci exprese ZAP-70 tak lze užít v době diagnózy B-CLL k identifikaci pacientů s různou prognózou a k predikci nutnosti terapie při vyšším riziku časné progrese nemoci. Mezi hlavní výhody IHC obecně patří její dostupnost a jednoduchost, přičemž oproti jiným metodám stanovení ZAP-70 navíc odpadá nutnost purifikace B-buněk (PCR, Western blot) i potřeba dostupnosti čerstvých či zmražených vzorků (průtoková cytometrie). Velkou předností je potom možnost jejího využití v archivních materiálech. Z uvedených důvodů lze doporučit IHC jako alternativní metodu stanovení ZAP-70 u pacientů s B-CLL při nedostupnosti jiných vzorků nebo v retrospektivních studiích.
Western blotting
Ve studiích, které užily ke stanovení exprese ZAP-70 i Western blotting, se prokázala dobrá korelace s detekcí pomocí PCR či imunohistochemie [4,9,11]. Hlavní nevýhodou této metody je podobně jako u PCR citlivost ke kontaminaci T-buňkami. Crespo et al [11] uvádí ovlivnění výsledků již při přítomnosti 2 % T-buněk, ačkoli jiná práce [23] ukázala únosné množství T-buněk mnohem vyšší (33 %), ale pro odlišné rozvržení experimentu není tento výsledek zcela relevantní. Jako v případě PCR je tedy nutné použít separaci B-buněk, ale navíc je u Western blotu potřeba relativně velké množství studovaného materiálu. Sama metoda patří laboratorně spíše k náročnějším, a proto lze očekávat, že v běžné praxi by se alternativou k průtokové cytometrii mohla stát čím dál dostupnější PCR, a že Western blot se uplatní spíše jako ověřující metoda více ve výzkumných aktivitách.
Stanovení ZAP-70 mRNA
Stanovení informační RNA (mRNA) pro ZAP-70 pomocí polymerázové řetězové reakce (PCR) je ve srovnání s imunohistochemií či Western blotem citlivější a přesnější, je však technologicky a finančně náročnější a podobně jako Western blotting vyžaduje pečlivou selekci B-CLL buněk, aby nedošlo ke zkreslení výsledků kontaminací T-lymfocyty. Dürig et al [12] v retrospektivní studii použili semikvantitativní RT-PCR s reverzní transkriptázou (RT-PCR) magneticky separovaných B-CLL buněk od 39 pacientů. Nemocní s pozitivitou ZAP-70 měli významně kratší dobu do progrese než ZAP-70 negativní pacienti. Dosud byly publikovány dvě studie, které využily modernější a citlivější metodiku - kvantitativní real-time PCR (RQ-PCR). Wiestner et al [4] takto testoval expresi ZAP-70 u 29 nemocných s B-CLL. Buňky B-CLL byly purifikovány pomocí imunomagnetické separace protilátkou anti-CD19. Byla zjištěna vynikající korelace s výsledky získanými pomocí DNA mikročipů. V práci Catherwooda et al [24] byla stejnou metodikou měřena exprese mRNA pro ZAP-70 u 42 nemocných. Pouze 3/42 vzorků vykazovaly diskordanci mezi mutačním stavem IgVH a expresí ZAP-70. Laurenti et al [25] studovali pomocí kvantitativní RT-PCR poměr exprese mRNA pro ZAP-70 a Syk v purifikovaných buňkách 93 nemocných. Exprese Syk byla použita jako vnitřní standard. Vysoká exprese ZAP-70, definovaná jako poměr ZAP/Syk < 0,25 byla pozorována zejména u nemocných s nemutovanými IgVH geny a krátkým obdobím bez terapie. Naopak nebyl zjištěn žádný rozdíl v době do léčby u nemocných se střední (poměr ZAP/Syk = 0,05 - 0,25) a nízkou (ZAP/Syk < 0,05) expresí ZAP-70. V 73 případech byla stanovena exprese ZAP-70 i průtokovou cytometrií; konkordance s mutačním stavem IgVH však byla pouze 86 % pro RQ-PCR a 71 % pro průtokovou cytometrii. Na základě těchto výsledků lze očekávat, že měření exprese mRNA pro ZAP-70 pomocí real-time RQ-PCR se i přes technickou a finanční náročnost v budoucnu stane referenční metodou umožňující validaci výsledků průtokové cytometrie.
Stav metylace genu ZAP-70
Dosud byla publikována jediná práce, která analyzovala korelaci mezi metylačním stavem genu ZAP-70 a hladinou exprese proteinu ZAP-70 u CLL [26]. Autoři zjišťovali metylaci cytozinu v dinukleotidu CpG na pozici -334 vzhledem ke startovacímu místu transkripce genu ZAP-70 pomocí bisulfidové restrikční analýzy (COBRA). Výhodou této metody je potřeba jen malého množství vzorku (DNA) a oproti PCR či Western blotu také vysoká tolerance vůči kontaminaci T/NK buňkami. Exprese proteinu ZAP-70 byla určena průtokovou cytometrií, celkem bylo vyšetřeno 87 pacientů s B-CLL. Z 53 pacientů ZAP-70 negativních mělo 51 metylaci C-334 (96 %) a z 32 pacientů ZAP-70 pozitivních 30 nemělo metylaci detekovánu (94 %). Prokázalo se tak, že gen ZAP-70 je u CLL různě metylován, a že stav metylace vysoce koreluje s jeho expresí.
Závěr
Exprese ZAP-70 představuje moderní ukazatel prognózy pacientů s B-CLL sloužící nejen jako možný zástupný ukazatel pro mutační stav IgVH, ale poskytující i cennou samostatnou prognostickou informaci. Pozitivní exprese ZAP-70, ani přítomnost nemutovaných genů pro IgVH nejsou na základě dosud provedených studií směrodatnými pro rozhodnutí o zahájení terapie [27]. K průkazu účinnosti časné terapie u pacientů s vysokým rizikem progrese B-CLL je třeba dalších klinických studií. Poznatky o funkci ZAP-70 u B-lymfocytů jsou dosud nekompletní, ale významně posunují naše znalosti o patogenezi B-CLL. Recentní studie [7,28] nasvědčují tomu, že exprese ZAP-70 není omezena jen na část B-CLL, ale že se vyskytuje také u některých populací normálních B-lymfocytů a odráží stupeň buněčné aktivace. Největší úskalí představuje standardizace a validace metod stanovení exprese ZAP-70. Nejdostupnější a nejčastěji užívanou metodou je průtoková cytometrie; její vyhodnocování je ale značně subjektivní a standardizace vyžaduje do budoucna porovnání s výsledky jiných metod (zejména PCR). Dostupnou alternativu s možností retrospektivní analýzy představuje imunohistochemie.
Poděkování
Práce byla podpořena grantem č.NR/8373-3 IGA MZ ČR, grantem GAUK64/2005/C a výzkumným záměrem MZO 00179906.
MUDr. Lukáš Smolej
www.fnhk.cz
e-mail: smolej@seznam.cz
Doručeno do redakce: 10. 6. 2006
Přijato po recenzi: 13. 9. 2006
Sources
1. Prausová D, Krejsek J, Žák P et al. Význam imunofenotypového vyšetření v diagnostice B-lymfoproliferativních onemocnění. Vnitř Lék 2004; 50 : 45-53.
2. Papajík T, Jarošová M, Plachý R et al. Chronická B-lymfocytární leukemie. Část I: Pohled na původ, biologii a genetické změny leukemických buněk. Trans Hemat dnes 2006; 12 : 53-61.
3. Hamblin TJ, Davis Z, Gardiner A et al. Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood 1999; 94 : 1848-1854.
4. Wiestner A, Rosenwald A, Barry TS et al. ZAP-70 expression identifies a chronic lymphocytic leukemia subtype with unmutated immunoglobulin genes, inferior clinical outcome, and distinct gene expression profile. Blood 2003; 101 : 4944-4951.
5. Rosenwald A, Alizadeh AA, Widhopf G et al. Relation of gene expression phenotype to immunoglobulin mutation genotype in B cell chronic lymphocytic leukemia. J Exp Med 2001; 194 : 1639-1647.
6. Chan AC, Iwashima M, Turck CW et al. ZAP-70: a 70 kd protein-tyrosine kinase that associates with the TCR zeta chain. Cell 1992; 71 : 649-662
7. Nolz JC, Tschumper RC, Pittner BT et al. ZAP-70 is expressed by a subset of normal human B-lymphocytes displaying an activated phenotype. Leukemia 2005; 19 : 1018-1024.
8. Orchard J, Ibbotson R, Best G et al. ZAP-70 in B-cell malignancies. Leuk Lymphoma 2005; 46 : 1689-1698.
9. Rassenti L, Huynh L, Toy TL et al. ZAP-70 compared with immunoglobulin heavy-chain gene mutation status as a predictor of disease progression in chronic lymphocytic leukemia. N Engl J Med 2004; 351 : 893-901.
10. Orchard J, Ibbotson R, Davis Z et al. ZAP-70 expression and prognosis in chronic lymphocytic leukemia. Lancet 2004; 363 : 105-111.
11. Crespo M, Bosch F, Villamor N et al. ZAP-70 expression as a surrogate for immunoglobulin-variable-region mutations in chronic lymphocytic leukemia. N Engl J Med 2003; 348 : 1764-1775.
12. Dürig J, Nückel H, Cremer M et al. ZAP-70 expression is a prognostic factor in chronic lymphocytic leukemia. Leukemia 2003; 17 : 2426-2434.
13. Orchard J, Best OG, Ibbotson RE et al. ZAP-70 by flow cytometry: Comparison of methodologies, and with IgVH mutational nad ZAP-70 methylation status. (ASH Annual Meeting Abstracts) 2005; 106 : 1181.
14. Gibbs G, Bromidge T, Howe D et al. Comparison of flow cytometric methods for the measurement of ZAP-70 expression in a routine diagnostic laboratory. Clin Lab Haem 2005; 27 : 258-266.
15. Jorgensen J, Jones D, Luthra R et al. Flow cytometric detection of ZAP-70 in chronic lymphocytis leukemia: addition of a novel second monoclonal antibody improves correlation with IgVH mutation status. Blood (ASH Annual Meeting Abstracts) 2005; 106 : 3277.
16. Letestu R, Baran-Marszak F, Lefebvre V et al. Evaluation of ZAP-70 expression using real-time quantitative RT PCR (RQ-PCR) in chronic lymphocytic leukemia (CLL), a reference method for flow cytometry (FCM) harmonization? Blood (ASH Annual Meeting Abstracts) 2005; 106 : 1195.
17. Kay S, Herishanu Y, Pick M et al. Quantitative flow cytometry of ZAP-70 levels in chronic lymphocytic leukemia using molecules of equivalent soluble fluorochrome. Cytometry B Clin Cytom 2006; 70 : 218-226.
18. Sup SJ, Domiati-Saad R, Kelley TW et al. ZAP-70 expression in B-cell hematologic malignancy is not limited to CLL/SLL. Am J Clin Pathol 2004; 122 : 582-587.
19. Admirand JH, Rassidakis GZ, Abruzzo LV et al. Immunohistochemical detection of ZAP-70 in 341 cases of non-Hodgkin and Hodgkin lymphoma. Mod Pathol 2004; 17 : 954-961.
20. Carreras J, Villamor N, Colomo L et al. Immunohistochemical analysis of ZAP-70 expression in B-cell lymphoid neoplasms. J Pathol 2005; 205 : 507-513.
21. Wang J, Young L, Win W et al. Distribution and ZAP-70 expression of WHO lymphoma categories in Shanxi, China: a review of 447 cases using a tissue microarray technique. Appl Immunohistochem Mol Morphol 2005; 13 : 323-332.
22. Vener C, Gianelli U, Cortelezzi A et al. ZAP-70 immunoreactivity is a prognostic marker of disease progression in chronic lymphocytic leukemia. Leuk Lymphoma 2006; 47 : 245-251.
23. Kim SZ, Chow KU, Kukoc-Zivojnov N et al. Expression of ZAP-70 protein correlates with disease stage in chronic lymphocytic leukemia and is associated with, but not generally restricted to, non-mutated Ig VH status. Leuk Lymphoma 2004; 45 : 2037-2045.
24. Catherwood MA, Matthews C, Niblock R et al. ZAP-70 mRNA quantification in B-cell chronic lymphocytic leukaemia. Eur J Haematol. 2006; 76 : 294-298.
25. Laurenti L, Petlickovski A, Rumi C et al. Comparison of ZAP-70/Syk mRNA levels with immunoglobulin heavy-chain gene mutation status and disease progression in chronic lymphocytic leukemia. Haematologica 2005; 90 : 1533-1540.
26. Corcoran M, Parker A, Orchard J et al. ZAP-70 methylation status is associated with ZAP-70 expression status in chronic lymphocytic leukemia. Haematologica 2005; 90 : 1078-1088.
27. Binet J-L, Caligaris-Capio F, Catovsky D et al. Perspectives on the use of new diagnostic tools in the treatment of chronic lymphocytic leukemia. Blood 2006; 107 : 859-861.
28. Scielzo C, Camporeale A, Geuna M. ZAP-70 is expressed by normal and malignant human B-cell subsets of different maturational stage. Leukemia 2006; 20 : 689-195.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 12-
All articles in this issue
- Alogenní transplantace krvetvorných buněk u nemocných s chronickou myeloidní leukemií v České republice: retrospektivní hodnocení výsledků z let 1988 až 2005
- Elektrokardiogram u akutního infarktu myokardu s reperfuzí: co s Q-kmity a jejich dynamikou v dnešní době?
- Statiny a osteoporóza
- ZAP-70 u chronické B-lymfocytární leukemie: klinický význam a metody detekce
- Kolagenofibrotická glomerulopatia - raritná glomerulonefritída
- Ultrazvukové mapování žilního systému dolních končetin s ohledem na výskyt a anatomii přední přídatné velké safény
- Role EuroSCORE pro prospektivní odhad krátkodobého rizika u kandidátů pro kardiochirurgickou operaci: Je přesnost EuroSCORE pro odhad perioperačního rizika stejná jako pro odhad rizika nechirurgické léčby?
- Non-arrhythmic therapy of ventricular tachyarrhythmias and sudden cardiac death after acute myocardial infarction
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Statiny a osteoporóza
- Ultrazvukové mapování žilního systému dolních končetin s ohledem na výskyt a anatomii přední přídatné velké safény
- Role EuroSCORE pro prospektivní odhad krátkodobého rizika u kandidátů pro kardiochirurgickou operaci: Je přesnost EuroSCORE pro odhad perioperačního rizika stejná jako pro odhad rizika nechirurgické léčby?
- Kolagenofibrotická glomerulopatia - raritná glomerulonefritída
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

