-
Medical journals
- Career
Lokalizace zdroje recidivujícího krvácení v tenkém střevě u hemoragické hereditární teleangiektazie pomocí scintigrafie s in vivo označenými erytrocyty pomocí 99mTc−pertechnetátu
Authors: J. Doležal 1; J. Vižďa 1; M. Kopáčová 2; J. Bureš 2; I. Šteiner 3; J. Příborský 4
Authors‘ workplace: Oddělení nukleární medicíny FN Hradec Králové, přednosta MUDr. Ing. Jaroslav Vižďa 1; II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 2; Fingerlandův ústav patologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Ivo Šteiner, CSc. 3; Chirurgická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Zbyněk Vobořil, DrSc. 4
Published in: Vnitř Lék 2005; 51(5): 583-587
Category: Case Reports
Overview
53letá pacientka byla v minulosti opakovaně vyšetřována pro krvácení do trávicího traktu s enteroragií a melénou, 2krát podstoupila laparotomii bez zjištění zdroje krvácení. V roce 1999 jsme pacientku hospitalizovali pro enteroragii s klinicky vyjádřeným anemickým syndromem při posthemoragické anémii (hemoglobin 67 g/l). Po podání krevních převodů a stabilizaci krevního oběhu jsme zahájili pátrání po zdroji krvácení. Gastroskopie, push-enteroskopie a koloskopie neobjevily zdroj krvácení. Při scintigrafii po podání autologních erytrocytů in vivo označených 99mTc-pertechnetátem bylo za 1 hodinu od i.v. Aplikace radiofarmaka prokázáno ložisko intestinální extravazace erytrocytů, které bylo uloženo nad močovým měchýřem vlevo od střední čáry. Intraoperační enteroskopie zjistila longitudinálně probíhající vinuté cévy postihující velkou část jejuna. Nález byl hodnocen jako v.s. vrozená cévní malformace. Nejvíce postiženou část distálního jejuna v délce 50 cm chirurg resekoval. Histologický nález odpovídal diagnóze m. Rendu - Osler-Weber (hereditární hemoragická teleangiektazie). Pacientka neměla charakteristické teleangiektazie na rtech, bukální sliznici či na kůži kolem úst a nosu a měla negativní i anamnézu epistaxí. Během 4 let po resekci postižené části jejuna pacientka neměla obtíže, krevní obraz byl stabilizován na normálních hodnotách bez nutnosti krevních převodů. Na konci loňského roku došlo k dalšímu krvácení do trávicího traktu s enteroragií. Intraoperační enteroskopie odhalila několik drobných cévních malformací v jejunu a terminálním ileu, které byly koagulovány bipolární sondou.
Klíčová slova:
krvácení do gastrointestinálního traktu – scintigrafie s 99mTc-pertechnetátem označenými erytrocyty – m. Rendu-Osler-WeberÚvod
Hereditární hemoragická teleangiektazie (m. Rendu-Osler-Weber) je onemocnění, které je charakterizováno přítomností teleangiektazií, tj. rozšíření drobných cév, jehož podkladem je dysplazie pojivové složky stěn drobných cév. Krvácivé projevy vyplývají ze snížené odolnosti cévní stěny. Onemocnění se obvykle manifestuje na rtech, bukální sliznici, kůži kolem úst a nosu. Léze mají vzhled tmavě červených až fialových třískových skvrnek o velikosti 0,5–3 mm. Polovina nemocných má známky krvácení do trávicího traktu. Jsou-li teleangiektazie přístupné pohledu, je diagnóza zřejmá ze vzhledu teleangiektazií. Diagnóza je obtížně stanovitelná při orgánovém postižení, bez nálezu na kůži a viditelných sliznicích [12].
Pro diagnostiku krvácení z horní části trávicí trubice a z tlustého střeva je diagnostickou a terapeutickou metodou endoskopie [2,9,18,19]. Tenké střevo je zdrojem akutního krvácení do gastrointestinálního traktu asi v 10 % případů [2]. V případech krvácení do tenkého střeva se při stanovení lokalizace zdroje může vedle push-enteroskopie, popř. Intraoperační enteroskopie [13,14] a RTG angiografie uplatnit i scintigrafie s radionuklidy značenými erytrocyty [2,9,19]. Scintigrafie je neinvazivní vyšetřovací metoda [17,20], která umožňuje sledovat pacienta po několik hodin a detekovat časově aktuální či intermitentního krvácení. Scintigrafie se provádí s autologními erytrocyty označenými in vivo nebo in vitro 99mTc-pertechnetátem [19].
Rychlost krvácení do trávicího traktu nutná pro scintigrafickou detekci je alespoň 0,1 až 0,35 ml/min [6]. Pro detekci krvácení je potřebná extravazace pouze 2–3 ml krve [19]. Pro srovnání: RTG kontrastní angiografie detekuje krvácení od rychlosti okolo 1 ml/min [19].
Pozitivní scintigrafie se značenými autologními erytrocyty by měla splňovat následující kritéria [9,19]: 1. extravaskulární aktivita musí být přítomna intraluminálně; 2. ložisko extravazátu se musí zvětšovat v čase; 3. musí být vidět posun extravazátu trávícím traktem v čase. Pokud k posunu nedochází, nemělo by se jednat o místo aktivního krvácení do trávicího traktu, ale o fixovanou vaskulární strukturu [9], např. hemangiom, akcesorní slezinu, ektopickou ledvinu [19].
Klinická data
53letá pacientka se od 5 let léčila pro chronickou hypochromní anémii, opakovaně docházela na transfuze krve a užívala preparáty železa. V roce 1980 a následně v roce 1990 pacientka podstoupila laparotomii pro recidivující krvácení do trávicího traktu s enteroragií, kdy se zdroj krvácení nepodařilo nalézt. V posledních letech je pacientka sledována pro chronickou hepatitidu C (histologicky s obrazem jaterní cirhózy).
V roce 1999 jsme pacientku hospitalizovali pro enteroragii s klinicky vyjádřeným anemickým syndromem při posthemoragické anémii (hemoglobin 67 g/l). Podání erytrocytárních mas a plazmy vedlo ke stabilizaci krevního oběhu (hemoglobin 119 g/l). Druhý den došlo k dalšímu krvácení a poklesu hladiny hemoglobinu o 20 g/l. Následovaly další krevní převody (hemoglobin 120 g/l). Vzhledem k přítomnosti hepatitidy C bylo v diferenciální diagnostice pomýšleno na krvácení při portální hypertenzi. Gastroskopie, push-enteroskopie a koloskopie nenalezla zdroj krvácení. Pacientka neměla charakteristické teleangiektazie na rtech, bukální sliznici či na kůži kolem úst a nosu a neměla anamnézu epistaxí.
Z dalších neinvazivních metod jsme provedli scintigrafii s označenými erytrocyty k detekci zdroje krvácení. Pro označení erytrocytů jsme použili metodu in vivo. Nejprve jsme i.v. aplikovali Sn-pyrofosfát v dávce 15 μg chloridu cínatého dihydrátu na kilogram hmotnosti pacientky. Ionty cínu pronikají přes buněčnou membránu do erytrocytů. Za 20 minut následovalo i.v. podání 99mTc-pertechnetátu o aktivitě 750 MBq. Toto sedmimocné technecium proniká buněčnou membránou do erytrocytů a zde je ionty cínu redukováno [15,16]. Redukované technecium se váže na hemoglobin v erytrocytech [19]. Bezprostředně po aplikaci 99mTc-pertechnetátu jsme provedli dvoufázovou dynamickou scintigrafii dutiny břišní. Poté následovaly statické scintigramy, nejprve v 15minutových a pak v hodinových intervalech. Pro zvýšení senzitivity, specificity a upřesnění lokalizace zdroje krvácení jsme vyšetření doplnili o jednofotonovou emisní výpočetní tomografii (SPECT) dutiny břišní.
Před provedením scintigrafie s in vivo značenými erytrocyty nebyla nutná žádná speciální příprava, ale je možné podat perchlorát (chloristan draselný) k minimalizaci problému s volným, nenavázaným 99mTc-pertechnetátem [9] – blíže viz diskuse.
Radiační zátěž vyjádřená efektivní dávkou u scintigrafie s označenými erytrocyty pomocí 99mTc - ertechnetátu je 0,006 mSv/MBq [10]. Při aplikované aktivitě 750 MBq pacientka dostala efektivní dávku 4,5 mSv.
Na dynamické scintigrafii dutiny břišní i na následujících statických scintigramech dutiny břišní nebyla nalezena extravazace erytrocytů do lumen střeva (obr. 1). Ale na statickém scintigramu za 1 hodinu po i.v. aplikaci radiofarmaka se zobrazilo poloměsíčité ložisko extravazace erytrocytů v lumen střeva o délce 7 cm, které bylo uloženo nad močovým měchýřem vlevo od střední čáry (obr. 2). Na scintigramu za 2,5 hodiny po aplikaci radiofarmaka se extravazát erytrocytů dostal střevní peristaltikou do oblasti pravé jámy kyčelní (obr. 3). Nález jsme zhodnotili jako zdroj krvácení v kličce tenkého střeva nad močovým měchýřem.
Image 1. Statický scintigram dutiny břišní za 15 minut po i.v. Aplikaci radiofarmaka. 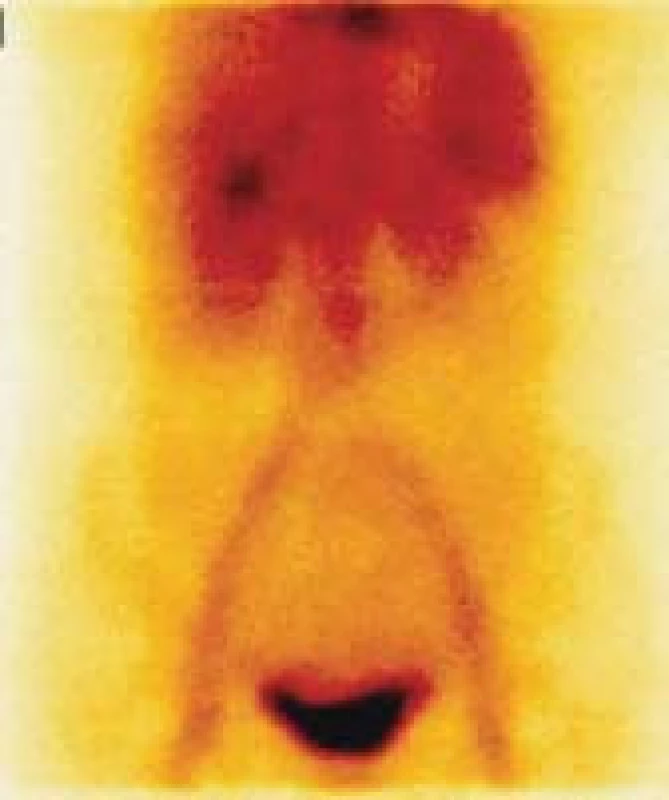
Jsou dobře patrné velké cévy a dobře prokrvené orgány, jako ledviny a játra, ale není patrné ložisko extravazace autologních, radioaktivně označených erytrocytů. Normální nález. Image 2. Statický scintigram dutiny břišní za 1 hodinu po i.v. aplikaci radiofarmaka. 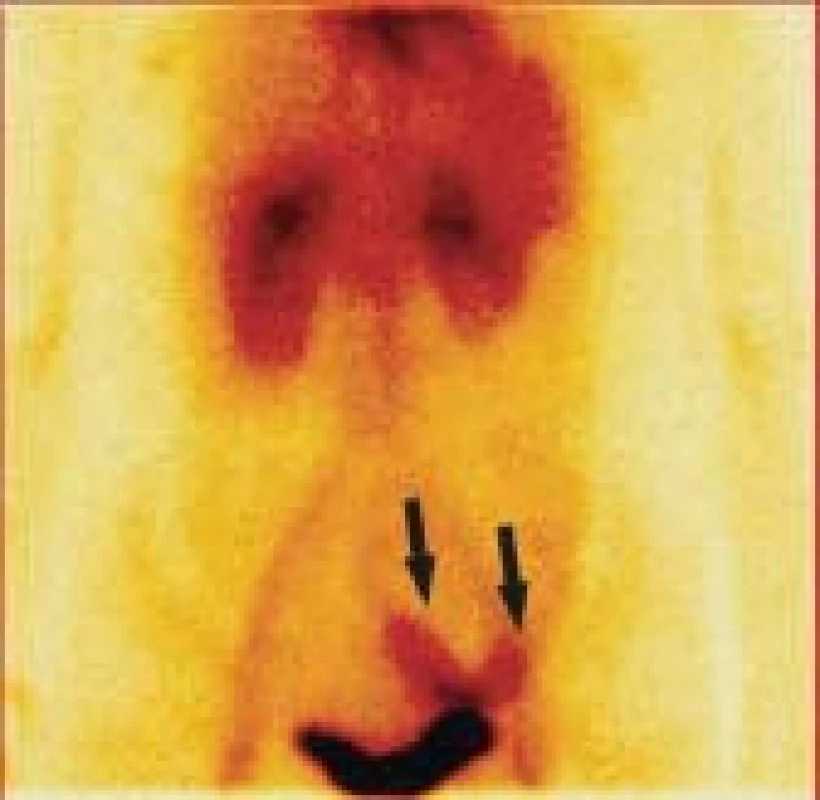
Zobrazilo se poloměsíčité ložisko extravazace autologních, radioaktivně označených erytrocytů do lumina kličky tenkého střeva, která je uložená nad močovým měchýřem vlevo od střední čáry (viz hroty šipek). Image 3. Na statickém scintigramu za 2,5 hodiny po i.v. aplikaci radiofarmaka se extravazát autologních, radioaktivně označených erytrocytů dostal střevní peristaltikou do oblasti ilea a ilické tepny vpravo. 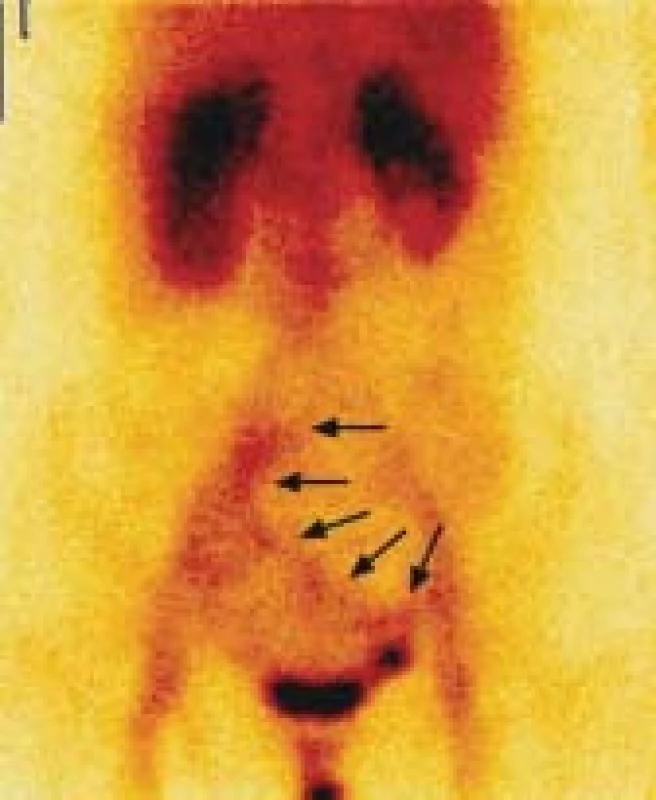
Následovala chirurgicky asistovaná intraoperační enteroskopie celého tenkého střeva. V endoskopickém obrazu dominovaly longitudinálně probíhající vinuté cévy postihující velkou část jejuna. Nález byl hodnocen jako v.s. vrozená cévní malformace. Nejvíce postiženou část distálního jejuna v délce 50 cm chirurg resekoval.
Na resekátu byly nejnápadnějším makroskopickým nálezem četné, široce dilatované, vinuté cévy na seróze, které tvořily až drobná kulovitá aneuryzmata. Histologicky se jednalo o systémové rozšíření drobných cév, a to charakteru arteriol, venul i kapilár. Stěny dilatovaných cév nejevily strukturální odchylky od normy. Nejvíce rozšířené cévy se nacházely na seróze a v submukóze. Některé z nich dosahovaly i do vlastní sliznice. Vyšetřeno bylo i mezenterium; zde byly patrné ektazie cév obdobného charakteru. Neobvyklým nálezem byla přítomnost vícečetných tenkých vazivových sept přemosťujících lumen některých cév, takže v lumen vznikla až jakási řídká síť. V zastižené lymfatické uzlině byly rozšířené krevní i lymfatické cévy. Nález odpovídal diagnóze m. Rendu-Osler--Weber (hereditární hemoragická teleangiektazie).
Během 4 let po resekci postižené části jejuna pacientka neměla obtíže, krevní obraz byl stabilizován na normálních hodnotách bez nutnosti krevních převodů. V závěru roku 2003 se u pacientky znovu objevila hemodynamicky závažná enteroragie. Gastroskopie, koloskopie a push-enteroskopie neodhalily zdroj krvácení. Kapslová enteroskopie prokázala aktuální krvácení v oblasti jejuna a terminálního ilea, ale nepodařilo se identifikovat zdroj. Intraoperační enteroskopie zjistila několik drobných cévních malformací v jejunu a terminálním ileu, které byly koagulovány bipolární sondou. Spirální CT hrudníku s bolusem kontrastní látky vyloučilo cévní malformaci v plicním řečišti. V současnosti je pacientka bez obtíží, krevní obraz je stabilizován.
Diskuse
Základní digestivní endoskopie umožňuje detekci zdroje krvácení v horní části trávicího traktu a v oblasti tlustého střeva a následnou léčbu tohoto krvácení. Pokud jsou endoskopické metody (gastroskopie, enteroskopie, koloskopie) negativní, tj. neodhalily zdroj aktuálního krvácení, je vhodné provést scintigrafii s označenými erytrocyty. Scintigrafie s označenými erytrocyty je doplňková zobrazovací metoda, která má pomoci při hledání zdroje krvácení, především v oblasti tenkého střeva, což potvrzuje i náš výsledek. Zdroj krvácení může být v nevyšetřené části tenkého střeva, tedy v úseku, který je běžnými endoskopickými vyšetřovacími metodami nedostupný (pokud není použita intraoperační endoskopie nebo nověji kapslová enteroskopie). Je-li scintigrafie s autologními označenými erytrocyty pozitivní, tj. lokalizuje - li zdroj krvácení v tenkém střevě, je na našem pracovišti indikována intraoperační enteroskopie.
Scintigrafie označenými erytrocyty je neinvazivní vyšetřovací metoda, která ve srovnání s kontrastní RTG angiografií umožňuje sledovat pacienta po několik hodin a detekovat i intermitentní krvácení.
Přestože jsme při scintigrafii použili metodu in vivo pro označení erytrocytů 99mTc - pertechnetátem, která má dle literatury nižší účinnost značení než metoda in vitro [9,19] a tudíž vyšší podíl volného 99mTc-pertechnetátu, nepozorovali jsme akumulaci volného 99mTc - pertechnetátu v žaludeční sliznici ani jeho sekreci do trávicího traktu. Docházelo pouze k mírnému vylučování nenavázaného 99mTc-pertechnetátu ledvinami a k naplnění močového měchýře, což bylo možno eliminovat vyprázdněním močového měchýře před každým scintigramem. Metoda značení in vivo, na rozdíl od metody in vitro, nevyžaduje separaci a zpracování autologních erytrocytů, tudíž se snižuje riziko transferu krví přenosných infekčních onemocnění na personál manipulující s krví pacienta.
Náš nález na scintigrafii s označenými erytrocyty odpovídá zkušenostem v literatuře. Například Hansen et al publikovali kazuistiku o dvou pacientech s alkoholickou cirhózou, portální hypertenzí a enteroragií. Scintigrafie s 99mTc-pertechnetátem označenými erytrocyty demonstrovala krvácení z mezenterických varixů do přilehlého střeva [8]. Caruana et al detekovali krvácení z leiomyosarkomu v jejunu pomocí scintigrafie se značenými erytrocyty [3]. Bagga et al provedli scintigrafii s 99mTc označenými erytrocyty u dvou pacientů s recidivujícím pooperačním krvácením do trávicího traktu po částečné resekci tlustého střeva a odhalili zdroj krvácení v místě anastomózy [1]. Iwata et al popisují případ 25letého muže s recidivující anémií z nedostatku železa. Scintigrafie s označenými erytrocyty odhalila krvácející lézi v trávicím traktu. Byla provedena částečná resekce tenkého střeva a byl diagnostikován kavernózní hemangiom [11].
Dusold et al ve své práci identifikovali správné místo zdroje krvácení pomocí scintigrafie s označenými erytrocyty u 33 (75 %) pacientů [5]. Gutierrez et al ve své práci popisují retrospektivní analýzu pacientů s krvácením do dolní části trávicího traktu. Místo krvácení bylo správně určeno scintigrafií u 22 (88 %) pacientů [7].
Ve studii, která probíhala na našem pracovišti od roku 1998, jsme vyšetřili celkem 34 pacientů. U 23 pacientů jsme během scintigrafie s označenými erytrocyty zachytili krvácení do trávicího traktu. Stav nemocných si vyžádal enteroskopii (intraoperační či push-enteroskopii) nebo chirurgický výkon u 17 osob, zdroj krvácení jsme správně určili u 12 pacientů. U těchto pacientů jsme nalezli zdroj krvácení v tenkém střevě. Zbývajících 5 pacientů je podrobněji zmíněno v následujících řádcích. Pro první tři pacienty je charakteristické, že měli ověřený zdroj krvácení v tenkém střevě (AV malformace na rozhranní ilea a jejuna, krvácející eroze v tenkém střevě při uremické enteritidě a karcinoid v ileu). Na dynamické scintigrafii dutiny břišní bezprostředně po aplikaci i.v. 99MTc-pertechnetátu a na následných statických scintigramech během 3 hodin byl nález negativní. Teprve na pozdních statických scintigramech za 3–20 hodin se objevil extravazát radionuklidy značených erytrocytů v tlustém střevě. To znamená, že v časových intervalech mezi pozdními statickými scintigramy došlo ke krvácení do tenkého střeva a zrychlenou peristaltikou se extravazát dostal do tlustého střeva, kde byl detekován. Další pacient, u kterého byla scintigraficky nesprávně určena lokalizace zdroje krvácení, měl pseudocystu pankreatu s krvácející cévou a komunikací do colon transversum. Zde byl opět extravazát přítomen až na pozdních statických scintigramech a objevil se v oblasti sigmatu. V časových intervalech mezi pozdními statickými scintigramy došlo ke krvácení do colon transversum a zrychlenou peristaltikou se extravazát dostal do sigmatu, kde byl detekován. Poslední pacient s nesprávným scintigrafickým určením místa krvácení měl krvácející ulkus v oblasti Vaterské papily. Na dynamické scintigrafii a následné statické scintigrafii byl nález negativní. Teprve na pozdních statických scintigramech se zobrazilo ložisko extravazace v kličce tenkého střeva na rozhranní mezogastria a hypogastria ve střední čáře. V časových intervalech mezi pozdními statickými scintigramy došlo ke krvácení do tenkého střeva a zrychlenou peristaltikou se extravazát dostal do distální částí tenkého střeva, kde byl detekován. V těchto 5 případech se vzhledem k několika hodinovým intervalům mezi statickými scintigramy jednalo pouze o průkaz krvácení, nikoliv o průkaz lokalizace zdroje krvácení [4].
Zbývajících 11 pacientů v naší studii mělo scintigrafii negativní. U těchto 11 pacientů došlo ke spontánnímu zastavení krvácení do trávicího traktu, jednalo se pouze o jednu epizodu krvácení, která se již neopakovala a nebyly přítomny žádné jiné alarmující příznaky, jež by nutily k provedení intraoperační enteroskopie nebo chirurgického zákroku [4]. Na závěr diskuse uvádíme, jak je zajištěna péče o nemocné s krvácením do trávicího ústrojí v FN Hradec Králové a jaké postavení v tomto algoritmu má scintigrafie s radionuklidy značenými erytrocyty.
Akutní krvácení do trávicího ústrojí
- A. Dosud nevyšetřené akutní krvácení. Metodou první volby je digestivní endoskopie. Výjimkou jsou nemocní vyžadující urgentní chirurgický zákrok.
- B. Pokračující nebo recidivující krvácení, u kterého předchozí léčba selhala. Podle charakteru onemocnění, výsledků předchozí diagnostiky a typu provedené předchozí léčby se provádí endoskopie nebo urgentní chirurgický zákrok. U nemocných s krvácením z jícnových varixů při portální hypertenzi je indikováno zavedení transjugulárního portosystémového zkratu.
Akutní krvácení do gastrointestinálního traktu ze zdroje nezjištěného při endoskopii
Podle charakteru onemocnění, klinického stavu pacienta a výsledků předchozí provedené diagnostiky se provádí intraoperační enteroskopie, push-enteroskopie, angiografie a scintigrafie s radionuklidy značenými erytrocyty. Push-enteroskopie je prvním vyšetřením u akutního krvácení gastrointestinálního traktu z nezjištěného zdroje prezentující se melénou. Angiografie následuje, pokud push-enteroskopie krvácení neobjasnila, krvácení je hemodynamicky závažné a/nebo je potenciální možnost terapeutické intervence (terapeutická embolizace). Metody nukleární medicíny jsou indikovány pro diagnostiku aktuálního krvácení do gastrointestinálního traktu z nezjištěného zdroje, u nemocného, který není hemodynamicky nestabilní a/nebo když angiografie byla nediagnostická. Kapslová endoskopie je určena pro diagnostiku recidivujícího krvácení z nezjištěného zdroje k vyšetření v mezidobí, kdy pacient aktuálně nekrvácí. Intraoperační enteroskopie je indikována buď jako metoda terapeutická, kdy patologie byla předem objasněna (metodami nukleární medicíny nebo kapslovou endoskopií), anebo když u akutního krvácení z nezjištěného zdroje všechny ostatní diagnostické metody selhaly.
Okultní krvácení do trávicího ústrojí
Je vyšetřováno podle celostátního algoritmu přijatého v rámci Národního programu boje proti kolorektálnímu karcinomu.
Okultní krvácení do gastrointestinálního traktu z nezjištěného zdroje
Je indikací k intraoperační enteroskopii. Alternativou je kapslová enteroskopie.
Závěr
Případ naší pacientky s opakovanou enteroragií byl komplikovaný, a to ze dvou důvodů: 1. chyběl typický makroskopický nález charakteru teleangiektazií na rtech, bukální sliznici a na kůži kolem úst a nosu, což vedlo diferenciální diagnostiku jiným směrem; 2. přítomnost hepatitidy C s jaterní cirhózou a portální hypertenzí. Scintigrafie s radionuklidy značenými erytrocyty umožnila u pacientky detekovat krvácení do kličky tenkého střeva a zkrátit dobu diagnostického procesu a nasměrovat další postup k intraoperační enteroskopii a chirurgickému řešení.
MUDr. Jiří Doležal, Ph.D.
www.fnhk.cz
e-mail: dolezal@fnhk.cz
Doručeno do redakce: 20. 5. 2004
Přijato po recenzi: 3. 9. 2004
Sources
1. Bagga S, Gupta SM et al. Scintigraphic localization of recurrent anastomotic site bleeding in the gastrointestinal tract. Clin Nucl Med 1996; 21(4): 296–298.
2. Bureš J, Rejchrt S et al. Vyšetření tenkého střeva a enteroskopický atlas. Praha: Grada Publishing: 2001.
3. Caruana V, Swayne LC et al. Scintigraphic localization of a bleeding leiomyosarcoma of the proximal jejunum. Clin Nucl Med 1991; 16(4): 230–232.
4. Doležal J, Vižďa J, Bureš J. Přínos scintigrafie s autologními erytrocyty k určení místa krvácení v tenkém střevě. Folia Gastroenterologica et Hepatologica 2004; 2(1): 13–20.
5. Dusold R, Burke K et al. The accuracy of technetium-99m-labeled red cell scintigraphy in localizing gastrointestinal bleeding. Am J Gastroenterol 1994; 89(3): 345–348.
6. Ford PV, Bartold SP et al. Procedure Guideline for Gastrointestinal Bleeding and Meckel’s Diverticulum Scintigraphy. J Nucl Med 1999; 40(7): 1226–1232.
7. Gutierrez C, Mariano M et al. The use of technetium-labeled erythrocyte scintigraphy in the evaluation and treatment of lower gastrointestinal hemorrhage. Am Surg 1998; 64(10): 989–992.
8. Hansen ME, Coleman RE. Scintigraphic demonstration of gastrointestinal bleeding due to mesenteric varices. Clin Nucl Med 1990; 15(7): 488–490.
9. Harbert JC, Eckelman WC et al. Nuclear Medicine – Diagnosis and Therapy. New York: Thieme Medical Publ Inc 1996.
10. Hušák V, Petrová K et al. Aplikované aktivity radiofarmak, radiační zátěž a radiační riziko vyšetřovacích postupů v nukleární medicíně. Čas Lék Čes 1998; 138(11): 323–328.
11. Iwata Y, Shiomi S et al. A case of cavernous hemangioma of the small intestine diagnosed by scintigraphy with Tc-99m-labeled red blood cells. Ann Nucl Med 2000; 14(5): 373–376.
12. Klener P et al. Vnitřní lékařství. Praha: Galén 1999.
13. Kopáčová M, Bureš J et al. Intraoperační enteroskopie – vlastní zkušenosti z období 1995–2002. Čas Lék Čes 2003; 142(5): 303–306.
14. Kopáčová M, Bureš J et al. Intraoperační enteroskopie. Endoskopie 2003; 12(1): 3–6.
15. Krishnamurthy GT, Krishnamurthy S. Nuclear Hepatology. Berlin: Springer - Verlag 2000.
16. Miller TR. Cardiopulmonary Nuclear Medicine: Radionuclide Ventriculography. In: Brown ML, Collier BD. Syllabus: A Categorical Course in Nuclear Medicine. Oak Brook: Radiological Society of North America Inc. 1996 : 97–104.
17. Orellana P, Vial I et al. 99mTc red blood cell scintigraphy for assessment of active gastrointestinal bleeding. Rev Med Chil 1998; 126 : 413–418.
18. Šťovíček J, Keil R et al. Endoskopické stavění krvácení v horní části trávicího ústrojí pomocí hemostatických klipů. Vnitř Lék 2004; 50(2): 143–146.
19. Thrall JH, Ziessman HA. Nuclear Medicine – The requisites. 2nd ed. St. Louis: Mosby Harcourt Health Sciences 2001.
20. Van Geelen JA, De Graaf EM et al. Clinical value of labeled red blood cell scintigraphy in patients with difficult to diagnose gastrointestinal bleeding. Clin Nucl Med 1994; 19(11): 949–952.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 5-
All articles in this issue
- Prevence žilní trombózy a plicní embolie na interním oddělení
- Příčina klinických projevů chronické žilní nedostatečnosti u pacientů s nadváhou a obezitou
- Urgentní endoskopická papilosfinkterotomie u osob starších 70 let
- Prietok cez portálnu vénu a kongestívne poškodenie pečene u chorých s pokročilým srdcovým zlyhávaním
- Katetrová ablace atrioventrikulární nodální reentry tachykardie (neinvazivní možnosti diagnostiky, okamžité a jednoroční výsledky sledování skupiny 40 nemocných s provedenou radiofrekvenční ablací v roce 2002)
- Vazospastická angina pectoris – patogeneza, diagnostika a léčba
- Prodloužené podávání nízkomolekulárních heparinů v prevenci pooperační trombózy
- Genetické testy v predikcii účinnosti a toxicity chemoterapie u onkologických pacientov
- Pneumologická problematika pacientů s diabetes mellitus
- Obstrukční spánková apnoe, hypertenze a erektilní dysfunkce
- Lokalizace zdroje recidivujícího krvácení v tenkém střevě u hemoragické hereditární teleangiektazie pomocí scintigrafie s in vivo označenými erytrocyty pomocí 99mTc−pertechnetátu
- Systémová AL−amyloidóza s dominující klinickou manifestací v trávicím traktu
- Naše zkušenosti s léčbou membranózní nefropatie cyklosporinem
- Akútna myokarditída, výskyt, diagnostika a liečba v spádovej nemocnici
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akútna myokarditída, výskyt, diagnostika a liečba v spádovej nemocnici
- Vazospastická angina pectoris – patogeneza, diagnostika a léčba
- Naše zkušenosti s léčbou membranózní nefropatie cyklosporinem
- Pneumologická problematika pacientů s diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

