-
Medical journals
- Career
Poruchy paměti jako možná součást paraneoplastického neurologického syndromu: imunologicky podmíněné demence
Authors: J. Reban; Z. Vrajová; E. Bůrková; L. Zajícová
Published in: Geriatrie a Gerontologie 2017, 6, č. 3: 113-116
Category: Review Article
Overview
Ve druhé polovině 80. let minulého století byla věnována zvýšená pozornost imunitním procesům, které postihovaly mozkové struktury a ve svých důsledcích ovlivňovaly i funkce těchto oblastí. Některá taková postižení byla vyvolána přítomností nádorů, a to nikoliv jejich přímým růstem nebo metastázami, ale působením protilátek organismem produkovaných a atakujících nádor, zároveň však tyto protilátky působily na nervové struktury antigenně identické. Protilátky produkované pacientem byly nazvány onkoneurální a příslušná postižení jako paraneoplastické neurologické syndromy (PNS). Tyto neurologické syndromy se typicky projevují již před diagnózou nádoru. Důsledkem tohoto procesu může být i postižení mozkových struktur odpovědných za kognitivní funkce a chování. Diagnostické postupy jsou uvedeny. Takto imunologicky podmíněné demence mohou být, jak se ukazuje v současné době, také příslušně léčeny.
Klíčová slova:
kognitivní porucha – onkoneurální protilátky – paraneoplastické protilátky – inhibitory kontrolních bodů – imunoterapie u Alzheimerovy choroby
Převážná většina demencí má svůj původ v neurodegenerativních změnách, u nichž jsou možnosti terapie omezené a většinou krátkodobé. Konec 19. století a počátek 20. století přinesl zvýšený klinický zájem o osoby s mentálním postižením.
Alois Alzheimer předložil v roce 1906 své sledování Augusty D. na schůzi německých psychiatrů spolu s podrobným patologickoanatomickým nálezem. Profesor Emil Kraepelin v roce 1910 navrhl nazvat toto onemocnění Alzheimerovou chorobou. Další vývoj zájmu o toto onemocnění byl v následujících desetiletích pomalý. V 60. letech minulého století byl zdůrazňován rozdíl mezi stavy s časným počátkem symptomů a těmi, které se vyskytovaly v pozdějším věku. V 70. letech se jako subkortikální demence označoval stav při Huntingtonově chorobě. Mnohočetné fokální ischemické léze byly pak podkladem vaskulárních demencí. V 80. letech byl popsán syndrom s nálezem Lewyho tělísek a toto onemocnění bývá zařazováno jako druhé nejčastější neurodegenerativní. Precizní kritéria diagnostiky demencí byla stanovena Americkou psychiatrickou asociací ve 4. vydání statistického manuálu mentálních onemocnění v roce 1980.
Tyto nové poznatky v posledních desetiletích 20. století umožňovaly demence nejenom přesněji diagnostikovat, ale také některé z nich i léčit. Byla proto věnována zvýšená pozornost diferenciální diagnostice, zejména pokrokům v zobrazovacích metodách, biomarkerům v mozkomíšním moku a laboratorním i genetickým vyšetřením.
V roce 1985 byla poprvé detekována autoprotilátka anti-Hu a popsána u pacienta s malobuněčným karcinomem plic (SCLC) a senzorickou neuropatií. Od té doby byla věnována zvýšená pozornost imunitním procesům, které postihovaly mozkové struktury a ve svých důsledcích ovlivňovaly i funkce těchto oblastí. Některá taková postižení byla vyvolána přítomností nádorů, a to nikoliv jejich přímým růstem nebo metastázami, ale působením protilátek organismem produkovaných a atakujících nádor, zároveň také tyto protilátky působily na nervové struktury antigenně identické. Protilátky produkované pacientem byly nazvány onkoneurální a příslušná postižení jako paraneoplastické neurologické syndromy (PNS). Důsledkem tohoto procesu může být i postižení mozkových struktur zodpovědných za kognitivní funkce a chování. Takto imunologicky podmíněné demence mohou být, jak se ukazuje v současné době, také příslušně léčeny.
PNS se mohou projevovat u nádorů, které jsou ve svých počátcích, lokalizované, někdy i okultní, a tedy lépe přístupné terapii. Samotné onkoneurální protilátky mohou také svým autoimunitním působením zlepšovat prognózu tumoru. Na druhé straně tyto protilátky atakují neurologické struktury, a tím mají někdy i nevratný vliv na funkci CNS.
Nejčastěji citovaným příkladem paraneoplastických protilátek způsobujících kognitivní postižení je limbická encefalitida (LE), tedy paraneoplastická limbická encefalitida (PLE), u které mohou být přítomny protilátky zjištěných tumorů. V určitém procentu však nádor nemusí být znám. Do jisté míry se tak kognitivní postižení stává symptomem paraneoplastického neurologického syndromu. V současné době je používán termín imunologicky podmíněné demence (IPD).
Základní popis PNS a návrh diagnostického algoritmu při vyšetřování podává Štourač 2013. Na základě přítomnosti či nepřítomnosti tumorů a paraneoplastických protilátek jsou děleny PNS na klasické a neklasické a ty pak na definitivní nebo možné. Stejný postup by bylo vhodné aplikovat i v případě imunologicky zprostředkovaných demencí.
Sérologická diagnostika imunologických neurologických syndromů pomocí detekce onkoneurálních protilátek může efektivně doplňovat klinická kritéria onemocnění a přispívat k diferenciální diagnóze i efektivnímu rozhodování a volbě terapeutických postupů.
Důležitým krokem léčení PNS, v tomto případě i kognitivních poruch, je nalezení a příslušná terapie tumoru, který spouští tento imunologický řetězec.
Table 1. Přehled testovaných protilátek proti neurálním antigenům 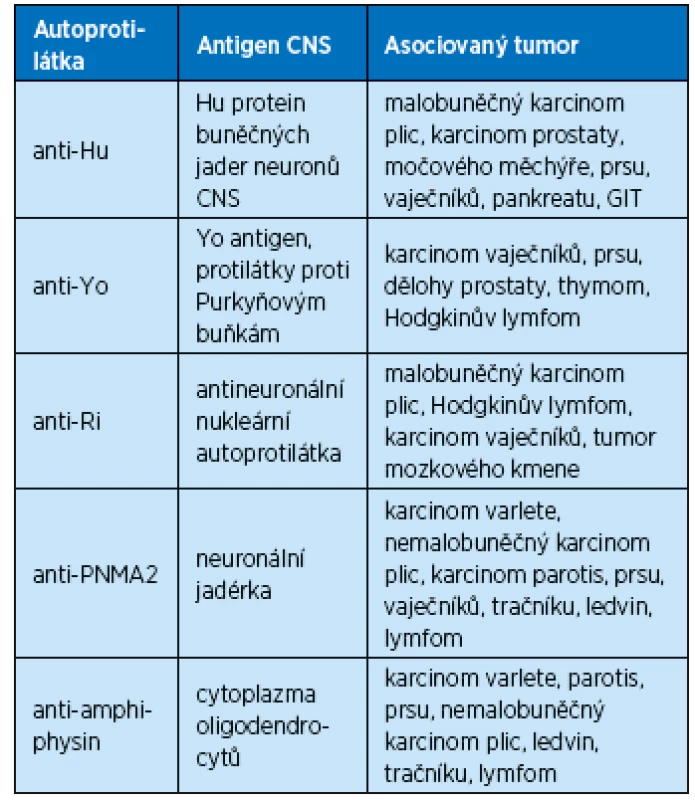
Diagnóza a terapie malignit
Důležitým krokem při léčení PNS je terapie suspektního tumoru klasickým onkologickým postupem. Prvým krokem je ale diagnóza a lokalizace nádoru pomocí FDG PET/CT vyšetření, které také umožňuje detekci recidiv i monitoraci výsledků použitých terapeutických intervencí. V případě podezření na možné imunologické konsekvence je také možná imunologická intervence pomocí tzv. checkpoint inhibitorů (inhibitorů kontrolních bodů).
Jde o checkpoints proteiny PD-1, PD-L1 (programme death – programovaný zánik). PD-1 protein je membránovým proteinem přítomným na T-lymfocytech a PD-L1 je membránovým proteinem nádorové buňky. V případě spojení lymfocytární PD-1 s nádorovým ligandem PD-L1 dochází k ochraně nádorové buňky. Tato ochrana může být zrušena příslušnými immune checkpoint inhibitory, tedy inhibitory spojení PD-1 s ligandou PD-L1. Tento postup je v poslední době základem biologické nádorové terapie. Recentně byly nalezeny i další checkpoints a jejich inhibitory anti-CTLA-4, anti-B7-1, anti-B7-2.
Terapie paraneuroplastického syndromu a imunoterapie
Léčba PNS zahrnuje především léčbu nádoru. Úspěšná onkologická léčba má zpravidla pozitivní vliv na regresi paraneoplastického neurologického syndromu. Symptomatická léčba PNS může ovlivnit řadu příznaků: spasticitu, křeče, kognitivní deficit. Sem patří také imunomodulační terapie, zvláště tam, kde nádor nebyl nalezen. Dále jsou popisovány také steroidy, intravenózní imunoglobuliny, plazmaferéza a cyklofosfamid.
Jedním ze základních příznaků Alzheimerovy demence je akumulace beta-amyloidu v mozkové tkáni. V posledních létech bylo na myších modelech AD zjištěno, že při použití checkpoint inhibitorů, tedy inhibitorů kontrolních bodů, imunitní reakce PD-1 a PD-L1 , vede ke snížení ukládání betaamyloidu v mozkové tkáni. Tato látka překonává mozkomíšní bariéru a aktivuje makrofágy, likvidující amyloidové plaky. Při tom dochází i ke zpomalování kognitivního postižení.
Farmaceutická firma Biogen se sídlem v Cambridge, Massachusetts, ve spolupráci s firmou Neurimmune z Curychu připravily checkpoint inhibitor aducanumab pro klinické studie. V současné době probíhá již rozsáhlá třetí fáze těchto studií. Ukazuje se, že v těchto studiích dochází k eliminaci betaamyloidových plaků spolu se zlepšením kognitivních testů. Aducanumab je podáván v infuzích v jednoměsíčních intervalech. Jsou sledovány i vedlejší účinky, jako např. bolesti hlavy vysvětlované hromaděním tekutiny v mozkové tkáni a vznikajícím edémem (ARIA amyloid-related imaging abnormalities). Jedním z vysvětlení je snižování betaamyloidu v mozkové tkáni, které je doprovázeno i jeho clearingem v cévách, způsobujícím zvýšený průnik tekutin. Tyto vedlejší účinky se vyskytují více u nositelů APOE4 alely.
Bylo by jistě potěšitelné, pokud by inhibitor PD-1 byl úspěšný při léčbě nádoru a současně zlepšoval kognitivní postižení. V současné době se objevují informace o podobných anti-Tau protilátkách s nepříliš pozitivními výsledky.
Soubor nemocných a metodika
Studie byla prováděna ve 2. čtvrtletí roku 2016 v Poradně pro poruchy paměti geriatrické ordinace Senior domova v Českých Budějovicích a Domova důchodců v Hluboké nad Vltavou. Počet ošetřených pacientů s kognitivními poruchami v geriatrické ordinaci v tomto roce byl 80 a od nich byla odebrána krev v měsíci květnu až červenci pouze od 21 pacienta.
Vzorky byly ihned transportovány do imunologické laboratoře krajské nemocnice v Českých Budějovicích. Zpracování bylo provedeno metodou Western blot firmy Euroimmun M. L. Jako pozitivní byly brány výsledky o intenzitě signálu od 11 do 50. Metoda nepřímé imunofluorescence nebyla aplikována.
Z 21 odebraných vzorků byly 3 pozitivní na onkoneurální protilátku anti-PNMA2.
Závažnost kognitivního postižení byla posuzována stupnicí CDR (clinical demetia rating) od 0 do 3. Počet mužů a žen podle klasifikace CDR viz tabulky 2 a 3.
Table 2. Muži, počet probandů ve studii a jejich stupeň kognitivního postižení 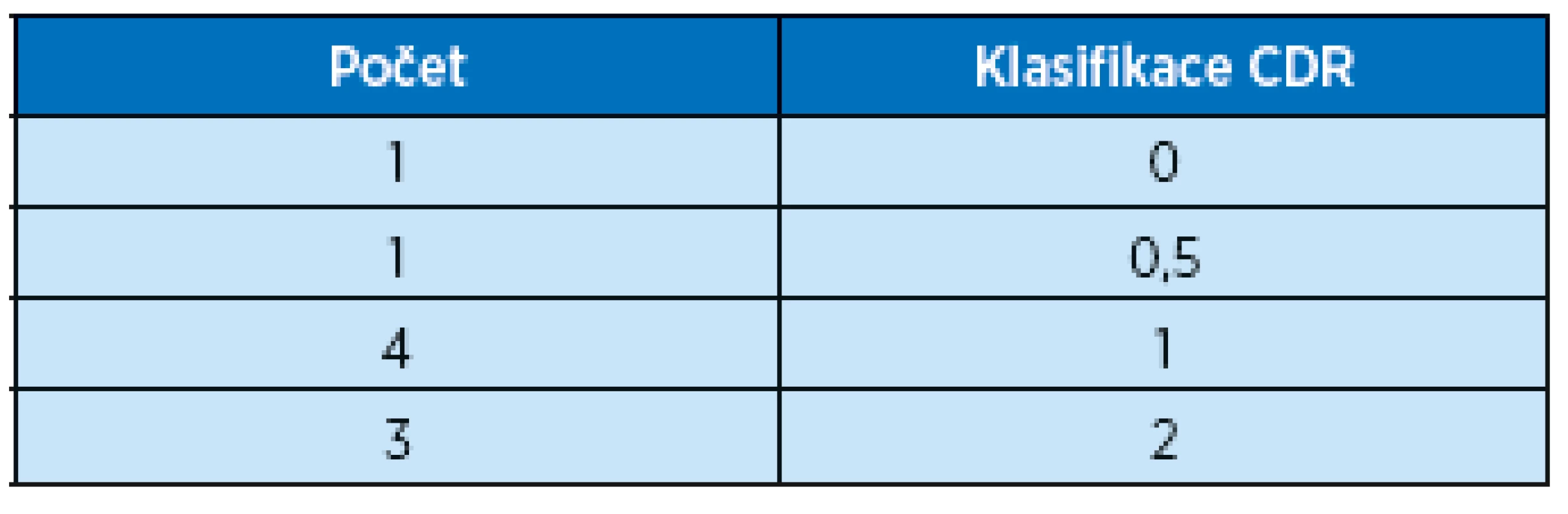
Table 3. Ženy, počet probandek ve studii a jejich stupeň kognitivního postižení 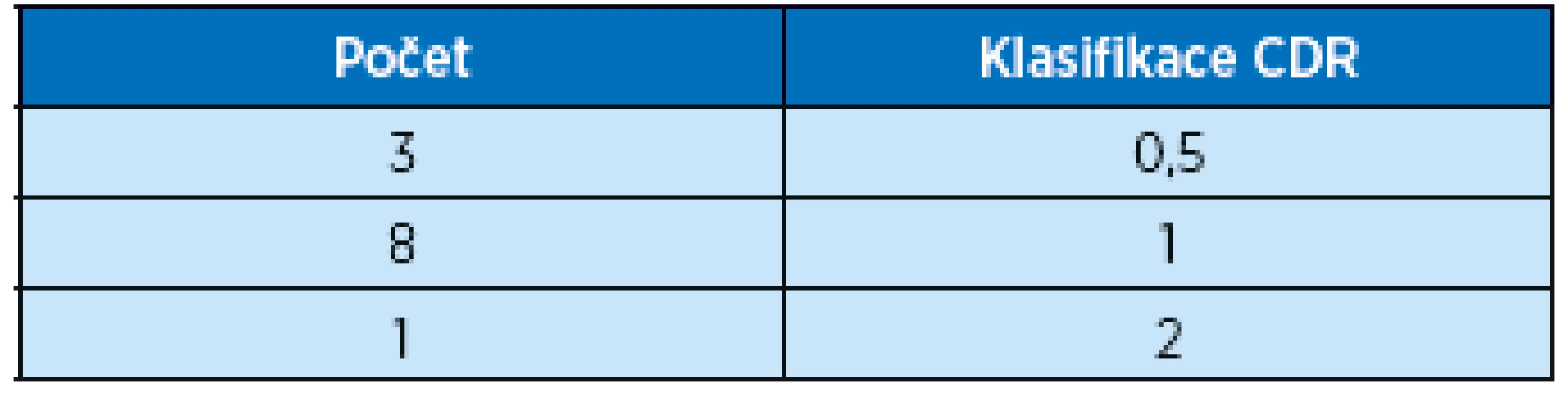
Soubor pacientů s pozitivními paraneoplastickými protilátkami
- Pacient V. J., 84letý, léčený pro recidivující vertigo, kolapsové stavy, s projevy polyneuropatie, dystaxie s levostrannou převahou, s pravostrannou nefrektomií pro tumor v r. 1981, gastrojejunostomie pro chronickou pankreatitis, st. p. cholecystektomii, anemie, bazaliom okolo pravého oka, kognitivní obtíže CDR 1, s nálezem onkoneurální protilátky anti-PNMA2. CT a MR mozku s těžšími atrofickým a vaskulárními změnami, celotělový PET bez konfirmace tumoru. Pacient zemřel v červnu 2016.
- Pacientka M. K., 86letá, léčena pro karcinom střeva s resekcí a kolostomií v péči onkologa, bez známek progrese tumoru, st. p. resekci žaludku pro vředovou chorobu, s ledvinovou insuficiencí, ischemickou chorobou srdeční, AV blok II. st, s kardiostimulátorem, hypertenzí, bércové vředy obou DK, TEP obou kyčelních kloubů. Kognitivní obtíže lehkého stupně (CDR. 1), při poslední kontrole kognitivní zlepšení. Vzhledem k renální insuficienci bez nasazení inhibitoru CHE. Zjištěna pozitivita anti-PNMA2 protilátek.
- Pacientka H. L., 37letá, prodělala v r. 2002 akutní diseminovanou encefalomyelitis, s kvadruparézou a těžkou bulbární symptomatologií, se zavedením PEG, s kortikoterapií. Koncem roku 2014 po protrahovaném infektu HCD měla výpadky paměti, pomalejší PM tempo, s poruchou paměti, diagnostikováno neurologickou klinikou v Motole jako MCI a anxiózně depresivní syndrom. Odebrány paraneuroplastické protilátky s pozitivitou anti-PNMA2. T. č. odeslána na kontrolní vyšetření na neurologickou kliniku v Motole k provedení PET vyšetření.
Závěr
Respektujíce poměrně malý soubor probandů s pozitivní onkoneurální protilátkou PNMA2, nelze s jistotou tvrdit, že jejich kognitivní postižení bylo způsobeno uvedenou protilátkou. Lze však s jistotou konstatovat, že toto kognitivní postižení bylo přítomno. Vhodné by jistě byly další podobné studie více početné.
U pacienta V. J. byl diagnostikován neurologický syndrom dystaxie, polyneuropatie, vertigo, kognitivní deficit a přítomnost protilátky PNMA2, nebyla však prokázána přítomnost tumoru. Podle diagnostického algoritmu PNS je možno pokládat syndrom jako definitivní (tumor nepřítomen, dobře definované onkoneurální Ab přítomny).
Pacientka M. K. – diagnostikován karcinom střeva, léčena onkologem, neurologický syndrom – kognitivní postižení – při kontrole zlepšeno, přítomnost protilátky PNMA2, dle algoritmu možno pokládat syndrom jako definitivní.
Pacientka H. L. – diagnostikován klasický neurologický syndrom, onkoneurální Ab přítomny. Pacientka vyšetřována pro možný tumor. Možná diagnóza bude uzavřena po ukončení vyšetření celotělovým FDG-PET.
Z uvedeného by bylo možné považovat demence s prokázanými onkoneurálními protilátkami v přítomnosti tumoru jako demence sekundární, imunologicky podmíněné s možností možné imunologické terapie.
Doporučené diagnostické postupy
U pacientů s podezřením na imunologicky podmíněné demence se doporučuje provést kompletní fyzikální i laboratorní vyšetření se zaměřením na sekundární demence. V osobní anamnéze se zaměřit na subakutní průběh kognitivních příznaků, na možné rizikové nádorové faktory i autoimunitní onemocnění. Analýza mozkomíšního moku může přinést známky zánětu. Pacienti by měli být doporučeni na MRI a FDG-PET celotělový scan pro potvrzení možného i okultního nádoru. Je doporučováno testování séra i likvoru na možné onkoneurální protilátky, a to jak metodou nepřímé imunofluorescence s konfirmací metodou Western blot. Pokud jsou paraneoplastické protilátky pozitivní a malignita není nalezena, opakování vyšetření v průběhu několika měsíců je vhodné.
Závěr
Má-li být geriatrie základním oborem, bylo by vhodné usilovat i o její košatění, rozšířením o specializace specifické pro tuto věkovou kategorii – např. ambulance kognitivní geriatrie včetně zakládání poraden pro poruchy paměti. Vhodné by bylo zařadit vyšetření onkoprotilátek jako základní vyšetření pro diagnózu imunitně podmíněných demencí.
Studie byla podpořena příspěvkem od Alzheimer nadačního fondu.
MUDr. Jan Reban1,
Eva Bůrková, Dis.1,
RNDr. Zdeňka Vrajová2,
Mgr. Lucie Zajícová3
1Geriatrická ordinace, Poradna pro poruchy paměti České Budějovice
2Imunologická laboratoř, Nemocnice České Budějovice a. s.
3Alzheimercentrum ČB o.p.s.
MUDr. Jan Reban
e-mail: jan.reban@gmail.com
Po ukončení studia na FVL UK (1967) pracoval rok na oddělení klinické farmakologie Institutu Carlo Erba v Miláně, kde se podílel na problematice výzkumu nových geriatrik. Poté působil na interních odděleních v Mělníce a Českých Budějovicích. Od r. 1971 pracuje jako obvodní, později praktický lékař a geriatr v Hluboké n/Vltavou. Byl organizátorem Jihočeských gerontologických dnů a Česko-anglických geriatrických seminářů u nás a Cardiffu, místopředsedou Československé gerontologické společnosti, členem Evropské psychogeriatrické společnosti a vice prezidentem EURAG. Absolvoval dvouletou stáž na univerzitě v Cardifu a Community Memory Clinic. Dále působil jako expert WHO a OSN v oboru geriatrie, podílel se na přípravě programu obou světových shromáždění o stáří. Je spoluautor manuálu o demencích a deontologii, zakladatel Poradny pro poruchy paměti v Hluboké n/Vltavou.
Sources
1. Vyhnálek M, Bartoš A, Dostál V. Diagnostikujeme a léčíme demence správně a včas? Výsledky průzkumu ve světle nových doporučení. Psychiatrie pro praxi 2012; 13(1).
2. Štourač P, Kadaňka Z. Paraneoplastické neurologické syndromy – protilátkový profil a jeho typické varianty. Klinická onkologie 2000; 13 : 5.
3. Štourač P, Ambler Z. Paraneoplastické neurologické syndromy – základní charakteristika, klasifikace, etiopatogeneze a diagnostika. Neurologie pro praxi 2013; 14(1).
4. Bayer A, Reban J. Alzheimer's Disease and Related Conditions. Medea Press 2004
5. McKeon A. Autoimmune Disorders of the Central Nervous Systém. Neurohospitalist 2013; 3(2): 53–64.
6. Ioanidis P, Karatocostas D. How Reversible are Reversible Dementias. European Neurological Review 2011 : 6(4): 230–3.
7. Tales A, Jessen F, Butler CH. Diagnosing Subjective Cognitive Impairment: A Non-Dementia Related Context. Journal of Alzheimer’s Disease 2015. Suppl. 1.
8. Selkoe DJ, Hardy J. The amyloid hypothesis of Alzheimer’s disease at 25 years. EMBO Molecular Medicine 2016; 8 : 595–608.
9. Takemura AF. Immunotherapy for Alzheimer's disease shows promise. Nature 19323, 2016.
10. Rosebloom MH, Smith S, Akdal G, Geshwind M. Immunologically Mediated Dementias. Cur Neurol Neurosci Rep 2009; 9(5): 359–367.
11. Sadeghian H, Vernino S. Progress in the management of paraneoplastic neurological disorders. Ther Adv Neurol Disord 2010; (1): 43–52.
12. Titulaer MJ, Soffietti R, Dalmau J, et al. Screening for tumors in paraneoplastic syndroms: report of EFNS task force. Eur J Neurol 2011; 18(1); 19-e3.
13. Steinman L. Conflicting consequences of immunity to cancer versus autoimmunity to neurons: Insight from paraneoplastic disease. Eur J Immunol 2014 : 3201–3205.
14. Danna-Farber. What is a Checkpoint Inhibitor? Immune Checpoint Inhibitor Definition. Cancer Research 2015.
15. Williams TJ, Benavides DR, Patrice KA, et al. Association of autoimmune encephalitis with combined immune checkpoint inhibitor treatment of metastatic cancer. JAMA Neurol 2016; 6.
16. Baruch K, Deczkowska A, Resenzweig N. PD-1 immune checkpoint blockade reduces pathology and improves memory in mouse models of Alzheimer´s disease. Nat Med 2016 : 135–7.
17. Almuhaideb A, Papathanasiou N, Boman J. F-FDG PET/CT Imaging in oncology. Ann Saudi 2011; 31(1): 3–13.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2017 Issue 3-
All articles in this issue
- Kvalita života ve vztahu k tělesné zdatnosti seniorek: pilotní studie
- Poruchy paměti jako možná součást paraneoplastického neurologického syndromu: imunologicky podmíněné demence
- Prevence pádů hospitalizovaných pacientů – intervenční programy
- Starší řidiči, mobilita a bezpečnost
- Patří pacienti s demencí za volant?
- Senior v dopravě: téma, kterým je třeba se zabývat?
- Příklady typických dopravních nehod seniorů
- Alois Alzheimer a Oskar Fischer – 110. výročí významných publikací o demenci
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Patří pacienti s demencí za volant?
- Prevence pádů hospitalizovaných pacientů – intervenční programy
- Senior v dopravě: téma, kterým je třeba se zabývat?
- Alois Alzheimer a Oskar Fischer – 110. výročí významných publikací o demenci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


