-
Medical journals
- Career
Vizuální a kolorimetrické hodnocení přítomnosti vyšší hladiny sarkosinu v moči
Authors: Z. Tóthová 1; M. Dočekalová 1; M. Staňková 1; D. Uhlířová 1; J. Růžička 1; R. Kizek 1,3
Authors‘ workplace: Prevention Medicals, s. r. o., Oddělení výzkumu a vývoje, Vedoucí: Ing. Miroslav Dosoudil 1; Masarykova univerzita, Farmaceutická fakulta, Ústav humánní farmakologie a toxikologie, Přednosta: doc. MVDr. Pavel Suchý, Ph. D. 2; Wroclaw Medical University, Wroclaw, Polsko, Ústav biomedicínských a environmentálních analýz, Přednosta: prof. dr. hab. Halina Milnerowicz, MD, Ph. D. 3
Published in: Prakt. Lék. 2020; 100(5): 251-256
Category: Of different specialties
Overview
Cíl: Karcinom prostaty je nejčastěji vyskytující se zhoubné nádorové onemocnění mužů. Jeho výskyt se geograficky výrazně liší a narůstá s věkem. Pro rychlou diagnostiku jsou hledány vhodné nádorové markery. Velmi slibným kandidátem je aminokyselina sarkosin (SAR), která je zvýšena v moči u zhoubného nádoru. Cílem této práce je vývoj jednoduché, rychlé a spolehlivé metody pro detekci SAR v lidské moči.
Materiál a metody: Vzorky umělé moči (15 typů) byly připraveny podle dostupných protokolů. Elektrochemická analýza byla provedena potenciometricky a voltametricky. Teplotní testy stability sarkosin oxidázy (SOX) byly provedeny při teplotách –5, 25, 30, 35, 40, 45 a 60 °C. Lyofilizace byla provedena po dobu 72 h (0,1 mbar, –80 °C). Na začátku a na konci experimentu byl test hodnocen vizuálně. Získané fotografie byly podrobeny matematické analýze (hodnocení barevné intenzity signálu).
Výsledky: Složení moči je velmi variabilní a obsahuje celou řadu odpadních metabolitů, léčiv a dalších interferentů. Umělá moč je vhodnou matricí pro studium změn aktivity SOX. Aktivita SOX (1 U/ml) byla sledována (Trinderovou reakcí) jako hydrolýza sarkosinu (60 min, 125 µM SAR, 0,4 mM AAP). V experimentu se pozoroval vliv přídavku interferentů (Cd, Pb, Zn a léky), kdy se inhibice SOX pohybovala v rozmezí 10–20 %. Enzym SOX byl zahříván, mražen a lyofilizován. Výsledky ukazují, že enzym je stabilní při teplotách 5–60 °C (pokles signálu o 10 % za 200 h). Teploty nad 60 °C vedou k inaktivaci enzymu (pokles signálu o 90 % při 120 min). Nízké teploty (–5 °C až –20 °C) nevedly po 5 týdnech k poklesu signálu. Vizuální výsledky jsou sumarizovány jako průměrná hodnota denzity RGB signálu v dané studované skupině vzorků (n = 10). Získané výsledky ukazují, že průměrná variabilita RGB signálu mezi jednotlivými testovanými vzorky byla 7,4 %. Z těchto hodnot byla určena ROC křivka jednotlivých experimentů (n = 5). Pomocí ROC křivek byla vypočítána senzitivita (od 0,59 do 0,83) a specificita (1) podle druhu umělých močí. ROC křivky byly z 26,7 % hodnoceny jako výborné, z 66,6 % jako velmi dobré z 6,6 % jako dobré a žádná jako nevyhovující.
Závěr: Byla provedena studie stanovení pro aminokyselinu sarkosin za využití enzymatické reakce. Vizuální vyhodnocení testu ukázalo 100% úspěšnost identifikace přítomnosti sarkosinu v umělé moči. Získaná data ukazují na potenciál metody pro vizuální hodnocení přítomnosti sarkosinu v moči.
Klíčová slova:
sarkosin – zhoubné nádory prostaty – biosenzor – vizuální test
ÚVOD
Karcinom prostaty je nejčastěji se vyskytující zhoubné nádorové onemocnění mužů (1–3). Podle statistik WHO je celosvětově každý rok diagnostikováno více než 1,1 milionu nových případů a evidováno asi 307 tisíc zemřelých mužů. V Evropě je každoročně zaznamenáno asi 190 tisíc nově diagnostikovaných případů a 80 tisíc zemřelých (1). Výskyt karcinomu prostaty se geograficky výrazně liší a narůstá s věkem (1). Pro rychlou diagnostiku jsou hledány vhodné nádorové markery (4–8). Velmi slibným biochemickým kandidátem je aminokyselina sarkosin (N-methylglycin) (9, 10). Sarkosin je aminokyselina, která je součástí metabolických drah glycinu, serinu a threoninu. Sarkosin může vznikat methylací glycinu působením enzymu glycin N-methyltransferázy (EC 2.1.1.20) (11) (obr. 1).
V řadě prací bylo zjištěno, že množství sarkosinu v krvi se pohybuje v jednotkách mikromolárních koncentrací (12, 13). V případě některých onemocnění jako je sarkosinemie a glutarová acidurie typu II se vyskytují zvýšené hodnoty sarkosinu v krvi a moči (13). Sarkosinemie je velmi vzácná metabolická porucha, která nemá přesně definované klinické projevy. U onemocnění dochází k vzestupu hladiny sarkosinu v moči i krevní plazmě (13). Analyzované hodnoty sarkosinu se v těchto případech mohou pohybovat v desítkách až stovkách mikromolárních koncentrací. Uvedená biologická relevance sarkosinu je významná, a proto je důležité hledat vhodné techniky jeho rychlé a spolehlivé detekce. Pro detekci sarkosinu se využívá řady analytických technik: fotometrie, elektrochemie, hmotnostní detekce a kapalinová chromatografie (14–19). Tyto techniky umožňují stanovení aminokyseliny selektivně a vysoce senzitivně (20, 21). Enzymatické metody jsou velmi vhodné pro automatizované stanovení kreatininu, kyseliny močové, triacylglycerolu, cholesterolu, glukózy a případně dalších analytů využívající Trinderovy reakce (22). Reakce je založena na použití vhodného barviva (jako je aminoantipyrin a další vhodné molekuly) v přítomnosti peroxidu vodíku a peroxidázy (23). Při reakci vzniká chinoniminové barvivo, které je vyhodnoceno fotometricky (24, 25). Zavedení této reakce do klinické biochemie přineslo ve spojení se substrátově specifickými enzymy výrazné zlepšení specificity a selektivity (26). Nanomedicínské přístupy přinášejí technologie s vysokou senzitivitou, specificitou a výrazně nižšími provozními náklady a jsou aplikovatelné pro analýzu biomolekul (2, 27, 28).
METODIKA
Kolorimetrické hodnocení. Měření probíhalo na spektrofotometru UV-3100 PC (VWR, USA). Pro měření byly použity plastové kyvety (UV-VIS, BRAND, USA). Do kyvety bylo napipetováno 500 µl činidla a následně 100 µl vzorku. Jako slepý vzorek byl použit reakční roztok. Měření probíhalo v oblasti 250–650 nm. Použité koncentrace sarkosinu byly 0–50 µM. Kalibrační křivka sarkosinu měla koeficient korelace r = 0,998, rovnici regrese y = 0,00239 + 0,00232x, RSD = 2,5 % a LOQ = 3 µM. Spektrofotometrické měření probíhalo také na polystyrenové mikrotitrační destičce, která byla předem promyta 18 MΩ vodou (3krát, 300 µl), za laboratorní teploty pomocí readeru (TECAN, Švýcarsko). Do jamky destičky se pipetovalo 50 µl vzorku a 250 µl činidla.
Vizuální hodnocení. Skleněná lahvička obsahuje zlaté magnetické nanočástice s navázanými enzymy. Celkový objem v lahvičce pro hodnocení je 1000 µl. Reakční roztok obsahuje komponenty pro barevné zviditelnění přítomnosti sarkosinu. Barevná reakce byla vyhodnocena vizuálně a statisticky zpracována v Laboratorním informačním systému (barevná lahvička – pozitivní; bezbarvá lahvička – negativní).
Reakční roztok obsahoval 4-AAP (4-aminoantipyrin), sarkosin oxidázu, křenovou peroxidázu v 0,2 M fosfátovém pufru (pH 8). Po napipetování vzorku do reakčního roztoku probíhala 30minutová inkubace.
Testovací vzorky. Vzorky umělé moči (15 typů) byly připraveny podle dostupných protokolů (29–31).
VÝSLEDKY
Princip kolorimetrického hodnocení sarkosinurie
Aminokyseliny jsou bezbarvé a jejich přímé fotometrické stanovení je obtížné. Vhodnou možností analýzy aminokyselin jsou reakce s chromoforem za vzniku barevných komplexů (32). Sarkosin oxidáza je specifický enzym, který hydrolyzuje pouze aminokyselinu sarkosin na glycin, za vzniku vedlejších produktů peroxidu vodíku a formaldehydu (viz obr. 1A). Následně lze stanovit vzniklý peroxid vodíku za využití Trinderovy reakce (viz obr. 1B) (3, 26, 33, 34). Fenol reaguje s peroxidem vodíku a 4-aminoantipyrinem za katalýzy enzymem peroxidázou a vzniká 4-(p-benzochinon-monoimino)-fenazon detekovatelný spektrofotometricky při 510 nm. Složení přirozené moči je velmi variabilní a obsahuje celou řadu odpadních metabolitů, léčiv a dalších interferentů. Umělá moč je vhodnou matricí pro studium změn aktivity SOX.
Image 1. Předpokládané schéma části metabolických drah metabolismu sarkosinu.
U zdravého člověka je sarkosin primárně metabolizován sarkosin oxidázou na glycin.
Další podrobnosti je možné nalézt v publikacích (9, 10). Schéma reakčního mechanismu
Trinderovy reakce na SPION nanočásticích. Částice je modifikována AuNPs/CS a SOX/HRP;
SPION (Fe2O3 magnetická částice); AuNPs (zlatá nanočástice), SOX (sarkosin oxidáza), HRP
(křenová peroxidáza). Reakcí se vytváří barevný produkt pomocí 4-aminoantipyrinu.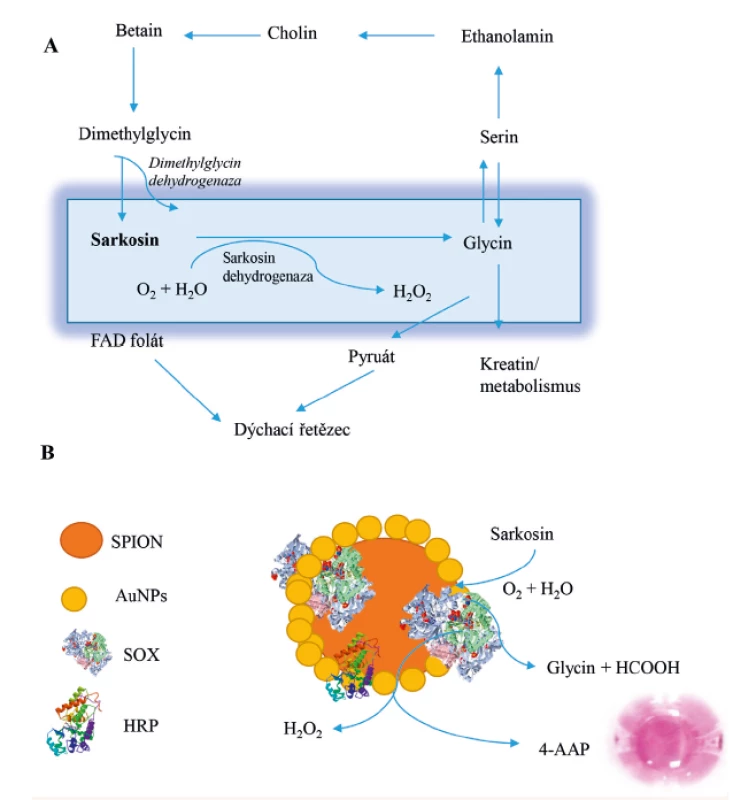
Typický obraz provedeného testu na přítomnost sarkosinu je ukázán na obrázku 2. Hraniční koncentrace je velmi dobře rozlišitelná od negativního výsledku (LOD = 5 µM, LOQ = 14 µM, RSD = 20 %). Při splnění této podmínky byl test dále podrobně vizuálně hodnocen. Mezi základní parametr ukazatele vhodnosti testu patří vyhodnocení ROC křivek a tím specificity a senzitivity testu. Byly připraveny testovací série (n = 5), kdy byly na destičky naneseny vzorky močí. Artificiální moč byla obohacena o několik koncentrací sarkosinu (216, 166, 125, 62,5, 31,2, 15,6 a 0 µM). Následně byl přidán reakční roztok a barevná reakce byla vyvíjena po dobu 30 minut (obr. 3) (35). Následně byla každá série vzorků (15 typů umělých močí, 12 opakování v sedmi různých koncentracích sarkosinu) fotograficky zachycena a následně vizuálně hodnocena. Každý provedený test byl hodnocen v nezávislých opakováních (n = 4). Jednotlivé výsledky byly označeny jako pravdivě pozitivní, falešně negativní nebo pravdivě negativní. Výsledky hodnocení byly zpracovány statisticky metodou vyhodnocení ROC křivky (na hladině 95 %). Tabulka 1 shrnuje dosažené výsledky kolorimetrického testu, kdy senzitivita byla 1 (žádný falešně pozitivní výsledek). Specificita testu byla v rozsahu 0,6 až 0,8. Podle běžně dostupné klasifikace byl test hodnocen v 26 % jako výborný, 66 % jako velmi dobrý a 6 % jako dobrý. Výsledky hodnocení vizuálního testu jsou sumarizovány jako průměrná hodnota denzity RGB signálu v dané studované skupině vzorků (n = 10).
Image 2. Typické VIS spektrum průběhu Trinderovy reakce v závislosti na koncentraci sarkosinu po 15 min reakce. Podmínky: 600 μl, SOX 1 U/ml, sarkosin (0, 10, 25, 50, 100 μM), sken 2 nm, 250 až 800 nm (A). Typická reakční křivka průběhu enzymatické reakce (SOX) při hydrolýze sarkosinu (100 μM). Ve spodní části obrázku je ukázán vizuální vzhled průběhu reakce. Podmínky: 300 μl, SOX 1 U/ml, sarkosin (0, 15,6, 31,2, 62,5, 125, 166, 216 μM), sken 2 nm, 540 nm, reakční čas 60 min (B). 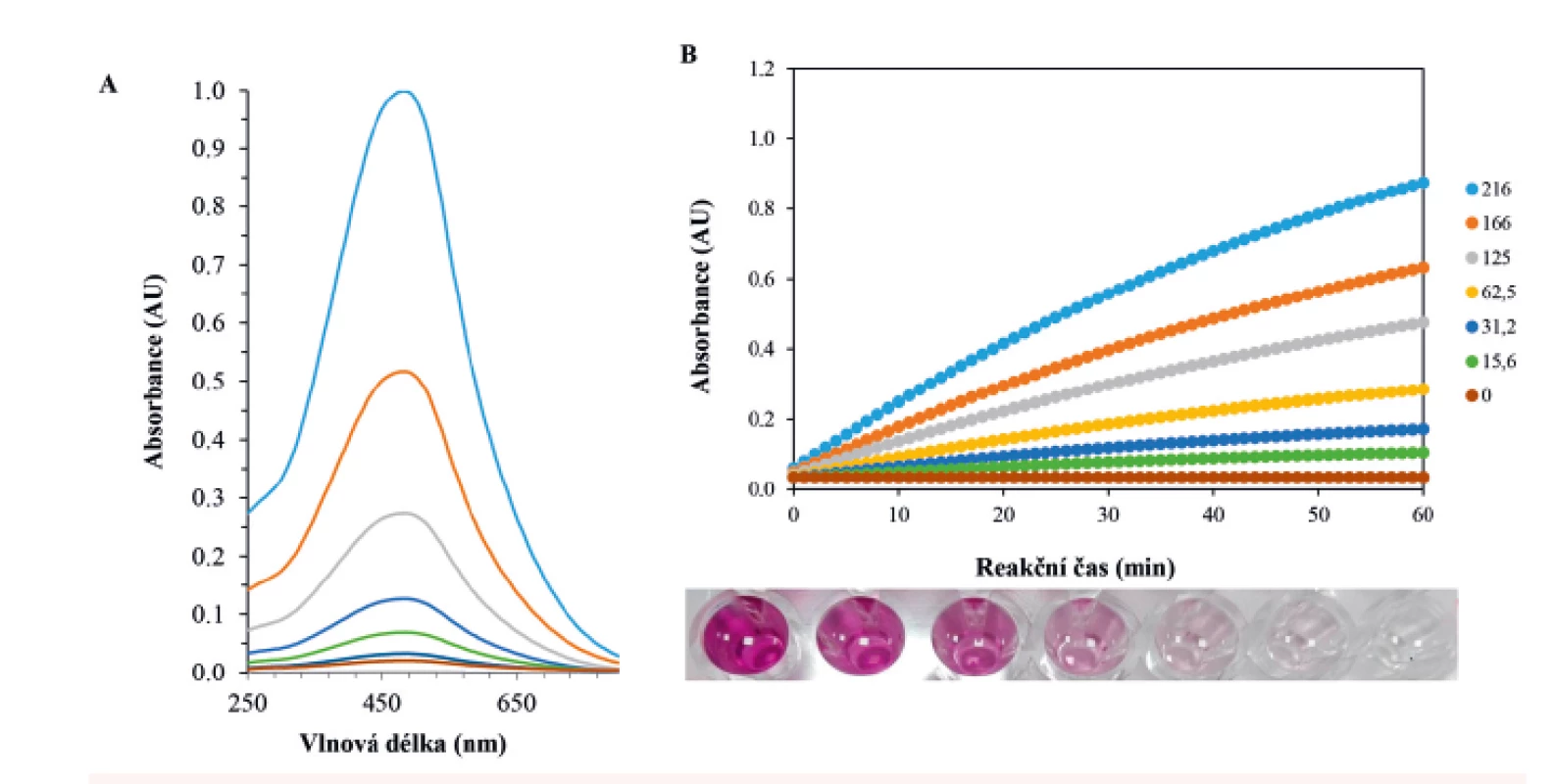
Image 3. Typický obraz vizuálního testu na přítomnost sarkosinu v různých typech umělých močích (fosfátový pufr – kontrola, AU-N, Gly-1, Pro-1, Pro-2, Keto-2, pH-1, pH-2, Hemog, Brown, Opalko, Grases, Christmas, Bact, Mayrovitz, Chutipongtande). Koncentrace sarkosinu 216, 166, 125, 62,5, 31,2, 15,6 a 0 μM. Výsledné barevné reakce po 30minutové reakci. Fotodokumentace Canon 10 Mpx. Každý obraz byl hodnocen (n = 5). Další podrobnosti jsou uvedeny v části Metody. 
Table 1. Hodnocení senzitivity a specificity kolorimetrického testu 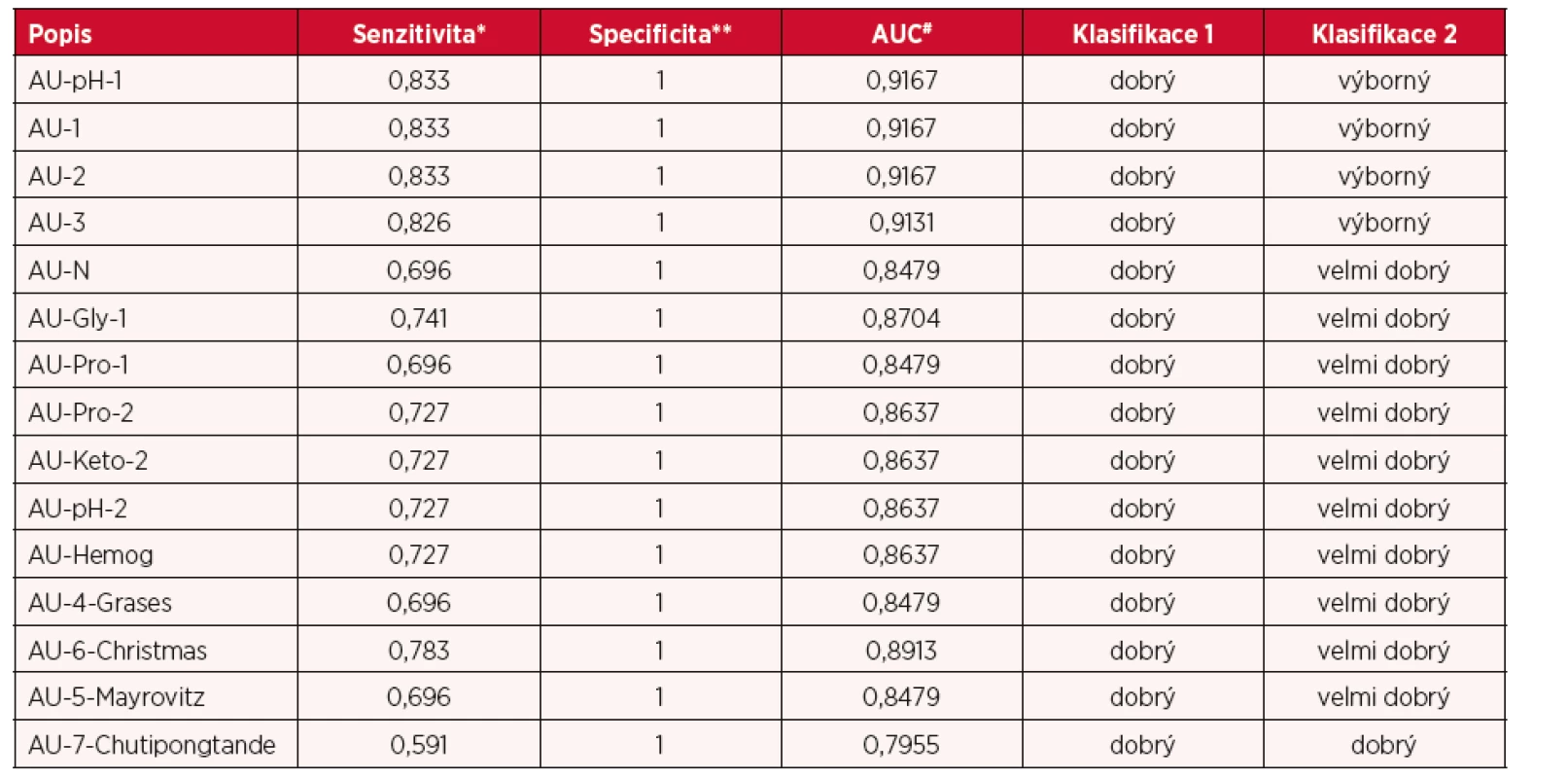
*SPEC = 1 – FP/(FP + TN), **SENZ = TP/(TP + FN) Vliv interferentů. V experimentu se pozoroval vliv přídavku interferentů (Cd, Pb, Zn a léčiv, 100 µM), kdy se inhibice SOX pohybovala v rozmezí 10–20 %. Enzym SOX byl zahříván, mražen a lyofilizován. Výsledky ukazují, že enzym je stabilní při teplotách 5–60 °C (pokles signálu o 10 % za 200 h). Teploty nad 60 °C vedou k inaktivaci enzymu (pokles signálu o 90 % za 120 min). Nízké teploty (–5 °C až –20 °C) nevedly po 5 týdnech k poklesu signálu.
Princip vizuálního hodnocení sarkosinurie
Test byl proveden s přídavky sarkosinu (216, 166, 125, 62,5, 31,2, 15,6 a 0 µM) za běžné laboratorní teploty, po dobu 30 minut. Výsledná barevná reakce byla fotograficky zaznamenána. Jednotlivé obrazy byly vizuálně hodnoceny (n = 5). Každý vzorek byl posouzen, zda poskytoval nebo neposkytoval barevnou reakci. LOD byla určena jako koncentrace sarkosinu v moči, kterou bylo možné vizuálně rozpoznat. Všechna získaná data byla následně matematicky vyhodnocena. Byla určena ROC křivka jednotlivých experimentů (n = 4). Pomocí ROC křivek byla vypočítána senzitivita od 0,78 do 1 a specificita 1 podle druhu umělých močí. ROC křivky byly z 26,6 % hodnoceny jako vynikající, ze 46,6 % jako výborné, z 23,3 % jako velmi dobré, z 3,3 % jako dobré a žádná jako nevyhovující (tab. 2).
Table 2. Hodnocení senzitivity a specificity vizuálního testu 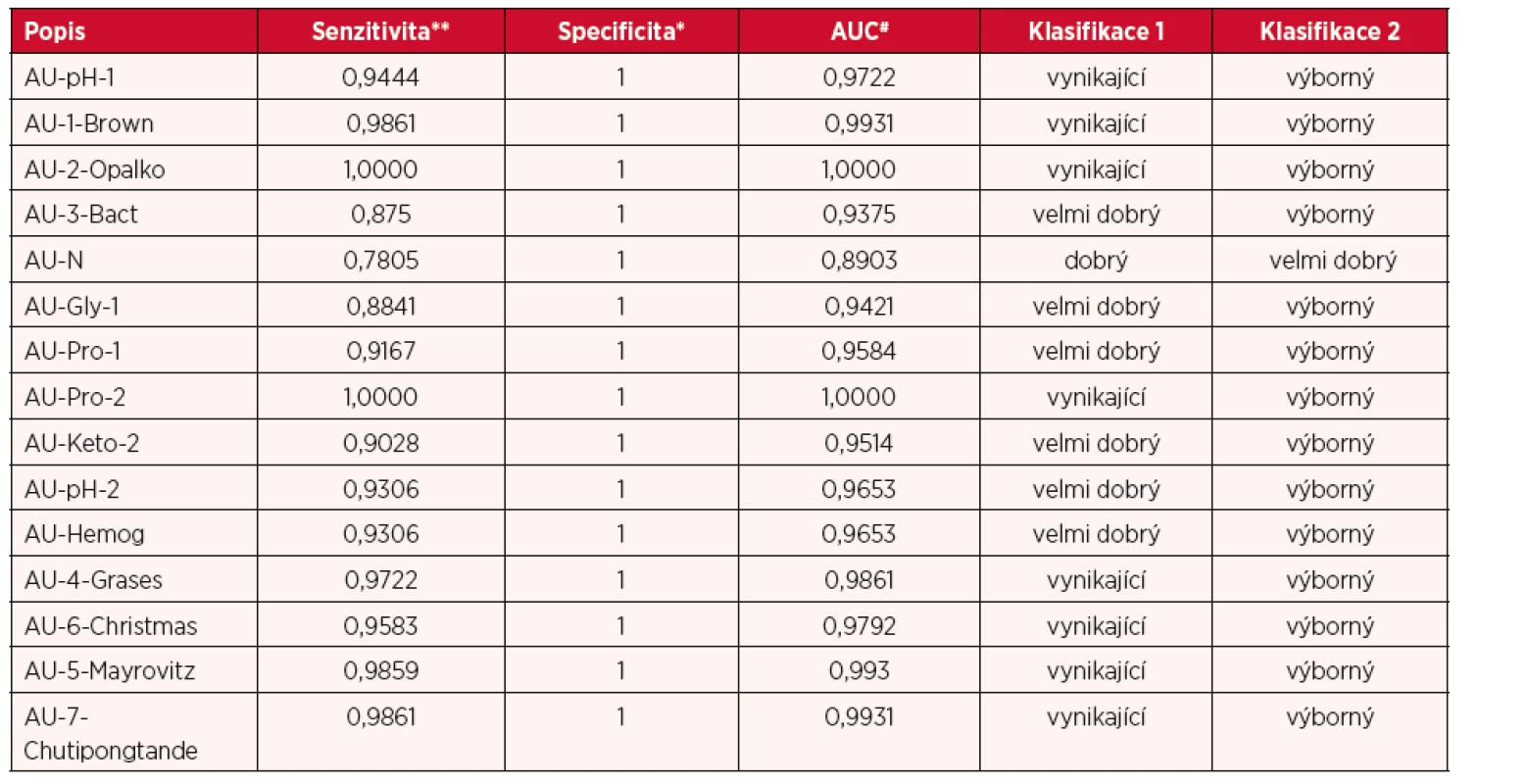
*SPEC = 1 – FP/(FP + TN), **SENZ = TP/(TP + FN) ZÁVĚRY PRO KLINICKOU PRAXI
Sarkosinurie byla hodnocena kolorimetricky a vizuálně. Ze získaného statistického vyhodnocení testu ROC křivkami byla potvrzena 100% úspěšnost identifikace přítomnosti sarkosinu. Získaná data ukazují na potenciál enzymatické metody pro vizuální hodnocení přítomnosti sarkosinu v moči.
Práce byla realizována za podpory projektu SarkoTest 165/2015 Liga proti rakovině Praha a The European Technology Platform for Nanomedicine.
Konflikt zájmů: žádný.
ADRESA PRO KORESPONDENCI:
prof. Ing. René Kizek, PhD., DrSc., MBA
Farmaceutická fakulta MU
Palackého tř. 1946/1, 612 00 Brno
e-mail: kizek@sci.muni.cz
Sources
1. Barbieri CE, Chinnaiyan AM, Lerner SP, et al. The Emergence of Precision Urologic Oncology: A Collaborative Review on Biomarker-driven Therapeutics. Eur Urol 2017; 71 : 237–246.
2. Altwaijry N, Somani S, Dufes Ch. Targeted nonviral gene therapy in prostate cancer. Int J Nanomed 2018; 13 : 5753–5767.
3. Trinder P. Determination of blood glucose using 4-amino phenazone as oxygen acceptor. J Clin Pathol 1969; 22.
4. Sawyers CL. The cancer biomarker problem. Nature 2008; 452 : 548–552.
5. Gil J, Ramirez-Torres A, Encarnacion-Guevara S. Lysine acetylation and cancer: A proteomics perspective. J Proteomics 2017; 150 : 297–309.
6. Maurer T, Eiber M. Practice changing for prostate cancer: a vision of the future. Nat Rev Urol 2019; 16 : 71–72.
7. Heitzer E, Haque IS, Roberts CES, et al. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nat Rev Genetics 2019; 20 : 71–88.
8. Zachoval R, Dusek L, Babjuk M. Screening karcinomu prostaty v České republice. Prakt. Lék. 2019; 99 : 102–109.
9. Sreekumar A, Poisson LM, Rajendiran TM, et al. Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression. Nature 2009; 457 : 910–914.
10. Cernei N, Heger Z, Gumulec J, et al. Sarcosine as a potential prostate cancer biomarker – a review. Int J Mol Sci 2013; 14 : 13893–13908.
11. Kanehisa M, Goto S. KEGG PATHWAY: Glycine, serine and threonine metabolism. Encyclopedia of Genes and Genomes 2010.
12. Gkotsos G, Virgiliou C, Lagoudaki I, et al. The role of sarcosine, uracil, and kynurenic acid metabolism in urine for diagnosis and progression monitoring of prostate cancer. Metabolites 2017; 7 : 14.
13. Lee SY, Chan KY, Chan AYW, et al. A report of two families with sarcosinaemia in Hong Kong and revisiting the pathogenetic potential of hypersarcosinaemia. Annal Acad Med Singapore 2006; 35 : 582–584.
14. Cernei N, Zitka O, Ryvolova M, et al. Spectrometric and Electrochemical Analysis of Sarcosine as a Potential Prostate Carcinoma Marker. Int J Electrochem Sci 2012; 7 : 4286–4301.
15. Huang Y, Huang XB, Huang LP, et al. Three-phase solvent bar liquid-phase microextraction combined with high-performance liquid chromatography to determine sarcosine in human urine. J Sep Sci 2018; 41 : 3121–3128.
16. Narwal V, Kumar P, Joon P, et al. Fabrication of an amperometric sarcosine biosensor based on sarcosine oxidase/chitosan/CuNPs/c-MWCNT/Au electrode for detection of prostate cancer. Enzym Microb Technol 2018; 113 : 44–51.
17. Kumar P, Jaiwal R, Pundir CS. An improved amperometric creatinine biosensor based on nanoparticles of creatininase, creatinase and sarcosine oxidase. Anal Biochem 2017; 537 : 41–49.
18. Josypcuk O, Barek J, Josypcuk B. Construction and application of flow enzymatic biosensor based of silver solid amalgam electrode for determination of sarcosine. Electroanalysis 2015; 27 : 2559–2566.
19. Gonzalez-Solino C, di LorenzoM. Enzymatic fuel cells: towards self-powered implantable and wearable diagnostics. Biosensors-Basel 2018; 8 : 18.
20. Samanta S, Rahaman SZ, Roy A, et al. Understanding of multi-level resistive switching mechanism in GeOx through redox reaction in H2O2/sarcosine prostate cancer biomarker detection. Sci Rep 2017; 7 : 12.
21. Berthias F, Maatoug B, Glish GL, et al. Resolution and Assignment of differential ion mobility spectra of sarcosine and isomers. J Am Soc Mass Spectrom 2018; 29 : 752–760.
22. Uhlirova D, Stankova M, Docekalova M, et al. A rapid method for the detection of sarcosine using SPIONs/Au/CS/SOX/NPs for prostate cancer sensing. Int J Mol Sci 2018; 19 : 29.
23. Uhlirova D, Docekalova M, Stankova M, et al. A rapid ELISA method for the detection of sarcosine using pseudoperoxidase activity of gold nanoparticles. 9th International Conference on Nanomaterials – Research & Application 2018 : 524–530.
24. Jia J, Liu G, Li S, et al. Urine sample hepatitis B virus covalently closed circular DNA sarcosine quantitative detection method, involves detecting quantitative rate of sarcosine solution, and calculating content of sarcosine in urine sample. Patent CN102662013-A CN10154590 2012 : 7.
25. Stankova M, Ruttkay-Nedecky B, Docekalova M, et al. Fotometrická detekce aminokyseliny sarkosinu za využití jeho hydrolýzy sarkosin oxidasou. Chem Listy 2019; 113 : 603–609.
26. Wiewiorka O, Dastych M, Cermakova Z. Trinderova reakce v klinické biochemii – přínosy a limity. Chem Listy 2017; 111 : 186–191.
27. Lan JM, Xu WM, Wan QP, et al. Colorimetric determination of sarcosine in urine samples of prostatic carcinoma by mimic enzyme palladium nanoparticles. Anal Chim Acta 2014; 825 : 63–68.
28. Rebelo TSCR, Pereira CM, Sales MGF, et al. Sarcosine oxidase composite screen-printed electrode for sarcosine determination in biological samples. Anal Chim Acta 2014; 850 : 26–32.
29. Pietrzynska M, Voelkel A. Stability of simulated body fluids such as blood plasma, artificial urine and artificial saliva. Microchem J 2017; 134 : 197–201.
30. Chutipongtanate S, Thongboonkerd V. Systematic comparisons of artificial urine formulas for in vitro cellular study. Anal Biochem 2010; 402 : 110–112.
31. Shmaefsky BR. Artificial urine for laboratory testing. Amer Biol Teacher 1990; 52 : 170–172.
32. Yamkamon V, Phakdee B, Yainoy S, et al. Development of sarcosine quantification in urine based on enzyme-coupled colorimetric method for prostate cancer diagnosis. EXCLI J 2018; 17 : 467–478.
33. Jones PF, Johnson KE. Estimation of phenols by the 4-aminoantipyrine method: Identification of the colored reaction products by proton magnetic resonance spectroscopy. Canad J Chem 1973; 51 : 2860–2868.
34. Vecera M. Detection and identification of organic compounds. Boston, USA: Springer 1971; 1 : 1–150.
35. Uhlirova D, Docekalova M, Stankova M, et al. Quantitatively determining sarcosine in biological sample, involves using anti-sarcosine antibodies and peroxidase-like activity gold nanoparticles, or anti-sarcosine antibodies and quantum dots. Patent EP176436.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2020 Issue 5-
All articles in this issue
- Úloha imunity u zhoubných novotvarů, dvojsečný meč?
-
Vaskulárny Ehlersov-Danlosov syndróm (Sackov-Barabasov syndróm) –
multiorganomultivaskulárna choroba - Cvičenie v liečbe nealkoholického stukovatenia pečene (NAFLD)
- Možnosti hodnocení stability v klinické praxi u pacientů s možným rizikem pádu
- Hodnocení poruch motorické kontroly u pacientů s nespecifickými bolestmi zad v bederním úseku páteře v ordinaci praktického lékaře
- Hodnocení strachu u pacientů před plánovanou operací
- Elektronická neschopenka
- Vizuální a kolorimetrické hodnocení přítomnosti vyšší hladiny sarkosinu v moči
- Nová forma glukagonu – práškový glukagon pro nosní aplikaci
- Před 500 lety plul Fernao de Magalhães (1480–1521) kolem světa
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Elektronická neschopenka
- Hodnocení strachu u pacientů před plánovanou operací
- Možnosti hodnocení stability v klinické praxi u pacientů s možným rizikem pádu
-
Vaskulárny Ehlersov-Danlosov syndróm (Sackov-Barabasov syndróm) –
multiorganomultivaskulárna choroba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

