-
Medical journals
- Career
Všeobecný prehľad o perkutánnej endoskopickej gastrostómii
Authors: Z. Ďurkovičová 1; M. Jakabovičová 1; L. Slezáková 2; M. Szántová 1; V. Mojto 1
Authors‘ workplace: Lekárská fakulta Univerzity Komenského v Bratislave a Univerzitnej nemocnice v Bratislave, Nemocnica akademika Ladislava Dérera, III. Interná klinika, Prednosta: doc. MUDr. Viliam Mojto, CSc., MHA 1; Dialyzačné stredisko Bratislava – Nové Mesto, Vedúci lekár: MUDr. Ľubomír Polaščín 2
Published in: Prakt. Lék. 2020; 100(2): 59-64
Category: Reviews
Overview
Perkutánna endoskopická gastrostómia (PEG) je v súčasnosti obľúbeným spôsobom dlhodobého podávania enterálnej výživy u vybranej skupiny pacientov. Napriek tomu, že je to bezpečná endoskopická metóda, môžu sa vyskytnúť ľahké alebo závažné komplikácie. Poznanie týchto komplikácii, ako aj poznanie postprocedurálnej starostlivosti o PEG, je základom zlepšovania kvality života pacientov so zavedenou PEG. Cieľom tohto článku je priblížiť nielen indikácie, ale aj komplikácie PEG a ich riešenie.
Klíčová slova:
perkutánna endoskopická gastrostómia (PEG) – indikácie – komplikácie – enterálna výživa
ÚVOD
Perkutánna endoskopická gastrostómia (PEG) je zavedenie výživového setu za účelom podávania výživy priamo do žalúdka cez brušnú stenu. Laparotomicky vedená gastrostómia bola po celé dekády zlatým štandardom priamej enterálnej výživy. Prielom v gastrostómiách a následne aj jejunostómiách bola v roku 1980 perkutánna endoskopická gastrostómia (PEG) predstavená v Clevelande (Ohio) detským chirurgom Ponskym. Od začiatku boli jej hlavné benefity nízkonákladovosť a minimálne invazívna technika výkonu bez nutnosti použitia celkovej anestézy u väčšiny pacientov. Zároveň ponúkla stredne až dlhodobé riešenie enterálneho výživového vstupu s nižšou periprocedurálnou mortalitou (0,5–2 %) a nižším počtom komplikácií (24). Primárnou indikáciou enterálnej a parenterálnej výživy je zabezpečenie nutričnej podpory a požiadaviek metabolizmu u pacientov s nedostatočným perorálnym príjmom. Všeobecne sa odporúča začať s enterálnou výživou už po 6 – 12 hodinách po traume, po resekcii čreva po 24 – 48 hodinách (17). Enterálna výživa je jednoduchšia, bezpečnejšia a účinnejšia v predchádzaní infekčných, metabolických a technických komplikácií u kriticky chorých a v neposlednom rade je aj ekonomicky dostupnejšia.
Cieľom práce je podať všeobecný prehľad indikácii a komplikácií PEG a zároveň podať aj možnosti riešenia komplikácií. V práci je súčasne zahrnutý aj stručný pohľad na zavedenie PEG a jeho kontraindikácie.
NAJČASTEJŠIE INDIKÁCIE PUNKČNEJ GASTROSTÓMIE
Neurologické ochorenia
Cerebrovaskulárne ochorenia/cievne mozgové príhody
Dysfágia na podklade neurologických ochorení je jednou z najčastejších indikácií na zavedenie PEG a súčasne je aj najčastejšou komplikáciou cievnych mozgových príhod (CMP). Postihuje až 45 % hospitalizovaných pacientov (13). Ak je predpoklad dlhodobejšej rekonvalescencie hltania ako 4 týždne, je nutné zvážiť indikáciu PEG (8). V prípade obnovenia hltacieho aktu u pacienta je možné PEG kedykoľvek odstrániť.
Ochorenia motoneurónov
Ochorenia motoneurónov (amyotrofická laterálna skleróza (ALS), progresívna bulbárna paralýza a progresívna svalová atrofia) sú štandardnou indikáciou na výživu PEG. U niektorých pacientov sa metódy zavedenia PEG modifikujú pre zmenené anatomické pomery, taktiež insuflácia vzduchu počas a po výkone musí byť minimálna, keďže je postihnutý aj pohyb dýchacích svalov, predovšetkým bránice (13). Aj keď existujú práce o bezpečnosti zavádzania PEG u pacientov s alterovanými respiračnými funkciami, Czell et al. (9) popisuje, že zavedenie PEG je bezpečnejšie s použitím miniinvazívnej ventilácie s minimálnymi peri - a postprocedurálnymi komplikáciami.
Psychomotorická retardácia
Pacienti s psychomotorickou retardáciou sú náchylní na malnutríciu a gastroezofageálny reflux (GER). Štúdie dokázali dlhodobú úspešnosť PEG výživy so zlepšením nutričného statusu u ťažko mentálne aj fyzicky postihnutých dospelých aj detských pacientov. V tejto skupine pacientov sa preukázala vhodnejšia nutričná PEG-J ako PEG vzhľadom na GER a vysoké riziko aspirácie (19).
Demencia
Poruchy príjmu potravy sú jedným zo symptómov pokročilej demencie so 6 mesačnou mortalitou u 25% pacientov (21). Nezávisle od veku, pacienti s demenciou so zavedeným PEG mali horšiu prognózu ako pacienti bez PEG s 54% mortalitou po 1 mesiaci od zavedenia a 90 % po 1 roku od zavedenia, pričom potreba enterálnej výživy a prevencia malnutrície u pacientov s demenciou je nesporná, no zatiaľ nie sú dáta podporujúce fakt, že by zavedenie PEG a výživa cez PEG zlepšovali prežívanie u týchto pacientov (1).
Onkologická ochorenia
Viac ako 40 % pacientov s onkologickým ochorením trpí určitým stupňom malnutrície (3). Zavedenie PEG v profylaktickom režime je spojené s nižším výskytom periprocedurálnych komplikácií v porovnaní s terapeutickým zavedením (20). Taktiež sa zavedenie PEG odporúča pacientom s dysfágiou a stratou hmotnosti alebo pacientom so stratou hmotnosti počas onkologickej liečby, pričom 20 % pacientov vyžaduje nutričnú podporu cez PEG viac ako 1 rok (6).
Gastrická dekompresia pri črevnej obštrukcii
U pacientov s gastrointestinálnou (GI) stenózou alebo ileom môže gastrická sonda slúžiť ako drenážne zariadenie s redukciou epizód nauzey a vracania. Malígna obštrukcia alebo stenóza gastrointestinálneho traktu je často dôsledkom terminálneho onkologického ochorenia (32). Chirurgické riešenie častokrát nie je možné, preto je namieste drenáž a dekompresia nazogastrickou alebo nazojejunálnou sondou. PEG bol pôvodné vyvinutý ako dlhodobý spôsob výživy pacienta, no našiel uplatnenie aj ako dekompresný PEG pri malígnych aj nemalígnych stenózach v gastrointestinálnom trakte a v prípade potreby výživy je možné cez PEG extenziou zaviesť jejunálnu sondu buď za účelom dekompresie postpylorickej časti, alebo podávania enterálnej výživy (14).
Cystická fibróza, chronická obštrukčná choroba pľúc (CHOBPCH)
U pacientov s chronickým pľúcnym ochorením ako cystická fibróza alebo chronická obštrukčná choroba je lepší nutričný status v priamej korelácii s lepším prežívaním pacientov (15). Enterálna výživa má nezastupiteľnú úlohu v zlepšovaní výživy a pľúcnych funkcií týchto pacientov. Preto niektorí špecialisti odporúčajú radšej skoršie zavedenie vstupu pre enterálnu výživu ako neskoršiu korekciu malnutrície u pacientov s chronickým pľúcnym ochorením (37).
Pankreatitída
Chronická pankreatitída (CP) je zápalové ochorenie, ktoré spôsobuje trvalé poškodenie samotnej žľazy s alebo bez narušenia jej endokrinných a exokrinných funkcií. K rozvoju malnutrície u pacientov s CP dochádza až v terminálnych štádiách ochorenia, pri strate 80–90 % exokrinnej funkcie pankreasu (11). Enterálna výživa u pacientov s CP je indikovaná pri maldigescii (s bolesťami alebo pyloro-duodeno stenózou pri zväčšenej hlave pankreasu alebo pseudocystickej formácii), pri progredujúcej strate hmotnosti napriek normálnemu perorálnemu príjmu, pri akútnych komplikáciach – ako napr. akútna pankreatitída alebo formácia fistuly, príp. v predoperačnej príprave na chirurgický výkon. Jejunálne podávanie enterálnej stravy signifikantne zlepšilo prognózu pacientov s CP (31).
Iné indikácie punkčnej gastrostómie
S menšími modifikáciami techniky zavedenia, môže byť zavedený PEG aj u obéznych pacientov. V literatúre sú popísané úspešné implantácie PEG setu aj u morbídne obéznych pacientov s extrémne vysokým body mass indexom (> 60 kg/m2) (5).
Existuje niekoľko prípadov úspešného zavedenia gastrickej sondy u pacientov s ascitom po vykonaní paracentézy a modifikácii techniky zavedenia, dokonca aj u pacientov s masívnym ascitom. Avšak napriek tomuto technickému úspechu, bola u týchto pacientov popisovaná zvýšená úmrtnosť nesúvisiaca s výkonom. Zostáva preto otázne riziko verzus benefit zavedenia PEG u tejto skupiny pacientov (2).
KONTRAINDIKÁCIE PEG (tab. 1)
Table 1. Všeobecné kontraindikacie (KI) zavedenia endoskopickej gastrostómie 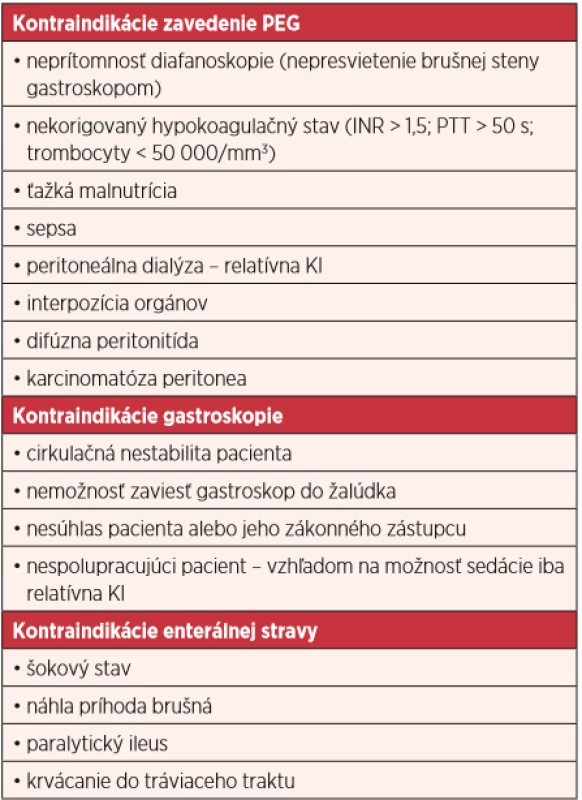
TECHNIKA ZAVEDENIA PEG
Perkutánna endoskopická gastrostómia sa zavádza perorálnou „pull“ technikou ťahom podľa Ponského-Gauderera alebo „push“ technikou tlakom podľa Sacks-Vine priamo cez prednú brušnú stenu.
„Push“ technikou sa výživová sonda zavádza tlakom po vodiči cez brušnú stenu do žalúdka pod röntgenovou kontrolou. Používajú sa najmä balónkové sondy. Iniciálne zavedenie sondy si vyžaduje použitie dilatátora. Bezpečnosť tejto techniky sa zlepšila použitím intragastricky uloženého T-fixátora s použitím skiaskopie alebo endoskopickej kontroly s fixáciou žalúdka k brušnej stene. „Pull“ technikou je výživová sonda zavedená cez ústa do žalúdka a vytiahnutá von cez brušnú stenu za použitia slučky zavedenej priamo cez punkčné zariadenie pod endoskopickou kontrolou (obr. 1). Úspešnosť zavedenia PEG je vysoká, pohybuje sa v rozmedzí od 76 do 100 % (16). Priemerná životnosť PEG sondy bola popisovaná od 1 do 5 rokov (30).
Image 1. Schematický obrázok perkutánnej endoskopickej gastrostómie (Endoskopická ambulancia III. Internej kliniky LF UK a UNB v Bratislave)
1 – transiluminácia, 2 – digitálne potvrdenie transiluminácie, 3 – lokálne aplikovaná analgézia 1% Mesocainom, 4 – skalpelom realizovaná kožná incízia, 5 – kožná incízia, 6 – kožnou incíziou zavedená punkčná ihla aj so zavádzačom, pohľad zvnútra na hrot ihly, 7 – cez zavádzač zavedené ťažné vlákno do žalúdka, pohľad do žalúdka, kde je vlákno zachytené slučkou a vyvedené ústami von, 8 – ťahom čiže „pull“ metódou vyvedená PEG sonda cez brušnú stenu, 9 – vyvedená PEG sonda, pohľad z vnútra na fixačnú platničku PEG-u, 10 – pohľad na zavedenú PEG sondu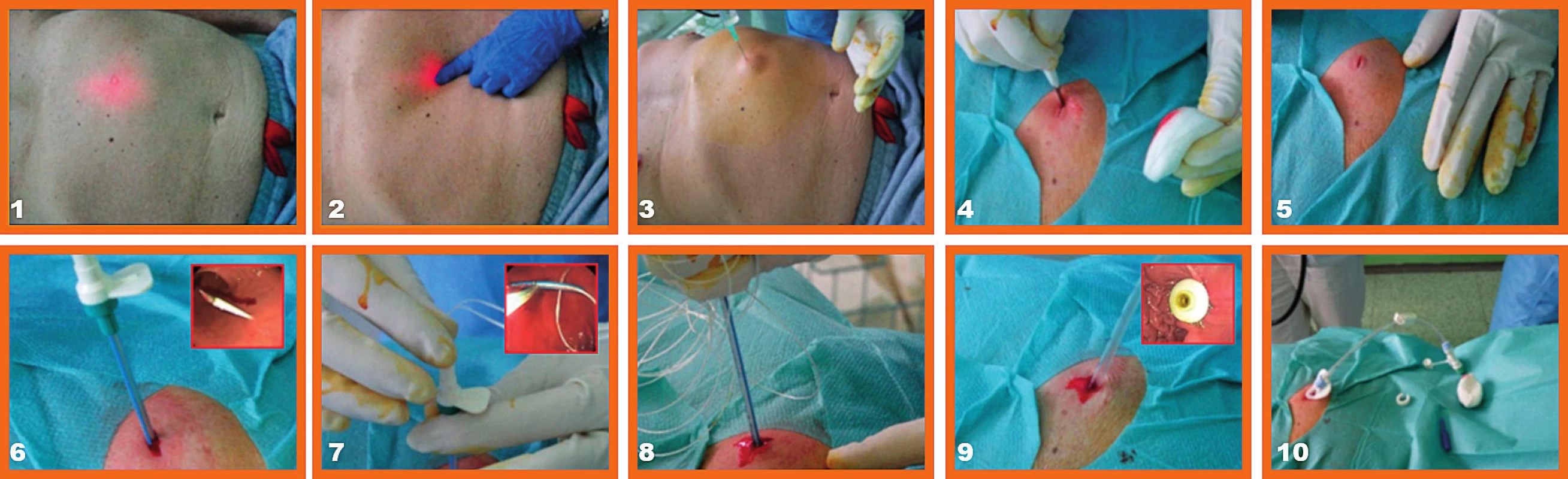
Príprava na výkon
Požadované hodnoty koagulačných parametrov sú: INR do 1,3, APTT pomer do 1,3, počet trombocytov nad 100 tisíc/ml. Posledná dávka heparínu alebo nízkomolekulového heparínu by mala byť podaná najneskôr 12 hodín pred výkonom (26). Pred výkonom 6 – 8 hodín nejesť, nepiť, nefajčiť, ukončiť podávanie enterálnej stravy, ak sa podáva do žalúdka nazogastrickou sondou. Podávanie stravy do jejuna sa nemusí ukončiť. V deň výkonu je dôležité vykonať hygienu dutiny ústnej, aby sa tak znížilo riziko infekcie stomického kanála a s tým súvisiacich komplikácií a vytiahnuť zubnú protézu. Pred výkonom sa odporúča aplikovať antimikrobiálna profylaxia.
KOMPLIKÁCIE PEG
Najčastejšie sa vyskytujú v prvých dňoch po zavedení PEG sondy, kým nie je vytvorený gastrokutánny stomický kanál. Ten sa začína formovať 7 – 10 dní po zavedení PEG, jeho zrenie sa ukončuje zhruba 21 dní od výkonu, ale u malnutričných pacientov alebo imunokompromitovaných môže hojenie trvať dlhšie. Tridsaťdňová periprocedurálna mortalita sa udáva v 6,7 – 26 %, pričom mortalitné čísla sú dané skôr komorbiditami pacientov ako výkonom samotným (12) (tab. 2).
Table 2. Komplikácie zavedenia PEG 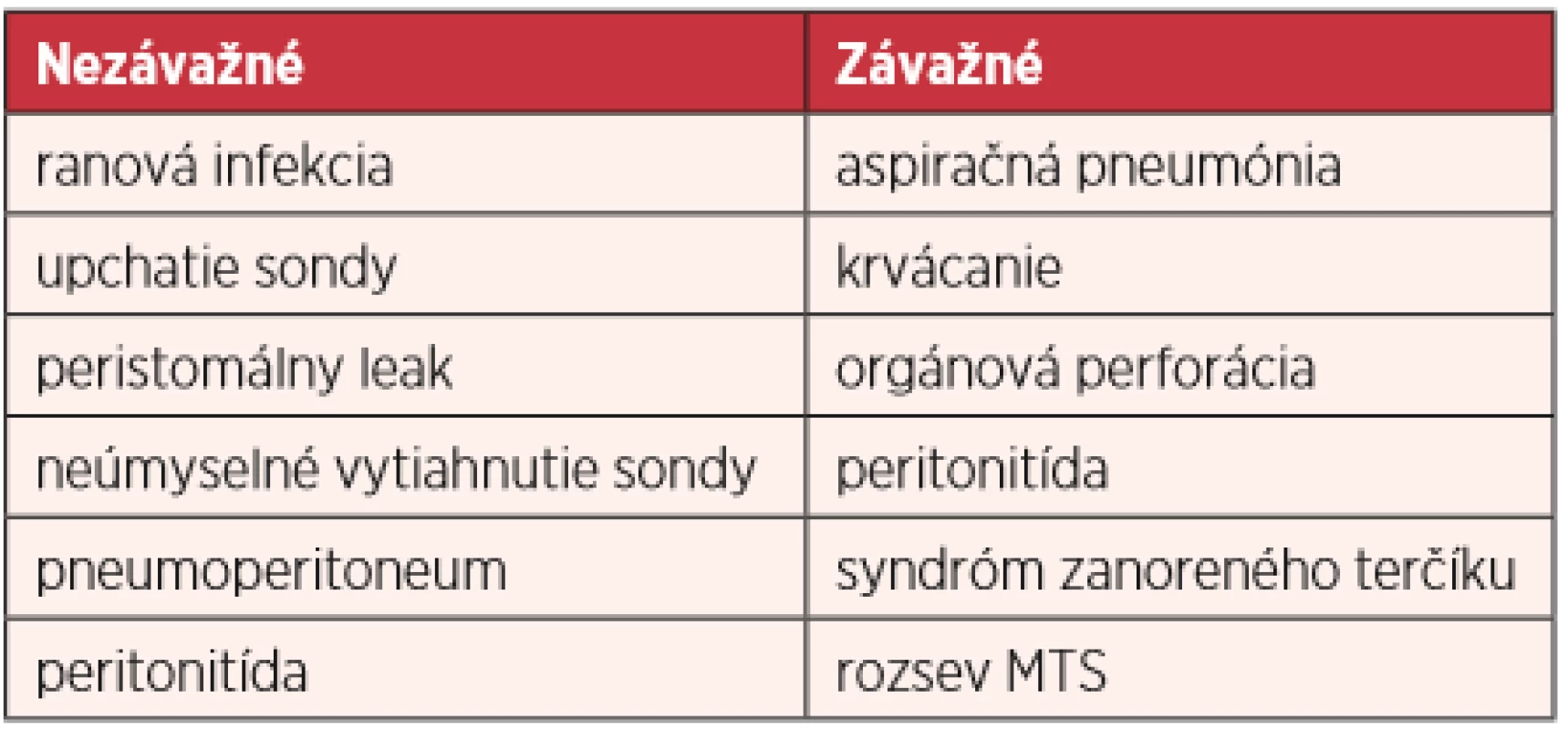
Mechanické komplikácie súvisiace s výkonom
Peristomálna infekcia miesta zavedenia je jednou z najčastejších komplikácii výkonu s incidenciou 4 – 30 % (29). Väčšina prípadov býva ľahká a úspešne zvládnuteľná antibiotickou liečbou. Predisponujúcimi faktormi infekcie sú aj technika výkonu, ako úzka incízia kože alebo nedostatočná antibiotická profylaxia, ďalej faktory na strane pacienta (malnutrícia, obezita, diabetes, malignita, lieky, imunosupresíva, chronická kortikoidná liečba) a faktory ošetrovania rany (nedostatočné krytie rany, silný ťah sondou v mieste medzi fixačnou platničkou a brušnou stenou).
Nefunkčná výživová sonda. Incidencia upchatia výživovej sondy je pomerne vysoká a to až v 35 – 45 % (4). Sonda sa upcháva predovšetkým používaním hustých výživových formulí a medikáciou. Opakovaná aspirácia žalúdkových zvyškov je v rámci prevencie nežiadúca, keďže pH nižšie ako 4 urýchľuje zrážanie proteínov. Sondy sa majú preplachovať 50 ml pred a po aplikácií medikamentov alebo potenciálne upchávajúcich zložiek stravy (napr. vo vode rozpustná vláknina). Podávanie pankreatických enzýmov spolu s bikarbonátmi sa preukázalo ako účinná prevencia upchatia sondy. Upchatú sondu je možné spriechodniť mechanicky, a to použitím endoskopických katétrov, vodičov alebo špeciálnych kefiek. Pokiaľ tento spôsob zlyhá, je potrebné sondu vymeniť.
Peristomálny leak. Incidencia peristomálneho leaku nie je vysoká, vyskytuje sa v 1 – 2 %. Rizikovými faktormi sú napr. častá dezinfekcia peroxidom vodíka, infekcia, gastrická hypersekrécia, výrazné točenie PEG sondou a špecifické faktory brániace hojeniu rany (napr. malnutrícia, diabetes mellitus, imunosupresia). Prevencia je zameraná na redukciu rizikových faktorov (napr. antisekrečná liečba PPI a lokálna liečba s obsahom zinku). Pri zlyhaní preventívnych oparení je potrebné PEG sondu odstrániť.
Krvácanie nie je zriedkavou komplikáciou s incidenciou viac ako 2,5 %. Najčastejšou príčinou akútneho krvácania sú cievne poranenia na úrovni kože alebo slizničné trhliny. Rizikové faktory zahŕňajú zmenené anatomické pomery, antikoagulačnú a antiagregačnú liečbu (4). Warfarín sa odporúča vynechať 3 – 5 dní pred zavedením PEG. U vysoko rizikových pacientov z tromboembolizmu je indikovaná prechodná liečba nízkomolekulovým heparínom s jeho vysadením 6 – 12 hodín pred výkonom a opätovným podaním 2 – 6 hodín po výkone. Liečba warfarínom sa môže obnoviť deň po výkone (26). V prípade orálnych antikoagulancií (NOAK) sa u nízko rizikových výkonov odporúča vynechať rannú dávku v deň výkonu. U vysoko rizikových výkonov sa pacientom odporúča užiť poslednú dávku aspoň 48 hodín pred výkonom. Pacienti s chronickým ochorením obličiek (CrCl 50 – 30 ml/min) užívajúci dabigatran by ho mali vysadiť 72 hodín pred výkonom (34).
Syndróm zanoreného terčíka (burried bumper syndrome – BBS) je zriedkavou a neskorou komplikáciou zavedenia PEG, kedy vnútorný terčík PEG-u migruje z lúmenu žalúdka a uviazne v stene žalúdka (nekompletný syndróm zanoreného terčíka) alebo kdekoľvek inde mimo tráviaceho traktu a lúmenu žalúdka (kompletný syndróm zanoreného terčíka). Prevalencia sa pohybuje od 1,5 – 8,8 % (29). Príznakmi BBS sú narušená pohyblivosť PEG sondy, sťažené kŕmenie, obtekanie obsahu okolo sondy, kompletné upchatie sondy, abdominálna bolesť a hmatná rezistencia v okolí zavedenia PEG. Faktormi vzniku BBS sú nadmerný ťah sondy medzi vonkajším a vnútorným fixačným diskom, malnutrícia pacienta, sťažené hojenie rany, chronický kašeľ, prírastok hmotnosti a tuhý vnútorný disk (polyuretán). Najdôležitejšie v liečbe BBS je odstránenie zanoreného terčíka, dokonca aj u asymptomatických pacientov, čím sa vyhneme možným ďalším komplikáciám (perforácia žalúdka, peritonitída, infekcia hlbších vrstiev kože) (23).
Kolonické fistuly sú fistuly spájajúce žalúdok, hrubé črevo a kožu. Bývajú zriedkavé, avšak potenciálne život ohrozujúce. Gastrokolokutánna fistula môže vzniknúť, ak je črevo vmedzerené medzi brušnou stenou a žalúdkom pri zavádzaní punkčnej ihly, alebo častejšie následkom postupnej erózie steny vmedzereného čreva PEG sondou (39). Akútne klinické prejavy súvisia s črevnou perforáciou, no väčšinou sa fistula prejavuje ako chronické obtekanie sondy stolicou a výživovou formulou. Diagnostika fistuly pozostáva v aplikácii kontrastnej látky cez PEG. V prípade rozvoja sterkorálnej peritonitídy alebo neuzavretia sa fistuly, je nutná chirurgická liečba.
Pneumoperitoneum ako následok zavedenia PEG alebo PEG-J sa vyskytuje v asi 8 – 18 %. Pneumoperitoneum je obyčajne benígne a spontánne sa resorbuje a nevyžaduje ďalšiu intervenciu. Vzduch pod bránicou je prítomný do 72 hodín po zavedení PEG. Ak je pacient asymptomatický a hemodynamicky stabilizovaný, neodporúča sa žiadna ďalšia intervencia (36).
Neúmyselné vytiahnutie PEG sondy sa vyskytuje v 1,6 – 4,4 % (27). Hojenie stomického kanála trvá zvyčajne 7 – 10 dní. V prípade malnutrície, ascitu a kortikoterapie sa môže predĺžiť až na 4 týždne. Zariadenie PEG, ktoré sa náhodne vytiahne v tomto časovom období, sa opätovne zavádza endoskopicky, keďže kanál nie je „dozretý“ a stena žalúdka a predná brušná stena sa môžu od seba oddeliť. Ak sa táto komplikácia odhalí včas do 24 hodín, je možné endoskopicky zaviesť nový PEG cez pôvodný kanál. Po zhojení stomického kanála, čiže 3 – 4 týždne po zavedení, je možné PEG zaviesť aj bez endoskopie (18).
MTS brušnej steny na strane PEG sú neskorou a veľmi zriedkavou komplikáciou s výskytom pod 1 % prípadov (7). Rizikovými faktormi metastatického rozsevu sú primárny orofaryngeálny a ezofágový karcinóm, histologický nález squamocelulárneho karcinómu, nízkodiferencované karcinómy a pokročilé štádium onkologického ochorenia. Keďže najpravdepodobnejším mechanizmom je mechanická manipulácia s tumorom, preferuje sa push metóda zavádzania.
Gastrointestinálne komplikácie
Hnačka je najčastejšou komplikáciou výživy enterálnymi formulami s výskytom 30 – 80 % (38). Patogenéza je multifaktoriálna, vzniká najčastejšie pri chybnom, príliš rýchlom začatí EV. Ďalšou možnou príčinou je atrofizácia sliznice tenkého a hrubého čreva po dlhodobej parenterálnej výžive bez zaťažovania GIT-u, často v kombinácii s hypoalbuminémiou a katabolizmom. V týchto prípadoch je potrebné EV začať pomaly a cieľovú dávku dosiahnuť v priebehu 8 dní a voliť radšej izoosmolárne alebo hypoosmolárne, obvykle polymérne formuly s vlákninou. Liečivá obsahujúce sorbitol môžu spôsobovať hnačku osmotickým efektom, zatiaľ čo antibiotiká narušujú črevnú flóru s pomnožením Clostridium difficile (C. difficile), E. coli a Klebsiella.
Použitie probiotík ako prevencie hnačky pri sondovej strave je užitočné. Pokiaľ hnačka pretrváva aj pri kontinuálnom podávaní polymérnej EV s vlákninou rýchlosťou 100 ml/hod. i po zmene prípravku, je nutné pátrať aj po iných príčinách hnačky (infekčné príčiny, postantibiotické hnačky pri dysmikróbii, malabsorpčné stavy (Crohnova choroba, ulcerózna kolitída, celiakia, postradiačná enteritída, poresekčné stavy apod.).
Infekčné komplikácie
Aspiračná pneumónia je potenciálne život ohrozujúca komplikácia, ktorá býva zvyčajne následkom aspirácie ústneho sekrétu alebo gastrického obsahu. K aspirácii môže dôjsť aj bez zrejmých prejavov vracania. Je veľmi častá u pacientov s kvantitatívnou poruchou vedomia alebo oslabeným dávivým reflexom. Vyskytuje sa takmer u 30 % pacientov s tracheostómiou a u 12,5 % pacientov s neurologickým ochorením, náchylní sú aj starší pacienti (22). Najčastejšími vyvolávajúcimi patogénmi sú Streptococcus pneumoniae, Staphylococcus aureus, Haemophilus influensae a Enterobacteriaceae. Pri nozokomiálnej aspiračnej pneumónii sú najčastejšími patogénmi gramnegatívne baktérie vrátane Pseudomonas aeruginosa a Klebsiella pneumoniae. V liečbe sú vždy indikované širokospektrálne antibiotiká, vhodné sú s aktivitou proti gramnegatívnym organizmom: treťogeneračné cefalosporíny, fluorochinolóny a piperacilín (33).
Peritonitída je zriedkavou komplikáciu, s frekvenciou do 2,3 % (28). Manifestuje sa abdominálnou bolesťou, horúčkou, leukocytózou. Príčiny vzniku peritonitídy v sebe zahŕňajú dislokáciu alebo odstránenie PEG sondy skôr, ako sa zhojil a vytvoril gastrokutánny kanál, peristomické obtekanie alebo leak alebo perforácia iného orgánu. Neexistujú žiadne odporúčania ohľadom menežmentu peritonitídy, ale vo všeobecnosti sú pacienti liečení širokospektrálnymi ATB. Perforácia čreva alebo leak z rany sú indikáciou chirurgickej revízie (25).
Metabolické komplikácie
Refeeding syndróm (RFS) môže vzniknúť u podvýživených pacientov, ktorí stratili viac ako 10 – 15 % svojej pôvodnej hmotnosti v priebehu 3 – 6 mesiacov, alebo bez príjmu potravy dlhšie než 7 dní, s indexom telesnej hmotnosti pod 16 kg/m2 s nedostatočnou substitúciou iónov K, P, Mg. V klinickom obraze dominuje celková slabosť, dezorientácia, somnolencia, poruchy srdcového rytmu, známky srdcového zlyhávania. V závažných prípadoch dochádza k rozvoju kómy, malígnych srdcových arytmií a respiračnej insuficiencie. Prevenciou vzniku tohto syndrómu je pomalé zahájenie enterálnej výživy a intravenózne hradenie intracelulárnych iónov za monitoringu ich sérových hladín (35).
Preťažením nutričnými substrátmi (tzv. overfeeding) sú ohrození malnutriční pacienti s príliš vysokou celkovou dennou dávkou enterálnej výživy, pri nerešpektovaní dennej potreby 30 – 35 kcal/kg na aktuálnu hmotnosť. U pacientov s BMI pod 18 je denná dávka EV vypočítaná na aktuálnu hmotnosť a táto dávka sa postupne po 2 – 3 týždňoch zvyšuje podľa tolerancie s cieľom dosiahnuť potrebný hmotnostný prírastok (10). Overfeeding syndróm sa prejavuje ako hyperglykémia, steatóza heparu, hyperlipoproteinémia, subfebrílie, hyperkapnia.
ZÁVER
Hlavným účelom PEG je dlhodobé podávanie enterálnej výživy priamo do žalúdka cez brušnú stenu. Primárnou indikáciou enterálnej výživy je zabezpečenie nutričnej podpory a požiadaviek metabolizmu u pacientov s nedostatočným perorálnym príjmom. Hlavnými indikáciami sú onkologické ochorenia, neurologické ochorenia. Je viacero techník zavedenia PEG, pričom „pull“ metóda je najrozšírenejšia s najnižšou periprocedurálnou morbiditou a mortalitou. Posledné desaťročia preukázali množstvo výhod enterálnej výživy pred parenterálnou. Enterálna výživa je jednoduchšia, bezpečnejšia, účinnejšia v predchádzaní infekčných, metabolických a technických komplikácií a tiež je ekonomicky výhodnejšia. No napriek tomu prináša so sebou aj spektrum komplikácii. Komplikácie sú častejšie u starších a polymorbídnych pacientov. Ich poznanie a rozpoznanie a rýchly menežment môže signifikantne znížiť morbiditu a mortalitu súvisiacu s výkonom zavedenia PEG.
Z hľadiska pacienta je výživa cestou PEG dobre tolerovaná, nemutiluje, naopak, zlepšuje mobilitu, výživu, kvalitu života a napomáha zachovaniu sociálnej integrácie pacienta.
Konflikt záujmov: žiadny.
ADRESA PRE KOREŠPONDENCIU:
MUDr. Zuzana Ďurkovičová
III. Interná klinika Lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice
Limbová 5, 833 05 Bratislava, SR
e-mail: zuz.sedlakova@gmail.com
Sources
1. Ayman AR, Khoury T, Cohen J, et al. PEG insertion in patients with dementia does not improve nutritional status and has worse outcomes as compared with PEG insertion for other indications. J Clin Gastroenterol 2017; 51(5): 417–420.
2. Baltz JG, Argo CK, Al-Osaimi AM, et al. Mortality after percutaneous endoscopic gastrostomy in patients with cirrhosis: a case series. Gastrointest Endosc 2010; 72(5): 1072–1075.
3. Bassett MR, Dobie RA. Patterns of nutritional deficiency in head and neck cancer. Otolaryngol Head Neck Surg 1983; 91(2): 119–125.
4. Blumenstein I, Shastri YM, Stein J. Gastroenteric tube feeding: techniques, problems and solutions. World J Gastroenterol 2014; 20(26): 8505–8524.
5. Bochicchio GV, Guzzo JL, Scalea TM. 2006. Percutaneous endoscopic gastrostomy in the supermorbidly obese patient. JSLS 2006; 10(4): 409–413.
6. Burney RE, Bryner BS. Safety and long-term outcomes of percutaneous endoscopic gastrostomy in patients with head and neck cancer. Surg Endosc 2015; 29(12): 3685–3689.
7. Cappell MS. Risk factors and risk reduction of malignant seeding of the percutaneous endoscopic gastrostomy track from pharyngoesophageal malignancy: a review of all 44 known reported cases. Am J Gastroenterol 2007; 102(6): 1307–1311.
8. Corrigan ML, Escuro AA, Celestin J, et al. Nutrition in the stroke patient. Nutr Clin Pract 2011; 26(2): 242–252.
9. Czell D, Bauer M, Binek J, et al. Outcomes of percutaneous endoscopic gastrostomy tube insertion in respiratory impaired amyotrophic lateral sclerosis patients under noninvasive ventilation. Respir Care 2013; 58(5): 838–844.
10. Dastych M. Enterální výživa v klinické praxi. Interní Med 2012; 14(4): 152–156.
11. Del Prato S, Tiengo A. The importance of first-phase insulin secretion: implications for the therapy of type 2 diabetes mellitus. Diabetes Metab Res Rev 2001; 17(3): 164–174.
12. DiSario JA. Endoscopic approaches to enteral nutritional support. Best Pract Res Clin Gastroenterol 2006; 20(3): 605–630.
13. Gordon C, Hewer RL, Wade DT. Dysphagia in acute stroke. Br Med J (Clin Res Ed) 1987; 295(6595): 411–414.
14. Kawata N, Kakushima N, Tanaka M, et al. Percutaneous endoscopic gastrostomy for decompression of malignant bowel obstruction. Dig Endosc 2014; 26 : 208–213.
15. Khalaf RT, Green D, Amankwah EK, et al. Percutaneous endoscopic gastrostomy tubes may be associated with preservation of lung function in patients with cystic fibrosis. Nutr Clin Pract 2019; 34(2): 290–296.
16. Kwon RS, Banerjee S, Desilets D, et al. Enteral nutrition access devices. Gastrointest Endosc 2010; 72(2): 236–248.
17. Lloyd DA, Powell-Tuck J. Artificial nutrition: principles and practice of enteral feeding. Clin Colon Rectal Surg 2004; 17(2): 107–118.
18. Lynch CR, Fang JC. Prevention and management of complications of percutaneous endoscopic gastrostomy (PEG) tubes. Practical Gastroenterol 2004; 28 : 66–76.
19. Mathus-Vliegen EM, Koning H, Taminiau JA, et al. Percutaneous endoscopic gastrostomy and gastrojejunostomy in psychomotor retarded subjects: a follow-up covering 106 patient years. J Pediatr Gastroenterol Nutr 2001; 33(4): 488–494.
20. Matsumoto A, Yuda M, Tanaka Y, et al. Efficacy of percutaneous endoscopic gastrostomy for patients with esophageal cancer during preoperative therapy. Anticancer Res 2019; 39(8): 4243–4248.
21. Mitchell SL, Teno JM, Kiely DK, et al. The clinical course of advanced dementia. N Engl J Med 2009; 361(16): 1529–1538.
22. Olivares L, Segovia A, Revuelta R. Tube feeding and lethal aspiration in neurological patients: a review of 720 autopsy cases. Stroke 1974; 5(5): 654–657.
23. Piskač P, Wasiková S, Hnízdil L, a kol. Buried bumper syndrom (BBS) jako komplikace perkutánní endoskopické gastrostomie. Rozhl Chir 2010; 89(5): 298–299.
24. Ponsky JL. The development of PEG: how it was. J Interv Gastroenterol 2011; 1(2): 88–89.
25. Potack JZ, Chokhavatia S. Complications of and controversies associated with percutaneous endoscopic gastrostomy: report of a case and literature review. Medscape J Med 2008; 10(6): 142.
26. Richter JA, Patrie JT, Richter RP, et al. Bleeding after percutaneous endoscopic gastrostomy is linked to serotonin reuptake inhibitors, not aspirin or clopidogrel. Gastrointest Endosc 2011; 74(1): 22–34.
27. Rimon E. The safety and feasibility of percutaneous endoscopic gastrostomy placement by a single physician. Endoscopy 2001; 33(3): 241–244.
28. Sheehan JJ, Hill AD, Fanning NP, et al. Percutaneous endoscopic gastrostomy: 5 years of clinical experience on 238 patients. Ir Med J 2003; 96(9): 265–267.
29. Schrag SP, Sharma R, Jaik NP, et al. Complications related to percutaneous endoscopic gastrostomy (PEG) tubes. A comprehensive clinical review. J Gastrointestin Liver Dis 2007; 16(4): 407–418.
30. Siau K, Troth T, Gibson E, et al. How long do percutaneous endoscopic gastrostomy feeding tubes last? A retrospective analysis. Postgrad Med J 2018; 94(1114): 469–474.
31. Stanga Z, Giger U, Marx A, et al. Effect of jejunal long-term feeding in chronic pancreatitis. J Parenter Enteral Nutr 2005; 29(1): 12–20.
32. Tang DM, Friedenberg FK. Gastroparesis: approach, diagnostic evaluation, and management. Dis Mon 2001; 57(2): 74–101.
33. Tedlová E, Mucska I. Neinfekčné zápaly pľúc. Via Pract 2008 : 5(2): 68–71.
34. Veitch AM, Vanbiervliet G, Gershlick AH, et al. Endoscopy in patients on antiplatelet or anticoagulant therapy, including direct oral anticoagulants: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guidelines. Endoscopy 2016; 48(4): 385–402.
35. Vignaud M, Constantin JM, Ruivard M, et al. Refeeding syndrome influences outcome of anorexia nervosa patients in intensive care unit: an observational study. Crit Care 2010; 14(5): R172.
36. Vijayakrishnan R, Adhikari D, Anand CP. Recurrent tense pneumoperitoneum due to air influx via abdominal wall stoma of a PEG tube. World J Radiol 2010; 2(7): 280–282.
37. Walker SA, Gozal D. Pulmonary function correlates in the prediction of long-term weight gain in cystic fibrosis patients with gastrostomy tube feedings. J Pediatr Gastroenterol Nutr 1998; 27(1): 53–56.
38. Whelan K, Schneider SM. Mechanisms, prevention, and management of diarrhea in enteral nutrition. Curr Opin Gastroenterol 2011; 27(2): 152–159.
39. Yamazaki T, Sakai Y, Hatakeyama K, et al. Colocutaneous fistula after percutaneous endoscopic gastrostomy in a remnant stomach. Surg Endosc 1999; 13(3): 280–282.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2020 Issue 2-
All articles in this issue
- Anxiety of pregnant women – importance, risk factors, consequences
- General overview of percutaneous endoscopic gastrostomy
- Standard, neglected and new information about compression therapy with bandages
- Sit-to-stand test in fall prediction in elderly adults: what are the options of use in clinical practice?
- Overweight and obesity in children in relation to physical activity and excessive body weight in their parents
- Immunity at the most common non-communicable diseases – atherosclerosis and malignant neoplasms
- Perception in healthcare practicable information-communication technologies by Czech general practitioners
- Thyroid cancers
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- General overview of percutaneous endoscopic gastrostomy
- Standard, neglected and new information about compression therapy with bandages
- Anxiety of pregnant women – importance, risk factors, consequences
- Thyroid cancers
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

