-
Medical journals
- Career
Přežití po resekci karcinomu jícnu
Authors: J. Šafránek 1; J. Geiger 1; J. Šebek 1; P. Hošek 2
Authors‘ workplace: Univerzita Karlova v Praze Lékařská fakulta v Plzni ; Chirurgická klinika Přednosta: prof. MUDr. Vladislav Třeška, DrSc. 1; Biomedicínské centrum Vědecký ředitel: doc. MUDr. Milan Štengl, Ph. D. 2
Published in: Prakt. Lék. 2018; 98(2): 69-72
Category: Of different specialties
Overview
Metodika:
Byla provedena retrospektivní analýza souboru pacientů po resekci jícnu pro karcinom za 5 let z hlediska délky přežití pro typ a stadium karcinomu. Nemocní byli operováni otevřeně, z torakofrenolaparotomie, nebo dvoudutinovým způsobem s hrudní, eventuálně krční, cirkulární, staplerovou, anastomózou.Výsledky:
Sedmdesát jedna pacientů bylo operováno pro karcinom, 50 pro adenokarcinom, 20 spinocelulární a jeden nediferencovanou formu karcinomu. Třicetidenní mortalita byla 7,9 %. Průměrná doba hospitalizace byla 21 dní (10–99 dní). Pooperačně pro komplikace byla nutná 4krát laparotomie, 6krát torakotomie, 9krát tracheostomie. Insuficienci anastomózy jsme zaznamenali v pěti případech (6,6 %). Tříleté přežití v pětiletém souboru bylo 28,4% (11,5–45,3 %), pro adenokarcinom 29,6% a 23,2% pro spinocelulární karcinom. Bez statistické významnosti bylo přežití ve skupině adenokarcinom (50) vs. spinocelulární karcinom (20) p = 0,413, uzlinové postižení N0 (24) vs. vyšší N (40) p = 0,288, i stadium karcinomu I (12), II (16) vs. III + vyšší (41) p = 0,671.Závěr:
Prognóza karcinomu jícnu i přes radikální chirurgický výkon zůstává nepříznivá, v našem souboru na ni neměla statisticky významný vliv ani TMN klasifikace ani typ karcinomu. .KLÍČOVÁ SLOVA:
karcinom jícnu – celkové přežití – komplikaceÚVOD
Karcinom jícnu patří k nádorům s vysokou mortalitou. Na rozdíl od kolorektáního karcinomu, kde je ČR na předních místech v incidenci, jsou karcinomy horní části zažívacího traktu u nás vzácnější. Za rok 2015 je incidence karcinomu jícnu 3,2 na 100 000 obyvatel (17).
Léta jsou známé rizikové faktory vzniku spinocelulárního karcinomu, především alkohol a kouření a pro adenokarcinom symptomatický gastroezofageální reflux, či již Barrettova metaplazie (6, 10). Navzdory nákladům vydávaným na prevenci, diagnostiku i léčbu, výsledky přežití nemocných zůstávají špatné. Celkové přežití nemocných (s resekcí, nebo bez resekce) není více než 10 % (13). Ani chirurgická léčba celkové přežití příliš neprodlužuje, zřídka přesáhne 5leté přežití 40 % (1, 5, 11). Chirurgická resekce se provádí přístupem, při kterém hraje roli lokalizace karcinomu, ale i zvyklosti pracoviště. Otevřeně je možností operace skrz brániční hiatus s cervikální anastomózou, dvoudutinový výkon (laparotomie, torakotomie) s anastomózou nitrohrudně a případně torakofrenolaparotomie s anastomózou na přechodu hrudní a břišní dutiny. Nabízí se řešení otevřeným přístupem nebo miniinvazivně. Ke konstrukci náhrady jícnu se prakticky vždy užívá tubulizovaný žaludek.
METODIKA
Retrospektivní soubor resekcí jícnu za uplynulých 5 let, rozbor výsledků, délky přežití pro typ a stadium karcinomu. Nemocné jsme operovali klasicky, otevřeně, z torakofrenolaparotomie, nebo dvoudutinovým způsobem s hrudní, případně krční, cirkulární, staplerovou, anastomózou. Soubor tvořilo celkem 76 pacientů, průměr věku 59,5 let (37–76 let). Pro karcinom bylo operováno celkem 71 pacientů, z toho 50 pro adenokarcinom, 20 pro spinocelulární karcinom a jeden pro nediferencovanou formu karcinomu. Dva nemocní byli operováni pro akutní perforaci tumoru. Resekce jícnu pro jinou diagnózu byla provedena 5krát (2krát poleptání jícnu, striktura po léčbě achalázie, leiomyom a bronchogenní cysta). Křivky přežití byly srovnávány pomocí Gehan-Breslow-Wilcoxonova testu.
VÝSLEDKY
Časná 30denní mortalita byla 7,9 % (šest úmrtí – dvě komplikace anastomózy, dvě kardiální, jedno hepatorenální selhání, jedno bazální léčba po R1 resekci perforace pokročilého karcinomu). Průměrná délka hospitalizace byla 21 dní (10–99 dní). Pooperačně pro komplikace byla nutná 4krát laparotomie (dehiscence laparotomie, komplikace výživné jejunostomie, krvácení), 6krát torakotomie (komplikace při anastomóze či krvácení). Tracheostomie byla provedena u devíti nemocných. Insuficienci anastomózy jsme zaznamenali (radiologicky, endoskopicky potvrzenou) v pěti případech (6,6 %), 3krát byla řešena zavedením stentu. Tříleté přežití v 5letém souboru bylo 28,4 % (11,5–45,3 %), pro adenokarcinom 29,6 % a 23,2 % pro spinocelulární karcinom.
Přežití ve skupině adenokarcinom (50) vs. spinocelulární karcinom (20) bylo bez statistické významnosti (p = 0,413 (obr. 1), uzlinové postižení N0 (24) vs. vyšší N (40), též bez statistického rozdílu (p = 0,288 (obr. 2) a mezi stadii karcinomu I (12), II (16) a III a vyšší (41), rovněž nebylo statisticky významné (p = 0,671 (obr. 3).
Image 1. Přežití ve skupině adenokarcinom vs. spinocelulární (dlaždicobuněčný) karcinom 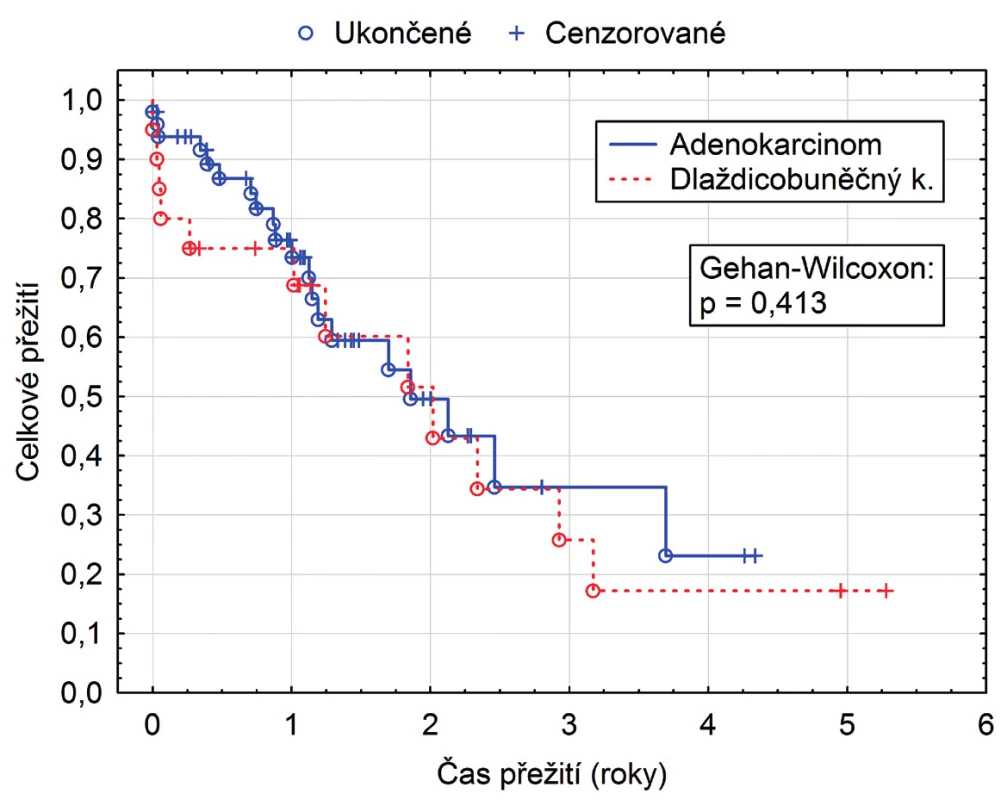
Image 2. Přežití dle uzlinového postižení N0 vs. vyšší N 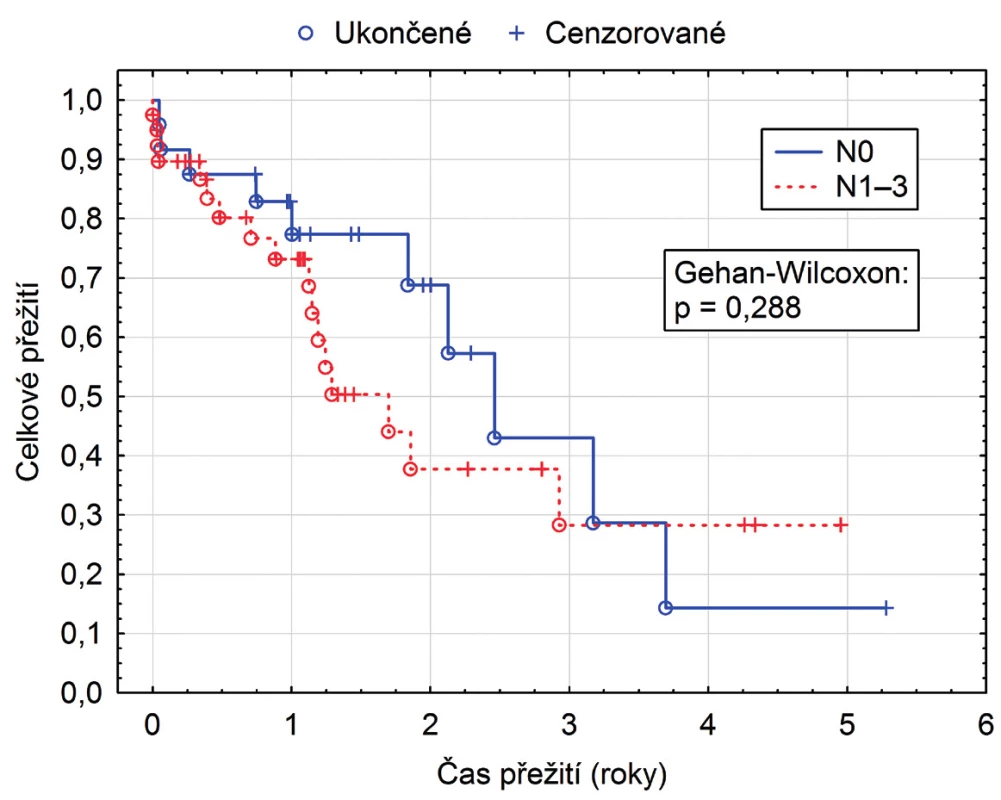
Image 3. Přežití podle stadia karcinomu I, II, III a vyšší 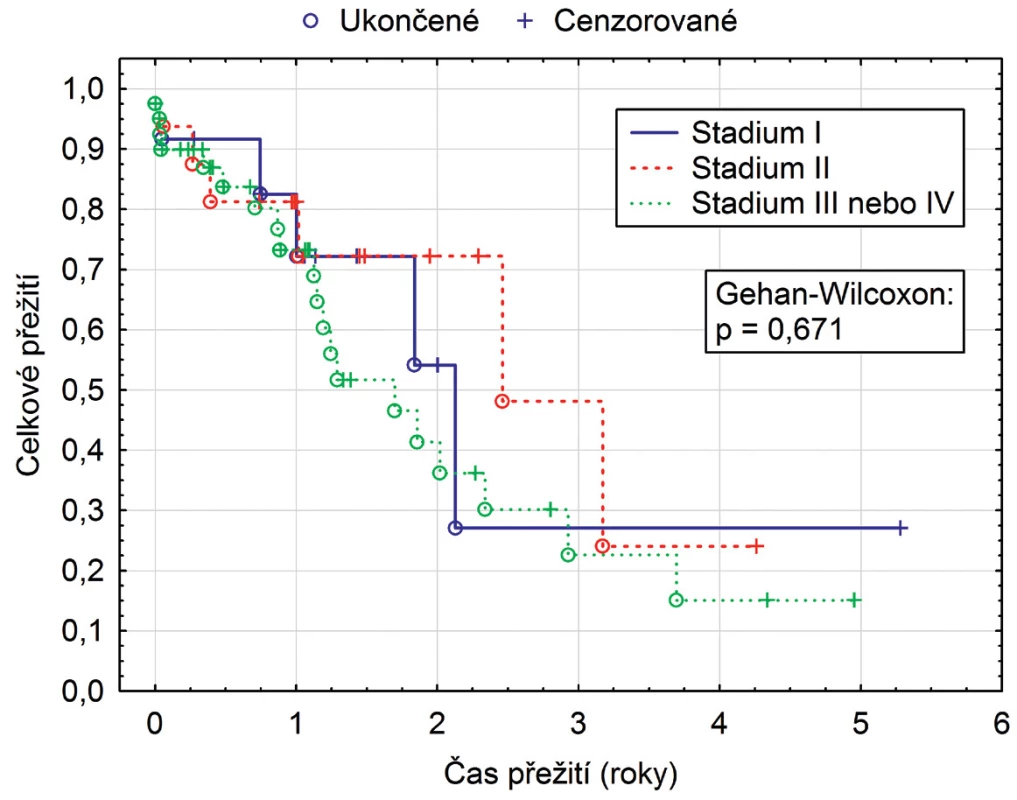
DISKUZE
V současnosti je trendem zejména pro spinocelulární karcionom jícnu, provádět resekci otevřeně, nebo asistovaně miniinvazivně (laparoskopie, torakoskopie) s krční anastomózou (transhiatálně) (8). Nicméně v reálné praxi zůstává dosud častou standardní resekce s hrudní anastomózou, vykazující nižší riziko komplikací anastomózy, ale na hůře přístupném místě (mediastinum). Komplikace krční anastomózy je lépe přístupná k ošetření než hrudní, ale není spojena i s nižší morbiditou a mortalitou. I proto se stále volí oba přístupy. Rovněž lymfadenektomie v krční etáži může být příčinou komplikací (7, 15). Za rozvojem miniinvazivní resekce je snaha snížit riziko pooperačních komplikací přístupem s menší operační zátěží a zkrácením pobytu v nemocnici. Rozsah resekce a lymfadenektomie však musí být oběma způsoby stejný a stejný v publikovaných výsledcích zůstává i nejdůležitější parametr – celkové přežití (3 roky cca 50 %, 5 let cca 30 %) (2, 3, 9, 12, 16). Stejně jako v kolorektální chirurgii je miniinvazivní přístup v jícnové chirurgii dnes uznán za rovnocenný otevřenému. Miniinvazivní přístup znamená také ale delší operační čas, vyšší finanční nákladnost, vyžaduje erudici týmu v dané problematice. Při efektivní epidurální analgezii je sporný i faktor menší pooperační bolestivosti. Riziko velkého operačního výkonu (krvácení, poranění okolních struktur, nutnost lymfadenektomie) je stejné u obou metod. Rovněž v ČR se miniinvazivní přístup resekce jícnu na některých pracovištích provádí (23). Na vznik komplikace anastomózy (insuficience, stenózy) má vliv prokrvení resekčních okrajů a chirurgická technika. Variantou je kompletně ručně šitá anastomóza (dnes již minimálně používaná), konstrukce jen cirkulárním staplerem, jen lineárním staplerem, nebo kombinace staplerové a ručně šité. Možnosti řešení insuficience jsou vedle především chirurgické revize a drenáže (v krční lokalizaci méně rizikové než mediastinu) zavedení stentu, popřípadě podtlaková drenážní terapie. Vedle řešení insuficience samotné je zásadní stabilizace celkového stavu nemocného – jedná se vždy potenciálně o fatální komplikaci, zejména při hrudní anastomóze.
Širší jsou v současnosti možnosti onkologické léčby. Přínos předoperační chemoradioterapie je větší než samotné neoadjuvantní chemoterapie pro oba typy karcinomů, jak prokázaly randomizované studie japonských autorů (4, 14). Nejen asijští autoři již potvrdili přínos neoadjuvantní chemoradioterapie i před resekcí adenokarcinomu jícnu a kardie (18, 20–22). Tyto výsledky se dostávají do praxe komplexní léčby karcinomu jícnu, zatím především pro pokročilé, tedy hraničně resekabilní nálezy. V některých případech dojde po takové neoadjuvantní léčbě k téměř úplné regresi tumoru a operace se provádí na traktu bez residuálního tumoru. I v našem souboru, ve dvou případech, nebyl spinocelurální karcinom po onkologické předléčbě patrný a resekce provedena „naslepo“.
Radioterapie zůstává stěžejní terapeutickou metodou u lokálně pokročilého karcinomu jícnu i gastroezofageální junkce, kdy již chirurgická léčba většinou není možná. Z chemoterapie se standardně používal režim založený na 5-fluorouracilu a cisplatině, v poslední době je cisplatina nahrazována méně toxickou oxaliplatinou. Přidání transtuzumabu k uvedené kombinaci u HER2 pozitivních pacientů s karcinomem gastroezofageální junkce je zatím jediným využitím cílené biologické léčby v problematice. Podle ESMO (European Society for Medical Oncology) guidelines 2016 je neoadjuvatní chemoradioterapie s následnou s operací nebo definitivní chemoradioterapie se sledováním a operací jen v případě perzistence tumoru či lokální recidivy dokonce srovnatelným léčebným postupem. V léčebné rozvaze jsou možné oba léčebné postupy, ačkoliv dosud neexistují data, která by přímo srovnala obě modality. Definitivní chemoradioterapie je jediným doporučeným léčebným postupem u krční lokalizace a lokálně pokročilého/metastazujícího karcinomu jícnu ostatních lokalizací (17).
Na našem pracovišti dáváme stále přednost otevřené resekci (z důvodů bezpečnosti operování, ceny i kratší doby výkonu). Nelze proklamovat na výsledcích našeho malého souboru, že rozsah uzlinového postižení a stadium karcinomu nehrají roli v prognóze přežití, spíše to dokazuje významu faktorů dalších (pooperační komplikace, věk, forma onkologické léčby). Saddoughi v souboru nebývalých rozměrů – 3500 resekcí jícnu za 30 let – zaznamenal významný rozdíl celkového 5letého přežití ve stadiu T2 a nižším (50 %) vs. T3 a vyšším (17 %) (p = 0,0002), i rovněž kratší dobu do rekurence u stadia N2 (19).
ZÁVĚR
Naše výsledky dokladují vliv více faktorů na celkové přežití pacienta po resekci jícnu, než jsou jen parametry TNM klasifikace a typ karcinomu. Prognóza i přes radikální chirurgický výkon zůstává nepříznivá, přestože se domníváme, že jsme na limitech chirurgické léčby. Zlepšení tak v budoucnu může přinést spíše pokrok v onkologické léčbě. Zásadní ovšem zůstává prevence.
Střet zájmů: žádný.
ADRESA PRO KORESPONDENCI:
doc. MUDr. Jarmil Šafránek, Ph.D.
Chirurgická klinika FN Plzeň
Alej Svobody 80, 304 60 Plzeň
e-mail: safranek@fnplzen.cz
Sources
1. Allum WH, Stenning SP, Bancewicz J, et al. Long-term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer. J Clin Oncol 2009; 27 : 5062–5067.
2. Armanios M, Xu R, Forastiere AA, et al. Adjuvant chemotherapy for resected adenocarcinoma of the esophagus, gastro-esophageal junction, and cardia: phase II trial (E8296) of the Eastern Cooperative Oncology Group. J Clin Oncol 2004; 22 : 4495–4499.
3. Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial. Lancet 2012; 379 : 1887–1892.
4. Keegan N, Keane F, Cuffe S, et al. ICORG 10-14: Neo-AEGIS: a randomized clinical trial of neoadjuvant and adjuvant chemotherapy (modifi ed MAGIC regimen) versus neoadjuvant chemoradiation (CROSS protocol) in adenocarcinoma of the esophagus and esophagogastric junction. Proc Am Soc Clin Oncol 2014; 32(5 Suppl): TPS4145.
5. Kelsen DP, Winter KA, Gunderson LL, et al. Long-term results of RTOG trial 8911 (USA Intergroup 113): a random assignment trial comparison of chemotherapy followed by surgery compared with surgery alone for esophageal cancer. J Clin Oncol 2007; 25 : 3719–3725.
6. Lee CH, Wu DC, Lee JM, et al. Carcinogenetic impact of alcohol intake on squamous cell carcinoma risk of the oesophagus in relation to tobacco smoking. Eur J Cancer 2007; 43 : 1188–1199.
7. Lerut T, Nafteux P, Moons J, et al. Three-field lymphadenectomy for carcinoma of the esophagus and gastroesophageal junction in 174 R0 resections: impact on staging, disease-free survival, and outcome: a plea for adaptation of TNM classification in upper-half esophageal carcinoma. Ann Surg 2004; 240 : 962–972.
8. Luketich JD, Alvelo-Rivera M, Buenaventura PO, et al. Minimally invasive esophagectomy: outcomes in 222 patients. Ann Thorac Surg 2003; 238 : 486–495.
9. Luketich JD, Pennathur A, Franchetti Y, et al. Minimally invasive esophagectomy: results of a prospective phase II multicenter trial-the eastern cooperative oncology group (E2202) study. Ann Surg 2015; 261(4): 702–707.
10. Gammon MD, Schoenberg JB, Ahsan H, et al. Tobacco, alcohol, and socioeconomic status and adenocarcinomas of the esophagus and gastric cardia. J Natl Cancer Inst 1997; 89 : 1277–1284.
11. Hulscher JBF, van Sandick JW, de Boer AGEM, et al. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus. N Engl J Med 2002; 347 : 1662–1669.
12. Macdonald JS, Smalley SR, Benedetti J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345 : 725–730.
13. van Meerten E, van der Gaast A. Systemic treatment for oesophageal cancer. Eur J Cancer 2005; 41 : 664–672.
14. Nakamura K, Kato K, Igaki H, et al. Three-arm phase III trial comparing cisplatin plus 5-FU (CF) versus docetaxel, cisplatin plus 5-FU (DCF) versus radiotherapy with CF (CF-RT) as preoperative therapy for locally advanced esophageal cancer (JCOG1109, NExT study). Jpn J Clin Oncol 2013; 43 : 752–755.
15. Nishihira T, Hirayama K, Mori S. A prospective randomized trial of extended cervical and superior mediastinal lymphadenectomy for carcinoma of the thoracic esophagus. Am J Surg 1998; 175 : 47–51.
16. Nguyen NT, Follette DM, Wolfe BM, et al. Comparison of minimally invasive esophagectomy with transthoracic and transhiatal esophagectomy. Arch Surg 2000; 135 : 920–925.
17. Obermannová R. Moderní léčba karcinomu jícnu, gastroesofageální junkce a žaludku-update roku 2017. Gastroent Hepatol 2017; 71(5): 409–414.
18. Pennathur A, Gibson MK, Jobe BA, Luketich JD. Oesophageal carcinoma. Lancet 2013; 381 : 400–412.
19. Saddoughi SA, Reinersman JM, Zhukov YO, et al. Survival after surgical resection of stage IV esophageal cancer. Ann Thorac Surg 2017; 103 : 261–266.
20. Shapiro J, van Lanschot JJ, Hulshof MC, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol 2015; 16 : 1090–1098.
21. Sjoquist KM, Burmeister BH, Smithers BM, et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma: an updated meta-analysis. Lancet Oncol 2011; 12 : 681–692.
22. Wang BY, Lin PY, Wu SC, et al. Comparison of pathologic stage in patients receiving esophagectomy with and without preoperative chemoradiation therapy for esophageal SCC.
J Natl Compr Canc Netw 2014; 12 : 1697–1705.
23. Zonča P, Peteja M, Richter V, a kol. Kompletní miniivazivní Ivor-Lewisova resekce jícnu. Rozhl Chir 2017; 96 : 114–119.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2018 Issue 2-
All articles in this issue
- Přehled dotazníků a škál hodnotících kvalitu života a non-motorické příznaky pacientů s Parkinsonovou nemocí
- Přežití po resekci karcinomu jícnu
- Vztah pohybové aktivity rodičů a jejich dětí v českých rodinách s dětmi s normální tělesnou hmotností a dětmi s nadváhou/obezitou
- Ateroskleróza a imunita Arterie jako terciární lymfoidní orgán?
- Vplyv compliancie u diabetikov 2. typu liečených inzulínom v selfmonitoringu glykémie na kompenzáciu ochorenia
- Srovnání ankle brachial indexu s ultrasonografickým vyšetřením tepen dolních končetin u diabetiků
- Profesionální onemocnění hlášená v České republice v roce 2017
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přežití po resekci karcinomu jícnu
- Přehled dotazníků a škál hodnotících kvalitu života a non-motorické příznaky pacientů s Parkinsonovou nemocí
- Srovnání ankle brachial indexu s ultrasonografickým vyšetřením tepen dolních končetin u diabetiků
- Vztah pohybové aktivity rodičů a jejich dětí v českých rodinách s dětmi s normální tělesnou hmotností a dětmi s nadváhou/obezitou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

