-
Medical journals
- Career
Kognitívna rehabilitácia u pacientov s miernou kognitívnou poruchou a demenciou v podmienkach denného stacionára – pilotná štúdia
: M. Tomagová 1; M. Miertová 1; I. Ondrejka 2; G. Hollá 2
: Ústav ošetrovateľstva Jesseniova lekárska fakulta Univerzity Komenského v BratislaveVedúci pracovník: doc. Mgr. Katarína Žiaková, PhD. 1; Psychiatrická klinika Univerzitná nemocnica Martin a Jesseniova lekárska fakulta v Martine Univerzity Komenského v BratislaveVedúci pracovník: doc. MUDr. Igor Ondrejka, PhD. 2
: Prakt. Lék. 2013; 93(6): 269-275
: Of different specialties
Kognitívna rehabilitácia (KR) je jedným z nefarmakologických terapeutických prístupov tvoriacich súčasť komplexnej starostlivosti o pacienta s miernou kognitívnou poruchou (MCI) a ľahkým až stredne ťažkým stupňom demencie. Jej benefity sú hlavne v oblasti kognitívneho a funkčného stavu, zároveň posilňuje sebarealizáciu pacienta, jeho sebahodnotenie, spokojnosť, sociálne kontakty, čo významne ovplyvňuje kvalitu života pacienta. Cieľom pilotnej intervenčnej štúdie je monitorovať oblasť kognitívnych funkcií, nálady, sebaopatery pred a po realizácii kognitívnej rehabilitácie v podmienkach denného stacionára u pacientov s miernou kognitívnou poruchou a s ľahkým až stredne ťažkým stupňom demencie. Práca má charakter kvantitatívno-kvalitatívnej pilotnej intervenčnej štúdie. Kognitívna rehabilitácia prebiehala v čase od apríla 2010 do mája 2012 v dennom stacionári Psychiatrickej kliniky Univerzitnej nemocnice Martin a Jesseniovej lekárskej fakulty v Martine Univerzity Komenského v Bratislave (JLF UK a UNM). Do kognitívnej rehabilitácie sme zaradili 6 pacientov s MCI a 11 s dementným syndrómom. Empirické údaje o pacientoch pred a po kognitívnej rehabilitácii sme získali prostredníctvom vybraných meracích nástrojov, pološtrukturovaného rozhovoru a analýzou zdravotnej dokumentácie. Zo zaradených pacientov 3 s MCI a 3 s demenciou absolvovali celý cyklus kognitívnej rehabilitácie. Registrovali sme niekoľko faktorov (dekompenzácia telesného stavu, progresia demencie, depresia, spolupráca príbuzných) znižujúce komplianciu pacientov. Významným výsledkom u tých, ktorí absolvovali KR sa javí spokojnosť s priebehom kognitívnej rehabilitácie a vlastným výkonom. Výsledky našej pilotnej štúdie v oblasti kognície, nálady, sebaopatery sú porovnateľné s výsledkami viacerých zahraničných štúdií. Naša štúdia má niekoľko limitácií a vážnym problémom sa ukazuje kompliancia pacientov, preto problematika vyžaduje ďalšie skúmanie a výsledky nie je možné generalizovať.
KĽÚČOVÉ SLOVÁ:
kognitívna rehabilitácia – demencia – mierna kognitívna poruchaÚVOD
Kognitívna rehabilitácia (KR) je jedným z nefarmakologických terapeutických prístupov tvoriacich súčasť komplexnej starostlivosti o pacienta s miernou kognitívnou poruchou (MCI) a s demenciou, konkrétne s ľahkým až stredne ťažkým stupňom demencie (17, 20). Ponímaná je aj ako súčasť preventívnych aktivít v súvislosti s MCI (34), zároveň ako suplementárna terapia k farmakoterapii demencie (33). Obsahuje intervencie cielene zamerané na aktivizáciu pacienta (a zároveň aj rodinných príslušníkov), na stabilizáciu kognitívnych funkcií vychádzajúc z individuálnych požiadaviek a potrieb pacienta tak, aby sa kompenzoval jeho kognitívny deficit (16). V KR sú zadefinované dva základné prístupy:
- posilňujúci (kognitívny deficit je zlepšený prostredníctvom rôznych opakujúcich sa cvičení) a
- kompenzačný (adaptívne stratégie a úpravy prostredia sú použité pre obnovenie funkcie napriek trvajúcemu deficitu).
Tieto dva prístupy môžu byť kombinované a ich komponenty zahrnuté do iných nefarmakologických (psychosociálnych) foriem terapie (10). Daný prístup má teoreticko-metodologický rámec a vychádza z individuálnych požiadaviek pacienta (32).
V manažmente starostlivosti o pacientov s demenciou sa KR odporúča na základe výsledkov výskumných štúdií prezentovaných v klinických odporúčaných postupoch (guidelines) rôznych odborných spoločností, napr. European Federation of Neurological Societies (34), American Psychiatric Association (30), Česká neurologická spoločnosť (31). V Slovenskej republike zatiaľ nebol publikovaný klinický odporúčaný postup k prezentovanej problematike. Kognitívnu rehabilitáciu v klinickej praxi realizujú terapeuti na základe absolvovania vzdelávacích modulov (v Českej republike napr. v Gerontologickom centre, AD Centre a v Slovenskej republike v Centre Memory, n.o. v Bratislave).
Benefity KR sú hlavne v oblasti kognitívneho a funkčného stavu, nálady, zároveň posilňuje sebarealizáciu pacienta, jeho sebahodnotenie, spokojnosť, sociálne kontakty, prežívaný stav pohody, čo významne ovplyvňuje kvalitu života pacienta. Pozitívny efekt metódy sa prejaví aj na znížení záťaže opatrovateľa. Zároveň umožní zhodnotenie síl a limitácií v kognitívnom fungovaní pacienta a demonštruje efekt poskytovanej liečby (16, 32).
Sitzer et al. (33) upozorňujú na problematiku uvádzania jednoznačných záverov o benefitoch kognitívnej rehabilitácie vzhľadom k tomu, že vo väčšine štúdií na danú tému sa u pacientov uplatňuje komplexná terapia a je problematické hodnotiť účinnosť jednotlivých stratégií. Predpokladom dosahovania aspoň parciálnych benefitov a cieľov je dlhodobá aktívna spolupráca pacienta (a jeho príbuzných) (23), ktorá je ovplyvnená širokým spektrom faktorov, ako je vek, pohlavie, vzdelanie, sociálny stav, motivácia pacienta, kognícia, zmeny v nálade (depresia), postoj k terapii, vzťah medzi pacientom a zdravotníckym pracovníkom, zdravotná gramotnosť, pacientove vedomosti o ochorení a liečbe, s terapiou spojené faktory (komplexnosť, trvanie, nutné zmeny v životnom štýle), sociálna opora, dostupnosť zdravotníckych služieb a iné (19).
V nadväznosti na vyššie uvedené, cieľom našej pilotnej intervenčnej štúdie bolo monitorovať oblasť kognitívnych funkcií, nálady, sebaopatery pred a po realizácii kognitívnej rehabilitácie u pacientov s ľahkým až stredne ťažkým stupňom demencie a MCI v podmienkach denného stacionára.
SÚBOR A METODIKA
Kognitívna rehabilitácia bola realizovaná v období od apríla 2010 do mája 2012. Do KR bolo zaradených 17 pacientov (3 muži a 14 žien), ich priemerný vek bol 69,18 roka.
Pred ich zaradením bolo realizované psychiatrické a psychologické vyšetrenie a u pacientov prebiehala farmakoterapia demencie (kognitíva, antialzheimeriká) a depresie (antidepresíva). Výber pacientov bol zámerný podľa vopred zadefinovaných zaraďovacích kritérií: diagnostikovaná MCI (pozn. MCI sme definovali v súlade s MKCH 10 (25) ako poruchu, ktorú charakterizuje zhoršenie pamäti, ťažkosti pri učení a znížená schopnosť sústredenia na určitú úlohu po dlhší čas. Pri pokusoch o psychický výkon sa často pociťuje duševná vyčerpanosť, učenie nového sa subjektívne prežíva ako namáhavé, aj keď objektívne úspešné.), alebo dia-gnostikovaný ľahký až stredne ťažký stupeň demencie podľa medzinárodne platných kritérií, indikácia psychiatra pre KR, farmakoterapia demencie viac ako 3 mesiace pred začiatkom KR, informovanosť príbuzných o priebehu a význame KR, farmakoterapia depresie (antidepresívami) v prípade jej prítomnosti, písomný informovaný súhlas pacientov s účasťou na KR, ochota a schopnosť spolupracovať, neprítomnosť porúch vedomia, zachovaný alebo kompenzovaný zrak, sluch a jemná motorika, zachovaná schopnosť porozumieť a odpovedať, bývanie v rodinnom prostredí s príbuzným. Vyraďujúce kritériá boli: diagnostikovaný rozvinutý stredne ťažký a ťažký stupeň demencie podľa medzinárodne platných kritérií, psychotická porucha, závislosť od psychoaktívnych látok, novodiagnostikovaná depresia, farmakoterapia demencie menej ako 3 mesiace, liečba depresie menej ako 3 mesiace, odmietnutie spolupráce zo strany pacienta, neschopnosť písať a čítať, poruchy reči, nekorigovaná porucha zraku a sluchu, narušená motorika dominantnej hornej končatiny, poruchy správania, dekompenzácia v telesnom stave.
Pacienti zaradení do kognitívnej rehabilitácie boli z regió-nu Turiec a všetci bývali v domácom prostredí s príbuznými (manžel, manželka, syn, dcéra).
V sledovanom období kognitívnu rehabilitáciu predčasne ukončilo 11 pacientov. Celý cyklus kognitívnej rehabilitácie absolvovalo a záverečného posúdenia sa zúčastnilo 6 pacientov (1 muž a 5 žien).
Kognitívnu rehabilitáciu sme realizovali v čase od apríla 2010 do mája 2012 v dennom stacionári Psychiatrickej kliniky JLF UK a Univerzitnej nemocnice Martin, s frekvenciou 1krát za týždeň, v rozsahu 90 minút, ako to uvádzajú Čunderlíková, Wirth (12). Kompetenciu realizovať KR sme získali na základe absolvovania vzdelávacích kurzov v Centre Memory n.o. v Bratislave. Realizácia pilotnej štúdie bola schválená etickou komisiou Jesseniovej lekárskej fakulty v Martine Univerzity Komenského v Bratislave.
Jednotlivé aktivity kognitívnej rehabilitácie boli zamerané na oblasť zmyslového vnímania, orientáciu, pozornosť, pamäť, motiváciu, exekutívne funkcie, komplexné myšlienkové operácie (priestorovo-konštrukčné myslenie, asociačné myslenie, riešenie logických úloh, abstrakciu, fantáziu, tvorivosť), na reguláciu sociálneho správania, stimuláciu pohybovej aktivity (senzomotoriky a koordinácie). KR prebiehala v dvoch skupinách: skupina 6 pacientov s MCI a skupina 11 pacientov s demenciou. Výber cvičení pre pacientov bol na základe ich kognitívnych schopností, záujmov a preferencií. Rehabilitačná jednotka (RJ) bola štruktúrovaná nasledovne: úvod (privítanie, zakotvenie v realite, podpora komunikácie), pohybovo-koncentračné cvičenie, realizácia jednotlivých kognitívnych úloh, záver (ocenenie práce, podpora sebareflexie, rozlúčenie) (12, 21). Rodinní príslušníci neboli počas KR prítomní. O priebehu boli informovaní po jej ukončení. V prípade, že príbuzný nesprevádzal pacienta na a z KR, bol kontaktovaný telefonicky.
Práca má charakter kvantitatívno-kvalitatívnej pilotnej intervenčnej štúdie. Pre zber empirických údajov o kognícii, depresii a sebaopatere v aktivitách denného života (activity daily living, ADL) pred a po ukončení KR sme použili nasledovné meracie nástroje. Údaje o kognícii globálne sme zistili prostredníctvom Addenbrookského kognitívneho testu (ACE-R) (3), ktorý je charakterizovaný ako neuropsychologická screeningová testová batéria slúžiaca k záchytu demencie. Jej súčasťou je Folsteinov test (MMSE) a Test kreslenia hodín (CDT). Zároveň bol použitý Test cesty (TMT), ktorý má skríningový charakter a jeho výsledok je ukazovateľom všeobecnej výkonnosti mozgu. Je senzitívny v prípade organického poškodenia mozgu a niektorých kognitívnych funkcií, napr. psychomotorického tempa. Skladá sa z dvoch častí A a B, výsledné skóre pre každú časť vyjadruje čas potrebný na realizáciu úloh (29).
Pre posúdenie pamäti bola použitá Wechslerova škála pamäti (WMS) (38). Nástroj obsahuje 7 subtestov hodnotiacich sluchovú a zrakovú pamäť, bezprostredné a oddialené vybavenie, bezprostrednú, oddialenú, celkovú a verbálno-logickú pamäť, asociačné učenie. Prítomnosť depresívnej nálady bola zisťovaná sebaposudzovacím nástrojom Geriatrická škála depresie (GDS) (37). Nástroj je považovaný ako vhodný aj pre posudzovanie pacientov s ľahkou a stredne ťažkou kognitívnou poruchou (15), pretože má jednoduchšiu administráciu vyžadujúcu nižšiu mieru koncentrácie. Pre potreby skríningu vo vykonávaní aktivít denného života sme použili Barthelovej index aktivít denného života (Barthel ADL) (24) a Škálu inštrumentálnych aktivít denného života (Lawton-Brody IADL) (22), vhodné pre posudzovanie sebaopatery u pacientov s MCI a dementným syndrómom. Barthelovej index ADL bol použitý iba u pacientov s demenciou, pretože funkčný stav v oblasti ADL u pacientov s MCI bol neporušený. Tieto meracie nástroje z dôvodu zachovania reliability a senzitivity boli administrované príbuznými, tak ako uvádza Bóriková (4).
Prostredníctvom pološtrukturovaného rozhovoru s pacientmi boli zisťované očakávania od KR a dôvody jej absolvovania, ktoré boli zaznamenané do zdravotnej dokumentácie pacientov. V prípade, keď pacient predčasne ukončil KR, boli od neho i príbuzného zisťované prostredníctvom rozhovoru príčiny tohto ukončenia. Zároveň bol lekárom zhodnotený zdravotný stav pacienta. Analýzou zápisu o dôvodoch ukončenia KR boli stanovené významové kategórie vyjadrujúce faktory, ktoré pacienti a ich príbuzní oznámili ako podstatné bariéry pre absolvovanie celého cyklu KR.
VÝSLEDKY
Do kognitívnej rehabilitácie bolo zaradených spolu 17 pacientov, predčasne ju ukončilo 11 pacientov. Celý cyklus kognitívnej rehabilitácie absolvovalo a záverečného posúdenia sa zúčastnilo 6 pacientov (3 s MCI a 3 s demenciou) (tab. 2). Príčiny predčasného ukončenia sme zhrnuli do niekoľkých kategórií - kognitívny deficit (progresia demencie, znížená kritickosť, bagatelizácia ťažkostí); prítomnosť depresie u pacienta (neschopnosť sa potešiť z aktivity, znížená ochota spolupráce, pokles koncentrácie pozornosti, spomalenie psychomotorického tempa, neistota v riešení úloh); dekompenzácia v telesnom stave (muskuloskeletálneho ochorenia, kardiovaskulárneho ochorenia, onkologického ochorenia, cerebrovaskulárneho ochorenia, protrahovaný priebeh bronchopneumónie); nedostatočná informovanosť o KR zo strany pacienta a príbuzného (pochybnosti o význame KR, skreslené a nereálne očakávania od KR) a zvyšujúce sa nároky na príbuzného v starostlivosti o pacienta s demenciou v domácom prostredí. Vyjadrenia jednotlivých pacientov k očakávaniam a k dôvodom absolvovania kognitívnej rehabilitácie uvádzame v tabuľke 1. Výsledky meracích nástrojov u posudzovaných pacientov pred a po kognitívnej rehabilitácii uvádzame v tabuľke 2.
1. Vyjadrenia pacientov k očakávaniam a dôvodom absolvovania 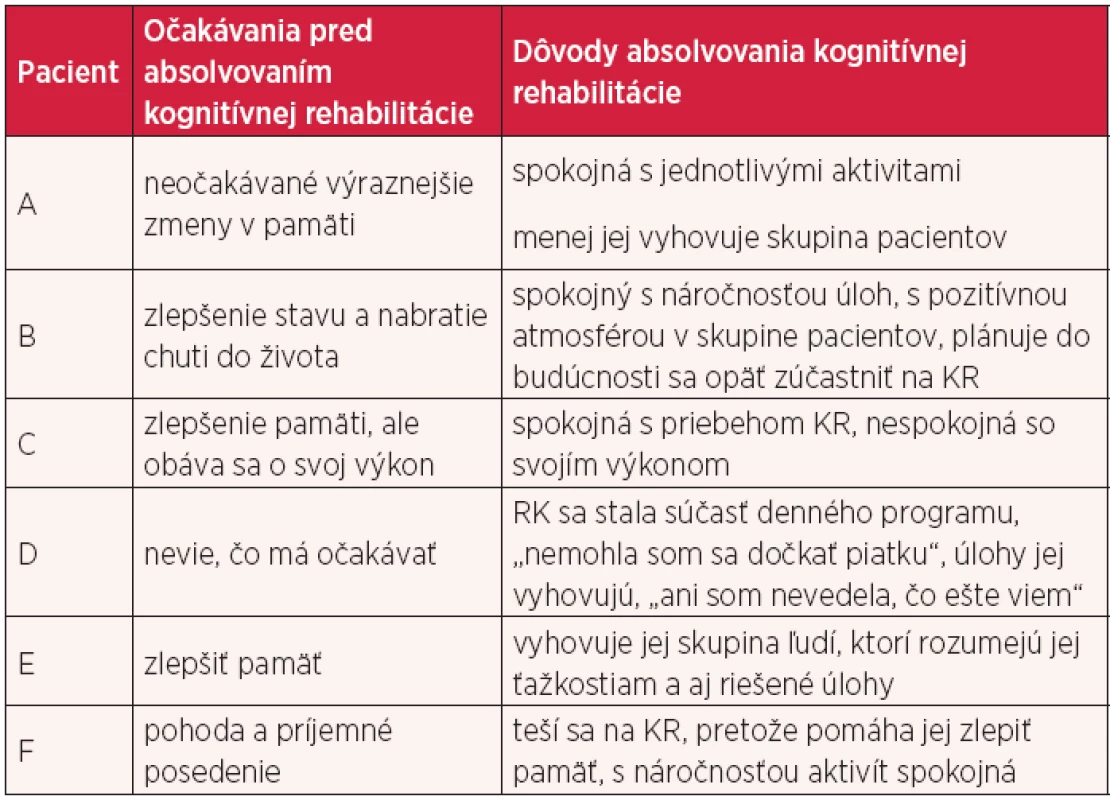
2. Výsledky meracích nástrojov u pacientov s MCI a dementným syndrómom 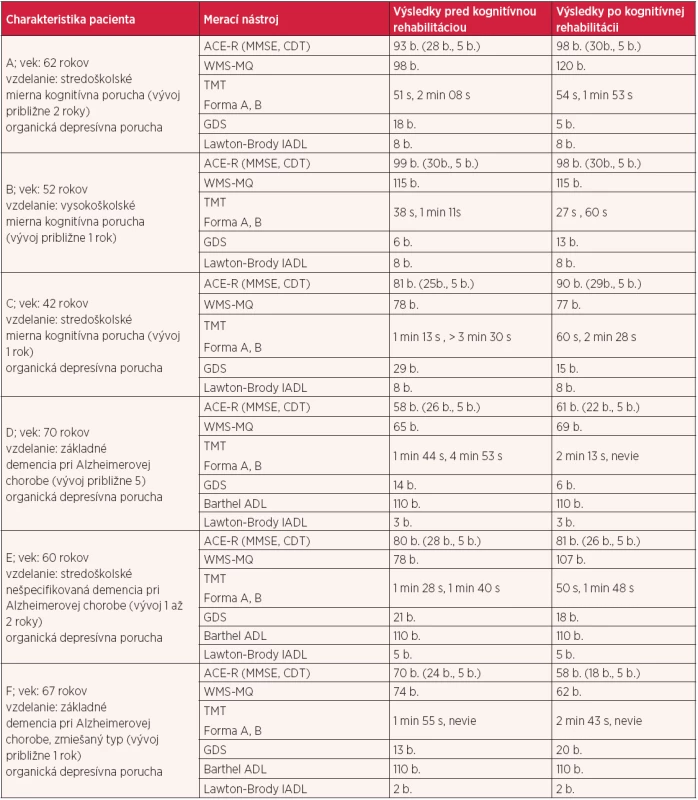
Legenda: b. – body, s – sekunda, min – minúta Interpretácia výsledného skóre nástrojov: ACE-R (The Addenbrooke’s Cognitive Examination Revised) „cut-off“ bod je 88 (18) MMSE (Mini-Mental State Examination) 30–25 b. bez kognitívneho poškodenia, 24–21 b. mierna kognitívna porucha, 10–20 b. stredná kognitívna porucha, ≤ 9 b. ťažká kognitívna porucha CDT (Clock Drawing Test) 0 b. vážne zmeny v zrakovopriestorových funkciách, 5 b. bez zmeny v zrakovopriestorových funkciách (18) WMS (Wechsler Memory Scale) MQ (Memory Quotient) 115 b. a viac je nadpriemer, 115–90 b. je norma, 89–76 b. sú mierne parciálne poruchy, 75–50 b. je defekt (37) TMT (Trail Making Test) forma A 24–79 s norma, 80–97 s hraničná hodnota, 98 s a viac poškodenie kognitívnych funkcií; forma B 46–202 s norma, 203–254 s hraničná hodnota, viac ako 255 s poškodenie kognitívnych funkcií (28) GDS (Geriatric Depresion Scale), skóre 0–10 b. norma, 11–20 b. mierna depresia, 21–30 b. ťažká depresia (36) Barthel ADL (The Barthel Index of Activities of Daily Living) 0–40 b. vysoká závislosť, 45–60 b. stredná závislosť, nad 60 b. mierna závislosť, nad 100 b. nezávislosť (24) Lawton-Brody IADL (The Lawton Instrumental Activities of Daily Living Scale) 0–8 b., „cut of“ bod je 5 (22) DISKUSIA
Do kognitívnej rehabilitácie sme zaradili 17 pacientov na základe zaraďujúcich kritérií uvedených v literárnych zdrojoch (8, 36), z nich iba 3 pacienti s MCI a 3 s demenciou absolvovali celý jej cyklus. Ako vážny problém počas realizácie kognitívnej rehabilitácie u prezentovanej skupiny pacientov, uvedený aj v štúdiách podobného zamerania (7), sa javila ich spolupráca. Pacienti zaradení do pilotnej štúdie mali diagnostikovanú MCI a ľahký až začiatok stredne ťažkého stupňa demencie, kedy je ešte predpoklad schopnosti spolupráce (28). Zároveň sa však kognitívny deficit považuje za vážny prediktor nonkompliancie pacientov (19) tak, ako bolo načrtnuté aj v našej štúdii. Depresia je tiež významný faktor, ktorý redukuje aktivitu a spoluprácu pacienta počas farmakoterapie i rehabilitácie (13). Prezentovaní pacienti patria prevažne do vekovej skupiny seniorov, ktorá sa považuje za rizikovú skupinu pre nonkomplianciu z dôvodu špecifických zmien vyplývajúcich z veku, napr. nárast počtu chronických chorôb, zmyslový deficit (19), okrem toho autori uvádzajú informovanosť o terapii ako dôležitú v podpore kompliancie. V našom prípade je to jedna z oblastí, ktorú je potrebné posilniť u pacientov a ich príbuzných, s cieľom udržania ich aktivity počas celého trvania KR. Aj príbuzní z viacerých dôvodov, ako napr. fyzické a psychické vyčerpanie, depresia, nedocenenie významu KR, sa spolupodieľali na jej predčasnom ukončení u posudzovaných pacientov, ktorí boli závislí na ich pomoci. Dostupnosť a pomoc príbuzných je charakterizovaná ako zdroj podporujúci resilienciu pacienta s demenciou v rámci nefarmakologickej terapie, ale na druhej strane zhoršenie stavu pacienta je vyčerpávajúce pre rodinných príslušníkov poskytujúcich opateru pacientom, čo sa stáva dôvodom pre neposkytnutie potrebnej pomoci a starostlivosti (6).
V nami prezentovanej skupine pacientov s MCI (pacient A, B, C) zisťujeme prostredníctvom meracích nástrojov stabilizáciu stavu až mierne zlepšenie v kognícii globálne (výsledky ACE-R vrátane MMSE) a v sledovaných parametroch pamäti (výsledky WMS), v zrakovo-priestorových schopnostiach, v psychomotorickom tempe, v exekutívnych funkciách (výsledky CDT, TMT) (tab. 2). Faucounau et al. (14), ktorí sa zaoberajú kognitívnou rehabilitáciou u pacientov s MCI, uvádzajú niekoľko jej významov pre túto skupinu, hlavne v oblasti stimulácie kognitívnych funkcií môže prispieť k optimalizácii kognitívneho fungovania, udržaniu kognitívnej kapacity a prispieva k spomaleniu kognitívneho poklesu.
Závery štúdie autorov Talassi et al. (35) o signifikantnom vplyve kognitívnej rehabilitácie na kogníciu u pacientov s MCI nie sú jednoznačné, tento vplyv potvrdený nebol. Štúdie skúmajúce vzťah medzi kognitívnou rehabilitáciou a jej benefitmi u pacienta majú často niekoľko metodologických limitácií, ako sú nedostatok randomizovaných štúdií, malá vzorka respondentov, krátka doba trvania rehabilitácie, rozdielnosť v metodike a časovom trvaní KR, čo je problematické pre vyhodnocovanie výsledkov a uvádzania jednoznačných záverov o efektivite KR (11).
U pacientov D a E s diagnostikovaným dementným syndrómom meracie nástroje ACE-R a WMS poukazujú na stabilizáciu až mierne zlepšenie v kognitívnom stave. MMSE a TMT naopak signalizujú mierny pokles, čo však môže súvisieť s ich nižšou citlivosťou a špecifickosťou na kognitívny deficit v rámci ľahkej formy demencie (36). U pacientky F sa kognitívny výkon vo všetkých sledovaných parametroch zhoršil, zhoršila sa aj depresívna symptomatika a kritickosť pacientky (tab. 1, 2), zároveň aj psychiater na základe klinického stavu konštaroval progresiu demencie.
V súčasnej dobe sú k dispozícii viaceré štúdie posudzujúce účinnosť KR. Bottino et al. (5) potvrdzujú význam KR spojenej s farmakoterapiou (inhibítormi cholínesterázy) u pacientov s ľahkou formou demencie Alzheimerovho typu na stabilizácii až zlepšení kognitívneho a funkčného výkonu. Viola et al. (36) zistili v sledovanom súbore 25 pacientov s demenciou Alzheimerovho typu stabilizáciu v kognícii globálne. Systematické prehľady a metaanalýzy štúdií, však v mnohých aspektoch neprinášajú jednoznačné závery o benefitoch KR u pacientov s demenciou. Nebol identifikovaný signifikantne pozitívny, ale ani signifikantne negatívny efekt KR (28, 14, 9). Zároveň sú problémové aj z metodologického hľadiska, pretože väčšina nefarmakologických prístupov je uchopiteľná skôr kvalitatívnymi metódami, zatiaľ čo prax založená na dôkazoch (EBP) vyžaduje výsledky kvantitatívne (17).
Prostredníctvom GDS sme monitorovali prítomnosť depresívnej nálady, ktorá sa považuje za jeden z faktorov zhoršujúcich kognitívny výkon (19). K stabilizácii až zlepšeniu kognitívneho výkonu mohla prispieť aj stabilizácia v stave nálady (pacienti A, B, C) (tab. 2). Zároveň ku stabilizácii nálady, zmierneniu depresie a úzkosti mohla viesť aj samotná KR (36).
Oblasť funkčného stavu je považovaná za jednu z cieľových oblastí pôsobenia kognitívnej rehabilitácie (39). Nástroje Barthel ADL a Lawton-Brody IADL sú často používané nástroje pri hodnotení sebaopatery vo vzťahu ku zmenám v kognitívnych funkciách. Nástroj Lawton-Brody IADL identifikoval pred a po absolvovaní KR u pacientov s MCI úplnú sebestačnosť vo vykonávaní inštrumentálnych aktivít denného života. Špecifické zmeny v sebaopatere pacientov s MCI sme nezistili vzhľadom k tomu, že Lawton-Brody IADL patrí medzi generické nástroje, nie je dostatočne citlivý na zachytenie takýchto špecifických zmien pri MCI. Medzi ne patria napr. správne užívanie liekov, iniciácia komplexnej aktivity, rešpektovanie dohodnutých termínov stretnutí (26). Ďalším limitujúcim faktorom môže byť vek pacientok, pretože citlivosť IADL stúpa až vo vekovej skupine 75 a viac rokov.
U pacientov s demenciou sme posudzovali zmeny funkčného stavu v oblasti aktivít denného života prostredníctvom Barthel ADL a vo všetkych troch prípadoch sme zistili úplnú nezávislosť (tab. 2). Môže to súvisieť s tým, že významejšie zmeny v ADL sa vyskytujú až v stredne ťažkom a ťažkom stupni demencie (27). Lawton-Brody IADL identifikoval zvyšujúcu sa závislosť v IADL. Ako úspech kognitívnej rehabilitácie môže byť považované udržanie existujúcej úrovne funkčného stavu a spomalenie progresie závislosti na pomoci iných (1), ako sme zistili u všetkých hodnotených pacientov.
Jeden z významných výsledkov KR je popisovaná spokojnosť pacientov s jej priebehom (28), hlavne v súvislosti s dosahovaním ich osobných cieľov v rámci KR v oblasti kognitívnych funkcií, funkčného stavu, sociálneho kontaktu, sebadôvery (7). Pacienti, ktorí absolvovali celý cyklus KR, hodnotili priebeh kognitívnej rehabilitácie kladne. Spokojnosť s jej priebehom, s vlastným výkonom môže prispieť k sebadôvere, ako v prípade pacienta D. Vyjadrenia pacientov pred KR o ich očakávaniach v súvislosti s touto terapiou sa ukazujú ako podstatné pre prežívanie spokojnosti s jej priebehom a výsledkami, zároveň aj spoluprácu pacienta. Z tohto dôvodu vyjadrenie pacientky F „neviem, čo mám očakávať“ (tab. 1), je podnet pre terapeuta na podrobnejšiu informovanosť pacienta, pretože jeho motivácia je považovaná za významný faktor udržania spolupráce (2). Vysoké očakávania alebo nedocenenie významu KR zo strany pacienta a príbuzného sa ukazuje ako dôvod nespokojnosti pacientov a zníženie ich spolupráce. Hodnotenie pacientky A po ukončení KR „menej mi vyhovuje skupina“ alebo pacientky C „nespokojná so svojím výkonom“ sú tiež významným podnetom pre individuálnu prácu terapeuta a pacienta, ktorá sa môže javiť viac prínosná ako rešpektovanie štandardného plánu rehabilitácie (8).
ZÁVER
I napriek tomu, že kognitívna rehabilitácia je súčasťou komplexnej starostlivosti o pacientov s MCI a demenciou, v Slovenskej republike absentuje komplexný výskumý záujem o túto problematikou v porovnaní so zahraničím. Vyvodzovanie jednoznačných záverov o benefitoch KR u pacientov zahrnutých do štúdie je problematické vzhľadom k tomu, že u pacientov sa uplatňuje komplexná terapia a nie je možné hodnotiť účinnosť jednotlivých stratégií separátne. V pilotnej štúdii benefity KR sme zistili hlavne v oblasti spokojnosti pacientov a podpory ich sociálneho kontaktu. Vážnym problémom sa v štúdii ukazuje kompliancia pacientov. Samotná podstata demencie ako neurodegeneratívneho ochorenia a jej dlhodobá liečba je negatívnym prediktorom pre dlhodobú spoluprácu pacientov v terapeutickom procese. V popisovanom súbore pacientov sumarizujeme niekoľko faktorov (dekompenzácia telesného stavu, progresia demencie, depresia, znížená spolupráca príbuzných), ktoré znižujú spoluprácu pacienta počas KR a spôsobujú jej predčasné ukončenie. Z dôvodu dosahovania benefitov KR u pacientov, redukciu pre nich nadmernej záťaže, je potrebné zvážiť ich zaradenie do KR. Na základe literárnych zdrojov a našich skúseností navrhujeme už v charakteristike súboru spomínané zaraďovacie kritériá doplniť o nasledovné: kompenzovaný telesný stav pacientov, zachovaná chôdza pacientov (aj prostredníctvom kompenzačných pomôcok), záujem pacientov a príbuzných o KR, ochota príbuzných spolupracovať. Ďalšie možnosti zlepšenia kompliancie pacientov a príbuzných sú v ich podrobnejšej informovanosti o význame a priebehu KR, v rešpektovaní homogenity skupiny pri jej kreácii, v prehodnotení vhodnosti jednotlivých rehabilitačných aktivít a dĺžky trvania KR vzhľadom na individualitu pacientov.
Naša štúdia má niekoľko limitácií, hlavne nízky počet respondentov, veľký vekový rozptyl pacientov, absencia kontrolnej skupiny, nesledované niektoré významné premenné (napr. vzdelanie pacientov, kompliancia pacientov s farmakoterapiou) vo vzťahu k efektivite KR, preto nie je možné získané výsledky generalizovať.
Poďakovanie
Autori vyjadrujú poďakovanie všetkým pacientom a ich rodinným príslušníkom, ktorí participovali v pilotnej štúdii.
Uvedený príspevok bol finančne podporený projektom KEGA 054UK-4/2012 Meracie nástroje v gerontologickom ošetrovateľstve – tvorba elektronickej databázy.
ADRESA PRO KORESPONDENCI:
doc. Mgr. Martina Tomagová, PhD.
Ústav ošetrovateľstva
Jesseniova lekárska fakulta UK
Malá Hora 5, 036 01 Martin, Slovenská republika
e-mail: tomagova@jfmed.uniba.sk
Sources
1. Acevedo A, Loewenstein DA. Nonpharmacological cognitive interventions in aging and dementia. J Geriatr Psychiatry Neurol 2007; 20(4): 239–249.
2. Bagwell DK, West RL. Assessing compliance: active versus inactive trainees in a memory intervention. Clin Interv Aging 2008; 3(2): 371–382.
3. Bartoš A, Hasalíková M. Poznejte demenci správně a včas – příručka pro klinickou praxi. Praha: Mladá fronta 2010.
4. Bóriková I. Posudzovanie aktivít denného života. Assessment of activities of daily living. Ošetřovatelství a porodní asistence 2010; 1(1): 24–30.
5. Bottino CM, Carvalho IA, Alvarez AM, et al. Cognitive rehabilitation combined with drug treatment in Alzheimer‘s disease patients: a pilot study. Clin Rehabil 2005; 19(8): 861–869.
6. Brodaty H. Meta-analysis of nonpharmacological intervetions for neuropsychiatric symptoms of dementia. Am J Psychiatry 2012; 169(9): 946–953.
7. Clare L, Linden DE, Woods RT, et al. Goal-oriented cognitive rehabilitation for people with early stage Alzheimer disease: a single-blind randomized controlled trial of clinical efficacy. Am J Geriatr Psychiatry 2010; 18(10): 928–939.
8. Clare L, van Paaschen J, Evans SJ, et al. Goal-oriented cognitive rehabilitation for an individual with Mild Cognitive Impairment: behavioural and neuroimaging outcomes. Neurocase 2009; 15(4): 318–331.
9. Clare L, Woods B. Cognitive rehabilitation and cognitive training for early-stage Alzheimer’s disease and vascular dementia (Cochrane Review) [online]. The Cochrane Library 2008; 4 : 3 [cit. 2013-01-26]. Dostupné z: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD003260/pdf/abstract.
10. Clare L, Woods RT. Cognitive trainig and cognitive rehabilitation for people with early-stage Alzheimer´s disease: A review. Neuropsychol Rehabil 2004; 14(4): 385–401.
11. Coley N, Andrieu S, Gardette V, et al. Dementia prevention: Methodological explanations for inconsistent results. Epidemiol Rev 2008; 30(1): 35–66.
12. Čunderlíková M, Wirth M. Trénovanie kognitívnych funkcií a špecifiká komunikácie u ľudí s poruchami pamäti. Bratislava: Centrum MEMORY 2009.
13. Demyttenaere K. Risk factors and predictors of compliance in depression. Eur Neuropsychopharmacol 2003; 13(Suppl 3): 69–75.
14. Faucounau V, Wu YH, Boulay M, et al. Cognitive intervention programmes on patients affected by mild cognitive impairment: a promising intervention tool for MCI? J Nutr Health Aging 2010; 14(1): 31–35.
15. Frank-Stromborg M, Olsen SJ, et al. Clinical health-care research. 3rd ed. Massachusetts: Jones and Bartlett Publishers 2004.
16. Gardette V, Coley N, Anrieu S. Non-pharmacologic therapies: a different approach to AD. The Canadian review of Alzheimer´s Disease and other Dementias [online] 2010 : 13–22 [cit. 2011–02–15]. Dostupné z: http://www.stacommunications.com/customcomm/Back–issue_pages/AD_Review/adPDF s/2010/October2010/13.pdf.
17. Holmerová I, Janečková H, Vaňková H, Veleta P. Nefarmakologické přístupy v terapii Alzheimerovy demence a praktické aspekty péče o postižené. Psychiatr. pro Praxi 2005; 6(4): 175–178.
18. Hummelová-Fanfrdlová Z, Rektorová I, Sheardová K. a kol. Česká adaptace Addenbrookského kognitivního testu. Československá psychologie 2009; 53(4): 376–388.
19. Jin J, Klar GE, Oh VM, et al. Factors affecting therapeutic compliance: Areview from the patient´s perspective. Ther Clin Risk Manag 2008; 1(4): 269–286.
20. Jirák R. a kol. Demence a jiné poruchy paměti. Praha: Grada Publishing 2009.
21. Klucká J, Volfová P. Kognitivní trénink v praxi. Praha: Grada Publishing 2009.
22. Lawton MP, Brody EM. Assessment of older people: self-maintaining and instrumental activities of daily living. Gerontologist 1969; 9 : 179–186.
23. Lindesay J, Bullock R, Daniels H, et al. Turning principles into practice in Alzheimer´s disease. Int J Clin Pract 2010; 64(10): 1198–1209.
24. Mahoney FI, Barthel DW. Functional evaluation: The Barthel Index. Maryland State Med J 1965; 14(2): 61–65.
25. Medzinárodná klasifikácia chorôb – MKCH 10. Duševné poruchy a poruchy správania F00–F99 [online]. Národné centrum zdravotníckych informácií 2011; 224 [cit. 2013-06-15]. Dostupné z: http://data.nczisk.sk/old/infozz/mkch/mkch–10/cast0500.pdf.
26. Pedrosa H, Guerreiro M, Maroco J, et al. Functional evaluation distinguishes MCI patients from healthy elderly people – the ADCS/MCI/ADL Scale. J Nutr Health Aging 2010; 14(8): 703–709.
27. Peres K, Helmer C, Amieva H, et al. Natural history of decline in instrumental activities of daily living performance over the 10 years preceding the clinical diagnosis of dementia: A prospective population-based study. J Am Soc Geriatr 2008; 56(1): 37–44.
28. Prince M, Bryce R, Ferri C. The benefits of early diagnosis and intervention [on-line]. London: Alzheimer´s Disease International, 2011): 68 [cit. 2013-01-15]. Dostupný z: http://www.alz.co.uk/research/WorldAlzheimerReport2011.pdf.
29. Preiss M, a kol. Test cesty. Bratislava: Psychodiagnostika 1997.
30. Rabins PV, Blacker D, Rovner BW, et al. Practice Guideline fot the Treatment of Patients with Alzheimer´s Disease and Others Dementias [online]. 2nd ed. American Psychiatric Association 2007 [cit. 2013-01-21]. Dostupné z: http://psychiatryonline.org/pdfaccess.ashx?ResourceID=243205&PDFSource=6.
31. Sheardová K, Hort J, Rusina R. a kol. Doporučené postupy pro terapii Alzheimerovy nemoci a ostatních demencí. Psychiatr prax 2009; 10(5): 224–227.
32. Sheardová K, Hort J, Rusina R, et al. Doporučené postupy pro léčbu Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Česk Slov Neurol N 2007; 70(5): 589–594.
33. Sitzer DI, Twamley EW, Jeste DV. Cognitive training in Alzheimer´s disease: a meta-analysis of the literature. Acta Psychiatr Scand 2006; 114(2): 75–90.
34. Sorbi S, Hort J, Erkinjuntti T, et al. EFNS-ENS Guidelines on the diagnosis and management of disorders associated with dementia. Eur J Neurol 2012; 19(9): 1159–1179.
35. Talassi E, Guerreschi M, Feriani M, et al. Effectiveness of a cognitive rehabilitation program in mild dementia and mild cognitive impairment (MCI): a case control study. Arch Gerontol Geriatr 2007; 44(Suppl. 1): 391–399.
36. Viola LF, Nunes PV, Yassuda MS, et al. Effects of a multidisciplinar cognitive rehabilitation program for patients with mild Alzheimer´s disease. Clinics 2011; 66(8): 1395–1400.
37. Yesavage JA, Bring TL, Rose TL, et al. Development and validation of a geriatric depression screening scale: a preliminary report. J Psychiatr Res 1982–1983; 17(1): 37–49.
38. Wechsler D. Wechslerova pamäťová škála: príručka pre administrovanie a skórovanie. Bratislava: Psychodiagnostika 1999.
39. Willis SL, Tennstedt SL, Marsiske M, et al. Long-term effects of cognitive training on every day functional outcomes in older adults. JAMA 2006; 296(23): 2805–2814.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2013 Issue 6-
All articles in this issue
- Neurobiology of adolescence
- ECG in athletes: new „Seattle criteria“
- WikiLectures: On-line educational materials for studies and clinical practice
- Life style analysis of yoga exercisers in comparison with the general population
- Violence in health care
- Cognitive rehabilitation in patients with mild cognitive impairment and dementia in conditions of daily out-patient unit – pilot study
- Personage and writings of Aulus Cornelius Celsus
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neurobiology of adolescence
- ECG in athletes: new „Seattle criteria“
- Cognitive rehabilitation in patients with mild cognitive impairment and dementia in conditions of daily out-patient unit – pilot study
- Violence in health care
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

