-
Medical journals
- Career
Význam histologické verifikace metastáz tumorů
: Š. Lukešová 1,2; O. Kopecký 1,3; P. Škoda 4
: Oddělení klinické onkologie Oblastní nemocnice Náchod, Primář: MUDr. Šárka Lukešová, Ph. D. 1; Ústav klinické mikrobiologie LF UK, Hradec Králové, Přednosta: doc. RNDr. Vladimír Buchta, CSc. 2; Stomatologická klinika LF UK, Hradec Králové, Přednosta: doc. MUDr. Radovan Slezák, CSc. 3; Radiodiagnostické oddělení Oblastní nemocnice Náchod, Primář: MUDr. Petr Kohoutek 4
: Prakt. Lék. 2012; 92(4): 237-240
: Case Report
Nádorový růst můžeme definovat jako proliferaci, která se vymkla zákonitostem zdravých tkání. V průběhu růstu nádoru pravidelně dochází k mutacím odpovědným za vznik nových klonů. Čím větší je nádor, tím větší je genetická labilita a výraznější nesourodost nádorové populace. Mutované klony jeví zpravidla větší proliferační aktivitu a postupně nabývají v nádorové populaci převahu, mají výraznější tendenci k metastazování a jejich citlivost k protinádorové léčbě bývá omezená. Na rozdíl od necílených chemoterapeutik, která inhibují proliferaci a indukují apoptózu nádorových buněk poměrně nespecifickými zásahy do replikace, transkripce, translace a průběhu mitózy, cílenou léčbu lze charakterizovat poměrně specifickým působením na konkrétní proteiny či signální dráhy. Histologická verifikace s podrobným imunohistochemickým vyšetřením je pro podání cílené léčby nezbytnou nutností. V článku jsou uvedeny tři kazuistiky, na nichž je překvapivý, klinicky málo očekávaný, histologický nález demonstrován.
Klíčová slova:
protinádorová léčba, histologická verifikace.Úvod
Nádorový růst můžeme definovat jako proliferaci, která se vymkla zákonitostem zdravých tkání. Největší rychlost růstu je v období, kdy nádor dosahuje 37 % své celkové maximálně možné velikosti. Dál se růstová frakce (tj. poměr proliferujících buněk k neproliferujícím) zmenšuje z důvodu nedostatku nutričních faktorů, kyslíku, nekrotizace buněk, exfoliace, metastazování, apoptózy buněk. Velikost růstové frakce závisí nejen na velikosti nádoru, ale i na typu nádoru (3).
Proces malignizace a metastazování
Postupná maligní transformace má následující etapy:
- iniciace – účinkem zevních či vnitřních faktorů dojde ke genetické poruše (může být bez funkčních důsledků řadu let);
- promoce – spoluúčastí dalších podnětů se objevují poruchy diferenciace (carcinoma in situ);
- konverze (transformace) – změna fenotypu, vznik maligního klonu;
- progrese – transformované buňky ztrácejí schopnost odpovědi na regulační mechanismy, dochází k lokálnímu růstu nádoru;
- metastazování – šíření nádoru mimo prvotní ložisko.
V průběhu růstu nádoru pravidelně dochází k mutacím odpovědným za vznik nových klonů. Čím větší je nádor, tím větší je genetická labilita a výraznější nesourodost nádorové populace. Mutované klony jeví zpravidla větší proliferační aktivitu a postupně nabývají v nádorové populaci převahu. Mají výraznější tendenci k metastazování a jejich citlivost k protinádorové léčbě bývá omezená.
Proliferace buněk a růst nádoru jsou vázány na vhodné mikroprostředí vytvářené stromatem, jehož tvorba probíhá paralelně s proliferací nádorových buněk. V důsledku zvýšené kapilární permeability (indukované VEGF uvolňovaným z nádorových buněk) uniká plazminogen, fibrinogen a další koagulační faktory z cév, vzniká extracelulární fibrinový gel, do něhož vcestují fibroblasty, které proliferují a vytvářejí stroma nádoru. Důležitá je angiogeneze (3).
Proces metastazování má následující etapy:
- invaze nádoru do okolí (průnik bazální membránou a intersticiálním stromatem);
- transport nádorových buněk lymfatickou nebo krevní cestou;
- nidace nádorových buněk a jejich zpětný průnik do tkáně (agregáty nádorových buněk s destičkami, adheze destiček, degranulace a uvolnění aktivních látek; fibrinový obal poskytuje nádorovým buňkám nejen ochranu proti mechanické traumatizaci, ale i před imunokompetentními buňkami);
- růst metastázy v novém mikroprostředí (různá koncentrace růstových faktorů a jejich inhibitorů v různých orgánech; odpověď na léčbu může být v metastáze jiná než v primárním nádoru).
Morfologicky lze nádory rozdělit na:
- epitelové
- z dlaždicového epitelu (dlaždicobuněčný či spinocelulární karcinom),
- z přechodního epitelu (např. urotelu),
- ze žlázového epitelu (adenokarcinomy). Pokud převládá nádorový parenchym jde o medulární karcinomy, při převaze stromatu jde o skirhotický karcinom.
- mezenchymové – sarkomy; nádory z hemopoetické tkáně;
- neuroektodermové – CNS (gliomy, meduloblastom, meningeom);
- germinální – nádory ze zárodečných buněk: seminomy, neseminomy (embryonální karcinom, nádor ze žloutkového váčku, choriokarcinom, teratom);
- smíšené – z různých mezenchymových složek, epitelových a neuroektodermových tkání různé vyzrálosti a biologické povahy.
Systémová onkologická léčba
K základní systémové onkologické léčbě patří léčba cytostatiky. Mechanismus účinku cytostatik je:
- inhibice klíčových enzymů metabolismu, jež vede k poruše biosyntézy nukleových kyselin s následnou inhibicí buněčného dělení (analoga kyseliny listové, purinová analoga, pyrimidinová analoga);
- přímé poškození struktury již hotových nukleových kyselin (alkylace, interkalace, inhibice topoizomeráz, rozštěpení molekuly DNA);
- alterace mikrotubulárního proteinu, jež má za následek abnormální průběh mitózy a její blokádu v metafázi;
- porucha syntézy proteinů;
- kombinované účinky;
- poškození buněčné membrány.
Mezi další modality systémové léčby patří léčba hormonální, léčba monoklonálními protilátkami proti růstovým faktorům, proti receptorům pro růstové faktory a cílená léčba (1, 2, 3). V průběhu onemocnění může docházet k alteraci exprese a struktury receptorů, nádor ztrácí hormonální závislost a stává se rezistentním na hormonální léčbu. Monoklonální protilátky jsou produkovány jedním klonem B-lymfocytů, vykazují shodnou antigenní specificitu. Mají schopnost vázat se na epitopy konkrétních povrchových nádorových antigenů či solubilních proteinů. Mechanismus účinku jejich účinku je:
- ADCC (antibody dependent cellular cytotoxicity),
- CDC (complement dependent cytotoxicity),
- přímý cytotoxický účinek.
Na rozdíl od necílených chemoterapeutik, která inhibují proliferaci a indukují apoptózu nádorových buněk poměrně nespecifickými zásahy do replikace, transkripce, translace a průběhu mitózy, lze cílenou léčbu charakterizovat poměrně specifickým působením na konkrétní proteiny či signální dráhy. Mezi cílenou léčbu řadíme léky, jejichž protinádorový účinek je zacílen predominantně proti samotným nádorovým buňkám a dále skupinu léků, které cíleně zasahující do patologicky změněných vztahů mezi nádorem a mikroprostředím (1, 2).
Do první skupiny léků, jejichž protinádorový účinek je zacílen predominantně proti samotným nádorovým buňkám, řadíme léky inhibující sebeobnovu nádorových buněk (např. inhibice telomeráz), léky inhibující proliferaci (např. inhibice receptorových kináz a signálních drah) a induktory apoptózy (působící blokádu aberantně upregulovaných antiapoptotických molekul nebo indukci apoptózy stimulací exprese proapoptotických proteinů) (2).
Do druhé skupiny léků, které cíleně zasahují do patologicky změněných vztahů mezi nádorem a mikroprostředím, řadíme imunomodulační látky schopné vyvolat či posílit složky protinádorové imunity a zaktivizovat je v boji proti zhoubnému onemocnění, inhibitory neovaskularizace (angiogeneze), léčbu zaměřenou i proti podpůrným buňkám a inhibitory invazivity a metastazování (např. inhibitory matrix metaloproteáz, inhibitory autokrinní a parakrinní stimulace). Blokáda novotvorby cév spočívá v aplikaci přirozených inhibitorů angiogeneze, farmakologické blokádě signálních kaskád spouštěných zvýšeně exprimovanými proangiogenními faktory (např. VEGF). Další možností je destrukce již vytvořených cév či snaha o normalizaci chaotické průniku cytostatik do nitra nádoru (2).
Vlastní pozorování 1
Jednašedesátileté pacientce byl v rámci mamografického screeningu v říjnu 2010 zjištěn v horním zevním kvadrantu levého prsu tumor, velikosti 16 ⋅ 22 mm. Histologicky šlo o invazivně rostoucí středně diferencovaný duktilní karcinom, T2 (16 ⋅ 22 cm) N0 MX (susp. skelet), ER (estrogenové receptory) středně silně pozitivní v 90 % buněk, PR (progesteronové receptory) středně silně pozitivní v 80 % buněk, proliferační antigen Ki-67 pozitivní v 10 % buněk, onkoprotein p53 negativní, exprese onkoproteinu HER-2/neu byla slabě pozitivní, HER skóre = 2, metodou Dual ISH celkově nebyla nalezena amplifikace genu HER-2/neu; nádorové markery: CEA 5,7 ∝g/l, CA153 51,8 kU/l. Dle scintigrafie skeletu byl neurčitý nález v L4,L5. Při doplňujícím RTG vyšetření byl popsán vs. osteolytický defekt obratlového těla L4 laterálně vpravo velikosti 2 ⋅ 1,5 cm (obr. 1), při MR byla popsána osteolytická změna obratle L4, postihující jak tělo obratle, tak i pravou část oblouku. Měkkotkáňová porce prominovala extrakanalikulárně i do páteřního kanálu, který byl zúžen na 9 ⋅ 7 mm, a podmiňovala i pravostrannou foraminostenózu L4/5. Další neexpandující ložiska byla popsána v těle Th11 i v Th8. V prosinci 2010 byl proveden neurochirurgický výkon: laminektomie L4, dekomprese kanálu a fixace L3–L5. Histologicky s trepanobioptickým ověřením byl zjištěn mnohočetný myelom, stadium IIIA dle Durie-Salmona, ISS 1 s nutností systémové léčby. V lednu 2011 byla provedena parciální mastektomie a biopsie sentinelové uzliny. Histologicky se jednalo o multifokální výskyt invazivně rostoucího karcinomu prsní žlázy, v jednom z lemů byla zastižena velmi drobná ložiska intraduktálního (in situ) karcinomu dosahující okraje. Vzhledem k těmto faktům a vzhledem k life expectance pro neléčený myelom bylo t.č. ustoupeno od adjuvantní radioterapie prsu. Byla zahájena adjuvantní hormonální léčba inhibitorem aromatázy včetně léčby jednoduchým bisfosfonátem, tj. klodronát 1600 mg pro die. Pacientka byla předána k další léčbě na hematologii. Byla provedena paliativní radioterapie na oblast L2–L5, LD 20 Gy/5 frakcí, ale přesto došlo k rychlé progresi paraparézy dolních končetin z útlaku kořenových struktur narůstající nádorovou masou. Po prefázi methylprednisolonem 40 mg byla zahájena chemoterapie CTD junior ve složení cyclofosfamid 500 mg D1, thalidomid kontinuálně 200 mg, dexamethason 40 mg D1–4, bez komplikací. Pacientka byla přeložena na lůžka následné péče, kde počátkem května 2011 umírá na multiorgánové selhání při základním onkologickém onemocnění. Vyvolávajícím momentem byl bronchopulmonální infekt.
1. Osteolytický defekt obratlového těla L4 laterálně vpravo velikosti 2 × 1,5 cm 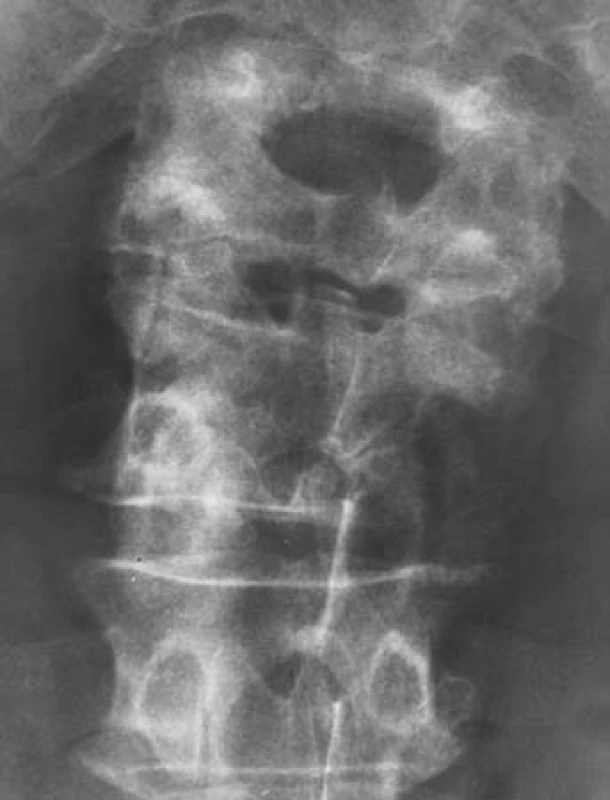
Vlastní pozorování 2
Jednašedesátileté pacientce byl v lednu 2001 diagnostikován karcinom sigmatu (histologicky hlenotvorný adenokarcinom, místy gelatinózní), v únoru 2001 byla provedena hemikolektomie. Pacientka byla zaléčena půlroční adjuvantní chemoterapií ve složení leukovorin a 5-fluorouracil a dále dispenzarizována. V rámci dispenzárních kontrol byla v lednu 2011 popsána při RTG plic polycyklická, oválná expanze asi 8 ⋅ 5 cm, promítající se do oblasti pravého hilu, na UZ břicha susp. prstenčité ložisko velikosti 15 mm v levém jaterním laloku. Při doplňujícím CT vyšetření bylo vysloveno podezření na metastázu nebo primární tumor v S6 pravého dolního plicního laloku s lymfangiopathií v okolí, susp. drobná metastáza nebo ložisko jiné etiologie v S10 vpravo, mediastinální a pravostranná hilová lymfadenopathie, solitární metastáza v levém laloku jaterním. Pacientka byla odeslána k bronchoskopickému vyšetření s odběrem bioptického vzorku, který prokázal malobuněčný karcinom plic. Pacientce byly podány čtyři cykly paliativní chemoterapie (carboplatina + etopozid á 4 týdny). Dle kontrolního CT v červnu 2011 došlo k regresi velikosti ložiska v S6 vpravo z 62 ⋅ 44 mm na 33 ⋅ 33 mm (obr. 2 a 3), k úplné regresi metastatického ložiska v levém laloku jater (obr. 4). Pacientka byla odeslána k paliativnímu ozáření zbytkového tumoru a profylaktickému ozáření krania.
2. Plicní ložisko v S6 vpravo před léčbou (62 × 44 mm) 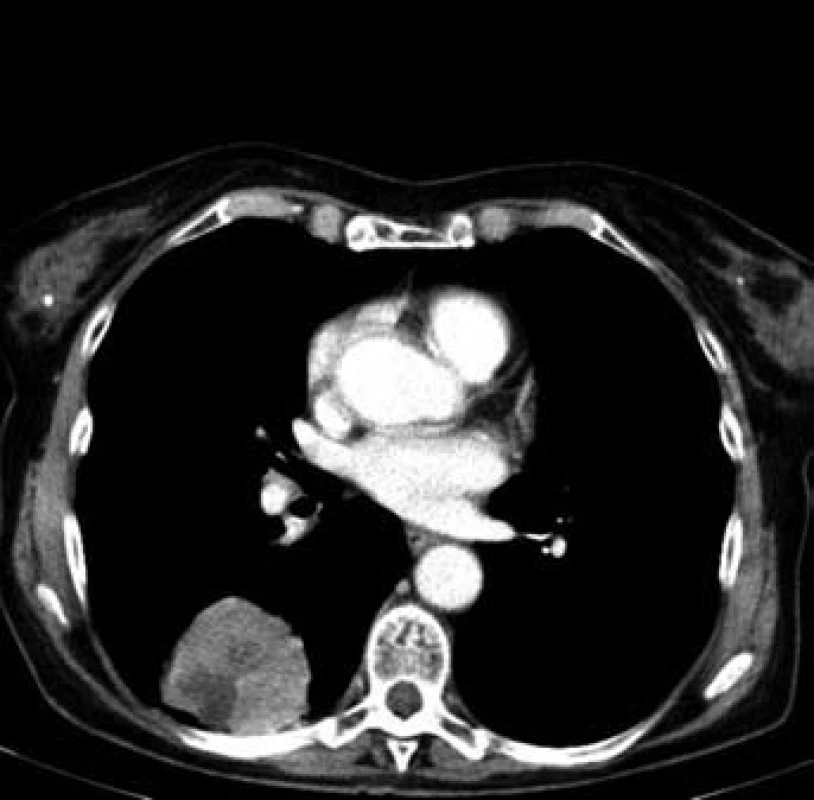
3. Plicní ložisko v S6 vpravo po léčbě (regrese) (33 × 33 mm) 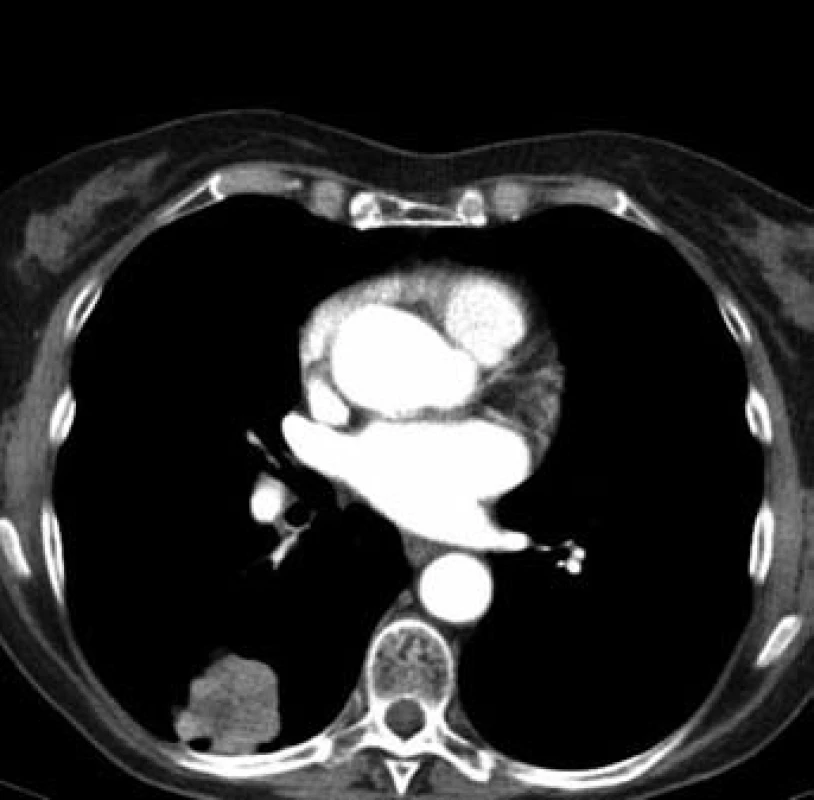
4. Úplná regrese metastatického ložiska v levém laloku jater 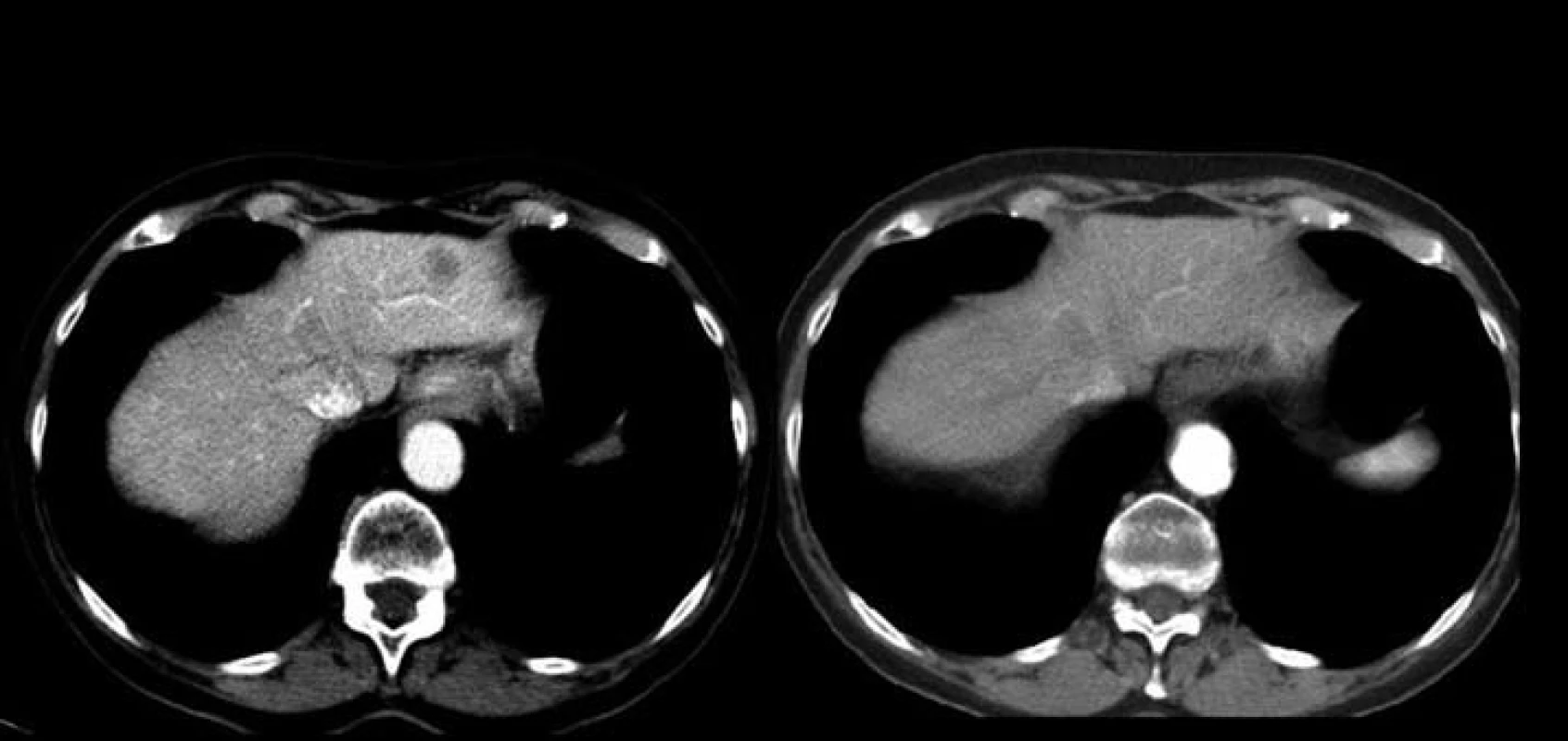
Vlastní pozorování 3
Sedmdesátileté pacientce byl v rámci mamografického screeningu diagnostikován tumor v periferii horního vnitřního kvadrantu levého prsu, velikosti 23 ⋅ 12 mm, histologicky středně diferencovaný, duktální karcinom, ER středně silně pozitivní v 80 % buněk, PR středně silně pozitivní v 80 % buněk, proliferační antigen Ki-67 pozitivní ve 20 % buněk, onkoprotein p53 pozitivní v 5 % buněk, onkoprotein HER-2/neu neprokázán. V rámci stagingových vyšetření provedená scintigrafie skeletu prokázala jednoznačně patologický nález na kalvě vpravo parietálně, doplňující CT vyšetření vs. metastázu ve skeletu kalvy vpravo s měkkotkáňovou složkou zasahují intrakraniálně, bez přítomnosti intracerebrálních metastáz (obr. 5 a 6). Primárně byla provedena operace kalvy. Histologicky se však nejednalo o metastázu karcinomu prsu, nýbrž o meningoteliální meningeom dle WHO grade I s poněkud vyšší proliferační aktivitou. Následně byla provedena excize tumoru levé mamy a exenteraci axily. Patologický nález byl pT1b (10 mm) pN0 (15/0+) M0; histologicky byl potvrzen středně diferencovaný duktální karcinom, bez perineurálního šíření, bez progrese do lymfatických štěrbin. Byla doporučena adjuvantní radioterapie a adjuvantní hormonální léčba.
5. Patologické ložisko ve skeletu kalvy vpravo (kostní onko) 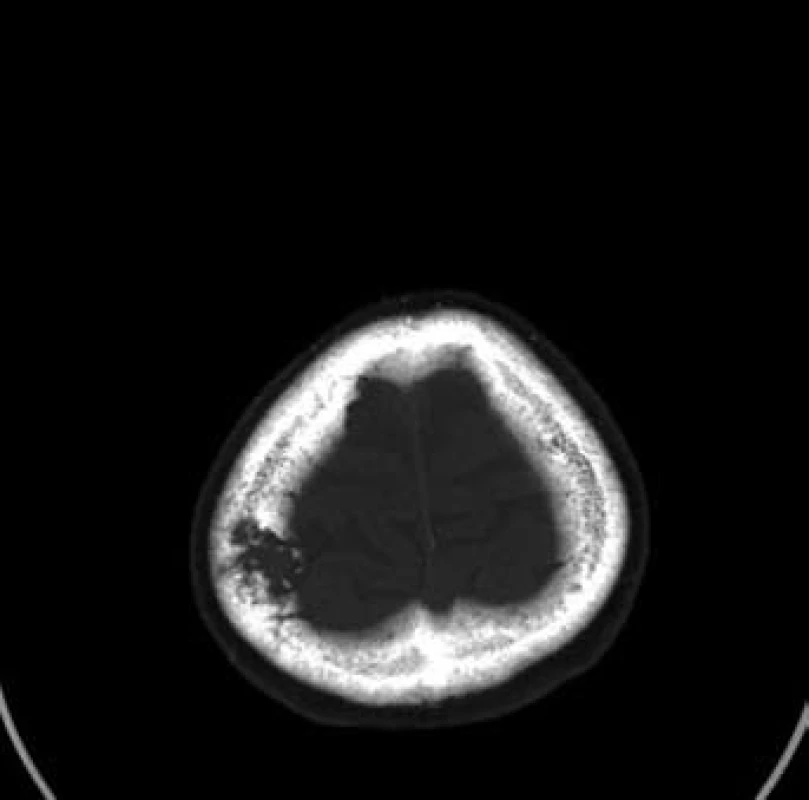
6. Patologické ložisko ve skeletu kalvy vpravo (mozek) 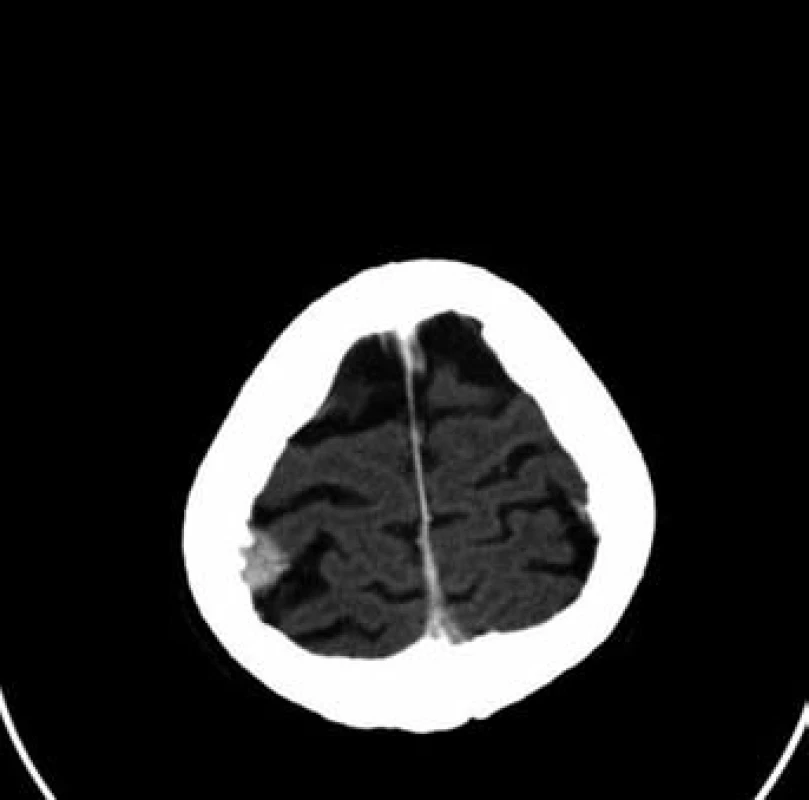
Diskuse
Nárůst počtu pacientů s duplicitními nádory se přičítá prodloužení střední délky života, zlepšení léčebných i diagnostických možností a delšímu přežívání onkologicky nemocných, vlivu zhoršujícího se zevního prostředí (chemizace, hormonizace) a životního stylu (stres, nedostatek pohybu, pracovní tempo, nadužívání léků, nevhodná strava, drogy). Výskyt některých druhů nádorových onemocnění po léčbě určitými cytostatiky se vysvětluje kancerogenním účinkem některých cytostatik, ale i prodloužením doby přežití nemocných. Nejčastěji se pozorují hematologické malignity. Solidní nádory vznikají jako druhotné malignity vzácně. Jedinou výjimkou je zvýšený výskyt karcinomů močového měchýře u nemocných léčených cyklofosfamidem (3). Vznik sekundárních malignit může přicházet i jako velmi pozdní nežádoucí účinek po ukončení ozařování (po 5–15 letech), způsobený mutacemi vzniklými ozařováním. Příkladem je sekundární nádor prsu po ozařování Hodgkinovy choroby mediastina v dětském věku (1).
Pravděpodobnost recidivy je dána vztahem mezi tumorem a hostitelským organismem. Vzrůstá při špatných prognostických znacích tumoru, v případě genetických abnormalit (mutace onkosupresorových genů, zvýšená exprese onkogenů), při nedostatečnosti imunitního systému, po neadekvátní nebo nedostatečné onkologické léčbě, ale zároveň i díky delšímu přežívání nemocných daným zlepšenými léčebnými možnostmi.
Závěr
Histologická verifikace s podrobným imunohistochemickým vyšetřením je pro podání léčby nezbytnou nutností. Na uvedených kazuistikách je demonstrováno, že nález nádorové duplicity může být relativně překvapujícím nálezem jak v rámci primární diagnostiky tumoru, tak v rámci dispenzarizace.
MUDr. Šárka Lukešová, Ph.D.
Milady Horákové 421
500 06 Hradec Králové
E-mail:
lukesova.sarka@nemocnicenachod.cz
Sources
1. Adam Z., Krejčí M., Vorlíček J., et al. Obecná onkologie, 2011, Praha: Galén, s. 35–42, 122–123, 129–174.
2. Klener P., Klener P. jr. Nová protinádorová léčiva a léčebné strategie v onkologii. Praha: Grada Publishing, 2010, s. 13–46, 77–130.
3. Klener P. Klinická onkologie. Praha: Galén, 2002, s. 1–78, 145–248, 275–276.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2012 Issue 4-
All articles in this issue
- Basics of social cognitive and affective neuroscience: XVII. Free will
- Asthma and nutrition: diet for the primary prevention and treatment of asthma
- Physical activity in the context of the postprandial metabolism of glucose and lipids
- Variants of human chromosomes and their significance from the point of view of clinical genetics
- What is the risk of disease caused by Legionella in the Czech Republic?
- Occupational diseases reported in the Czech Republic in 2011
- Risk factors of working environment and occupational diseases reported in the Czech Republic in 2011
- Alcohol and oesophageal cancer – economical expenditures
- Personal situation of general practitioners in the Czech Republic
- The QUALICOPC study – a comparison of development of primary care in 31 European countries
- The importance of histological verification of tumour metastasis
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Asthma and nutrition: diet for the primary prevention and treatment of asthma
- Variants of human chromosomes and their significance from the point of view of clinical genetics
- What is the risk of disease caused by Legionella in the Czech Republic?
- The importance of histological verification of tumour metastasis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

