-
Medical journals
- Career
Retroperitoneální lymfadenektomie a poruchy ejakulace u pacientů s nonseminomovýmí germinálními tumory varlat
Authors: J. Jarabák 1; R. Zachoval 1; J. Abrahámová 2; Z. Donátová 2
Authors‘ workplace: Urologické oddělení Primář: doc. MUDr. Roman Zachoval, Ph. D. 1; Onkologické oddělení Primář: prof. MUDr. Jitka Abrahámová, DrSc. Fakultní Thomayerova nemocnice s poliklinikou 2
Published in: Prakt. Lék. 2009; 89(3): 143-146
Category: Therapy
Overview
Léčba neseminomových germinálních tumorů varlat je multimodální. Spočívá především v různé kombinaci surveillance, chemoterapie a RPLA. Z důvodu vysoké morbidity, včetně negativního vlivu na ejakulatorní funkce a významného pokroku v chemoterapii, ztratila v posledních dvou desetiletích retroperitoneální lymfadenektomie svoji původně dominantní roli při léčbě časných stádií těchto tumorů. V současnosti díky rozvoji laparoskopických technik znovu získává její modifikovaná a nervy šetřící forma na popularitě. Tyto typy výkonů vykazují u vhodně indikovaných pacientů onkologické výsledky srovnatelné s klasickou retroperitoneální lymfadenektomií při nízkém množství komplikací. Při léčbě pokročilých stádií NSGCT hraje stále významnou roli technicky náročná salvage lymfadenektomie, pří které je provedení nervy šetřící techniky značně nejisté.
Klíčová slova:
retroperitoneální lymfadenektomie, ejakulatorní funkce, nonseminomové germinální nádory varlat.Neseminomové germinální tumory varlat (NSGCT) reprezentují 40–50 % všech nádorů varlat. Na rozdíl od seminomů jsou více agresivní a minimálně nebo vůbec radiosenzitivní. Podle stadia onemocnění a přítomnosti rizikových faktorů (vaskulární invaze krevní i lymfatická, embryonální komponenta a rozsah primárního nádoru) se po radikální orchiektomii používá taktika zvýšeného dohledu (surveillance), systémová chemoterapie nebo retroperitoneální lymfadenektomii (RPLA).
Primární lymfatickou drenáží varlete je oblast jeho embryonálního původu, představují ji retroperitoneální lymfatické uzliny v okolí velkých cév. Lymfatické cévy z levého varlete ústí do levostranných para - a preaortálních uzlin, z pravého varlete do para - a prekaválních a interaortokaválních lymfatických uzlin.
Dobře provedená RPLA má u pacientů s NSGCT ve vhodné indikaci prokazatelně pozitivní onkologický význam:
- je nejefektivnějším doplněním stagingu,
- u pacientů s nízkým stádiem onemocnění má kurabilní efekt,
- do budoucna eliminuje retroperitoneum jako místo možné recidivy.
Operační technika klasické otevřené RPLA má však bohužel vysoké procento komplikací (krevní ztráty při preparaci v oblasti velkých cév, infekce operační rány, střevní komplikace, chylózní ascites, lymfokéla, déle trvající pooperační bolesti v operační ráně, delší dobu trvající rekonvalescence, hernie, apod.). Z andrologického hlediska je nejzávažnější komplikací ejakulatorní dysfunkce.
Fyziologie ejakulace
Ejakulace je u zdravého muže reflexní jev, který nastává po dosažení kritické úrovně v aferentní stimulaci míšních ejakulačních center. Fyziologickým podnětem ejakulace je distenze zadní části močové trubice seminální tekutinou. Proces ejakulace má 2 po sobě jdoucí fáze
- sympatikem řízenou emisi, a
- somaticky zprostředkovanou vlastní ejakulaci.
Při emisi dochází ke kontrakci chámovodů, ampul semenních váčků, parauretrálních a prostatických žláz, a tím se z nich dostává seminální tekutina do zadní uretry. Současně se kontrahuje vnitřní svěrač močové trubice, který funguje jako uzávěr hrdla močového měchýře a brání retrográdnímu toku vypuzené seminální tekutiny.
Ve fázi vlastní ejakulace je ejakulát vypuzován rytmickou kontrakcí m. bulbospongiosus a perineálních svalů ven z močové trubice. Souhru obou fází ejakulace koordinuje autonomní a somatický nervový systém. Aferentní nervová vlákna přenášející podněty ze zevního genitálu probíhají v n. dorsalis penis, stimulace z oblasti vnitřního genitálu probíhá do míšních center přes aferentní vlákna v nn. pelvici. Eferentní sympatiková vlákna zodpovědná za zprostředkování emise pocházejí z neuronů ejakulačního centra v distálních torakálních a proximálních lumbálních segmentech míchy (Th10–L2). Přecházejí přes řetězec paravertebrálních sympatických ganglií, přes plexus hypogastricus superior v blízkosti kmene dolní mezenterické artérie nad aortální bifurkací, přes hypogastrické nervy a v adventícii orgánů vnitřního genitálu se spojují s adrenergními ganglii, z kterých odstupují koncová postgangliová vlákna inervující hladkou svalovinu hrdla měchýře, prostaty, chámovodů a semenných váčků.
Motorická inervace bulbospongiozního svalu a svalů perinea pochází z ganglií ve 2. až 4. segmentu sakrální míchy a probíhá v nervus pudendus. Pro zachování ejakulace po RPLA má klíčový význam zachování paravertebrálních torakolumbálních sympatických ganglií (asi největší podíl na ejakulaci mají vlákna vycházející z ganglií L1-4) a vláken konvergujících v hypogastrický plexus (1, 2).
Léčba NSGCT ve vztahu ke stádiu onemocnění
Stanovení stadia onemocnění je důležité pro strategii léčby pacientů s NSGCT. Rozdělení jednotlivých stadii onemocnění na podkladě TNM klasifikace (tab. 1, 2).
Table 1. TNM klasifikace nádorů varlete 
Table 2. Rozdělení nádorů varlete do stadií 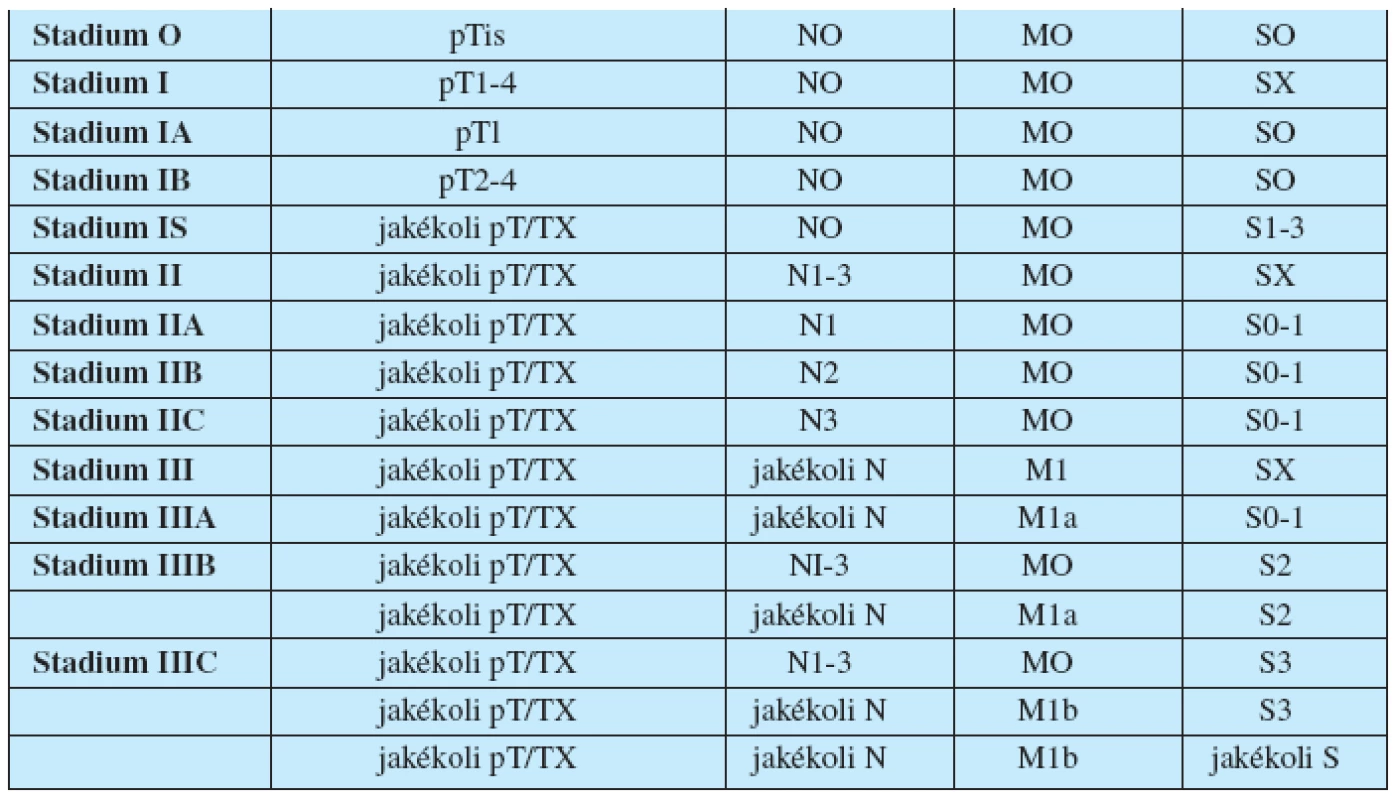
U pacientů s I. stadiem byla klasická léčba po radikální orchiektomii do 80. let minulého století spojována s kompletní (klasická, radikální) bilaterální RPLA, která byla zatížená vysokou morbiditou a ejakulatorní dysfunkce se vyskytovala u více než 75 % pacientů (3). V té době byly do praxe uvedeny nové operační techniky RPLA:
- modifikovaná (rozsah výkonu je redukován pouze na stranu tumoru varlete a do určitých mezí zasahuje i do oblasti velkých cév) (4), nervy šetřícílymfadenektomie (se snahou ušetřit sympatická thorakolumbální ganglia a pleteně), a
- salvage lymfadenektomie (cílené odstranění tumorózní masy perzistující po aplikaci chemoterapie).
Modifikovaná a nervy šetřící lymfadenektomie vykazovaly ve srovnávajících studiích stejné onkologické výsledky jako kompletní bilaterální RPLA, ale se zachováním ejakulatorních funkcí u 62–88 % pacientů (5). Perioperační morbidita RPLA však stále zůstávala vysoká, a proto se po zavedení vysoce účinných chemoterapeutických režimů na bázi platiny v 80. letech začala na většině pracovišť používat adjuvantní chemoterapeutická léčba, která RPLA z její pozice téměř vytlačila.
Avšak i tento způsob léčby má řadu známých komplikací a rizik. Ve stádiu I jsou navíc metastázy v retroperitoneálních uzlinách přítomny přibližně jen u 30 % pacientů, a proto při paušálně podávané chemoterapii všem pacientům dochází až u 70 % pacientů k „overtreatment“. V I. stadiu onemocnění se proto doporučuje kombinace zvýšeného dohledu u nízkorizikových pacientů a adjuvantní chemoterapie pacientů s vyšším onkologickým rizikem.
I tak však u významné skupiny pacientů dochází k „overtreatment“, a proto se v poslední době na řadě významných světových pracovišť začala znovu uplatňovat strategie provádění RPLA, a to v laparoskopické modifikaci, která výrazně snižuje výskyt některých perioperační komplikací a pooperačního diskomfortu pacienta.
U pacientů se stadiem IIA a IIB se na evropských pracovištích preferuje strategie primární chemoterapie, a RPLA je indikována v případech nekompletní remise (salvage lymfadenektomie). Nejcennějším zobrazovacím vyšetřením k posouzení viability tumoru v oblasti retroperitonea je v současné době PET/CT vyšetření (obr. 1). K provedení primární RPLA v těchto stadiích se kloní spíš pracoviště v USA.
Image 1. PET/CT pacienta s perzistující retroperitoneální masou po chemoterapii 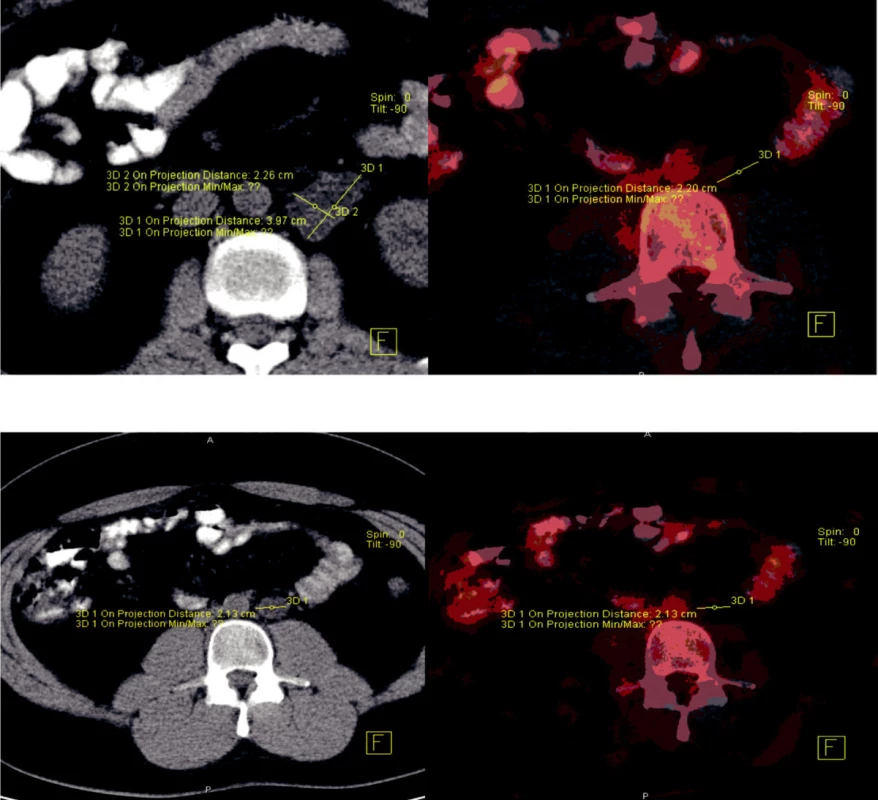
Ve stadiu IIC a III je salvage RPLA indikována až po vyčerpání možností chemoterapie v případě perzistence viabilní tumorózní masy v retroperitoneu.
RPLA a ejakulatorní dysfunkce
Jednou z hlavních dlouhodobých komplikací výkonu je ejakulatorní dysfunkce. V důsledku poškození retroperitoneální sympatické inervace může dojít buď k suché ejakulaci v důsledku ztráty emise, a/nebo k retrográdní ejakulaci.
Ejakulatorní dysfunkce se po klasické bilaterální RPLA vyskytuje u více než 75 % pacientů (3), někteří autoři udávají až 100% incidenci (6).
Modifikovaná lymfadenektomie, popsaná poprvé Fossem et al. (7), a nervy šetřící postupy navržené Jewettem et al. (1) a později zdokonalené Donohuem et al. (2) představily směr vedoucí k redukci morbidity RPLA u pacientů s NSGCT. Z analýzy reprezentativních souborů pacientů stran zachování ejakulatorní funkce po primární RPLA vyplývá jednoznačná výhoda modifikované a nervy šetřící techniky u vhodně indikovaných skupin pacientů bez ohrožení onkologických výsledků léčby (tab. 3).
Table 3. Výskyt poruch ejakulace po jednotlivých typech RPLA 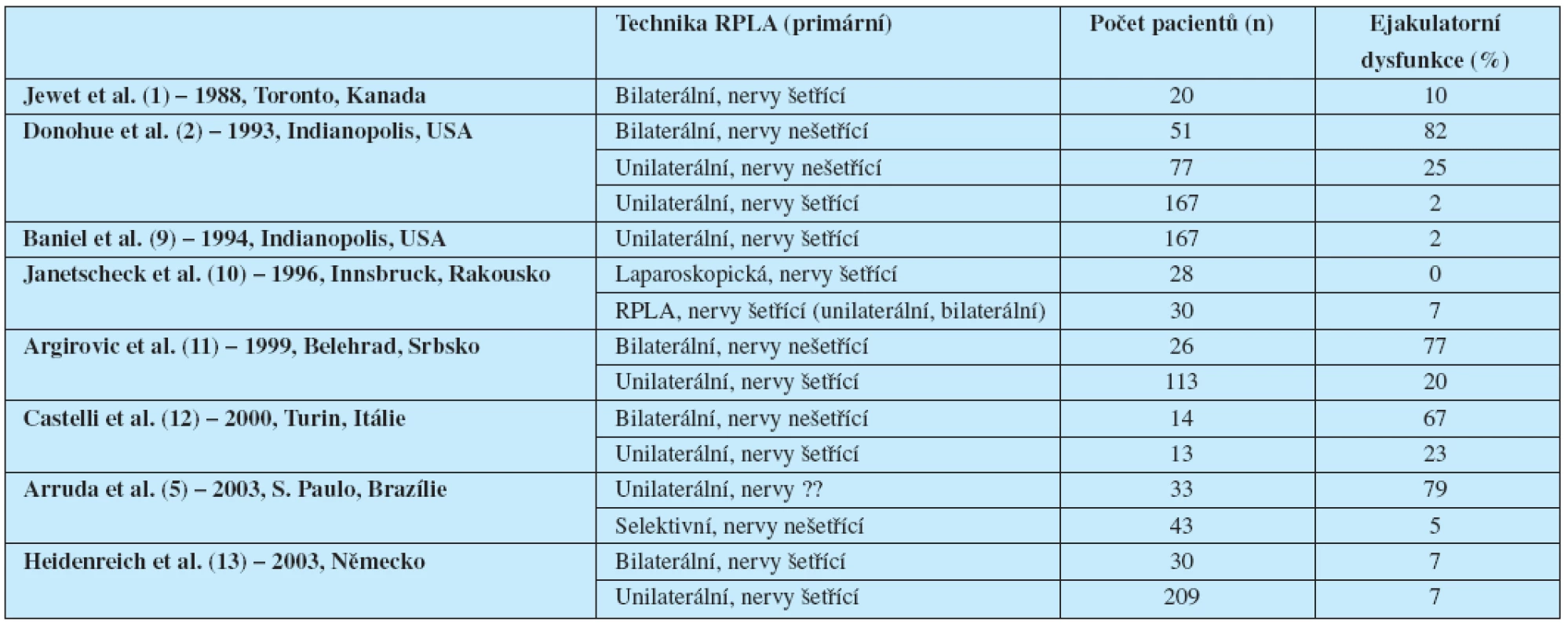
Ejakulatorní funkce zůstaly zachované u 77–100 % pacientů po této technice RPLA. Jako nejefektivnější se v tomto směru v současné době jeví laparoskopické modifikace operačních výkonů. Plné zachování ejakulatorních funkcí u všech pacientů po primární laparoskopické lymfadenektomii prezentoval Janetscheck et al. (10) již v r. 1996. Zachování ejakulatorních funkcí u všech pacientů po primární laparoskopické RPLA prezentoval v r. 2007 také Castillo et al. (14).
Salvage (sekundární) lymfadenektomie je často technicky o mnoho náročnější než primární výkon pro výskyt fibrózy indukované předchozí chemoterapií. Do fibrózy jsou velmi často zavzatá také nervová vlákna, která je z hlediska ejakulatorní funkce nutné zachovat. Tato skutečnost zhoršuje techniku nervy šetřící disekce u salvage RPLA, je ale možné ji provést (8).
Závěr
V léčbě NSGCT hraje zásadní roli multimodalitní přístup, spočívající především v různé kombinaci surveillance, chemoterapie a RPLA. Z důvodu vysoké morbidity, včetně negativního vlivu na ejakulatorní funkce, a významného pokroku v chemoterapii ztratila v posledních dvou desetiletích RPLA svoji původně dominantní roli při léčbě časných stádií NSGCT. V současné době však díky rozvoji laparoskopických technik znovu získává její modifikovaná a nervy šetřící forma na popularitě. Tyto typy výkonů vykazují u vhodně indikovaných pacientů onkologické výsledky srovnatelné s klasickou retroperitoneální lymfadenektomií při nízkém množství komplikací, včetně ejakulatorní dysfunkce. Při léčbě pokročilých stádií NSGCT hraje stále významnou roli technicky často náročná salvage lymfadenektomie, pří které je provedení nervy šetřící techniky značně nejisté.
MUDr. Jaroslav Jarabák
Urologické oddělení
Fakultní Thomayerova nemocnice
Vídeňská 800
14059 Praha 4
E-mail: jaroslav.jarabak@ftn.cz
Sources
1. Jewett, M.A., Kang, Y., Goldberg, S.D. et al. Retroperitoneal lymphadenectomy for testis tumor with nerve sparing for ejaculation. J. Urol. 1988, 139, p. 1220-1224.
2. Donohue, J.P., Foster, R.S., Rowland, R.G. et al. Nerve-sparing retroperitoneal lymphadenectomy with preservativ of ejaculation. J. Urol. 1993, 144, p. 287-292.
3. Pizzocaro, G. Retroperitoneal lymphadenectomy in clinical stage I nonseminomatous germinal testis cancer. Eur. J. Surg. Oncol. 1986, 12, p. 25-28.
4. Foster, R.S. Modified retroperitoneal lymphadenectomy. BJU Int. 2004, 94, p. 941-955.
5. Arruda, H.O., Paula, P., Suarez, R. et al. Can selective retroperitoneal lymphadenectomy by better than unilateral retroperitoneal lymhadenectomy? Inter. Braz. J. Urol. 2003, 29, p. 412-417.
6. Magelssen, H., Brydoy, M., Fossa, D.S. The effects of cancer and cancer treatments on male reproductive function. Nat. Clin. Pract. Urol. 2006, 3(6), p. 312-322.
7. Fossa, S.D., Kleep, O., Ous, S. et al. Unilateral retroperitoneal lymf node dissecton in patiens with nonseimonomaotus testicular tumor in clinical stage I. Eur. Urol. 1984, 10, p. 17-23.
8. Klein, E.A. Open technique for nerve-sparing retroperitoneal lymphadenectomy. Urology 2000, 55, p. 132-135.
9. Baniel, J., Foster, R.S., Rowland, R.G. et al. Complications of primary retroperitoneal lymph node dissection. J. Urol. 1994, 152, p. 424-427.
10. Janetscheck, G., Hobish, A., Hotl, L. et al. Retroperitoneal lymphadenectomy for clinical stage I nonseminomatous testicular tumor: laparoscopy versus oper surgery and impact of learning curve. J. Urol. 1996, 156(1), p. 89-93.
11. Argirovic, D., Hadzi-Djokic, J., Micic, S. Quality of life after retroperitoneal lymphadenectomy in low clinical stages of nonseminomatous testicular tumors. Acta Chir. Iugosl. 1999, 46(1), p. 31-33.
12. Castelli, E., Terrone, C., De Lucca, S. et al. Retroperitoneal lymphadenectomy for testicular cancer and genito-sexual conditions: retrospective study. Prog. Urol. 2000, 10(4), p. 578-582.
13. Heidenreich, A., Albers, P., Hartmann, M. et al. Complications of primary nerve sparing retroperitoneal lymph node dissection for clinical stage I nonseminomatous germ cell tumors of the testis: experience of the german testicular cancer study group. J. Urol. 2003, 169, p. 1710-1714.
14. Castillo, A.O., Alvarez, M.J., Vitagliano, G. et al. Linfadenectomia retroperitoneal laparoscopica en cancer de testiculo no seminoma estadio I. Arch. Esp. Urol. 2007, 60(1), p. 59-66.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2009 Issue 3-
All articles in this issue
- Návykové látky v primární péči
- Hudba a lidský mozek
- Importované infekce z exotických krajů
- Konec elektromagnetické hypersenzitivity
- Nové antiobezitikum na obzoru?
- Léčba revmatoidní artritidy kortikoidy
- Co by měli vědět rodiče o prevenci
- Atypický průběh ruptury srdeční stěny při infarktu myokardu
- Retroperitoneální lymfadenektomie a poruchy ejakulace u pacientů s nonseminomovýmí germinálními tumory varlat
- Sté výročí zahájení pravidelné dezinfekce pitné vody chlorem
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba revmatoidní artritidy kortikoidy
- Nové antiobezitikum na obzoru?
- Návykové látky v primární péči
- Importované infekce z exotických krajů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

