-
Medical journals
- Career
Hidradenitis suppurativa, črevný mikrobióm a SIBO – komplexný prehľad problematiky
Authors: B. Ivanková 1; J. Baloghová 1,2
Authors‘ workplace: Klinika dermatovenerológie UN L. Pasteura, Košice 1; LF UPJŠ Košice 2
Published in: Gastroent Hepatol 2024; 78(1): 41-46
Category: Clinical and Experimental Gastroenterology: Review Article
doi: https://doi.org/10.48096/ccgh202441Overview
Súhrn: Hidradenitis suppurativa (HS) je chronický imunitne mediovaný zápal pilosebaceóznej jednotky a apokrinných potných žliaz s tvorbou bolestivých uzlov, abscesov, hnisajúcich fistúl a jaziev predilekčne v intertiginóznych priestoroch. U pacientov s HS je zvýšená incidencia zápalových ochorení čreva (IBD – inflammatory bowel disease), čo poukazuje na ich vzájomné priesečníky v patogenéze dysregulácie vrodenej a adaptívnej imunity. Nedávno sa výrazne zvýšil záujem o črevný mikrobióm kožných ochorení, predmetom záujmu je aj jeho úloha v patogenéze HS. Podľa literárnych údajov črevná dysbióza podporuje produkciu prozápalových cytokínov a následne tvorbu HS lézií. Syndróm prerastania baktérií v tenkom čreve (SIBO – small intestinal bacterial overgrowth) je stav, ktorý sa vyznačuje zvýšenou koncentráciou baktérií hrubého čreva v tenkom čreve. Eredikácia SIBO bola napr. schopná zlepšiť kožné prejavy pri psoriáze, v zmysle zníženia indexu jej závažnosti. V tomto kontexte existuje hypotéza, že eredikácia SIBO môže mať priaznivý vplyv na závažnosť prejavov zápalových imunitne mediovaných kožných ochorení, vrátane HS.
Klíčová slova:
hidradenitis suppurativa – imunitne mediovaný zápal – črevný mikrobióm – small intestinal bacterial overgrowth – SIBO – medziodborová spolupráca
Úvod
Hidradenitis suppurativa (HS), inak označovaná aj ako akné inversa, je chronické, bolestivé, progresívne zápalové ochorenie predilekčne sa objavujúce v intertriginóznych oblastiach tela so zvýšenou koncentráciou apokrinných potných žliaz. Predovšetkým sú to axily, inguiny, gluteálne a submamárne oblasti (obr. 1–4). Etiopatogenetickým podkladom ochorenia je imunologicky mediovaný zápal pôsobiaci na keratinocyty vo výstelke ústia folikulu. Autoinflamácia vedie k oklúzii folikulu (klinicky sa tvorí nodozita či absces) a následne k jeho ruptúre a postupnej tvorbe fistulácií a sínusových traktov [1].
Dôležitým faktorom v spustení zápalového procesu je genetická záťaž. Pozitívnu rodinnú anamnézu má 30–40 % pacientov. V posledných rokoch sa mnoho diskutuje o defekte signálnych ciest Notch a gama-sekretázy. Viaceré štúdie dokazujú zvýšenú hladinu cytokínov IL-1beta, IL-10, TNFa, IL-12, IL-23, IL-17 v léziách HS v porovnaní so zdravou kožou. Medzi vyvolávajúce faktory patrí fajčenie a významnú úlohu zohráva aj obezita, vďaka mechanickej iritácii, oklúzii a macerácii [2,3].
Incidencia ochorenia varíruje od 1 do 4 %, postihuje predovšetkým ženské pohlavie. Hlavným diagnostickým kritériom ochorenia je recidíva jednej či viacerých typických lézií, t. j. nodozita či absces, v jednej z predilekčných oblastí viac ako 2-krát za 6 mesiacov [4].
Na objektivizáciu závažnosti ochorenia a jej dynamiky využívame skórovacie systémy, ktoré majú vplyv aj pri rozhodovaní sa o ďalších terapeutických postupoch. V praxi sa najčastejšie využíva hodnotenie stupňa závažnosti podľa Hurley klasifikácie (tab. 1) a na hodnotenie aktivity ochorenia sa uplatňuje HS-PGA škála závažnosti (HS Physician’s Global Assessment, tab. 2). Kvalitu života pacienta s HS hodnotíme na základe dotazníkov kvality života DLQI (Dermatological Life Quality Index).
Na posúdenie úspešnosti liečby a sledovanie aktivity ochorenia bol vytvorený index – HISCR (HS Clinical Response). Podľa HISCR je liečba úspešná, ak je po 4 mesiacoch prítomná aspoň 50% redukcia počtu abscesov a nodozít, nepribudne žiaden nový absces či fistulácia, novo vytvorené nodozity sú akceptované [5].
Pacienti s HS trpia rôznym spektrom symptómov, od lokálnych cez systémové. Medzi lokálne patrí bolestivosť a pálenie ložísk, pruritus a nadmerné potenie. Výnimkou nie je ani anémia, hypoproteinémia, sekundárny lymfedém a muskuloskeletálne abnormality. Chronický invalidizujúci charakter hlavne stredne ťažkej a ťažkej formy ochorenia predstavuje pre pacienta nielen záťaž psychickú, ale má aj výrazný celospoločenský ekonomický dopad [6].
Image 1. Gluteálny fenotyp HS. // Gluteal HS phenotype. 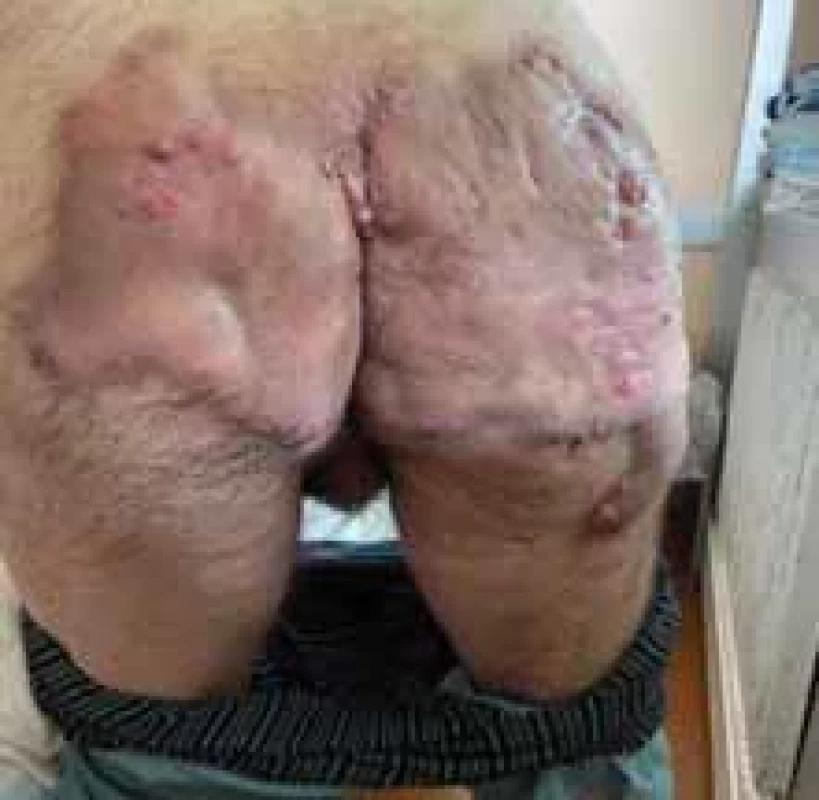
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Image 2. Axilárne postihnutie pri HS. // Axillary involvement in HS. 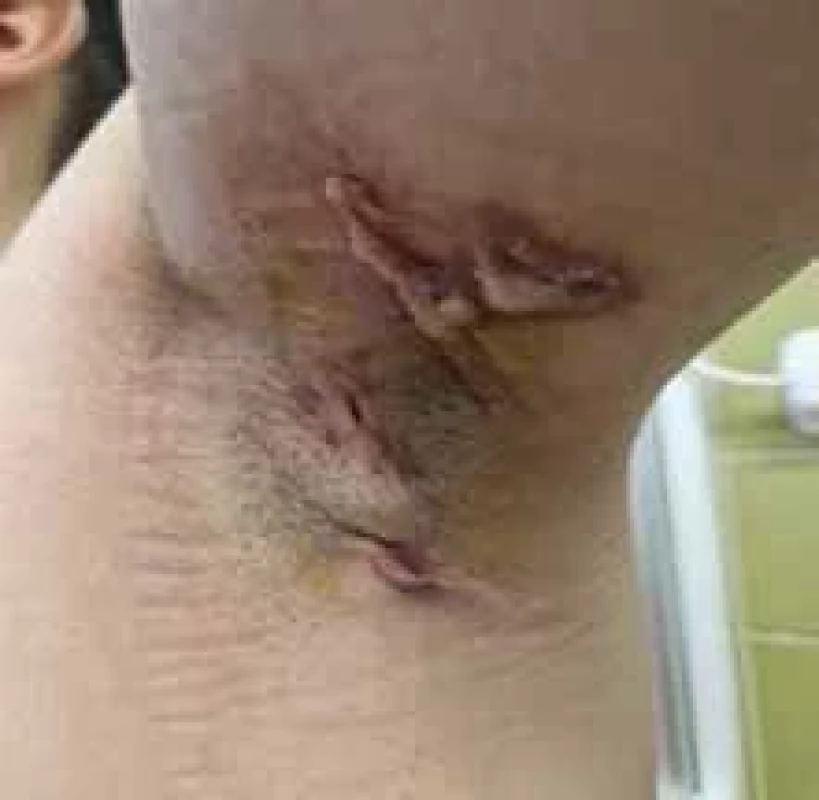
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Image 3. Typická distribúcia HS. // Typical HS distribution. 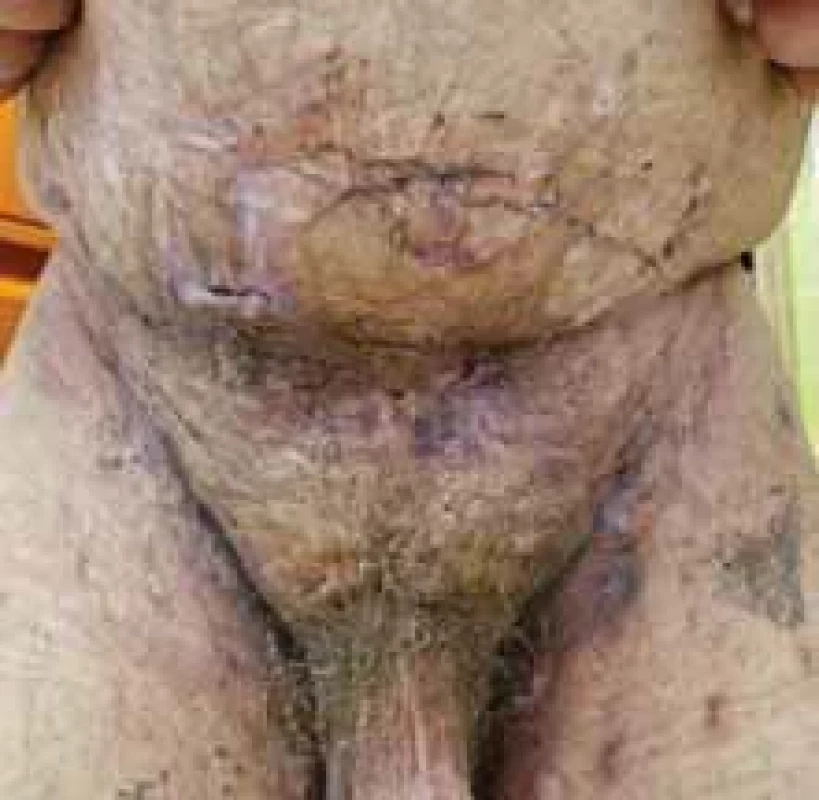
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Image 4. Zápalové prejavy HS u pacientky – nodozity, drenujúce fi stuly, jazvy. // Infl ammatory manifestations of HS in the patient – nodositis, draining fi stulas, scars. 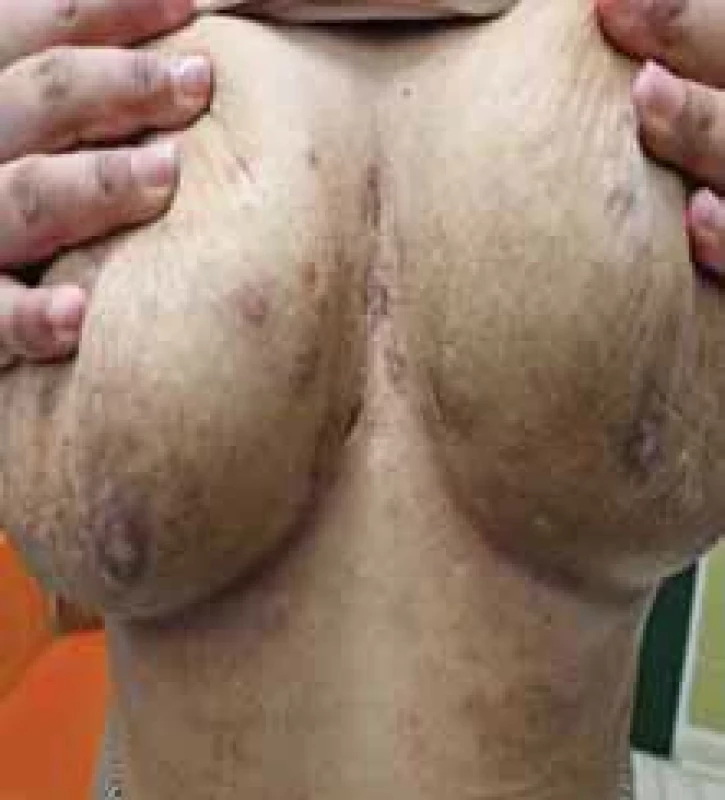
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Table 1. Hurley klasifi kácia stupňa závažnosti HS [spracované podľa 5]. // Hurley classification of the degree of severity of HS [processed according to 5]. ![Hurley klasifi kácia stupňa závažnosti HS [spracované podľa 5]. // Hurley classification of the degree of severity of HS [processed according to 5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/adea8aa4cb70ce0048a5b0efb855354b.png)
Table 2. Hodnotenie škály závažnosti HS-PGA [spracované podľa 5]. // HS-PGA Severity Scale Rating [adapted from 5]. ![Hodnotenie škály závažnosti HS-PGA [spracované podľa 5]. // HS-PGA Severity Scale Rating [adapted from 5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e58e07e2f926db29f692fa4bb71c78cf.png)
Črevný mikrobióm pri HS
Nedávno sa výrazne zvýšil záujem o mikrobióm kožných ochorení. Zvlášť zaujímavá je os črevo–mozog–koža, ktorú navrhli Stokes a Pillsbury v roku 1930, pričom sa predpokladá, že emocionálne stavy by mohli zmeniť črevný mikrobión, zvýšiť priepustnosť čriev a viesť k systémovému zápalu, a tým zhoršiť stav kože. Mikrobióm je predmetom záujmu aj v patogenéze HS [7].
Ľudský črevný mikrobióm je definovaný ako komplexný ekosystém pozostávajúci z baktérií, húb a vírusov, pričom všetky sa podieľajú na zdraví svojho hostiteľa [8]. Je známe, že sa podieľa na rôznych procesoch, vrátane trávenia, syntézy živín a stimulácie imunitného systému. Z prevažnej časti možno v ľudskom črevnom mikrobióme nájsť 6 kmeňov baktérií: Fusobacteria, Proteobacteria, Verrucomicrobia, Actinobacteria, Bacteroides a Firmicutes. Črevný mikrobióm môže ovplyvniť niekoľko faktorov, medzi ktoré patrí aj spôsob pôrodu a kàmenia novorodencov, strava dojčiat a dospelých, body mass index (BMI), pohlavie, užívanie antibiotík, proces starnutia a stres. U zdravých jedincov je zloženie stolice v priebehu času stabilné, je dôležité udržiavať črevnú eubiózu, nakoľko znížená mikrobiálna diverzita môže viesť k zvýšeniu zápalových parametrov, ako je C-reaktívny proteín, IL-6, IL-8 a TNFa [8,9].
Keďže dysbióza v črevnom mikrobióme bola spojená s viacerými patofyziologickými procesmi zahrňujúcimi imunitnú dysreguláciu, bola vyslovená hypotéza, že by mohla zohrať úlohu aj v patogenéze hidradenitis suppurativa. Podľa literárnych údajov črevná dysbióza podporuje produkciu prozápalových cytokínov, ako sú IL-6, IL-17 a TNFa črevným epitelom, po čom nasleduje zvýšenie cirkulujúcich cytokínov IFNg a TNFa. To následne vedie k zvýšenej hladine matrixových metaloproteináz (MMP-2, MMP-8 a MMP-9) a k tvorbe HS lézií [10].
V štúdii, ktorú prezentovali McCarthy et al., sa zistilo, že je rozdiel medzi črevným mikrobiómom jedincov s HS a zdravej kontroly. Do štúdie bolo zaradených 59 pacientov s HS, ktorí poskytli vzorky stolice, ako aj výtery z nosa a kože. Na celkovej DNA získanej zo vzoriek vykonali sekvenovanie amplikónov génu bakteriálnej 16S ribozomálnej RNA. Marker variácie mikrobiálnych druhov, označovaný aj ako a-diverzita, bol významne nižší u subjektov s HS. Preukázala sa aj zvýšená hladina Ruminococcus gnavus a Clostridium ramosum v porovnaní s mikrobiómami kontrolnej skupiny [11].
Zistilo sa, že u účastníkov štúdie s HS je nadmerne zastúpený Ruminococcus gnavus, ale aj u pacientov s Crohnovou chorobou a zároveň je spojený so spondyloartritídou a syndrómom dráždivého čreva. Jeho úloha pri Crohnovej chorobe bola podporená produkciou prozápalového polysacharidu, ktorý zvyšuje produkciu TNFa interakciou s toll-like receptorom 4 (TLR4) imunitných buniek, predovšetkým dendritických. Autori predpokladajú, že produkcia tohto polysacharidu môže prispieť k patogenéze HS [9,11].
V limitovanej vzorke sledovaných pacientov s HS, ktorú prezentovali Kam et al. sa uvádza, že toto ochorenie môže súvisieť so zníženou druhovou diverzitou črevnej mikroflóry, zvýšeným výskytom Bilophila a Holdemania a zníženým množstvom ochranných Lachnobactrium a Firmicutes [12].
SIBO – small intestinal bacterial overgrowth – znamená syndróm bakteriálneho prerastania čreva, teda poruchu nadmerného rastu baktérií v tenkom čreve. Je to klinický syndróm charakterizovaný zvýšeným počtom a/ alebo abnormálnym typom baktérií v tenkom čreve. Nadmerné nefyziologické osídlenie tenkého čreva baktériami môže spôsobovať poškodenie steny čreva a jeho funkcie. Najčastejšími klinickými prejavmi SIBO sú vodnatá hnačka, nadúvanie, bolesti brucha a distenzia. Môže sa prejaviť aj nedostatkom vitamínov a minerálov [13].
Bežne tenké črevo obsahuje koncentráciu baktérií nižšiu ako 103 jednotiek tvoriacich kolónie [colony forming unit] (CFU)/ ml a väčšina z nich sú grampozitívne organizmy. Hranica 105 CFU/ ml sa považuje za optimálny prah pre diagnostiku SIBO. V praxi sa využívajú vodíkové dychové testy, najmä laktulózový a glukózový dychový test. SIBO sa však nevyznačuje len kvantitatívnym posunom, ale aj kvalitatívnou zmenou. V skutočnosti sa pri SIBO často pozoruje prevaha gramnegatívnych a anaeróbnych druhov. Najvýraznejšie sa zdá prepojenie SIBO a syndrómu dráždivého čreva (IBS – irritable bowel syndrome), nakoľko frekvencia SIBO u jedincov s IBS sa pohybovala medzi 4 a 78 %, zatiaľ čo u zdravých asymptomatických jedincov u 1–40 %. Metaanalýza na túto tému založená na 25 štúdiách s 3 192 pacientmi s IBS a 3 320 kontrolami ukázala, že prevalencia SIBO u pacientov s IBS je o 3,7-krát vyššia, ako u kontrol [14].
Metaanalýza jedenástich štúdií ukázala riziko SIBO 9,51-krát vyššie u zápalových ochorení čriev (IBD), ako u kontrol [15].
Ekosystém ľudskej mikroflóry môže ovplyvniť kožnú fyziológiu a patológiu nepriamo, reguláciou imunitného systému a priamo prostredníctvom prenosu črevného mikrobiómu a ich metabolitov do kože. Po nedávnych štúdiách, ktoré analyzovali vzťah medzi SIBO a zápalovými kožnými ochoreniami, ako je rosacea a psoriáza, sa predpokladá možný patogénny mechanizmus. Weinstock et al. zaznamenali výrazné zlepšenie kožného nálezu u všetkých pacientov s rosaceou a SIBO po liečbe rifaximínom [16,17].
Eredikácia SIBO bola schopná zlepšiť kožné prejavy pri psoriáze v zmysle indexu závažnosti psoriázy a erytému. V tomto kontexte existuje hypotéza, že eredikácia SIBO môže mať priaznivý vplyv na závažnosť prejavov zápalových imunitne mediovaných kožných ochorení [18].
Prevalencia SIBO a jeho úloha pri HS nebola doteraz preskúmaná a je predmetom ďalšieho výskumu.
Image 5. Perifoliculitis capitis abscendens et sufoidens. 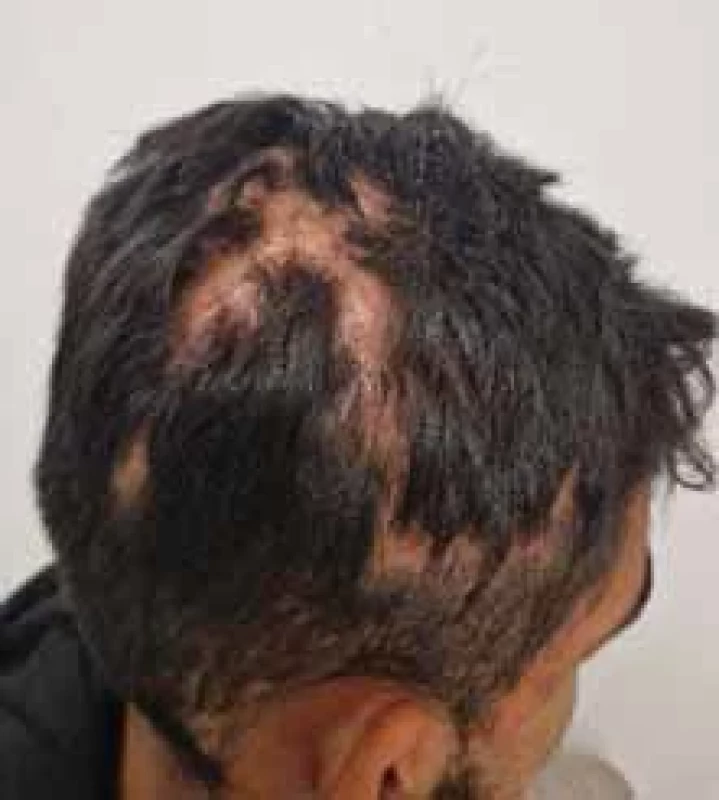
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Image 6. Acne conglobata. 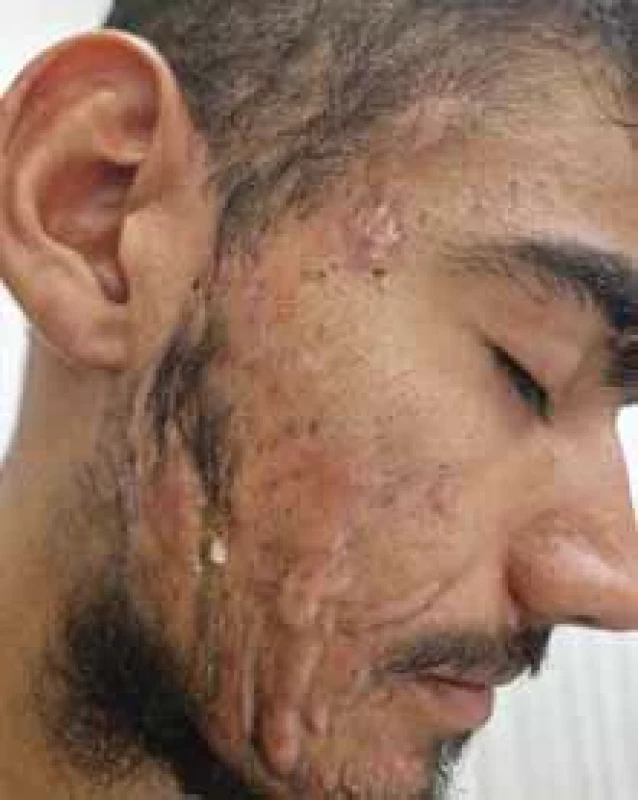
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Image 7. Perianálne postihnutie pri HS. // Perianal involvement in HS. 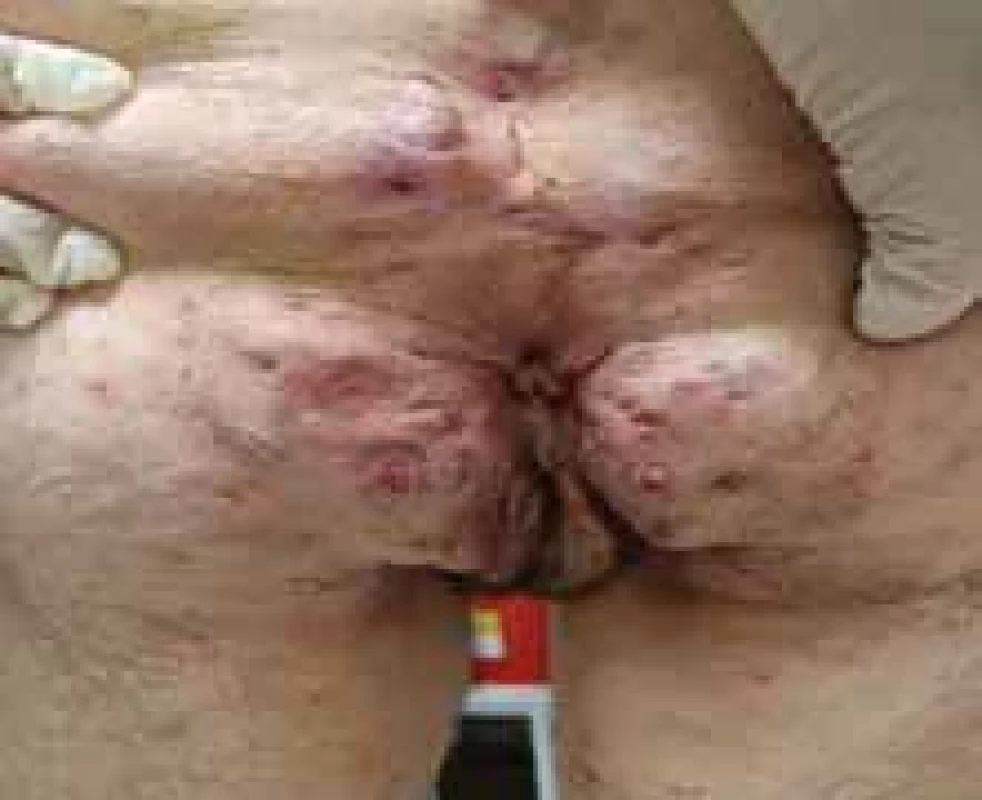
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Image 8. SCC v teréne HS s postihnutím gluteálnej oblasti Hurley III. // SCC in the fi eld of HS with involvement of the gluteal region Hurley III. 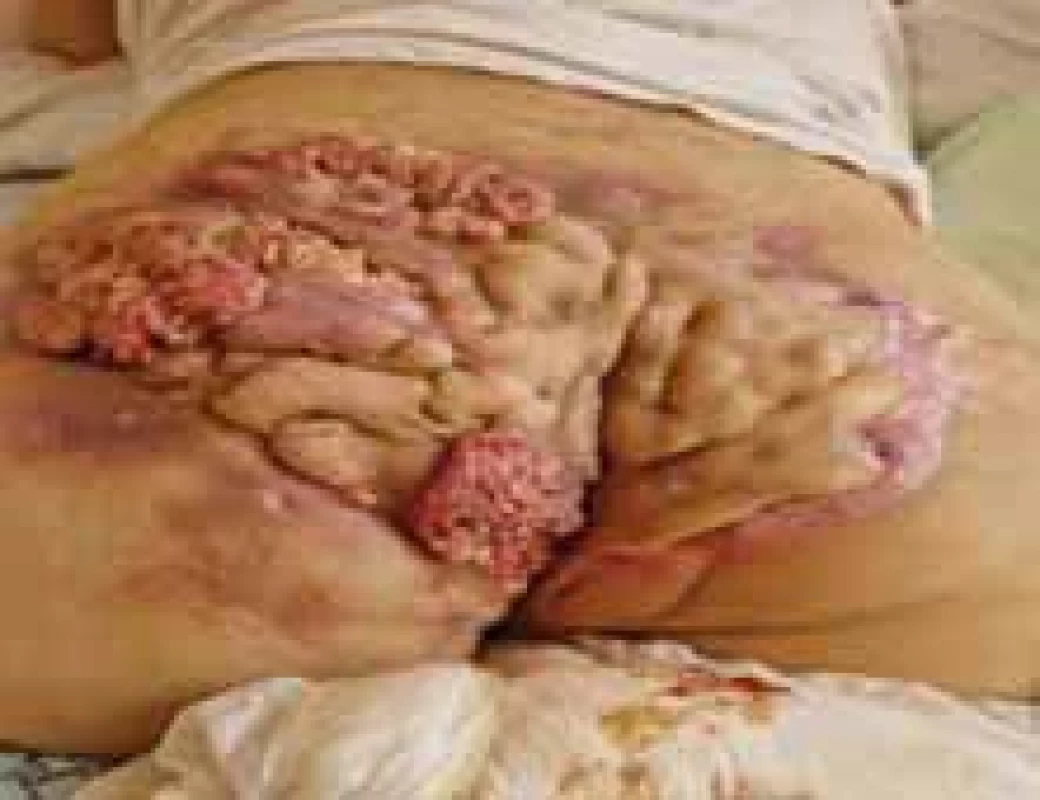
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.HS – asociované ochorenia a komorbidity v medziodborovej spolupráci
Pri ochorení HS je potrebné sa zamerať aj na sledovanie komorbidít, ktoré môžu byť asociované s ochorením a môžu ho ovplyvniť. S chronickým zápalom a HS je asociovaný metabolický syndróm, ktorý zahàňa diabetes mellitus, arteriálnu hypertenziu, dyslipidémiu a obezitu [19].
HS je aj súčasťou akné triády – HS, acne conglobata (obr. 5) a perifoliculitis capitis abscendens et sufoidens (obr. 6) a so sinus pinoidalis aj akné tetrády. HS môže byť asociovaná aj s autoinflamačnými nozologickými jednotkami a byť súčasťou syndrómov, ako PAPASH (pyoderma gangrenosum, akné, pyogénna artritída a HS) alebo PsAPASH (psoriatická artritída, pyoderma gangrenosum, akné, HS) [20].
Ukazuje sa, že existuje výrazná súvislosť medzi HS a Crohnovou chorobou (CD) na základe klinických a histologických podobností (vývoj sínusových trakov, granulomatózny zápal a jazvenie), priesečníkov v patogenéze (genetické lokusy, mechanizmy imunitnej disregulácie a zmeny mikrobiómu), ako aj zhody v liečbe (anti-TNF7a). Početné štúdie ukázali, že pacienti s CD majú výrazne 9-krát vyššie riziko HS ako bežná populácia [21].
Len málo štúdií sa zameralo na koreláciu medzi HS a CD na úrovni mikrobiómu a génu. Mikrobióm ovplyvňuje imunologickú a fyziologickú homeostázu kožného epitelu a črevnej sliznice aktiváciou Toll-like receptorov, aby rozpoznala patogény a opravila poškodenie. Rôzne enviromentálne faktory však môžu zmeniť mikrobiálnu rovnováhu, čo vedie k zníženiu mikrobiálnej diverzity. Takéto zmeny mikrobiómu môžu spôsobiť imunitnú dysreguláciu a náchylnosť na HS a zápalové ochorenia čreva (IBD) [22].
Niekedy je ťažké odlíšiť perianálne fistulujúce prejavy CD od HS iba klinickými znakmi a patologickými prejavmi (obr. 7). Približne 17–40 % pacientov s CD má aj perianálne postihnutie HS, kde sa symptómy často prekrývajú, preto je mimoriadne dôležité zobrazovacie vyšetrenie magnetickou rezonanciou (MR). Monnier et al. porovnávali charakteristické znaky MR panvy u 23 pacientov s HS a 46 pacientov s CD s anoperineálnym postihnutím. Výsledky ukázali, že medzi špecifické charakteristiky HS patrila najmä prevaha „abscencie znakov“ v perianálnej oblasti, abscencia zhrubnutia steny rekta a bilateralita znakov. Ďalšie ukazovatele zahàňali podkožný edém, menšie postihnutie análneho zvierača a sínusové trakty bez spojenia s anorektálnym kanálom [23].
U pacientov so simultánnym postihnutím CD a HS sa zvyčajne vyskytuje závažnejšie postihnutie CD hrubého čreva. Kamal et al. retrospektívne skúmali 15 pacientov s CD a HS. 47 % pacientov malo CD hrubého čreva, 53 % pacientov ileokolonické CD, neboli žiadne prípady izolovaného postihnutia ilea alebo CD hornej časti gastrointestinálneho traktu a 67 % pacientov bolo s perianálnymi léziami. Priemerný vek pacientov bol 34 rokov. Miesta lézií pri HS boli axilárne (53 %), inguinálne (47 %) a perianálne/ perineálne (73 %). Trinásť pacientov (93 %) malo štádium HS podľa Hurley klasifikácie II alebo III [22,24].
Pri HS je v teréne chronického zápalu v ložiskách zvýšené riziko rozvoja spinocelulárneho karcinómu (SCC) [25]. Bola hlásená aj zvýšená incidencia lymfómov, predovšetkým sa jedná o non-Hodgkinov lymfóm [26]. SCC transformácia pri HS je častejšia u mužov, hlavne perianálne, perineálne a v gluteálnej oblasti (obr. 8). V literatúre boli popísané aj prípady SCC vulvy. Tieto lokality sú viac exponované bakteriálnej, mykotickej alebo vírusovej expozícii, čo môže potencovať chronický zápal a rozvoj SCC. Infekcia ľudským papilomavírusom (HPV – human papillomavirus) býva významný kofaktor. V kontexte s HS je vhodná diskusia aj o HPV vakcinácii, nakoľko sa ukázal profitujúci profil pomeru benefit – riziko, ako prevencia rakoviny krčka maternice a anogenitálnej intraepiteliálnej neoplázie, ako aj invazívneho análneho karcinómu. Imunosupresívna terapia sa popri chronickej infekcii a fajčení ukazuje ako ďalší rizikový faktor neoplázie [27,28].
Terapia HS
Voľbu liečby ovplyvňuje stupeň závažnosti ochorenia a lokalizácia prejavov. Komplexným prehľadom, ako postupovať, sú európske S1 odporúčania pre liečbu HS (schéma 1). Vo všeobecnosti je liečba medikamentózna, adjuvantná a chirurgická. Liečba spočíva v dvoch základných cieľoch: liečba existujúcich lézií a zabránenie vzniku nových prejavov [29].
V literatúre máme údaje o použití aj iných biologických liekov (anakinra – inhibítor IL-1, golimumab – TNF-blokátor, guselkumab – inhibítor IL-23, ustekinumab – inhibítor IL-12/ 23, sekukinumab – inhibítor IL-17, brodalumab – inhibítor IL-17, bimekizumab – inhibítor IL-17A a IL-17F) [29,30].
Schéma 1. Modifikovaný algoritmus liečby HS [spracované podľa 29,30]. ![Schéma 1. Modifikovaný algoritmus liečby HS [spracované podľa 29,30].](https://pl-master.mdcdn.cz/media/image/0fe80417ea55084cbe9b4c61b0e41acd.png?version=1710240758)
Scheme 1. Modified HS treatment algorithm [edited according to 29,30]. Záver
Niektoré zdroje uvádzajú ako priemernú dobu od prvých príznakov HS po stanovenie správnej diagnózy u pacienta 7,5 roka. Práve včasná diagnostika a liečba v počiatočných prejavoch je kľúčová z hľadiska kontroly zápalovej aktivity ochorenia a ďalšej prognózy. Dôsledný monitoring komorbidít a komplikácií HS, ktoré vychádzajú zo samotného ochorenia a jeho liečby, je kľúčová pre kvalitu života pacienta s touto nepríjemnou diagnózou. Dostupné dáta naznačujú, že črevný mikrobióm zohráva významnú úlohu v rozvoji imunitných zápalových kožných ochorení, vrátane HS. Je predmetom ďalšieho výskumu a sledovania určiť prevalenciu bakteriálneho prerastania čreva u pacientov s HS a jeho možný dopad na závažnosť prejavov a asociované ochorenia. U všetkých pacientov s pokročilým ochorením je potrebný multidisciplinárny prístup.
Sources
1. Sabat R, Jemec GBE, Matusiak Ł et al. Hidradenitis suppurativa. Nat Rev Dis Primers 2020; 6(1): 18. doi: 10.1038/ s41572-020-0149-1.
2. Van der Zee HH, Riuter L, Broecke DG et al. Elevated levels of tumor necrosis factor alfa, interleukin 1 beta in hidradenitis suppurativa skin: a rationale for targeting TNF alfa and Il beta. Br J Dermatol 2011; 164(6): 1292–1298. doi: 10.1111/ j.1365-2133.2011.10254.x.
3. Prens E, Deckers I. Pathophysiology of hidradenitis suppurativa. J Am Acad Dermatol 2015; 73(5 suppl 1): S8–S11. doi: 10.1016/ j.jaad.2015.07.045.
4. Revuz JE, Canoui-Poitrine F, Wolkenstein P et al. Prevalence and factors associated with hidradenitis suppurativa: Results from two case-control studies. J Am Acad Dermatol 2008; 59(4): 596–601. doi: 10.1016/ j.jaad.2008.06.020.
5. Kimball AB, Jemec GB, Yang M et al. Assessing the validity, responsiveness and meaningfulness of the Hidradenitis suppurativa Clinical Response (HiSCR) as the clinical endpoint for hidradenitis suppurativa treatement. Br J Dermatol 2014; 171(6): 1434–1442. doi: 10.1111/ bjd.13270.
6. Kohorst J, Baum C, Otley C et al. Surgical management of Hidradenitis Suppurativa. Dermatol Surg 2016; 42(9): 1030–1040. doi: 10.1097/ DSS.0000000000000806.
7. Ursell LK, Metcalf JL, Partfrey lW et al. Defining the human microbiome. Nutr Rev 2012; 70(1): S38–S44. doi: 10.1111/ j.1753-4887.2012.00493.x.
8. Heintz-Buschart A, Wilmes P. Human Gut Microbiome: Function Matters. Trends Microbiol 2018; 26(7): 563–574. doi: 10.1016/ j.tim.2017.11.002.
9. Świerczewska Z, Lewandowski M, Surowiecka A et al. Microbiome in Hidradenitis Suppurativa – What We Know and Where We are Heading. Int J Mol Sci 2022; 23(19): 11280. doi: 10.3390/ ijms231911280.
10. Molnar J, Mallonee CJ, Stanisic D et al. Hidradenitis suppurativa and 1-CarbonMetabolism: Role of Gut Microbiome, matrix Metalloproteinases and Hyperhomocysteinemia. Front Immunol 2020; 11 : 1730. doi: 10.3389/ fimmu.2020.01730.
11. McCarthy S, Barret M, Kirthi S et al. Altered Skin and Gut Microbiome in Hidradenitis Suppurativa. J Invest Dermatol 2021; 142(2): 459–468. doi: 10.1016/ j.jid.2021.05.036.
12. Kam S, Collard M, Lam J et al. Gut Microbiome Pertubations in patients with Hidradenitis Suppurativa: A Case Series. J Invest Dermatol 2021; 141(1): 225–228. doi: 10.1016/ j.jid.2020.04.017.
13. Dukowicz AC, Lacy BE, Levine GM. Small intestinal bacterial overgrowth: a comprehensive review. Gastroenterol Hepatol (NY) 2007; 3(2): 112–122.
14. Losurdo G, Salvatore D‘Abramo F, Indellicati G et al. The Influence of Small Intestinal Bacterial Overgrowth in Digestive and Extra-Intestinal Disorders. Int J Mol Sci 2020; 21(10): 3531. doi: 10.3390/ ijms21103531.
15. Shah A, Morrison M, Burger D et al. Systematic Review with metaanalysis: The prevalence of small intestinal bacterial overgrowth in inflammatory bowel disease. Aliment Pharmacol Ther 2019; 49(6): 624–635. doi: 10.1111/ apt.15133.
16. Weinstock LB, Steinhoff M. Rosecea and small intestinal bacterial overgrowth: Prevalence and response to rifaximin. J Am Acad Dermatol 2013; 68(5): 875–876. doi: 10.1016/ j.jaad.2012.11.038.
17. Salem I, Ramser A, Isham N, Ghannoum MA. The Gut Microbiome as a Major Regulator of the Gut-Skin Axis. Front Microbiol 2018; 9 : 1459. doi: 10.3389/ fmicb.2018.01459.
18. Drago F, Ciccarese G, Indemini E et al. Psoriasis and small intestine bacterial overgrowth. Int J Dermatol 2018; 57(1): 112–113. doi: 10.1111/ ijd.13797.
19. Miller IM, Ellervik C, Vinding GR et al. Associoation of metabolic syndrome and hidradenitis suppurativa. AMA Dermatol 2014; 150(12): 1273–1280. doi: 10.1001/ jamadermatol.2014.1165.
20. Vorčáková K, Péčová K, Madleňák M et al. Hidradenitis suppurativa – terapeutická výzva pre dermatológa. Dermatol Prax 2021; 15(2): 62–67.
21. Zhang M, Chen QD, Xu HX et al. Association of hidradenitis suppurativa with Crohn’s disease. World J Clin Cases 2021; 9(15): 3506–3516. doi: 10.12998/ wjcc.v9.i15.3506.
22. Chen WT, Chi CC. Association of Hidradenitis suppurativa With Inflamatory Bowel Disease: A systemic Review and meta-analysis. JAMA Dermatol 2019; 155(9): 1022–1027. doi: 10.1001/ jamadermatol.2019.0891.
23. Monnier L, Dohan A, Amara N et al. Anoperineal disease in Hidradenitis suppurativa: MR imaging distinction from perianal Crohn’s disease. Eur Radiol. 2017; 27(10): 4100–4109. doi: 10.1007/ s00330-017-4776-1.
24. Kamal N, Cohen BL, Buche S et al. Features of Patients With Crohn’s Disease and Hidradenitis Suppurativa. Clin Gastroenterol Hepatol 2016; 14(1): 71–79. doi: 10.1016/ j.cgh.2015.04.180.
25. Manolitas T, Biankin S, Jaworski R et al. Vulval squamouscell carcinoma arising in chronic hidradenitis suppurativa a case report and rewiev of the literature. Int Wound J 2017; 14(2): 435–438. doi: 10.1111/ iwj.12671.
26. Tannebaum R, Strunk A, Garg A. Association between hidradenitis suppurativa and lymphoma. JAMA Dermatol 2019; 155(5): 624–625. doi: 10.1001/ jamadermatol.2018.5230.
27. Racanelli E, Jfri A, Gefri A et al. Cutaneous Squamous Cell Carcinoma in Patients with Hidradenitis Suppurativa. Cancers (Basel) 2021; 13(5): 1153. doi: 10.3390/ cancers13051153.
28. Gierek M, Niemiec P, Szyluk K et al. Hidradenitis supurrativa and squamous cell carcinoma: a systemic review of the literature. Postepy Dermatol Alegol 2023; 40(3): 350–354. doi: 10.5114/ ada.2023.126563.
29. Zouboulis CC, Desai N, Emtestam L et al. European S1 guideline for the treatment of hidradenitis suppurativa/ acne inversa. J Eur Acad Dermatol Venereol 2015; 29(4): 619–644. doi: 10.1111/ jdv.12966.
30. Urbanček S, Vorčáková K. Aktuálna farmakoterapia Hidradenitis suppurativa. Dermatol Prax 2022; 16(1): 14–16.
ORCID autorov
B. Ivanková 0009-0005-6036-9357,
J. Baloghová 0000-0003-4470-5777.
Doručené/ Submitted: 8. 11. 2023
Prijaté/ Accepted: 6. 1. 2024MU Dr. Barbara Ivanková, MBA
Klinika dermatovenerológie
UPJŠ LF a UN LP Košice
Trieda SNP 1
040 01 Košice
barbara.ivankova@unlp.skLabels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2024 Issue 1-
All articles in this issue
- Editorial
- Heuréka!
- What will be your recommendation for therapy for severe ulcerative colitis?
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku Crohnovy choroby
- Reduced urinary magnesium levels after ileocolic resection in patients with Crohn’s disease
- Mirikizumab – the first anti-IL23 p19 antibody in ulcerative colitis therapy
- Efficacy and safety of switching from intravenous to subcutaneous CTP-13 treatment in IBD patients – a one-year retrospective study from large Slovak IBD centre
- Methotrexate is the re-discovered drug for Crohn’s disease
- Hidradenitis suppurativa, intestinal microbiome and SIBO – a comprehensive overview of the issue
- Idiopathic hypereosinophilic syndrome with gastrointestinal involvement
- Simultaneous robotic resection of colorectal cancer and liver metastases – first experience
- The selection from international journals
- Hoffmanová I. Abdominální sonografie žlučníku a žlučových cest
- Kreditovaný autodidaktický test: IBD
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Methotrexate is the re-discovered drug for Crohn’s disease
- Idiopathic hypereosinophilic syndrome with gastrointestinal involvement
- Mirikizumab – the first anti-IL23 p19 antibody in ulcerative colitis therapy
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku Crohnovy choroby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

