-
Medical journals
- Career
Monocentrická retrospektívna analýza asociácie hidradenitis suppurativa a chronických zápalových ochorení čreva
Authors: Vorčáková K. 1; Ballová A. 1; Madleňák M. 1; Vorčák M. 2; Péč J. 1
Authors‘ workplace: Dermatovenerologická klinika JLF UK a UN Martin 1; Radiologická klinika JLF UK a UN Martin 2
Published in: Gastroent Hepatol 2021; 75(5): 438-443
Category: Original Article
doi: https://doi.org/10.48095/ccgh2021438Overview
Úvod: Hidradenitis suppurativa (HS) a chronické zápalové ochorenia čreva (IBD) sú navzájom asociované. Prevalencia IBD u pacientov s HS nie je úplne objasnená. Cieľom práce bolo zistiť prevalenciu IBD u HS pacientov a vyhodnotiť rizikové faktory a možný fenotyp pacientov HS a IBD. Metodika: Monocentrickou retrospektívnou analýzou dát u 241 pacientov s HS sme na základe zdravotnej dokumentácie určili výskyt IBD. Následne sme vyhodnocovali epidemiologické faktory HS. Výsledky: IBD sme potvrdili u 5,8 % pacientov. Z uvedeného počtu bolo 13 (92,9 %) pacientov s Crohnovou chorobou a 1 (7,1 %) pacient s ulceróznou kolitídou. Gastroenterológom bolo odoslaných 8 (57,1 %) pacientov a u 6 (42,9 %) pacientov sme našli asociáciu náhodne v rámci dermatologického vyšetrenia. Práca nepotvrdila jednoznačne odlišný fenotyp pacienta, ktorý je pri ochorení HS asociovaný s IBD. Upozorňujeme na výskyt možných spoločných komorbidít a rizikových faktorov ako abúzus fajčenia a obezitu. Diskusia: Práca potvrdzuje dostupné literárne údaje, významnú asociáciu HS a CD a nižšiu pri HS a UC. Záver: Prevalencia IBD u pacientov s HS je 5,8 %, u pacientov s HS a IBD sme nepotvrdili jednoznačne odlišný fenotyp ochorenia.
Klíčová slova:
ulcerózna kolitída – rizikové faktory – Crohnova choroba – komorbidity – hidradenitis suppurativa – chronické zápalové ochorenia čriev – asociácia
Úvod
Hidradenitis suppurativa (HS) je chronické, zápalové, rekurentné ochorenie kože primárne postihujúce vlasový folikul. Zvyčajne sa prejavuje po puberte bolestivými, hlboko uloženými léziami v oblastiach bohatých na apokrinné žľazy, najčastejšie v axilárnej, ingvinálnej a anogenitálnej oblasti. Etiológia HS doteraz nie je úplne objasnená. Predpokladá sa, že ide o ochorenie, pri ktorom hrá úlohu viacero vnútorných a vonkajších faktorov, ako je genetická predispozícia jedinca, dysregulácia imunitného systému, hormonálna dysregulácia, fajčenie, obezita, mechanické trenie, stres a zmeny bakteriálnej flóry kože. Tieto faktory podmieňujú vznik folikulárnej oklúzie, od ktorej sa odvíja ďalší priebeh ochorenia, vzniká dilatácia, ruptúra folikulu a akútna zápalová odpoveď kože [1]. V posledných rokoch sa ukazuje, že HS má rôzne fenotypy, ktoré majú inú závažnosť, priebeh ochorenia aj prognózu [2]. Asociácia HS a chronických zápalových ochorení čreva (IBD) bola prvý krát popísaná už v roku 1991 [3]. Ich asociácia sa ukazuje ako štatisticky signifikantná, aj keď viaceré práce podporujú výraznejšiu incidenciu Crohnovej choroby (CD), ako ulceróznej kolitídy (UC) u pacientov s HS. Cieľom tejto práce je v skupine 241 pacientov s HS identifikovať pacientov so súčasným výskytom IBD v podmienkach Slovenska so zameraním aj na možné fenotypové odlišnosti. V práci samostatne analyzujeme pacientov, ktorí boli na dermatologickú ambulanciu odoslaní gastroenterológom, pre možnú zvýšenú incidenciu HS u pacientov s IBD ako u pacientov s HS v bežnej populácii.
Metodika
Retrospektívnou analýzou dát ambulancie biologickej liečby Dermatovenerologickej kliniky UN Martin sme analyzovali spolu 257 pacientov, ktorí navštívili ambulanciu za obdobie 05/2017–05/2021 pre konzultáciu ochorenia hidradenitis suppurativa. Z uvedenej skupiny sme vylúčili 16 pacientov pre nekompletné údaje v dokumentácii. Následne u pacientov s IBD a HS boli hodnotené základné epidemiologické údaje ako vek nástupu ochorenia (HS a IBD), rodinná anamnéza so zameraním na HS a IBD, anamnéza akné, výskyt pilonidálneho sínusu, výskyt disekujúcej celulitídy kapilícia, lokalizáciu prejavov, závažnosť ochorenia vyjadrenú v Hurley skóre, abúzus fajčenia, obezita a iné možné asociované komorbidity. V skupine pacientov s IBD a HS sme sledovali, kto pacienta odoslal, či dermatológ, alebo gastroenterológ. V skupine pacientov HS a IBD sme hodnotili anamnézu používania biologickej liečby.
Výsledky
Z celkového počtu vyšetrených pacientov 241 malo v čase dermatologického vyšetrenia gastroenterológom potvrdené chronické zápalové ochorenie čreva (IBD) 14 (5,8 %) pacientov, z toho 13 (92,9 %) pacientov malo CD a 1 (7,1 %) pacient mal UC. Z celkového počtu pacientov s HS a IBD bolo 8 (57,14 %) mužov a 6 (42,86 %) žien. Rodinná anamnéza bola pozitívna u 1 pacienta, ktorého brat mal CD. Fajčiarov a bývalých fajčiarov bolo v sledovanej skupine 8 (57,14 %) pacientov. Ani jeden pacient nemal anamnézu ťažkej formy akné a disekujúcej celulitídy kapilícia. Folikulitída sa vyskytovala u 5 (35,71 %) pacientov. Najviac pacientov, 8 (57,14 %) malo potvrdený stupeň závažnosti ochorenia Hurley I, Hurley II mali 4 (28,57 %) pacienti a 2 (14,29 %) pacienti mali potvrdený stupeň Hurley III. Čo sa týka počtu lokalizácií, 1–2 postihnuté lokalizácie mali 8 (57,14 %) pacienti, 3–4 postihnuté oblasti mali 4 (28,57 %) pacienti, 4 a viac lokalít mali 2 (14,29 %) pacienti. Nadváhou alebo obezitou s Body mass index (BMI) nad 25 kg/m2 trpelo v sledovanej skupine 6 (42,86 %) pacientov. Ako prvé sa manifestovalo črevné ochorenie u 2 (14,29 %) pacientov, u 10 (71,43 %) pacientov sa ako prvá manifestovala HS a 2 (14,29 %) pacienti udávali vznik ložísk v rovnakom časovom období ako vznik IBD. Gastroenterológom bolo odoslaných 8 (57,14 %) pacientov, z toho 3 (21,43 %) z iného centra biologickej liečby ako z UN Martin. Všetci pacienti odoslaní od gastroenterológa mali anamnézu používania biologickej liečby, 8 (57,14 %) z nich používalo biologickú liečbu v čase konzultácie HS. Z komorbidít pacientov sme zaznamenali u 1 pacienta autizmus a epilepsiu, u 1 pacienta Downov syndróm, psychiatrické komorbidity (1x schizofrénia, 1x atypická depresia, 1x depresia), z asociovaných ochorení 1x pyoderma gangrenosum, 1x psoriáza, 1x urtikária, 2 pacienti mali ťažký priebeh zápalového ochorenia (u 1 IBD a u 1 ťažká forma HS) s rozvojom monoklonálnej gamapatie s neurčitým významom (MGUS) (tab. 1).
Table 1. Klinická charakteristika pacientov s hidradenitis suppurativa a chronickým zápalovým ochorením čreva.
Tab. 1. Clinical characteristics of patients with hidradenitis suppurativa and inflammatory bowel disease.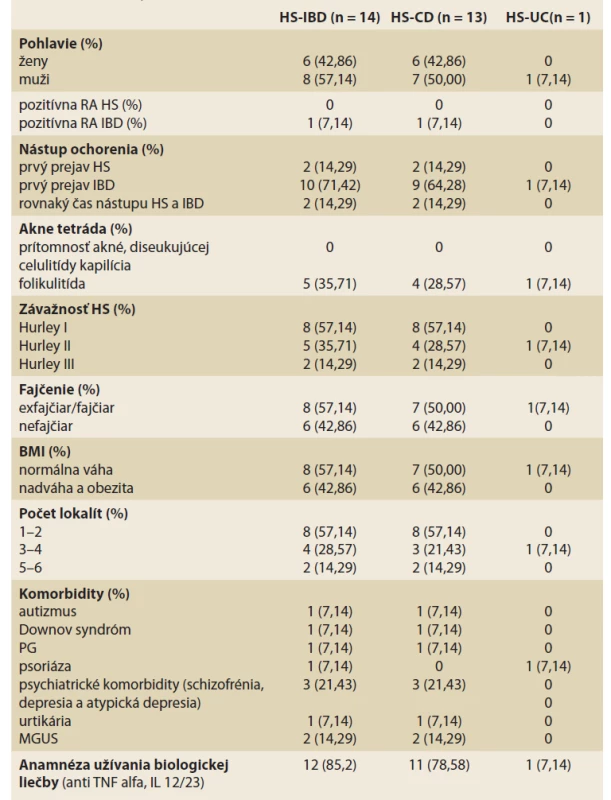
HS – hidradenitis suppurativa, CD – Crohnova choroba, UC – ulcerózna kolitída, TNF – tumor necrosis factor, IL – interleukin, MGUS – monoklonálna gamapatia s neurčitým významom, obezita a nadváha bola hodnotená v jednej skupine s hodnotami BMI nad 25 kg/m2, TNF – tumor necrosisi faktor, IBD – inflammatory bowel diseases, RA – rodinná anamnéza, BMI – body mass index, PG – pyoderma gangrenosum Diskusia
V našej práci sme potvrdili súčasný výskyt HS a IBD u 14 (5,8 %) pacientov, s výsledným percentuálnym zastúpením 5,39 % pre CD a 0,41 % pre UC. V porovnaní prevalencia IBD v bežnej populácii severnej Európy sa pohybuje medzi 0,41 a 0,74 %, jednotlivo pre CD v rozmedzí 0,14 a 0,32 % a pre UC v rozmedzí 0,24 a 0,41 % [4–7]. Literárne práce podporujú výrazne vyššiu asociáciu CD a HS v porovnaní s HS a UC [8,9]. Niektoré z prác asociácie HS a UC ich asociáciu nepotvrdili, rovnako ako v našej sledovanej skupine sa incidencia pohybovala v rovnakom zastúpení [9]. Americká populačná štúdia dokázala, že 2 % pacientov s HS majú súčasne CD, je však nutné upozorniť aj na možné etnické rozdiely [10]. Dánska štúdia potvrdila len 0,8 % pacientov s CD v skupine 7 732 pacientov s HS [11]. Multicentrická štúdia z 3 univerzitných centier na 1 074 pacientov potvrdila asociáciu CD u 2,5 % pacientov s HS a prevalenciu UC u 0,8 %, celková asociácia IBD dosiahla 3,3 % [8]. Viaceré štúdie poukazujú na možné rozdiely zastúpenia CD v skupine pacientov s HS a na zastúpenie HS v skupine pacientov s CD. Holandská skupina publikovala 2 práce, v pilotnej štúdii na vzorke 156 pacientov, kde preukázali výskyt HS u 16 % pacientov s IBD, v následnej štúdii na základe anamnestického dotazníka na vzorke 1 093 pacientov s IBD potvrdili HS až u 23 % pacientov. Pre uvedené dáta, sme v našej práci z celkového počtu pacientov HS-IBD rozdelili pacientov na tých, ktorí boli odoslaní od gastroenterológa (64,3 %), a na pacientov, u ktorých sme v rámci dermatologického vyšetrenia zaznamenali asociáciu na základe anamnestických údajov (35,7 % pacientov).
Pri sledovaní fenotypových odlišností sme v našej sledovanej skupine u žiadneho z pacientov nepozorovali výskyt viacerých ochorení folikulárnej tetrády, rovnako ani rodinná anamnéza IBD a HS nebola významná. Z celkového počtu HS-IBD dominovali muži v pomere 8 : 6. Iné práce rozdiely v pohlaví nepozorovali a ako v populácii HS pacientov aj tu dominovalo ženské pohlavie [8,12]. Nadváhu alebo obezitu s BMI > 25 sme potvrdili u 6 pacientov s HS-IBD, fajčiarov a exfajčiarov bolo 57,14 % pacientov. Fajčenie a nadváha sa ukazujú ako spoločné spúšťacie faktory, na ktoré upozorňujú aj Lukach et al ako na významné rizikové faktory vzniku HS u pacientov s IBD. Okrem uvedených rizikových faktorov autori poukazujú na vyšší výskyt HS u pacientov s lokalizáciou IBD perianálne a v iloekolonickej lokalizácii [12].
Iné významné rozdiely v závažnosti ochorenia, lokalizácie kožných lézií oproti publikovaným dátam sme nenašli. Deckers et al [8] vo svojej multicentrickej prierezovej štúdii sledovali odlišnosti fenotypu HS pri súčasnom IBD a samotnej HS. Autori zistili, že pacienti s oboma ochoreniami boli menej často obézni (14 vs. 31,4 %), čo môže byť vysvetlené malnutríciou, zníženým apetítom a stratou hmotnosti u pacientov s IBD. Rozdiely v pohlaví, závažnosťou HS, fajčením cigariet a rodinnou anamnézou zistené neboli.
V našej sledovanej skupine sa ako klinicky relevantné ukazujú údaje o vzájomných asociovaných ochoreniach. V našom súbore pacientov až 50 % malo ochorenie, ktoré sa vyskytuje súčasne pri IBD aj pri HS. Prítomnosť obidvoch ochorení dominuje u detí s Downovým syndrómom, ukazuje sa aj možná asociácia s autizmom a epilepsiou [13–15]. Spoločnými komorbiditami ochorenia sú aj pyoderma gangrenosum, psoriáza a psychiatrické komorbidity [13,16]. Závažný priebeh HS alebo CD môže viesť k monoklonálnej gamapatii a tú sme pozorovali u 2 pacientov.
HS aj IBD majú podobné klinické prejavy, ktoré sa vyznačujú sterilnými abscesmi v perianálnej oblasti, tvorbou sínusových traktov a jaziev (obr. 1–3) [1]. Klinické rozdiely medzi HS a mimočrevnou IBD niekedy môžu byť len minimálne, rovnako histologický obraz ochorení sa nemusí výrazne odlišovať, kedy môžeme pozorovať granulomatózny zápal a lymfoidnú folikulitídu. Najčastejším diagnostickým problémom je perianálna choroba, ktorá je častokrát považovaná za IBD, naopak izolované zápalové nodozity nie sú považované za HS len za mimočrevné prejavy IBD [17]. Indikácie na MR vyšetrenie panvy pri HS nie sú jasne stanovené. Všeobecne sa MR realizuje u ťažších prípadov na určenie rozsahu ochorenia a ako kontrola efektu liečby. Správna diagnostika anoperineálneho postihnutia HS je podstatná v dvoch prípadoch. Prvý prípad tvoria pacienti s CD a neznámou HS, kedy rádiológ podľa MR vyšetrenia môže suponovať HS ako ochorenie zapríčiňujúce zmeny v anoperineálnej oblasti. HS sa často primárne prejaví ako izolované anoperineálne postihnutie a u pacientov s oboma diagnózami, sú zmeny pripisované primárne CD. V druhom prípade, s anoperineálnym postihnutím oboma ochoreniami, je pre liečbu dôležité, ktoré zmeny možno priradiť k HS, a ktoré k CD. V MR obraze existuje široké spektrum prejavov anoperineálneho postihnutia pri HS, ktoré sa čiastočne prelínajú so zmenami pri postihnutí pri CD. Zdá sa, že na základe kombinácie nálezov je možné určiť príčinné ochorenie týchto zmien. Známky zvyšujúce pravdepodobnosť diagnózy HS predstavujú obojstranné postihnutie, podkožný edém a tvorba granulómov. Zároveň sa abscesy a granulómy pri HS vyskytujú vo väčšom počte, zvyknú byť menšie a koalescenčné. Naopak dôležitú rozlišovaciu známku v prospech diagnózy CD predstavuje zhrubnutie steny rekta. Prítomnosť fistúl je častejšia u pacientov s CD a častejšie komunikujú s análnymi sfinktermi. Dôležitá rozlišovacia známka je aj lokalita, pričom pri HS je významne častejšie postihnutá oblasť predného perinea, inguín a/alebo sakrálnej a gluteálnej oblasti (obr. 4) [18].
Image 1. Hidradenitis suppurativa, mierna závažnosť ochorenia Hurley I v oblasti ľavej axily s prítomným zápalovým nodulom.
Fig. 1. Patient with mild stage hidradenitis suppurativa (Hurley I) in left axillary region with accompanying inflammatory nodule.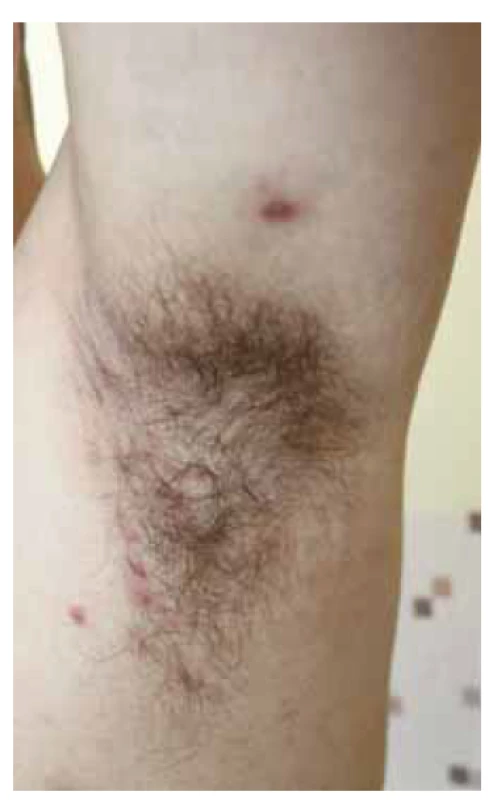
Image 2. Pacient s hidradenitis suppurativa v gluteálnej oblasti Hurley III, kolonoskopicky vylúčené IBD.
Fig. 2. Patient with hidradenitis suppurativa in gluteal region (Hurley III), repeated colonoscopy ruled out IBD.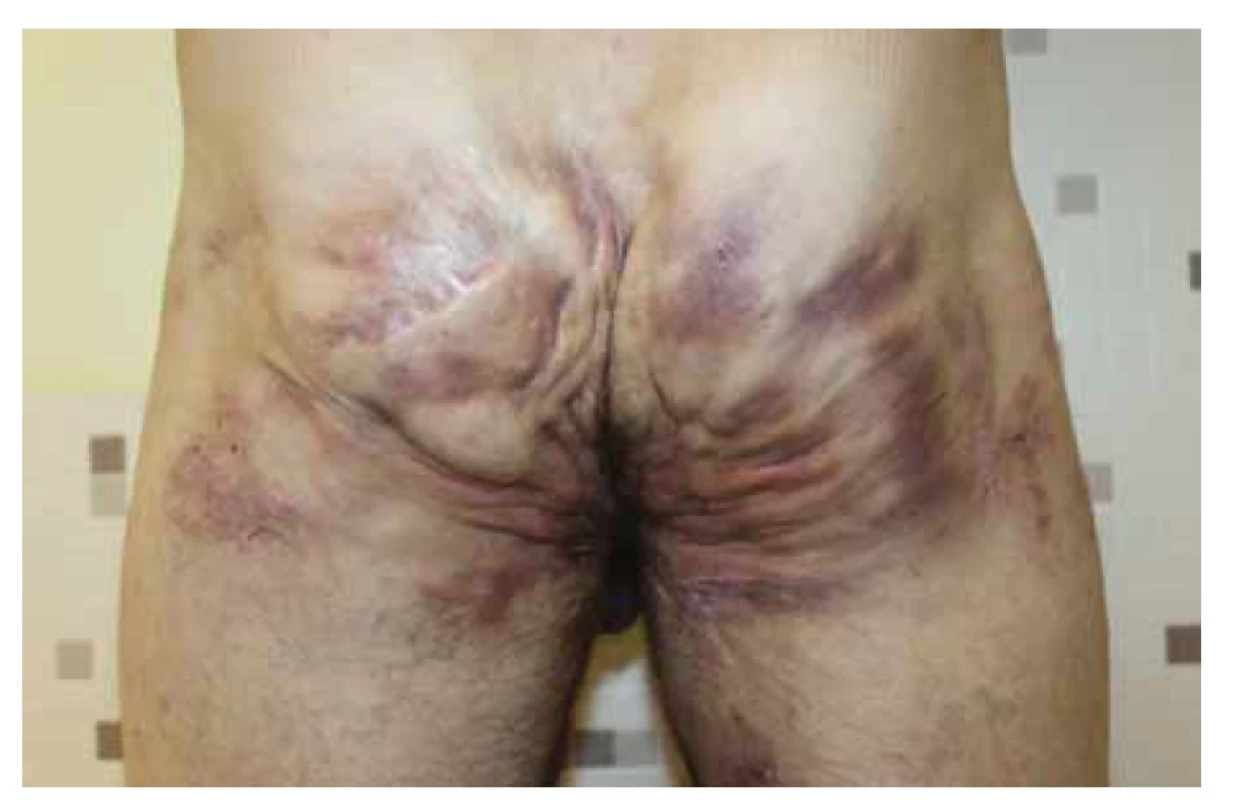
Image 3. Pacient s hidradenitis suppurativa v gluteálnej časti Hurley III, s potvrdenou Crohnovou chorobou.
Fig. 3. Patient with hidradenitis suppurativa in gluteal region (Hurley III) with confirmed Crohnʼs disease.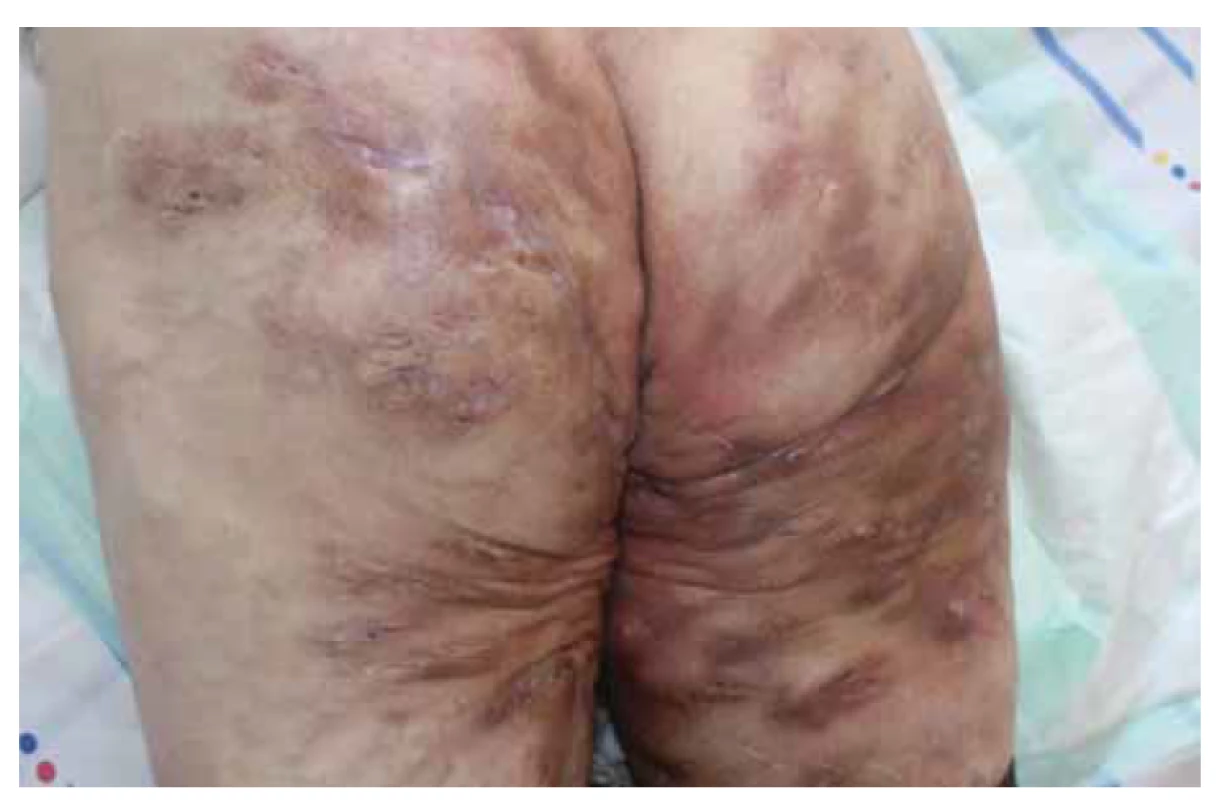
Image 4. MR vyšetrenie, T2 váženie s potlačením signálu tuku – A) transverzálny rez, zobrazujú sa obojstranné fistuly v oblasti perinea zasahujúce ventrálne na skrotum a dorzálne do gluteálnej oblasti (šípky). B) sagitálny rez, viditeľný edém skróta a perinea (hviezdička), análne sfinktre intaktné, stena rekta bez zhrubnutia (šípky).
Fig. 4. MR imaging, fat suppressed T2 image – A) axial view, bilateral fistulae in perineal region extending to scrotum and to gluteal region (arrows). B) sagittal view, scrotal and perineal oedema (star), anal sphincters are not affected, rectal wall without thickening (arrows).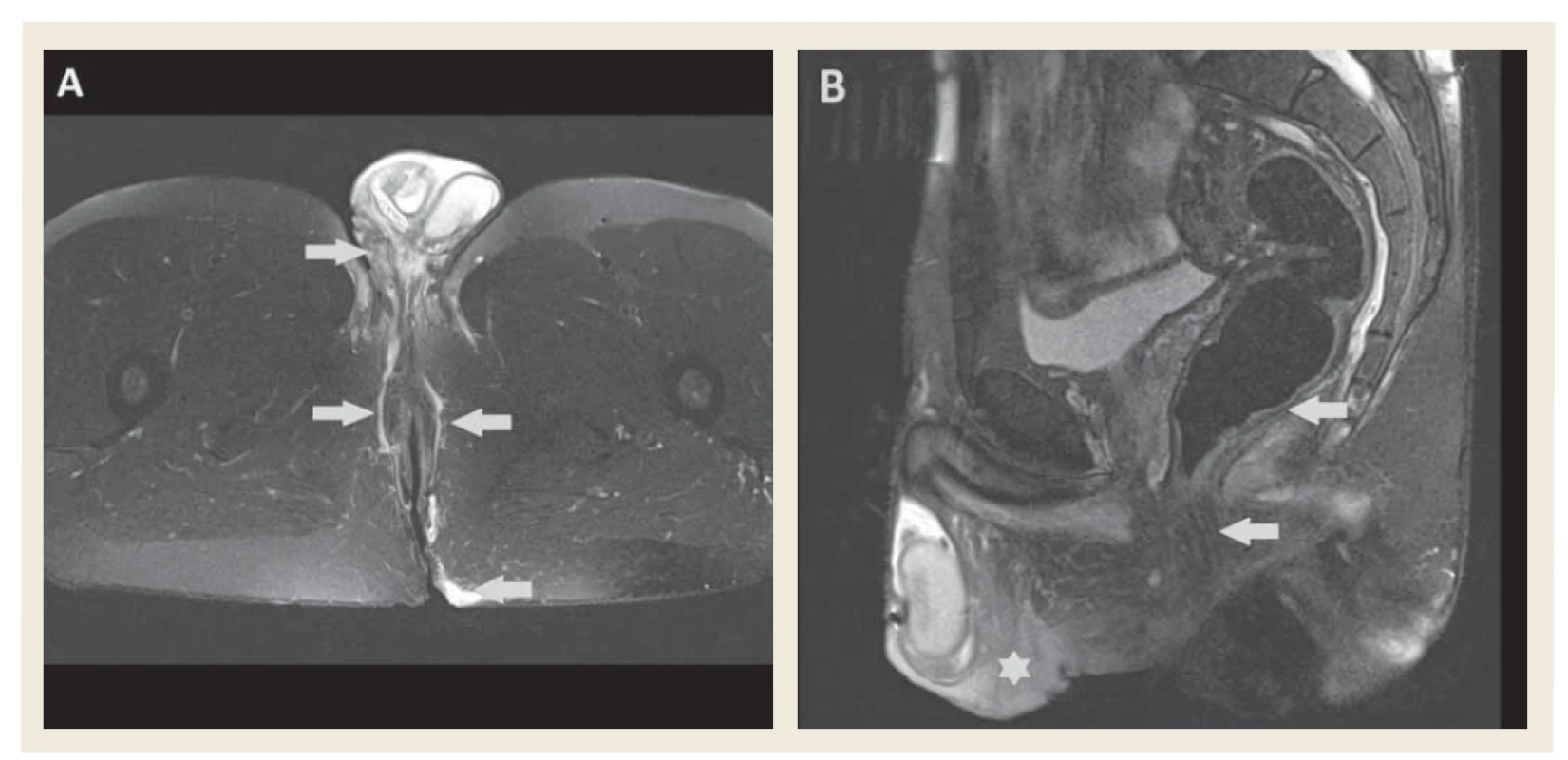
Spoločnými znakmi IBD a HS je imunitná dysregulácia, pri ktorej sa vyskytujú cytokínové abnormality, ako je zvýšenie hladiny interleukínu 1 (IL-1), IL-6, IL-17, IL-23 a TNF-alfa [19–21]. Ďalšími spoločnými charakteristikami sú genetická predispozícia, podobné imunologické cesty a porucha črevnej mikrobioty. Boli identifikované gény ako SULT1B1 a SULT1E1, ktoré sú asociované s obidvoma ochoreniami. Porucha črevnej mikrobioty môže mať za následok systémovú poruchu imunity a nové dôkazy tiež naznačujú možný vplyv na kožný mikrobióm [22]. Táto úzka súhra medzi poruchou črevnej mikrobioty, cytokínmi a kožnými ochoreniami bola označená ako teória osi črevo–koža[23]. Nie menej dôležitým faktom je efektivita anti-TNF alfa liečby u obidvoch ochorení. V našej sledovanej skupine sme v čase dermatologického vyšetrenia zaznamenali anamnézu užívania biologickej liečby u 85,71 %. U pacientov na biologickej liečbe HS vznikla v čase vzniku IBD alebo v priebehu ochorenia. Z tohto pohľadu je nutné pri hodnotení etiológie HS myslieť aj na možnú paradoxne (biologickou liečbou) indukovanú HS [24]. Klinické dáta o vzniku prvých nodozít na koži častokrát v dokumentácii absentujú alebo sú považované za asociované prejavy pri IBD. Pred samotným nastavením na systémovú a biologickú liečbu u pacientov s IBD by sme sa mali zamerať na klinické vyšetrenie kože a anamnézu zápalových nodozít v oblasti axíl, inguín submamárne a v gluteálnej oblasti. Rovnako dermatologické vyšetrenie pacienta s HS by malo obsahovať odobratie anamnézy zameranej na prítomnosť respektíve možný rozvoj IBD. V prípade fistúl v perianálnej oblasti by sme mali konzultovať gastroenterológa a v prípade nutnosti doplniť ďalšie potrebné vyšetrenia.
Záver
Naša práca potvrdila významne vyššiu incidenciu CD u pacientov s HS v porovnaní s jej výskytom v bežnej populácii. Fajčenie a obezita sa ukazujú ako spoločný spúšťač a sú rizikové pre rozvoj HS u pacientov s IBD. Skúmanie spoločných asociovaných ochorení, spoločných genetických prediktorov, budú cieľom ďalšieho výskumu. Liečba HS u pacienta s CD je založená na úzkej spolupráci gastroenterológa, dermatológa a chirurga. Biologická liečba skupiny anti-TNF alfa môže obidve ochorenia potláčať, ale musíme myslieť aj na fakt, že môže HS paradoxne indukovať. Limitáciou našej práce je retrospektívna analýza dát, malý počet pacientov a chýbajúce dáta z porovnávacej skupiny pacientov s IBD v našej populácii.
ORCID autorů
K. Vorčáková ORCID 0000-0001-8851-2809,
M. Vorčák ORCID 0000-0002-1117-2356.
Doručené/Submitted: 12. 6. 2021
Prijaté/Accepted: 15. 7. 2021
MUDr. Karolína Vorčáková, PhD.
Dermatovenerologická klinika
JLF UK a UN Martin
Kollárova 2
036 59 Martin
Sources
1. Chen WT, Chi CC. Association of hidradenitis suppurativa with inflammatory bowel disease: a systematic review and meta-analysis. JAMA Dermatol 2019; 155 (9): 1022–1027. doi: 10.1001/jamadermatol.2019.0891.
2. Martorell A, Jfri A, Koster SB et al. Defining hidradenitis suppurativa phenotypes based on the elementary lesion pattern: results of a prospective study. J Eur Acad Dermatol Venereol 2020; 34 (65): 1309–1318. doi: 10.1111/jdv.16 183.
3. Ostlere LS, Langtry JA, Mortimer PS et al. Hidradenitis suppurativa in Crohn’s disease. Br J Dermatol 1991; 125 (4): 384–386. doi: 10.1111/j.1365-2133.1991.tb14178.x.
4. Hein R, Köster I, Bollschweiler E et al. Prevalence of inflammatory bowel disease: estimates for 2010 and trends in Germany from a large insurance-based regional cohort. Scand J Gastroenterol 2014; 49 (11): 1325–1335. doi: 10.3109/00365521.2014.962605.
5. Rubin GP, Hungin AP, Kelly PJ et al. Inflammatory bowel disease: epidemiology and management in an English general practice population. Aliment Pharmacol Ther 2000; 14 (12): 1553 – –1559. doi: 10.1046/j.1365-2036.2000.00886.x.
6. Büsch K, Ludvigsson JF, Ekström-Smedby K et al. Nationwide prevalence of inflammatory bowel disease in Sweden: a population-based register study. Aliment Pharmacol Ther 2014; 39 (1): 57–68. doi: 10.1111/apt.12528.
7. Jacobsen BA, Fallingborg J, Rasmussen HH et al. Increase in incidence and prevalence of inflammatory bowel disease in northern Denmark: a population-based study, 1978–2002. Eur J Gastroenterol Hepatol 2006; 18 (6): 601–606. doi: 10.1097/00042737-200606000-00005.
8. Deckers IE, Benhadou F, Koldijk MJ et al. Inflammatory bowel disease is associated with hidradenitis suppurativa: results from a multicenter cross-sectional study. J Am Acad Dermatol 2017; 76 (1): 49–53. doi: 10.1016/j.jaad.2016.08.031.
9. Shalom G, Freud T, Yakov GB et al. Hidradenitis suppurativa and inflammatory bowel disease: a cross-sectional study of 3,207 patients. J Invest Dermatol 2016; 136 (8): 1716–1718. doi: 10.1016/j.jid.2016.04.003.
10. Garg A, Hundal J, Strunk A. Overall and subgroup prevalence of Crohn disease among patients with hidradenitis suppurativa a population-based analysis in the United States. JAMA Dermatol 2018; 154 (7): 814–818. doi: 10.1001/jamadermatol.2018.0878.
11. Egeberg A, Jemec GB, Kimball AB et al. Prevalence and risk of inflammatory bowel disease in patients with hidradenitis suppurativa. J Invest Dermatol 2017; 137 (5): 1060–1064. doi: 10.1016/j.jid.2016.11.040.
12. Lukach AJ, Saul MI, Ferris LK et al. Risk factors for hidradenitis suppurativa in patients with inflammatory bowel disease. Dig Dis Sci 2018; 63 (3): 755–760. doi: 10.1007/s10620-018-4919-5.
13. Scheinfeld N. Diseases associated with hidranitis suppurativa: part 2 of a series on hidradenitis. Dermatol Online J 2013; 19 (6): 18558.
14. Lee M, Krishnamurthy J, Susi A et al. Association of autism spectrum disorders and inflammatory bowel disease. J Autism Dev Disord 2018; 48 (5): 1523–1529. doi: 10.1007/s10803-017-3409-5.
15. Souto-Rodríguez R, Barreiro-de-Acosta M, Domínguez-Muñoz JE. Down’s syndrome and inflammatory bowel disease: is there a real link? Rev Esp Enferm Dig 2014; 106 (3): 220–222.
16. Bernstein CN, Hitchon CA, Walld R et al. Increased burden of psychiatric disorders in inflammatory bowel disease. Inflamm Bowel Dis 2019; 25 (2): 360–368. doi: 10.1093/ibd/izy235.
17. van der Zee HH, Horvath B, Jemec GB et al. The association between hidradenitis suppurativa and Crohn’s disease: in search of the missing pathogenic link. J Invest Dermatol 2016; 136 (9): 1747–1748. doi: 10.1016/j.jid.2016.05.102.
18. Monnier L, Dohan A, Amara N et al. Anoperineal disease in Hidradenitis Suppurativa : MR imaging distinction from perianal Crohn’s disease. Eur Radiol 2017; 27 (10): 4100–4109. doi: 10.1007/s00330-017-4776-1.
19. Schlapbach C, Hänni T, Yawalkar N et al. Expression of the IL-23/Th17 pathway in lesions of hidradenitis suppurativa. J Am Acad Dermatol 2011; 65 (4): 790–798. doi: 10.1016/j.jaad.2010.07.010.
20. Duerr RH, Taylor KD, Brant SR et al. A genome-wide association study identifies IL23R as an inflammatory bowel disease gene. Science 2006; 314 (5804): 1461–1463. doi: 10.1126/ science.1135245.
21. Yang Y, Owyang C, Wu GD. East Meets West: the increasing incidence of inflammatory bowel disease in Asia as a paradigm for environmental effects on the pathogenesis of immune-mediated disease. Gastroenterology 2016; 151 (6): e1–e5. Doi: 10.1053/j.gastro.2016.10. 034.
22. Schwarz A, Bruhs A, Schwarz T. The short-chain fatty acid sodium butyrate functions as a regulator of the skin immune system. J Invest Dermatol 2017; 137 (4): 855–864. doi: 10.1016/ j.jid.2016.11.014.
23. O’Neill CA, Monteleone G, McLaughlin JT et al. The gut-skin axis in health and disease: a paradigm with therapeutic implications. Bioessays 2016; 38 (11): 1167–1176. doi: 10.1002/bies.201600008.
24. Vorčáková K, Horáková M, Péč J. Anti-TNF alpha-induced immune-mediated skin adverse reactions resolved by switching to ustekinumab. Gastroent Hepatol 2019; 73 (6): 496–500. doi: 10.14735/amgh2019496.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2021 Issue 5-
All articles in this issue
- Gastrointestinální onkologie – mezioborová spolupráce
- Gastrointestinálna onkológia
- Kvíz z klinické praxe
- Screening karcinomu pankreatu: nastal čas vykročit?
- Primárny lymfóm pankreasu – kazuistika
- Roboticky asistovaná léčba zhoubných nádorů kolorekta a hepatopankreatobiliární oblasti
- Role molekulární biologie v diferenciální diagnostice pankreatických cystických neoplazií
- Postavení miniinvazivní a robotické chirurgie v léčbě nádorů jícnu a žaludku
- Diagnostika a endoskopická intervence u raritního MALT lymfomu proximálního jejuna
- Monocentrická retrospektívna analýza asociácie hidradenitis suppurativa a chronických zápalových ochorení čreva
- Jak mohou ledviny ovlivnit léčbu pacientů s gastroenterologickými chorobami
- Komentář k doporučení Americké gastroenterologické asociace (AGA) pro léčbu středně těžké a těžké Crohnovy nemoci
- Recenze knih
- Životné jubileum prof. MUDr. Rudolfa Hyrdela, CSc
- Prof. MUDr. Marian Bátovský, CSc., MPH, 70-ročný
- Za Ivanom, kolegom, priateľom, ktorý nás učil žiť... MUDr. Ivan Bunganič (1952–2021)
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Buried karcinom
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- 7. kongres ČGS ČLS JEP 10.–12. listopadu 2021 Virtuální konference
- Videomaraton
- Tenkoihlová aspirácia pod endosonografickou kontrolou u pankreatických cystických lézií – skúsenosti z jedného centra a porovnanie s resekčnou histológiou
- Potenciál spektroskopie v diagnostice hepatocelulárního karcinomu – pilotní studie
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Screening karcinomu pankreatu: nastal čas vykročit?
- Postavení miniinvazivní a robotické chirurgie v léčbě nádorů jícnu a žaludku
- Primárny lymfóm pankreasu – kazuistika
- Role molekulární biologie v diferenciální diagnostice pankreatických cystických neoplazií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

