-
Medical journals
- Career
Neobvyklý případ dysfagie horního typu
Authors: Linter R. 1; Kubát J. 1; Mezera V. 2; Vyhnálek P. 1
Authors‘ workplace: Interní oddělení, Pardubická nemocnice2 Geriatrické centrum, Pardubická nemocnice 1
Published in: Gastroent Hepatol 2020; 74(3): 250-255
Category: Clinical and Experimental Gastroenterology: Case Report
doi: https://doi.org/10.14735/amgh2020250Overview
Inlet patch (IP) představuje ostrůvek heterotopické žaludeční sliznice nacházející se na místě mimo své fyziologické určení. Jeho původ se předpokládá v poruše embryonálního vývoje slizničních vrstev v 11. týdnu embryogeneze. IP může být lokalizován v kterékoli části trávicího traktu od dutiny ústní až po anus. Nejčastějším místem jeho výskytu je proximální jícen. Prevalence heterotopické žaludeční sliznice je v širokém rozmezí od 0,9 do 15 %. Průběh je často asymptomatický, ale v ojedinělých případech se může manifestovat jako chrapot, kašel, pocit cizího tělesa v krku, bolesti v krku apod. Patogeneze vzniku obtíží spočívá v hypersekreci žaludeční kyseliny parietálními buňkami přímo v IP se zánětlivou infiltrací, vznikem vředů, chronických striktur a v extrémních případech dochází až k maligní transformaci. Záchyt této slizniční anomálie se zakládá na kvalitně provedeném endoskopickém vyšetření s důkladným prohlédnutím proximálních částí jícnu a také s využitím možnosti moderních režimů virtuální chromoendoskopie. V kazuistice prezentujeme případ mladého muže vyšetřovaného pro chronické dysfagické a respirační obtíže. Již prvotní ORL vyšetření poukázalo na etiologii potíží v proximálním jícnu. Gastroskopicky byla zjištěna hladká, pro přístroj prostupná stenóza v terénu pro jícen atypické, lososově zbarvené sliznice. Histologicky se jednalo o heterotopickou žaludeční sliznici kardiálního typu. Pro perzistující dysfagické obtíže a recentní aspirační pneumonii bylo po vyloučení nádorového onemocnění nutné provést dilataci stenózy. Po dilataci došlo ke kompletnímu odeznění klinické symptomatologie. Kontrolní histologie potvrdila známky intestinální metaplazie, ale bez dysplastických změn. Pacient byl proto ponechán k endoskopické dispenzarizaci, prozatím bez intervence.
Klíčová slova:
heterotopická žaludeční sliznice – dysfagie – inlet patch – inhibitory protonové pumpy – benigní stenóza jícnu – peptický vřed
Úvod
Inlet patch (IP) představuje ostrůvek heterotopické žaludeční sliznice nacházející se na místě mimo své fyziologické určení. IP může být lokalizován v kterékoli části trávicího traktu od dutiny ústní až po anus. Nejčastějším místem jeho výskytu je proximální jícen [7]. Heterotopická žaludeční sliznice může být svou lokalizací příčinou dysfagických nebo respiračních potíží. K manifestaci IP dochází v 1–5 % [1,2]. Klinickou symptomatologii předurčuje velikost léze, jejich počet, lokalizace, typ sliznice a četnost parietálních (oxyntických) buněk v IP. Patogeneze vzniku obtíží spočívá v hypersekreci žaludeční kyseliny parietálními buňkami přímo v IP se zánětlivou infiltrací, vznikem vředů, chronických striktur a v extrémních případech dochází až k maligní transformaci. Potíže vznikají nejspíš refluxem takto produkované kyseliny chlorovodíkové do laryngofaryngeální oblasti, kde dochází k jejímu přímému působení [11]. Diagnóza heterotopické žaludeční sliznice v proximálním jícnu se zakládá na kvalitně provedené gastroskopii, při které nacházíme lososově zbarvený a ostře ohraničený ostrůvek oddělený od Z linie a bez souvislosti s Barrettovým jícnem. IP se v jícnu nejčastěji nachází kolem 15–21 cm od řezáků, vypadá jako sametově, růžově nebo lososově zbarvený ostrůvek oválného nebo okrouhlého tvaru s jasně definovanými okraji k perleťově zbarvené sliznici jícnu. Velikost IP je rozdílná od několika milimetrů až do několika centimetrů, stejně tak i jejich počet od samostatných po vícečetné ostrůvky IP. Někdy mohou IP zabírat až celý obvod jícnu, což pak často vede ke strikturám jícnu. V diagnostice IP máme k dispozici nejen standardní přístroje, ale také endoskopy s režimy: narrow band imaging, blue light imaging, linked colour imaging a multi light technology. Technika narrow band imaging je schopna detekovat heterotopickou žaludeční sliznici v jícnu 3× častěji než běžný endoskop [14]. Význam rutinní biopsie z heterotopické sliznice žaludku v jícnu nebyl ještě vzhledem k širokým možnostem virtuální chromoendoskopie zaveden a přesně definován. Neexistují žádné standardizované léčebné strategie v případě žaludeční heterotopie v proximálním jícnu. Asymptomatičtí pacienti s náhodným nálezem IP v jícnu nevyžadují žádnou léčbu. Pokud jsou IP příčinou různých symptomů jako kašel, pocit knedlíku v krku, bolesti v krku apod., přistupujeme k jejich terapii medikamentózně nebo endoskopicky. V případě endoskopických technik máme k dispozici argonovou plazmakoagulaci (APC – argon plasma coagulation), která je široce dostupná a efektivní, nicméně z hlavních omezení APC je potenciální riziko vzniku striktur. Další je radiofrekvenční ablace (RFA), její výhodou je kromě vysoké efektivity nízké riziko komplikací. Endoskopické techniky jako endoskopická mukózní resekce a endoskopická submukózní disekce se používají přednostně při menších slizničních lézích, aby se snížilo riziko perforace a vzniku striktur.
Prezentace případu
Pacient, 22 let, byl indikován ke gastroskopickému vyšetření pro chronické potíže s polykáním, svírání v krku po jídle, intermitentní zvracení a postprandiální suchý dráždivý kašel. Osobní anamnéza byla bez pozoruhodností, rodinná anamnéza stran onemocnění GIT rovněž negativní. Trvalou medikaci neužíval, alergická anamnéza byla pozitivní na pyly, roztoče, prach a amoxicilin. Na polykací obtíže, které se objevovaly vždy po jídle, a dráždivý kašel si intermitentně stěžoval poslední 4 roky. Pacient byl nejdříve vyšetřen na ORL oddělení pro pocit uvázlého sousta, kde bylo provedeno vyšetření polykacího aktu.
Výsledkem vyšetření bylo zaklíněné sousto v oblasti jugula se známkami aspirace kontrastní látky do dýchacích cest (obr. 1). Po intramuskulárním podání butylskopolaminu se pacientovi ulevilo. Na ORL oddělení byla provedena rigidní ezofagoskopie s nálezem naznačené hladké stenózy jícnu do 50 % lumen v 19 cm od řezáků, již bez cizího tělesa. Vzhledem k nálezu byl pacient odeslán ke gastroskopii, při které se potvrdila pro přístroj prostupná stenóza v proximálním jícnu v terénu lososově až sametově zbarvené sliznice (obr. 2). Histologicky se jednalo o fragmenty z oblasti přechodu cylindrického a dlaždicobuněčného epitelu vykazujícího lehký stupeň chronického zánětu, žlázový epitel bohatý na pohárkovité buňky s hyperplastickými foveolami bez známek intestinální metaplazie. V distální části jícnu byla zjištěna refluxní ezofagitida LA A, histologicky bez známek Barrettova jícnu, a dále již normální nález na žaludku a duodenu. Pacientovi byla doporučena kašovitá šetřicí dieta a inhibitory protonové pumpy (PPI) 2× denně. K vyloučení submukózně se šířící neoplazie nebo neoplazie v hrudníku s kompresí jícnu bylo doplněno CT krku a hrudníku, na kterém nebyla popsána žádná patologie na jícnu ani v jeho blízkém okolí. Vedlejším nálezem bylo solitární ložisko plic vpravo v segmentu S10 dorzálně velkosti 25 mm (obr. 3). Pneumolog provedl bronchoskopii s nálezem pravostranné bronchopneumonie se zvýšenou purulentní sekrecí. Mikrobiologicky byl v odebraném aspirátě prokázán Streptococcus pneumoniae, následně pacient přeléčen klaritromycinem 2× denně 500 mg per os po dobu 14 dní s postupným odezněním respiračních potíží. Navzdory užívání PPI v terapeutické dávce dysfagické obtíže přetrvávaly. Při kontrolní gastroskopii po třech týdnech přetrvávala v 19 cm od řezáků v terénu cirkulárního a rozsáhlého IP stenóza jícnu. Přestože byla pro endoskop volně průchozí (obr. 4), provedli jsme dilataci bužiemi do 45 F s odběrem kontrolních biopsií. Histologické vyšetření verifikovalo částečky heterotopické žaludeční sliznice kardiálního typu se známkami intestinální metaplazie, dysplastické změny nebyly prokázány (obr. 5). Vzhledem k zachycené intestinální metaplazii, ale bez dysplastických změn byl pacient zařazen do endoskopické dispenzarizace. Při další kontrole v naší poradně již pacient neudával dysfagii, regurgitaci stravy ani dráždivý kašel. Po 8 týdnech bylo provedeno kontrolní CT hrudníku, kde došlo k významné regresi plicního infiltrátu v segmentu S10 vpravo dorzobazálně, zbylo pouze reziduum velikosti 11 × 8 mm. Aktuálně je pacient zcela bez potíží, léčba PPI byla ukončena 8 týdnů po dilataci.
Image 1. RTG snímek zaklíněného sousta v oblasti jugula se známkami aspirace kontrastní látky.
Fig. 1. X-ray picture of food stuck in jugular area with signs of contrast aspiration.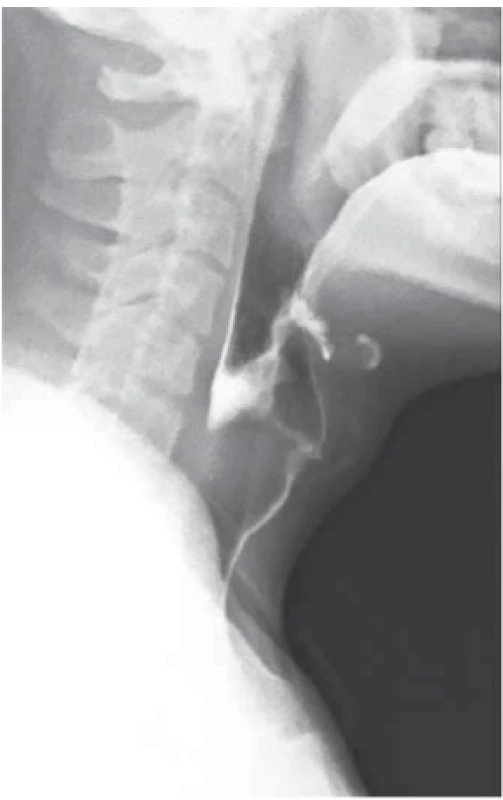
Image 2. Stenóza v proximálním jícnu v terénu atypické sliznice.
Fig. 2. Stenosis in the proximal esophagus in the field of atypical mucosa.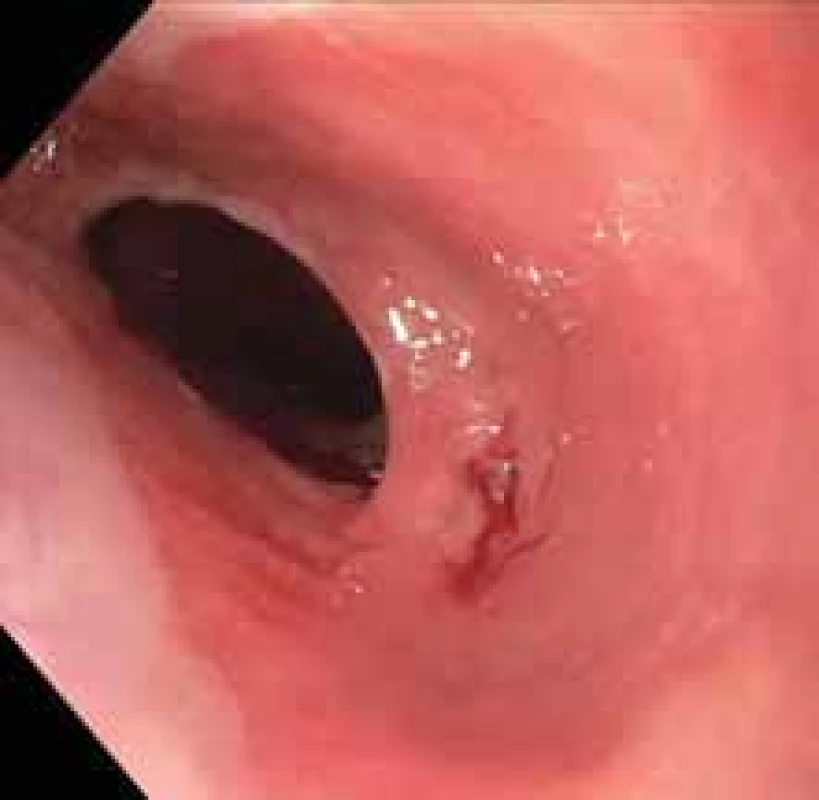
Image 3. Solitární ložisko plic.
Fig. 3. Solitary lung focus.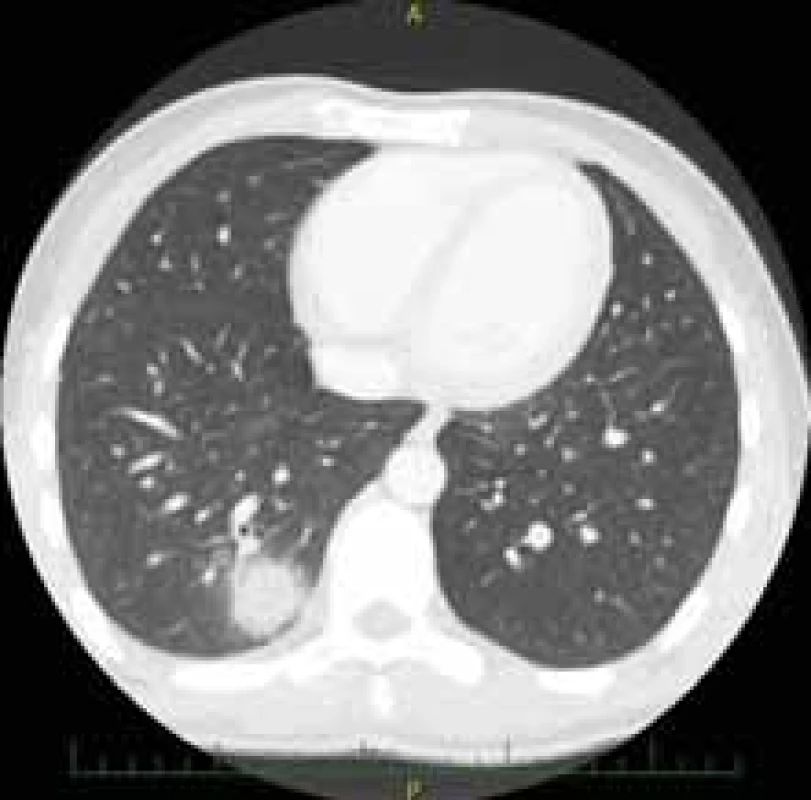
Image 4. Inlet patch.
Fig. 4. Inlet patch.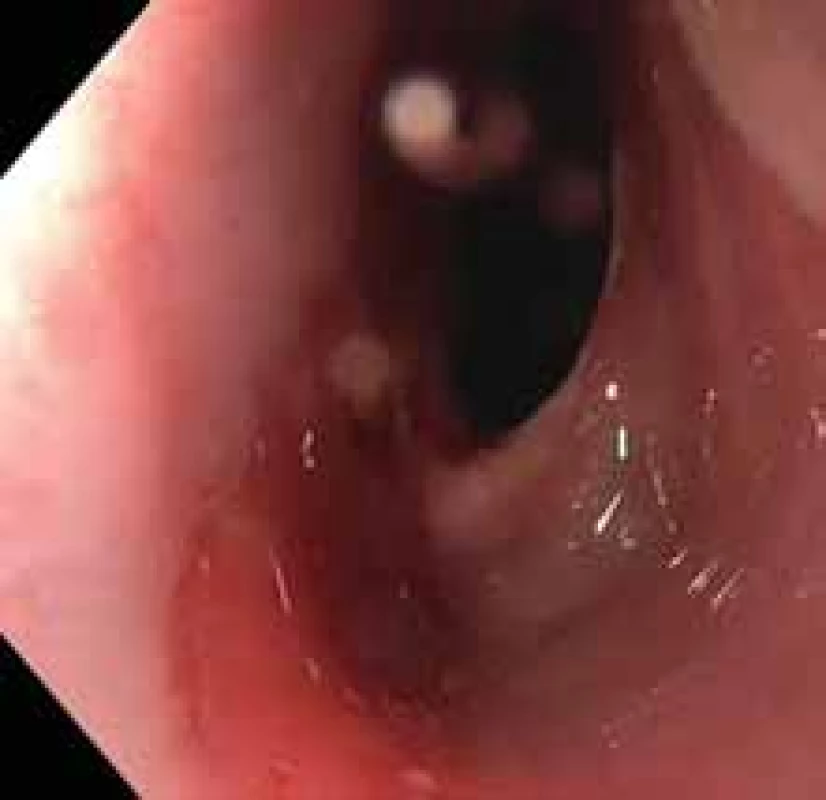
Image 5. Přechod dlaždicobuněčného epitelu jícnu a žlázového epitelu žaludku se známkami intestinální metaplasie, barvení alciánovou modří.
Fig. 5. Transition of squamous epithelium of esophagus and glandular epithelium of stomach with signs of intestinal metaplasia, staining with alcian blue.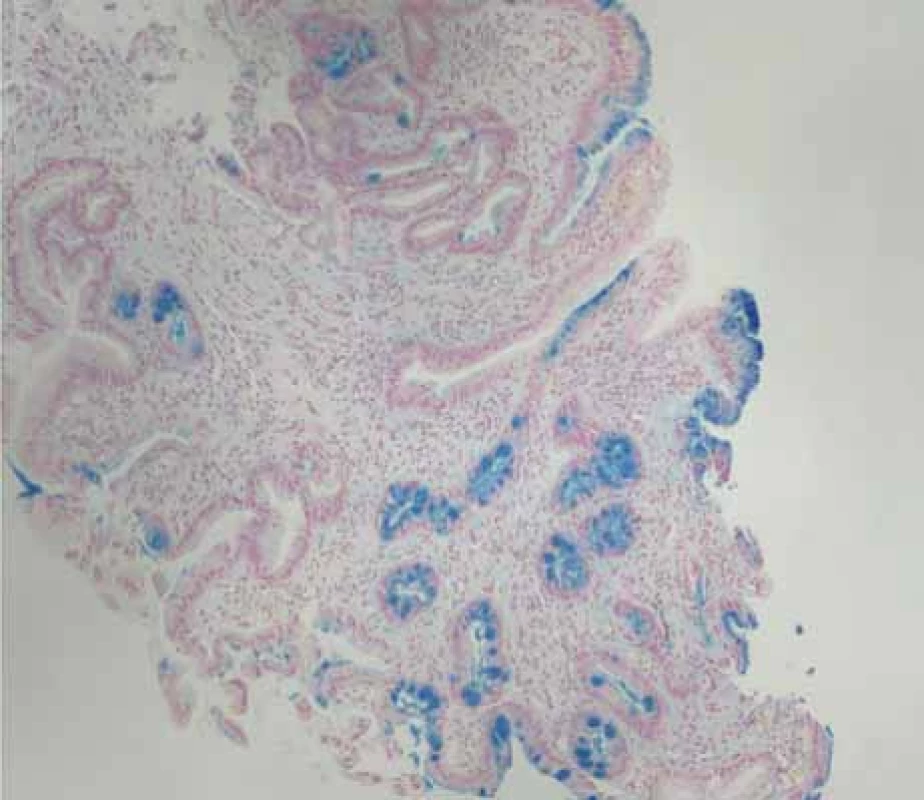
Diskuze
Heterotopická sliznice žaludku v jícnu neboli IP může být náhodným endoskopickým nálezem při vyšetření horního GIT. Studie uvádějí různý výskyt IP v proximálním jícnu. Největší pitevní studie 1 000 pitevních protokolů dětí uvádí prevalenci heterotopické žaludeční sliznice u 4,5 % [1], jiné studie uvádějí prevalenci 0,03–5,9 % u dětí [2]. Schridde zjistil, že jsou přítomna mikroskopická ložiska v proximálním jícnu až u 70 % pitev. Předpokládal rovnoměrný výskyt v jednotlivých věkových kategoriích a stejný výskyt u obou pohlaví [3], další studie však popisují větší výskyt u mužů [4]. Prevalence IP v proximálním jícnu (CIP – cervical inlet patch) se pohybuje mezi 0,1 a 15 %. Identifikace žaludeční heterotopie v proximálním jícnu koreluje s povědomím a zkušeností endoskopisty, kdy jedna ze studií demonstruje snížení záchytu IP z 2,27 na 0,29 % u endoskopisty, který výkon prováděl jako běžný, bez předem určených cílů [5]. Další tři studie potvrzují, že při transnazálně provedené ezofagogastroduodenoskopii u 800 pacientů na klinikách ORL byl záchyt žaludeční slizniční léze nulový, což poukazuje, že prevalence IP je v současnosti podceňována [6].
Patogeneze IP není přesně známá. Mnoho hypotéz předpokládá embryonální původ při nedostatečné transformaci cylindrického epitelu v dlaždicobuněčný v průběhu vývoje. Nejpravděpodobnější teorie uvádí, že v 11. týdnu embryonálního vývoje nahrazuje dlaždicobunečný epitel původní cylindrický. Začátek transformace je v prostředním jícnu a šíří se do obou směrů – proximálně i distálně. Proximální část jícnu je poslední oblastí transformace, což může vysvětlovat výskyt heterotopické žaludeční sliznice právě v tomto okrsku [7]. Imunohistochemické vyšetření potvrzuje, že IP obsahuje glukagon pozitivní buňky, které nejsou přítomny ve zralém žaludku, jsou zachyceny jen v průběhu embryonálního vývoje [8]. Méně pravděpodobná teorie předpokládá rupturu uzavřené jícnové cysty, která vede ke vzniku retenční cysty s jejich následnou transformací v cylindrický epitel a vznik heterotopické žaludeční sliznice [9]. Třetí teorie uvádí vliv chronického dráždění žaludeční kyselinou s následnou metaplastickou transformací dlaždicobuněčného epitelu v okrsek cylindrické sliznice [10]. Nejčastější histologický subtyp je fundická sliznice (cylindrická sliznice bohatá na oxyntické a hlavní buňky), dále kardiální a smíšený typ. Mezi komplikace IP patří slizniční prstence až striktury s následným uváznutím sousta nebo vředy, které se mohou projevit krvácením, bolestí v krku nebo projevy imitujícími pálení žáhy typickými při GERD. Dále mohou vést až k perforaci jícnu nebo vzniku tracheoezofageální fistule až k narušení funkce hlasivek. Předpokládá se, že tyto komplikace jsou projevem hypersekrece žaludeční kyseliny parietálními buňkami v ektopické žaludeční sliznici proximálního jícnu [27]. V takových případech jsou histologicky přítomny plazmatické buňky, granulocyty, histiocyty a jiné buňky svědčící pro zánětlivý infiltrát. Ve velice vzácných případech jsou přítomny známky atrofie, dysplazie, metaplazie až adenokarcinomu. V jedné retrospektivní studii, která zahrnovala endoskopie u 487 229 pacientů, hodnotili Neumann et al prevalenci laryngofaryngeálního refluxu mezi pacienty s heterotopickou žaludeční sliznicí a bez ní v proximálním jícnu. Ukázalo se, že odynofagie, dysfagie, chrapot a jiné respirační příznaky byly častější u pacientu s IP než u běžné populace. Neuman et al také zaznamenali přímou souvislost mezi velikostí slizniční léze a intenzitou příznaků, což dávali do souvislosti s velikostí plochy, která kyselinu produkuje [11]. Jiní autoři popisují častější výskyt chronického kašle u pacientů s většími ostrůvky IP, naproti tomu menší ostrůvky způsobují bolesti v krku [12]. Ve studii s 173 809 subjektů s biopsií jícnu autoři Lujan et al zjistili, že je významné spojení mezi endoskopickým podezřením na IP a jeho histopatologickým potvrzením (pozitivní prediktivní hodnota 0,53) [13]. Také na základě výše uvedené studie lze říct, že pokud je endoskopické podezření na IP v tak signifikantní míře histopatologicky verifikované, pak by rutinní biopsie z IP nemusela být součástí diagnostického procesu. V diagnostice IP máme k dispozici nejen standardní přístroje, ale také virtuální endoskopy s narrow band imaging a jiné chromoendoskopie. Narrow band imaging dokazuje svou vysokou citlivost v detekci malých ostrůvku IP v prospektivní studii 99 pacientů s IP (54 vs. 17 % při nativní endoskopii) [14]. V důsledku heterotopické sekrece žaludeční kyseliny a poklesu pH v lumen jícnu dochází k narušení funkce a koordinace podélné a cirkulární svaloviny jícnu. Rosztóczy et al nachází signifikantně nižší hodnoty tlaku v dolním ezofageálním svěrači s delší dobou relaxace, zatímco se ve střední částí jícnu zvýšil počet současně probíhajících kontrakcí s poklesem amplitudy peristaltických vln [15]. Korkut et al také zaznamenali u pacientů s IP v jícnu známky motorické dysfunkce, které mohou přispívat ke klinické manifestaci [16]. Asociace mezi heterotopickou žaludeční sliznicí a Barrettovým jícnem se zkoumala v mnoha studiích s protichůdnými výsledky. Čtyři studie poukázaly na spojitost mezi IP a Barrettovým jícnem, přičemž dalších sedm studií asociaci nenalezlo. Avidan et al potvrdili v kontrolované studii (53 pacientů s IP a 4 882 kontrolních subjektů), že výskyt Barrettova jícnu u pacientů s IP je 4× častější než v kontrolní skupině bez IP (34 vs. 9 %) [17]. Tato skutečnost vede k teorii o možné asociaci heterotopické žaludeční sliznice a Barrettova jícnu, kdy nekompletní vývoj dlaždicobuněčné sliznice zanechává v jednotlivých částech jícnu izolované žaludeční buňky nebo jejich ostrůvky.
Obecně je známo, že CIP není prekanceróza. Někteří autoři tvrdí, že nízký maligní potenciál IP ve srovnání s Barrettovým jícnem nepředurčuje danou lézi do skupiny prekanceróz. Na druhé straně prevalence adenokarcinomů přímo z heterotopické žaludeční sliznice jícnu je udávaná od 0,1 do 1,5 %, což vyvolává pochybnosti o správnosti zařazení IP mimo skupinu prekanceróz. Střevní metaplazie byly často hlášeny ve spojitosti s adenokarcinomem jícnu v IP, dysplazie byla jen raritně [18]. Wojciech et al ve své studii potvrdili, že běžná endoskopie v kombinaci s histopatologickým a mikrobiologickým vyšetřením je díky své citlivosti, bezpečnosti a specificitě metodou volby k vyhodnocení metaplastických a nemetaplastických změn v heterotopické žaludeční sliznici [18]. Jedna ze studií zjistila, že imunohistochemické barvení adenokarcinomu v IP mělo stejnou charakteristiku jako barvení v Barrettově metaplazii, tedy CK7 pozitivní a CK20 negativní barvení. Z toho vyvodili závěry, že IP a Barrettův jícen mohou mít společnou patogenezi. Přestože IP může být vrozený stav, expozice kyselinám přímo z parietálních buněk v IP nebo kyselině regurgitované ze žaludku k IP může vést k sekundárním zánětlivým změnám v IP, které jsou právě typické pro Barrettův jícen [19].
Cervikální IP může být kolonizována bakterií Helicobacter pylori s prevalencí až 82 %, ovšem při současné antrální kolonizaci [20]. Vysoká prevalence v IP byla dána do souvislosti s vysokým výskytem H. pylori v žaludeční sliznici. H. pylori je přenášen perorální cestou, proto se předpokládá, že kolonizace IP v proximálním jícnu je náchylnější ke kolonizaci vzhledem k jeho umístnění. Další způsob, jakým ke kolonizaci IP může docházet, je gastroezofageální reflux s přesunem H. pylori z antra do proximálních částí jícnu [20]. H. pylori kolonizující IP může vést k pocitu knedlíku v krku. Mechanizmus vzniku není znám, předpokládá se vliv hypersekrece kyseliny vlivem kolonizace nebo zánětlivá celulizace v submukóze. Podle Borhan-Manesh et al a Guttierez et al neexistuje korelace mezi pozitivitou H. pylori a zánětem v IP [20,21].
Von Rahden et al vytvořili klinicko-patologický systém hodnocení heterotopické sliznice žaludku v jícnu [22]. Většina okrsků heterotopické žaludeční sliznice jícnu (HGM – heterotopic gastric mucosa) je asymptomatická (HGM I). Jedinci s dyspeptickými nebo respiračními obtížemi, ale bez makroskopických změn v místě IP, jsou pak klasifikováni jako HGM II. Menší skupinu tvoří pacienti, kteří jsou symptomatičtí a také mají při endoskopickém vyšetření morfologické změny (stenóza, zánět, eroze až vřed) v místě IP – HGM III. Pokud se v místě IP objeví změny, které dle histologické verifikace vykazují známky malignity, pak mluvíme o skupině HGM IV (intraepiteliální neoplazie) nebo HGM V (adenokarcinom) (tab. 1). Danou klasifikaci vytvořili Von Rahden et al ještě v roce 2004, ale nebyla kromě pár kazuistik v klinické praxi akceptována.
Table 1. Klinicko-patologický systém hodnocení heterotopické sliznice žaludku v jícnu, od von Rahden et al [22].
Tab. 1. Clinical-pathological system of evaluation of heterotopic gastric mucosa in esophagus, by von Rahden et al [22].![Klinicko-patologický systém hodnocení heterotopické sliznice
žaludku v jícnu, od von Rahden et al [22].<br>
Tab. 1. Clinical-pathological system of evaluation of heterotopic gastric mucosa
in esophagus, by von Rahden et al [22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6c3acc13c9e801d7ff16b4de46109517.png)
HGM – heterotopická žaludeční sliznice Neexistují žádné standardizované léčebné strategie v případě IP. Pokud jsou IP příčinou různých symptomů, přistupujeme k jejich terapii. Může se jednat o léčbu farmakologickou (prokinetika, PPI, antacida), endoskopickou nebo chirurgickou. Samotná léčba PPI může redukovat symptomy. Meining et al jako první demonstrovali pozitivní vliv argonové plazmakoagulace (APC) v léčbě IP u pacienta s pocitem knedlíku v krku, kdy došlo k odeznění příznaků s dobou sledování 2 měsíce [9]. V randomizované kontrolované studii pak tito autoři potvrdili, že u 82 % pacientů léčených APC se signifikantně snížily dysfagické obtíže a v 90 % došlo k endoskopickému zhojení sliznice. V období 27 měsíců dispenzarizace se potvrdila APC jako úspěšná léčebná modalita až u 74 % subjektů [23]. V dalších šesti metaanalytických studiích se hodnotila APC jako účinná ve více než 80 % případů, přičemž délka sledování byla 1–36 měsíců. Endoskopická mukózní resekce byla popsána u jednoho pacienta s high dysplasií a u 6 pacientů se superficiálním adenokarcinomem vycházejícím z IP. U sledovaných pacientů nebyly žádné známky recidivy ve 12. a 31. měsíci po výkonu [24]. Radiofrekvenční ablace je metoda používaná v terapii symptomatických IP, její výhodou kromě vysoké účinnosti je nízké riziko komplikací. Dunn et al hodnotili ve své pilotní prospektivní studii zahrnující 10 pacientů se symptomatickým IP využití RFA. Jednalo se o pacienty s histologicky verifikovaným IP, s chronickými projevy. Průměrný počet IP byl dva a průměrná plocha lézí 2 cm2. Průměrně po dvou sezeních RFA dosáhlo 80 % pacientů úplného endoskopického a histologického vyhojení a zbytek měl ve více než 90 % lokální slizniční zlepšení. Klinické potíže výrazně ustoupily a stabilizovaly se v průběhu 15 měsíců sledování, kdy také nebyly zaznamenané žádné komplikace [25].
Důležité je hodnotit nejen přítomnost heterotopické sliznice žaludku v jícnu, ale také další rizikové faktory, které by se mohly spolupodílet na vzniku nebo progresi dané morfologie. Kouření a alkohol byly hodnoceny jako možné rizikové faktory vzniku IP. Ve studii autorů Govanni et al byl hodnocen vliv kouření jako rizikového faktoru na vznik IP v mužské populaci. Pacienti s IP byli v průběhu života více exponováni kouření než skupina pacientů bez IP. Byla zjištěna nejen příčinná souvislost kouření s IP, ale také že s narůstající intenzitou kouření lineárně stoupá riziko vzniku IP. Autoři dále zjistili, že bývalí kuřáci měli nižší výskyt IP než pacienti aktivně kouřící a také že bývalí kuřáci po 10 letech měli stejnou prevalenci IP jako nekuřáci. Průměrná konzumace alkoholu nebyla ve studii spojována s vyšším výskytem IP [26].
Závěrem bychom chtěli zdůraznit roli ezofagogastroduodenoskopie v algoritmu vyšetřování dysfagie. I pro IP platí, že kdo hledá, najde. Kromě diagnózy umožňuje endoskopie rovněž účinnou léčbu, a to odstranění léze či řešení již vzniklých komplikací. Léčba pak vede k výraznému zlepšení kvality života pacienta. Do budoucna se nabízí otázka, zda po IP aktivně pátrat u asymptomatických jedinců vyšetřovaných endoskopicky z jiné indikace.
Doručeno/Submitted: 31. 1. 2020
Přijato/Accepted: 1. 3. 2020
MUDr. Róbert Linter
Interní oddělení, Pardubická nemocnice
Kyjevská 44
532 03 Pardubice
Sources
1. Rector LE, Connerley ML. Aberrant mucosa in esophagus in infants and in children. Arch Pathol 1941; 31 : 285.
2. Georges A, Coopman S, Rebeuh J et al. Inlet patch: clinical presentation and outcome in children. J Pediatr Gastroenterol Nutr 2011; 52 (4): 419–423. doi: 10.1097/MPG.0b013e3181f2a913.
3. Schridde H. Über Magenschleimhaut-Inseln vom Bau der Cardialdrüsenzone und Fundusdrüsenregion und den unteren, oesophagealen Cardialdrüsen gleichende Drüsen im obersten Oesophagusabschnitt. Virchows Arch Pathol Anat Physiol Klin Med 1904; 175 : 1–16.
4. Sakitani K, Toyoshima O, Watanabe H. Mo1823 prevalence of heterotopic gastric mucosa in the cervical esophagus and its pathological characteristics. Gastroenterology 2014; 146 (5): S662–S663. doi: 10.1016/S0016-5085 (14) 62414-8.
5. Maconi G, Pace F, Vago L et al. Prevalence and clinical features of heterotopic gastric mucosa in the upper oesophagus (inlet patch). Eur J Gastroenterol Hepatol 2000; 12 (7): 745–749.
6. Tong MC, Gao H, Lin JS et al. One-stop evaluation of globus pharyngeus symptoms with transnasal esophagoscopy and swallowing function test. J Otolaryngol Head Neck Surg 2012; 41 (1): 46–50.
7. Chong VH. Clinical significance of heterotopic gastric mucosal patch of the proximal esophagus. World J Gastroenterol 2013; 19 (3): 331–338. doi: 10.3748/wjg.v19.i3.331.
8. Feurle GE, Helmstaedter V, Buehring A et al. Distinct immunohistochemical findings in columnar epithelium of esophageal inlet patch and of Barrett‘s esophagus. Dig Dis Sci 1990; 35 (1): 86–92. doi: 10.1007/BF01537228.
9. Meining A, Bajbouj M. Erupted cysts in the cervical esophagus result in gastric inlet patches. Gastrointest Endosc 2010; 72 (3): 603–605. doi: 10.1016/j.gie.2010.05.008.
10. Alagozlu H, Simsek Z, Unal S et al. Is there an association between Helicobacter pylori in the inlet patch and globus sensation? World J Gastroenterol 2010; 16 (1): 42–47. doi: 10.3748/wjg.v16.i1.42.
11. Neumann WL, Luján GM, Genta RM. Gastric heterotopia in the proximal oesophagus („inlet patch“): Association with adenocarcinomas arising in Barrett mucosa. Dig Liver Dis 2012; 44 (4): 292–296. doi: 10.1016/j.dld.2011.11.008.
12. Chong VH, Jalihal A. Heterotopic gastric mucosal patch of the esophagus is associated with higher prevalence of laryngopharyngeal reflux symptoms. Eur Arch Otorhinolaryngol 2010; 267 (11): 1793–1799. doi: 10.1007/s00405-010-1259-2.
13. Lujan G, Genta R. The inlet patch revisited: a clinicopathologic study of 569 patients with heterotopic gastric mucosa in the proximal esophagus. Am J Gastroenterol 2010; 105 : 0002–9270.
14. Cheng CL, Lin CH, Liu NJ et al. Endoscopic diagnosis of cervical esophageal heterotopic gastric mucosa with conventional and narrow-band images. World J Gastroenterol 2014; 20 (1): 242–249. doi: 10.3748/wjg.v20.i1.242.
15. Rosztóczy A, Izbéki F, Németh IB et al. Detailed esophageal function and morphological analysis shows high prevalence of gastroesophageal reflux disease and Barrett‘s esophagus in patients with cervical inlet patch. Dis Esophagus 2012; 25 (6): 498 – 504. doi: 10.1111/j.1442-2050.2011.01281.x. 16 Korkut E, Bektaş M, Alkan M et al. Esophageal motility and 24-h pH profiles of patients with heterotopic gastric mucosa in the cervical esophagus. Eur J Intern Med 2010; 21 (1): 21–24. doi: 10.1016/j.ejim.2009.10.009.
17. Avidan B, Sonnenberg A, Chejfec G et al. Is there a link between cervical inlet patch and Barrett‘s esophagus? Gastrointest Endosc 2001; 53 (7): 717–721. doi: 10.1067/mge.2001.114782.
18. Wojciech Latos et al. Clinical evaluation of twenty cases of heterotopic gastric mucosa of upper esophagus during five-year observation, using gastroscopy in combination with histopathological and microbiological analysis of biopsies. Wspolczesna Onkol 2013; 17 (2): 171–175. doi: 10.5114/wo.2013.34376.
19. Georgina E. Riddiough et al. Gastric adenocarinoma of the upper oesophagus: A literature review and case report. Int J Surg Case Rep 2017; 30 : 205–214. doi: 10.1016/j.ijscr.2016.11.014.
20. Gutierrez O, Akamatsu T, Cardona H et al. Helicobacter pylori and hetertopic gastric mucosa in the upper esophagus (the inlet patch). Am J Gastroenterol 2003; 98 (6): 1266–1270. doi: 10.1111/j.1572-0241.2003.07488.x.
21. Borhan-Manesh F, Farnum JB. Study of Helicobacter pylori colonisation of patches of heterotopic gastric mucosa (HGM) at the upper esophagus. Dig Dis Sci 1993; 38 (1): 142–146. doi: 10.1007/BF01296787.
22. Von Rahden BH, Stein HJ, Becker K et al. Heterotopic gastric mucosa of the esophagus: literature-review and proposal of a clinico-pathologic classification. Am J Gastroenterol 2004; 99 (3): 543–551. doi: 10.1111/j.1572-0241.2004.04082.x.
23. Bajbouj M, Becker V, Eckel F et al. Argon plasma coagulation of cervical heterotopic gastric mucosa as an alternative treatment for globus sensations. Gastroenterology 2009; 137 (2): 440–444. doi: 10.1053/j.gastro.2009.04.053.
24. Kadota T, Fujii S, Oono Y et al. Adenocarcinoma arising from heterotopic gastric mucosa in the cervical esophagus and upper thoracic esophagus: two case reports and literature review. Expert Rev Gastroenterol Hepatol 2016; 10 (3): 405–414. doi: 10.1586/17474124.2016.1125780.
25. Dunn JM, Sui G, Anggiansah A et al. Radiofrequency ablation of symptomatic cervical inlet patch using a through-the-scope device: a pilot study. Gastrointest Endosc 2016; 84 (6): 1022–1026. doi: 10.1016/j.gie.2016.06.037.
26. Govani SM, Metko V, Rubenstein JH. Prevalence and risk factors for heterotopic gastric mucosa of the upper esophagus among men undergoing routine screening colonoscopy. Dis Esophagus 2015; 28 (5): 442–447. doi: 10.1111/dote.12221.
27. Guider J, Scott L. Esophageal Rings and Stricture Related to a Circumferential Inlet Patch. ACG Case Rep J 2016; 3 (4): e124. doi: 10.14309/crj.2016.97.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2020 Issue 3-
All articles in this issue
- Editorial
- Kvíz z klinické praxe
- Vliv pandemie COVID-19 na endoskopickou praxi v České republice – dotazníková studie
- Syndrom odpojeného pankreatického vývodu – opomíjená komplikace akutní pankreatitidy
- Motorizovaná spirální enteroskopie – naše první zkušenosti
- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- Projekt „Endoskopická centra“v České republice
- Aktuální vědecké podklady pro dietu pro Crohnovu chorobu založenou na vyloučení konkrétních potravin (CDED)
- Budesonid MMX v léčbě ulcerózní kolitidy
- Neobvyklý případ dysfagie horního typu
- Renální onemocnění pacientů s idiopatickými střevními záněty
- Na památku doc. Jana Kotrlíka
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz: Ischemická kolitida na podkladě trombózy dolní mezenterické žíly
- Perioperační ezofagogastroduodenoskopie v prevenci a terapii anastomotických komplikací – přehledový článek
- Herpetická ezofagitida u imunokompetentního sedmiletého pacienta
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Neobvyklý případ dysfagie horního typu
- Motorizovaná spirální enteroskopie – naše první zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

