-
Medical journals
- Career
Cytomegalovirová infekce a játra
: K. Chmelová; S. Fraňková; J. Šperl
: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha
: Gastroent Hepatol 2017; 71(6): 517-523
: Hepatology: Review article
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2017517Cytomegalovirus (CMV) je DNA virus patřící do čeledi Herpesviridae a podčeledi Betaherpesviridae. Stejně jako další herpesviry má po primoinfekci schopnost v organizmu perzistovat v latentní formě. Séroprevalence CMV u dospělých se celosvětově významně liší, negativně koreluje se socioekonomickým stavem a pohybuje se od 40 % v zemích západní Evropy až po více než 90 % v rozvojových zemích. Séroprevalence se zvyšuje s věkem. CMV se přenáší tělesnými tekutinami, pohlavním stykem nebo transplantovaným orgánem. CMV je schopen replikace v řadě buněk vč. hepatocytů, v myeloidních buňkách kostní dřeně se pak udržuje latentní infekce schopná reaktivace při imunosupresi. CMV primoinfekce u imunokompetentních osob má většinou asymptomatický průběh, ale u imunokompromitovaných jedinců může primoinfekce i reaktivace probíhat jako život ohrožující CMV nemoc. Klinická manifestace CMV infekce kolísá od asymptomatické viremie (CMV infekce v užším slova smyslu) přes CMV nemoc typu nespecifického virového syndromu až po CMV nemoc s orgánovým postižením, kterým může být CMV hepatitida, kolitida, pneumonie apod. CMV infekce, resp. nemoc představuje závažnou a život ohrožující komplikaci zejména u pacientů po orgánových transplantacích a u pacientů s HIV infekcí. Incidence CMV hepatitidy v 1. roce po transplantaci jater dosahuje až 20 %. Profylaxe i protivirová léčba CMV infekce jsou vysoce důležitým bodem v péči o imunosuprimované pacienty. Naopak u imunokompetentních pacientů představuje CMV hepatitida jen asi 1 % příčin zvýšení jaterních enzymů. Roční incidence CMV hepatitidy je odhadována na 4 případy na 100 000 obyvatel, postihuje osoby středního věku a má obvykle mírný průběh a nevyžaduje protivirovou léčbu, fulminantní průběh je raritní. CMV infekce nepatří mezi příčiny chronických hepatitid. Vyšetření protilátek proti CMV či CMV DNA nepatří do 1. linie diferenciální diagnostiky zvýšení jaterních enzymů. Na CMV hepatitidu je nutno pomýšlet při neobjasněném zvýšení jaterních enzymů provázeném virovým syndromem zejména u osob středního věku.
Klíčová slova:
cytomegalovirus – hepatitida – séroprevalence – incidence – léčba – riziko – imunosupreseÚvod
Cytomegalovirus (CMV) je DNA virus patřící do čeledi Herpesviridae a podčeledi Betaherpesviridae. Stejně jako ostatní herpesviry (např. Herpes simplex virus – HSV-1, HSV-2, virus Epstein-Barrové – EBV) má po primoinfekci schopnost perzistovat v latentní formě. Séroprevalence CMV u dospělých se celosvětově významně liší, negativně koreluje se socioekonomickým statusem a pohybuje se od 40 % v zemích západní Evropy až po více než 90 % v Africe, Asii a Jižní Americe (tab. 1) [1]. Séroprevalence se zvyšuje s věkem a onemocnění je o něco častější u žen. Rozdíl je patrný také v jednotlivých rasách, u Afroameričanů a Asiatů je séroprevalence o 20–30 % vyšší [2]. K přenosu onemocnění dochází pomocí přímého kontaktu s tělními tekutinami, jako jsou sliny, moč nebo mateřské mléko, dále krevní cestou, pohlavním stykem nebo transplantovaným orgánem [3]. CMV infikuje a je schopen replikace v širokém spektru buněk, jako jsou fibroblasty, makrofágy, dendritické buňky, hepatocyty, buňky cévního endotelu nebo buňky slizničního epitelu, což umožňuje snadný přenos infekce [4]. V mononukleárních leukocytech a myeloidních buňkách kostní dřeně potom vede k latentní infekci, která je schopna reaktivace i u zdravých jedinců, ale je obvykle rychle potlačena robustní imunitní odpovědí zprostředkovanou zejména CMV specifickými CD8+ lymfocyty [5,6]. Primoinfekce CMV u imunokompetentních osob má obvykle asymptomatický průběh, ale u specifických skupin pacientů, jako jsou novorozenci nebo imunokompromitovaní jedinci, může představovat život ohrožující onemocnění.
1. Séroprevalence anti-CMV IgG protilátek v jednotlivých zemích. Tab. 1. Seroprevalence of anti-CMV IgG antibodies in bellow-listed countries. 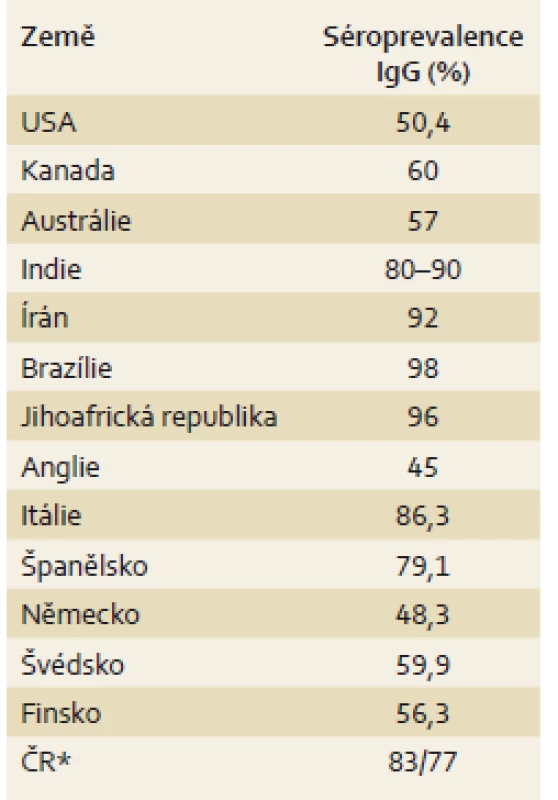
CMV – cytomegalovirus Národní studie byly prováděné u těhotných žen nebo u žen v reprodukčním věku mezi 12. a 49. rokem věku. *V ČR nebyla obdobná studie provedena, byla použita data ze skupiny příjemců po transplantaci jater/dárců orgánů v IKEM mezi roky 1995 - 2016. Přirozený průběh
Primoinfekce, definovaná jako replikace viru nebo pozitivita CMV IgM protilátek u doposud IgG séronegativních pacientů, nastává okolo 33. roku života, tj. později než primoinfekce způsobená EBV. K rozvoji symptomů dochází obvykle mezi 9. a 60. dnem po přenosu viru. Kromě příznaků podobných mononukleóze, jako je tonzilitida, myelosuprese, febrilie, dochází u téměř 70 % symptomatických pacientů k elevaci aminotransferáz [7], podle jiných studií u 30–90 % [8,9]. Postižení jiných orgánů je méně časté a může zahrnovat onemocnění gastrointestinálního traktu, nejčastěji CMV kolitidu u pacientů s idiopatickým střevním zánětem léčeným imunosupresivy, dále pneumonii, retinitidu u HIV pozitivních osob nebo encefalitidu u pacientů po transplantaci krvetvorných kmenových buněk a u dětí. Přítomnost latentní infekce, tj. pozitivita anti-CMV IgG, není nikdy spojena s chronickým onemocněním jater ani jiného orgánu, ale představuje substrát pro možnou reaktivaci infekce. K reaktivaci latentní infekce dochází u jedinců s přítomnými IgG protilátkami, a to i u jinak zdravých osob, obvykle v období interkurentních infekcí či u kriticky nemocných [10], nejčastěji však u pacientů po orgánových transplantacích, transplantacích kostní dřeně nebo u osob se syndromem získané imunodeficience (AIDS) [11]. U pacientů s přítomnými IgG protilátkami není možné běžnými diagnostickými metodami odlišit reaktivaci onemocnění od reinfekce jiným virovým kmenem. Podle klinických projevů odlišujeme CMV infekci, tzn. záchyt viremie (CMV DNA v krvi) bez klinických projevů, a CMV nemoc, tj. průkaz viremie doprovázený nespecifickými příznaky, jako jsou febrilie, myelosuprese, bolesti svalů a kloubů (virový syndrom) nebo CMV nemoc s orgánovým postižením. Viremie v případě orgánového postižení nemusí být vždy prokazatelná. Obě klinické varianty, tj. CMV infekce i CMV nemoc, budou pro jednoduchost v dalším textu označované jako epizoda CMV infekce.
CMV infekce u imunokompetentních jedinců
U imunokompetentních jedinců je CMV primoinfekce většinou asymptomatická nebo se projevuje jako virový syndrom nebo syndrom podobný mononukleóze způsobené EBV. Dle recentní islandské studie [7], která prokázala symptomatickou CMV infekci u 118 osob ze spádové oblasti Reykjavíku z let 2006–2015, mělo 81 (69 %) symptomatických pacientů zároveň CMV hepatitidu. Mezi 81 pacienty s CMV hepatitidou bylo 14 pacientů užívajících imunosupresiva a 5 gravidních žen. Ikterus byl zaznamenán u 7 z 81 pacientů, 1 z pacientů užívajících imunosupresiva zemřel. Průměrná roční incidence CMV hepatitidy během zmíněných 10 let sledování činila 4 případy na 100 000 obyvatel, průměrná incidence EBV hepatitidy byla ve stejném období dvojnásobná. V jiné skandinávské studii bylo ovšem zjištěno, že CMV hepatitida byla příčinou elevace jen u méně než 1 % z celkového počtu 155 jedinců vyšetřovaných pro elevaci aminotransferáz [12]. CMV primoinfekce obvykle vede jen k mírnému zvýšení aktivity alaninaminotransferázy a aspartátaminotransferázy, ikterus má méně než 10 % nemocných [7,9]. Fulminantní průběh primoinfekce CMV je raritní, nicméně bylo publikováno několik případů urgentní transplantace jater pro akutní jaterní selhání při CMV nemoci u jinak zdravých osob [13,14]. Zvýšení sérové aktivity aminotransferáz může přetrvávat až 6 týdnů, protivirová léčba obvykle není nutná. CMV primoinfekce nepřechází do chronicity, nezpůsobuje chronickou hepatitidu a jaterní enzymy se zcela normalizují, není-li přítomno jiné jaterní onemocnění. Antivirotika byla ve výše zmíněné studii podána u 15 % CMV infekcí se závažnějším průběhem a alterací syntetické funkce jater. Jednotné doporučení pro zahájení protivirové léčby u imunokompetentních osob však není stanoveno. Ojedinělou, ale závažnou komplikací CMV hepatitidy může být trombóza portální žíly, která je vysvětlována alterací povrchu endoteliálních buněk se zvýšenou expresí adhezivních molekul [15], stimulací leukocytární a destičkové adheze [16] a zároveň navozením prokoagulačního stavu [17,18]. Na CMV hepatitidu je nutno pomýšlet i v diferenciální diagnostice granulomatózních hepatitid [19].
CMV infekce u těhotných žen a novorozenců
CMV je nejčastější příčina kongenitálních infekcí s prevalencí 0,8–1,3 %, k přenosu infekce dochází transplacentárně nebo peripartálně. Její průběh bývá asymptomatický, ale může způsobit i život ohrožující neurologické poškození novorozence. V obou případech však mají novorozenci zvýšené riziko ztráty sluchu v kojeneckém věku, CMV infekce je častou příčinou poruchy neurologického vývoje jedince [20,21]. Na CMV infekci by se u těhotných žen mělo pomýšlet v případě podezření na infekční mononukleózu nebo je-li na ultrazvuku patrná anomálie plodu typická pro CMV infekci. Diagnostika je založena výhradně na sérologickém vyšetření matky a pro primoinfekci svědčí záchyt sérokonverze IgG nebo pozitivita IgM protilátek a IgG s nízkou aviditou. Samotná detekce IgM protilátek je nespecifická, neboť může vzniknout i při reaktivaci, reinfekci, popřípadě zkříženě při infekci EBV. Užitečným markerem k určení rizika transplacentárního přenosu je avidita anti-CMV IgG. Pokud je avidita vysoká, je pravděpodobné, že k infekci došlo před více než 6 měsíci a riziko transplacentární infekce je relativně malé. Je-li naopak avidita nízká, je nutno usuzovat na recentní primoinfekci s vyšším rizikem přenosu infekce na plod [22].
U těhotných žen je v případě podezření na CMV infekci nutno odlišit primární a non-primární CMV infekci [23]. Asi 25 % CMV infekcí v těhotenství je primoinfekcí, z tohoto počtu jen asi u 3 % hrozí závažné neurologické poškození plodu [24]. Některé studie prokazují významně nižší riziko přenosu u žen, které měly dokumentovanou anti-CMV IgG pozitivitu již před těhotenstvím, tj. při reaktivaci [25–27]. Léčba CMV infekce u imunokompetentních těhotných žen je většinou pouze symptomatická. Protivirová léčba je indikována jen v závažných případech orgánového postižení, je možné užít gancyklovir či foscarnet, které vedou k časnějšímu uzdravení matky, ale nesníží riziko transplacentárního přenosu na plod. Nejčastější klinickou manifestací CMV infekce novorozence je nízká porodní váha, mikrocefalie, ventrikulomegalie, ikterus, hepatosplenomegalie, petechie. Poporodní mortalita těchto dětí je asi 5 %, příčinou je diseminovaná intravaskulární koagulace, jaterní selhání nebo bakteriální superinfekce [28]. Dalších 50–60 % nakažených dětí má trvalý neurologický deficit, nejčastěji ztrátu sluchu či zraku, méně často opožděný neurologický vývoj [29]. CMV je příčinou až 40 % cholestatických hepatitid v novorozeneckém věku při vyloučení biliární atrezie, častěji se vyskytuje u chlapců. Léčba infekce u dětí není doporučována, v závažných případech je možné užít gancyklovir intravenózně [30].
CMV infekce u pacientů po orgánových transplantacích a po transplantaci kostní dřeně
CMV hepatitida je časté orgánové postižení u pacientů po transplantaci jater, její incidence se pohybuje okolo 15–20 % [31,32]. Infekce jaterního štěpu může být jediným projevem, zatímco u ostatních orgánových transplantací bývá CMV hepatitida doprovázena virovým syndromem. K primoinfekci po transplantacích dochází nejčastěji u séronegativních pacientů (R), kteří dostali štěp od séropozitivního dárce (D). Oproti imunokompetentním jedincům má primoinfekce závažnější průběh a klinicky se projeví až v 60 % případů [33,34]. K reaktivaci dochází u séropozitivních příjemců při podání imunosupresivní léčby. U transplantovaných jedinců je peak incidence onemocnění kolem 2.–3. měsíce po transplantaci, v případě, že je podávána CMV profylaxe, může dojít k rozvoji CMV infekce s pozdním nástupem až po jejím ukončení. Rizikovými faktory pro vznik onemocnění je typ a dávka imunosuprese, epizoda akutní celulární rejekce, koinfekce jinými viry (např. lidský herpes virus – HHV-6 a HHV-7), bakteriální nebo kvasinkové infekce [35–37]. Nejrizikovější je sérostatus D+/R–, kdy potransplantačně onemocní 44–65 % jedinců, zatímco u séropozitivních příjemců (R+) je to jen 8–19 %. Nejméně riziková je skupina D–/R – s incidencí 1–2 % [38]. Ke snížení rizika rozvoje CMV infekce existují dva přístupy. Prvním je preemptivní strategie, kdy se u transplantovaného pacienta monitoruje pravidelně každé 1–2 týdny CMV viremie a protivirová profylaxe se podává pouze pacientům se záchytem viremie s cílem zabránit rozvoji CMV nemoci [39]. Druhou možností je univerzální profylaxe, která se podává ihned po transplantaci po dobu 3–6 měsíců všem pacientům. Tato strategie je častěji spojována s pozdním nástupem CMV nemoci po ukončení profylaxe, ale významně snižuje incidenci CMV nemoci v časném potransplantačním období, zejména u nejrizikovější skupiny D+/R – [40]. V prevenci CMV nemoci lze v současnosti užít několik preparátů. U méně rizikových skupin se užívá acyklovir nebo valacyklovir, zatímco u rizikové skupiny séronegativních příjemců se obvykle užívá gancyklovir nebo valgancyklovir [41]. K průkazu replikace viru se používá vyšetření CMV DNA metodou polymerázové řetězové reakce (PCR – polymerase chain reaction) z plazmy nebo plné krve, které nahradilo průkaz časného antigenu CMV (pp65). Detekce protilátek není v případě transplantovaných pacientů dostačující diagnostickou metodou.
CMV infekce u pacientů s AIDS
U pacientů s AIDS, zejména u těch, kteří mají celkový počet CD4 lymfocytů < 50/μl, je CMV infekce běžnou příčinou závažných oportunních infekcí, která výrazně zvyšuje morbiditu a mortalitu. Před zavedením antiretrovirové léčby (ART) postihovala asi 30–40 % pacientů s AIDS [42], incidence CMV infekce se po zavedení ART snížila z 23 na 8 případů na 10 000 nemocných [43] a incidence CMV retinitidy se v USA snížila o 90 % [44]. Nejčastěji postiženým orgánem je, na rozdíl od jiných skupin pacientů, retina. CMV hepatitida je raritní komplikací a jsou popisované jen jednotlivé případy. Hepatitida, podobně jako ostatní formy CMV infekce, nebývá doprovázena vzestupem teploty, je ale obvykle příznakem diseminované infekce. Laboratorně je patrna mírná elevace aminotransferáz, jen výjimečně dochází ke zvýšení bilirubinu [45]. Intravenózní protivirová léčba je v úvodu nezbytná, perorální léčba má trvat nejméně 6 měsíců nebo do vzestupu celkových CD4 lymfocytů nad 100/μl. U pacientů s počtem CD4 < 200/μl a negativními IgG CMV protilátkami se doporučuje pravidelný každoroční screening infekce. Metodou volby diagnostiky je kromě biopsie kvantitativní stanovení viremie metodou PCR, která je přesnější než průkaz pp65.
Diagnostika
V současnosti existuje několik metod detekce CMV infekce. Mezi diagnostické modality patří sérologické vyšetření, kvantitativní a kvalitativní PCR, stanovení pp65 antigenemie, kultivační a histopatologický nález.
Sérologie poskytuje nepřímý průkaz akutní nebo dříve prodělané infekce, detekují se anti-CMV protilátky v třídách IgM a IgG. K dispozici je celá škála metod, v klinických laboratořích se nejčastěji užívá enzymová imunoassay, nepřímá a antikomplementární imunofluorescenční assay. Méně dostupné jsou metody komplement fixační reakce, nepřímá hemaglutinace, imunitní adherentní hemaglutinace a neutralizační testy. CMV specifické IgM protilátky jsou detekovatelné do 2 týdnů od vzniku příznaků a mohou přetrvávat několik měsíců. IgG protilátky nastupují asi 3 týdny od počátku infekce a jejich pozitivita přetrvává doživotně [46].
Kvantitativní stanovení viremie metodou PCR je postupem volby u pacientů imunokompromitovaných. Výhodou je možnost časné detekce infekce a zároveň monitorování úspěšnosti její léčby. Kvalitativní stanovení přítomnosti CMV DNA pomocí PCR je vysoce senzitivní metoda, avšak bez možnosti odlišení vysoké a nízké viremie, což je nezbytné např. při preemptivní strategii sledování imunokompromitovaných pacientů (viz výše). Stanovení DNA se provádí z plazmy nebo z plné krve. Druhý způsob je přesnější, neboť je možno detekovat intra-i extracelulární virové partikule [47].
Stanovení pp65 proteinu představuje rychlý a přímý průkaz CMV antigenemie. Jedná se o fluorescenčně značené monoklonální protilátky specifické pro pp65 protein CMV na periferních monocytech. Semikvantitativně se hodnotí množství obarvených buněk z celkového počtu. Výsledek je dostupný do 24 hod a je dobře hodnotitelný i u HIV pozitivních jedinců a pacientů po orgánových transplantacích, limitací je snížená validita u jedinců s leukopenií [48,49].
Při podezření na CMV orgánové postižení je metodou volby biopsie. Histologický nález je založen na průkazu virových bazofilních intranukleárních inkluzí, podezření na CMV nemoc může být verifikováno imunohistochemickým barvením (obr. 1) [50].
1. CMV hepatitida. Mikroabsces tvořený shlukem neutrofilů s intranukleární virovou inkluzí (šipka). Hematoxilin-eozin, původní zvětšení 400×. Fig. 1. CMV hepatitis. Micro-abscess formed by a collection of neutrophils with intranuclear viral inclusion (arrow). Haematoxylin-eosin, original magnification ×400. 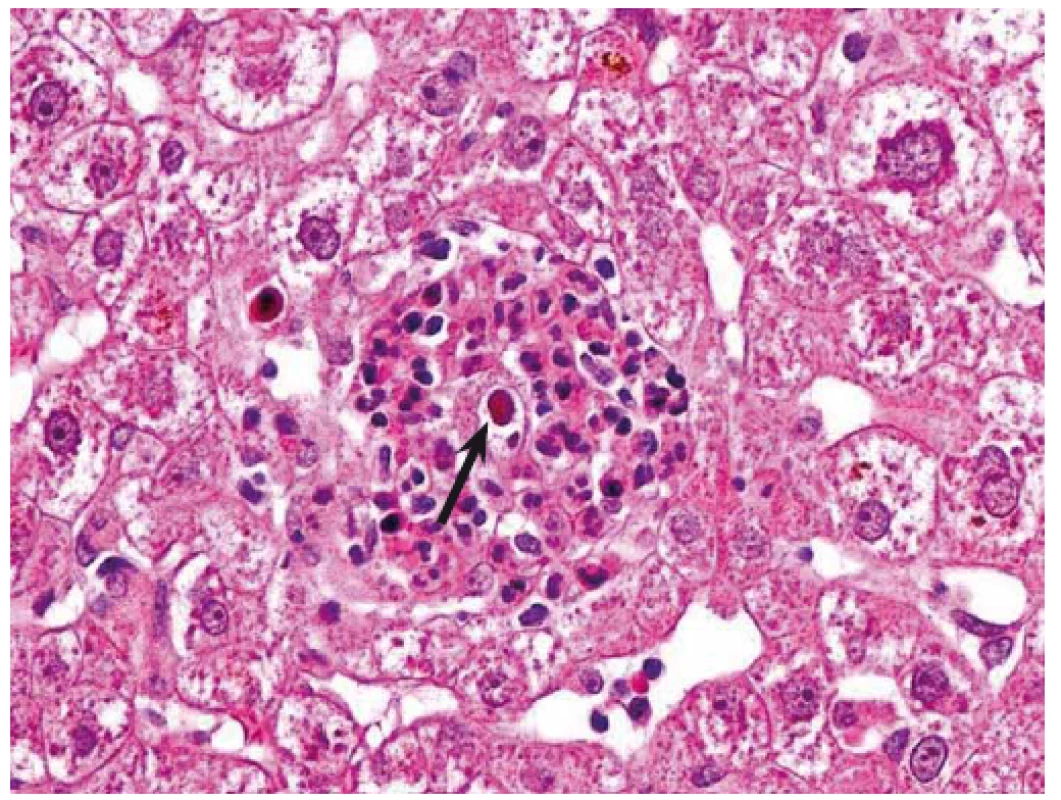
Kultivace na lidských fibroblastech má spíše marginální využití v případě nutnosti vyšetření bronchoalveolární laváže, mozkomíšního moku nebo moči.
Některé laboratoře umožňují genotypizaci viru na testování rezistencí, assaye jsou komerčně vyráběné.
Prevence a léčba
Preventivní podávání antivirotik je indikováno u pacientů po orgánových transplantacích nebo u pacientů po transplantaci kostní dřeně, léčba je potom nutná u osob s AIDS, u kriticky nemocných a u dětských pacientů se závažným průběhem CMV infekce. Dobrá dostupnost efektivní léčby přispěla významně ke snížení morbidity a mortality [51]. Léčba pacientů představuje významnou ekonomickou zátěž, proto se doporučuje u vybraných skupin podávání CMV profylaxe. V 1. linii je dostupný intravenózně podávaný gancyklovir, který může být podáván profylakticky i léčebně. Jeho nevýhodou je prodloužení hospitalizace v případě intravenózního podávání, v perorální formě má nízkou biologickou dostupnost, což může vést k nedostatečnému potlačení virové replikace a zároveň k rozvoji rezistentních forem viru [52,53]. Valgancyklovir je valinový ester gancykloviru, je podáván perorálně a má výbornou biologickou dostupnost, v profylaktické indikaci se užívá jen 1× denně. Nevýhodou je riziko leukopenie a vysoká cena preparátu. V USA je schválen jen ve vybraných indikacích (tab. 2). Acyklovir ve vysokých dávkách je dobře tolerovaný lék, který však nemá dostatečný léčebný efekt a nenašel běžné využití ani v preventivním podávání [54,55]. Valacyklovir je L-valinový ester acykloviru, má dostatečnou biologickou dostupnost a ve vysokých dávkách je efektivní v CMV profylaxi [56,57]. Foscarnet je v současnosti využíván v 2. linii léčby a je vyhrazen pro rezistentní formy viru. Jeho nevýhodou je závažná nefrotoxicita a hyperkalcemie. Cidofovir se užívá v léčbě CMV retinitidy u HIV pozitivních pacientů.
2. Dostupná antivirotika užívaná k profylaxi a k léčbě CMV hepatitidy. Tab. 2. Available antiviral drugs used for the prophylaxis and treatment of CMV hepatitis. 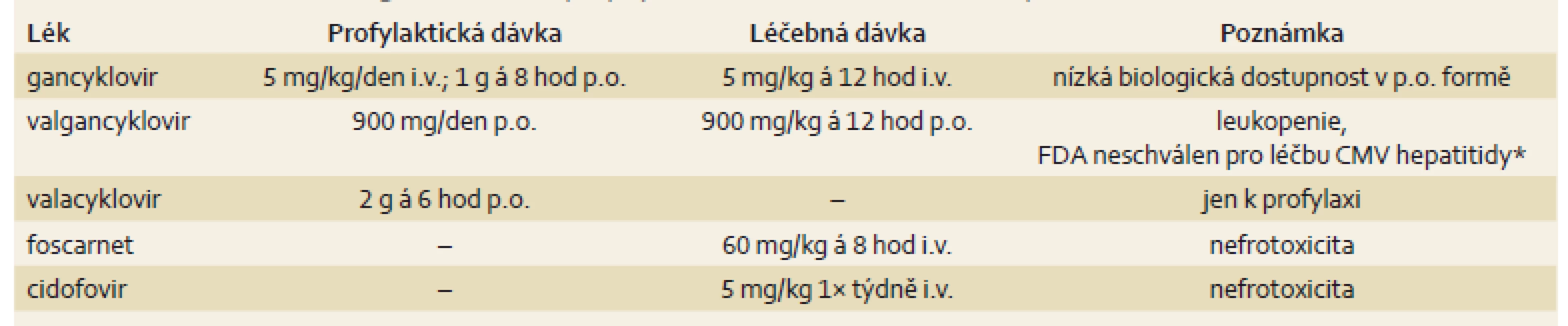
FDA – Food and Drug Administration, CMV – cytomegalovirus * Valgancyclovir schválen pouze k léčbě CMV retinitdy u pacientů s HIV a k profylaxi CMV infekce u pacientů po transplantaci srdce, pankreatu a ledvin. 2. CMV hepatitida. Imunohistochemická detekce okamžitého časného antigenu CMV (buňky infikované CMV jsou hnědé). Primární myší monoklonální anti-CMV protilátka (klon CCH2 + DDG9, Dako), původní zvětšení 400×. Fig. 2. CMV hepatitis. Immunohistochemical detection of CMV immediate early antigen (CMV/infected cells are brown). Primary mouse monoclonal anti-CMV antibody (clone CCH2 + DDG9, Dako), original magnification ×400. 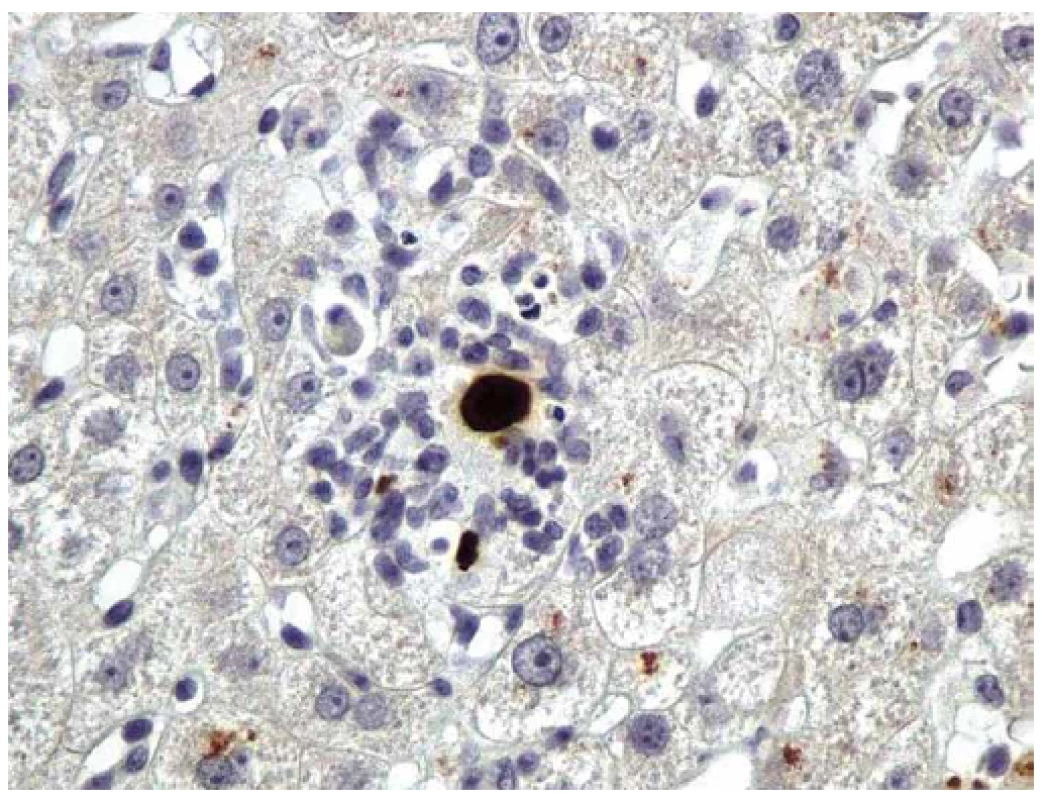
Závěr a doporučení pro praxi
Přestože se séroprevalence anti-CMV IgG pohybuje mezi 40 a 100 %, zůstává CMV infekce u zdravých jedinců spíše marginální problematikou. Symptomatická primoinfekce nastává obvykle po 30. roce věku a k symptomatické reaktivaci dochází jen v ojedinělých případech, jako jsou kriticky nemocní jedinci. Symptomatologie CMV infekce se podobá infekci EBV, ale incidence je nižší. Škála příznaků CMV infekce je rozsáhlá, nejčastěji se manifestuje nespecifickými příznaky nebo syndromem podobným mononukleóze, méně často dochází k orgánovému postižení. Elevace jaterních enzymů je přítomna asi u 70 % symptomatických osob, stejně jako EBV nezpůsobuje CMV chronickou hepatitidu. Oproti hepatitidě při EBV má CMV hepatitida méně cholestatický charakter, dominuje zvýšení aktivity ALT, 3–9 % nemocných má ikterus [7]. Podle recentních doporučení pro vyšetřování elevace jaterních testů (American College of Gastroenterology) není doporučeno stanovovat anti-CMV IgG či IgM u zdravých pacientů s mírnou elevací aminotransferáz. Protilátky je vhodné vyšetřit až při středně závažném (hodnota aminotranferáz je 5–15× nad horní hranicí normy (ULN – upper limit of normal)) nebo těžkém jaterním poškození (> 15× ULN), neboť byla popsána masivní nekróza jater s nutností transplantace na podkladě CMV hepatitidy [58]. Mnoho oligosymptomatických pacientů však unikne diagnostice. U naprosté většiny pacientů se jedná o nezávažně probíhající a spontánně regredující onemocnění s dobrou prognózou a není zapotřebí žádná léčba. Jednotná doporučení pro zahájení protivirové léčby u imunokompetentních jedinců nebyla vytvořena, ta je však indikována pouze u kriticky nemocných nebo u závažnější dysfunkce jater. Vhodná je léčba intravenózním gancyklovirem nebo perorálním valgancyklovirem. CMV infekce nemá žádný význam v etiologii chronických hepatitid a v žádném případě nelze přítomností anti-CMV IgG protilátek vysvětlovat dlouhodobou elevaci jaterních enzymů.
Naproti tomu u imunokompromitovaných nemocných, jako jsou pacienti s AIDS či užívající imunosupresiva, může mít primoinfekce i reaktivace CMV závažný až život ohrožující průběh. Z tohoto důvodu je nutno pacientům před plánovaným zahájením imunosupresivní léčby vyšetřit sérostatus anti-CMV IgG i IgM a dle platných doporučení podávat profylaxi. Na možný rozvoj infekce s pozdním nástupem je nutno pomýšlet i po ukončení profylaxe. Při prokázaném rozvoji infekce je nezbytné zahájit protivirovou léčbu gancyklovirem nebo valgancyklovirem.
Děkujeme MUDr. Evě Sticové, Ph.D., za poskytnutí fotografií.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 18. 9. 2017
Přijato: 26. 9. 2017
MUDr. Klára Chmelová
Klinika hepatogastroenterologie
Transplantcentrum, IKEM
Vídeňská 1958/9
140 21 Praha 4
chmk@ikem.cz
Sources
1. Stadler LP, Bernstein DI, Callahan ST et al. Seroprevalence of cytomegalovirus (CMV) and risk factors for infection in adolescent males. Clin Infect Dis 2010; 51 (10): e76–e81. doi: 10.1086/656918.
2. Cannon MJ, Schmid DS, Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Rev Med Virol 2010; 20 (4): 202–213. doi: 10.1002/rmv.655.
3. Evans AS. Infectious mononucleosis and related syndromes. Am J Med Sci 1978; 276 (3): 325–339.
4. Sinzger C, Digel M, Jahn G. Cytomegalovirus cell tropism. Curr Top Microbiol Immunol 2008; 325 : 63–83.
5. Sinclair J. Human cytomegalovirus: latency and reactivation in the myeloid lineage. J Clin Virol 2008; 41 (3): 180–185. doi: 10.1016/j.jcv.2007.11.014.
6. Stanier P, Taylor DL, Kitchen AD et al. Persistence of cytomegalovirus in mononuclear cells in peripheral blood from blood donors. BMJ 1989; 299 (6704): 897–898.
7. Leonardsson H, Hreinsson JP, Löve A et al. Hepatitis due to Epstein-Barr virus and cytomegalovirus: clinical features and outcomes. Scand J Gastroenterol 2017; 52 (8): 893–897. doi: 10.1080/00365521.2017.1319972.
8. Eddleston M, Peacock S, Juniper M et al. Severe cytomegalovirus infection in immunocompetent patients. Clin Infect Dis 1997; 24 (1): 52–56.
9. Bonnet F, Neau D, Viallard JF et al. Clinical and laboratory findings of cytomegalovirus infection in 115 hospitalized non-immunocompromised adults. Ann Med Interne (Paris) 2001; 152 (4): 227–235.
10. Kalil AC, Florescu DF. Prevalence and mortality associated with cytomegalovirus infection in nonimmunosuppressed patients in the intensive care unit. Crit Care Med 2009; 37 (8): 2350–2358. doi: 10.1097/CCM.0b013e3181a3aa43.
11. Reeves M, Sinclair J. Aspects of human cytomegalovirus latency and reactivation. Curr Top Microbiol Immunol 2008; 325 : 297–313.
12. Björnsson HK, Olafsson S, Bergmann OM et al. A prospective study on the causes of notably raised alanine aminotransferase (ALT). Scand J Gastroenterol 2016; 51 (5): 594–600. doi: 10.3109/00365521.2015.1121516.
13. Shusterman NH, Frauenhoffer C, Kinsey MD. Fatal massive hepatic necrosis in cytomegalovirus mononucleosis. Ann Intern Med 1978; 88 (6): 810–812.
14. Yu YD, Park GC, Park PJ et al. Cytomegalovirus infection-associated fulminant hepatitis in an immunocompetent adult requiring emergency living-donor liver transplantation: report of a case. Surg Today 2013; 43 (4): 424–428. doi: 10.1007/s00595-012-0209-6.
15. Cebulla CM, Miller DM, Knight DA et al. Cytomegalovirus induces sialyl Lewis (x) and Lewis (x) on human endothelial cells. Transplantation 2000; 69 (6): 1202–1209.
16. Span AH, van Dam-Mieras MC, Mullers W et al. The effect of virus infection on the adherence of leukocytes or platelets to endothelial cells. Eur J Clin Invest 1991; 21 (3): 331–338.
17. Squizzato A, Gerdes VE, Buller HR. Effects of human cytomegalovirus infection on the coagulation system. Thromb Haemost 2005; 93 (3): 403–410.
18. Vercellotti GM. Effects of viral activation of the vessel wall on inflammation and thrombosis. Blood Coagul Fibrin 1998; 9: S3–S6.
19. Bonkowsky HL, Lee RV, Klatskin G. Acute granulomatous hepatitis. Occurrence in cytomegalovirus mononucleosis. JAMA 1975; 233 (12): 1284–1288.
20. Kenneson A, Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol 2007; 17 (4): 253–276.
21. Stagno S, Whitley RJ. Herpesvirus infections of pregnancy. Part I: cytomegalovirus and Epstein-Barr virus infections. N Engl J Med 1985; 313 (20): 1270–1274.
22. Eggers M, Bader U, Enders G. Combination of microneutralization and avidity assays: improved diagnosis of recent primary human cytomegalovirus infection in single serum sample of second trimester pregnancy. J Med Virol 2000; 60 (3): 324–330.
23. Townsend CL, Forsgren M, Ahlfors K et al. Long-term outcomes of congenital cytomegalovirus infection in Sweden and the United Kingdom. Clin Infect Dis 2013; 56 (9): 1232–1239. doi: 10.1093/cid/ cit018.
24. Society for Maternal-Fetal M, Hughes BL et al. Diagnosis and antenatal management of congenital cytomegalovirus infection. Am J Obstet Gynecol 2016; 214 (6): B5–B11. doi: 10.1016/j.ajog.2016.02.042.
25. Picone O, Vauloup-Fellous C, Cordier AG et al. A series of 238 cytomegalovirus primary infections during pregnancy: description and outcome. Prenat Diagn 2013; 33 (8): 751–758. doi: 10.1002/pd.4118.
26. Gabrielli L, Bonasoni MP, Lazzarotto T et al. Histological findings in foetuses congenitally infected by cytomegalovirus. J Clin Virol 2009; 46 (Suppl 4): S16–S21. doi: 10.1016/j.jcv.2009.09.026.
27. Boppana SB, Fowler KB, Britt WJ et al. Symptomatic congenital cytomegalovirus infection in infants born to mothers with preexisting immunity to cytomegalovirus. Pediatrics 1999; 104 (1 Pt 1): 55–60.
28. Pass RF, Fowler KB, Boppana SB et al. Congenital cytomegalovirus infection following first trimester maternal infection: symptoms at birth and outcome. J Clin Virol 2006; 35 (2): 216–220.
29. Manicklal S, Emery VC, Lazzarotto T et al. The “silent” global burden of congenital cytomegalovirus. Clin Microbiol Rev 2013; 26 (1): 86–102. doi: 10.1128/CMR.00062-12.
30. Ozkan TB, Mistik R, Dikici B et al. Antiviral therapy in neonatal cholestatic cytomegalovirus hepatitis. BMC Gastroenterol 2007; 7 : 9.
31. Simon DM, Levin S. Infectious complications of solid organ transplantations. Infect Dis Clin North Am 2001; 15 (2): 521–549.
32. Paya CV, Hermans PE, Wiesner RH et al. Cytomegalovirus hepatitis in liver transplantation: prospective analysis of 93 consecutive orthotopic liver transplantations. J Infect Dis 1989; 160 (5): 752–758.
33. Hibberd PL, Tolkoff-Rubin NE, Cosimi AB et al. Symptomatic cytomegalovirus disease in the cytomegalovirus antibody seropositive renal transplant recipient treated with OKT3. Transplantation 1992; 53 (1): 68–72.
34. Drouet E, Colimon R, Michelson S et al. Monitoring levels of human cytomegalovirus DNA in blood after liver transplantation. J Clin Microbiol 1995; 33 (2): 389–394.
35. Humar A, Snydman D, Practice ASTIDCo. Cytomegalovirus in solid organ transplant recipients. Am J Transplant 2009; 9 (Suppl 4): S78–S86. doi: 10.1111/ j.1600-6143.2009.02897.x.
36. Lee SO, Razonable RR. Current concepts on cytomegalovirus infection after liver transplantation. World J Hepatol 2010; 2 (9): 325–336. doi: 10.4254/wjh.v2.i9.325.
37. Paya CV. Prevention of cytomegalovirus disease in recipients of solid-organ transplants. Clin Infect Dis 2001; 32 (4): 596–603.
38. Singh N, Wannstedt C, Keyes L et al. Who among cytomegalovirus-seropositive liver transplant recipients is at risk for cytomegalovirus infection? Liver Transpl 2005; 11 (6): 700–704.
39. Strippoli GF, Hodson EM, Jones CJ et al. Pre-emptive treatment for cytomegalovirus viraemia to prevent cytomegalovirus disease in solid organ transplant recipients. Cochrane Database Syst Rev 2006 (1): CD005133.
40. Singh N. Optimization of outcomes related to cytomegalovirus in organ transplant recipients. Transplantation 2006; 82 (1): 15–16.
41. Razonable RR, Paya CV. Valganciclovir for the prevention and treatment of cytomegalovirus disease in immunocompromised hosts. Expert Rev Anti Infect Ther 2004; 2 (1): 27–41.
42. Salzberger B, Hartmann P, Hanses F et al. Incidence and prognosis of CMV disease in HIV-infected patients before and after introduction of combination antiretroviral therapy. Infection 2005; 33 (5–6): 345–349.
43. Emery VC. Restimulating interest in cytomegalovirus as a cofactor for HIV infection. J Infect Dis 2015; 211 (2): 169–171. doi: 10.1093/infdis/jiu419.
44. Jabs DA, Van Natta ML, Kempen JH et al. Characteristics of patients with cytomegalovirus retinitis in the era of highly active antiretroviral therapy. Am J Ophthalmol 2002; 133 (1): 48–61.
45. Jabs DA, Holbrook JT, Van Natta ML et al. Risk factors for mortality in patients with AIDS in the era of highly active antiretroviral therapy. Ophthalmology 2005; 112 (5): 771–779.
46. Chou S. Newer methods for diagnosis of cytomegalovirus infection. Rev Infect Dis 1990; 12 (Suppl 7): S727–S736.
47. Kraft CS, Armstrong WS, Caliendo AM. Interpreting quantitative cytomegalovirus DNA testing: understanding the laboratory perspective. Clin Infect Dis 2012; 54 (12): 1793–1797. doi: 10.1093/cid/cis212.
48. Bek B, Boeckh M, Lepenies J et al. High-level sensitivity of quantitative pp65 cytomegalovirus (CMV) antigenemia assay for diagnosis of CMV disease in AIDS patients and follow-up. J Clin Microbiol 1996; 34 (2): 457–459.
49. van den Berg AP, Klompmaker IJ, Haagsma EB et al. Antigenemia in the diagnosis and monitoring of active cytomegalovirus infection after liver transplantation. J Infect Dis 1991; 164 (2): 265–270.
50. Kotton CN, Kumar D, Caliendo AM et al. Updated international consensus guidelines on the management of cytomegalovirus in solid-organ transplantation. Transplantation 2013; 96 (4): 333–360. doi: 10.1097/TP.0b013e31829df29d.
51. Murray BM. Management of cytomegalovirus infection in solid-organ transplant recipients. Immunol Invest 1997; 26 (1–2): 243–255.
52. Crumpacker CS. Ganciclovir. N Engl J Med 1996; 335 (10): 721–729.
53. Limaye AP. Ganciclovir-resistant cytomegalovirus in organ transplant recipients. Clin Infect Dis 2002; 35 (7): 866–872.
54. Balfour HH Jr, Chace BA, Stapleton JT et al. A randomized, placebo-controlled trial of oral acyclovir for the prevention of cytomegalovirus disease in recipients of renal allografts. N Engl J Med 1989; 320 (21): 1381–1387.
55. Flechner SM, Avery RK, Fisher R et al. A randomized prospective controlled trial of oral acyclovir versus oral ganciclovir for cytomegalovirus prophylaxis in high-risk kidney transplant recipients. Transplantation 1998; 66 (12): 1682–1688.
56. Lowance D, Neumayer HH, Legendre CM et al. Valacyclovir for the prevention of cytomegalovirus disease after renal transplantation. International Valacyclovir Cytomegalovirus Prophylaxis Transplantation Study Group. N Engl J Med 1999; 340 (19): 1462–1470.
57. Reischig T, Hribova P, Jindra P et al. Long-term outcomes of pre-emptive valganciclovir compared with valacyclovir prophylaxis for prevention of cytomegalovirus in renal transplantation. J Am Soc Nephrol 2012; 23 (9): 1588–1597. doi: 10.1681/ASN.2012010100.
58. Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: evaluation of abnormal liver chemistries. Am J Gastroenterol 2017; 112 (1): 18–35. doi: 10.1038/ajg.2016.517.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2017 Issue 6-
All articles in this issue
- Pediatric gastroenterology and hepatology
- Bariatrics
- Evaluation and applicability of nonbiopsy criteria in children and adolescents according to ESPGHAN for diagnosis of celiac disease
- Wilson’s disease in a cohort of pediatric patients in Slovakia
- Epidemiology, hospitalization and migration of patients with IBD under specialized care in the Czech Republic
- Obesity and kidney
- Cytomegalovirus infection and the liver
- Magnesium sulfate saline laxatives in the preparation for colonoscopy – our experience
- 4th International Symposium on Pediatric IBD
- The selection from international journals
- Thanks to reviewers
- Severe gastric ulcer as a first manifestation of systemic lupus erythematosus in a child
- Interdisciplinary European guidelines on metabolic and bariatric surgery
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cytomegalovirus infection and the liver
- Magnesium sulfate saline laxatives in the preparation for colonoscopy – our experience
- Epidemiology, hospitalization and migration of patients with IBD under specialized care in the Czech Republic
- Obesity and kidney
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

