-
Medical journals
- Career
Přímo působící antivirotika v léčbě HCV asociovaných maligních lymfomů
Authors: J. Šperl 1; S. Fraňková 1; E. Sticová 2; L. Bartoňová 2; M. Drastichová 3; P. Štirand 1
Authors‘ workplace: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 1; Pracoviště klinické a transplantační patologie, Transplantcentrum, IKEM, Praha 2; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha 3
Published in: Gastroent Hepatol 2017; 71(2): 138-144
Category: Hepatology: Original Article
doi: https://doi.org/10.14735/amgh2017138Overview
HCV asociované lymfoproliferace, jejichž nečastější formou je smíšená kryoglobulinemie 2. typu s projevy vaskulitidy, nebo HCV asociované B buněčné non-Hodgkinské maligní lymfomy představují nejzávažnější extrahepatální komplikace chronické HCV infekce. Patogenetický mechanizmus, kterým chronická HCV infekce způsobuje dlouhodobou stimulaci, aktivaci, proliferaci a následnou klonální expanzi B lymfocytů, nesjpíše spočívá v dlouhodobé stimulaci B lymfocytů E2 proteinem viru. Protivirová léčba vedoucí k eradikaci infekce představuje postup volby u indolentních lymfomů, u agresivních lymfomů má vždy následovat po imunoterapii a chemoterapii za účelem snížení rizika relapsu lymfomu a reaktivace HCV infekce. Léčba režimy založenými na interferonu α byla u našich pacientů málo účinná jednak kvůli dominanci genotypu 1, jednak kvůli dlouhému trvání infekce před manifestací lymfomu. Autoři popisují tři pacienty s HCV asociovaným lymfomem, dvě ženy ve věku 57 a 65 let a jednoho 55letého muže. Všichni byli infikováni genotypem 1b a v době manifestace lymfomu již měli fibrózu jater stadia F3 nebo F4. Všichni byli v minulosti neúspěšně léčeni pegylovaným interferonem α a ribavirinem. U všech byl maligní lymfom zjištěn při pravidelném sonografickém vyšetření jater v rámci detekce časného hepatocelulárního karcinomu, v prvních dvou případech se jednalo o ložiskové postižení jater, ve třetím případě o postižení uzlin v hilu jater. Remise lymfomu bylo u všech pacientů dosaženo kombinací hematoonkologické a protivirové léčby. První pacientka dosáhla setrvalé virologické odpovědi léčbou kombinací pegylovaného interferonu α s ribavirinem a s boceprevirem, další dva kombinací přímo působících antivirotik, peritapreviru potencovaného ritonavirem s ombitasvirem a dasabuvirem. Remise trvá u všech tří pacientů 24, 26 a 45 měsíců od ukončení léčby. Cílem sdělení je upozornit na přínos léčby přímo působícími antivirotiky pro pacienty s HCV asociovanými maligními lymfomy. Také ale na nutnost provádění pravidelných sonografických vyšetření v rámci detekce časných forem hepatocelulárního karcinomu (ale i lymfomu) u těchto pacientů a konečně na nutnost histologické verifikace při každém podezření na HCV asociovaný lymfom.
Klíčová slova:
chronická hepatitida C – HCV asociovaný lymfom – přímo působící antivirotikaÚvod
Chronická infekce virem hepatitidy C (HCV) představuje pro své nositele zejména rizika spojená s progredující fibrózou jater s následnou cirhotickou přestavbou, chronickým selháním jater a často i se vznikem hepatocelulárního karcinomu (HCC) v cirhóze [1,2]. Jinou závažnou a život ohrožující komplikací chronické HCV infekce může být tzv. HCV asociovaná lymfoproliferace, jejíž nečastější formou je smíšená kryoglobulinemie 2. typu s projevy vaskulitidy nebo HCV asociované B buněčné non-Hodgkinské maligní lymfomy (B-NHL) [3,4]. První, nejčastěji zmiňovaná teorie předpokládá trvalou stimulaci B lymfocytů vazbou strukturálního E2 HCV proteinu na CD81 receptor [5,6], druhá teorie předpokládá vstup viru do B lymfocytu po navázání E2 proteinu na receptor CD81 a následnou replikaci HCV v B lymfocytech, jejichž trvalou stimulaci způsobují virové proteiny intracelulárně. Třetí teorie též počítá s replikací HCV v B lymfocytech, jejímž následkem je mutace tumor supresorových genů. Zmiňován je i možný podíl trvalé stimulace toll-like receptoru 2 virovou RNA s následnou zvýšenou produkcí IL6, který stimuluje B lymfocyty [7]. Spektrum HCV asociovaných B-NHL kolísá od forem indolentních až po formy agresivní. Dle WHO klasifikace jsou indolentní formou HCV asociovaných B-NHL lymfomy z marginální zóny, případně i lymfoplazmocytové lymfomy [8,9], agresivní formu představují difuzní velkobuněčné B lymfomy (DLBCL – diffuse large B-cell lymphoma) [10]. Léčba HCV asociovaných B-NHL spočívá v kombinaci protivirové léčby s onkologickou imunoterapií či chemoterapií. Samotné dosažení eradikace HCV infekce navodí remisi až poloviny indolentních forem B-NHL, u agresivních forem, kdy je nutná i onkologická léčba, je eradikace HCV infekce spojena s významně lepším přežitím. Dalším možným přínosem eradikace HCV je zabránění reaktivace HCV infekce během onkologické léčby. Skutečnost, že vznik HCV asociovaných B-NHL je spojen s dlouhým trváním virové infekce (> 15 let) vysvětluje, proč má většina pacientů v době stanovení diagnózy B-NHL již i pokročilou fibrózu jater. Dlouhé trvání choroby představovalo v minulosti negativní prognostický faktor při léčbě pegylovaným interferonem α a ribavirinem (P/RBV), dalším negativním prognostickým faktorem byla infekce genotypem 1, který je prevalentní u našich starších pacientů. Léčba P/RBV byla kromě nízké účinnosti provázena závažnými nežádoucími účinky. Zavedení přímo působících antivirotik (DAA – direct-acting antivirals) do léčby chronické HCV infekce přineslo naději na dosažení eradikace viru (dosažení setrvalé virologické odpovědi (SVR)) i pro pacienty s HCV asociovanými B-NHL, čímž se zvýšila i jejich šance na dosažení remise lymfomu. V předložené práci jsou popsány tři případy pacientů s pokročilou fibrózou jater a s HCV asociovaným B-NHL. U všech tří, kteří byli v minulosti neúspěšně léčeni kombinací P/RBV, se podařilo vyléčit virovou infekci pomocí DAA a v kombinaci s onkologickou léčbou dosáhnout i remise lymfomu.
Popis případů
V prvním případě se jedná o ženu narozenou v roce 1954, diagnóza chronické hepatitidy C jí byla stanovena v roce 2000, kdy byla vyšetřena pro elevaci aktivity jaterních enzymů. Měla diabetes mellitus léčený inzulinem a hypertenzi. Biopticky již při stanovení diagnózy byla přítomna septální fibróza (F3 dle Metavir skóre), genotyp viru byl 1b. V roce 2006 byla poprvé léčena dvojkombinací P/RBV, odpověď na léčbu byla hodnocena jako pomalá (slow response), dosáhla HCV RNA negativity v týdnu 24, kdy léčbu rovněž ukončila pro nežádoucí účinky. Po předčasném ukončení léčby došlo k relapsu HCV infekce. Další protivirová léčba dvojkombinací P/RBV nebyla podána, pacientka byla nadále sledována v naší ambulanci a z důvodu pokročilé fibrózy byly prováděny screeningové sonografie za účelem detekce časného HCC v pokročilé fibróze. V dubnu 2011 byla při sonografii nově zjištěna mnohočetná malá hypoechogenní ložiska v játrech (největší 22 mm) (obr. 1), koncentrace AFP v séru byla 10 μg/l. V CT obraze neměla ložiska typický charakter HCC, proto byla provedena cílená biopsie, která potvrdila diagnózu lymfomu z B buněk marginální zóny (obr. 2). Trepanobiopsie neprokázala infiltraci kostní dřeně. Nález zhodnocen hematologem jako extranodální MALT HCV-asociovaný lymfom, nebyla indikována chemoterapie, ale byla doporučena protivirová léčba HCV infekce. HCV RNA byla 1,21 × 106 IU/ml. Léčba byla zahájena v prosinci 2011 kombinací peginterferonu α 2b, RBV a bocepreviru (P/RBV/BOC) v obvyklém dávkování, BOC byl přidán po čtyřtýdenní lead-in fázi P/RBV. Při léčbě byla nemocná významně anemická, s nutností podávání erytropoetinu (20 000 IU týdně) a následnou redukcí dávky RBV. Dosáhla HCV RNA negativity ve 12. týdnu léčby, léčbu dokončila plánovaně v týdnu 48. Již po 3 měsících však došlo k významné regresi počtu i velikosti ložisek lymfomu v játrech, po 6 měsících protivirové léčby nebyla již sonograficky ložiska vůbec patrna. Pacientka dosáhla SVR 24 týdnů po léčbě, rovněž hematolog konstatoval kompletní remisi lymfomu. V roce 2014 došlo k recidivě lymfomu v játrech, histologická klasifikace byla identická, remise, která trvá dosud, byla dosažena monoterapií rituximabem.
Image 1. Ložisko lymfomu v játrech. Ultrazvukové vyšetření jater prokazující hypoechogenní ložisko velikosti 22 mm. Fig. 1. Lymphoma in the liver. Ultrasound showing a hypoechogenic mass of 22 mm in diameter 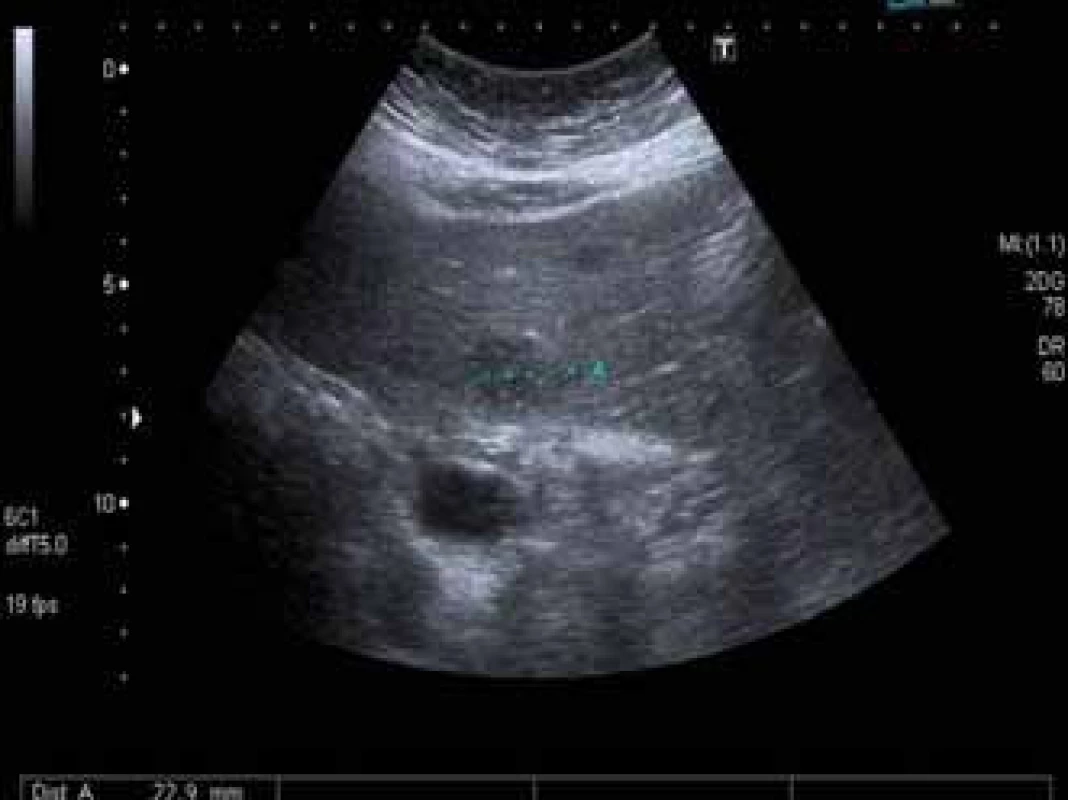
Image 2. Extranodální lymfom z B buněk marginální zóny. Portální pole s vágně nodulární proliferací malých a středně velkých lymfocytů zčásti centrocytoidního vzhledu. Hematoxylin-eozin, původní zvětšení 400×. Fig. 2. Extranodal marginal zone B-cell lymphoma. Portal tracts with nodular proliferation of small and medium lymphocytes, some of them with centrocytoid appearance. Haematoxylin-eosin staining, magnification ×400. 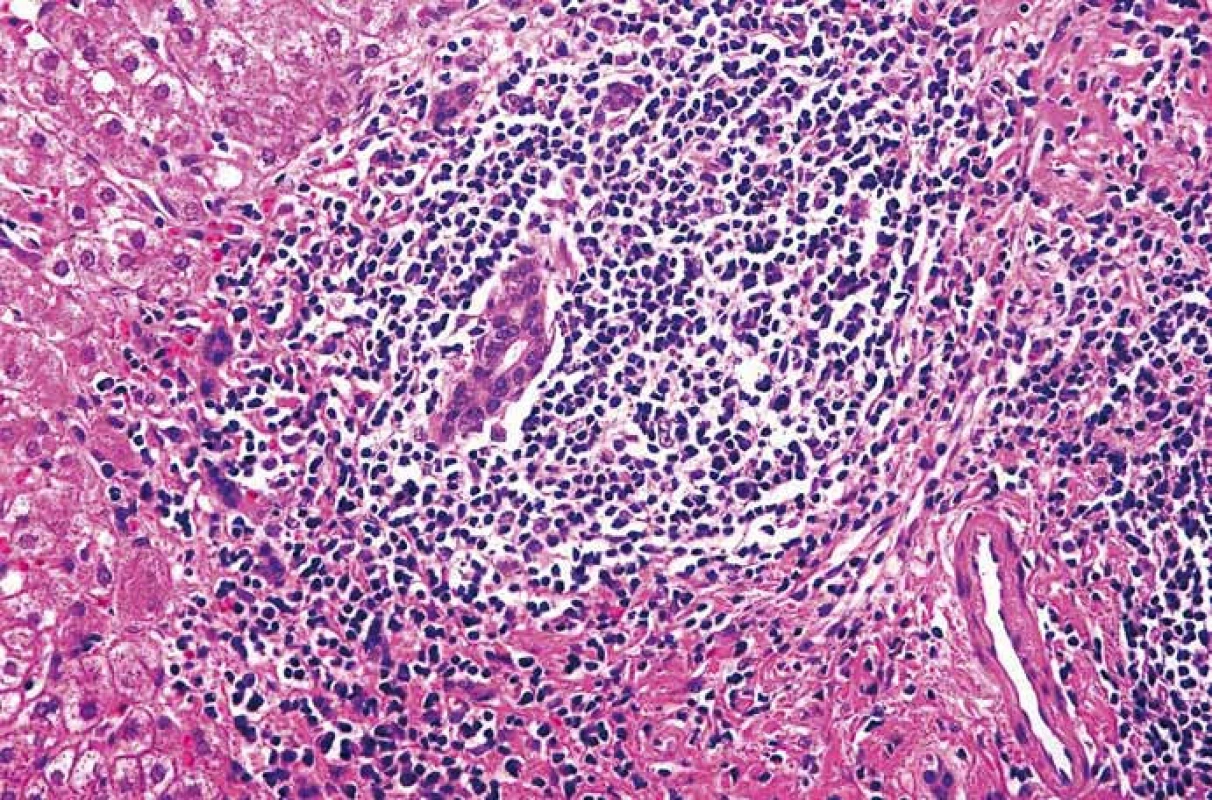
Druhý pacient byl muž narozený v roce 1959, diabetik, hypertonik. V roce 2008 byl vyšetřen pro elevaci aktivity ALT a byla mu diagnostikována chronická hepatitida C. Jaterní biopsii podstoupil v roce 2009 již s nálezem cirhotické přestavby (Metavir F4). Následně byl léčen 24 týdnů P/RBV, léčba byla ukončena pro virologické selhání (nullresponse). Od ledna do prosince 2012 byl léčen kombinací P/RBV a telapreviru (TVR), léčba opět selhala (fenomén průlomu s opětovně pozitivní viremií v týdnu 48). Pacient absolvoval pravidelná sonografická vyšetření jater v rámci detekce časného HCC, v únoru 2014 byl při sonografii zjištěn paket uzlin v hilu jater 10 × 7 cm, nález byl potvrzen CT vyšetřením (obr. 3). Ložiska v jaterním parenchymu nebyla zjištěna. Byla vyslovena suspekce na lymfom, diagnóza byla potvrzena odběrem lymfatické uzliny z jaterního hilu při laparoskopii, histologické vyšetření potvrdilo DLBCL (obr. 4). HCV RNA byla 2,89 × 106 IU/ml. O 2 týdny později se manifestoval ikterus (bilirubin 101 μmol/l), sonograficky byla nově přítomna dilatace žlučových cest. Proto byla provedena ERCP s nálezem útlaku ductus hepaticus communis uzlinami (obr. 5), po provedení papilotomie byl zaveden biliární stent. Ikterus rychle ustoupil a za další 2 týdny mohla být zahájena chemoterapie R-CHOP (rituximab, vikristin, cyklofosfamid, adriamycin, prednison). Pacient obdržel celkem šest cyklů bez nežádoucích příhod, nedošlo k reaktivaci HCV infekce, jako prevence rekurence HBV infekce (izolovaná anti-HBc total pozitivita před léčbou) byl podáván po dobu chemoterapie a rok po ní lamivudin. Biliární stent byl extrahován po 4 měsících, kdy došlo ke kompletní regresi hilové jaterní lymfadenopatie. V lednu 2015 byla hematologem konstatována kompletní remise lymfomu. Od června do září 2016 byl poté pacient léčen kombinací DAA paritapreviru s ritonavirem, ombitasvirem a dasabuvirem (Pr/O/D). Léčba trvala 12 týdnů a pacient dosáhl SVR 12 týdnů po léčbě. Jaterní cirhóza je nadále plně kompenzovaná, lymfom je v remisi, sonografická vyšetření neprokázala ložiska suspektní z HCC.
Image 3. Postižení uzlin jaterního hilu lymfomem. CT vyšetření (arteriální fáze) zachycující paket uzlin v jaterním hilu velikosti 10 × 7 cm. Uzlinami prochází arteria hepatica. Fig. 3. Lymphoma infiltration of lymph nodes in liver hilum. CT scan (arterial phase) showing bulk lymph nodes in the liver hilum of 10 × 7 cm. Hepatic artery incasement. 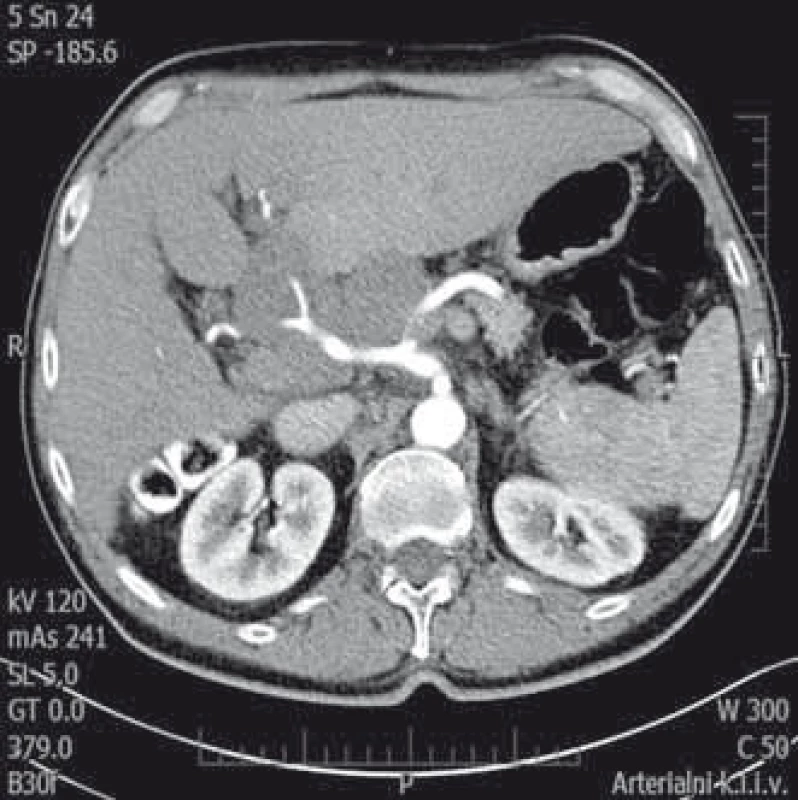
Image 4. Difuzní velkobuněčný lymfom z B buněk. Difuzní proliferace středně velkých až velkých B lymocytů (A) (hematoxylin-eozin) vykazujících imunohistochemickou pozitivitu v reakcích s protilátkou CD20 (B). Původní zvětšení 200×. Fig. 4. Diffuse large B-cell lymphoma. Diffuse proliferation of medium to large B-lymphocytes (A) (haematoxylin-eosin staining) showing immunohistochemic positivity in CD20 staining (B). Magnification ×200. 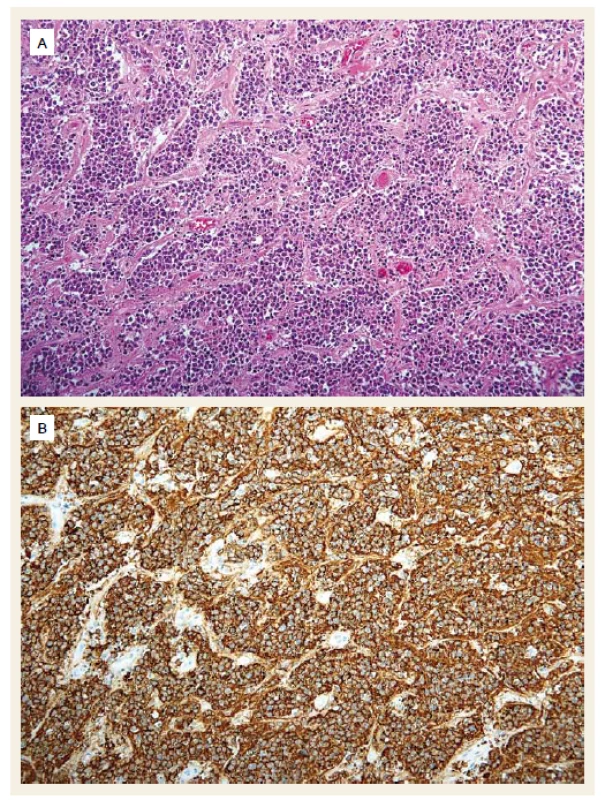
Image 5. Útlak ductus hepaticus communis uzlinovým procesem v jaterním hilu. ERCP, cholangiogram. Fig. 5. Common bile duct stenosis caused by lymph nodes in the liver hilum. ERCP, cholangiogram. 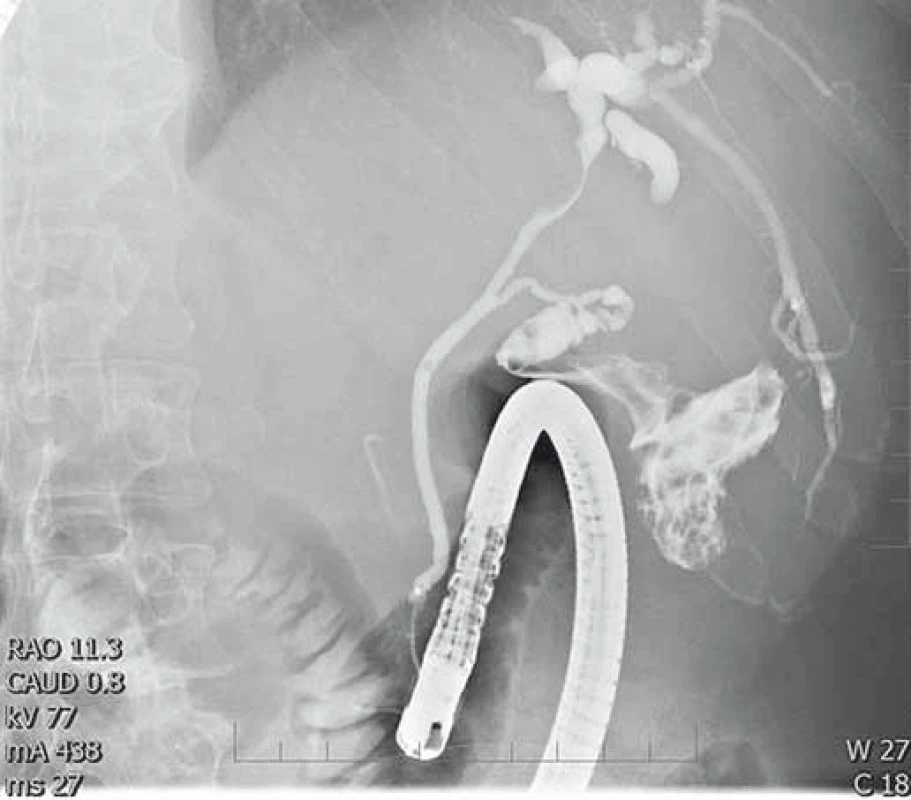
Ve třetím případě se jednalo o ženu narozenou v roce 1947, HCV infekce byla diagnostikována v roce 1997. Genotyp viru byl 1b, jaterní biopsie byla provedena v roce 2000 s nálezem středního stupně fibrózy (F2 dle Metavir skóre). Pacientka byla neúspěšně protivirově léčena rekombinantním IFN-α a RBV, následně v roce 2002 P/RBV. Léčbou nikdy nedosáhla negativity HCV RNA, léčba byla předčasně ukončena pro nullresponse. V dalším sledování byla opět zvažována protivirová léčba, fibróza byla znovu zhodnocena pomocí tranzientní elastografie v únoru 2012, tuhost jater odpovídala stupni fibrózy F3 dle Metavir skóre (10,9 kPa). V dubnu 2012 bylo sonograficky zjištěno ložisko jater velikosti 15 mm a ložisko sleziny velikosti 31 mm (obr. 6). Koncentrace AFP v séru byla 4,9 μg/l a HCV RNA 4,03 × 106 IU/ml. CT vyšetření potvrdilo obě ložiska jako hypodenzní, ložisko v játrech nemělo charakter HCC, v diferenciální diagnóze bylo pomýšleno na metastatické postižení či lymfom, nebyla však přítomna jiná lymfadenopatie. Vyšetřením gastrointestinálního traktu, plic, štítné žlázy a mammy nebyl prokázán primární tumor, následně byly provedeny dva neúspěšné pokusy o bioptickou verifikaci ložiska jater (cílená biopsie pod sonografickou kontrolou). Diagnóza byla nakonec stanovena až v říjnu 2012 při diagnostické laparoskopii (vzorek tkáně byl odebrán kleštěmi, biopsie jehlou nebyla možná pro nepříznivé uložení ložiska). Histologicky byl prokázán DLBCL, pacientka byla indikována k podání chemoterapie v režimu R-CHOP, celkem šest cyklů, od listopadu 2012 do března 2013. Léčba lymfomu byla komplikována vikristinovou polyneuropatií a febrilní neutropenií, k reaktivaci HCV infekce nedošlo. Bylo dosaženo remise lymfomu, následně pacientka zahájila v listopadu 2013 trojkombinační léčbu HCV infekce P/RBV/BOC. Léčba byla ukončena předčasně v 6. týdnu pro nežádoucí účinky BOC. Nemocná byla nadále pravidelně sledována v naší ambulanci, od září do listopadu 2015 byla úspěšně léčena 12 týdnů bezinterferonovou kombinací Pr/O/D a dosáhla SVR (hodnoceno 24 týdnů a rok po léčbě), lymfom je rovněž v remisi, jaterní onemocnění je nadále plně kompenzované.
Image 6. Ložisko lymfomu ve slezině. Ultrazvukové vyšetření sleziny prokazující hypoechogenní ložisko v hilu velikosti 31 mm. Fig. 6. Lymphoma mass in the spleen. Spleen ultrasound showing hypoechogenic mass in the spleen, 31 mm in diameter. 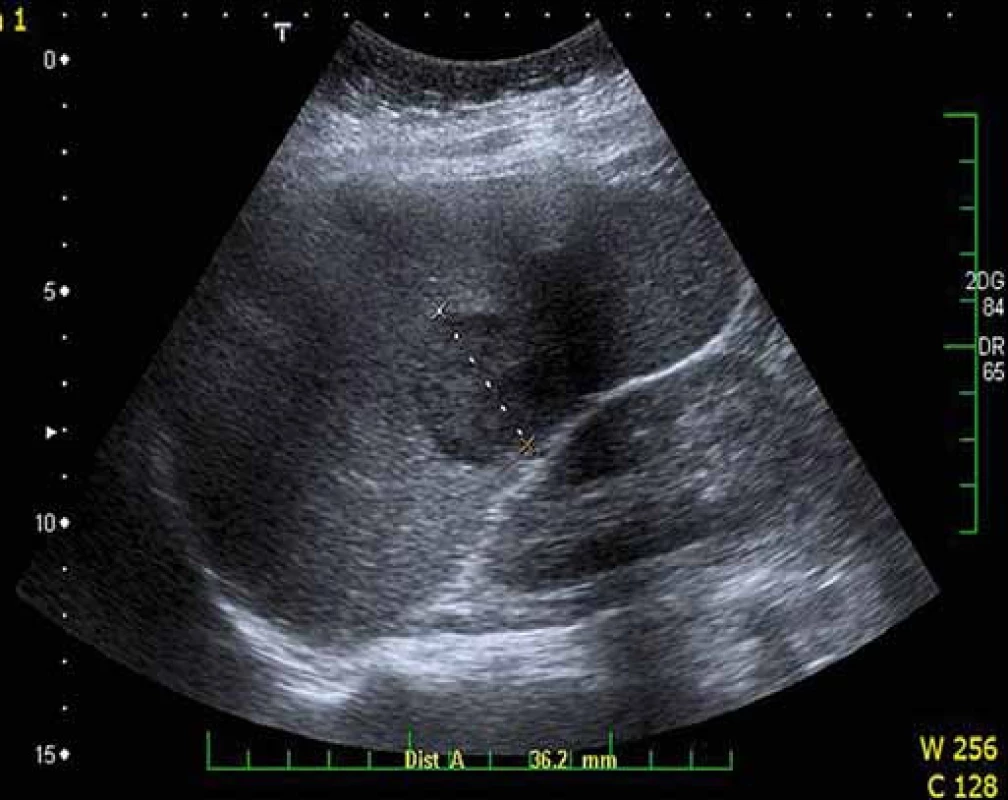
Diskuze
Všichni tři popisovaní pacienti měli B-NHL typu, který odpovídal lymfomům asociovaným s chronickou HCV infekcí. Asociace mezi chronickou HCV infekcí a B-NHL je považována za prokázanou na základě několika rozsáhlých epidemiologických studií i následných metaanalýz. Metaanalýza publikovaná Gisbertem et al [11] zahrnula 48 studií (celkem 5 542 pacientů) a prokázala průměrnou prevalenci chronické HCV infekce 13 % u pacientů s B-NHL. Ve vybraných kontrolovaných 10 studiích byla prevalence chronické HCV infekce 17 % u pacientů s B-NHL a 1,5 % u zdravých dobrovolníků (odds ratio (OR) 10,8) [11]. Další metaanalýza zahrnující 15 kontrolovaných studií prokázala u pacientů s chronickou HCV infekcí 2,5násobně vyšší riziko vzniku B-NHL ve srovnání se zdravými dobrovolníky [12]. V prevalenci chronické HCV infekce u pacientů s B-NHL byly zjištěny značné rozdíly mezi studiemi zahrnutými do zmíněných metaanalýz. Za jednoznačné potvrzení asociace je považována epidemiologická studie InterLymph konsorcia (The International Lymphoma Epidemiology Consortium), která zhodnotila prevalenci chronické HCV infekce u 4 784 pacientů s B-NHL a 6 269 zdravých dobrovolníků z USA, Evropy a Austrálie. Prevalence chronické HCV infekce mezi pacienty s B-NHL byla 3,6 % a mezi zdravými dobrovolníky 2,7 % (OR 1,8; CI 1,4–2,3) [13].
Dalším faktem podporujícím asociaci mezi chronickou HCV infekcí a B-NHL je navození remise lymfomu úspěšnou protivirovou léčbou u indolentních forem lymfomů [14,15]. Někteří autoři zpochybňovali v minulosti význam eradikace HCV infekce pro dosažení remise N-NHL a vyzdvihovali význam antiproliferačního účinku IFN-α, který byl až do roku 2013 součástí všech léčebných režimů. V současné době jsou ale již popsány případy pacientů, kdy k vyléčení chronické HCV infekce i k dosažení remise lymfomu vedla léčba kombinací bez IFN-α, tj. kombinace DAA [16,17]. Účinnost léčby P/RBV u pacientů s B-NHL popisovaná v minulosti v řadě studií byla značně rozdílná. Výsledky byly ovlivněny zejména zastoupením různých genotypů HCV. V italské multicentrické retrospektivní studii zahrnující 100 pacientů s B-NHL jich 80 dosáhlo SVR léčbou kombinací P/RBV, nutno ale zmínit, že 55 pacientů ze 100 bylo infikováno genotypem 2 [18]. U pacientů infikovaných genotypem 1, kterých byla v ČR v minulosti naprostá většina, byla účinnost léčby kombinací P/RBV nízká [19,20], ke snížení účinnosti kombinace P/RBV přispívala i skutečnost, že B-NHL je spojen s dlouhým trváním HCV infekce, a tím i s pokročilou fibrózou jater. V souladu s výše uvedeným byly i výsledky léčby P/RBV u našich pacientů, léčba P/RBV selhala u všech tří pacientů. Zavedení prvních DAA do léčby chronické HCV infekce, kterými byly proteázové inhibitory první generace (BOC a TVR), zvýšilo naději na vyléčení zejména pacientům, kteří po předchozí léčbě P/RBV relabovali a neměli ještě pokročilou fibrózu jater [21,22]. Účinnost trojkombinační léčby P/RBV s BOC nebo TVR u pacientů s pokročilou fibrózou se pohybovala kolem 30 % [23]. Je proto vcelku překvapivé, že naše první pacientka dosáhla SVR léčbou P/RBV/BOC, na úspěchu léčby se významně podílelo její odhodlání snášet nežádoucí účinky léčby. Obě zmíněné trojkombinace již nepatří mezi doporučené postupy léčby chronické HCV infekce právě pro nízkou účinnost a nedobrou toleranci. U dalších dvou našich pacientů byla trojkombinace P/RBV s BOC nebo TVR neúspěšná, tito pacienti dosáhli SVR léčbou DAA kombinací Pr/O/D. Zmíněný režim je jedinou dostupnou trojkombinací DAA, která je používána k léčbě chronické HCV infekce, ostatní dostupné bezinterferonové režimy jsou dvojkombinacemi DAA. Režim Pr/O/D se vyznačuje vysokou protivirovou účinností, zejména u genotypu 1b. U pacientů infikovaných genotypem 1b není nutno přidávat RBV, který obvykle zhoršuje toleranci léčby. RBV není nutno podávat s režimem Pr/O/D ani u pacientů s jaterní cirhózou, v otevřené studii dosáhlo SVR všech 60 pacientů s kompenzovanou jaterní cirhózou infikovaných genotypem 1b [24]. Léčba kombinací Pr/O/D je velmi dobře tolerována, jedinou limitací jejího podání jsou lékové interakce. Před zahájením léčby je bezpodmínečně nutné ověřit kompatibilitu se všemi dalšími léčivy, která pacient užívá, a případně současně podávanou medikaci na dobu protivirové léčby upravit.
U všech tří našich pacientů byl HCV asociovaný B-NHL časně zjištěn v asymptomatickém stadiu díky pravidelně prováděné detekci časného HCC u pacientů s jaterní cirhózou. Optimálním postupem pro detekci časného HCC je provádění sonografického vyšetření jater každých 6 měsíců [25]. Pacienti s jaterní cirhózou, u kterých se pravidelná detekce časného HCC provádí, mají lepší dlouhodobé přežití ve srovnání s pacienty, u kterých se pravidelná detekce neprovádí. Diagnóza HCC je v současné době založena zejména na typickém obrazu nejméně na dvou zobrazovacích metodách. Pokud je splněno i kritérium velikosti a případně i vysoká koncentrace AFP v séru, není histologická verifikace nutná. U našich dvou pacientů s jaterní lokalizací B-NHL nebyl sonografický obraz ložisek typický pro HCC, proto bylo nutno přistoupit k histologické verifikaci. Získání materiálu pro histologické vyšetření bylo ve všech případech obtížné jak pro lokalizaci léze, tak pro rizika vyplývající z přítomnosti jaterní cirhózy. Na druhou stranu bychom bez histologické verifikace B-NHL nemohli našim pacientům přednostně zahájit protivirovou léčbu DAA nebo zahájit onkologickou léčbu. U první pacientky bychom vůbec neuvažovali o podání kombinace P/RBV/BOC vzhledem k předchozí nedobré toleranci léčby P/RBV.
Závěr
Na popsaných třech případech pacientů s chronickou HCV infekcí a HCV asciovaným B-NHL jsme kromě přínosu protivirové léčby DAA chtěli demonstrovat přínos pravidelného provádění ultrasonografií jater v rámci detekce časného HCC u pacientů s jaterní cirhózou i pro časnou detekci B-NHL. Třetím faktem, který jsme chtěli zdůraznit, je nutnost histologické verifikace ložiskového postižení jater, které nesplňuje kritéria pro diagnózu HCC, i za cenu opakování cílených biopsií nebo získání materiálu při laparoskopii.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 3. 3. 2017
Přijato: 17. 3. 2017
MUDr. Jan Šperl, CSc.
Klinika hepatogastroenterologie
Transplantcentrum, IKEM
Vídeňská 1958/9
140 21 Praha 4
jan.sperl@ikem.cz
Sources
1. Asselah T, Bièche I, Sabbagh A et al. Gene expression and hepatitis C virus infection. Gut 2009; 58 (6): 846–858. doi: 10.1136/gut.2008.166348.
2. Poynard T, Ratziu V, Charlotte F et al. Rates and risk factors of liver fibrosis progression in patients with chronic hepatitis C. J Hepatol 2001; 34 (5): 730–739.
3. Paydas S. Hepatitis C virus and lymphoma. Crit Rev Oncol Hematol 2015; 93 (3): 246–256. doi: 10.1016/j.critrevonc. 2014.10.008.
4. Paydas S, Kilic B, Yavuz S et al. Anti-HCV and HCV-RNA prevalence and clinical correlations in cases with non-Hodgkin’s lymphoma. Am J Hematol 2003; 74 (2): 89–93. doi: 10.1002/ajh.10386.
5. Rosa D, Saletti G, De Gregorio E et al. Activation of naive B lymphocytes via CD81, a pathogenetic mechanism for hepatitis C virus-associated B lymphocyte disorders. Proc Natl Acad Sci U S A 2005; 102 (51): 18544–18549. doi: 10.1073/pnas. 0509402 102.
6. Machida K, Cheng KT, Pavio N et al. Hepatitis C virus E2-CD81 interaction induces hypermutation of the immunoglobulin gene in B cells. J Virol 2005; 79 (13): 8079 – –8089. doi: 10.1128/JVI.79.13.8079-8089. 2005.
7. Durand T, Di Liberto G, Colman H et al. Occult infection of peripheral B cells by hepatitis C variants which have low translational efficiency in cultured hepatocytes. Gut 2010; 59 (7): 934–942. doi: 10.1136/ gut.2009.192088.
8. Arcaini L, Varettoni M, Boveri E et al. Distinctive clinical and histological features of Waldenstrom‘s macroglobulinemia and splenic marginal zone lymphoma. Clin Lymphoma Myeloma Leuk 2011; 11 (1): 103–105. doi: 10.3816/CLML.2011.n. 020.
9. Arcaini L, Merli M, Volpetti S et al. Indolent B-cell lymphomas associated with HCV infection: clinical and virological features and role of antiviral therapy. Clin Dev Immunol 2012; 2012 : 638185. doi: 10.1155/2012/638185.
10. Visco C, Finotto S. Hepatitis C virus and diffuse large B-cell lymphoma: Pathogenesis, behavior and treatment. World J Gastroenterol 2014; 20 (32): 11054–11061. doi: 10.3748/wjg.v20.i32.11054.
11. Gisbert JP, Garcia-Buey L, Arranz R et al. The prevalence of hepatitis C virus infection in patients with non-Hodgkin’s lymphoma. Eur J Gastroenterol Hepatol 2004; 16 (2): 135–138.
12. Dal Maso L, Franceschi S. Hepatitis C virus and risk of lymphoma and other lymphoid neoplasms: a meta-analysis of epidemiologic studies. Cancer Epidemiol Biomarkers Prev 2006; 15 (11): 2078–2085. doi: 10.1158/1055-9965.EPI - 06-0308.
13. de Sanjose S, Benavente Y, Vajdic CM et al. Hepatitis C and non-Hodgkin lymphoma among 4784 cases and 6269 controls from the International Lymphoma Epidemiology Consortium. Clin Gastroenterol Hepatol 2008; 6 (4): 451–458. doi: 10.1016/j.cgh.2008.02.011.
14. Hermine O, Lefrère F, Bronowicki JP et al. Regression of splenic lymphoma with villous lymphocytes after treatment of hepatitis C virus infection. N Engl J Med 2002; 347 (2): 89–94. doi: 10.1056/NEJMoa013 376.
15. Kelaidi C, Rollot F, Park S et al. Response to antiviral treatment in hepatitis C virus-associated marginal zone lymphomas. Leukemia 2004; 18 (10): 1711–1716. doi: 10.1038/sj.leu.2403443.
16. Sultanik P, Klotz C, Brault P et al. Regression of an HCV-associated disseminated marginal zone lymphoma under IFN-free antiviral treatment. Blood 2015; 125 (15): 2446–2447. doi: 10.1182/blood - 2014-12-618652.
17. Rossotti R, Travi G, Pazzi A et al. Rapid clearance of HCV-related splenic marginal zone lymphoma under an interferon-free, NS3/NS4A inhibitor-based treatment. A case report. J Hepatol 2015; 62 (1): 234–237. doi: 10.1016/j.jhep.2014.09. 031.
18. Vallisa D, Bernuzzi P, Arcaini L et al. Role of anti-hepatitis C virus (HCV) treatment in HCV-related, low-grade, B-cell, non-Hodgkin’s lymphoma: a multicenter Italian experience. J Clin Oncol 2005; 23 (3): 468–473. doi: 10.1200/JCO.2005.06. 008.
19. Manns MP, McHutchison JG, Gordon SC et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001; 358 (9286): 958–965.
20. Fried MW, Shiffman ML, Reddy KR et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347 (13): 975–982. doi: 10.1056/NEJMoa020047.
21. Bacon BR, Gordon SC, Lawitz E et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med 2011; 364 (13): 1207–1217. doi: 10.1056/NEJMoa1009482.
22. Kwo PY, Lawitz EJ, McCone J et al. Efficacy of boceprevir, an NS3 protease inhibitor, in combination with peginterferon alfa-2b and ribavirin in treatment-naive patients with genotype 1 hepatitis C infection (SPRINT-1): an open-label, random - ised, multicentre phase 2 trial. Lancet 2010; 376 (9742): 705–716. doi: 10.1016/ S0140-6736 (10) 609 34-8.
23. Hézode C, Fontaine H, Dorival C et al. Effectiveness of telaprevir or boceprevir in treatment-experienced patients with HCV genotype 1 infection and cirrhosis. Gastroenterology 2014; 147 (1): 132–142. doi: 10.1053/j.gastro.2014.03.051.
24. Feld JJ, Moreno C, Trinh R et al. Sustained virologic response of 100% in HCV genotype 1b patients with cirrhosis receiving ombitasvir/paritaprevir/r and dasabuvir for 12weeks. J Hepatol 2016; 64 (2): 301–307. doi: 10.1016/j.jhep.2015.10.005.
25. EASL. EASL–EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2012; 56 (4): 908–943. doi: 10.1016/j.jhep.2011.12.001.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2017 Issue 2-
All articles in this issue
- Hepatologie
- Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu akutních porfyrií
- Léčba krvácení v důsledku portální hypertenze při jaterní cirhóze – aktualizace doporučených postupů ČHS ČLS JEP
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C
- Přímo působící antivirotika v léčbě HCV asociovaných maligních lymfomů
- Dysfágia po prednej krčnej diskektómii a intersomatickej fúzii
- První případ elektrické stimulační terapie dolního jícnového svěrače indikovaný v České republice k implantaci
- Výběr z mezinárodních časopisů
- Picoprep® – očistný prostředek s novým dávkovacím schématem
- Ustekinumab – nová biologická léčba pro pacienty s Crohnovou chorobou
- Mechanizmy vzniku motorických a evakuačních poruch při gastroezofageální refluxní chorobě se souběžnou obezitou
-
Developments in digestive endoscopy
Andrea May, Marco Bruno and Bjorn Rembacken Lectures – Gastro Update Europe 2016, Prague
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ustekinumab – nová biologická léčba pro pacienty s Crohnovou chorobou
- Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu akutních porfyrií
- Picoprep® – očistný prostředek s novým dávkovacím schématem
- Léčba krvácení v důsledku portální hypertenze při jaterní cirhóze – aktualizace doporučených postupů ČHS ČLS JEP
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

