-
Medical journals
- Career
Transjugulární intrahepatální portosytémová spojka v terapii refrakterního ascitu: současný pohled jednoho pracoviště
Authors: T. Fejfar 1; V. Šafka 2; V. Jirkovský 1; T. Vaňásek 1; Š. Šembera 1; Miroslav Lojík 3; J. Raupach 3; V. Chovanec 3; O. Renc 3; A. Michl 3; J. Žižka 3; A. Krajina 3; P. Hůlek 1,4
Authors‘ workplace: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; Ústav fyziologie, LF UK Hradec Králové 2; Radiologická klinika FN Hradec Králové 3; Interní klinika LF OU, Ostrava 4
Published in: Gastroent Hepatol 2014; 68(2): 124-131
Category: Hepatology: Review article
Overview
Ascites a refrakterní ascites je jednou z nejzávažnějších komplikací portální hypertenze a jeho rozvoj je spojen s vysokou úmrtností. V případě refrakterity na léčbu zůstává jako léčebná modalita jaterní transplantace, provádění velkoobjemových paracentéz se substitucí albuminu nebo nechirurgické vytvoření portokaválního zkratu – transjugulární intrahepatální portosystémové spojky (TIPS). Místo v indikaci TIPS je stále diskutovaným tématem. Autoři přinášejí současný náhled na problematiku terapie refrakterního ascitu i vlastní zkušenosti s touto terapií u 361 nemocných v období posledních 22 let.
Klíčová slova:
portální hypertenze – refrakterní ascites – transjugulární intrahepatální portosystémová spojkaPřehled problematiky
Tvorba ascitu (volné tekutiny v dutině břišní) patří spolu s varikózním krvácením a jaterní encefalopatií mezi nejčastější a nejzávažnější komplikace portální hypertenze [1], která je i jeho nejčastější příčinou. V rámci diferenciální diagnostiky je ale třeba vyloučit i jiné možné příčiny, zejména srdeční selhávání, tumorózní nebo zánětlivé postižení peritonea nebo komplikovanou pankreatitidu.
V Evropě je nejčastějším patofyziologickým podkladem závažné portální hypertenze jaterní cirhóza (více než 80 %), méně častou příčinou bývá Budd-Chiari syndrom, venookluzivní choroba jater nebo prehepátální portální hypertenze.
Přesné patofyziologické mechanizmy nejsou dosud zcela známé. Jedním ze zásadních mechanizmů podílejících se na tvorbě ascitu u nemocných s jaterní cirózou jsou ale oběhové změny provázející asociovanou splachnickou vazodilataci se zvýšením minutového srdečního výdeje a zvětšením objemu extracelulární tekutiny s retencí sodíku. Posléze dochází ke snížení efektivního intravaskulárního objemu s aktivací sympatického nervového systému (SNS), osy renin-angiotenzin-aldosteron (RAAS) a nadprodukcí adiuretinu (ADH) s retencí volné vody. Dochází k překročení poměru transudace/reabsorbce s akumulací ascitické tekutiny [2].
Klinicky dělíme ascites do tří stadií. První – ascites zjistitelný pouze zobrazovacím vyšetřením, druhé – ascites zjistitelný fyzikálním vyšetřením a vyžadující léčbu diuretiky s restrikcí sodíku v dietě a třetí – objemný až tenzní ascites. Riziko přechodu kompenzovaného stadia cirhózy do stadia dekompenzovaného s tvorbou ascitu je vysoké. V závislosti na progresi základního onemocnění se ascites objeví do 10 let od diagnózy jaterní cirhózy u 50–60 % nemocných [1,3]. Rozvoj ascitu je i významným negativním prognostickým ukazatelem. Pravděpodobnost úmrtí nemocných ve III. klinickém stadiu dle D´Amica, kam nemocní s ascitem patří, dosahuje v horizontu jednoho roku 20–40 % [3–7]. Mezi další prognostické ukazatele spolu s Child-Pugh a MELD skóre [8–10] patří i hodnoty natria a kreatininu v séru a hodnoty středního arteriálního tlaku [4,11]. Riziko dekompenzace velmi dobře odráží i hodnoty invazivně měřeného tlakového gradientu v jaterních žilách (hepatic venous pressure gradient – HVPG).
Při další progresi jaterního onemocnění dochází k vyčerpání kompenzačních mechanizmů. Zprvu zvýšený minutový srdeční výdej klesá, stupňuje se aktivita SNS, RAAS a ADH, rozvíjí se diluční hyponatremie a ascites přestává odpovídat na diuretickou léčbu. Hovoříme o refrakterním ascitu. Medián přežívání těchto nemocných se dále zkracuje a nepřesahuje šest měsíců [4]. Z klinického pohledu hovoříme o ascitu rezistentním nebo intraktabilním. Rezistentní je označován v případě, že k adekvátní mobilizaci tekutin nedochází ani při maximálních doporučených dávkách kombinované diuretické léčby (spironolakton, furosemid). Jako ascites intraktabilní pak v případě, že tato léčba nemůže být podávána pro závažné nežádoucí účinky (tab. 1) [12].
Table 1. Kritéria refrakterního ascitu dle International ascitic club 2003 [12,17]. Tab. 1. Diagnostic criteria of refractory ascites according to International ascitic club 2003 [12,17]. ![Kritéria refrakterního ascitu dle International ascitic club 2003 [12,17].
Tab. 1. Diagnostic criteria of refractory ascites according to International ascitic club 2003 [12,17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b7aec1925c1f377bb5ca9f24755a8412.png)
S přítomností ascitu se druží i další komplikace. Nemocní jsou v riziku rozvoje spontánní bakteriální peritonitidy (SBP). U hospitalizovaných nemocných je její výskyt vysoký (10–30 %) [13,14]. Diagnostická punkce se stanovením hodnoty polymorfonukleárních leukocytů a kultivačním vyšetřením ascitu je proto standardem péče o každého cirhotika s ascitem. I u adekvátně léčených nemocných ale dále zhoršuje jejich prognózu [15–17]. Úmrtnost epizody SBP dosahuje 10–30 % [13,18].
Další závažnou komplikací spojenou s progresí základního onemocnění je rozvoj hepatorenálního syndromu jak II. (pomalu progredujícího), tak I. typu (rychle progredujícího) [19]. Výskyt je udáván u 20 % nemocných s acitem v průběhu jednoho roku a objevuje se zejména u nemocných s již rozvinutou diluční hyponatremií a nízkým systémovým krevním tlakem [20]. Prognóza je velmi závažná s mediánem přežívání dva týdny u I. typu a šest měsíců u II. typu [20,21]. Na léčbu albuminem a vazokonstriktory odpoví jen část nemocných [22] a prognóza zůstává obecně nepříznivá.
U 5–10 % nemocných s acitem můžeme též nalézt klinicky významný, převážně pravostranný hydrothorax. Odpověď na kombinovanou léčbu diuretiky bývá v tomto případě horší než u nemocných s ascitem [23,24].
Léčba refrakterního ascitu zahrnuje provádění velkoobjemových paracentéz se substitucí albuminu (large volume paracentesis – LVP), v případě možnosti navození adekvátní natriurézy i podávání diuretik, provedení transjugulární intrahepatální portosystémové spojky (TIPS) a jaterní transplantaci [17].
Jaterní transplantace by měla být zvážena u všech nemocných s ascitem, zejména ascitem refrakterním na prvním místě.
Velkoobjemové paracentézy jsou efektivní a bezpečnou terapií za předpokladu současné substituce albuminu v doporučované a v prospektivních studiích ověřené dávce (8 g na litr vypuštěného ascitu) [12,16,17]. Jedná se však o léčbu čistě symptomatickou.
Vytvoření TIPS jako side-to-side portosystémové spojky vede k dekompresi portálního řečiště se snížením portosystémového gradientu. Následkem toho dochází ke snížení aktivity RAAS, ADH a SNS [25–27] a zvýšení efektivního intravaskulárního objemu. Tím je ovlivněn základní patofyziologický mechanizmus tvorby ascitu. Zlepšuje se perfuze ledvin, zvyšuje se natriuréza a ve vysokém procentu dochází k mobilizaci ascitické tekutiny. Léčba pomocí TIPS má však své limitace a jako každý výkon relativní i absolutní kontraindikace. Mezi ně patří zejména výraznější pokročilost jaterního onemocnění s Child-Pugh skóre 12 a více, MELD nad 18 a u nemocných s ascitem zejména kontraindikace kardiovaskulární (závažná plicní hypertenze, pokročilá srdeční insuficience) [28,29]. U nemocných s elevací kreatininu a vysokým MELD skóre je ale na druhou stranu nutno brát zřetel na možný podíl hepatorenálního selhávání, které pokročilost stanovenou pomocí MELD skóre nadhodnocuje [30].
Místo TIPS v terapii refrakterního ascitu je stále v některých otázkách diskutováno. Dosud byly publikovány výsledky šesti prospektivních randomizovaných studií porovnávajících TIPS s LVP celkem u 390 nemocných (tab. 2) [26,27,31–34].
Table 2. Prospektivní randomizované studie porovnávající velkoobjemové paracentézy (LVP) s TIPS v léčbě refrakterního ascitu. TÚ – technická úspěšnost výkonu, HRS – hepatorenální syndrom, NS – nesignifikantní, NR – nebylo uvedeno; a) p = 0,008; b) p = 0,02; c) p = 0,03 (lepší přežití ve skupině LVP); d) p = 0,02; e) p = 0,021 hodnoceno ve 24 měsících; f) p < 0,005 – hodnoceno ve 12 a 24 měsících Tab. 2. Prospective randomised trials comparing large volume paracentesis (LVP) and TIPS in the therapy of refractory ascites. TU – procedure success rate, HRS – hepatorenal syndrome, NS – nonsignificant, NR – not reported; a) p = 0.008; b) p = 0.02; c) p = 0.03 (better survival in LVP group); d) p = 0.02; e) p = 0,021 assessed at 24 months; f) p < 0,005 – assessed at 12 and 24 months 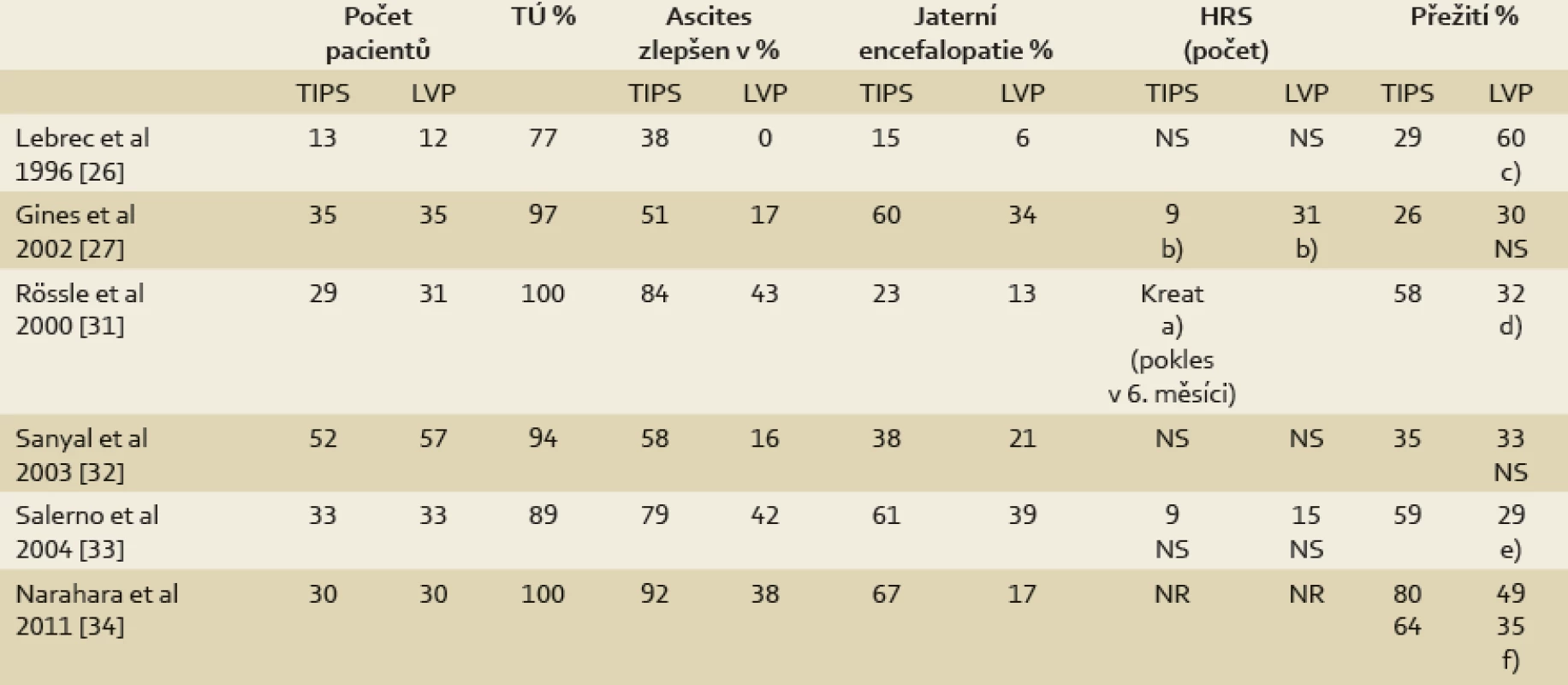
Všechny studie se shodují na signifikantně vyšším efektu na kontrolu ascitu bez nutnosti paracentéz u nemocných s TIPS, ale současně na vyšším výskytu jaterní encefalopatie. Rozvoj jaterní encefalopatie je ale z části ovlivnitelný průměrem zkratu [30].
Ani mezi experty nepanuje shoda v interpretaci výsledků studií hodnotící vliv na přežívání [30,35–38]. První Lebrecova studie na rozdíl od všech následujících ukázala zhoršené přežívání nemocných po TIPS v porovnání s LVP, zejména u pacientů s pokročilejším jaterním onemocněním ve skupině C dle Childa a Pugha [26]. Diskutovanou slabinou této studie je zejména absence vylučovacích kritérií stran pokročilosti jaterního onemocnění a výrazně nižší technická úspěšnost zákroku v porovnání s pozdějšími pracemi i běžnou klinickou praxí. Studie však přinesla první, velmi zajímavé výsledky týkající se hemodynamických změn a humorální odpovědi po TIPS [26]. Naproti tomu tři pozdější práce v hodnocení vlivu na přežívání přinesly výsledky zcela opačné [30,33,34]. Největší studie severoamerická a studie španělských autorů rozdíly v přežívání u obou metod nepotvrdily (tab. 2) [27,32], stejně jako následně provedené multivariantní analýzy zahrnující prvních pět studií (včetně první studie Lebrecovy) [35–37]. Naopak následná multivariantní analýza při vyloučení diskutabilní Lebrecovy práce a hodnocení individuálních dat pacientů již favorizovala TIPS před LVP nejen stran snížení rizika hepatorenálního selhávání, ale i celkového přežívání [39]. Přesto je dle současných doporučení EASL jako metoda první volby doporučována velkoobjemová paracentéza.
Jak ukazuje ale i poslední randomizovaná studie, při tvrdších indikačních kritériích vylučujících pokročilejší nemocné po stránce jaterní insuficience mohou být výsledky přežívání signifikantně lepší.
Současně je třeba mít na paměti zmíněný příznivý efekt TIPS na snížení aktivity SNS, ADH a RAAS a renální perfuzi [26,27,31,40]. Tímto efektem i v prospektivních studiích porovnávajících TIPS s LVP došlo ke snížení výskytu HRS v TIPS skupinách [27] nebo alespoň k dlouhodobému zlepšení hodnot kreatininu [31] na rozdíl od paracentézy, která v určitém procentu i při adekvátní substituci může vést k postparacentézní dysfunkci. Data o využití TIPS v terapii HRS jsou ale bohužel sporá. Přesto např. v práci Brensinga u nemocných odpovídajících na terapii vazokonstriktorem (terlipresinem) byl pozitivní efekt na snížení úmrtnosti na 31 nemocných s HRS II. i I. typu prokázán [41]. Přesto dle dosud platných doporučení je použití TIPS v terapii hepatorenálního selhávání stále diskutovaným tématem a není obecně přijato [17,28].
Naopak u nemocných s refrakterním jaterním hydrothoraxem je TIPS považován za efektivní léčebnou alternativu s poměrně vysokou odpovědí 60–80 % [42–45].
V případě rozsáhlejších endovaskulárních zákroků, mezi které provedení TIPS beze sporu patří, je důležitá cena a cost efektivita dané terapie. Z randomizovaných studií jsou výsledky cost analýzy dostupné jen ze studie Ginese. V této práci, v podmínkách pracovišť v USA a Španělsku, v časovém horizontu dvou let vyznělo srovnání ve prospěch LVP [27].
Pro náš středoevropský region nebyla dosud studie porovnávací nákladovost obou metod provedena. V našich podmínkách se cena nekomplikovaného TIPS, zejména v závislost na použitém druhu stentu, pohybuje v úrovni 50–150 tis. Kč, naproti tomu LVP při evakuaci 6–7 litrů, za adekvátní substituce albuminem vychází přibližně na 5–6 tis. Kč na jednu paracentézu.
Zkušenosti centra v Hradci Králové
Fakultní nemocnice Hradec Králové patří od září roku 1992 mezi pracoviště, kde je transjugulární intrahepatální portosystémová spojka v rámci léčby refrakterního ascitu prováděna. Od tohoto data, do února 2014 podstoupilo léčbu refrakterního ascitu pomocí TIPS celkem 361 pacientů, z toho bylo 121 (34 %) žen (do tohoto souboru byli zařazeni i nemocní se současným recidivujícím varikózním krvácením a jaterním hydrothoraxem). Průměrný věk námi léčených pacientů byl 56 let, přičemž nejmladšímu a nejstaršímu nemocnému bylo 12 a 82 let. U všech nemocných byla tíže onemocnění klasifikována dle Child-Pugh klasifikace a později i MELD a Na-MELD skóre. Jak plyne z vlastní indikace, skupinu nemocných tvořili zejména nemocí s pokročilejší chorobou, řazení z 61 % a 39 % do skupiny B a C dle Child-Pugh. Průměrné MELD a Na-MELD skóre bylo 16 a 20 bodů (tab. 3). Jak ukazují i laboratorní hodnoty, vyšší hodnoty MELD a Na-MELD skóre plynuly z často asociované diluční hyponatremie a u některých nemocných i z počínajícího nebo již rozvinutého hepatorenálního selhávání.
Table 3. Charakteristika souboru 361 nemocných s refrakterním ascitem léčených pomocí TIPS na našem pracovišti. Hodnoty vyjádřeny jako průměr ± SD, < minimum; maximum >. Tab. 3. Characteristics of group of 361 patients with refractory ascites treated by TIPS. Values expressed as mean ± SD, < minimum; maximum >. 
Stejně jako u ostatních nemocných s diagnózou již rozvinuté jaterní cirhózy byla nejčastější příčinou jaterní léze konzumace alkoholu (63 %). Druhou a třetí nejpočetnější skupinu tvoří nemocní s neobjasněnou příčinou – 13 % a nemocní s jaterní cirhózou na podkladě chronické infekce HBV a HCV – 10 % (graf 1).
Graph 1. Etiologie jaterního onemocnění. alkohol – alkoholová cirhóza, hep B/C – cirhóza na podkladě chronické hepatitidy B a C, autoim. – autoimunitní cirhóza, kryptog. – cirhóza nejasné příčiny, B-Ch – Budd-Chiari syndrom Graph 1. Etiology of liver disease. alkohol – alcohol liver cirrhosis, hep B/C – liver cirrhosis due to hepatitis B and C, autoim. – autoimune hepatitis, kryptog. – etiology unclear, B-Ch – Budd-Chiari syndrome 
Technická úspěšnost byla na našem pracovišti vysoká a přesahovala 99 %. Jen u třech nemocných se v této indikaci nepodařilo zkrat vytvořit, u dvou pro asociovanou prehepatální portální hypertenzi s kavernomem porty a u jedné nemocné pro závažné technické komplikace. Jejich stav byl dále řešen pokračováním v paracentézách, provedením peritoneovenózního zkratu a jaterní transplantací.
Průměrný portosystémový gradient v celé skupině léčených byl před výkonem 21 mmHg a výkonem došlo k jeho redukci v průměru na 8 mmHg. To znamená snížení o 60 % (graf 2). Při výkonu pro refrakterní ascites je vždy snahou snížení gradientu nejen pod 12 mmHg jako u nemocných s varikózním krvácením, ale spíš pod 10 mmHg. Za celé sledované období od roku 1992 došlo k výraznému vývoji a změně spektra používaných stentů, zejména k posunu od nepotahovaných ke stentům potaženým ePTFE (graf 3).
Graph 2. Hodnoty tlaků před a po TIPS. JŽ – jaterní žíla, PŽ – portální žíla, PSG – portosystémový gradient, hodnoty tlaků uváděny v milimetrech rtuti, snížení portosystémového gradientu o 60 % Graph 2. Values of pressure before and post TIPS. JŽ – hepatic vein, PŽ – portal vein, PSG – portosystemic gradient, values expressed in mmHg, reduction of portosystemic gradient by 60% 
Graph 3. Spektrum použitých stentů (v letech 1992–2014). ePTFE – expandovaný polytetra fluoroethylen Graph 3. Used stents (from 1992 to 2014). ePTFE – expanded polytetrafluoroethylen 
Standardním postupem po výkonu bylo sledování nemocných ve 3–6měsíčních intervalech. Průměrná doba sledování u našich nemocných dosud činí 23,2 měsíce. Efekt na ascites byl hodnocen měsíc po vytvoření zkratu a dále během sledování. Zhodnocení nemohlo být provedeno u nemocných, kteří do jednoho měsíce zemřeli, a u nemocných, kteří vypadli ze sledování a nepodstoupili ani jednu ambulantní kontrolu (celkem 19 %) (graf 4A).
Graph 4. Efekt TIPS na ascites. A – všichni nemocní, B – hodnocení nemocní (nejsou zobrazeni nemocní kteří zemřeli do 1 měsíce, nebo nebyly dostupné informace o efektu na ascites), kompletní mob. – úplná mobilizace ascitu, recid. se sten. – recidiva ascitu spojená se stenózou TIPS Graph 4. Effect of TIPS on ascites. A – all patients, B – assessed patients (patients died up to one month and lost in folow up are not reported), kompletní mob. – complete effect on ascites, recid. se sten. – recurrence of ascites due to TIPS stenosis 
U hodnocených nemocných došlo ke kompletnímu vymizení ascitu u 49 % a u 31 % nemocných byl dále po výkonu ascites dobře kontrolován podávanými diuretiky. U 17 % nemocných došlo v průběhu sledování ke klinicky významné recidivě ascitu v souvislosti se stenózou zkratu, která byla uspokojivě řešitelná reintervencí s dobrou odpovědí. Pouze u 3 % nemocných musela být dále prováděna terapie pomocí LVP (graf 4B), přičemž sedm z těchto nemocných tvořili pacienti s pokračujícím významným abúzem alkoholu a závažnou progresí jaterní insuficience. Tyto výsledky jsou více než srovnatelné s publikovanými daty.
Přežívání nemocných v našem souboru včetně časné jedno - a tříměsíční úmrtnosti také odpovídá publikovaným údajům. V jednom, třech, šesti a dvanácti měsících přežívalo 88,7 %, 76 %, 68,5 % a 56,8 % nemocných. Jaterní transplantaci následně podstoupilo 21 nemocných. Kumulativní přežívání dle Kaplan-Meiera v celé skupině ve 24 měsících přesahovalo 48 % (graf 5).
Graph 5. Kumulativní přežívání (Kaplan-Meier) v celé skupině nemocných po TIPS pro refrakterní ascites. CI – konfidenční interval, přežívání uvedeno v %. Graph 5. Cumulative survival (Kaplan-Meier) in whole group patients undergone TIPS for refractory ascites. CI – confidence interval, survival expressed in %. 
Při rozdělení nemocných do dvou podskupin dle Child-Pugh skóre je patrné očekávané horší přežívání nemocných ve skupině C, ale nedosahuje statistické významnosti (graf 6) na rozdíl od dělení nemocných dle MELD (MELD pod 18 a MELD 18 a více) (graf 7). Tento rozdíl opět odpovídá publikovaným údajům favorizujícím MELD skóre před Child-Pugh klasifikací u nemocných s refrakterním ascitem a odráží význam hodnot kreatininu pro stratifikaci nemocných [9,10,30]. To je jedním z problémů správné indikace nemocných k výkonu. I při lepší predikci pomocí MELD není znám jednoznačný ukazatel nebo skupina ukazatelů, které by s vysokou prediktivní silou jednoznačně určovaly vhodné a méně vhodné kandidáty výkonu.
Graph 6. Kumulativní přežívání po TIPS pro refrakterní ascites v podskupinách B a C dle Childa a Pugha (Kaplan-Meier). Není signifikantní rozdíl v přežívání mezi podskupinami – log-rank test. Graph 6. Cumulative survival after the TIPS for refractory ascites in subgroups acording to Child-Pugh (Kaplan-Meier). Non-significant difference – log-rank test. 
Graph 7. Kumulativní přežívání po TIPS pro refrakterní ascites v podskupinách dle MELD skóre (Kaplan-Meier). Je signifikantní rozdíl v přežívání mezi podskupinami – log-rank test. Graph 7. Cumulative survival after the TIPS for refractory ascites in subgroups acording to MELD score (Kaplan-Meier). Significant difference in survival – log-rank test. 
Po provedení zákroku je jako u jiných nemocných zcela zásadní jejich další sledování s pokračováním terapie základního onemocnění a u nemocných s alkoholovou etiologií motivace k trvalé abstinenci. Následná péče o nemocné se zkratem sestává zejména z prevence nebo terapie přidružené jaterní encefalopatie, infekcí a samozřejmě sledování průchodnosti spojky pomocí ultrazvuku spolu se současným vyhledáváním hepatocelulárního karcinomu. Na rozdíl od nemocných indikovaných k výkonu pro varikózní krvácení jsou většinou dostatečné ultrazvukové, klinické a laboratorní kontroly bez nutnosti provádění kontrolních endoskopických vyšetření. Při každé z kontrol je samozřejmostí i hodnocení stavu nemocného s ohledem k možné indikaci k transplantaci jater.
Závěr
V současné době lze jistě říci, že transjugulární intrahepatální portosystémová spojka je již zavedenou metodou v terapii refrakterního ascitu a cirhotického pohrudničního výpotku. Jisté rezervy jsou stále ve výběru nemocných s maximálním profitem. V současných podmínkách je v popředí i otázka cost efektivity dané terapie. Vstupní finanční zátěž u nemocných léčených pomocí TIPS je samozřejmě vysoká, na druhou stranu je třeba mít na paměti, že provádění velkoobjemových paracentéz bez adekvátní substituce finančně náročným albuminem dnes již nelze považovat za terapii lege artis.
Podpořeno projektem MZ koncepčního rozvoje výzkumné organizace 00179906 a Evropským sociálním fondem a státním rozpočtem České republiky. CZ.1.07/2.3.00/20.054, HEPIN II.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 1. 3. 2014
Přijato: 7. 4. 2014
MUDr. Tomáš Fejfar Ph.D.
II.interní gastroenterologická klinika
LF UK a FN Hradec Králové
tomas.fejfar@fnhk.cz
Sources
1. Ginés P, Quintero E, Arroyo V et al. Compensated cirrhosis: natural history and prognostic factors. Hepatology 1987; 7(1): 122–128.
2. Šafka V. Patofyziologie portální hypertenze. In: Ehrmann J, Hůlek P. Hepatologie. 1. ed. Praha: Grada Publishing 2010.
3. Garcia-Tsao G. D´Amico G. Predictive models in portal hypertension In: de Franchis R et al. Portal hypertension IV: proceedings of the fourth Baveno International Consensus Workshop. London: Blackwell Publishing 2006.
4. Guevara M, Cárdenas A, Uriz J et al. Prognosis in patients with cirrhosis and ascites. In: Gines P, Arroyo V, Rodés J et al (eds). Ascites and renal dysfunction in liver disease: pathogenesis, diagnosis and treatment. Malden, Mass, USA: Blackwell 2005 : 260–270.
5. Arroyo V, Gines P, Gerbes AL et al. Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. International Ascites Club. Hepatology 1996; 23(1): 164–176.
6. Salerno F, Borroni G, Moser P et al. Survival and prognostic factors of cirrhotic patients with ascites: a study of 134 outpatients. Am J Gastroenterol 1993; 88(4): 514–519.
7. Guardiola J, Baliellas C, Xiol X et al. External validation of a prognostic model for predicting survival of cirrhotic patients with refractory ascites. Am J Gastroenterol 2002; 97(9): 2374–2378.
8. Moreau R, Delegue P, Pessione F et al. Clinical characteristics and outcome of patients with cirrhosis and refractory ascites. Liver Int 2004; 24(5): 457–464.
9. Kamath PS, Wiesner RH, Malinchoc M et al. A model to predict survival in patients with end-stage liver disease. Hepatology 2001; 33(2): 464–470.
10. Fejfar T, Safka V, Hůlek P et al. MELD score in prediction of early mortality in patients suffering refractory ascites treated by TIPS. Vnitr Lek 2006; 52(9): 771–776.
11. Llach J, Gines P, Arroyo V et al. Prognostic value of arterial pressure, endogenous vasoactive systems and renal function in cirrhotic patiens admitted to the hospital for the treatment of ascites. Gastroenterology 1988; 94(2): 482–487.
12. Moore KP, Wong F, Gines P et al. The management of ascites in cirrhosis: report on the consensus conference of the International Ascites Club. Hepatology 2003; 38(1): 258–266.
13. Navasa M, Rodés J. Bacterial infections in cirrhosis. Liver Int 2004; 24(4): 277–280.
14. Lata J, Fejfar T, Krechler T et al. Spontaneous bacterial peritonitis in the Czech Republic: prevalence and aetiology. Eur J Gastroenterol Hepatol 2003; 15(7): 739–743.
15. Runyon BA. Introduction to the revised American Association for the Study of Liver Diseases Practice Guideline management of adult patients with ascites due to cirrhosis 2012. Hepatology 2013; 57(4): 1651–1653. doi: 10.1002/hep.26359.
16. Runyon BA. Management of adult patients with ascites due to cirrhosis: an update. Hepatology 2009; 49(6): 2087–2107. doi: 10.1002/hep.22853.
17. European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53(3): 397–417. doi: 10.1016/j.jhep.2010.05.004.
18. Sort P, Navasa M, Arroyo V et al. Effect of intravenous albumin on renal mpairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999; 341(6): 403–409.
19. Cárdenas A, Ginés P. Hepatorenal Syndrome: Current Concepts. In: De Francis R et al. Portal hypertension IV: proceedings of the fourth Baveno International Consensus Workshop. London: Blackwell Publishing 2006.
20. Gines A, Escorsell A, Gines P et al. Incidence, predictive factors, and prognosis of the hepatorenal syndrome in cirrhosis with ascites. Gastroenterology 1993; 105(1): 229–236.
21. Gines P, Guevara M, Arroyo V et al. Hepatorenal syndrome. Lancet 2003; 362(9398): 1819–1827.
22. Gluud LL, Christensen K, Christensen E et al. Systematic review of randomized trials on vasoconstrictor drugs for hepatorenal syndrome. Hepatology 2010; 51(2): 576–584. doi: 10.1002/hep.23286.
23. Strauss RM, Boyer TD. Hepatic hydrothorax. Semin Liver Dis 1997; 17(3): 227–232.
24. Kiafar C, Gilani N. Hepatic hydrothorax: current concepts of pathophysiology and treatment options. Ann Hepatol 2008; 7(4): 313–320.
25. Hůlek P, Krajina A (eds). Current Practice of TIPS. Hradec Králové: Olga Štambergová 2001.
26. Lebrec D, Giuily N, Hadengue A et al. Transjugular intrahepatic portosystemic shunts: comparison with paracentesis in patients with cirrhosis and refractory ascites: a randomized trial. French Group of Clinicians and a Group of Biologists. J Hepatol 1996; 25(2): 135–144.
27. Gines P, Uriz J, Calahorra B et al. Transjugular intrahepatic portosystemic shunting versus paracentesis plus albumin for refractory ascites in cirrhosis. Gastroenterology 2002; 123(6): 1839–1847.
28. Boyer TD, Haskal ZJ. The Role of Transjugular Intrahepatic Portosystemic Shunt (TIPS) in the Management of Portal Hypertension: update 2009. Hepatology 2010; 51(1): 306. doi: 10.1002/hep.23383.
29. Krajina A, Hulek P, Fejfar T et al. Quality improvement guidelines for Transjugular Intrahepatic Portosystemic Shunt (TIPS). Cardiovasc Intervent Radiol 2012; 35(6): 1295–1300. doi: 10.1007/s00270-012-0493-y.
30. Rössle M, Gerbes AL. TIPS for the treatment of refractory ascites, hepatorenal syndrome and hepatic hydrothorax: a critical update. Gut 2010; 59(7): 988–1000. doi: 10.1136/gut.2009.193227.
31. Rössle M, Ochs A, Gülberg V et al. A comparison of paracentesis and transjugular intrahepatic portosystemic shunting in patients with ascites. N Engl J Med 2000; 342(23): 1701–1707.
32. Sanyal AJ, Genning C, Reddy KR et al. The North American Study for the Treatment of Refractory Ascites. Gastroenterology 2003; 124(3): 634–641.
33. Salerno F, Merli M, Riggio O et al. Randomized controlled study of TIPS versus paracentesis plus albumin in cirrhosis with severe ascites. Hepatology 2004; 40(3): 629–635.
34. Narahara Y, Kanazawa H, Fukuda T et al. Transjugular intrahepatic portosystemic shunt versus paracentesis plus albumin in patients with refractory ascites who have good hepatic and renal function: a prospective randomized trial. J Gastroenterol 2011; 46(1): 78–85. doi: 10.1007/s00535-010-0282-9.
35. Albillos A, Banares R, González M et al. A meta-analysis of transjugular intrahepatic portosystemic shunt versus paracentesis for refractory ascites. J Hepatol 2005; 43(6): 990–996.
36. Deltenre P, Mathurin P, Dharancy S et al. Transjugular intrahepatic portosystemic shunt in refractory ascites: a meta-analysis. Liver Int 2005; 25(2): 349–356.
37. Saab S, Nieto JM, Lewis SK et al. TIPS versus paracentesis for cirrhotic patients with refractory ascites. Cochrane Database Syst Rev 2006; 4: CD004889.
38. D’Amico G, Luca A, Morabito A et al. Uncovered transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis. Gastroenterology 2005; 129(4): 1282–1293.
39. Salerno F, Camma C, Enea M et al. Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patient data. Gastroenterology 2007; 133(3): 825–834.
40. Guevara M, Ginès P, Bandi JC et al. Transjugular intrahepatic portosystemic shunt in hepatorenal syndrome: effects on renal function and vasoactive systems. Hepatology 1998; 28(2): 416–422.
41. Brensing KA, Textor J, Perz J et al. Long term outcome after transjugular intrahepatic portosystemic stent-shunt in non-transplant cirrhotics with hepatorenal syndrome: a phase II study. Gut 2000; 47(2): 288–295.
42. Siegerstetter V, Deibert P, Ochs A et al. Treatment of refractory hepatic hydrothorax with transjugular intrahepatic portosystemic shunt: long-term results in 40 patients. Eur J Gastroenterol Hepatol 2001; 13(5): 529–534.
43. Spencer EB, Cohen DT, Darcy MD. Safety and efficacy of transjugular intrahepatic portosystemic shunt creation for the treatment of hepatic hydrothorax. J Vasc Interv Radiol 2002; 13(4): 385–390.
44. Wilputte JY, Goffette P, Zech F et al. The outcome after transjugular intrahepatic portosystemic shunt (TIPS) for hepatic hydrothorax is closely related to liver dysfunction: a long-term study in 28 patients. Acta Gastroenterol Belg 2007; 70(1): 6–10.
45. Dhanasekaran R, West JK, Gonzales PC et al. Transjugular intrahepatic portosystemic shunt for symptomatic refractory hepatic hydrothorax in patients with cirrhosis. Am J Gastroenterol 2010; 105(3): 635–641. doi: 10.1038/ajg.2009.634.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2014 Issue 2-
All articles in this issue
- 1 000 TIPS ve FN Hradec Králové: indikace a přežívání nemocných
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
- Transjugulární intrahepatální portosytémová spojka v terapii refrakterního ascitu: současný pohled jednoho pracoviště
- Dispenzarizace nemocných po zavedení transjugulární intrahepatální portosystémové spojky – diagnostika dysfunkce zkratu a možnosti intervence
- Transplantace jater pro hepatocelulární karcinom, dlouhodobé přežití a faktory ovlivňující rekurenci tumoru (zkušenosti jednoho centra)
- Využití EUS navigované choledochoduodenostomie v léčbě biliární obstrukce
- Hereditárny angioedém ako príčina bolestí brucha
- Moderní diagnostika Lynchova syndromu
- EUS workshop v Jablonci nad Nisou
- 13th Czech-Slovak IBD symposium
- 9th Congress of ECCO, Copenhagen, Denmark
- Oznámení
- Omluva
- Remsima™ – první biosimilární infliximab
- Hepatologie nejen z Hradce Králové
- Léčba portální hypertenze pomocí transjugulární intrahepatální portosystémové spojky – prvních 1 000 výkonů ve FN Hradec Králové
- Malígny melanóm konečníka – zriedkavá kazuistika a prehľad literatúry
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Budd-Chiari syndrom a TIPS – 21 let zkušeností
- Hereditárny angioedém ako príčina bolestí brucha
- Léčba portální hypertenze pomocí transjugulární intrahepatální portosystémové spojky – prvních 1 000 výkonů ve FN Hradec Králové
- Moderní diagnostika Lynchova syndromu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

