-
Medical journals
- Career
Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
Authors: I. Krajčovičová 1; E. Bolješíková 2; M. Šándorová 2
Authors‘ workplace: I. onkologická klinika LF UK v Bratislave, Onkologický ústav sv. Alžbety, Bratislava 1; Klinika radiačnej onkológie SZU v Bratislave, Onkologický ústav sv. Alžbety, Bratislava 2
Published in: Gastroent Hepatol 2013; 67(5): 354-360
Category: Gastrointestinal Oncology: Original Article
Overview
Bola vykonaná retrospektívna analýza dvoch modalít predoperačnej liečby u pacientov s karcinómom rekta v II. a III. klinickom štádiu, liečených na Klinike radiačnej onkológie OÚSA a SZU v Bratislave od januára 1999 do januára 2008. Pacienti boli liečení krátkodobou predoperačnou rádioterapiou (96 pacientov) v celkovej dávke 25 Gy (po 5 Gy v piatich frakciách) a následne operovaní priemerne do piatich dní. Dlhodobou predoperačnou rádioterapiou (55 pacientov) s alebo bez chemoterapie (na báze 5-FU) boli liečení pacienti do celkovej dávky 50,4 Gy po 1,8–2,0 Gy. Táto skupina pacientov podstúpila následnú operáciu do štyroch až ôsmich týždňov po ukončení liečby. Pacienti pri oboch spôsoboch liečby boli ožarovaní za rovnakých podmienok na lineárnom urýchľovači 6–18 MV X lúčmi, 3D konformnou rádioterapiou, technikou troch konvergentných polí alebo BOX technikou. Analyzovali sme vplyv oboch modalít na typ operácie, downstaging, patologickú kompletnú remisiu (pCR), výskyt lokálnych recidív (LR), vzdialených metastáz, toxicitu, celkové prežívanie (OS) a bezpríznakové prežívanie (DFS) podľa štádia ochorenia. Dlhodobou liečbou bolo liečených štatisticky významne viac pacientov vo vyššom štádiu ako krátkodobou rádioterapiou (p = 0,000002 < 0,05). Všetky naše výsledky je potrebné vziať do úvahy v tejto súvislosti. Downstaging, ako aj pCR boli dosiahnuté iba u pacientov liečených dlhodobou predoperačnou liečbou. Vo výskyte LR, vzdialených metastáz, toxicity, OS, ako i DFS nebol štatisticky významný rozdiel medzi dlhodobou a krátkodobou liečbou. Štatisticky významne lepšie výsledky vo výskyte LR, vzdialených metastáz, OS, ako i DFS boli v skupine s dlhodobou predoperačnou chemorádioterapiou ako v skupine so samostatnou rádioterapiou. Naše výsledky v zhode s porovnávanými randomizovanými štúdiami poukazujú na výhody dlhodobej predoperačnej rádiochemoterapie v liečbe pacientov s pokročilým karcinómom rekta. Podľa prebiehajúcich štúdií sa črtá nový spôsob predoperačnej krátkodobej rádioterapie v kombinácii s chemoterapiou a operáciou po štyroch týždňoch od ukončenia liečby.
Kľúčové slová:
karcinóm rekta – neoadjuvantná rádioterapia – konkomitantná chemoterapiaPodľa posledných štatisticky spracovaných údajov z Národného onkologického registra SR bolo v Slovenskej republike v roku 2007 [1] hlásených 675 prípadov zhubných nádorov rekta u mužov a 392 u žien. U vekovo štandardizovanej miery (Európskej) na 100 000 stojí SR v incidencii kolorektálneho karcinómu u mužov (90,7) na 1. mieste a v mortalite (46,8) na 2. mieste v Európe.
Jedinou potencionálne kuratívnou metódou u karcinómu rekta naďalej zostáva chirurgická liečba. Trendy v operačných výkonoch smerujú jednoznačne k sfinkter zachovávajúcim výkonom. Samozrejmosťou sa stala TME. V multimodálnom princípe liečby karcinómu rekta sa po pooperačnej rádioterapii postupne zavádza pooperačná chemorádioterapia. Štandardom sa stala neoadjuvantná liečba. Medzi výhody neoadjuvantnej rádioterapie patrí neporušené cievne zásobenie, menší objem ožiareného tenkého čreva, zníženie rizika peroperačnej implantácie nádorových buniek. Výhodou dlhodobej neodjuvantnej rádioterapie je downstaging, zlepšenie operability, potencionálne zachovanie funkcie sfinkterov a zníženie rizika lokálnej recidívy. Relatívne nevýhody neoadjuvantnej rádioterapie predstavujú oddialenie termínu operácie, obmedzenú znalosť histopatologického stagingu a riziko nadliečenia u včasných štádií ochorenia. Vždy, keď je to možné, má prednosť neoadjuvantná liečba s optimálnym načasovaním a kombinovaným režimom. Vzhľad polí pri ožarovaní malej panvy vychádza z poznatkov o lokálnom zlyhaní po operácii. Nežiaduce účinky rádioterapie pri liečbe karcinómu rekta sú funkciou objemu ožiarených polí, celkového času liečby, frakcionačnej dávky, radiačnej energie, celkovej dávky, techniky a sekvencie rádioterapie. S optimálnou lokálnou liečbou dosahovanou predoperačnou chemorádioterapiou a TME klesla miera lokálnej recidívy.
Cieľom našej práce bolo vyhodnotenie efektívnosti dvoch spôsobov predoperačnej liečby u pacientov s lokálne pokročilým karcinómom rekta. Poukazujeme na výhody, ale i úskalia neoadjuvantnej liečby a výsledky porovnávame s publikovanými štúdiami s cieľom stanoviť optimálny prístup k tejto pomerne zložitej problematike.
Klinický materiál a metódy
Od januára 1999 do januára 2008 bolo v OUSA v Bratislave liečených neoadjuvantnou liečbou 151 pacientov s karcinómom rekta v II. a III. klinickom štádiu. Krátkodobou rádioterapiou bolo liečených 96 pacientov, dlhodobou 55, z toho samostatnou rádioterapiou 22 pacientov a chemorádioterapiou 33. Dlhodobou liečbou bolo liečených štatisticky významne viac pacientov vo vyššom štádiu a viac rizikovejších pacientov ako krátkodobou rádioterapiou (p = 0,000002 < 0,05; p = 0,00038 < 0,05). Medián sledovania bol 48,03 mesiacov. Histologicky išlo najčastejšie o intestinálny adenokarcinóm s rôznym stupňom diferenciácie. Počet pacientov s nízko sediacim tumorom bol pri oboch typoch liečby v oboch štádiách porovnateľný. Rádioterapia bola aplikovaná prevažne v pronačnej polohe. Zdrojom 6–18 MV X lúčov bol lineárny urýchľovač CLINAC 2100 C/D, VARIAN. Podkladom pre plánovanie bolo terapeutické CT. Všetci pacienti boli liečení 3D konformnou rádioterapiou tromi alebo štyrmi konvergentnými poliami (obr. 1).
Image 1. Plánovací objem v axiálnej, sagitálnej a koronálnej rovine, dávkovo-objemový histogram. Fig. 1. Planning volume in axial, sagital and coronal plane, dose-volume histogram. 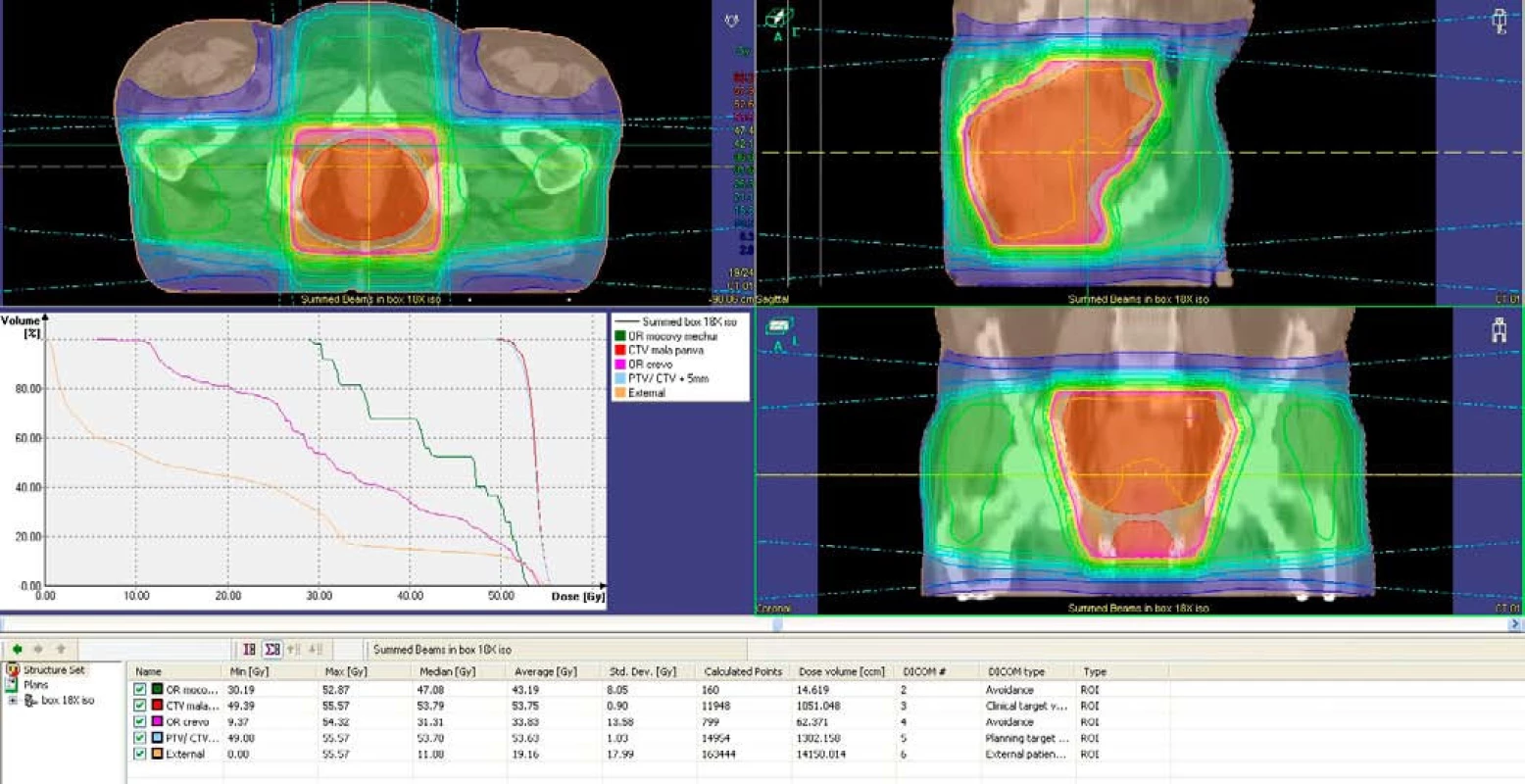
Krátkodobou predoperačnou rádioterapiou boli liečení pacienti 5-krát po 5,0 Gy počas prvého týždňa do celkovej dávky (TD) 25,0 Gy. Dlhodobá rádioterapia bola aplikovaná konvenčnou frakcionáciou 5-krát po 1,8–2,0 Gy týždenne do celkovej dávky (TD) 44–46 Gy, doplnená o boost dávku 5,4–6,0 Gy. Chemoterapia pri kombinovanom režime bola podávaná ako bolus 5-FU 350 mg/m² 5-krát v prvom a poslednom týždni liečby žiarením alebo kapecitabínom 875 mg/m² v dvoch denných dávkach počas celej liečby. Po krátkodobej liečbe podstúpilo systémovú chemoterapiu na báze 5-FU ± leukovorin 72 % pacientov, po dlhodobej samostatnej rádioterapii 20 % a po chemorádioterapii 24 %. Po ukončení krátkodobej predoperačnej rádioterapie boli pacienti operovaní priemerne do piatich dní, po dlhodobej liečbe priemerne do 42 dní. Všetci pacienti z nášho súboru boli operovaní radikálne abdominoperineálnou resekciou alebo operáciou so zachovaním sfinktera. Nebol štatisticky významný rozdiel medzi spôsobom liečby a typom operácie v oboch štádiách. Výpočty boli vykonané v štatistickom softvéri EView a v Excel 2010 s doplnkom XLSTAT. Pre hodnotenie celkového prežívania a bezpríznakového prežívania vo vzťahu ku každému spôsobu liečby bola použitá Kaplan-Meierova analýza. Porovnania prežívania u oboch spôsobov liečby bolo vykonané Log-rank a Wilcoxon testom. Všetky testy boli obojstranné a boli vykonané na hladine významnosti α = 0,05. Na porovnanie rozdielu medzi liečebnými modalitami bol použitý χ2 test a na porovnanie kontinuálnych premenných Mann-Whitney U test.
Výsledky
1. Downstaging
Klinicky zjavný downstaging bol dosiahnutý iba u pacientov liečených dlhodobou predoperačnou rádioterapiou, pri chemorádioterapii v 61,61 %, pri samostatnej rádioterapii v 45,45 %, bez štatisticky významného rozdielu medzi oboma skupinami u oboch štádií.
2. Patologická kompletná odpoveď a lokálna recidíva
Patologická kompletná odpoveď bola dosiahnutá iba u siedmich pacientov (12,73%), a to po dlhodobej predoperačnej liečbe. Lokálna recidíva bola zistená po troch rokoch od ukončenia liečby spolu v oboch štádiách po krátkodobej liečbe v 6,25 %, po dlhodobej v 16,36 %, so štatisticky významným rozdielom (p = 0,04557 < 0,05). So štatisticky významným rozdielom bola zistená tiež lokálna recidíva po chemorádioterapii v 1,82 % a po samostatnej dlhodobej rádioterapii v 14,55 % (p = 0,001062 < 0,05). Lokálna recidíva po piatich rokoch od ukončenia liečby sa vyskytla bez štatisticky významného rozdielu medzi dlhodobou a krátkodobou liečbou, ale opäť sa potvrdil štatisticky významný rozdiel vo výskyte lokálnych recidív medzi chemorádioterapiou a samostatnou rádioterapiou (p = 0,0132 < 0,05). Po troch aj piatich rokoch po ukončení liečby bolo zistených viac lokálnych recidív v III. štádiu ako v II. štádiu. Medián výskytu bol 23 mesiacov.
3. Vzdialená rekurencia ochorenia – výskyt vzdialených metastáz
Po troch rokoch od začiatku liečby boli zistené metastázy spolu v oboch štádiách po krátkodobej liečbe v 16,67 %, po dlhodobej v 25,45 %, bez štatisticky významného rozdielu (p = 0,192788 > > 0,05). Metastázy u dlhodobej liečby sa po chemorádioterapii vyskytli v 7,27 % a po samostatnej rádioterapii v 18,18 %, so štatisticky významným rozdielom (p = 0,00543293 < 0,05). Metastázy päť rokov po liečbe sa vyskytli bez štatisticky významného rozdielu medzi dlhodobou a krátkodobou liečbou (p = 0,3749 > 0,05), ale so štatisticky významným rozdielom medzi chemorádioterapiou a samostatnou rádioterapiou (p = 0,013433 < 0,05). Po troch aj piatich rokoch boli zistené vzdialené metastázy častejšie v III. ako v II. štádiu. Medián výskytu metastáz bol 20 mesiacov.
4. Toxicita
Po krátkodobej predoperačnej rádioterapii bola akútna toxicita pozorovaná v 5,21 % a po dlhodobej predoperačnej rádioterapii v 12,73 %, z toho 10,9 % pri chemorádioterapii, bez štatisticky významného rozdielu. Prevažne to boli ťažkosti 1. a 2. stupňa podľa RTOG//EORTC hodnotenia (10) zo strany GIT (hnačky, bolestivé nutkanie na stolicu), dyzurické ťažkosti a reakcia na koži. Rovnako medzi skupinou so samostatnou rádioterapiou a skupinou s chemorádioterapiou neboli štatisticky významné rozdiely. Peroperačné komplikácie, vo forme abscesu, sekundárneho hojenia a krvácania z GIT, sa vyskytli po dlhodobej liečbe u štyroch pacientov, po krátkodobej predoperačnej liečbe u šiestich pacientov, bez štatisticky významného rozdielu. Výskyt neskorej toxicity sme zaznamenali u 15 pacientov po krátkodobej liečbe a u 13 pacientov po dlhodobej liečbe, bez štatisticky významného rozdielu. Prejavili sa GIT ťažkosťami 1.a 2. stupňa, len u troch pacientov 3. až 4. stupňa podľa RTOG/EORTC hodnotenia chronických zmien po ožiarení [2] vo forme ilea a rektovaginálnej fistuly.
5. Celkové prežívanie
Po krátkodobej predoperačnej rádioterapii zomrelo na progresiu ochorenia (vzdialené metastázy, lokálnu recidívu) 16 pacientov (16,67 %), priemerný celkový čas prežívania bol 97,5 mesiacov (CI 95 %; 89,29–105,7). Tri roky po liečbe prežívalo 94,3 % pacientov, päť rokov 80,5 %. Po dlhodobej predoperačnej rádioterapii zomrelo na progresiu ochorenia 14 pacientov (25,5 %). Priemerný celkový čas prežívania bol 71,0 mesiacov (CI 95 %: 62,238–79,742). Tri roky po liečbe sa dožilo 82,5 % pacientov, päť rokov 70,4 %. Nepotvrdil sa štatisticky významný rozdiel v prežívaní pri oboch typoch liečby (p = 0,101 > 0,05). Po dlhodobej predoperačnej samostatnej rádioterapii zomrelo na progresiu ochorenia 10 pacientov, priemerný celkový čas prežívania bol 47,8 mesiacov (CI 95 %: 38,321–57,335). Tri roky po liečbe sa dožilo 67 % pacientov, päť rokov 55,3 %. Po chemorádioterapii zomreli na progresiu ochorenia štyria pacienti. Priemerný celkový čas prežívania bol 81,0 mesiacov (CI 95 %: 71,527–90,407). Tri roky po liečbe prežívalo 93,1 % pacientov, päť rokov 83,7 %. Štatisticky významný rozdiel v prežívaní medzi pacientmi liečenými samostatnou rádioterapiou a chemorádioterapiou (p = 0,015 < 0,05) ukazuje graf 1.
Graph 1. Porovnanie celkového prežívania po dlhodobej samostatnej rádioterapii a chemorádioterapii. Graph 1. Comparison of overall survival in patients treated with long-course radiotherapy alone or in combination with chemotherapy. 
V II. štádiu zomrelo na progresiu ochorenia sedem pacientov, priemerný celkový čas prežívania bol 99,049 mesiacov (CI 95 %: 86,928–111,17). Tri roky po liečbe sa dožilo 95,6 % pacientov, päť rokov 77,2 %. U pacientov v III. štádiu zomrelo na progresiu ochorenia 23 pacientov. Celkový čas prežívania bol 84,5 mesiacov (CI 95 %: 76,845–92,092). Tri roky po liečbe sa dožilo 87,3 % pacientov, päť rokov 76,4 %. Štatistickým vyhodnotením sa nepotvrdil štatistický významný rozdiel v prežívaní medzi II. a III. štádiom.
6. Bezpríznakové prežívanie
Po krátkodobej rádioterapii sa prejavili príznaky recidívy ochorenia alebo smrť u 39 pacientov, po dlhodobej liečbe u 24 pacientov. Po krátkodobej liečbe sa do troch rokov nevyskytli príznaky recidívy ochorenia u 72,8 %, po dlhodobej u 65,5 % pozorovaných pacientov, bez štatisticky významného rozdielu. Po krátkodobej liečbe päť rokov po liečbe zostalo 66,5 % pacientov bez príznakov ochorenia, po dlhodobej 54,4 % pacientov. Príznaky ochorenia sa vyskytli u 16 pacientov liečených samostatnou rádioterapiou a u ôsmich pacientov liečených chemorádioterapiou. Priemerný čas do objavenia sa ochorenia po samostatnej rádioterapii bol 27 mesiacov a 57,2 mesiacov po chemorádioterapii. Po chemorádioterapii tri roky od liečby sa nevyskytli známky ochorenia u 81,8 %, po piatich rokoch u 77,27 %. Po samostatnej rádioterapii tri roky od liečby bez príznakov ochorenia bolo 40,9 % sledovaných pacientov, päť rokov od liečby 28,05 %. Rozdiel v bezpríznakovom prežívaní medzi skupinou so samostatnou rádioterapiou a chemorádioterapiou (graf 2) sa potvrdil ako štatisticky významný (p = 0,001 < 0,05).
Graph 2. Porovnanie bezpríznakového prežívania po samostatnej rádioterapii a chemorádioterapii pri dlhodobej liečbe. Graph 2. Comparison of disease-free survival in patients treated with long-course radiotherapy alone or in combination with chemotherapy. 
Zo skupiny pacientov v II. štádiu zomrelo na progresiu ochorenia alebo sa prejavili príznaky recidívy ochorenia u 18 pacientov. Priemerný čas bezpríznakového prežívania bol 79,48 mesiacov (CI 95 %: 65,29–93,67). Tri roky od stanovenia diagnózy sa dožilo bez recidívy ochorenia 72,54 % pacientov, päť rokov 61,68 %. Z pacientov v III. štádiu zomrelo na progresiu ochorenia alebo sa prejavili príznaky recidívy ochorenia u 45 pacientov. Priemerný čas bezpríznakového prežívania bol 63,29 mesiacov (CI 95 %: 54,04–72,54). Tri roky od stanovenia diagnózy sa dožilo bez príznakov ochorenia 68,93 % pacientov, päť rokov 62,92 %. Nepotvrdil sa štatisticky významný rozdiel v bezpríznakovom prežívaní medzi II. a III. štádiom.
Diskusia
V našej retrospektívnej analýze sme sa zamerali na porovnanie krátkodobej a dlhodobej predoperačnej liečby a porovnanie výsledkov s randomizovanými štúdiami porovnávajúcimi tieto modality liečby. Vekové zastúpenie, priemer a medián veku, pomer liečených mužov a žien (2 : 1), medián sledovania, počtu pacientov s nízko sediacim tumorom boli v jednotlivých skupinách porovnateľné. Dlhodobou liečbou bolo liečených štatisticky významne viac rizikovejších pacientov než krátkodobou liečbou (p = 0,00038 < 0,05). Všetky naše výsledky je potrebné vziať do úvahy v tejto súvislosti. Pacienti pri oboch spôsoboch liečby boli ožarovaní za rovnakých podmienok a absolvovali plnú dávku podľa známych odporúčaní pri oboch modalitách. Adjuvantnú systémovú chemoterapiu v štandardných režimoch absolvovali pacienti po krátkodobej liečbe v 72 %, po dlhodobej v 20 %, resp. 24 %. Aj podľa literárnych údajov len približne 50 % pacientov je schopných absolvovať plánovanú adjuvantnú chemoterapiu v plánovanej dávke pre jej toxicitu a odmietnutie zo strany pacienta [3–7]. V randomizovanej poľskej štúdii Warsaw; 2010 PMID 20231300 [8] nebol preukázaný štatisticky významný prínos adjuvantnej chemoterapie u pacientov po predoperačnej (chemo)rádioterapii. Adjuvantná chemoterapia prispieva k eliminácii vzdialených metastáz. Je však spojená so zvýšenou toxicitou a zhoršenou compliance. Adjuvantná chemoterapia je prínosom pre rizikových pacientov. Je odôvodnená hlavne v prípadoch, ak zostanú po predoperačnej (chemo)rádioterapii pozitívne lymfatické uzliny. Účinnosť adjuvantnej chemoterapie je znížená, ak nádor nereagoval na predoperačnú (chemo)-rádioterapiu. Podľa randomizovanej štúdie EORTC22921 [9] porovnávajúcej preodoperačnú chemorádioterapiu so samostatnou rádioterapiou a v oboch ramenách následne s alebo bez adjuvantnej chemoterapie, pridanie chemoterapie ku rádioterapii či už v neoadjuvancii alebo v adjuvancii je vždy prínosom. Po ukončení neoadjuvantnej liečby boli pacienti v našom súbore po krátkodobej liečbe operovaní priemerne do piatich dní, po dlhodobej priemerne do 42 dní. Výsledky veľkej multicentrickej štúdie [10,11] naznačujú, že operácia by mala byť vykonaná do piatich dní od ukončenia krátkodobej predoperačnej rádioterapie alebo sa môže odložiť o viac ako štyri týždne. Operácií so zachovaním sfinktera v našom súbore bolo po krátkodobej liečbe 46,88 %, po dlhodobej liečbe 47,27 % (po chemorádioterapii 54,55 %). Miera sfinkterzáchovných operácií bola porovnateľná s výsledkami štúdie z Uppsaly (43,5 %) [12] a lyonskej štúdie R96-02 (44 %) [4]. V porovnaní s našimi výsledkami vyššiu mieru zachovania sfinktera preukázali holandská štúdia (67 %) [13] a nemecká štúdia (69 %) [3].Vyššia miera sfinkterzáchovných operácií je umožnená regresiou nádoru po neoadjuvantnej liečbe, zavedením staplerov, ktoré vytvárajú predpoklad konštrukcie aj veľmi nízkych anastomóz a tiež dostatočnej erudície chirurga. Pacienti v našom súbore neboli všetci operovaní na pracoviskách špecializovaných na kolorektálnu chirurgiu, a to môže byť jeden z dôvodov nižšieho podielu týchto operácií ako v uvádzaných štúdiách.
Downstaging efekt v našom súbore bol dosiahnutý iba u pacientov liečených dlhodobou predoperačnou rádioterapiou, vo vyššej miere po chemorádioterapii (61,61 %) ako po samostatnej rádioterapii (45,45 %), ale bez štatisticky významného rozdielu. Aj podľa randomizovaných štúdií sa potvrdzuje signifikantný downstaging viac po chemorádioterapii ako po samostatnej rádioterapii [5].
Patologická kompletná remisia bola dosiahnutá u siedmich pacientov (13 %) liečených dlhodobou liečbou, po krátkodobej predoperačnej rádioterapii sa nevyskytla. Naše výsledky sú porovnateľné s výsledkami veľkých randomizovaných štúdií (15 %; 11,7 %; 16 %; 14 %; 8 %) [3,4,14,15]. Lokálny relaps ochorenia po troch rokoch bol zistený v oboch štádiách u oboch modalít so štatisticky významne vyšším podielom po dlhodobej liečbe ako po krátkodobej rádioterapii (16,36 %, resp. 6,25 % , p = 0,04557 < 0,05); po dlhodobej samostatnej rádioterapii štatisticky významne viac ako po chemorádioterapii (14,55 %, resp. 1,82 %, p = 0,001062 < 0,05). Lokálna recidíva po piatich rokoch po liečbe sa vyskytla bez štatisticky významného rozdielu medzi dlhodobou (5,5 %; 14,6 %) a krátkodobou liečbou (11,5 %) (p = 0,1522 > 0,05), ale štatisticky významný rozdiel bol vo výskyte lokálnych recidív medzi dlhodobou chemorádioterapiou a dlhodobou rádioterapiou (p = 0,0132 < 0,05). Po troch aj piatich rokoch bolo zistených viac lokálnych recidív v III. štádiu ako v II. štádiu. 50 % lokálnych recidív (11 pacientov = 7,28 % z celkového počtu 151 pacientov) sa vyskytlo do 22. mesiaca po liečbe. Po piatich rokoch bola lokálna recidíva diagnostikovaná u 20 pacientov z celkového súboru (13,25 %). Miera lokálnych recidív v našom súbore je o niečo vyššia ako v novších randomizovaných štúdiách, v ktorých bola použitá TME a boli použité dávky rádioterapie podobné ako v našom súbore. Jedným z dôvodov môže byť už vyššie uvádzaný fakt, že nie všetci pacienti boli operovaní na pracoviskách špecializovaných na kolorektálny karcinóm a nie je záruka dodržania TME. Výskyt recidív porovnávaných štúdií pri krátkodobej predoperačnej liečbe sa pohybuje v rozmedzí 4–17 %, pri dlhodobej predoperačnej samostatnej rádioterapii 16–17 % (porovnateľné s našou štúdiou) a pri dlhodobej predoperačnej chemorádioterapii 6–14 % (porovnateľné s našou štúdiou). V súlade s porovnávanými štúdiami je miera lokálnych recidív najnižšia po dlhodobej chemorádioterapii. Nepotvrdil sa štatisticky významný rozdiel vo výskyte vzdialených metastáz po krátkodobej a dlhodobej predoperačnej liečbe po troch ani po piatich rokoch (p = 0,192788 > 0,05, p = 0,3749 > 0,05). Po dlhodobej liečbe sa vzdialené metastázy vyskytli po chemorádioterapii v 7,27 % a po samostatnej rádioterapii v 18,18 % a potvrdil sa štatisticky významný rozdiel (p = 0,00543293 < 0,05). Výskyt vzdialených metastáz v našom súbore je porovnateľný s randomizovanými štúdiami, pri dlhodobej liečbe sú naše výsledky lepšie. V našom súbore sa vyvinuli lokálne recidívy aj so vzdialenými metastázami po chemorádioterapii len v 3,64 %, po dlhodobej samostatnej rádioterapii v 12,73 % a po krátkodobej rádioterapii u 6,25 %. Akútna toxicita po krátkodobej predoperačnej rádioterapii bola pozorovaná v 5,21 % a po dlhodobej predoperačnej rádioterapii v 12,73 %, z toho 10,9 % pri chemorádioterapii, bez štatisticky signifikantných rozdielov. Peroperačné komplikácie sa vyskytli bez štatisticky významného rozdielu medzi skupinami (p = 0,9966 > 0,05), podobne nebol významný rozdiel vo výskyte neskorej toxicity. Pri krátkodobej rádioterapii sa akútna toxicita prejavila porovnateľne ako v randomizovaných štúdiách, neskorá toxicita u väčšieho počtu pacientov. Pri dlhodobej samostatnej rádioterapii, ako aj chemorádioterapii, akútna toxicita bola u našich pacientov niečo nižšia ako v uvádzaných štúdiách. Neskorá toxicita po chemorádioterapii bola v našom súbore porovnateľná so štúdiami. Neskoré komplikácie boli vo forme prevažne nezávažného 1. a 2. stupňa hodnotenia. Z pacientov liečených krátkodobou predoperačnou rádioterapiou tri roky od stanovenia diagnózy prežívalo 94,3 % pacientov, päť rokov 80,5 %. Po dlhodobej predoperačnej liečbe tri roky od stanovenia diagnózy sa dožilo 82,5 % pacientov, päť rokov 70,4 %, bez štatistického rozdielu. Rozdiel v päťročnom celkovom prežívaní v rámci dlhodobej liečby medzi pacientmi liečenými samostatnou rádioterapiou (55,3 %) a pacientmi, ktorí podstúpili chemorádioterapiu (83,7 %), sa ukázal ako štatisticky významný (p = 0,005433 < 0,05). Päťročné prežívanie po krátkodobej rádioterapii v porovnávaných štúdiách sa pohybuje medzi 50–74 %. Naše výsledky v tomto prípade sú lepšie. Po dlhodobej samostatnej rádioterapii je v štúdiách celkové prežívanie po piatich rokoch 65–68 %, v našom súbore je prežívanie tejto skupiny nižšie. Celkové prežívanie v skupine s dlhodobou chemorádioterapiou je opäť vyššie v našej skupine, oproti štúdiám, kde dosahuje hodnoty 65–76 %. Podľa francúzskej štúdie French FFCD 9203 [4] a veľkej randomizovanej EORTC 22921 štúdie [5], ktoré porovnávali režimy dlhodobej predoperačnej rádioterapie a chemorádioterapie, nebol konštatovaný rozdiel v päťročnom prežívaní. V našom súbore sa nepotvrdil štatisticky významný rozdiel v prežívaní medzi II. a III. štádiom. Po krátkodobej liečbe päť rokov zostalo 66,5 % pacientov bez príznakov ochorenia, po dlhodobej 54,4 % pacientov, bez štatisticky významného rozdielu medzi danými skupinami. Po chemorádioterapii po piatich rokov bez príznakov ochorenia prežívalo 77,27 %, po samostatnej dlhodobej rádioterapii 28,05 %. Rozdiel sa potvrdil ako štatisticky významný (p = 0,001 < 0,05). Nepotvrdil sa štatisticky významný rozdiel v bezpríznakovom prežívaní medzi II. a III. štádiom. Podľa dostupných výsledkov randomizovaných štúdií päťročné bezpríznakové prežívanie pre krátkodobú predoperačnú rádioterapiu 77 % [16] a dlhodobú predoperačnú chemorádioterapiu 68–78 % [3,14,16] sú porovnateľné s našimi výsledkami.
Záver
Liečba karcinómu rekta vyžaduje spoluprácu gastroenterológa, rádiodiagnostika, radiačného onkológa, klinického onkológa, chirurga a patológa. Naša retrospektívna analýza poukázala na potrebu kooperácie a dostatočnej erudície všetkých zúčastnených. Predoperačná liečba sa stáva dnes štandardom. Zavedenie neoadjuvantnej liečby je prínosom pre pacientov s karcinómom rekta. Naše výsledky poukazujú na pozitívny vplyv sledovaných modalít neoadjuvantnej liečby na dlhodobé výsledky u II. aj III. štádia ochorenia. Podstatný rozdiel medzi krátkodobou a dlhodobou predoperačnou liečbou nebol zaznamenaný v miere sfinkterzáchovných operácií, miere toxicity a bezpríznakovom prežívaní. Významný rozdiel medzi dlhodobou samostatnou rádioterapiou a chemorádioterapiou v znížení miery lokálnych recidív, výskytu vzdialených metastáz a celkového prežívania v našom súbore je v zhode aj s publikovanými štúdiami. Kombinovaná chemorádioterapia je plne indikovaná u lokálne pokročilého ochorenia v distálnych častiach rekta. Chemorádioterapia je horšie tolerovaná u pacientov vo vyššom veku a u pacientov s pridruženými ochoreniami. Otázna zostáva skupina nízkorizikového T3N0M0, s nádormi s nízkym zapojením cirkumferenciálneho okraja, v strednej a hornej tretine rekta, kde predoperačná chemorádioterapia môže znamenať nadliečenie a zbytočné zaťaženie pacienta. Predoperačná biopsia nevylúči spoľahlivo nepriaznivé patologické črty. Problémom býva tiež identifikácia pozitívnych lymfatických uzlín. Preto bezpečnejšie a odporučované je aj v týchto prípadoch neoadjuvantnú chemorádioterapiu radšej indikovať. Podľa dostupných údajov asi 12 % pacientov s karcinómom rekta nebude odpovedať vôbec alebo len minimálne na predoperačnú chemorádioterapiu. Zatiaľ tiež nevieme bezpečne identifikovať túto skupinu, ktorá by sa mohla vyhnúť oneskoreniu chirurgickej liečby a zbytočnému zaťaženiu neoadjuvantnou liečbou. Prínosom v neoadjuvantnej liečbe môžu byť nové chemoterapeutiká a biologická liečba. Diskutuje sa o krátkodobej predoperačnej chemorádioterapii s odloženou operáciou v termíne viac ako štyri týždne po ukončení neoadjuvantnej liečby, ktorá by mohla priniesť spojenie výhod krátkodobej a dlhodobej neoadjuvantnej liečby.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 30. 8. 2013
Přijato: 23. 9. 2013
MUDr. Ivana Krajčovičová, PhD.
I. onkologická klinika LF UK
Onkologický ústav sv. Alžbety
Heydukova 10, 812 50 Bratislava
ikrajcov1@hotmail.com
Sources
1. Diba C, Pleško I, Hlava P. Incidencia zhubných nádorov v Slovenskej republike 2007. Bratislava: NCZI 2012.
2. Šlampa P, Petera J. Radiační onkologie. 1. vyd. Praha: Galén 2007; 153–161.
3. Sauer R, Becker H, Hohenberger W et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351(17): 1731–1740.
4. Gérard JP, Conroy T, Bonnetain F et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3–4 rectal cancers: results of FFCD 9203. J Clin Oncol 2006; 24(28): 4620–4625.
5. Bosset JF, Collette L, Calais G et al. Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med 2006; 355(11): 1114–1123.
6. Rödel C, Arnold D,Hipp M et al. Phase I–II trial of cetuximab, capecitabine, oxaliplatin, and radiotherapy as preoperative treatment in rectal cancer. Int J Radiat Oncol Biol Phys 2007; 70(4): 1081–1086.
7. Sebag-Montefiore D. Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial. Lancet 2009; 373(9666): 811–820.
8. Bujko K, Glynne-Jones R, Bujko M. Does adjuvant fluoropyrimidine-based chemotherapy provide a benefit for patients with resected rectal cancer who have already received neoadjuvant radiochemotherapy? A systematic review of randomised trials. Ann Oncol 2010; 21(9): 1743–1750.
9. Collette L, Bosset JF, den Dulk M et al. Patients with curative resection of cT3–4 rectal cancer after preoperative radiotherapy or radiochemotherapy: does anybody benefit from adjuvant fluorouracil-based chemotherapy? A trial of the European Organisation for Research and Treatment of Cancer Radiation Oncology Group. J Clin Oncol 2007; 25(28): 4379–4386.
10. Pettersson D, Cedermark B, Holm T et al. Interim analysis of the Stockholm III trial of preoperative radiotherapy regimens for rectal cancer. Br J Surg 2010; 97(4): 580–587.
11. Frykholm GJ, Glimelius B, Påhlman L. Preoperative or postoperative irradiation in adenocarcinoma of the rectum: final treatment results of a randomized trial and an evaluation of late secondary effects. Dis Colon Rectum 1993; 36(6): 564–572.
12. Van Gijn W, Marijnen CA, Nagtegaal ID et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 2011; 12(6): 575–582.
13. Roh MS, Colangelo LH, O’Connell MJ et al. Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03. J Clin Oncol 2009; 27(31): 5124–5130.
14. Aschele C, Cionini L, Leonardi S et al. Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase III trial. J Clin Oncol 2011; 29(20): 2773–2780.
15. Sebag-Montefiore D, Stephens RJ, Steele R et al. Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial. Lancet 2009; 373(9666): 811–820.
16. Wiltshire KL, Ward IG, Swallow C et al. Preoperative radiation with concurrent chemotherapy for resectable rectal cancer: effect of dose escalation on pathologic complete response, local recurrence-free survival, disease-free survival, and overall survival. Int J Radiat Oncol Biol Phys 2006; 64(3): 709–716.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2013 Issue 5-
All articles in this issue
- Gastrointestinální onkologie
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

