-
Medical journals
- Career
Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
Authors: Š. Suchánek 1; M. Minárik 2; L. Benešová 2; B. Belšánová 2; P. Mináriková 1; P. Hrabal 4; P. Frič 1; L. Dušek 3; M. Zavoral 1
Authors‘ workplace: Interní klinika 1. LF UK a ÚVN – VFN, Praha 1; Genomac International, s. r. o, Centrum aplikované genomiky solidních nádorů, Praha 2; Institut biostatistiky a analýz, Masarykova univerzita, Brno 3; Oddělení patologie, ÚVN – VFN, Praha 4
Published in: Gastroent Hepatol 2013; 67(5): 348-353
Category: Gastrointestinal Oncology: Original Article
Overview
Vývojová stadia kolorektálního karcinomu (adenomy) jsou určena histopatologickým stagingem, který určuje míru rizika vzniku karcinomu. Rekurence kolorektálních adenomů zvyšuje nároky na dispenzarizaci pacientů. Proces maligní transformace z normální tkáně je provázen charakteristickými změnami na úrovni genetických a epigenetických poruch. Hlavním cílem studie bylo dlouhodobé (6–11 let) sledování pacientů po endoskopické polypektomii, především vzhledem k výskytu následných (rekurentních) adenomů. Dalším cílem bylo sledování genetického profilu nejčastějších somatických DNA mutací a jejich případný vztah k histologické charakteristice adenomů.
Materiál a metody:
Do studie byli zařazeni pacienti, kteří v letech 2002–2006 podstoupili kolonoskopické vyšetření s odstraněním adenomového polypu. Bylo provedeno standardní histopatologické vyšetření vzorků a následně korelováno s vyšetřením vybraného panelu somatických mutací (geny APC, TP53, KRAS a BRAF), které jsou typické pro sporadické kolorektální karcinomy. Podskupina pacientů byla následně endoskopicky sledována dle doporučených intervalů se zaměřením na vztah mezi mutací odstraněného adenomu a výskytem následných adenomů v intervalu a) ≤ 3 roky, nebo b) > 3 roky či delším.Výsledky:
Celkem bylo vyšetřeno 48 pacientů (39 mužů, 9 žen; průměrný věk 62 let). Dispenzární kolonoskopie podstoupilo 30 pacientů, následný adenom v intervalu ≤ 3 roky byl diagnostikován u 11 (37 %) z nich, 19 pacientů (63 %) bylo bez nálezu adenomu nebo byl interval detekce následného adenomu delší než tři roky. V obou skupinách byly nalezeny mutace primárního adenomu, ve skupině s následným adenomem ≤ 3 roky u 10 pacientů, v druhé skupině u 8 pacientů (90 %, resp. 42 %; p = 0,0249). Mutace byly nalezeny u 60 % pacientů (29/48); s pokročilým (velikost ≥ 10 mm, vilózní složka, high-grade dysplazie) i časným adenomem (21 pacientů, 72 %; resp. 8 pacientů, 28 %).Závěr:
Dispenzarizace s dodržením doporučených intervalů je vhodným nástrojem prevence vzniku kolorektálního karcinomu, a to především u nezanedbatelné části pacientů, u kterých dochází k opětovným rekurencím výskytu adenomů. Pilotní výsledky též naznačují, že fenotyp chromozomální nestability (CIN) může představovat nezávislý faktor zvýšeného rizika takových rekurencí.Klíčová slova:
kolorektální karcinom – adenom – kancerogeneze – DNA mutace
Kolorektální karcinom (KRK) je druhé nejčastější nádorové onemocnění, jehož výskyt stoupá zejména v rozvinutých zemích. V roce 2010 byl v České republice diagnostikován KRK u 8 265 osob a 3 991 pacientů na tuto malignitu zemřelo. Přestože je v posledních letech pozorován pozitivní trend snižování mortality (možný vliv 13 let trvajícího screeningového programu), tak je i nadále KRK diagnostikován v pokročilých stadiích. Predikce na rok 2013 předpokládají záchyt 2 222 pacientů ve stadiu III a 2 177 pacientů ve stadiu IV, což představuje 25,4 %, resp. 25,3 % ze všech pacientů s diagnózou KRK [1].
Naprostá většina kolorektálních karcinomů vzniká postupnou přeměnou normálního kolonického epitelu přes mezistupeň adenomového polypu. Tato cesta vedoucí až k maligní transformaci je poměrně dobře popsána jak na úrovni morfologické s postupnými dysplastickými změnami, tak i na úrovni molekulárně genetické. Klasický model progrese kolorektálního karcinomu předpokládá, že významná část neoplazií vzniká na podkladu specifických poruch (bodových DNA mutací či nadměrné DNA metylace) postihujících významné regulátory drah růstových faktorů, bunečného cyklu, geny zajišťující opravy chyb DNA replikace, modulátory apoptózy atd. V důsledku těchto poruch pak dochází ke ztrátě kontroly nad buněčným růstem a dělením. Na makroskopické úrovni je tento proces doprovázen projevy absence tzv. kontaktní inhibice vedoucí ke vzniku polypózních nádorových struktur až po nekrotické změny u rozvinutých karcinomů.
Je známou skutečností, že KRK je nádor dobře ovlivnitelný prevencí. Primární prevence spočívá v úpravě životosprávy a jídelníčku. Sekundární prevence je zaměřena buď na vyhledávání a časnou diagnostiku onemocnění u bezpříznakových jedinců starších 50 let (screening, depistáž), nebo na dlouhodobé sledování vysokorizikových skupin chorob, tedy osob s pozitivní rodinnou či osobní anamnézou kolorektální neoplazie nebo déletrvajícího nespecifického střevního zánětu (dispenzarizace, surveillance, follow-up). Osobní anamnézou se rozumí stav po operaci pro KRK nebo po endoskopickém odstranění adenomového polypu. Surveillance probíhá formou dispenzárních kolonoskopií, které se provádějí v pravidelných intervalech. Jejich cílem je záchyt rekurentních adenomů, jejich odstranění, a tím přerušení kancerogeneze KRK [2].
Intervaly dispenzárních kolonoskopií vycházejí z odborných doporučení. V roce 2010 byla publikována obsáhlá Evropská guidelines pro screening a diagnostiku KRK vypracovaná na základě principu evidence based medicine. Součástí těchto doporučení je i schéma intervalů dispenzárních kolonoskopií, které bylo adaptováno pro účely této studie (obr. 1) [3]. Pacienti jsou zde rozděleni (dle počtu, velikosti a histopatologické charakteristiky adenomových polypů) do tří skupin určující míru rizika (nízké, střední a vysoké riziko) vzniku KRK. Klíčovým intervalem sledování jsou jeden až tři roky, během kterých je dispenzární kolonoskopie indikovaná u pacientů se středním (tři roky) a vysokým rizikem (jeden rok).
Image 1. Intervaly dispenzárních kolonoskopií po odstranění adenomových polypů. Fig. 1. Follow-up colonoscopies intervals after adenomatous polyp removal. 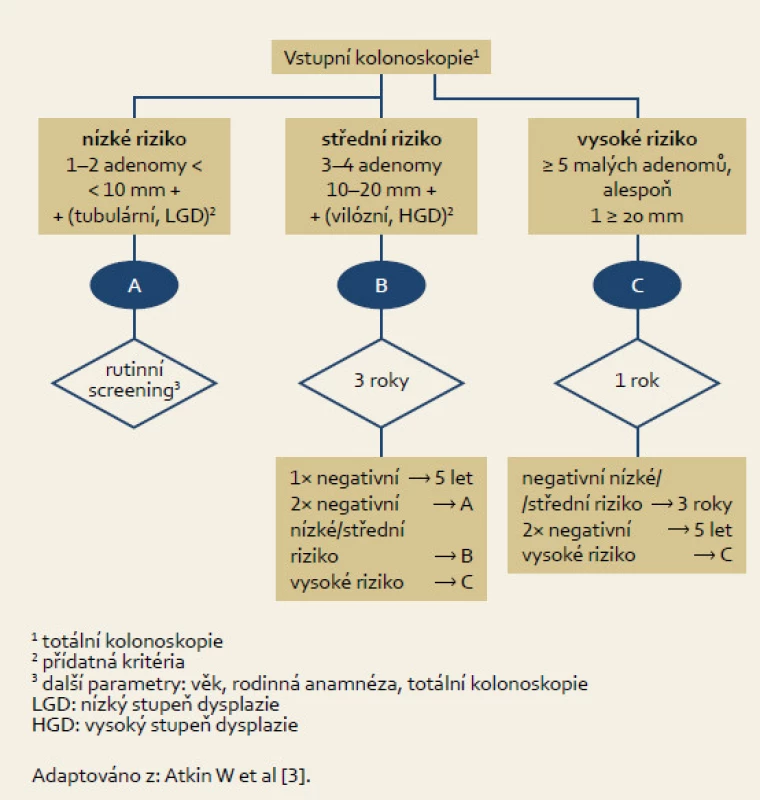
Přestože výše uvedený model molekulárních změn v sekvenci adenom--karcinom je znám již více než 20 let, nebyl přínos genetického vyšetřování tkání odebíraných adenomů za účelem predikce rekurence adenomů či vzniku karcinomu doposud prokázán.
Hlavní náplní této práce je popis pilotních dat projektu dlouhodobého sledování (6–11 let) pacientů po endoskopické polypektomii, především vzhledem k výskytu následných (rekurentních) adenomů. Dalším cílem je sledování genetického profilu nejčastějších somatických DNA mutací a jejich případný vztah k histologické charakteristice adenomů.
Materiál a metody
Do studie byli zařazeni pacienti vyšetření na Endoskopické jednotce Interní kliniky Ústřední vojenské nemocnice Praha (dříve Interní oddělení ÚVN) v letech 2002–2006 v rámci probíhajících výzkumných projektů zahrnujících projekty Interní grantové agentury MZ ČR a společnosti Liga proti rakovině. Inkluzní kritéria zahrnovala věk ≥ 18 let (bez horní věkové hranice); totální kolonoskopii (dosažení céka) indikovanou jako součást diagnostického procesu a i v rámci screeningu; a informovaný souhlas se studií a molekulárně genetickým testováním.
Polypy byly odstraněny polypektomickou kličkou a standardně histologicky vyšetřeny. Byla hodnocena přítomnost vilózní komponenty (tubulární, tubulovilózní a vilózní) a stupeň dysplazie: nízký stupeň dysplazie (low-grade dysplazie, LGD) a vysoký stupeň dysplazie (high-grade dysplazie, HGD). Hraniční nálezy, dříve označované jako střední dysplazie (mild dysplasia), byly hodnoceny jako HGD. Polypy byly hodnoceny jako pokročilé (≥ 10 mm a/nebo vilózní složka > 20 % a/nebo HGD) a časné (nesplňující kritéria pokročilého adenomu) [4].
Odebírané polypektomické vzorky byly zpracovávány do formátu parafínových bločků (FFPE, formalin-fixed parafin-embedded) a podrobeny standardnímu histopatologickému hodnocení, které odpovídalo aktuálním doporučením platným v době odběru. U FFPE bločků bylo patologem následně provedeno vyznačení oblasti zjištěné přítomnosti nádorových buněk a tyto byly odeslány do molekulárněgenetické laboratoře. Zde byla provedena izolace genomové DNA s použitím standardního postupu a kolonkové metody s kitem JetQuick tissue kit (Genomed, G.m.b.H, Loehne, Německo). Panel testovaných somatických mutací zahrnoval mutační hotspoty genů nejčastěji mutovaných v průběhu sporadické kolorektální karcinogeneze. Jednalo se o exon 1 genu KRAS (zahrnující kodony 12 a 13), exony 5–10 genu TP53, exon 15 genu BRAF (mutace V600E) a mutační cluster region exonu 15 genu APC pokrývající rozpětí kodonů 1 250–1 450. Přítomnost mutací byla detekována za použití vysoce citlivé metody denaturační kapilární elektroforézy s využitím kitů Genoscan (Carolina Biosystems, Praha, CZ). Tato metoda je založena na kapilárně-elektroforetické separaci heteroduplexů PCR amplifikovaných úseků za podmínek jejich částečné denaturace na genetickém analyzátoru ABI PRISM 3100 (Applied Biosystems Foster Vity, CA) [5].
Podskupina pacientů byla následně endoskopicky sledována dle odborných doporučení. Soubor pacientů v této studii byl rozdělen do dvou skupin:
- pacienti s diagnostikovaným následným adenomem během prvních tří let od iniciální kolonoskopie,
- pacienti, u kterých nebyl prokázán následný adenom vůbec nebo byl interval mezi iniciální kolonoskopií a diagnózou následného adenomu delší než tři roky.
U pacientů v obou skupinách byly sledovány i další následné adenomy. Byl hodnocen vztah mezi přítomností mutace v iniciálním adenomu a detekcí následných adenomů. Pacienti byli rozděleni do čtyř skupin dle následných adenomů.
Statistická analýza vztahu výskytu mutací u rekurentních adenomů a ostatních parametrů byla provedena pomocí standardního testu dobré shody při hladině statistické významnosti ≤ 0,05.
Výsledky
Celkem bylo do studie zahrnuto 48 pacientů (39 mužů, 9 žen; průměrný věk 62 let), u kterých bylo provedeno molekulárně genetické vyšetření odstraněných adenomů po iniciální kolonoskopii. Dispenzární kolonoskopie byly následně provedeny u podskupiny 30 pacientů (62 %), 18 pacientů (38 %) nebylo dále sledováno (7× exitus letalis, 6× krátký interval od vstupní kolonoskopie, 4 pacienti se na dispenzární vyšetření nedostavili a u 1 pacienta byl diagnostikován synchronní KRK). Dispenzarizovaní pacienti byli dále sledováni po dobu 6–11 let. Následný adenom byl prokázán v období ≤ 3 roky u 11 pacientů (37 %). U 19 pacientů (63 %) byl adenom detekován později nebo nebyl zachycen vůbec. Z hlediska výsledků dlouhodobého sledování (opakované adenomy) byli pacienti rozděleni do čtyř skupin (A, B, C, D) s následujícím procentuálním rozložením: 29 %, 14 %, 43 % a 14 % (obr. 2, tab. 1). Průměrný věk a velikost léze v jednotlivých skupinách činil 69, 72, 60 a 45 let a 19, 13, 17 a 16 mm. Histologicky byly ve skupině A prokázány 2× LGD a 4× HGD, ve skupině B 3× LGD, ve skupině C 6× LGD a 3× HGD a ve skupině D 3× LGD. Adenomy byly lokalizovány převážně v rektu a v levém tračníku (18×, všechny léze ve skupině A), v menší míře v ascendens (3×, vždy jedna léze ve skupině B, C, D). Mutace primárního adenomu byly nalezeny u 10 pacientů s následným adenomem ≤ 3 roky a u 8 pacientů, u kterých nebyl adenom při první dispenzární kolonoskopii prokázán, nebo byl interval delší než tři roky (90 %, resp. 42 %; p = 0,0249). Mutace byly nalezeny u 60 % pacientů (29/48) s pokročilým i časným adenomem (21 pacientů, 72 %; resp. 8 pacientů, 28 %) (tab. 2 a 3). Pro srovnání získaných dat o frekvenci výskytu somatických mutací v adenomech s rozložením těchto mutací v karcinomech byla použita mutační data získaná z nezávislého projektu zaměřeného výhradně na vyšetřování u klinicky potvrzených karcinomů tlustého střeva a konečníku (IGA MZ grantový projekt č. NS9809).
Image 2. Základní charakteristika souboru. Fig. 2. Basic study characteristics. 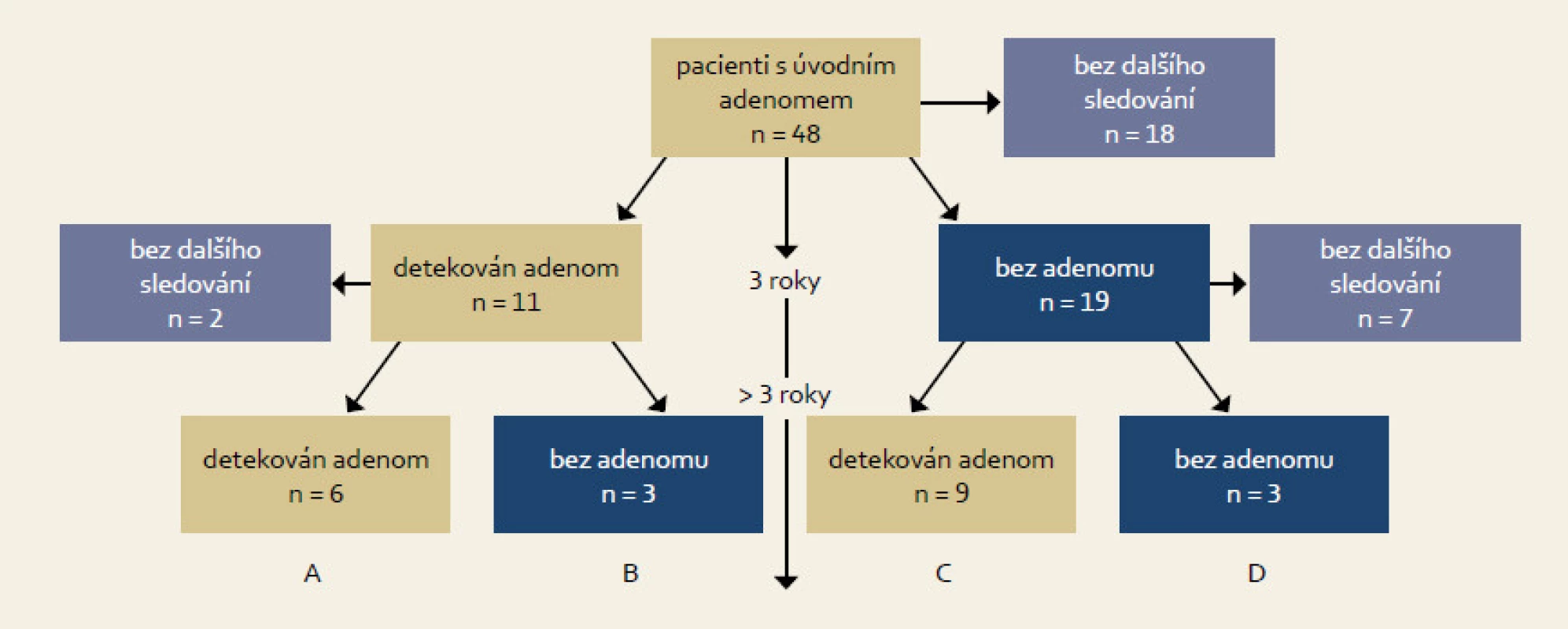
Table 1. Rozdělení pacientů dle opakované detekce následných adenomů. Tab. 1. Selection of patients due to repeated detection of recurrence adenomas. 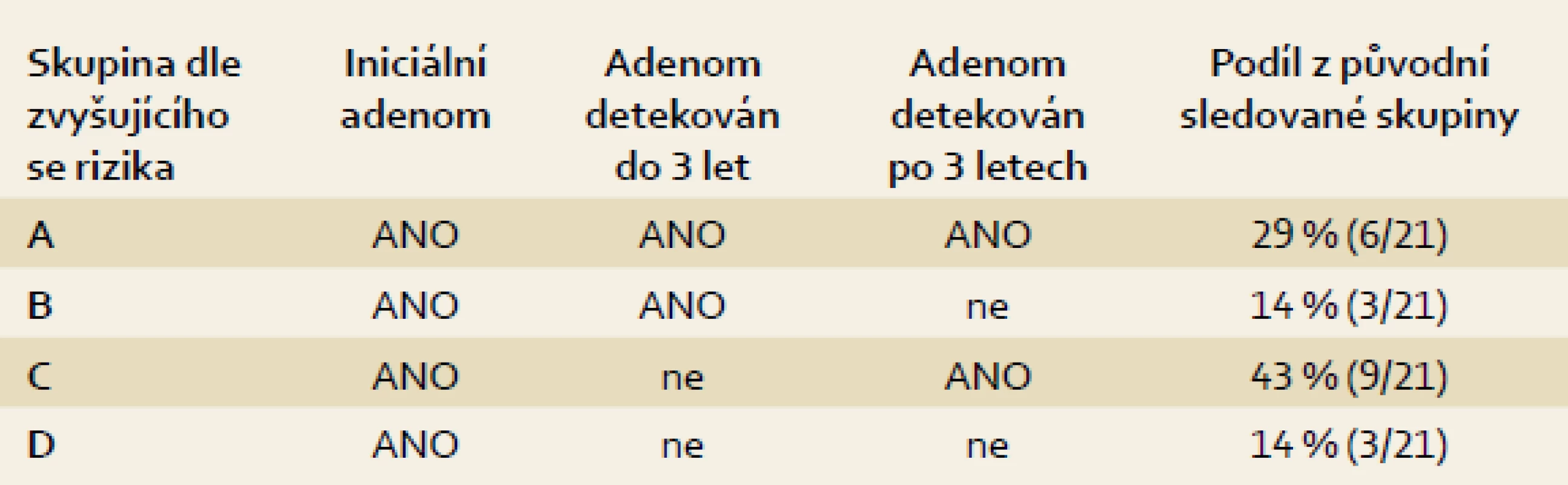
Table 2. Rozdělení pacientů dle přítomnosti mutace primárního adenomu. Tab. 2. Selection of patients due to the presence of initial adenoma mutation. 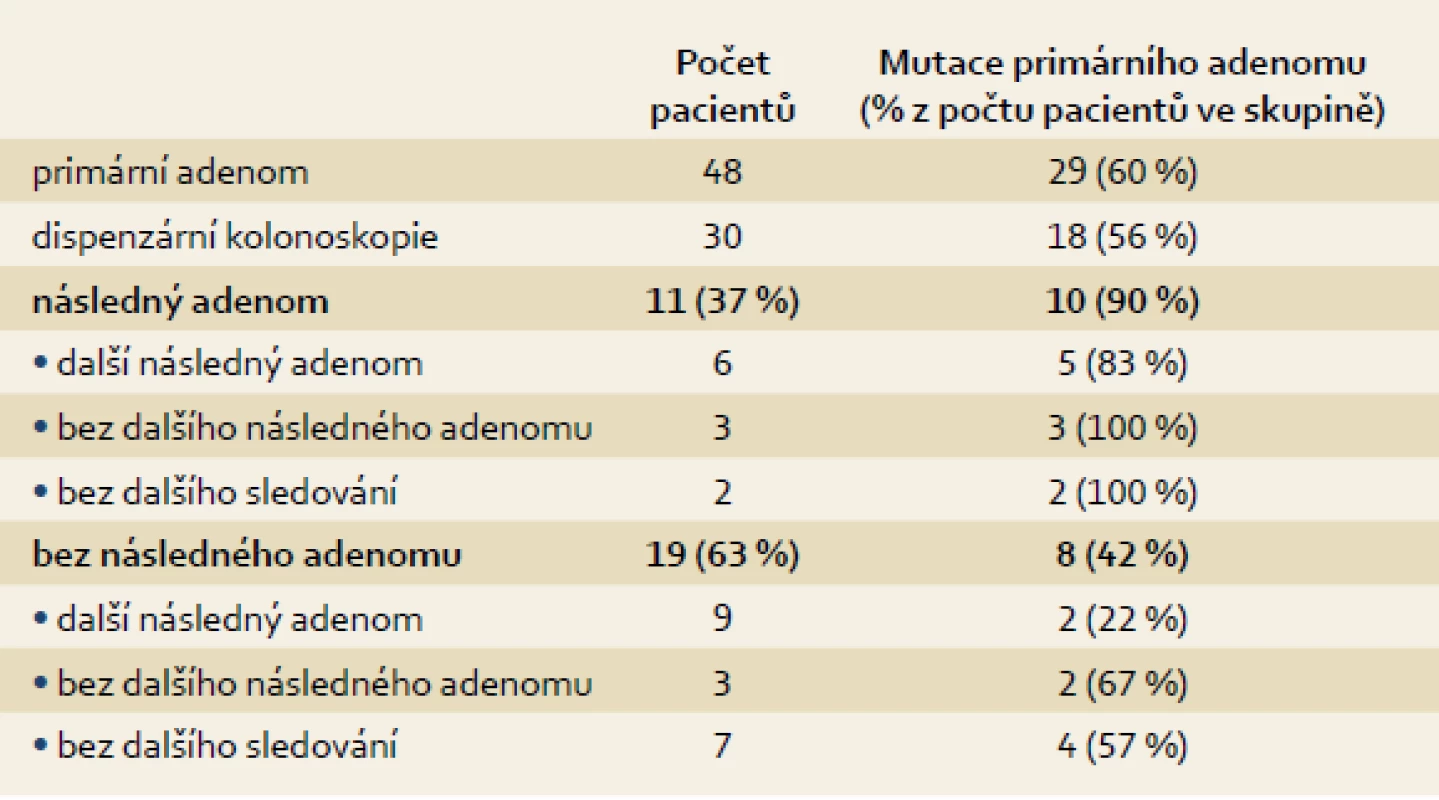
Table 3. Charakteristika mutací. Tab. 3. Mutation characteristics. 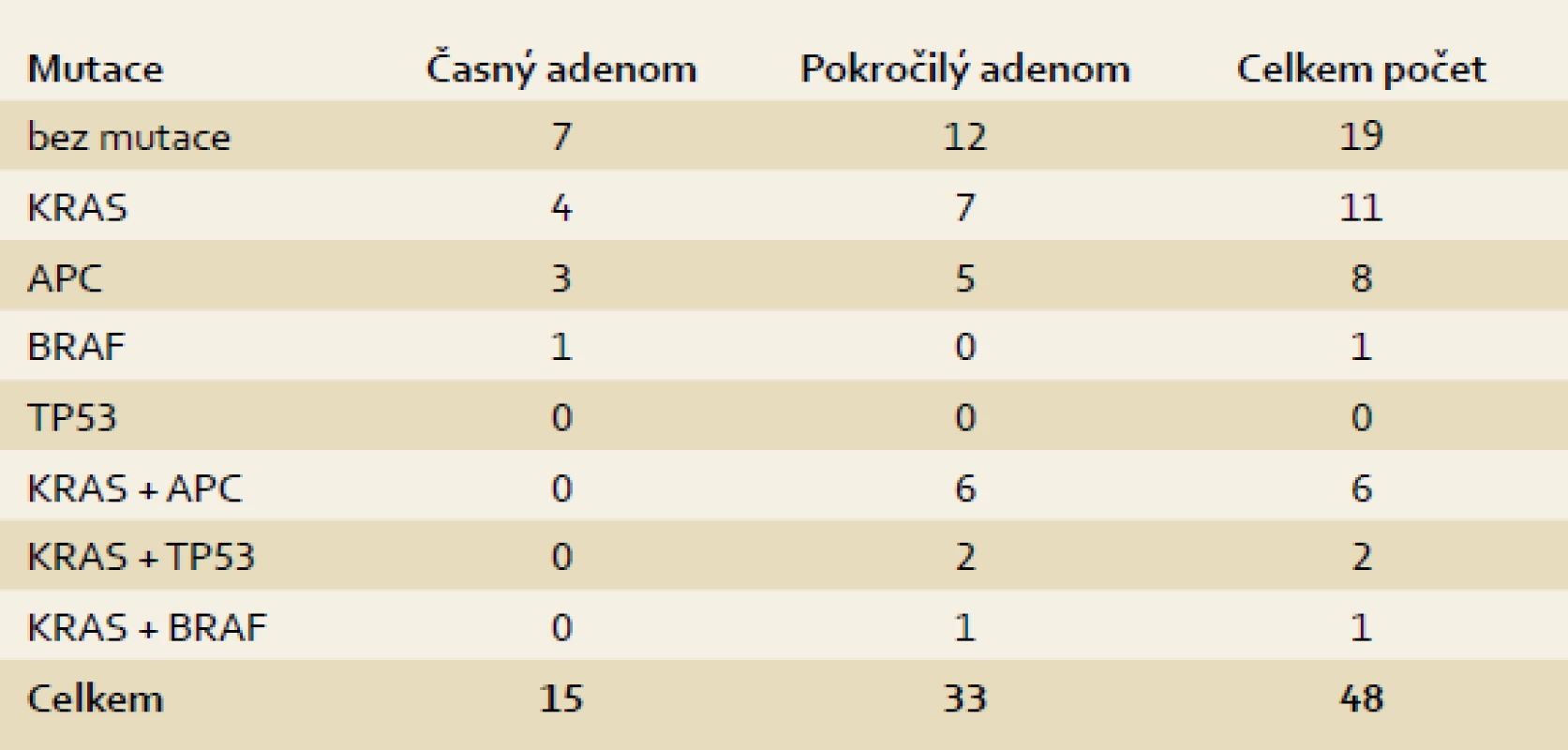
pokročilý adenom: ≥ 10 mm a/nebo vilózní složka > 20 % a/nebo high-grade dysplazie Diskuze
Adenomy jako prekurzorové léze většiny kolorektálních karcinomů jsou často detekovány při kolonoskopickém vyšetření [6]. Tuto skutečnost potvrzují i data z Registru screeningových kolonoskopií v České republice, která ukazují, že adenomový polyp je diagnostikován u 32,1 % vyšetřených pacientů [7,8]. Tito pacienti mají zvýšené riziko následných (rekurentních) adenomů, a tedy eventuálně i kolorektálního karcinomu. Dle výsledků mezinárodních studií vyplývá, že následný adenom je diagnostikován u jedné třetiny až poloviny pacientů po endoskopické polypektomii [9,10]. Toto riziko je závislé na nálezu na vstupní (iniciální) kolonoskopii, zejména na velikosti a histologické charakteristice polypů.
U dlouhodobě sledovaných pacientů v našem souboru se ukázala odlišná míra rizika vzniku kolorektálního karcinomu. Vysoké riziko bylo prokázáno u necelé třetiny pacientů (obr. 2, skupina A), u kterých byly adenomy diagnostikovány opakovaně, minimálně při dvou dispenzárních kolonoskopiích. Dle očekávání byla průměrná velikost adenomů v této skupině největší (19 mm) a převažovala HGD nad LGD (4 vs 2). Na druhé straně, nejmenší riziko rekurence bylo zaznamenáno u přibližně u 14 % pacientů (obr. 2, skupina D), ve které nebyl následný adenom v průběhu sledování prokázán. V této skupině převažovali mladší pacienti (průměrný věk 45 let) s časnými polypy (pouze LGD), které se taktéž často vyskytovaly ve skupinách B a C. Rozložení adenomů odpovídalo publikovaným datům o častějším výskytu kolorektálního karcinomu v levém tračníku a rektu [11] oproti méně častému výskytu lézí v pravém tračníku (pouze 3× ascendens).
Somatické mutace ve vyšetřované sadě genů v iniciálně odebíraných adenomových tkání jsme nalezli u celkem 60 % (29/48) pacientů podstupujících úvodní kolonoskopické vyšetření. Dle očekávání byly nejčastěji nalézanými mutace genu KRAS u cca 40 % (19/48), naopak mutace genu TP53 byly nalezeny pouze u 2 % (2/48). Z hlediska tzv. mutačního modelu vývoje sporadického kolorektálního karcinomu transformací z adenomových polypů je tak zajímavé srovnání s poměrným zastoupením těchto somatických mutací nalézaných u kolorektálních karcinomů. Srovnání výskytu somatických mutací detekovaných u kolorektálních adenomů, resp. karcinomů je uvedeno v obr. 3. Z tohoto je zřejmé, že celkový podíl tkání nesoucí některou ze sledovaných mutací je u obou skupin srovnatelný (58 %, resp. 60 %). Toto zjištění není překvapivé a lze jej interpretovat tak, že minimálně část adenomů a karcinomů bez prokázané přítomnosti somatické mutace představuje molekulárně odlišnou kategorii na rozdíl od ostatní většiny, která je často označována jako tzv. mutátorový typ vykazující chromozomální nestabilitu (chromosomal instability – CIN) [12]. Aberantní kolorektální tkáně s absencí CIN znaků (a tedy většinou i bez detekovatelných mutací v genech KRAS, APC či TP53) často vykazují tzv. epigenetické poruchy na úrovni DNA metylace, tzv. metylační fenotyp CIMP (CpG island methylation phenotype). Do této skupiny mohou být přiřazeny polypy nesoucí mutace genu BRAF, neboť právě výskyt hypermetylace bývá často mutací BRAF provázen. Z morfologického hlediska se nejčastěji jedná o tzv. pilovité polypy (serrated polyps) [13]. Rozsáhlá retrospektivní studie Dana-Farber Cancer institute a Harvard Medical School zahrnující více než 88 tisíc pacientů uvádí, že výrazná většina nádorů diagnostikovaných do pěti let po úvodní kolonoskopii nebo sigmoideoskopii vykazuje některý z uvedených fenotypů CIN nebo CIMP [14].
Image 3. Porovnání četnosti mutací u adenomů a karcinomů. Fig. 3. Comparison of mutation frequency in adenomas and carcinomas. 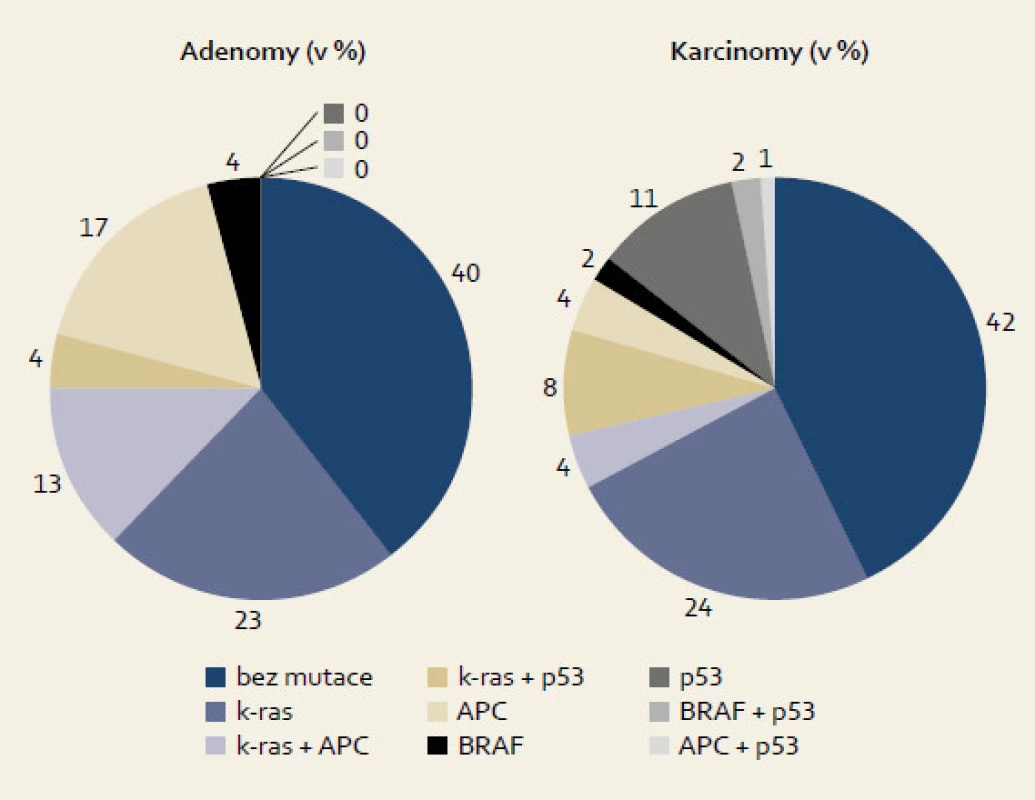
Při stejném podílu mutovaných vzorků u obou skupin (obr. 3) vzrůstá výrazně u karcinomů podíl vzorků, které nesou více mutací najednou. Současně je zřejmé, že zatímco podíl mutací genu KRAS je v obou typech tkání obdobný (40 %, resp. 42 %), karcinomy vykazují výrazně vyšší podíl přítomnosti mutace genu p53 v porovnání s adenomovými polypy (22 % vs 4 %). Toto pozorování by mohlo potvrzovat význam mutace genu p53 jako pozdního jevu v sekvenci adenom-karcinom tak, jak byla představena v původním Vogelsteinově modelu [15] popisujícím kolorektální karcinogenezi u sporadických kolorektálních nádorů vykazujících CIN fenotyp.
Jedním z nejdůležitějších výsledků této studie je zjištění statisticky významně častější časné rekurence adenomů nesoucích některou ze sledovaných mutací. Přestože se v daném případě stále jedná o vyhodnocení relativně malého souboru (opakované několikaleté sledování bylo provedeno u podskupiny 21 pacientů), lze se domnívat, že právě CIN fenotyp, charakterizovaný přítomností některé ze sledovaných mutací, je faktorem predikujícím časnou rekurenci adenomových polypů a pravděpodobně i následných karcinomů [16]. Tuto hypotézu bude třeba ověřit dodatečnou metylační analýzou všech vzorků zaměřenou na identifikaci CIMP fenotypu, především u vzorků, u kterých nebyly nalezeny somatické mutace, případně se jednalo o mutaci BRAF.
Závěr
Časná detekce adenomů a dodržování dispenzárních intervalů je důležitá, neboť u mnohých pacientů dochází k opakovaným rekurencím adenomu. Pilotní výsledky ukazují, že především CIN fenotyp může představovat komplementární rizikový faktor.
Poděkování
Autoři děkují Simoně Birtové a MUDr. Gabriele Vojtěchové za významný přínos k organizaci studie a zpracovávání dat.
Tato práce byla podpořena granty PRVOUK-P27/LF1/1, IP MO 1012 a IGA MZ č. NT14383.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 6. 9. 2013
Přijato: 1. 10. 2013
MUDr. Štěpán Suchánek
Interní klinika 1. LF UK a ÚVN – VFN
U Vojenské nemocnice 1200, 162 00 Praha 6
stepan.suchanek@uvn.cz
Sources
1. Dušek L, Mužík J, Pavlík T et al. Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce. Gastroent Hepatol 2012; 66(5): 331–339.
2. Zavoral M, Suchanek S, Zavada F et al. Colorectal cancer screening in Europe. World J Gastroenterol 2009; 15(47): 5907–5915.
3. Atkin W, Valori R, Kuipers EJ et al. Evaluation and interpretation of screening outcomes. In: Segnan N, Patnick J, von Karsa L (eds). European guidelines for quality assurance in colorectal cancer screening and diagnosis, 1st ed. Luxembourg: Publications Office of the European Union 2010; 273–298.
4. Quirke P, Risio M, Lambert R et al. Quality assurance in pathology in colorectal cancer screening and diagnosis. In: Segnan N, Patnick J, von Karsa L (eds). European guidelines for quality assurance in colorectal cancer screening and diagnosis, 1st ed. Luxembourg: Publications Office of the European Union 2010; 205–232.
5. Minarik M, Minarikova L, Hrabikova M et al. Application of cycling gradient capillary electrophoresis to detection of APC, K-ras, and DCC point mutations in patients with sporadic colorectal tumors. Electrophoresis 2004; 25(7–8): 1016–1021.
6. Imperiale TF, Wagner DR, Lin CY et al. Risk of advanced proximal neoplasms in asymptomatic adults according to the distal colorectal findings. N Engl J Med 2000; 343(3): 169–174.
7. Zavoral M, Suchánek Š, Májek O et al. Národní program screeningu kolorektálního karcinomu v České republice – minulost, přítomnost a budoucnost. Gastroent Hepatol 2012; 66(5): 345–349.
8. Suchanek S, Majek O, Vojtechova G et al. Colorectal cancer prevention in the Czech Republic: time trends in performance indicators and current situation after 10 years of screening. Eur J Cancer Prev 2013. [In press].
9. Robertson DJ, Greenberg ER, Beach M et al. Colorectal cancer in patients under close colonoscopic surveillance. Gastroenterology 2005; 129(1): 34–41.
10. Martinez ME, Baron JA, Liebermann DA et al. A pooled analysis of advanced colorectal neoplasia diagnoses after colonoscopic polypectomy. Gastroenterology 2009; 136(3): 832–841.
11. Caldarella A, Crocetti E, Messerini L et al. Trends in colorectal incidence by anatomic subsite from 1985 to 2005: a population-based study. Int J Colorectal Dis 2013; 28(5): 637–641.
12. Issa JP. Colon cancer: it's CIN or CIMP. Clin Cancer Res 2008; 14(19): 5939–5940.
13. Jass JR. Classification of colorectal cancer based on correlation of clinical, morphological and molecular features. Histopathology 2007; 50(1): 113–130.
14. Nishihara R, Wu K, Lochhead P et al. Long-term colorectal-cancer incidence and mortality after lower endoscopy. N Engl J Med 2013; 369(12): 1095–1105.
15. Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell 1990, 61(5): 759–767.
16. Habermann JK, Brucker CA, Freitag--Wolf S et al. Genomic instability and oncogene amplifications in colorectal adenomas predict recurrence and synchronous carcinoma. Mod Pathol 2011; 24(4): 542–555.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2013 Issue 5-
All articles in this issue
- Gastrointestinální onkologie
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

