-
Medical journals
- Career
Hereditárny difúzny karcinóm žalúdka
Authors: P. Mlkvý 1; M. Fritzmann 2; P. Minárik 1; K. Macháleková 1; I. Čavarga 1; A. Mateášik 1
Authors‘ workplace: Onkologický ústav Sv. Alžbety, Bratislava 1; Interné oddelenie NsP, Partizánske 2
Published in: Gastroent Hepatol 2013; 67(5): 361-365
Category: Gastrointestinal Oncology: Review Article
Overview
Hereditárny difúzny karcinóm žalúdka (HDGC) je dedičnou formou difúzneho typu karcinómu žalúdka s vysokou invazivitou. Približne 10 % pacientov s karcinómom žalúdka je familiárnych, pričom 3 % je autozomálne dedičných s vysokou penetranciou. HDGC je autozomálne dominantným dedičným typom karcinómového syndrómu, pri ktorom sa u postihnutých jedincov vyvinie v mladom veku difúzny karcinóm žalúdka. Mutáciou CDH1 génu sa inaktivovaný E-cadherin identifikuje u 30–50 % pacientov. Nosiči mutácie CDH1 génu majú približne 70% celoživotné riziko vzniku difúzneho karcinómu žalúdka (DGC), pričom u žien je 20 - až 40% riziko vzniku lobulárneho karcinómu prsníka. Bežné endoskopické sledovanie sa ukázalo ako inefektívne v diagnostikovaní včasnej formy HDGC. U nosičov mutácie CDH1 génu je geneticky indikovaná profylaktická totálna gastrektómia. Táto sa odporúča u pacienta päť rokov mladšieho ako je najmladší člen rodiny s karcinómom žalúdka a spravidla po 20. roku života. Pri odmietnutí odporúčaného chirurgického zákroku alternatívnu možnosť predstavuje intenzívne endoskopické sledovanie 2× ročne s početnými „protokolárnymi“, ako aj cielenými biopsiami, spojené s chromoendoskopiou, resp. NBI. Preventívna totálna gastrektómia predstavuje v súčasnosti jedinú kuratívnu možnosť pre pacientov s HDGC.
Kľúčové slová:
hereditárny difúzny karcinóm žalúdka – mutácia – gastrektómia
Karcinóm žalúdka je celosvetovo v incidencii štvrtou a v mortalite celosvetovo druhou najčastejšou malignitou. V Slovenskej republike v incidencii je siedmou najčastejšou malignitou u mužov a deviatou u žien. Laurénová klasifikácia rozoznáva dva hlavné histologické typy, a to:
- Intestinálny typ, ktorý je podstatne častejší a výrazne závisí od environmentálnych faktorov, ako sú napr. vplyvy stravovania (najmä s vysokým obsahom soli), fajčenia, prítomnosťou infekcie H. pylori.
- Difúzny karcinóm žalúdka ( DGC), ktorý je podstatne zriedkavejší a závislejší od individuálnych často aj genetických daností [1,2].
Hereditárny difúzny karcinóm žalúdka (HDGC) bol prvý raz popísaný v roku 1964 v troch Maorských rodinách na Novom Zélande. V roku 1998 Guildford identifikoval príčinu tohto autozomálne dominantne dedičného syndrómu (u tých istých Maorských rodín), ktorého základ predstavuje mutácia E-cadherin génu (CDH1 epiteliálny cadherin) [1]. Táto mutácia CDH1 sa vyskytuje približne u 40 % rodín s definovaným HDGC, pričom ženy s uvedenou mutáciou majú zvýšené celoživotné riziko vzniku lobulárneho karcinómu prsníka s penetranciou od 38 do 54 % [5,6]. Poznanie nosičstva CDH1 mutácie u pacienta má výpovednú hodnotu rizika vzniku difúzneho karcinómu žalúdka (DGC), ktorá je limitovaná len jej prípadnou redukovanou penetranciou, ktorá sa pohybuje od 67 % do 83 % (s priemerom okolo 70 %) [1,7]. Rôzny stupeň penetrancie spolu s variabilným vekom vzniku DGC predstavujú dva významné faktory pri rozhodovaní indikácie profylaktickej totálnej gastrektómie [7]. Priemerný vek vzniku HDGC je 38 rokov, avšak s prítomným širokým vekovým rozptylom od 16 do 82 rokov [3].
CDH1 mutácie
CDH1 zárodočné mutácie sú zriedkavé a zodpovedajú za približne 1 % incidenciu karcinómov žalúdka, čo platí najmä v krajinách s nízkou incidenciou (USA, Veľká Británia, Kanada, Nemecko). Podstatne zriedkavejšie sa vyskytuje v krajinách s vysokou incidenciou, ako sú Japonsko a Kórea, Portugalsko [1,8]. Okrem lobulárneho karcinómu prsníka u žien sa zárodočné CDH1 mutácie (zatiaľ kauzistického charakteru) zistili v rodinách s kolorektálnym karcinómom, karcinómom pľúc, slinných žliaz a tiež prostaty [9,10].
CDH1 je lokalizovaný na chromozóme 16q 22.1 a dekóduje kalcium dependentný bunkovo adhezívny glykoproteín E-cadherín. E-cadherín je transmembránovým proteínom spájajúcim cytoskeletónový aktín s komplexom α-catenin, ß-catenin a γ-catenin. Funkčne E-cadherin zabezpečuje udržiavanie normálnej morfológie tkanív a bunkovej diferenciácie. Vo vzťahu k HDGC sa CDH1 správa ako tumor supresorový gén, ktorého mutácia vedie ku strate bunkových adhézií, k proliferácii, invazivite a k metastázam [8]. U pacientov s HDGC je typickou zárodočnou CDH1 mutáciou trunkálna mutácia prítomná v cca 80 %. Táto mutácia je založená na jednotlivých substitúciách nukleotidov vedúcich k párovým inzerciám alebo deléciám s následnou tzv. trunkáciou proteínov. Tzv. missense mutácie, ktoré boli kauzatívne popísané u niekoľkých pacientov, sa nepovažujú za klinicky významné. Okrem uvedených existuje ešte malé percento doposiaľ neklasifikovaných zárodočných mutácií [11]. Všetky zárodočné mutácie sú rozložené pozdĺž génovej štruktúry a vedú k funkčnej haploinsuficiencii E-cadherínu. V žalúdočnej sliznici môže následne dôjsť k tzv. druhému úderu, tj. k somatickej mutácii (zvyčajne k metylácii promótora, k jeho mutácii, resp. straty heterozygozity), ktorá má za následok stratu expresivity E-cadherinu s jeho úplným funkčným vyradením. Zatiaľ nie je známe, nakoľko sú špecifické CDH1 mutácie s rozdielnymi fenotypickými charakteristikami asociované s rozličnou penetráciou, ktorá sa pohybuje od 67 % do 83 % [12].
Genetické testovanie
Ak je to realizovateľné, tak genetické testovanie sa má vykonávať na členovi rodiny – pacientovi postihnutým s DGC. Ak sa u pacienta zistí mutácia CDH1, sú na genetické testovanie indikovaní asymptomatickí členovia rodiny do veku 20 rokov. Ak sa u pacienta s DCG nezistí mutácia CDH1, resp. ak nie je k dispozícii žiaden člen rodiny na testovanie, tak sa považuje negatívny test u asymptomatického člena rodiny za neinformatívny.
Genetický test sa vykonáva najlepšie odberom z periférnej krvi priamo postihnutého pacienta s DGC, resp. u asymptomatického príbuzného. Genetické vyšetrenie z parafínového bločku zostáva poslednou možnosťou.
Kritériá
Základné podmienky predstavujú prítomnosť histologicky overeného difúzneho karcinómu žalúdka u troch prvostupňových príbuzných v akomkoľvek veku alebo prítomnosť dvoch a viac karcinómov žalúdka, pričom aspoň u jedného by mal byť histologicky potvrdený difúzny karcinóm žalúdka do veku 50 rokov. Za týchto predpokladov detekcia mutácií CDH1 génu sa pohybuje približne od 25 % do 50 % [12,13].
Prvé konsezuálne kritériá pre identifikáciu mutácií uvedených rodín boli zrealizované a prezentované v roku 2000 International Gastric Cancer Linkage Consortium a v podstate sú zhodné s vyššie uvedenými podmienkami úspešnosti genetického testovania. Nasledovali tzv. rozšírené kritériá z roku 2007 – „British Columbia Cancer Agency Hereditary Diffuse Gastric Cancer Program“, rozšírené o kritériá testovania lobulárneho karcinómu prsníka. V roku 2010 IGCLC (International Gastric Cancer Linkage Consortium)odporučilo zatiaľ posledné konsenzuálne kritériá genetického testovania CDH1 mutácií nazývané tiež Cambridge kritériá (tab. 1) [13,14].
Table 1. International Gastric Cancer Linkage Consortium – Cambridge kritériá (r. 2010). Rozšírené konsezuálne guideliny testovania mutácií CDH1. Tab. 1. International Gastric Cancer-Linkage Consortium – Cambridgecriteria (2010). Advanced consesual guidelines testing mutations CDH1. 
Konzorcium podporilo aj expertnými histopatológmi diagnostikované nálezy in situ „signet ring cells“, resp. ich pagetoidné usporiadanie uznať ako histologickú verifikáciu spĺňajúcu uvedené podmienky.
Histopatológia
Epigenetická somatická inaktivácia druhej alely CDH1 môže závislosti od fenotypickej penetrancie naštartovať karcinomatózny proces difúzneho karcinómu žalúdka. Medzi včasné nálezy patrí prítomnosť zhluku karcinómových buniek pečatného prsteňa (signet ring cells – SRC), predovšetkým v oblasti proximálneho istmu žalúdočných žliazok, ktorý je časťou proliferatívnej zóny. Nádorové bunky v tejto oblasti sú často proliferatívne, slabo diferencované a lokalizované v superficiálnej oblasti mukózy [12,13]. Ďalší stupeň predstavuje pagetoidná formácia často v hypoproliferatívnom stave, ktorý je charakteristický pre včasný HDGC (eHDGC). Následne sa pozoruje postupne čoraz častejšia prítomnosť nízko diferencovaných karcinomatóznych buniek s mezenchýmovo podobnou morfológiou v intramukóznych karcinomatóznych fokusoch. Na rozdiel od „signet ring buniek“ tieto málo diferencované bunky exprimujú aktivovanú c-SRC kinázu, ktorá je etablovaným spúšťačom epiteliálne--mezenchýmového tranzitu (EMT) a známkou invazívneho fenotypu karcinómu. Aktivácia c-SRC kináza sa udržuje aj v pokročilejších štádiách ochorenia, čo potvrdzuje predpoklad jej nevyhnutnej prítomnosti pri progresii ochorenia [15].
Rozoznávame dva hlavné podtypy difúzneho karcinómu žalúdka, a to: signet ring cell carcinoma (SRC) a slabo diferencovaný karcinóm (poor differenciated carcinoma – PDC), ktoré oba patria do fenotypu HDGC ochorenia (obr. 1, obr. 2). Typickým nálezom včasného SRC (eSRC) je prítomnosť multifokálnych fokusov signet ring cell karcinómu tesne pod intaktným povrchovým epitelom, ktoré pri absencii postihnutia lymfatického systému predstavujú T1a štádium a zvyčajne sú do veľkosti 1 mm. Nález SRC je typickým nálezom včasného HDGC. Prítomnosť aj SRC, aj slabo diferencovaných buniek s inváziou do muscularis mucosae je charakteristická pre T2 štádium, pričom multifokálne lézie sú spravidla veľkosti do 3 mm. Ďalšou akvizíciou slabo diferencovaných karcinómových buniek dochádza k postupnej invazivite hlbších vrstiev muscularis propria a serózy (št. T3, T4). Charakteristickým nálezom týchto pokročilých štádií je prakticky uniformná prítomnosť buniek slabo diferencovaného karcinómu (PDC). Prerastanie všetkých svalových vrstiev, rýchla peritoneálna disseminácia a metastatické šírenie sú typickým znakom pokročilých foriem. Je zaznamenaná aj geografická variabilita lokalizácií HDGC, i keď zatiaľ na pomerne malých súborov pacientov. Typickými predilekčnými lokalitami v žalúdku sú subkardiálna oblasť, najmä gastroezofageálnej junkcie, ako aj oblasť proximálnej tretiny žalúdka, niekde však prevládajú lokalizácie karcinómu v prepylorickom antre [15–17].
Image 1. Signet ring cell karcinom žalúdka (Pat. anat. odd., Onkol. ústav sv. Alžbety, Bratislava). Fig. 1. Signet ring cell carcinoma of the stomach (Pat. anat. dept., Oncol. institute of St. Elizabeth, Bratislava). 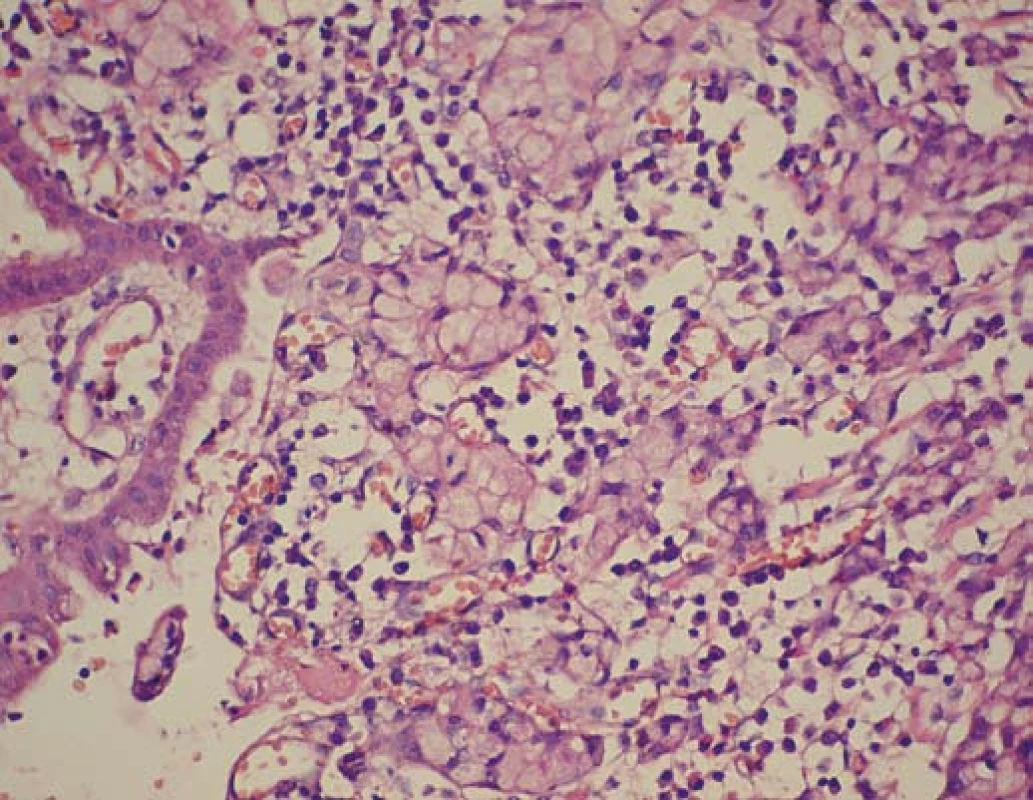
Image 2. Málo diferencovaný difúzny karcinóm žalúdka (Pat. anat. odd., Onkologický ústav sv. Alžbety, Bratislava). Fig. 2. Poorly differentiated diffuse gastric cancer (Pat. anat. odd., Cancer institute of St. Elizabeth, Bratislava). 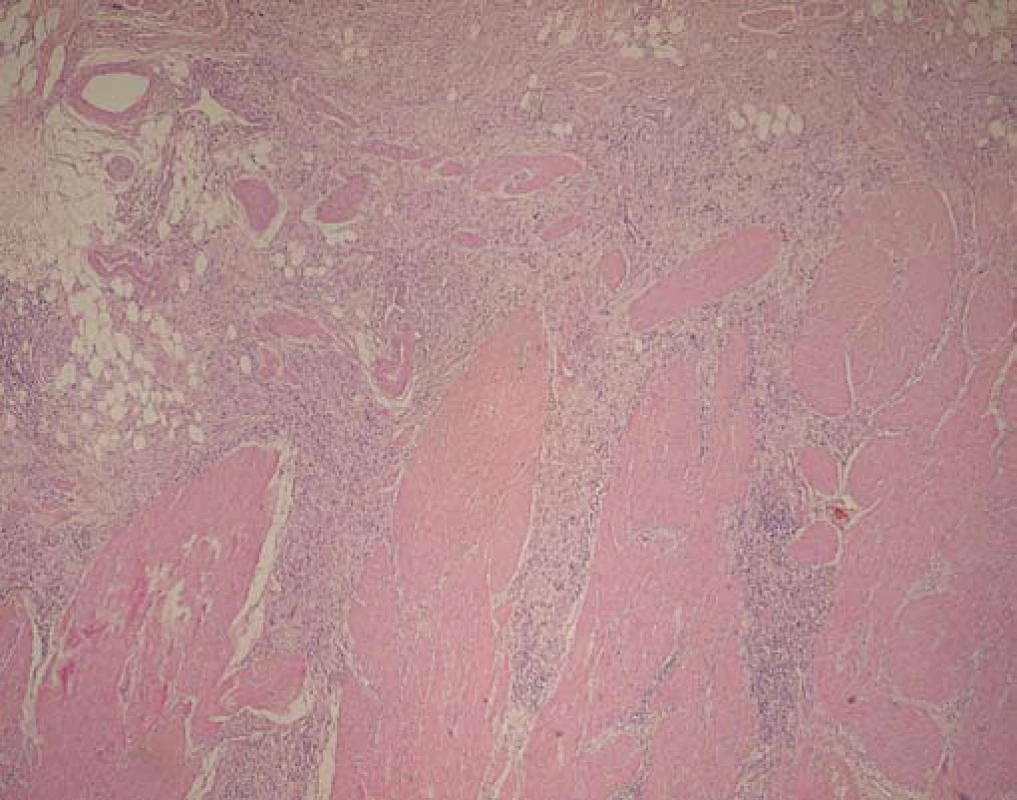
Klinický manažment
Manažment HDGC si vyžaduje multidisciplinárnu spoluprácu genetika, gastroenterológa, histopatológa a chirurga, a v súčasnosti je realizovaný podľa tzv. Stanfordského protokolu (tab. 2) [14].
Table 2. Stanfordský protokol manažmentu HDGC. Tab. 2. Stanford protocol management of HDGC. 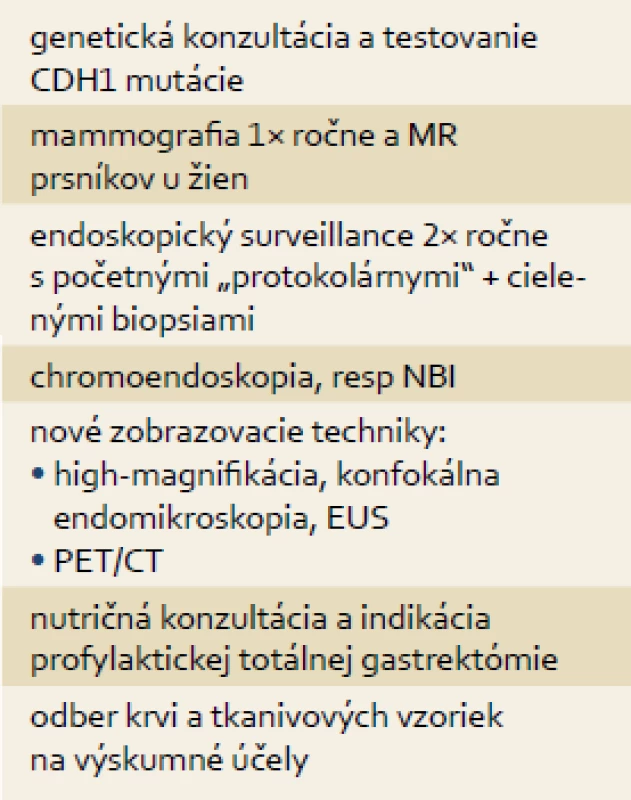
Genetické testovanie
Genetické testovanie spravidla je optimálne pri možnosti vyšetriť postihnutého pacienta, a to z periférnej krvi, pričom druhou možnosťou zostáva vyšetrenie zdravého príbuzného – potenciálneho nosiča takisto odbermi periférnej krvi. Poslednou možnosťou je vyšetrenie parafínových bločkov. Po odobratí anamnézy sa vyšetrujú ďalší prvostupňoví a druhostupňoví príbuzní spĺňajúci Cambridgské kritériá odporúčajúce testovať od 16. roku života [8]. K dispozícii sú dve diagnostické genetické metódy, a to denaturácia s high performance liquidnou chromatografiou (DHPLC) alebo metódou priamej sekvenácie [18].
Endoskopické sledovanie
Napriek tomu, že profylaktická totálna gastrektómia je jedinou efektívnou liečebnou metódou prevencie vývoja, resp. šírenia sa HDGC, nie každý nositeľ uvedenej mutácie je ochotný podrobiť sa uvedenému profylaktickému zákroku. Surveillance endoskopia – chromoendoskopia je indikovaná u jedincov mladších ako 20 rokov a odporúča sa začať v 16. roku života s jednoročnými kontrolami [8,17,18]. Takisto je indikovaná u jedincov odmietajúcich profylaktickú gastrektómiu s odporúčanými polročnými intervalmi sledovania. Včasné štádiá HDGC sú ohraničené na žalúdočnú sliznicu, pričom niekedy môžu byť viditeľné skúseným endoskopistom ako drobné bledé až biele drobné fokusy. Tieto farebné rozdiely možno zvýrazniť chromoendoskopiou, pričom najväčšie skúsenosti sú popísané s kombináciou metylénovej modrej s kongo červeňou, kde sa dosiahla až 41% diagnostická úspešnosť. Avšak následný objav účinku kongo červene, ako potenciálneho karcinogénu, prakticky zastavil diagnostické vyšetrovanie v uvedenej kombinácii [19]. Britskí autori odporúčajú protokolárne stanovený bioptický odber z predilekčných lokalít (z prevažne v proximálnej tretine žalúdka), ktorých počet by mal byť aspoň 24 a mali by byť doplnené cielenými biopsiami zo suspektných fokálnych lézií [14,19]. Ostatné potenciálne surveillance techniky zatiaľ zostávajú v kauzistickej rovine a predstavujú NBI, konfokálnu endomikroskopiu, PET//CT, prípadne EUS [19]. Ak sa pacient s uvedenou mutáciou rozhodne pre endoskopické sledovanie, je potrebná konzultácia s gastroenterológom s podrobnou inštruktážou jednoznačnému vyhýbaniu sa rizík spojených so vznikom spontánneho karcinómu žalúdka. Tieto obsahujú známe faktory, ako vyhýbanie sa údeným a nasoleným konzervovaným jedlám, fajčeniu, a naopak pridávaním do stravy viac zeleniny, ovocia, zvyšovanie si fyzickej zdatnosti. Pri zistení infekcie H. pylori je u nosičov mutácie indikovaná eradikačná liečba [13].
Chirurgická liečba
U pacientov starších ako 20 rokov vzrastá postupne riziko vzniku HGDC a odkladanie chirurgického riešenia môže mať fatálne následky, najmä pri alternatíve bežného endoskopického sledovania (bez chromoskopie, resp. iných vyššie zmienených techník) [19].
Naopak u pacientov mladších ako 20 rokov je riziko vzniku karcinómu menšie ako 1 %, čo predstavuje menšie riziko ako je riziko morbidity a mortality spojenej s chirurgickým zákrokom [14]. Ako chirurgický zákrok sa odporúča jednoznačne totálna gastrektómia s mimoriadnou pozornosťou venovanou resekcii v ezofagogastrickej junkcii. Totálna gastrektómia má byť spojená s D2 disekciou lymfatických uzlín (tak u asymptomatických pacientov, ako aj pacientov so včasným HDGC), pri zachovaní sleziny. Následne sa odporúča Roux-en-Y ezofagojejunostómia bez rezervoárneho jejunálneho pouchu. V štúdii žalúdočných resekátov sa u pacientov s mutáciami CDH1 zistila až v 90 % prítomnosť včasného HDGC. A naopak pri symptomatických HDGC pacientov dĺžka prežívania až v 80 % nepresahuje dva roky [18,20].
Záver
Včasný HDGC je charakterizovaný mnohopočetnými drobnými fokusmi lokalizovanými predovšetkým v subkardiálne oblasti, resp. v proximálnej tretiny žalúdka, pričom v iných zemepisných končinách (napr. Nový Zéland) sa pozoruje pomerne častá aj prepylorická lokalizácia. Čas progresie týchto drobných fokusov včasného HDGC je pomerne výrazne variabilný a nedá sa určiť. Vďaka tomuto často hypoproliferatívnemu stavu môžu multicentrické fokusy eHDGC v „spiacom režime“ s limitáciou na mukózu pretrvávať mnoho rokov. Možnosti manažmentu uvedeného ochorenia sú prakticky dve. Profylaktická gastrektómia a endoskopické prísne sledovanie (v kombinácii s vyššie zmienenými technikami) [19]. Nevyhnutným predpokladom úspešného manažmentu je úzka multidisciplinárna spolupráca genetika, gastroenterológa, histopatológa a chirurga, ktorí by mali byť skúsenými špecialistami a vybavení kvalitnou technológiou.
V molekulárnom výskume difúzneho karcinómu žalúdka na úrovni klinických trialov je v popredí v súčasnosti výskum c-SRC-kinázových inhibítorov, od ktorých sa očakáva výrazné spomalenie invazivity intramukóznych fokálnych karcinómov do submukózy. Teoreticky by uvedená hypotéza mohla výraznejšie oddialiť chirurgické riešenie. V posledných rokoch prebieha intenzívny výskum aj v oblasti epigenetických faktorov ako ďalších spúšťačov v procese karcinogenézy HDGC, a to hlavne v oblasti demetylačných agensov a inhibítorov deacetylázy [21].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 6. 9. 2013
Přijato: 4. 10. 2013
prof. MUDr. Peter Mlkvý , CSc.
Onkologický ústav sv. Alžbety
Heydukova 10, 812 50 Bratislava
pmlkvy@ousa.sk
Sources
1. Guilford P, Hopkins J, Harraway J et al. E-cadherin germline mutations in familial gastric cancer. Nature 1998; 392(6674): 402–405.
2. Pleško I, Obšitníková A. Incidencia zhubných nádorov v Slovenskej republike. Národný onkologický register SR 2009.
3. Grady WM, Willis J, Guilford PJ et al. Methylation of CDH1 promoter as the second genetic hit in hereditary diffuse gastric cancer. Nat Genet 2000; 26(1): 16–17.
4. Pharoah PD, Guilford P, Caldas C et al. Incidence of gastric cancer and breast cancer in CDH1 (E-cadherin) mutation carriers from hereditary diffuse gastric cancer families. Gastroenterology 2001; 121(6): 1348–1353.
5. Oliveira C, Senz J ,Kaurah P et al. Germline CDH1 deletions in hereditary diffuse gastric cancer families. Hum Mol Genet 2009; 18(9): 1545–1555.
6. Keller G, Vogelsang H, Becker I et al. Diffuse type gastric and lobular breast carcinoma in a familial gastric patient with an E-cadherin germline mutation. Am J Pathol 1999; 155(2): 337–342.
7. Lynch HT, Silva E, Wirtzfeld D et al. Hereditary diffuse gastric cancer: prophylactic surgical oncology implications. Surg Clin North Am 2008; 88(4): 759–778.
8. Blair V, Martin I, Shaw D et al. Hereditary diffuse gastric cancer: diagnosis and management. Clin Gastroenterol Hepatol 2006; 4(3): 262–275.
9. Richards FM, McKee SA, Rajpar MH et al. Germline E-cadherin gene (CDH1) mutations predispose to familial gastric cancer and colorectal cancer. Hum Mol Genet 1999; 8(4): 607–610.
10. Ikonen T, Matikainen M, Mononen N et al. Association of E-cadherin germ-line alterations with prostate cancer. Clin Cancer Res 2001; 7(11): 3465–3471.
11. Suriano G, Seixas S, Rocha J et al. A model to infer the pathogenic significance of CDH1 germline missense variants. J Mol Med (Berl) 2006; 84(12): 1023–1031.
12. Oliveira C, Seruca R, Carniero F. Genetics, pathology, and clinics of familial gastric cancer. Int J Surg Pathol 2006; 14(1): 21–33.
13. Guilford P, Blair V, More H et al. A short guide to hereditary diffuse gastric cancer. Hered Cancer Clin Pract 2007; 5(4): 183–194.
14. Fitzgerald RC, Hardwick R, Huntsman D et al. Hereditary diffuse gastric cancer: updated consensus guidelines for clinical management and directions for future research. J Med Genet 2010; 47(7): 436–444.
15. Charlton A, Blair V, Shaw D et al. Hereditary diffuse gastric cancer: predominance of multiple foci of signet ring cell carcinoma in distal stomach and transitional zone. Gut 2004; 53(6): 814–820.
16. Brooks-Wilson AR, Kaurah P, Suriano G et al. Germline E-cadherin mutations in hereditary diffuse gastric cancer. J Med Genet 2004; 41(7): 508–517.
17. Barber ME, Save V, Carneiro F et al. Histopathological and molecular analysis of gastrectomy specimens from hereditary diffuse gastric cancer patients has implications for endoscopic surveillance of individuals at risk. J Pathol 2008; 216(3): 286–294.
18. Cisco RM, Ford JM, Norton JA. Hereditary diffuse gastric cancer: implications of genetic testing for screening and prophylactic surgery. Cancer 2008; 113 (7 Suppl): 1850–1856.
19. Shaw D, Blair V, Framp A et al. Chromoendoscopic surveillance in hereditary diffuse gastric cancer: an alternative to prophylactic gastrectomy? Gut 2005; 54(4): 461–468.
20. Chen Y, Kingham K, Ford JM et al. A prospective study of total gastrectomy for CDH1-positive hereditary diffuse gastric cancer. Am Surg Oncol 2011; 18(9): 2594–2598.
21. Yoo CB , Jones PA. Epigenetic therapy of cancer: past, present and future. Nat Rev Drug Discov 2006; 5(1): 37–50.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2013 Issue 5-
All articles in this issue
- Gastrointestinální onkologie
- Metodika adresného zvaní občanů do českého programu screeningu nádorů tlustého střeva a konečníku
- Vliv klinických a molekulárních faktorů na odhad rekurence kolorektálních adenomů u dlouhodobě sledovaných pacientů
- Postavenie neoadjuvantnej terapie v multimodálnej liečbe karcinómu rekta – klinické výsledky
- Hereditárny difúzny karcinóm žalúdka
- Cílená léčba karcinomu pankreatu – minulost či budoucnost?
- Lymfomy tenkého střeva
- Stav onkochirurgické péče a vzdělávání v onkochirurgii v České republice
- Multidisciplinární přístup v diagnostice a léčbě karcinomu žaludku
- Prvních 1 000 transplantací jater v IKEM
- Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby
- Transplantace jater pro primární sklerozující cholangitidu
- Méně časté indikace k ortotopické transplantaci jater
- Vývoj postupů v léčbě akutního selhání jater
- Endosonograficky navigovaná tenkoihlová aspiračná biopsia zo solídnych pankreatických más – presnosť a impakt na liečbu u 358 pacientov
-
XXII. jarní setkání Loket 2013 – Neoplazie žaludku
3. postgraduální kurz společnosti pro gastrointestinální onkologii - Životní jubileum prof. Miroslava Zavorala
- Picoprep – očistný prostředek s dvojím účinkem
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Picoprep – očistný prostředek s dvojím účinkem
- Lymfomy tenkého střeva
- Transplantace jater pro primární sklerozující cholangitidu
- Hereditárny difúzny karcinóm žalúdka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

