-
Medical journals
- Career
Primární sklerozující cholangoitida u pacientů s idiopatickými střevnímí záněty
Authors: P. Matějková 1; P. Drastich 2; A. Jungwirthová 1
Authors‘ workplace: Sanatorium sv. Anny, EGK s. r. o., Praha, 2Klinika hepatogastroenterologie, IKEM, Praha 1
Published in: Gastroent Hepatol 2012; 66(3): 210-213
Category: IBD: Case Report
Overview
Primární sklerozující cholangoitida (PSC) je chronické cholestatické onemocnění postihující žlučovody, jehož příčina není známa. Charakteristický je zánět a difuzní fibrózní přestavba žlučových cest. V terminálním stadiu se PSC vyvíjí v cirhózu s portální hypertenzí a jaterní selhání vyžadující transplantaci jater. Jedinečným rysem tohoto onemocnění je velmi častá asociace s idiopatickými střevními záněty (IBD), zejména s ulcerózní kolitidou (UC), která se udává kolem 80 %. UC s asociovanou PSC probíhá spíše jako lehká pankolitida, u mnohých pacientů bez postižení rekta a s častým výskytem back-wash ileitidy. Opačně pouze kolem 2–7 % pacientů s IBD vyvine PSC. Pacienti s PSC mají vysoké riziko cholangiocelulárního karcinomu a život ohrožujících cholangoitid. Jedinou efektivní léčbou je transplantace jater. Uvádíme dvě kazuistiky diagnostiky PSC u mladých pacientů s UC. V prvním případě se jedná o poměrně snadnou diagnózu od okamžiku, kdy je na PSC pomýšleno. U této pacientky se objevuje i vzácné postižení pankreatického vývodu. V druhém případě je stanovení diagnózy PSC svízelnější vzhledem k negativnímu cholangiogramu. Jedná se o PSC malých žlučovodů.
Klíčová slova:
idiopatické střevní záněty – primární sklerozující cholangoitida – jaterní testyExtraintestinální komplikace idiopatických střevních zánětů (IBD) mohou být velmi závažnými onemocněními. V případě primární sklerozující cholangoitidy (PSC) je tato choroba vzhledem k neuspokojivým terapeutickým možnostem závažnější než samotné IBD. PSC zaujímá hlavní místo mezi hepatobiliárními komplikacemi IBD. Prosté zvýšení jaterních testů u pacientů s IBD se pohybuje v poměrně širokém rozmezí u 10–50 % pacientů, v tomto ohledu je nutné vždy pátrat po příčině a vyloučit možnost PSC. Diferenciálně diagnosticky připadá v úvahu zejména jaterní steatóza, cholelitiáza a polékové poškození jater.
PSC probíhá jako chronické onemocnění neznámé příčiny s typickým cholestatickým rysem způsobeným zánětem a difuzní fibrózní přestavbou žlučových cest. Postihnout může extra i intrahepatální žlučovody. PSC se až v 80 % případů vyskytuje současně s IBD, a to v naprosté většině případů s ulcerózní kolitidou (UC). Toto onemocnění má pak specifický fenotyp, probíhá jako kolitida s mírnou aktivitou, a tedy s nižším rizikem nutnosti kolektomie [1,2], u mnohých pacientů bez postižení rekta, s výraznějšími změnami v pravostranném tlustém střevě a s častým záchytem back-wash ileitidy [3]. Asi u 2–7 % pacientů s UC je diagnostikována PSC [4].
Subjektivní příznaky PSC jsou minimální, pacient si může stěžovat na únavu, slabost, dyspeptické obtíže, váhový úbytek, pruritus. V laboratoři bývají zvýšené cholestatické enzymy. Diagnózu stanovujeme pomocí MRCP (magnetická rezonanční cholangipankreatikografie) či ERCP (endoskopická retrográdní cholangiopankreatikografie), jaterní biopsie určuje spíše stadium onemocnění. Závažnost tohoto onemocnění podtrhuje zejména fakt, že jedinou efektivní léčbou je správně načasovaná transplantace jater. Median přežití pacientů s PSC se pohybuje kolem 12–17 let. V 8–30 % případů se vyskytne cholangiogenní karcinom, který se může objevit kdykoli v průběhu nemoci a má infaustní prognózu [5]. V terminálním stadiu PSC se vyvíjí jaterní cirhóza s portální hypertenzí. Navíc mají pacienti s UC a PSC zhruba čtyřikrát zvýšenou incidenci kolorektálního karcinomu oproti pacientům jen s UC [6]. Většinou se jedná o pravostranný nádor s minimální nebo žádnou symptomatologií, proto jsou důležité pravidelné koloskopie.
Kazuistika 1
Žena, narozená v roce 1977, nikdy nebyla vážněji nemocná. Diagnózu UC měla stanovenou ve 20 letech věku. Do roku 2007 byla léčena na jiném pracovišti, užívala mesalazin 800 mg denně a symptomatickou léčbu antidiarhoiky (etylmorfin). Koloskopie prokazovala postižení tlustého střeva do 50 cm a elevované jaterní testy (ALT 1,7 µkat/l, ALP 4,6 µkat/l). Rozbor anamnézy potvrdil, že hodnoty jaterních testů měla zvýšené několik let.
V srpnu 2007 pacientka již na našem pracovišti podstoupila koloskopii a bylo zjištěno difuzní postižení tlustého střeva s mírnou až střední aktivitou. V této době měla vysoké hodnoty jaterních testů: AST 3,58 µkat/l, ALT 4,6 µkat/l, GMT 6,98 µkat/l, ALP 15 µkat/l a pozitivitu pANCA protilátek. Zánětlivá aktivita UC byla vyjádřena elevací hladiny trombocytů na 521 × 109/l, hodnota C-reaktivního proteinu zůstala ve fyziologických mezích. Na ultrazvukovém vyšetření břicha byla potvrzena hepatomegalie a difuzní hepatopatie, dilatace hepatocholedochu s kolísajícím kalibrem a obrovský žlučník.
Po zintenzivnění protizánětlivé terapie (mesalazin 4 g denně) se nemocné dařilo dobře. V laboratoři během tří měsíců došlo ke snížení až postupné normalizaci jaterních testů. Výsledek MRCP však jednoznačně svědčil pro diagnózu PSC postihující celé intrahepatální žlučovody obou laloků a také postižení pankreatického vývodu (obr. 1). Z tohoto důvodu byla pacientka předána do péče IKEM. V současné době je její stav stabilizovaný, bez závažných cholangoitid či známek jaterní insuficience, a zatím není důvod zařadit pacientku do transplantačního programu.
Image 1. MRC P u první pacientky s typickým obrazem PSC. Fig. 1. MRCP results of first case with typical PSC profile. 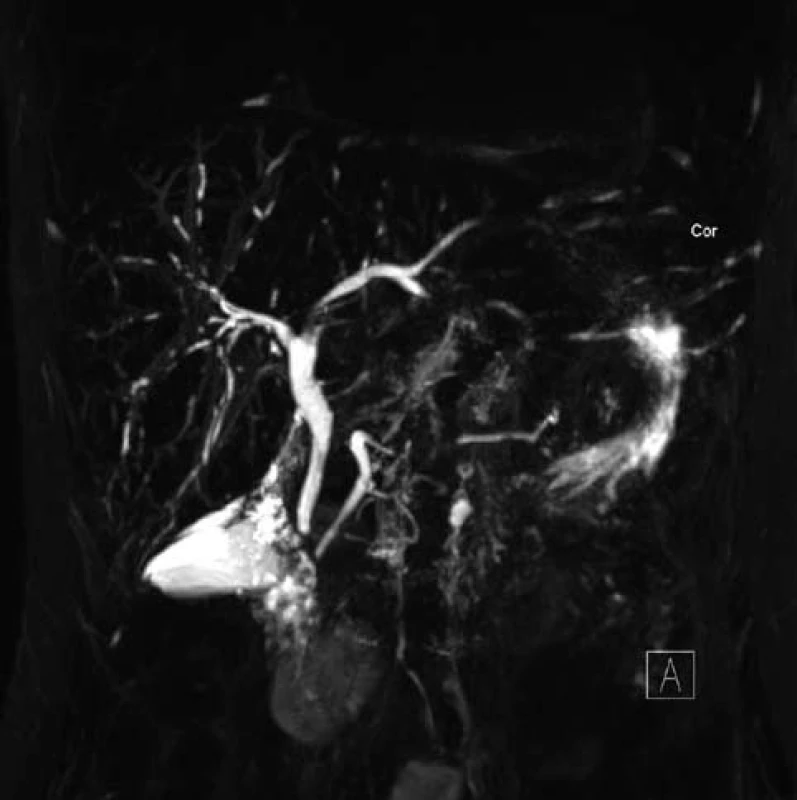
Kazuistika 2
Muž, narozený v roce 1979, navštívil naše pracoviště poprvé v květnu 2009 a stěžoval si na průjmy s příměsí krve. Koloskopické vyšetření potvrdilo aktivní UC postihující celé tlusté střevo. Pacientovi byl nasazen mesalazin v maximální dávce (4,5 g denně), avšak pro nedostatečný efekt byly záhy přidány systémové glukokortikosteroidy. Laboratorně měl pacient normální zánětlivé parametry (FW 14/27, CRP 6 mg/l), nebyl anemický, hodnota GMT ukazovala lehkou elevaci na 1,5 µkat/l. Na ultrazvuku byla zjištěna hraniční velikost a lehká hyperechogenita jater a nápadně velký žlučník. Jaterní testy s odstupem měsíce narostly, a proto jsme indikovali MRCP. Výsledek vyšetření však radiolog hodnotil jako normální (obr. 2). Při další kontrole se jaterní testy dále zvýšily, a to až na hodnoty ALT 9,4 µkat/l, AST 3,3 µkat/l, GMT 9,1 µkat/l, ALP 10,8 µkat/l, CRP 23 mg/l, autoprotilátky kompletně negativní a negativní panel hepatitid, normální hodnoty železa, feritinu a ceruloplasminu. Vyšší hodnoty vykazovaly sérová měď 26 umol/l (norma je do 22 umol/l) a beta2mikroglobulin 2,7 mg/l (norma do 2,4 mg/l). V jaterní biopsii popsal histopatolog chronickou hepatopatii zánětlivého typu se znaky cholestázy ve stadiu středně těžké fibrózy, popis připouštěl možnost PSC. Kontrolní laboratorní testy se s odstupem dvou měsíců mírně zlepšily, transaminázy byly pouze 2–3× zvýšené oproti normě, cholestatické enzymy zůstávaly 3–4× zvýšené. Rovněž tak došlo ke zlepšení celkového stavu pacienta a vymizení příznaků únavy, intermitentních artralgií a zvýšených teplot. Na počátku roku 2010 byla popsána i regrese endoskopického nálezu na tlustém střevě. Pacienta jsme předali do IKEM s pracovní s diagnózou difuzní forma UC s konkomitující PSC na léčbě mesalazinem 4 g/den a kyselinou ursodeoxycholovou (750 mg/den). Následně bylo provedeno ERCP vyšetření bez nálezu patologie na žlučových cestách. I když se nepotvrdily strukturální změny na žlučových cestách při zobrazovacích vyšetřeních (MRCP a ERCP), přesto se na základě klinického průběhu nemoci, histologického vyšetření a asociace s UC domníváme, že u nemocného jde o PSC s postižením drobných intrahepatálních žlučových cest „benigní-indolentní typ PSC“. Pacient zůstává ve stabilizovaném stavu ve sledování.
Image 2. MRC P vyšetření u druhého pacienta s normálním nálezem. Fig. 2. MRCP examination of second patient with normal results. 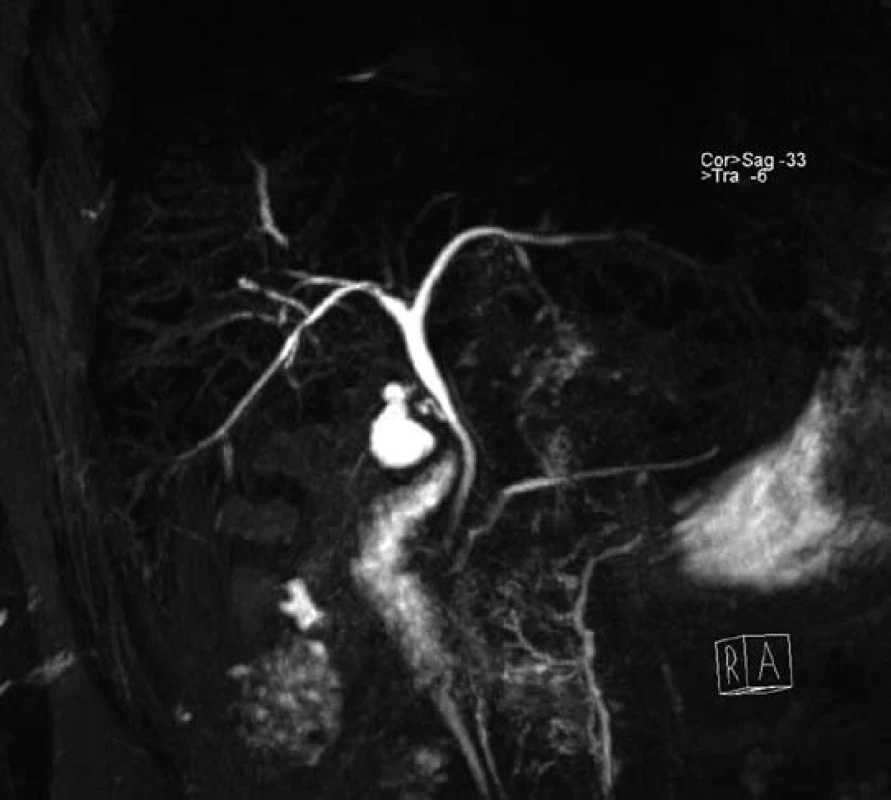
Diskuze
Správná a včasná diagnostika PSC může být v klinické praxi spojena s určitými nesnázemi. První kazuistika dokumentuje případ, kdy u pacientky s dlouhodobě známou diagnózou UC a elevací hodnot jaterních testů byla správná diagnóza zjištěna až po mnohaletém průběhu choroby. V tomto ohledu je nutné připomenout, že u všech pacientů s IBD, kteří mají elevaci cholestatických jaterních testů, je potřeba vždy aktivně pátrat po etiologii a vyloučit PSC. V okamžiku, kdy u této první pacientky bylo na PSC pomýšleno, potvrdila diagnózu MRCP. I když neexistuje žádná efektivní konzervativní terapie PSC, přesto je časná znalost této diagnózy pro nemocného zásadní. Všichni pacienti s prokázanou PSC musí být velmi pečlivě monitorováni s ohledem na jaterní funkce, pravidelné provádění screeningové koloskopie s cílem časného záchytu dysplazie v tlustém střevě. Základem současné terapie je podávání mesalazinu a ursodeoxycholové kyseliny.
Druhá kazuistika je v tomto smyslu opakem, PSC jsme zvažovali již od samého počátku, kdy pacientovi byla zjištěna UC a lehká elevace GMT, nicméně stanovení diagnózy se ukázalo jako velmi svízelné. Laboratorní vyšetření a typický UZ nález dával důvodné podezření, nicméně ke stanovení diagnózy nestačil. Zejména v počátečních stadiích nemoci či při tzv. small duct PSC může být MRCP nález negativní, jako tomu bylo v tomto případě. Dále nás posunulo histologické vyšetření jater. Onemocnění PSC je možné i při normálním cholangiogramu, pokud pacient má odpovídající známky v histologickém vyšetření současně se známkami cholestázy v laboratoři, důležitá je i současná diagnóza UC. Naopak nastává i situace, kdy cholangiogram je pozitivní a histologické vyšetření nepříznačné (onemocnění může mít fokální charakter distribuce).
Jak již bylo výše uvedeno, výskyt PSC u nemocných s IBD se pohybuje kolem 2–7 %. Některé zkušenosti nasvědčují tomu, že výskyt PSC u IBD pacientů je ale vyšší a že u některých pacientů má benigní průběh a nevede k jaterní cirhóze a jejím komplikacím. V roce 2008 byla publikována kohorta 441 kolektomovaných pacientů s UC, u kterých během kolektomie provedené jaterní biopsie prokázaly změny kompatibilní s diagnózou PSC až u 12 % pacientů. Překvapivě pouze u třetiny pacientů byla PSC diagnostikována již před operací [7].
Další zajímavou otázkou je, jak často se vyskytuje IBD u pacientů s PSC. Ze zkušeností pracoviště IKEM na souboru transplantovaných pacientů pro PSC byla diagnostikována UC u 84 % pacientů [8]. Problém tedy může být i opačný, pacienti se známou PSC nemusí mít vždy odhalenou koincidující UC. Důvodem je, že endoskopické změny jsou malé a často klinicky asymptomatické. Správnou diagnózu pomůže stanovit histologické vyšetření vícečetných biopsií z tlustého střeva [9].
Recentní práce podporují teorii o inverzní závislosti mezi tíží UC a vznikem PSC. Lehká forma UC je častěji asociována s těžším průběhem PSC a závažnější průběh kolitidy většinou znamená menší progresi cholangoitidy, resp. její „benigní-indolentní“ průběh charakterizovaný postižením pouze drobných žlučovodů [10,11]. Dalším poznatkem je riziko podcenění aktivity zánětu při endoskopickém vyšetření, kdy toto nekoreluje s histologickým vyšetřením, zdánlivě endoskopicky lehce probíhající kolitida může maskovat aktivní mikroskopický zánět, který by mohl vysvětlovat zvýšené riziko výskytu kolorektálního karcinomu u těchto pacientů [12].
Léčba PSC by měla probíhat na specializovaném pracovišti, nejlépe s možností transplantace jater. Vyjma řešení pokročilého stadia PSC transplantací jater je nejvhodnější terapeutickou možností kombinace endoskopické dilatace tzv. dominantní stenózy (je-li přítomna) a podávání kyseliny ursodeoxycholové. Standardně se používá dávka 12–15 mg/kg/den, někdy jsou doporučovány dávky kolem 20 mg/kg/den, nicméně studie, která ukazuje na větší riziko neoplazie u pacientů léčených vysokými dávkami kyseliny ursodeoxycholové, výhodnost této terapie zpochybňuje [13].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 10. 12. 2011
Přijato: 20. 1. 2012
MUDr. Petra Matějková, PhD.
Sanatorium sv. Anny, EGK s. r. o
Luční 7a/2776, 130 00 Praha 3
p.chalupna@seznam.cz
Sources
1. Sokol H, Cosnes J, Chazouilleres O et al. Disease activity and cancer risk in inflammatory bowel disease associated with primary sclerosing cholangitis. World J Gastroenterol 2008; 14(22): 3497–3503.
2. Drastich P, Kamenář D, Wohl P et al. Ulcerative colitis in patiens with primary sclerosing cholangitis (PSC-UC) - a specific subgroup. Čes a Slov Gastroent a Hepatol 2007; 61 (Suppl 1).
3. Loftus EV Jr., Harewood GC, Loftus C. PSC-IBD: a unique form of inflammatory bowel disease associated with primary sclerosing cholangitis. Gut 2005; 54(1): 91–96.
4. Olsson R, Danielsson A, Jarnerot G et al. Prevalence of primary sclerosing cholangitis in patients with ulcerative colitis. Gastroenterology 1991; 100 (5 Pt 1): 1319–1323.
5. Broome U, Olsson R, Loof L et al. Natural history and prognostic factors in 305 Swedish patients with primary sclerosing cholangitis. Gut 1996; 38(4): 610–615.
6. Soetikno RM, Lin OS, Heidenreich PA et al. Increased risk of colorectal neoplasia in patients with primary sclerosing cholangitis and ulcerative colitis: a meta-analysis. Gastrointest Endosc 2002; 56(1): 48–54.
7. Lepistö A, Kärkkäin P, Järvinen HJ et al. Prevalence of primary sclerosing cholangitis in ulcerative colitis patients undergoing proctocolectomy and ileal pouch-anal anastomosis. Inflamm Bowel Dis 2008; 14(6): 775–779.
8. Drastich P, Trunečka P, Špičák J. Ulcerative colitis after orthotopic liver transplantation for primary sclerosing cholangitis-a single center experience. Gut 2008; 57 (Suppl II).
9. Tung, Bruce Y Kowdley, Kris V. Epidemiology and pathogenesis of primary sclerosing cholangitis. UpToDate. Accessed: September 2009.
10. Marelli L, Xirouchakis E, Kalambokis G et al. Does the severity of primary sclerosing cholangitis influence the clinical course of associated ulcerative colitis? Gut 2011; 60(9): 1224–1228.
11. Rust C, Brand S. PSC: Protect and Serve with Colitis: does it help the liver to have severe ulcerative colitis? Gut 2011; 60(9): 1165–1166.
12. Jørgensen KK, Grzyb K, Lundin KE e al. Inflammatory bowel disease in patients with primary sclerosing cholangitis: Clinical characterization in liver transplanted and nontransplanted patients. Inflamm Bowel Dis 2011; 18(3): 536–545.
13. Eaton JE et al. High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Am J Gastroenterol 2011; 106(9): 1638–1645.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2012 Issue 3-
All articles in this issue
- Jak kvalitní je Vaše kolonoskopie?
- Endosonografie v diagnostice choledocholitiázy
- Využití NBI v diagnostice a sledování pacientů s Barrettovým jícnem
- Endoskopický trénink na neživém zvířecím modelu zlepšuje endoskopické dovednosti
- Snížení dyskomfortu spojeného s kolonoskopií použitím kombinace vodní imerze a insuflace oxidu uhličitého
- Endosonograficky navigovaná alkoholová ablácia cystickej neoplázie pankreasu
- Pozitivita imunoglobulinu IgG4 v krevním séru u osob s karcinomem slinivky břišní
- Korelace indikace k resekci pankreatu s následným histopatologickým nálezem
- Antibiotická profylaxe u akutní pankreatitidy
- Očekávané počty nádorů jater, žlučníku a pankreatu ve světě
- Primární sklerozující cholangoitida u pacientů s idiopatickými střevnímí záněty
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV)
- Highlights of the 34th Czech and Slovak endoscopic days
- Zpráva o DDW 2012
- Ostrava Live Endoscopy
- Prof. MUDr. Julius Špičák, CSc., šedesátníkem
- Prim. MUDr. Karel Lukáš, CSc., sedmdesátiletý
- Moviprep® – moderní příprava střeva před vyšetřením
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Moviprep® – moderní příprava střeva před vyšetřením
- Antibiotická profylaxe u akutní pankreatitidy
- Primární sklerozující cholangoitida u pacientů s idiopatickými střevnímí záněty
- Snížení dyskomfortu spojeného s kolonoskopií použitím kombinace vodní imerze a insuflace oxidu uhličitého
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

