-
Medical journals
- Career
Porovnanie účinnosti ranibizumabu a pegaptanibu sodného v liečbe diabetického edému makuly
Authors: Jana Štefaničková; Jaroslav Hasa
Authors‘ workplace: Klinika oftalmológie LF UK a UNB, Nemocnica Ružinov, Bratislava
Published in: Forum Diab 2017; 6(1): 20-26
Category: Topic
Overview
Cieľ:
Sledovať účinnosť ranibizumabu a pegaptanibu sodného v liečbe difúzneho diabetického edému makuly v úvodnej nasycovacej dávke (3 aplikácie).Materiál a metódy:
Pacienti s difúznym diabetickým edémom makuly, centrálnou hrúbkou makuly (CMT) ≥ 250 µm a najlepšie korigovanou centrálnou ostrosťou zraku (NKCOZ) medzi 39 a 73 písmen boli prospektívne rozdelení do 2 skupín podľa aplikovaného liečiva – ranibizumab (ranibizumab 0,5 mg) a pegaptanib (pegaptanib sodný 0,3 mg). Na základe doporučenej aplikačnej schémy pre sledované liečivá, oči liečené ranibizumabom sme hodnotili po 4, 8 a 12 týždňoch a oči liečené pegaptanibom sodným po 6, 12 a 18 týždňoch. Sledovali sme najlepšie korigovanú centrálnu ostrosť zraku (NKCOZ) – počet písmen, centrálnu hrúbku makuly (CMT) a objem makuly.Výsledky:
Do prospektívneho sledovania bolo zaradených 20 pacientov/21 očí s difúznym diabetickým edémom makuly, skupina s ranibizumabom 11 očí a skupina s pegaptanibom 10 očí. Priemerná hodnota HbA1c bola 7,55, respektíve 7,95. V skupine s ranibizumabom bola priemerná vstupná NKCOZ 51,9 písmena, CMT 553,45 µm a objem makuly 10,68 mm3. Po 12 týždňoch bol priemerný zisk písmen +11,2 písmena, CMT -135,9 µm, a objem makuly -1,62 mm3. V skupine s pegaptanibom bola priemerná vstupná NKCOZ 54,1 písmena, CMT 499,6 µm a objem makuly 10,4 mm3. Po 18 týždňoch bol priemerný zisk +3,25 písmena, priemerná CMT zmena +4,38 µm, a objem makuly zmena -0,56 mm3. V skupine s ranibizumabom bolo aplikovaných 29 injekcií, u 4 očí po úvodných 2 aplikáciách bola liečba prerušená podľa kritérií na prerušenie liečby (CMT ≤ 250 µm alebo NKCOZ ≥ 84 písmen). V skupine s pegaptanibom 28 injekcií 1 pacient zomrel na kardiálne zlyhanie po 10 týždňoch od začatia liečby.Záver:
Intravitreálne podávané blokátory cievneho endotelového rastového faktoru v liečbe diabetického edému makuly zlepšujú centrálnu ostrosť zraku a zmenšuje centrálnu hrúbku aj objem makuly na OCT. V tomto sledovaní ranibizumab 0,5 mg preukázal vyššiu účinnosť ako pegaptanib sodný 0,3 mg už po úvodných 3 dávkach.Kľúčové slová:
diabetický edém makuly, pegaptanib, ranibizumabÚvod
Diabetický edém makuly (DEM) je najčastejšou príčinou zhoršenia najlepšie korigovanej centrálnej ostrosti zraku (NKCOZ) u ľudí s ochorením diabetes mellitus. Môže sa objaviť v každom štádiu neproliferatívnej aj proliferatívnej diabetickej retinopatie. Veľmi často postihuje populáciu v produktívnom veku, a ak je ponechaný bez liečby, viac ako 50 % pacientov stratí > 2 riadky NKCOZ v rozmedzí 2 rokov [1]. V doteraz jedinej európskej štúdii bol zaznamenaný pokles zhoršenia NKCOZ pri DEM približne 5,4% [2]. Pri očakávanom raste prevalencie diabetu v budúcnosti bude rásť aj počet pacientov s DEM a s tým spojené zhoršovanie NKCOZ.
Hoci patogenéza diabetickej retinopatie a DEM nie je stále úplne známa, hyperglykémia je pravdepodobne najdôležitejší impulz pri jej vzniku. Zlá glykemická kontrola vedie k zhoršeniu diabetickej retinopatie. Zvýšená hladina glykémie poškodzuje cievy sietnice so vznikom krvácaní, mikroaneuryziem a uzáverom kapilár. Uzáver kapilár spôsobuje hypoxiu, a ako už bolo známe v minulosti, neovaskularizácie na sietnici. V ischemickej sietnici sa tvoria vysoké hladiny cievneho endotelového rastového faktoru (VEGF), ktorý nielen spôsobuje vznik neovaskularizácií na sietnici, ale zároveň je aj najsilnejším mediátorom zvýšenej cievnej permeablility, a tým aj opuchu makuly. V experimente injekcia VEGF do očí myší spôsobila zrútenie vnútornej hematookulárnej bariéry a následne opuch makuly [3].
V liečbe diabetickej retinopatie a DEM má nezastupiteľné miesto laserkoagulácia sietnice. Štandardná liečba DEM fokálnou alebo mriežkovou laserkoaguláciou v mnohých prípadoch dokáže NKCOZ len stabilizovať [1,4]. V Early Treatment Diabetic Retinopathy Study (EDTRS) u pacientov s DEM liečba laserkoaguláciou znížila riziko zhoršenia NKCOZ o 50 % [1]. Vedľajším nežiadúcim účinkom laserkoagulácie môže byť vznik skotómov, často veľmi negatívne vnímaných pacientami [5]. V štúdii DRCR.net [6] pacienti liečení laserkoaguláciou po 2 rokoch získali len 2 písmená. Snaha o zlepšenie liečby DEM spolu s novými údajmi o poruche regulácie VEGF v sietnici u diabetikov priniesla do liečby nové látky – blokátory VEGF, ktoré dokážu NKCOZ nielen stabilizovať, ale aj zlepšiť [6–11].
Cieľom tejto práce je sledovať účinnosť 2 blokátorov VEGF, ranibizumabu a pegaptanibu sodného, v liečbe DEM v úvodnej nasycovacej dávke (3 aplikácie).
Materiál a metódy
Do prospektívneho sledovania boli zaradené oči s difúznym DEM po splnení nasledujúcich kritérií:
- centrálna hrúbka makuly (CMT) ≥ 250 µm
- NKCOZ 20–73 písmen
- hodnota glykovaného hemoglobínu (HbA1c) za posledné 3 mesiace
Exklúzne kritéria:
- laserkoagulácia makuly < 3 mesiace a panretinálna laserkoagulácia < 4 mesiace pred začiatkom liečby
- intravitreálna aplikácia kortikosteroidov alebo inhibítorov VEGF < 3 mesiace pred iniciáciou liečby
Pacienti boli zaraďovaní do sledovania od decembra 2010 do januára 2011. Oči boli rozdelení do 2 súborov. V súbore „Ranibizumab“ bol pacientom intravitreálne aplikovaný ranibizumab 0,5 mg a v súbore „Pegaptanib“ liek pegaptanib sodný v dávke 0,3 mg. Na základe rôzne dlhých polčasov rozpadu a všeobecne známych aplikačných schém ranibizumabu a pegaptanibu sodného sme oči liečené ranibizumabom hodnotili po 4, 8 a 12 týždňoch a oči liečené pegaptanibom sodným po 6, 12 a 18 týždňoch od prvej aplikácie. Sledovali sme NKCOZ – počet písmen, CMT a objem makuly a nežiadúce účinky. V súbore „Ranibizumab“ bol podávaný ranibizumab v dávke 0,5 mg každé 4 týždne, spolu 3-krát. Liečba bola pozastavená, ak bola dosiahnutá CMT ≤ 250 µm alebo NKCOZ ≥ 84 písmen. Pacientom v súbore „Pegaptanib“ boli aplikované 3 intravitreálne injekcie pegaptanibu sodného 0,3 mg každých 6 týždňov. V tejto skupine neboli stanovené kritéria na prerušenie liečby vzhľadom na výsledky publikovaných štúdií s pegaptanibom sodným v liečbe DEM. U jedného pacienta liečeného ranibizumabom boli liečené 2 oči. Pri každej návšteve boli realizované tieto vyšetrenia: centrálna ostrosť zraku na EDTRS tabulách certifikovaným lekárom na toto vyšetrenie, meranie vnútroočného tlaku, vyšetrenie štrbinovou lampou predného segmentu, biomikroskopické vyšetrenie zadného segmentu v mydriáze, farebná fotografia fundu, fluoresceínová angiografia pred zaradením a na konci sledovania. Pri vyšetrení OCT na prístroji Stratus (Carl Zeiss, Meditec, Dublin, USA) sme použili fast macular scan 6 mm, Cross hair 6 mm a na zhodnotenie vitreomakulárneho rozhrania line scan 8 mm.
Na štatistické zhodnotenie parametrov pred a po aplikácii sme použili Wilcoxonov neparametrický test (ten sme si vybrali z dôvodu malého počtu pacientov v sledovaných skupinách).
Výsledky
Do skupiny „Ranibizumab“ bolo zaradených 10 pacientov/11 očí a do skupiny „Pegaptanib“ 10 pacientov/10 očí. Priemerný vek 59,7 a 60,3 roka. Priemerná hodnota HbA1c bola 7,55 %, resp. 7,95 %. Dĺžka zhoršovania NKCOZ bola v obidvoch súboroch približne rovnaká 21,7 a 18,9 mesiaca. Dve oči z prvého súboru a 6 očí z druhého súboru mali v minulosti podaný triamcinolon acetonid (TRIAM). U všetkých očí bol zistený DEM bez prítomnosti trakcie na OCT (8 mm scan). Doba sledovania bola 12 týždňov v súbore „Ranibizumab“ a 18 týždňov v súbore „Pegaptanib“ (tab. 1 a tab. 2).
Table 1. Charakteristika súborov podľa pohlavia, typu DM, výskytu hypertenzie, štádia DR a predchádzajúcej oftalmologickej liečby 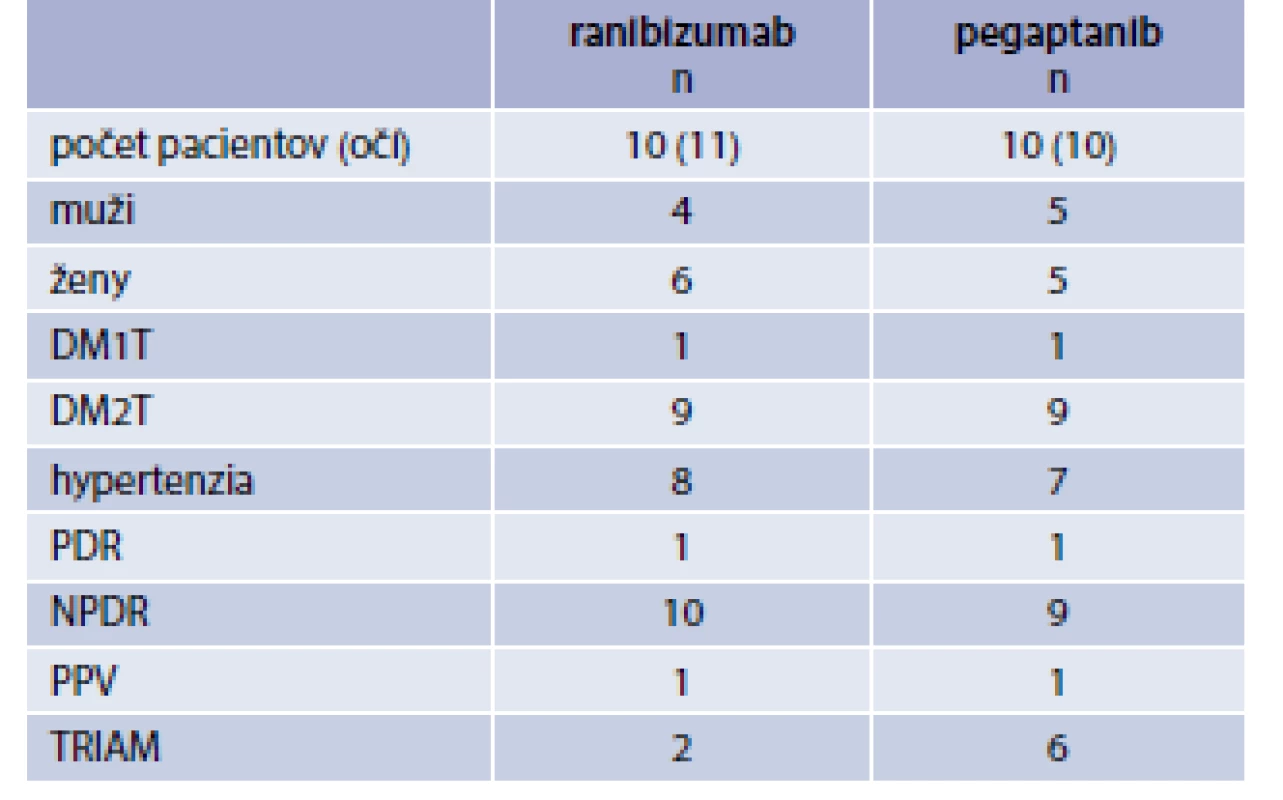
DM1T/DM2T – diabetes 1./2. typu NPDR – neproliferatívna diabetická retinopatia PDR – proliferatívna diabetická retinopatia PPV – pars plana vitrectomia TRIAM – triamcinolon acetonid Table 2. Charakteristika súborov podľa veku, trvania DM, HbA<sub>1c</sub>, dĺžky sledovania a zhoršovania NKCOZ 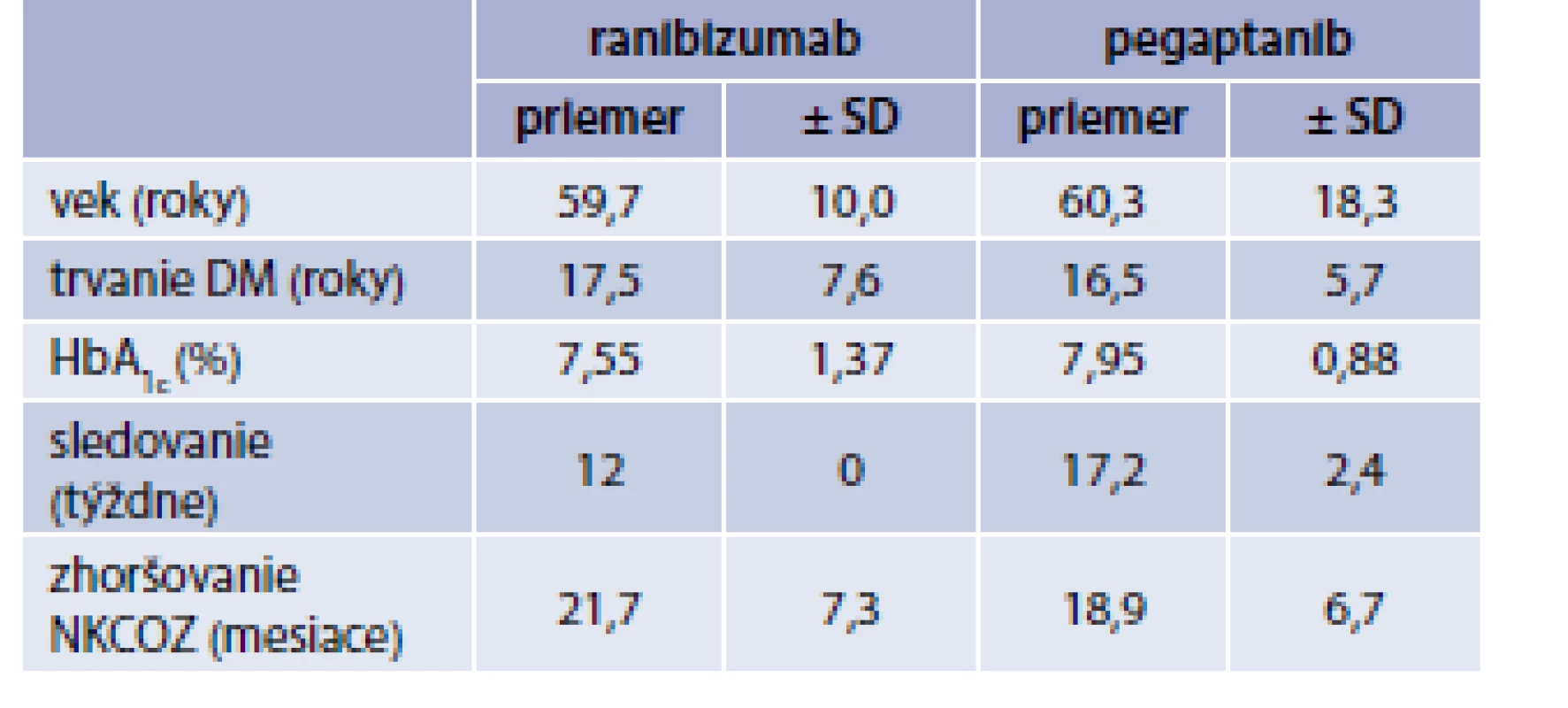
V skupine „Ranibizumab“ bola priemerná vstupná NKCOZ 51,9 písmena, CMT 553,5 µm a objem makuly 10,7 mm3. Po 4 týždňoch bola priemerná zmena NKCOZ +11,1 písmena, pokles CMT o -174,9 µm a objemu o -1,8 mm3.Po 8 týždňoch tento trend pokračoval a NKCOZ sa zlepšila priemerne o +12,4 písmena, CMT poklesla o -208,4 µm a objem makuly o -2,4 mm3. Po 12 týždňoch bola priemerná výsledná NKCOZ 63 písmena, priemerná zmena vs vstupná NKCOZ +11,1 písmena. Zisk 15 a viac písmen bol u 27,3 %, 10 a viac písmen u 54,5 %, Priemerná CMT bola 424,4 µm, priemerná zmena -129,1 µm, a objem makuly 9,3 mm3, priemerná zmena -1,4 mm3. Aplikovaných bolo 29 injekcií, u 4 očí po úvodných 2 aplikáciách bola liečba prerušená podľa vyššie uvedených kritérií na prerušenie liečby (CMT ≤ 250 µm alebo NKCOZ ≥ 84 písmen). Zlepšenie všetkých sledovaných parametrov vo všetkých sledovaných týždňoch bolo na hladine štatistickej významnosti p < 0,05 (tab. 3).
Table 3. Výsledné hodnoty NKCOZ, CMT a objemu makuly v skupine „Ranibizumab“ 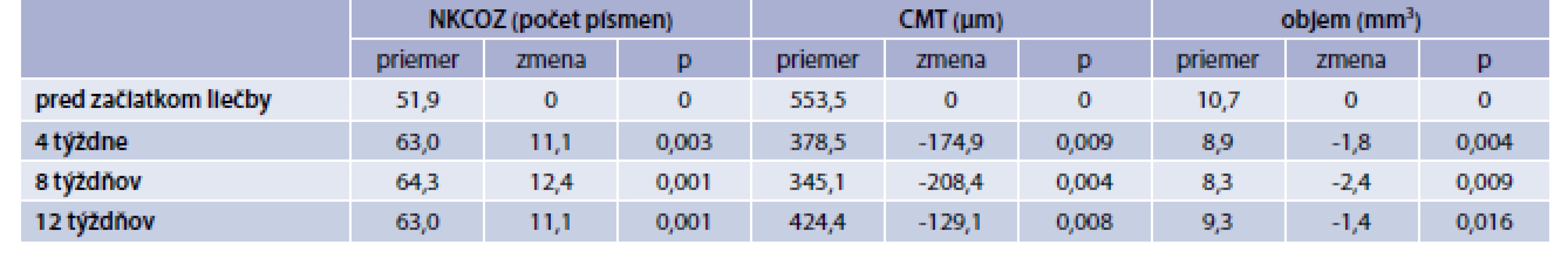
V súbore „Pegaptanib“ bola priemerná vstupná NKCOZ 54,1 písmena, CMT 499,6 µm a objem makuly 10,4 mm3. V 6. týždni sme zaznamenali len mierne zlepšenie NKCOZ o 0,2 písmena, V 12. týždni NKCOZ poklesla o -1,4 písmena a výsledná COZ v 18. týždni bola +2,8 písmena. V 18 týždňoch bola priemerná CMT 486,0 µm, priemerná zmena -13,6 µm, a objem makuly 9,8 mm3, priemerná zmena -0,6 mm3. V súbore „Pegaptanib“ bolo aplikovaných 29 injekcií. V tejto skupine jeden pacient zomrel na kardiálne zlyhanie po 10 týždňoch od zaradenia do sledovania. V 18. týždni bolo hodnotených 9 očí. V danom súbore sme ani v jednom parametre nezaznamenali štatisticky významnú zmenu p < 0,05 (tab. 4).
Table 4. Výsledné hodnoty NKCOZ, CMT a objemu makuly v skupine „Pegaptanib“ 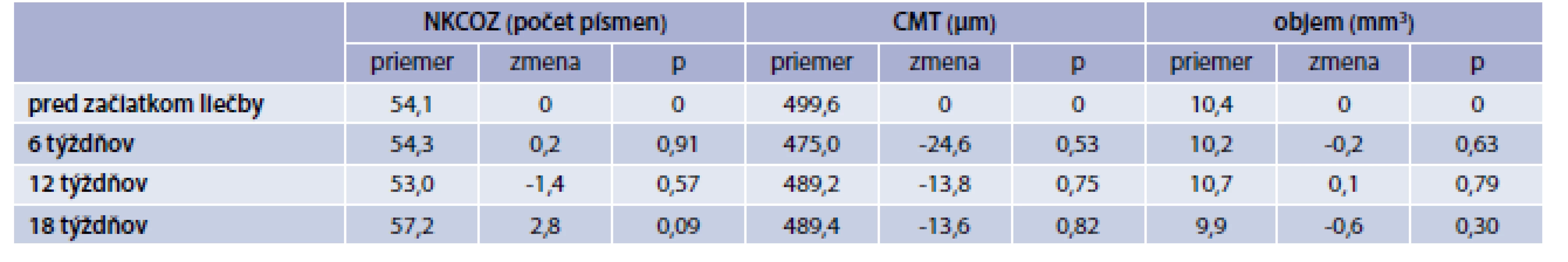
Priemerný zisk ≥ 15 písmen v súbore „Ranibizumab“ bola 27,3 %, v súbore „Pegaptanib“ 0 %, zisk ≥ 10 písmen 54,5 %, resp. 10 % a zisk ≥ 1 písmeno 100 %, resp. 60 % (tab. 5).
Table 5. Porovnanie skupín a výsledná NKCOZ 
Nepozorovali sme žiadnu závažnú očnú komplikáciu (endoftalmitídu alebo odlúčenie sietnice). Jeden pacient v súbore „Pegaptanib“ zomrel 10 týždňov od začatia liečby na kardiálne zlyhanie.
Porovnanie zmeny NKCOZ, CMT a objemu makuly k vstupným hodnotám uvádzajú grafy 1, 2 a 3.
Graph 1. Zmena najlepšej korigovanej centrálnej ostrosti zraku (počet písmen) 
Graph 2. Zmena centrálnej hrúbky makuly (μm) 
Graph 3. Zmena objemu makuly (mm<sup>3</sup>) 
Diskusia
Cievny endotelový rastový faktor je najdôležitejší stimulus pre vznik DEM [10]. Vzniká následkom zrútenia hematookulárnej bariéry a spôsobuje zhrubnutie sietnice v makule v dôsledku hromadenia tekutiny v sietnici. Primárnym endogénnym mediátorom DEM je VEGF, glykoproteín, ktorý sa tvorí v endotelových bunkách sietnice (REC), pericytoch a pigmentovom epiteli sietnice. Cievny endotelový rastový faktor kontroluje permeabilitu endotelových buniek v sietnici naväzovaním na receptor VEGF2. Prvým krokom pri vzniku DEM je pravdepodobne dysfunkcia REC. Hyperglykémia a následná hypoxia pri diabetickej retinopatii zvyšujú hladiny VEGF [2].
V preklinických štúdiách Deissler a Lang [12,13] realizovali in vitro štúdie na bovinných endotelových bunkách sietnice (bREC), skúmali VEGF – stimulovaný proces v REC a chceli zistiť, či môže byť tento proces zmenený účinkom ranibizumabu. V bielkovinových zlúčeninách REC zistili vysoké hodnoty VEGF165 – najdôležitejšej substancie zúčastňujúcej sa na vzniku opuchu makuly a proliferatívnej retinopatie. Pevné spojenia REC reprezentujú vnútornú hematookulárnu bariéru, ktorá sa skladá z rôznych proteínov, napríklad okludín, zonula occludens proteín (ZO-1) a klaudínov. Autori sledovali, že v prítomnosti VEGF165 klaudín-1 a okludín vymizli, pričom koncentrácia ostatných proteínov pevného spojenia REC, ako napr. ZO-1 klaudínu 5 sa menila len nevýrazne. Molekuly klaudínu 1 a okludínu sa presúvali z plazmatickej membrány do cytoplazmy REC. Po pridaní ranibizumabu do média s bunkami REC sa tento transfer zastavil a na základe týchto výsledkov predpokladajú, že klaudín 1 je jedným z najdôležitejších proteínov vnútornej hematookulárnej bariéry. Tieto výsledky podporujú používanie ranibizumabu v liečbe DEM.
My sme sa v našom sledovaní rozhodli porovnať účinok dvoch blokátorov VEGF – ranibizumabu a pegaptanibu sodného, ktoré v čase realizácie tohto sledovania boli jediné antiVEGF látky dostupné na trhu a používané v liečbe vlhkej formy vekom podmienenej degenrácie makuly.
Pegaptanib sodný je aptamér RNA, ktorý sa selektívne viaže na VEGF165 [14]. Do dvojito zaslepenej multicentrickej randomizovanej placebom kontrolovanej štúdie fáza 2/3 pri DEM bolo zaradených 260 a 207 očí, ktorí boli rozdelené do 4 liečebných skupín: pegaptanib sodný 0,3 mg, 1 mg, 3 mg alebo placebo. Pegaptanib sodný alebo placebo injekcia boli aplikované každých 6 týždňov. Od 18. týždňa bola povolená fokálna/mriežková laserkoagulácia, ak bola nutná podľa rozhodnutia investigátora. V 2. roku sledovania bolo možné prerušiť liečbu, ak boli CMT ≤ 175 µm a NKCOZ ≥ 20/25. Tieto údaje sme my pri zaraďovaní pacientov do sledovania nemali k dispozícii. Spolu 49 očí (36,8 %) liečených pegaptanibom sodným a 25 očí (19,7 %) liečených placebom získalo ≥ 10 písmen v prvom roku sledovania, v druhom roku sledovania 38,3 % a 30,0 %. Zmena NKCOZ od začiatku liečby do 2. roka bola vyššia pri liečbe pegaptanibom sodným ako placebom (p < 0,05). Priemerný zisk písmen v 54. týždni bol +5,2 a v 102. týždni +6,1 písmena vs +1,2 a +1,3 písmena skupine liečených placebom. Pokles CMT ≥ 50 % bol u 19,2 % liečených pegaptanibom sodným a 26,1 % liečených placebom. Signifikantne menej očí pri liečbe pegaptanibom sodným potrebovalo doplňujúcu fokálnu alebo mriežkovú laserkoaguláciu. Pegaptanib sodný bol dobre tolerovaný a výskyt nežiadúcich účinkov bol porovnateľný v obidvoch súboroch [7].
Ranibizumab je rekombinantná humánna monoklonová protilátka, fragment, ktorá inhibuje všetky formy VEGF-A. Bolo zrealizovaných viacero veľkých štúdií, v ktorých bol sledovaný pozitívny vplyv ranibizumabu na DEM [8–11].
V štúdii Restore [11] boli pacienti rozdelení do 3 skupín: ranibizumab 0,5 mg, ranibizumab 0,5 mg + laserkoagulácia a laserkoagulácia. Po úvodných 3 injekciách ranibizumabu v ramene ranibizumab a v kombinácii s laserkoaguláciou boli injekcie aplikované do stabilizácie nálezu. Priemerný zisk písmen v jednotlivých ramenách bol +6,1, +5,9 a +0,8 písmena. Na OCT bol priemerný pokles hrúbky sietnice -128,3 µm, -118,7 µm a -61,3 µm. V skupine ranibizumab v monoterapii bol zisk ≥ 15 písmen v 22,6 %, v kombinovanom ramene 22,9 % oproti 8,2 % liečených laserkoaguláciou [11]. Po troch rokoch sledovania stále pretrvával benefit liečby ranibizumabom [15]. Štúdia Diabetic Retinopathy Clinical Research Network (DRCR.net) [6] mala o niečo komplikovanejší design, nakoľko sa ukázalo, že režim mesačných aplikácií je veľmi ťažko dodržateľný v klinickej praxi. Do sledovania bolo zaradených 854 pacientov, ktorí boli rozdelení do 4 skupín: laserkoagulácia; 0,5 mg ranibizumab plus promptný laser; 0,5 mg ranibizumab plus odložená laserkoagulácia (v 24. týždni a neskôr) a 4 mg triamcinolone plus promptný laser [6]. Na základe výsledkov v 3. roku môžeme predpokladať, že skoré zahájenie laserkoagulácie makuly pri liečbe blokátormi VEGF nevedie k zlepšeniu videnia, naopak, môže v niektorých prípadoch zhoršiť výslednú NKCOZ. V skupine s odloženou laserkoaguláciou bolo zlepšenie o 10 a viac písmen u 47 pacientov a zhoršenie o 10 a viac písmen u 5 %, avšak v skupine s promptnou laserkoaguáciou zlepšenie o 10 a viac písmen len u 42 % a zhoršenie o 10 a viac písmen u 10 % [16].
V našom sledovaní boli oči rozdelené do 2 skupín podľa aplikovanej látky – do skupiny „Ranibizumab“ (ranibizumab 0,5mg) alebo do skupiny „Pegaptanib“ (pegaptanib sodný 0,3mg). Pacienti boli hodnotení po 12 (ranibizumab) alebo 18 týždňoch (pegaptanib sodný) podľa známych vedomostí o farmakokinetike jednotlivých liečiv. V skupine liečených ranibizumabom sme pozorovali rýchlejšie a výraznejšie zlepšenie NKCOZ, CMT a objemu makuly. Pri pegaptanibe sodnom bolo toto zlepšenie oveľa menej výrazne. V skupine ranibizumab už po jednej aplikácii nastalo výrazné zlepšenie NKCOZ o +11,1 písmena (p = 0,003), pokles CMT o -174,9 µm (p = 0,009) a objemu makuly -1,8 mm3 (p = 0,004). V 8. týždni nastalo ďalšie zlepšenie NKCOZ +12,4 písmena (p < 0,001), CMT -208,4 µm (p < 0,001), objem makuly o -2,4 mm3 (p = 0,009). Po 12 týždňoch bola priemerná zmena vs vstupná NKCOZ +11,1 písmena (p = 0,001), priemerná zmena CMT -135,9 µm (p = 0,008), a priemerná zmena objemu makuly -1,62 mm3 (p = 0,016). Pri liečbe pegaptanibom sodným zraková ostrosť sa len pozvoľna menila a táto zmena nebola štatisticky signifikantná, NCOZ +0,4; -1,4; +2,8 v 6., 12. a 18. týždni (p = 0,91; 0,57 a 0,09). Taktiež zmena CMT a objemu makuly bola oveľa pomalšia.
U 4 pacientov v skupine „Ranibizumab“ sme dosiahli už počas úvodnej nasycovacej dávky CMT ≤ 250 µm alebo NKCOZ ≥ 84 písmen a liečba bola prerušená. Aj tento fakt potvrdzuje výraznejší účinok ranibizumabu na zlepšenie NKCOZ a vstrebanie edému oproti pegaptanibu.
Dosiahnuté výsledky v liečbe ochorení sietnice blokátormi VEGF otvárali dvere pre nové preparáty. Aflibercept je ďalší preparát, ktorý v štúdiách preukázal výbornú účinnosť najprv v liečbe vlhkej formy vekom podmienenej degenerácie makuly a následnej sa jeho použitie rozšírilo aj na iné diagnózy [17]. Štúdia VIVID a VISTA [18] u pacientov s DEM potvrdila superioritu afliberceptu 2 mg v skupinách, v ktorých bol podávaný po úvodných 5 mesačných nasycovacích dávkach, buď mesačne 2q4 alebo v dvojmesačných intervaloch 2q8 oproti laserkoagulácii. Po dvoch rokoch v skupine 2q8, ktorá je používaná v liečbe pacientov s DEM afliberceptom, bol zisk písmen vo VIVID +9,4 písmena a VISTA +11,1 písmena [18].
Pacienti s diabetom majú spolu s očnými komplikáciami aj rôzne systémové komplikácie, najmä zvýšené riziko kardiovaskulárnych chorôb. Preto bezpečnosť a znášanlivosť tejto liečby je veľmi dôležitá. V klinických štúdiách zaoberajúcich sa liečbou ranibizumabom a pegaptanibom sodným neboli zistené závažnejšie nežiadúce účinky. Incidencia celkových závažných nežiadúcich účinkov v štúdii RESOLVE bola 13,7% a 12,2% pri liečbe ranibizumabom a placebom a 12,2%, 5,8% a 10% pri monoterapii ranibizumabom, v kombinácii a v monoterapii s laserom v štúdii RESTORE [8,11]. Pegaptanib sodný vykazoval v štúdiách pri vekom podmienenej degenerácii makuly veľmi dobrý bezpečnostný profil a tento trend bol potvrdený aj pri DEM [7,14]. V našom sledovaní bol ranibizumab dobre tolerovaný a neboli zaznamenané žiadne závažné vedľajšie účinky. Jeden pacient, ktorému boli aplikované injekcie pegaptanibu sodného, zomrel na kardiálne zlyhanie po podaní 2 injekcií 10 týždňov od začiatku liečby. Tento pacient už v minulosti prekonal infarkt myokardu.
Výsledky tohto sledovanie potvrdili účinok ranibizumabu pri DEM už po úvodných dávkach. Limitáciou tohto sledovania je malý súbor pacientov. Avšak vzhľadom obmedzenú dostupnosť blokátorov VEGF v liečbe DEM v čase realizovania tohto projektu, nebolo možné zaradiť väčší počet pacientov.
Záver
Diabetický edém makuly je závažnou príčinou poklesu NKCOZ. Laserkoagulácia makuly bola v minulosti štandardom liečby tohto ochorenia. Súčasné štúdie a už aj klinická prax potvrdzujú pozitívny vplyv blokátorov VEGF na NKCOZ a edém makuly ako primárnu liečbu v kombinácii s laserkoaguláciou.
V nami sledovaných malých súboroch u pacientov s DEM ranibizumab 0,5 mg preukázal vyššiu účinnosť v sledovanom období.
Doručené do redakcie 30. 12. 2016
Prijaté po recenzii 17. 2. 2017
MUDr. Jana Štefaničková, PhD.
jstefanicka@gmail.com
www.unb.sk
Sources
1. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study research group. Arch Ophthalmol 1985; 103(12): 1796–1806.
2. Lang GE. Diabetic macular edema. Ophthalmologica 2012; 227(Suppl 1): 21–29. Dostupné z DOI: <http://dx.doi.org/10.1159/000337156>.
3. Joussen AM, Smyth N, Niessen C. Pathophysiology of diabetic macular edema. Dev Ophthalmol 2007; 39 : 1–12.
4. Treatment techniques and clinical guidelines for photocoagulation of diabetic macular edema. Early Treatment Diabetic Retinopathy Study Report Number 2. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology 1987; 94(7): 761–774.
5. Sosna T, Bouček P, Fišer I. Diabetická retinopatie, diagnostika, prevence a léčba. Cendelín: Praha 2001.
6. Elman MJ, Aiello LP, Beck RW et al. [Diabetic Retinopathy Clinical Research Network]. Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolon plus prompt laser for diabetic macular edema. Ophthalmology 2010; 117(6): 1064–1077. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ophtha.2010.02.031>.
7. Sultan MB, Zhou D, Loftus J et al. A phase 2/3 multicenter randomized double masked 2 – year trial of pegaptanib sodium for the treatment of diabetic macular edema. Ophthalmology 2011;118(6): 1107–1118. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ophtha.2011.02.045>.
8. Massin P, Bandello F, Garweg JG et al. Safety and efflicacy of ranibizumab in diabetic macular edema (RESOLVE Study): a 12-month, randomized, controlled, double-masked, multicenter phase II study. Diabetes Care 2010; 33(11): 2399–2405. Dostupné z DOI: <http://dx.doi.org/10.2337/dc10–0493>.
9. Nguyen QD, Shah SM, Heier JS et al. Primary end point (six months) results of the ranibizumab for edema of the macula in diabetes (READ-2) Study. Ophthalmology 2009; 116(11): 2175–2181.e1.Dostupné z DOI: <http://dx.doi.org/10.1016/j.ophtha.2009.04.023>.
10. Nguyen QD1, Tatlipinar S, Shah SM et al. Vascular endothelial growth factor is a critical stimulus for diabetic macular edema. Am J Ophthalmol 2006;142(6): 961–969.
11. Mitchell P, Bandello F, Schmidt-Erfurth U et al. The RESTORE study: ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011; 118(4): 615–625. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ophtha.2011.01.031>.
12. Deissler HL, Lang GE. In vitro studies on the mechanism of action of VEGF and its inhibitors. Klin Monatsbl Augenheilkd 2008; 225(7): 623–628. Dostupné z DOI: <http://dx.doi.org/10.1055/s-2008–1027513>.
13. Deissler H, Deissler H, Lang S et al. VEGF – induced effects on proliferation, migration and tight junctions are restored by ranibizumab (Lucentis) in microvascular retinal endothelial cells. Br J Ophthalmol 2008; 92(6): 839–843. Dostupné z DOI: <http://dx.doi.org/10.1136/bjo.2007.135640>.
14. Gragoudas ES, Adamis AP, Cunningham ET Jr et al. Pegaptanib for neovascular age-related macular degeneration. N Engl J Med 2004; 351(27): 2805–2816.
15. Schmidt-Erfurth U, Lang GE, Holz FG et al. Three – year outcomes of individualized ranibizumab treatment in patients with diabetic macular edema: the RESTORE extension study. Ophthalmology 2014; 121(5): 1045–1053. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ophtha.2013.11.041>.
16. Elman MJ, Qin H, Aiello LP et al. [Diabetic Retinopathy Clinical Research Network]. Intravitreal Ranibizumab for diabetic macular edema with prompt versus deferred laser treatment: 3 – year randomized trial results. Ophthalmology 2012; 119(11): 2312–2318. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ophtha.2012.08.022>.
17. Heier JS, Brown DM, Chong V et al. Intravitreal Aflibercept (Trap –Eye) inwet age – related macular degeneration. Ophthalmology 2012; 119(12): 2537–2548. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ophtha.2012.09.006>. Erratum in Ophthalmology 2013;120(1): 209–2010.
18. Korobelnik JF, Do DV, Schmidt-Erfurth U et al. Intravitreal aflibercept for diabetic macular edema. Ophthalmology 2014;121(11): 2247–2254. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ophtha.2014.05.006>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2017 Issue 1-
All articles in this issue
- Metabolické choroby a oko v detskom veku
- Porovnanie účinnosti ranibizumabu a pegaptanibu sodného v liečbe diabetického edému makuly
- Autoimunita a diabetes mellitus
- Diabetes mellitus a dermatologické ochorenia
- Nastal čas pre redukciu ischemickej choroby srdca pomocou ovplyvnenia sérového Lp(a)?
- Ako monitorovať detského pacienta a adolescenta s diabetickou retinopatiou: kazuistika 20-ročnej pacientky a angio OCT
- Katarakta u pacienta s vrodeným deficitom galaktokinázy: kazuistika
- Angio OCT – nová neinvazívna zobrazovacia vyšetrovacia metóda diagnostiky a monitoringu diabetickej retinopatie
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Angio OCT – nová neinvazívna zobrazovacia vyšetrovacia metóda diagnostiky a monitoringu diabetickej retinopatie
- Autoimunita a diabetes mellitus
- Metabolické choroby a oko v detskom veku
- Diabetes mellitus a dermatologické ochorenia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

