-
Medical journals
- Career
Kardiometabolické riziká obezity
Authors: MUDr. Fábryová Ľubomíra, PhD.
Authors‘ workplace: MetabolKLINIK s. r. o., Ambulancia pre diabetológiu, poruchy látkovej premeny a výživy, Špecializovaná lipidologická ambulancia, Bratislava
Published in: Forum Diab 2015; 4(1): 67-74
Category: Topic
Overview
Obezita je progresívne chronické ochorenie charakterizované akumuláciou tuku s mnohými orgánovošpecifickými metabolickými a kardiovaskulárnymi komplikáciami, ktoré ovplyvňujú kvalitu a dĺžku života obézneho jedinca. Kardiometabolické komplikácie obezity združujeme pod pojmom metabolický syndróm v pozadí s inzulínovou rezistenciou, viscerálnou obezitou, systémovým subklinickým zápalom, poruchami koagulácie a fibrinolýzy a v ostatnom čase aj prítomnosťou ektopického tukového tkaniva. V klinike za metabolickým syndrómom stoja rôzne stupne poruchy tolerancie glukózy, aterogénna dyslipidémia, artériová hypertenzia, poruchy koagulácie a fibrinolýzy. Obezita ich prostredníctvom ovplyvňuje nárast kardiovaskulárnych ochorení (ischemickej choroby srdca, infarktov myokardu). Nové poznatky nám umožňujú zasiahnuť proti nárastu kardiovaskulárnych ochorení prevenciou a komplexným manažmentom obezity a kardiometabolických rizikových faktorov u rizikových pacientov.
Kľúčové slová:
aterogénna dyslipidémia – diabetes mellitus – kardiovaskulárne ochorenia – obezitaÚvod
Obezita je progresívne ochorenie charakterizované akumuláciou tuku, ktoré napĺňa všetky kritériá chronického ochorenia. Má svoju etiológiu, príznaky a symptómy, vedie ku štrukturálnym a funkčným zmenám, ktoré kulminujú mnohopočetnými orgánovo špecifickými patologickými komplikáciami. Obezita významne ovplyvňuje morbiditu a mortalitu na metabolické a kardiovaskulárne (KV) ochorenia, ako aj kvalitu a dĺžku života obézneho jedinca [1].
Publikované štúdie referujú o vyššom riziku vzniku nefatálneho infarktu myokardu (IM) a koronárneho úmrtia so zvyšujúcim sa BMI (body mass indexom/indexom telesnej hmotnosti). Riziko je najnižšie u mužov a žien s BMI < 22. V štúdii Nurses Health Study relatívne riziko rozvoja ischemickej choroby srdca (ICHS) bolo 2-násobne vyššie pri BMI v rozmedzí 25–28,9 a 3-násobne vyššie pri BMI > 29 v porovnaní s osobami s BMI < 21. Nárast hmotnosti od 5 do 8 kg zvyšuje koronárne riziko (nefatálny IM a koronárne úmrtie) o 25 % a nárast hmotnosti o ≥ 20 kg zvyšuje riziko viac ako 2,5-násobne oproti ženám so stabilnom hmotnosťou. V populácii britských mužov sa incidencia koronárneho ochorenia zvyšuje s BMI > 22 a nárast hmotnosti o 1 jednotku BMI je spojený s 10 % nárastom počtu KV-príhod. Podobný vzťah medzi nárastom hmotnosti a rizikom rozvoja ICHS priniesli štúdie v rôznych populáciách (Fínsko, Švédsko, Japonsko, USA) [2–4].
Celková mortalita sa zvyšuje s BMI > 25 (RR = 1,1), dramatické zvýšenie je pri BMI > 30 (RR = 1,5), napr. BMI = 35 zvyšuje mortalitu 2,5-násobne. Štúdie poukazujú na to, že aj dĺžka trvania obezity zvyšuje toto riziko [5].
Komplikácie obezity môžeme rozdeliť na 2 základné skupiny: mechanické a metabolické (kardiometabolické) [6].
Mechanické komplikácie (priamy následok zvýšenej telesnej hmotnosti) sú spojené so zvýšenou záťažou pohybového aparátu (osteoartróza, osteoartridída), s hypoventilačným syndrómom, syndrómom spánkového apnoe, gastroezofageálnou refluxnou chorobou a čiastočne aj s hypertrofiou srdca (kombinovaný efekt v súčinnosti s frekventne prítomnou artériovou hypertenziou).
Kardiometabolické komplikácie obezity obvykle združujeme pod pojmom metabolický syndróm (MS), ktorý predstavuje zoskupenie rizikových faktorov vplývajúcich na rozvoj kardio-cerebrovaskulárnej morbidity a mortality a rozvoj diabetes mellitus 2. typu (DM2T). V pozadí MS stoja viaceré faktory: inzulínorezistencia (IR) viscerálna (androidná, abdominálna) obezita, systémový subklinický zápal, poruchy koagulácie a fibrinolýzy [7,8].
Tukové (viscerálne) tkanivo považujeme za metabolicky aktívny orgán so sekréciou hormónov, cytokínov a rastových faktorov nazývaných adipocytokíny (adipokíny), ktoré účinkujú autokrínne, parakrínne alebo endokrínne. Produkuje antiaterogénne adipocytokíny (leptín a adiponektín), proaterogénne a prozápalové adipocytokíny interleukín 6 (IL6) a tumor nekrotizujúci faktor alfa (tumor necrosis factor alpha – TNFα), voľné mastné kyseliny (VMK), inhibítor aktivátora plazminogénu 1 (plasminogen activator inhibitor-1 – PAI-1) atď [9].
V patofyziológii s obezitou spojených komorbidít popri množstve a distribúcii tukového tkaniva nadobúda čoraz väčší význam nahromadenie lipidov v netukovom tkanive (ektopické tukové tkanivo – lokálna obezita orgánov) predovšetkým v pečeni, kostrovom svalstve, pankrease, perivaskulárne, intramyocelulárne a extramyocelulárne, perikardiálne, epikardiálne). Syndróm ektopického ukladania tuku súvisí pravdepodobne s neschopnosťou tukového tkaniva absorbovať ďalší tuk, ktorý sa nielen ukladá v netukových tkanivách, ale ich aj mechanicky a funkčne ovplyvňuje. Tukové bunky tak vstupujú do regulácie metabolickej a KV homeostázy na systémovej i lokálnej úrovni s potencovaním rozvoja IR, s potencovaním prozápalového a proaterogénneho stavu. V súčasnosti je ektopické tukové tkanivo považované za nový marker kardiometabolického rizika [10,11].
IR má úzky vzťah k rozvoju kardiometabolických rizikových faktorov. Medzi tieto rizikové faktory zaraďujeme rôzne stupne poruchy tolerancie glukózy (od hyperglykémie nalačno, cez poruchu tolerancie glukózy až po DM2T), aterogénnu dyslipidémiu, artériovú hypertenziu (AHT), poruchy koagulácie a fibrinolýzy, nealkoholovú steatózu pečene, sterilitu, kancerogenézu) [12–14], schéma 1.
Schéma 1. Ektopické tukové tkanivo, inzulínová rezistencia, kardiometabolické komplikácie 
Kardiometabolické komplikácie a ochorenia súvisiace s viscerálnou obezitou
Prediabetes a diabetes mellitus 2. typu
Progresia z normálnej homeostázy glukózy ku porušenej homeostáze je kontinuálny dej. Prediabetes – hraničná glykémia nalačno (IFG – impaired fasting glucose) a porucha tolerancie glukózy (IGT – impaired glucose tolerance) sú intermediárne stavy predchádzajúce manifestácii DM2T (tab.1). Pacienti v obidvoch skupinách majú vysoké riziko progresie do DM2T (25 % počas 3–5 rokov), ako aj vyššie riziko rozvoja KV komplikacii, avšak IGT je s vyšším KV rizikom asociovaná výraznejšie. Prítomnosť DM2T zvyšuje KV riziko 4-násobne a v súčasnosti patrí DM2T do kategórie rizikových ekvivalentov ICHS [15].
Mnohé klinické štúdie (Nurses Health Study, Health Professionals Follow-up Study) potvrdzujú, že riziko rozvoja prediabetu až po DM2T sa zvyšuje paralelne s nárastom BMI a obvodu pása. Tie isté štúdie zároveň poukazujú na fakt, že redukcia hmotnosti o 5 kg vedie ku zníženiu rizika rozvoja DM2T približne o 50 %. Tieto sledovania boli potvrdené aj v ďalších klinických štúdiách – DPS (The Diabetes Prevention Study) a DPP (Diabetes Prevention Program) – v ktorých nefarmakologická intervencia zameraná na redukciu hmotnosti významne znížila výskyt DM2T. Podobné výsledky priniesli aj štúdie u morbídne obéznych pacientov po bariatrickej chirurgii (štúdia SOS – Swedish Obese Subject).
Progresia normálnej homeostázy glukózy až do DM2T je spojená s nárastom IR (znižovaním inzulínovej senzitivity), s ktorou súbežne dochádza ku poklesu funkcie B-buniek pankreasu, čo sa prejaví zhoršením glykemickej kontroly. IR a hyperinzulinémia najlepšie predpovedajú rozvoj DM2T a mnohí jedinci s IR a hyperizulinémiou progredujú do DM2T. Hlavné spojivo medzi obezitou, IR a DM2T predstavuje zvýšená koncentrácia VMK, ktorá vedie ku stimulácii glukoneogenézy, ku akumulácii TAG, zvýšeniu IR v pečeni a vo svaloch, zhoršeniu sekrécie inzulínu u osôb s genetickou predispozíciou, zhoršeniu účinku inzulínu na periférii i v pečeni. Hovoríme o lipotoxicite, ktorá môže výrazným spôsobom zhoršovať funkciu B-buniek pankreasu. Vzťah medzi nahromadením viscerálneho tuku (zmenou distribúcie tuku) a IR je pripisovaný zvýšenej citlivosti viscerálneho tuku na lipolytické podnety, čo zvyšuje tok VMK do portálnej a systémovej cirkulácie. Na rozdiel od podkožného tukového tkaniva viscerálne tukové bunky produkujú väčšie množstvo už vyššie spomínaných prozápalových adipocytokínov (TNFα, IL6, PAI-1) a znižujú množstvo inzulín senzitizujúceho adiponektínu [6,15,16].
Z tohoto všetkého vyplýva, že prevencia zameraná proti rozvoju DM2T u vysoko rizikových osôb s nadhmotnosťou, obezitou, MS musí začať skutočne veľmi včasne. Z tohto uhla pohľadu pod pojmom primárnej prevencie rozumieme prevenciu vzniku samotnej nadhmotnosti a obezity (metabolického syndrómu – prediabetického stavu) ako nositeľa mnohopočetných kardiometabolických rizikových faktorov. V prípade, že už je prítomný DM2T musíme svoju pozornosť sústrediť na komplexný manažment kardiovaskulárnych rizikových faktorov a ich následkov (vrátane KV komplikacií) [6].
Table 1. Diagnostické kritériá pre FPG, IGT a DM2T 
Aterogénna dyslipidémia
U obéznych jedincov sa môžeme stretnúť s rôznymi poruchami metabolizmu lipidov a lipoproteínov (polygénová hypercholesterolémia, hypertriacylglycerolémia). Avšak typickou dyslipidémiou sprevádzajúcou viscerálnu obezitu pri MS (ale aj iných stavoch súvisiacich s inzulínovou rezistenciou ako napr. DM2T) je aterogénna (non-LDL) dyslipidémia. Charakterizuje ju lipidová triáda – zvýšené koncentrácie TAG – nalačno i postprandiálne, kvantitatívne (zníženie koncentrácie) i kvalitatívne zmeny HDL-častíc (malé denzné HDL-častice), s normálnymi alebo ľahko zvýšenými koncentráciami LDL-cholesterolu (low density lipoprotein – LDL-C) s prítomnosťou malých denzných (MD) LDL-častíc. Prítomnosť MD LDL-častíc a MD HDL-častíc je dôležitým aspektom dyslipidemických stavov (tab. 2). Tento fenomén vzniká remodeláciou lipoproteínov v cirkulácii enzýmami ako CETP (cholesteryl ester transfer protín) a hepatálna lipáza. Pri hypertriacylglycerolemických stavoch zvýšená koncentrácia veľkých VLDL1-častíc urýchľuje transfer TAG do LDL - a HDL-častíc výmenou za estery cholesterolu. LDL-a HDL-častice bohaté na TAG sú dobrým substrátom pre hepatálnu lipázu, čo vedie k tvorbe MD LDL a MD HDL častíc. MD HDL častice sú senzitívnejšie na degradáciu a zvýšené odbúravanie z krvi, čo vedie k nižším koncentráciám HDL-C [6,17].
Table 2. Charakteristika aterogénnej dyslipidémie 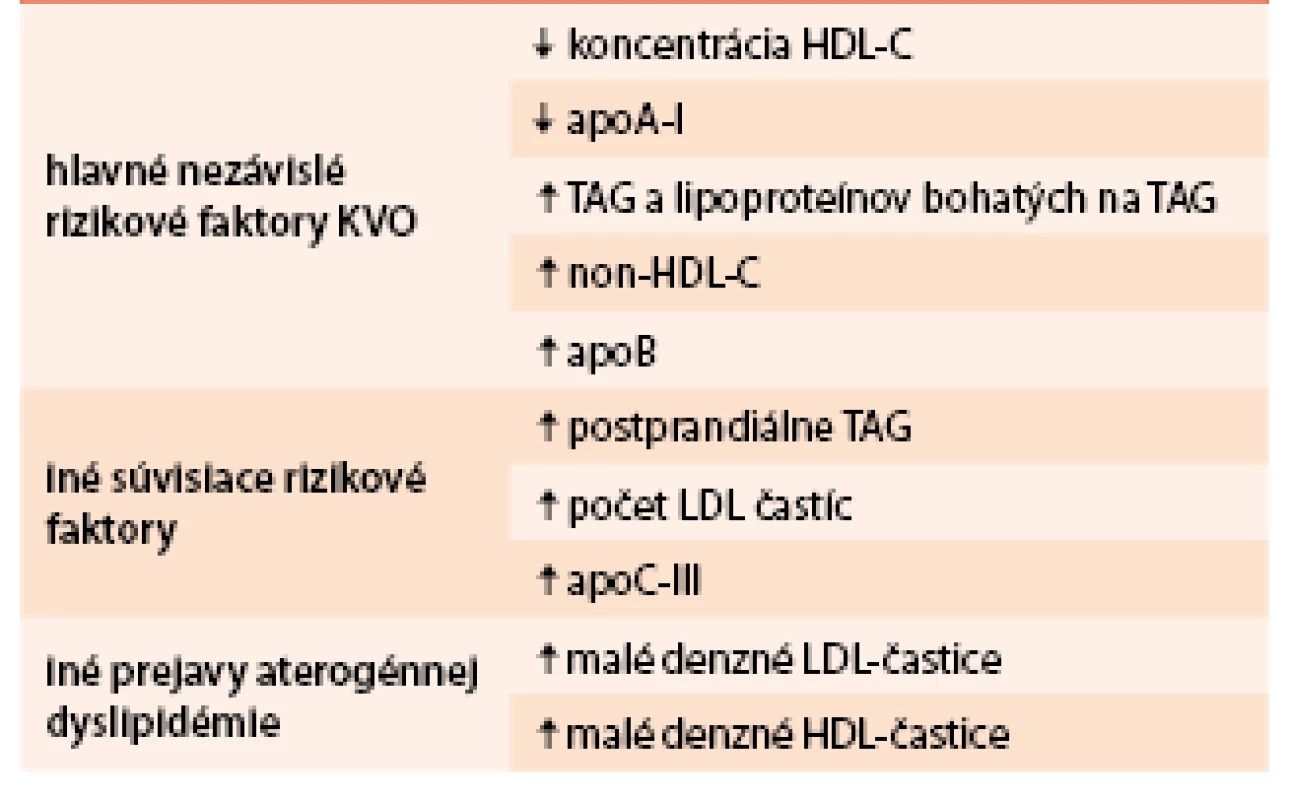
Existuje viacej spôsobov, ktorými sa chylomikrónové a VLDL-remnantné častice, LDL častice a MD LDL-častice podieľajú na rozvoji aterosklerózy. Uvedené častice migrujú do subendotelového priestoru a pretrvávajú v ňom, pokiaľ nie sú vychytané monocytmi/makrofágmi za vzniku penových buniek. Máme k dispozícii údaje, ktoré poukazujú na vzťah medzi koncentráciou lipoproteínov bohatých na TAG a remnantného cholesterolu ku koronárnej, cerebrálnej a periférnej ateroskleróze. Okrem nepriaznivého priameho vplyvu na cievnu stenu bol popísaný aj vplyv orálneho tukového tolerančného testu (oTTT) a infúzie na TAG bohatých lipoproteínov na endotelovú dysfunkciu. Na rozdiel od LDL-častíc chylomikrónové a VLDL-remnantné častice sú vychytávané scavengerovými receptormi makrofágov aj v prípade, že nie sú modifikované (oxidované, glykooxidované). MD LDL-častice majú zvýšenú afinitu k proteoglykanom v stene artérií, čo má za následok ich zvýšenú akumuláciu v subendotelovom priestore. MD LDL-častice sú náchylnejšie na oxidáciu kvôli menšiemu obsahu voľného cholesterolu a vyššej koncentrácii polynenasýtených mastných kyselín (PUFA – polyunsaturated fatty acid), ako aj kvôli nižšej koncentrácii antioxidačne pôsobiacich látok (polovičný obsah α-tokoferolu). Treba poznamenať, že veľkosť lipoproteínovej častice zohráva úlohu v migrácii cez endotel a LDL-častice migrujú podstatne ľahšie ako väčšie remnantné častice. Avšak počet častíc sa nakoniec nemusí pretransformovať do väčšej depozície cholesterolu v subendotelovom priestore (chylomikrónové remnantné častice obsahujú asi 40-násobne viac cholesterolu na jednu časticu ako LDL-častice). Modifikované MD LDL-častice majú nižšiu afinitu k LDL-receptoru, dlhšie zotrvávajú v krvnom obehu, čím sa predlžuje ich expozícia voči oxidácii (tab. 3).
Table 3. Vzťah aterogénnej (non-LDL) dyslipidémie ku aterotrombóze 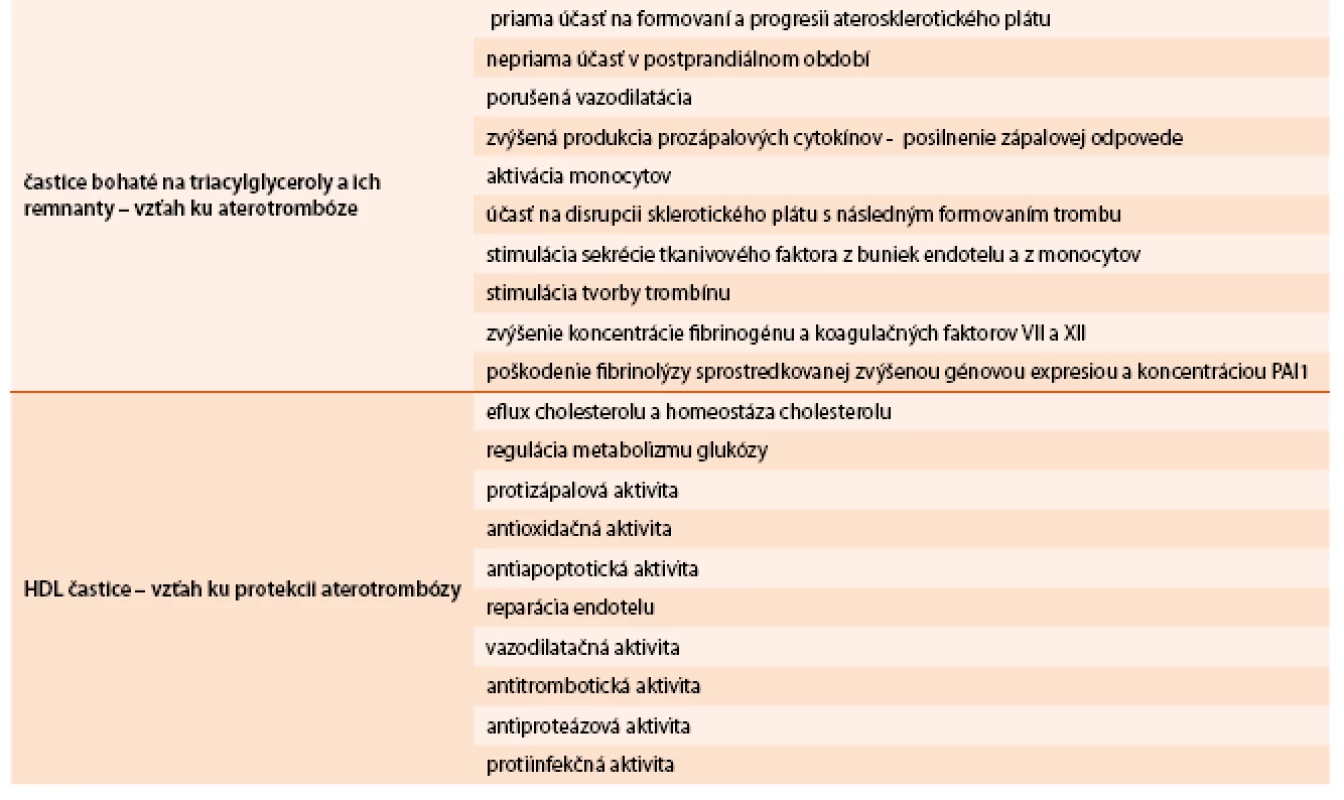
V súčasnosti máme k dispozícii dôkazy, že na TAG bohaté remnantné a HDL-častice relevantne ovplyvňujú všetky štádiá aterotrombózy, špeciálne v kontexte prítomnosti IR a prispievajú ku vyššej incidencii aterotrombotických komplikácií u obéznych jedincov [18,19].
Na TAG bohaté remnantné častice sa podieľajú na formovaní a progresii aterosklerotického plátu jednak priamo, ale aj nepriamo najmä v postprandiálnom období (porušená vazodilatácia, zvýšená produkcia prozápalových cytokínov, posilnenie zápalovej odpovede a aktivácie monocytov). Svoju úlohu zohrávajú aj v disrupcii sklerotického plátu s následnym formovaním trombu. Stimulujú sekréciu tkanivového faktora z buniek endotelu a z monocytov, stimulujú tvorbu trombínu, majú vzťah ku zvýšenej koncentrácii fibrinogénu a koagulačných faktorov VII a XII, ku poškodeniu fibrinolýzy sprostredkovanej zvýšenou génovou expresiou a koncentráciou PAI-1.
Dysfunkcia HDL-častíc (kvantitatívna i kvalitatívna) vedie ku zníženému reverznému transportu cholesterolu a ku zníženiu
- antioxidačnej ochrany LDL-častíc
- protizápalovej aktivity
Veľké epidemiologické a observačné štúdie, ako aj metaanalýzy (od konca 80. rokov minulého storočia až po súčasnosť) jasne dokázali súvislosť aterogénnej dyslipidémie spojenej s viscerálnou obezitou a zvýšeným KV-rizikom.
Patofyziológia aterogénnej dyslipidémie pri obezite je multifaktoriálna a zahŕňa nadprodukciu VLDL pečeňou, zníženie lipolýzy cirkulujúcich TAG, zvýšený tok VMK z adipocytov do pečene a ostatných tkanív, ako aj tvorbu MD LDL a MD HDL častíc. Liečba má byť zameraná na zlepšenie diétnych a režimových opatrení (redukcia kalorického príjmu, zvýšená pohybová aktivita). Prvolíniovou hypolipidemickou liečbou ostávajú statíny, avšak u pacientov s aterogénnou dyslipidémiou je vhodné použiť kombinačnú hypolipidemickú liečbu (statín s fibrátom) [20–22].
Artériová hypertenzia
Artériová hypertenzia je hlavným rizikovým faktorom pre rozvoj KV komplikacií (hypertrofia ľavej komory, predsieňová a komovorá arytmia, srdcové zlyhanie, KCHS s alebo bez kongestívneho srdcového zlyhania). AHT vedie ku poškodeniu centrálneho nervového systému a obličiek. Prítomnosť ďalších rizikových faktorov, ako je IR, MS potencuje nepriaznivý vplyv AHT na cieľové orgány a zvyšuje ďalej kardio-cerebrovaskulárne riziko. Vzťah medzi obezitou (viscerálnou obezitou) a AHT je známy veľmi dlho. Mechanizmov, ktoré vedú pri viscerálnej obezite ku zvýšeniu krvného tlaku je viacej. Jedným z možných ďalších je alterácia sekrécie angiotenzínu II a aldosterónu. V tukovom tkanive dokážeme identifikovať množstvo zložiek patriacich do systému renín-angiotenzín. Obezita taktiež vedie ku štrukturálnym zmenám v obličkách, čo môže viesť k funkčnej strate nefrónov s ďalším zvýšením krvného tlaku. Framigham Heart Study (CT podštúdia) priniesla dôkazy o tom, že abdominálna obezita sprevádzaná prítomnosťou ektopického tukového tkaniva v oblasti renálneho sínusu môže zohrávať dôležitú úlohu v patofyziológii hypertenzie [23,24].
Subklinický zápal
Zápalový stav sprevádzajúci MS nie je spôsobený infekciou, autoimunitnou odozvou alebo masívnym poškodením tkaniva. Rozmer zápalu nie je taký obrovský a nazývame ho chronický subklinický zápal. V literatúre sa môžeme stretnúť aj s pojmom „metazápal“ (metabolicky spúšťaný zápal) alebo „parazápal“ (termín definujúci stav medzi normálnym a zápalovým stavom). Nech však použijeme akýkoľvek termín, zápalový proces pri MS má svoje unikátne črty. Mechanizmy, ktoré spôsobujú chronický subklinický zápal nie sú v súčasnoti stále kompletne známe. Publikované štúdie potvrdzujú pozitívny vzťah medzi obezitou a viacerými markermi zápalu. Viscerálne tukové tkanivo je citlivé na lipolýzu, čo vedie ku zvýšenej produkcii TNFα, IL6 a hs-CRP (vysokosenzitívny C reaktivny proteín). Mnohé práce dokázali koreláciu medzi veľkosťou adipocytov a produkciou týchto zápalových markerov. Veľké viscerálne adipocyty sa odlišujú menším obsahom spojivového tkaniva s náchylnosťou k apoptóze a ruptúre pri vyššom vnútrobrušnom tlaku. Ruptúra adipocytu predstavuje zdroj zápalu (nález makrofágov obklopujúcich „mŕtve“ adipocyty podporuje túto hypotézu). V tukovom tkanive sa nachádzajú aj lymfocyty, ktoré sa zúčastňujú na zosilnení zápalovej reakcie. Nedávne výskumy poukazujú na význam rovnováhy medzi glukokortikoidmi a mineralokortikoidmi vo vzťahu k subklinickým zápalom asociovaným s obezitou [25,26] (schéma 2).
Schéma 2. Klinická aplikácia hs-CRP pre predikciu kardiovaskulárneho rizika 
Protrombotický stav
Protrombotický stav je frekventnou súčasťou metabolického syndrómu s významným podielom na rozvoji aterotrombotických komplikácií. Podieľa sa na ňom viacej faktorov súčasne (hypofibrinolýza, hyperkoagulácia, endotelová dysfunkcia, hyperaktivita trombocytov). Je charakterizovaný zvýšenými hodnotami PAI-1 – potentného inhibítora fibrinolýzy (inhibícia tvorby plazmínu z plazminogénu), ktorý je syntetizovaný mnohými tkanivami, ale najmä tukovým tkanivom a vaskulárnymi endotelovými bunkami. Mnohé práce ukazujú na jasný vzťah medzi koncentráciou PAI-1 a BMI, čo podporuje názor, že obezita je hlavným faktorom ovplyvňujúcim koncentrácie PAI-1. V súhlase s týmito štúdiami zase naopak zdravé stravovanie, zvýšená pohybová aktivita s redukciou hmotnosti vedie ku redukcii PAI-1. So zvyšovaním koncentrácie PAI-1 stúpa riziko KV-príhod.
Ďalšou koagulačnou abnormalitou sprevádzajúcou MS je zvýšená koncentrácia fibrinogénu, zapríčiňujúca hyperkoaguláciu. Fibrinogén je podobne ako CRP reaktantom akútnej fázy zápalu, zvýšenie koncentrácie je reakciou na nadmernú produkciu cytokínov. Na základe týchto údajov je veľmi pravdepodobné prepojenie protrombotického a prozápalového stavu pri MS. Fibrinogén je silným nezávislým rizikovým faktorom KV príhod.
Dôležitú úlohu vo vaskulárnej hemostáze zohráva endotel. MS, inzulínorezistentné stavy sú spojené s endotelovou dysfunkciou charakterizovanou deficitom produkcie oxidu dusného (NO), čo vedie ku vazkonstrikcii, aktivácii leukocytov, trombózy, proliferácii vaskulárnych hladkých svalových buniek, ku rozvoju AHT, aterosklerózy – aterotrombózy s nárastom KV ochorení.
Pacienti s MS a DM majú vyšší stupeň aktivácie trombocytov, ako aj jej markerov (P-selectin (CD62P), CD63, PAC-1 a anexin). Trombocyty produkujú tkanivový faktor, ktorý je upregulovaný pri MS a vedie k urýchleniu trombózy. Trombocyty účinkujú na tvorbu trombu priamo alebo prostredníctvom uvoľňovania trombocytových mikropartikúl (PMP – platelet microparticule), ktoré obsahujú fosfolipidy s prokoagulačnou aktivitou (zvýšené koncentrácie detekujeme u pacientov po infarkte myokardu alebo u diabetikov 2. typu). PMP urýchľujú formovanie trombu väzbou na subendotelovú matrix, ktorá pôsobí ako substrát pre ďalšiu väzbu trombocytov cestou GP IIb/IIIa. PMP aktivujú endotelové bunky a leukocyty uvoľňovaním kyseliny arachidonovej, ako aj ďalších molekúl zapríčiňujúcich zhoršenie endotelovej dysfunkcie [27].
Vzťah ektopického tukového tkaniva ku kardiovaskulárnym ochoreniam
Napriek faktu, že viscerálna obezita je hlavnou črtou MS, mechanizmus, ktorým abdominálna obezita indukuje rozvoj KV ochorení nie je úplne známy. Novinky sa objavujú s ohľadom na ektopické tukové tkanivo (lokálna obezita orgánov, nahromadenie lipidov v netukovom tkanive) [11].
Typickým prejavom nahromadenie ektopického tukového tkaniva je nealkoholové stukovatenie pečene (NAFL). Podľa niektorých prác NAFL predikuje budúce KV-príhody vrátane nefatálnych príhod (infarkt myokardu, koronárne revaskularizácie) ischemickú cievnu mozgovú príhodu alebo KV-smrť u diabetikov 2. typu. Po adjustácii na vek, pohlavie, fajčenie, trvanie DM, hladiny HbA1c, LDL-cholesterolu, hladinu pečeňových enzýmov, medikáciu bola prítomnosť NAFL signifikantne asociovaná so zvýšením KV-rizika (OR 1,84, p < 0,001) [28].
Objavujú sa však názory, že práve ektopické tukové tkanivo v myokarde je v príčinnej súvislosti ku štrukturálnej remodelácii srdca. Je to v dôsledku tuku prítomného v lokálnej cirkulácii (vaskulárna lipotoxicita), v dôsledku intramyocelulárneho a extramyocelulárneho, perivaskulárneho, perikardiálneho a epikardiálneho tuku. Tento stav sa v literatúre označuje ako kardiálna lipotoxicita [29].
Nadmerná ponuka VMK z viscerálneho tukového tkaniva v krvnom riečisku môže viesť k poškodeniu vaskulárnej homeostázy. Cirkulujúce VMK vedú k akútnej aktivácii reaktívnych foriem kyslíka (reactive oxygen species – ROS), ktoré reagujú s NO, čo vedie ku generovaniu peroxynitritu s poškodením cGMP-dependentnej vazodilatácie.
Akumulácia tuku v myokarde je asociovaná s hypertrofiou ľavej komory (ĽK) a dysfunkciou, ktorá nakoniec progreduje do lipotoxickej kardiomyopatie. Existujú práce, ktoré poukazujú na to, že zvýšená koncentrácia TAG v myokarde vedie k rozvoju koncentrickej hypertrofie ĽK. Obsah tuku v myokarde je u obéznych osôb zvýšený a koreluje s hladinou VMK, epikardiálnym tukom a s WHR (waist-to-hip ratio) [29].
Zo štúdií na potkanoch máme údaje o tom, že akumulácia lipidov v myokarde vedie lipotoxickým mechanizmom k srdcovému zlyhaniu.
Perivaskulárny tuk (nahromadenie tuku v blízkosti všetkých ciev, aj koronárnych artérií a aorty) je ďalším možným mediátorom KV rizika asociovaného s obezitou. Konvenčne sa perivaskulárny tuk vnímal ako štrukturálna podpora vaskulatúry. Avšak v súčasnosti sa zdá, že tuk lokalizovaný v periadventícii dokáže modulovať odozvu vaskulatúry na vazoaktívne podnety. Perivaskulárny tuk dokáže secernovať rôzne cytokíny a chemokíny, a tak môže vstupovať do patogenézy a/alebo progresie obezitou indukovanej aterosklerózy [30].
Akumulácia perikardiálneho tuku so schopnosťou sekreovať cytokíny je vo vzťaku k remodelácii srdca. Množstvo perikardiálneho tuku dobre koreluje s množstvom viscerálneho tuku. Perikardiálne tukové tkanivo má významnú sekrečnú aktivitu, produkuje proaterogénne a prozápalové adipocytokíny. U pacientov s rozvinutou KCHS perikardiálne tukové tkanivo obsahuje nižšie koncetrácie antiaterogénneho adipocytokínu – adiponektínu.
Epikardiálne tukové tkanivo (ETT) koreluje nezávisle s KV rizikovými faktormi ako je abdominálna viscerálna obezita, BMI, artériová hypertenzia a DM. Framingham Heart Study a Multi-Ethnic Study of Atherosclerosis (MESA) poukázali na ETT ako nezávislý prediktor KV ochorenia. ETT je zdrojom proaterogénnych mediátorov a adipocytokínov. Existujú štúdie, ktoré poukázali na silnú asociáciu medzi zvýšením ETT a koronárnou aterosklerózou u mužov [31].
Epikardiálny tuk je pozitívne asociovaný s periférnou vaskulárnou rezistenciou. Akumulácia TAG ako dôsledok zvýšenej expozície VMK, nárast ektopického tukového tkanivo v kombinácii s periférnou vaskulárnou rezistenciou vedie hypertrofii ĽK [31].
Záver
Viscerálne tukové tkanivo zohráva dôležitú úlohu v rozvoji metabolických a kardiovaskulárnych ochorení. Viscerálna obezita je asociovaná s porušením rovnováhy produkcie adipocytokínov s výsledným prozápalovým a proaterogénnym stavom. Popri množstve a distribúcii tukového tkaniva nadobúda čoraz väčší význam ektopické tukové tkanivo, ktoré je považované za nový marker kardiometabolického rizika. Obezita je v úzkom vzťahu s ochoreniami, ktoré označujeme ako komplikácie obezity. Obezita ovplyvňuje KV systém priamo i nepriamo. Kardiometabolické komplikácie sa naviac u obézneho jedinca kumulujú a výrazným spôsobom limitujú jeho život. Nové poznatky nám umožňujú zasiahnuť proti nárastu KV ochoreni prevenciou a komplexným manažmentom obezity a kardiometabolických rizikových faktorov u rizikových pacientov (tab. 4) [32–34].
Table 4. Manažment hlavných zložiek metabolického syndrómu vedúi ku zníženiu KV komplikácií 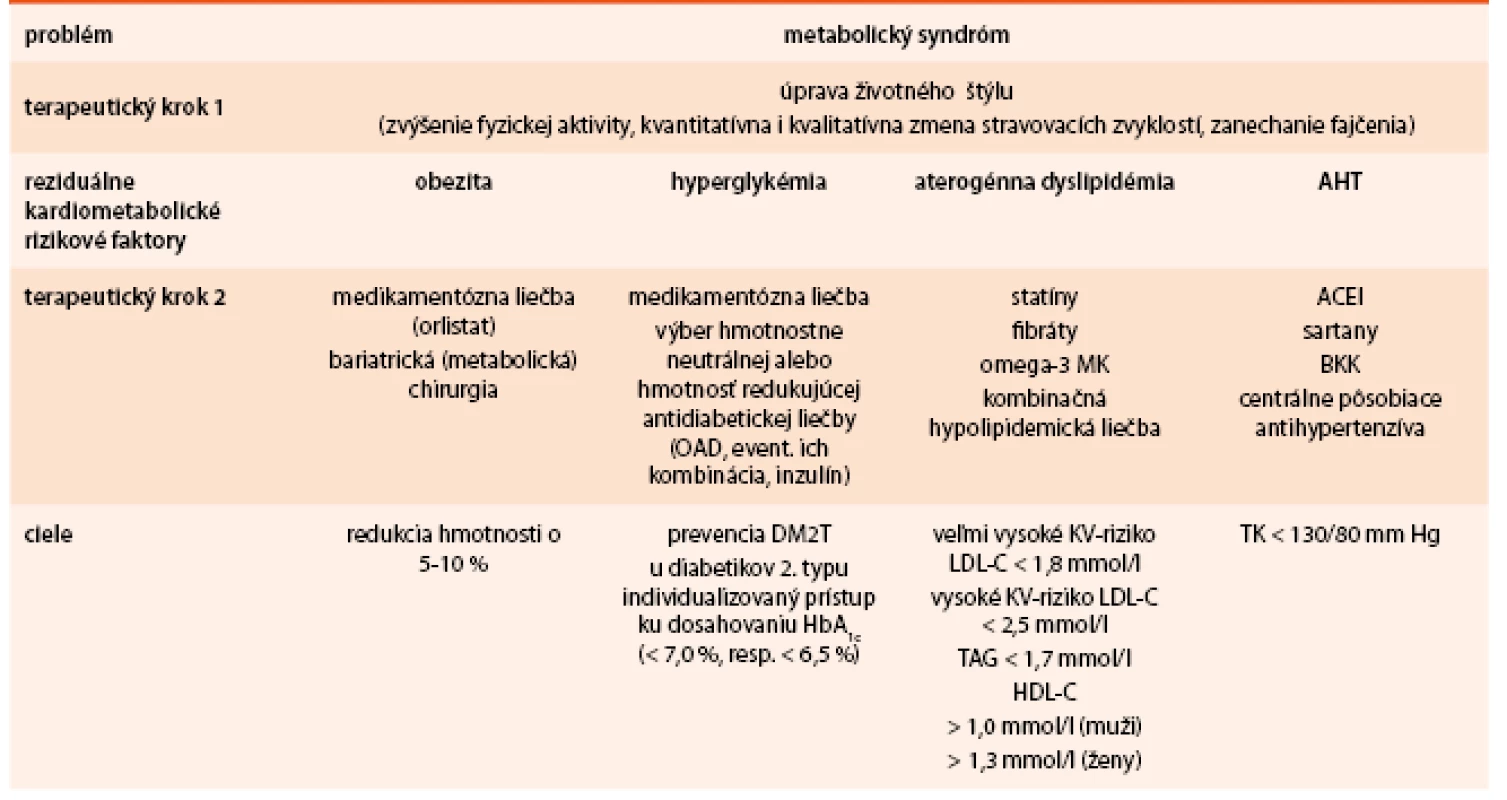
Doručeno do redakce 5. 1. 2015
Přijato po recenzi 19. 1. 2015
MUDr. Fábryová Ľubomíra, PhD.
lfabryova@metabolklinik.sk
MetabolKLINIK s.r.o., Ambulancia pre diabetológiu, poruchy látkovej premeny a výživy, Špecializovaná lipidologická ambulancia, Bratislava
Sources
1. Aronne LJ, Nelinson DS, Lillo JL et al. Obesity as a disease state: new paradigm for diagnosis and treatment. Clin Cornerstone 2009; 9(4): 9–29.
2. Willett WC, Manson JE, Stampfer MJ et al. Weight, weight change, and coronary heart disease in women. Risk within the ‘normal’ weight range. JAMA 1995; 273(6): 461–465.
3. Shaper AG, Wannamethee SG, Walker M. Body weight: implications for the prevention of coronary heart disease, stroke, and diabetes mellitus in a cohort study of middle aged men. BMJ 1997; 314(7090): 1311–1317.
4. Tokunaga K, Matsuzawa Y, Kotani K et al. Ideal body weight estimated from the body mass index with the lowest morbidity. Int J Obes 1991; 15(1): 1–5.
5. Jousilahti P, Tuomilehto J, Vartiainen E et al. Body weight, cardiovascular risk factors, and coronary mortality. 15-year follow-up of middle-aged men and women in eastern Finland. Circulation 1996; 93(7): 1372–1379.
6. Fábryová Ľ. Kardiometabolické riziká obezity. In: Krahulec B, Fábryová Ľ, Holéczy P et al (eds). Klinická obezitológia. Facta Medica; Brno 2013 : 166–177. IBSN 978–80–904731–7-1.
7. Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120(16): 1640–1645.
8. Fisman EZ, Tenenbaum A. The metabolic syndrome entanglement: cutting the Gordian knot. Cardiol J 2013; 21(1) :1–5 Dostupné z DOI: <http://dx.doi.org/10.5603/CJ.a2013.0054>.
9. Blüher M. Adipose tissue dysfunction contributes to obesity related metabolic diseases. Best Pract Res Clin Endocrinol Metab 2013; 27(2):163–177.
10. Tchernof A, Després JP. Pathophysiology of human visceral obesity: an update. Physiol Rev 2013; 93(1): 359–404.
11. Shimabukuro M, Kozuka C, Taira S et al. Ectopic fat deposition and global cardiometabolic risk: New paradigm in cardiovascular medicine. J Med Invest 2013; 60(1–2): 1–14.
12. Boden G, Salehi S. Why does obesity increase the risk for cardiovascular disease? Curr Pharm Des 2013; 19(32): 5678–5683.
13. Persic V. Obesity in the cardiovascular continuum. Curr Clin Pharmacol 2013; 8(2): 159–163.
14. Phillips CM, Tierney AC, Perez-Martinez P et al. Obesity and body fat classification in the metabolic syndrome: impact on cardiometabolic risk metabotype. Obesity (Silver Spring) 2013; 21(1): E154-E161.
15. Pedersen SD. Metabolic complications of obesity. Best Pract Res Clin Endocrinol Metab 2013, 27(2): 179–193.
16. Dukát A, Fábryová Ľ. Možné prítupy na zníženie reziduálneho kardiovaskulárneho rizika u pacientov s diabetes mellitus 2. typu. Cardiol 2010; 19(6): 474–480.
17. Klop B, Elte JWF, Cabezas MC. Dyslipidemia in obesity: mechanisms and potential targets. Nutrients 2013; 5(4): 1218–1240.
18. Varbo A, Benn M, Tybjærg-Hansen A et al. Remnant Cholesterol as a Causal Risk Factor for Ischemic Heart Disease. J Am Coll Cardiol 2013; 61(4): 427–436.
19. Toth PP. Insulin resistance, small LDL particles, and risk for atherosclerotic disease. Curr Vasc Pharmacol 2014; 12(4):653–657.
20. Catapano AL, Reiner Z, de Backer G et al. ESC/EAS Guidelines for the management of dyslipidaemias: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis 2011; 217(Suppl 1): 1–44.
21. Chapman MJ, Ginsberg HN, Amarenco P et al. European Atherosclerosis Society Consensus Panel. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J 2011; 32(11): 1345–1361.
22. Fábryová Ľ. Kombinačná hypolipidemická liečba v súčasnej klinickej praxi. Via pract 2014; 11(6): 201–206.
23. Cabral NAL, Ribeiro VS, França AKT et al. Hypertriglyceridemic waist and cardiometabolic risk in hypertensive women. Rev Assoc Med Bras 2012; 58(5): 568–573.
24. Dorresteijn JAN, Visseren FLJ, Spiering W. Mechanisms linking obesity to hypertension. Obes Rev 2012; 13(1): 17–26.
25. Dulloo AG, Montani JP. Body composition, inflammation and thermogenesis in pathways to obesity and the metabolic syndrome: an overview. Obes Rev 2012; 13(Suppl 2): 1–5.
26. Greevenbroek MM, Schalkwijk CG, Stehouwer CDA. Obesity-associated low-grade inflammation in type 2 diabetes mellitus: causes and consequences. Neth J Med 2013; 71(4): 174–187.
27. Santilli F, Vazzana N, Liani R et al. Platelet activation in obesity and metabolic syndrome. Obes Rev 2012; 13(1): 27–42.
28. Targher D, Bertolini L, Poli F et al. Nonalcoholic fatty liver disease and risk of future cardiovascular events among type 2 diabetic patients. Diabetes 2005; 54(12): 3541–3546.
29. Szczepaniak LS, Victor RG, Orci L et al. Forgotten but not gone: the rediscovery of fatty heart, the most common unrecognized disease in America. Circ Res 2007; 101(8): 759–767.
30. Takaoka M, SuzukiH, Shioda S et al. Endovascular injury induded rapid phenotypic changes in perivascular adipose tissue. Artherioscler Thromb Vasc Biol 2010; 30(8): 1576–1582.
31. Ding J, Hsu FC, Harris TB et al. The association of pericardial fat with incidence coronary heart disease. The Multietnic Study of Atherosclerosis (MESA). Am J Clin Nutr 2009; 90(3): 499–504.
32. Tsigos C, Hainer V, Basdevant A et al. Obesity Management Task Force Európskej obezitologickej spoločnosti (European Association for the Study of Obesity). Liečba obezity u dospelých. Európske odporúčania pre klinickú prax. Diabetes a obezita 2009; 9(17): 10–20.
33. Eckel RH, Jakicic JM, Ard JD et al. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014; 63(25 Pt B):2960–2984.
34. Jensen MD, Ryan DH, Apovian CM et al. 2013 AHA/ACC/TOS Guideline for the Management of Overweight and Obesity in Adults. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society. Circulation 2014; 129(25 Suppl 2): S102-S138.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2015 Issue 1-
All articles in this issue
-
Koronárna choroba srdca a diabetes mellitus 2. typu.
Pohľad kardiológa – editorial - Diabetes mellitus a ochorenia srdca. Nové paradigmy? – editorial
- Klinická diagnostika stabilnej koronárnej choroby srdca
- Koronárna choroba srdca a ženy
- Význam ambulantného monitorovania krvného tlaku a ambulantného monitorovania EKG u pacientov s koronárnou chorobou srdca
- Diabetes mellitus a arytmie
- Akútny koronárny syndróm a diabetes mellitus z pohľadu invazívneho kardiológa
- Revaskularizácia pri srdcovom zlyhávaní a diabetes mellitus
- Diabetes, hypertenzia a dyslipidémia – smrtiace trio
- Kardiometabolické riziká obezity
- Diétne zmeny a cvičenie v prevencii koronárnej choroby srdca u pacientov s diabetes mellitus 2. typu
- Diabetes, kardiovaskulárne choroby a mikrocirkulácia
-
Koronárna choroba srdca a diabetes mellitus 2. typu.
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinická diagnostika stabilnej koronárnej choroby srdca
- Význam ambulantného monitorovania krvného tlaku a ambulantného monitorovania EKG u pacientov s koronárnou chorobou srdca
- Koronárna choroba srdca a ženy
- Diabetes mellitus a arytmie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

