-
Medical journals
- Career
Průkaz benzodiazepinů v moči pomocí kapalinové chromatografie s tandemovou hmotnostní detekcí
Authors: L. Chytil 1,2; V. Marešová 1; O. Slanař 2
Authors‘ workplace: Ústav soudního lékařství a toxikologie 1. LF UK a VFN 1; Farmakologický ústav 1. LF UK 2
Published in: Soud Lék., 56, 2011, No. 1, p. 10-16
Category: Original Article
Overview
Popisujeme citlivou a selektivní metodu pro analýzu benzodiazepinů a jejich metabolitů v moči zahrnující kapalinovou chromatografii spojenou s tandemovou hmotnostní detekcí. Pro separaci látek na koloně s C18 fázi jsme použili gradientovou eluci. Kladná ionizace analytů proběhla v elektrospreji operujícím v módu Selected Reaction Monitoring. V popisu metodiky je zahrnuta i optimalizace kyselé hydrolýzy a liquid – liquid extrakce pro izolaci sledovaných molekul. Nalezení vhodných podmínek extrakce i analýzy zaručilo limit detekce pro většinu látek na úrovni 1ng/ml. Pro demonstrování jednoduchosti, funkčnosti a selektivity vyvinuté metody je předloženo několik případů, řešených v rámci systematické toxikologické analýzy.
Klíčová slova:
Benzodiazepiny - LC-MS/MS - kyselá hydrolýza - liquid–liquid extrakce – biotransformacePo syntéze chlordiazepoxidu, jež byla uskutečněna v šedesátých letech minulého století, započal rozsáhlý vývoj strukturně obdobných analog, nazvaných podle charakteristických rysů v molekulární struktuře benzodiazepiny. Celkově bylo vyvinuto přes 3000 struktur, z nichž asi 50 bylo uvedeno do praxe. Vzhledem ke svým anxiolytickým, antikonvulzním, myorelaxančním a sedativním účinkům, zprostředkovaným ovlivněním GABAA receptorů v mozku, jsou mnohé z nich hojně předepisovány lékaři různých specializací (1). Společně s rozšířením těchto léků v klinické praxi vzrůstala i četnost intoxikací benzodiazepiny, což si vyžadovalo zavedení nových analytických postupů v rámci systematické toxikologické analýzy. Kromě intoxikací v suicidálním úmyslu, bývá často nutné prokázat nebo vyvrátit zneužití benzodiazepinů v kriminálních deliktech například pro snadnější ovládnutí oběti, popřípadě objasnit zneužití benzodiazepinů pacientem, který je zařazen v léčebném odvykacím programu.
Poznatky o metabolických cestách patří k základním znalostem, na jejichž základě lze směřovat vývoj analytické metody. Vzhledem k intenzivní metabolizaci velké části benzodiazepinových derivátů, lze původní formu prokázat spíše v séru (plasmě) nebo žaludečním obsahu. Zatímco v moči mnohdy není možné vystopovat původní látku a je tedy nutné se spokojit s nálezem metabolitu, který odpovídá určité skupině strukturně obdobných látek podléhajících stejnému typu biotransformačních reakcí. V některých případech je interpretace usnadněna nálezem metabolitu, který je charakteristický pro konkrétní léčivo. Příklady základních metabolických pochodů benzodiazepinů, které bývají nejčastěji předepisovány v České republice jsou znázorněny v obrazové příloze (Obr. 1). Detailnější popisy, lze nalézt v odborné literatuře zabývající se danou problematikou (2-4).
Obr. 1. Znázornění různých metabolických cest benzodiazepinů s naznačením dalších kroků významných pro vznik charakteristických struktur: vznik bezofenonů MACB a ACB (A), redukce NO<sub>2</sub> skupiny clonazepamu, flunitrazepamu a nitrazepamu (B), α hydroxylace alprazolamu a midazolamu (C) a vznik ABP hydrolýzou bromazepamu a jeho metabolitu (D). 
V běžném provozu toxikologické laboratoře se lze nejčastěji setkat s nálezy diazepamu, alprazolamu, bromazepamu, tetrazepamu, clonazepamu a midazolamu. Méně často se vyskytuje flunitrazepam, chlordiazepoxid nebo nitrazepam (v současnosti již není v ČR registrován). Diazepam podléhá N–demetylaci za vzniku účinného metabolitu nordiazepamu, který je hydroxylován na sedmičlenném kruhu za vzniku 3–hydroxynordiazepamu (oxazepamu). Alternativní cestou je hydroxylace sedmičlenného kruhu diazepamu za vzniku 3–hydroxydiazepamu (temazepam). Oxazepam i nordiazepam podléhají konjugaci s kyselinou glukuronovou nebo sírovou (2). Kyselou hydrolýzou vzniklých glukuronidů, lze získat 2–amino–5–chlorbezofenon (ACB) (4). Konjugaci podléhá i 3–hydroxydiazepam, který po kyselé hydrolýze poskytuje 5–chlor–2 – (metylamino)benzofenon (MACB) (4). Současným nálezem ACB a MACB ovšem nelze spolehlivě prokázat požití diazepamu, jelikož ten sám může vznikat i biotransformací jiných látek, například medazepamu (3). Stejně tak i jeden z prekurzorů ACB – nordiazepam, může vzniknout biotransformací chlordiazepoxidu, což opět vylučuje jednoznačný závěr. Naopak kyselou hydrolýzou bromazepamu a jeho metabolitů lze získat (2–Amino–5–bromphenyl) pyridin–2–yl)metanon (ABP) jednoznačně poukazující na přítomnost původní formy (4). Redukcí nitroskupin clonazepamu, flunitrazepamu a nitrazepamu vznikají charakteristické aminoderiváty: redukovaný clonazepam (RC), nitrazepam (RN) a flunitrazepam (RF), jejichž nález ilustruje požití mateřských látek (2). Alprazolam se vylučuje z 20% v nezměněné podobě a dále asi ze 17% ve formě α–hydroxyalprazolamu (5), který pak vytváří konjugát s kyselinou glukuronovou (6). Analogicky dochází k hydroxylaci u midazolamu s následnou konjugací (7). Tetrazepam je rovněž intenzivně metabolizován – pouze 2% se vyloučí močí v původní formě, navíc je známo, že alternativní metabolickou cestou je vznik diazepamu (8,9) následně metabolizovaného výše popsanými způsoby.
Doposud bylo popsáno mnoho analytických postupů, které umožňují detekci benzofenonů (10,4), aminoderivátů (11,12), tertazepamu (8),alprazolamu (6,13) a midazolamu (14) s metabolity. Pro průkaz benzofenonů a redukovaných metabolitů v moči bylo po dlouhá léta v četných laboratorních provozech používáno TLC metodik (15), zatímco pro detekci alprazolamu, midazolamu a jejich metabolitů bylo použito metod vycházejících z plynové chromatografie (13). V současnosti již tenkovrstevná chromatografie nesplňuje požadavky, které si žádá moderní toxikologická analýza. Nevýhodou je velké množství zpracovávaného materiálu, náročné provedení hydrolýzy a samozřejmě interpretace chromatogramu, která je ztížena řadou interferujících artefaktů v chromatogramu. Metody na bázi plynové chromatografie (GC, GC/MS) zase většinou vyžadovaly, kromě extrakce, zdlouhavou a nákladnou dekonjugaci pomocí β–glukuronidázy s následnou derivatizací (tam, kde měla smysl). Vzhledem k těmto skutečnostem nebylo tedy ani možné počítat s rutinním prováděním GC analýz benzodiazepinů v rutinní praxi. V dnešní době můžeme k analýze benzodiazepinů a jejich metabolitů využít velmi rychlé a robustní kapalinové chromatografie spojené s tandemovou hmotnostní detekcí (LC-MS/MS), která již dnes pomalu patří do běžného vybavení toxikologické laboratoře.
Cílem této práce bylo popsat jednoduchou a spolehlivou analytickou metodu pro screeningové vyšetření benzodiazepinů nebo jejich metabolitů v moči pomocí LC-MS/MS. Popis metody se soustředí jak na přípravu extraktu moče liquid – liquid extrakce (LLE) s předřazenou kyselou hydrolýzou tak i na optimalizaci metody pro tandemovou hmotnostní detekci (MS/MS). Během zavádění metody jsme kladli důraz na to, aby bylo možné uvedený postup rutinně používat v běžném provozu forenzní nebo klinické toxikologické laboratoře. Součásti práce jsou i příklady reálných případů, které jsme řešili v rámci běžného laboratorního provozu, čímž je demonstrována přesnost, jednoznačnost, jednoduchost a především univerzálnost vyvinutého postupu.
EXPERIMENTÁLNÍ ČÁST
Chemikálie
Kyselina chlorovodíková (HCl), hydroxid sodný (NaOH), acetonitril, deionizovaná voda, terc – butylmetylether (TBME), chemikálie pro přípravu borátového pufru (kyselina boritá, chlorid draselný a uhličitan sodný), kyselina mravenčí a mravenčan amonný. Použitý acetonitril dosahoval čistoty LC–MS grade, ostatní chemikálie byly p. a. kvality
Příprava vzorku moče
Screeningové vyšetření vyžaduje provedení dvou extrakčních postupů: prostá LLE z bazického prostředí a kyselá hydrolýza s následnou neutralizací a extrakcí. Oba extrakty jsou následně spojeny a dále podrobeny analýze jako jeden vzorek.
Extrakce z alkalického prostředí
K 1 ml moče je přidáno 1 ml borátového pufru (pH 9) a 4 ml TBME. Následně se moč extrahuje buď manuálně nebo za pomoci horizontálního shakeru. Doporučený čas pro provedení extrakce je 5 minut. Po extrakci a odstředění (5 min; 4000 g) je supernatant opatrně odsát do skleněné zkumavky. Rozpouštědlo je odpařeno při 40°C pod jemným proudem dusíku.
Kyselá hydrolýza
Moč (1ml) okyselená koncentrovanou HCl (1ml) je 15 minut zahřívána v termostatu při 110°C. Po provedení hydrolýzy se směs vychladí a upraví se její pH pomocí ředěného NaOH (1mol/l) a HCl (1mol/l) na hodnotu 7 – 8. Poté se extrahuje 4 ml TBME po dobu 5 minut. Po odstředění (5 min; 4000 g) se odpipetuje horní organická vrstva do zkumavky s odparkem z předchozí LLE. Spojený extrakt je následně odpařen při 40°C pod proudem dusíku. Odparek se rozpustí v 200μl mobilní fáze pro LC–MS/MS analýzu a 5 μl je nastříknuto na kolonu.
LC-MS/MS analýza
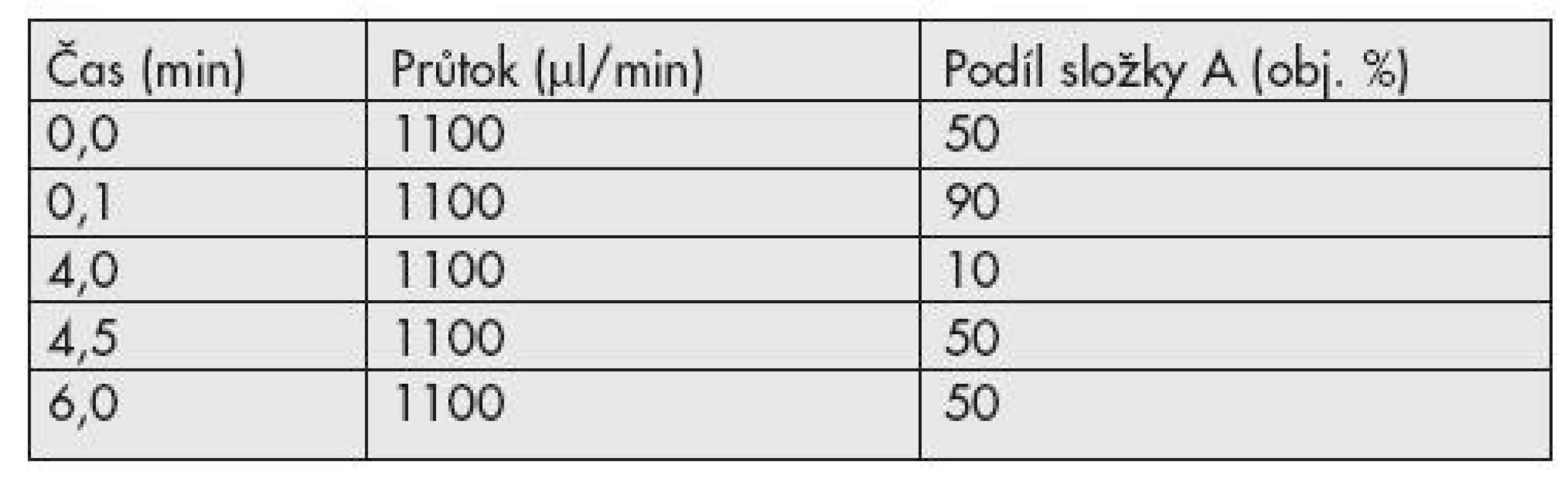
Pro analýzu extraktu jsme použili kapalinový chromatograf Agilent 1200 RRLC (Waldbronn, Německo), vybavený autosamplerem a termostatem kolon. Mobilní fáze je dvousložková: 0,02% vodní roztok kyseliny mravenčí s přídavkem 5 mmol/l mravenčanu amonného (složka A) a acetonitril (složka B). K separaci složek dochází při gradientové eluci (Tab. 1) na koloně ZORBAX Eclipse XBD – C18 (4.6x50mm; 1.8 μm) vybavené předkolonou Phenomenex Security Guard Cartridge C18 (4x2mm). Teplota kolony je 40±0,5°C.
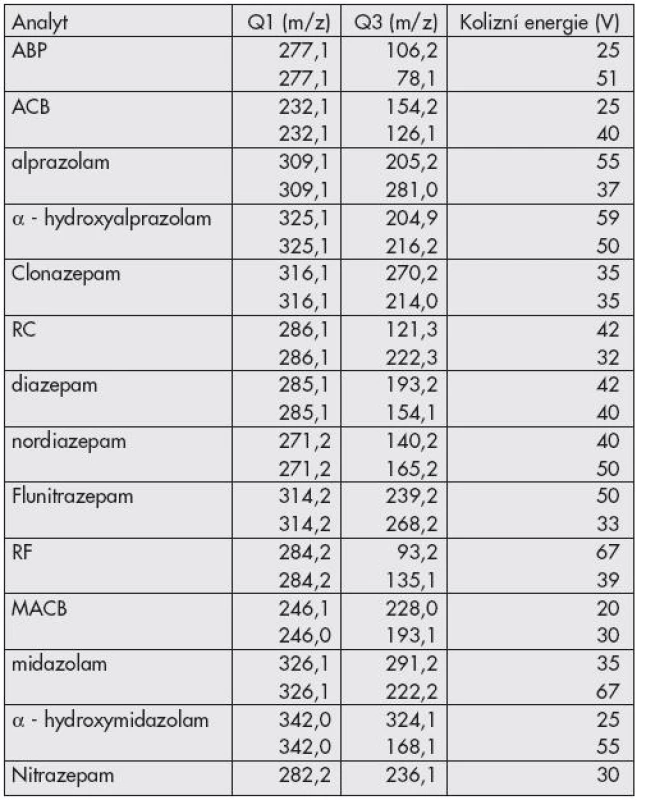
K detekci eluovaných složek jsme použili hybridní analyzátor 3200 QTrap AB Sciex (Ontario, Kanada) operující v módu selected reaction monitoring (SRM). Ke kladné ionizaci analytů byl použit elektrospray (ESI+). Teplotu ionizace jsme nastavili na 550°C a napětí na sprejovací kapiláře na 2000V. Pro detekci každého analytu jsme použili dvou SRM přechodů (Tab. 2) s detekčním oknem 60s.
VÝSLEDKY A DISKUZE
Optimalizace analytické metody LC-MS/MS
Při vývoji chromatografické metody jsme dbali na co nejúčinnější dělení analytů a zároveň na udržení co nejkratšího možného času analýzy. Dělení benzodiazepinů při izokratické eluci nebylo možné – docházelo totiž k retenci většiny analytů v čase 0,5 minuty, což nás vedlo k testování gradientové eluce. Maximální dělící účinnosti za současně přijatelné doby analýzy (6 minut) jsme dosáhli při použití prudkého poklesu podílu složky B na 10% obj. (již v 0,1 minutě chromatografického běhu) a následného jejího téměř čtyřminutového růstu k podílu 90% obj. To zaručilo rozseparování podstatné většiny analyzovaných složek a stabilitu jejich retenčních charakteristik (Obr. 2), což je samozřejmě nutné k identifikaci nálezů v neznámém vzorku. Odchylka retenčního času u všech analytů nebyla větší než 0,05 minuty, ve srovnání s analýzou složek v testovací směsi.
Obr. 2. Reprezentativní chromatogram analýzy 17 benzodiazepinů a metabolitů pomocí LC – MS/MS v moči. 
Hmotnostně spektrometrická detekce byla optimalizována pro každou složku zvlášť pomocí přímého nástřiku do iontového zdroje. Pro každou látku byly vybrány dva nejintenzivnější fragmentové ionty a byly vytvořeny stabilní SRM přechody (Tab. 2). Poměr intenzit těchto SRM přechodů, srovnaných s testovací směsí opět pomáhá při identifikaci nálezu v neznámém vzorku. Dvojce SRM pro analyt byla snímána v 60 sekundovém detekčním okně (retenční čas ± 30s), čímž se podstatně zvýšila citlivost metody. Díky tomuto způsobu MS/MS analýzy jsme dosáhli velmi nízkých limitů detekce, které většinou dosahovaly na úroveň 1 ng/ml (clonazepam, nitrazepam, flunitrazepam: 5 ng/ml).
Extrakční metoda
Při optimalizaci extrakční metody jsme vycházeli se známých skutečností o metabolizaci léčiv (4,2) a také ze znalostí předchozích metod pro analýzu benzodiazepinů v biologickém materiálu (13,15,10,6,8,4). Extrakce provedená z alkalického prostředí byla určena především pro získání redukovaných metabolitů a původních forem benzodiazepinů (Obr. 1.). Během optimalizace jsme testovali několik obvyklých alkalizačních činidel (TRIS, uhličitan sodný a borátový pufr) a extrakčních činidel (TBME, diethyleter a toluen). Optimálního výsledku, zaručující nejvyšší výtěžnost jsme dosáhli při použití borátového pufru pro alkalizaci a TBME pro extrakci.
Během optimalizace kyselé hydrolýzy jsme zkoušeli jak HCl tak mnohem slabší kyselinu octovou. Ukázalo se, že kyselina octová je schopna také vytvořit podmínky pro vznik benzofenonů, bohužel však s mnohem menším výtěžkem oproti HCl (přibližně 30% ve srovnání s HCl). Dále jsme testovali i potřebné množství kyseliny k provedení hydrolýzy. Nižší množství HCl (<0,8 ml) způsobilo nižší výtěžnost, zatímco vyšší množství kyseliny(>1ml) nepřineslo žádné zlepšení a naopak mělo za následek větší spotřebu chemikálií pro následnou neutralizaci směsi. Pro nejúčinnější extrakci produktů hydrolýzy z neutrálního nebo slabě alkalického prostředí jsme použili TBME.
Enzymatická hydrolýza, popsaná v několika pracích (13,16), byla rovněž testována. Porovnáním vlastní práce a literatury jsme došli k jednoznačnému zdůvodnění, proč není nutné enzymovou hydrolýzu zařazovat do extrakčního schématu pro LC–MS/MS analýzu. Průkaz požití alprazolamu pomocí GC/MS je založen především na průkazu hydroxymetabolitu, jehož derivatizace znásobí citlivost detektoru a sníží tak limit detekce. Naopak samotný alprazolam nelze derivatizovat a tudíž citlivost takové metody mnohdy nepokryje požadovanou úroveň. Naproti tomu při použití LC–MS/MS lze jednoduše prokázat mateřskou látku, jejíž izolace nevyžaduje předřazenou enzymatickou hydrolýzu. Obdobně je tomu i v případě midazolamu. Více je k tomuto tématu věnováno v dalším textu.
Poznámky k interpretaci nálezů
V následujícím textu je shrnuto několik okomentovaných příkladů, které byly posbírány během téměř ročního provozu popisované metody. Analýzy byly navíc po dobu 4 měsíců paralelně prováděny pomocí GC/MS, TLC a jiných modifikovaných LC–MS/MS metod, určených běžně pro kvantifikaci jednotlivých benzodiazepinů v séru.
Při interpetaci nálezů respektive pro vyslovení pozitivity lze na úvod sdělit tři jednoduchá pravidla:
- Je vždy nutné uvažovat nález jako celek a hledat souvislosti. Například nález samotného clonazepamu bez přítomnosti RC vzbuzuje velkou pochybnost, neboť pouze 0,5% léčiva se vylučuje jako mateřská látka, daleko větší část jako metabolity (17,18). Je třeba se tedy ptát, zda – li nedošlo například ke kontaminaci vzorku nebo k „carry over“ z předchozího stanovení clonazepamu. Benzodiazepiny podléhají v I. fázi biotransformace přeměně katalyzované enzymem 3A4 cytochromu P450, o kterém je známo, že může být relativně snadno inhibován nebo indukován velkou řadou konkomitantně podávaných léčiv. Při nálezu neobvyklého poměru mezi jednotlivými analyty je proto také vhodné pátrat v komedikaci pacienta po možných induktorech nebo inhibitorech metabolizmu.
- Je vždy nutné před neznámým vzorkem analyzovat testovací směs pro porovnání retenčních časů.
- Testovací směs kromě retenčních časů poskytne informace o poměru intenzit SRM přechodů. Často se totiž stává, že v hydrolyzátu vznikají artefakty, které mohou interferovat s analytem s totožným SRM. Pokud je navíc i totožný retenční čas artefaktu a analytu, může to pochopitelně vyvolat dojem přítomnosti určité látky v analyzovaném vzorku. Ovšem, při následném porovnání poměru intenzit SRM přechodů, je taková domněnka s jistotou vyloučena.
Příklady nálezů v toxikologické praxi
Spolehlivost metody je demonstrována na šesti případech (Obr. 3), které byly vyšetřovány na přítomnost benzodiazepinů v moči. Analýze LC-MS/MS bylo vždy předřazeno imunochemické testování na přítomnost benzodiazepinů, které ve všech případech poukazovalo na suspektní záchyt. Navíc byl výsledek ověřen jinými analytickými metodami (viz. Poznámky k interpretaci nálezů).
Nález benzofenonů ACB a MACB spolu s diazepamem a nordiazepamem (Obr. 3a) poukazuje na pravděpodobné požití diazepamu. Jak již bylo uvedeno, samotný diazepam může vznikat transformací například medazepamu nebo tetrazepamu, na což je samozřejmě nutné vždy pamatovat. Z poměru intenzit peaků clonazepamu a RC (Obr. 3b) je evidentní intenzivní metabolizace mateřské látky. Opačný poměr lze pozorovat v případě tetrazepamu (Obr. 3c). Vzhledem minoritě metabolitu a nepřítomnosti diazepamu (viz. Úvod), lze ovšem usoudit, že odběr byl proveden brzy po požití. Chromatogram extraktu moče odebrané pacientovy intoxikovanému midazolamem a bromazepamem je vyobrazen na Obrázku 3d. Poslední dvojici ukázek tvoří záznam chromatogramu extraktu z moče zdravého dobrovolníka (odběr po 8 hodinách), který požil 0,25 mg alprazolamu (nejnižší dávkování na trhu). Vzorek byl zpracován jak enzymatickou hydrolýzou (modifikace postupu Balíkové (13), Obr. 3d), tak i pomocí našeho postupu (Obr. 3e). Hydroxyalprazolam byl v obou případech pouze těsně nad limitem detekce.
Obr. 3. Příklady SRM chromatogramů, získaných analýzou neznámých vzorků: charakteristické benzofenony ACB a MACB s minoritním nálezem diazepamu s metabolitem (A), clonazepam s metabolitem (B), tetrazepam s metabolitem (C), kombinovaný nález metabolitu midazolamu a ABP (D) a nález alprazolamu získaný analýzou moče odebrané po 8 hodinách zdravému dobrovolníkovi po požití 0,25 mg alprazolamu zpracovaný enzymatickou hydrolýzou (E) i kyselou hydrolýzou (F). 
ZÁVĚR
Uvedená metoda využívající spojení kapalinové chromatografie a tandemové hmotnostní detekce s předřazenou dvojfázovou extrakcí z moče dovoluje prokázat benzodiazepiny nebo jejich metabolity různých typů. Postup se ukázal jako velmi pokrokový a stal se rutinním pro vyšetření benzodiazepinů v moči v rámci systematické toxikologické analýzy. Popisem metody jsme chtěli nastínit směr, kterým by se měla ubírat analýza stále velmi frekventovaných benzodiazepinů.
Adresa pro korespondenci:
Ing. Lukáš Chytil
Ústav soudního lékařství a toxikologie 1. LF UK a VFN
Ke Karlovu 2
Praha 2
128 00
tel: 224967196
fax: 2249611267
e-mail: lukas.chytil@lf1.cuni.cz
Sources
1. Lincová D, Farghali H. Základní a aplikovaná farmakologie. Praha: Galén; 2002.
2. Večerková J. Biotransformace léčiv a její význam pro toxikologickou praxi. Praha: Nakladatelství Univerzity Karlovy; 1997.
3. Balíková M. Forenzní a klinická toxikologie - laboratorní toxikologická vyšetření. Praha: Galén; 2004.
4. Schütz H. Dünnschichtchromatographische suchanalyse für 1,4 - benzodiazepine in harn, blut und mageninhalt. Weinheim: VCH – Verlagsgesellschaft; 1986.
5. Dawson GW, Jue SG, Brogden RN. Alprazolam: A review of its pharmacodynamic properties and efficacy in the treatment of anxiety and depression. Drugs 1984; 27 : 132-147.
6. Joern WA, Joern AB. Detection of alprazolam (Xanax) and its metabolites in urine using dual capillary column, dual nitrogen detector gas chromatography. Journal of analytical toxicology 1987; 11 : 247-251.
7. Reves JG, Fragen RJ, Vinik HR, Greenblatt DJ. Midazolam: Pharmacology and uses. Anesthesiology 1985; 62 : 310-324.
8. Maurer H, Pfleger K. Identification and differentiation of benzodiazepines and their metabolites in urine by computerized gas chromatography-mass spectrometry. J Chromatogr 1987; 422 : 85-101.
9. Schutz H, Ebel S, Fitz H. Screening and detection of tetrazepam and its major metabolites. Arzneimittel-Forschung 1985; 35 : 1015-1024.
10. Cardenas S, Gallego M, Valcarcel M. Gas chromatographic-mass spectrometric confirmation of selected benzophenones from benzodiazepines in human urine following automatic screening. Journal of chromatography 1998; 823 : 389-399.
11. Negrusz A, Bowen AM, Moore CM, Dowd SM, Strong MJ, Janicak PG. Elimination of 7-aminoclonazepam in urine after a single dose of clonazepam. Analytical and bioanalytical chemistry 2003; 376 : 1198-1204.
12. Hackett J, Elian AA. Extraction and analysis of flunitrazepam/7-aminoflunitrazepam in blood and urine by lc-pda and gc-ms using butyl spe columns. Forensic science international 2006; 157 : 156-162.
13. Balíkova M, Marešová V, Večerková J. Sensitivity of GC-MS in the detection of benzodiazepines in the urine in the form of trimethylsilyl derivatives. Soudní lékařství / Časopis Sekce soudního lékařství Čs. lékařské společnosti J Ev 1999; 44 : 34-42.
14. Ha HR, Rentsch KM, Kneer J, Vonderschmitt DJ: Determination of midazolam and its alpha-hydroxy metabolite in human plasma and urine by high-performance liquid chromatography. Therapeutic drug monitoring 1993; 15 : 338-343.
15. Večerková J. Systematic analytic procedure for identification of unknown medicaments in biological material. Sborník lékařský 1994; 95 : 357-361.
16. Meatherall R. Optimal enzymatic hydrolysis of urinary benzodiazepine conjugates. Journal of analytical toxicology 1994; 18 : 382-384.
17. Kaplan SA, Alexander K, Jack ML et al. Pharmacokinetic profiles of clonazepam in dog and humans and of flunitrazepam in dog. Journal of pharmaceutical sciences 1974; 63 : 527-532.
18. Eschenhof E. Studies on the disposition of the anticonvulsant clonazepam in the organisms of rat, dog, and man). Arzneimittel-Forschung 1973; 23 : 390-400.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inForensic Medicine

2011 Issue 1-
All articles in this issue
- Atypické strelné poranenie maxilofaciálnej oblasti
- Průkaz benzodiazepinů v moči pomocí kapalinové chromatografie s tandemovou hmotnostní detekcí
- Případ utopení pod vlivem brotizolamu, flunitrazepamu a etanolu
- Interdisciplinárna spolupráca súdneho lekárstva, klinickej medicíny a paleozoológie: Prípad kostí jaskynného medveďa (Ursus spelaeus)
- Forensic Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Průkaz benzodiazepinů v moči pomocí kapalinové chromatografie s tandemovou hmotnostní detekcí
- Atypické strelné poranenie maxilofaciálnej oblasti
- Případ utopení pod vlivem brotizolamu, flunitrazepamu a etanolu
- Interdisciplinárna spolupráca súdneho lekárstva, klinickej medicíny a paleozoológie: Prípad kostí jaskynného medveďa (Ursus spelaeus)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career