-
Medical journals
- Career
Přehled základních epidemiologických charakteristik a deskriptivní analýza výskytu humánní yersiniózy v České republice v letech 2018–2020
Authors: M. Špačková 1; O. Daniel 2,3; P. Klimešová 2; Z. Ileninová 2
Authors‘ workplace: Oddělení epidemiologie infekčních nemocí, Centrum epidemiologie a mikrobiologie, Státní zdravotní ústav Praha 1; Oddělení stafylokokových a alimentárních bakteriálních infekcí, Centrum epidemiologie a mikrobiologie, Státní zdravotní ústav Praha 2; Univerzita Karlova, 2. lékařská fakulta, Praha 3
Published in: Epidemiol. Mikrobiol. Imunol. 71, 2022, č. 1, s. 32-39
Category: Original Papers
Overview
Cíl práce: Cílem naší práce bylo podat přehled základních epidemiologických charakteristik humánní yersiniózy a analyzovat hlášená epidemiologická data výskytu tohoto onemocnění v České republice v letech 2018–2020.
Metody: Byla provedena deskriptivní analýza yersinióz zaznamenaných v rámci systému pro hlášení infekčních onemocnění (ISIN) v České republice (ČR) v letech 2018–2020. Pro zpracování a třídění dat byl použit program MS Excel 2010.
Výsledky: V České republice bylo v letech 2018–2020 hlášeno celkem 1 686 případů humánní yersiniózy (průměrná roční incidence 5/100 000 obyvatel). Nejvyšší průměrná věkově specifická incidence byla zaznamenána ve věkové skupině 1–4 roky (31,3 /100 000 obyv.) a potom u 0letých (26,9 /100 000 obyvatel). Podle pohlaví bylo ve sledovaném období detekováno celkem 942 případů u mužů a 744 u žen, incidence 6,0/100 000 obyvatel a 4,6/100 000 obyvatel. Podle krajů byla nejvyšší průměrná roční incidence v letech 2018–2020 zaznamenána v krajích Jihomoravském (9,1/100 000 obyvatel) a Moravskoslezském (7,5/100 000 obyvatel). Hospitalizováno bylo 14,3 % (n = 241) hlášených případů. Úmrtí nebylo zaznamenáno. Epidemie nebyly v tomto období hlášeny. Importováno bylo celkem 31 případů z obvyklých rekreačních destinací. Sezonnost nebyla v ČR zjištěna, nicméně více případů se objevuje vždy v lednu a v druhé polovině roku. V posledních 3 letech pozorujeme v ČR stagnující trend onemocnění.
Závěry: V letech 2018 a 2019 byla yersinióza (způsobená Y. enterocolitica a Y. pseudotuberculosis) čtvrtou nejčastěji hlášenou zoonózou u lidí v Evropské unii se stabilním trendem v letech 2014–2019. Česká republika hlásí až trojnásobnou incidenci, avšak 2,5krát nižší podíl hospitalizovaných oproti průměru zemí Evropské unie, což pravděpodobně ukazuje na kvalitní systém surveillance v ČR. Trend výskytu onemocnění v posledních letech v České republice i Evropské unii stagnuje. Nejčastějším vehikulem přenosu yersiniózy na člověka jsou kontaminované potraviny, zejména nedostatečně tepelně opracované vepřové maso, méně často zelenina či voda. Kontaminace zabíjačkových výrobků z domácích porážek je pravděpodobná, a také by vysvětlovala zvýšený výskyt onemocnění zejména v zimních měsících.
Klíčová slova:
Česká republika – alimentární infekce – infekce přenášené vodou a potravinami – Yersinia enterocolitica – Y. pseudotuberculosis – yersinióza – průjmová onemocnění
ÚVOD
Yersinióza je významné alimentární onemocnění lidí, zejména dětí [1–3]. Je čtvrtou nejčastěji hlášenou zoonózou v Evropě po salmonelóze, kampylobakterióze a infekcích způsobených Shiga toxin-produkujícími E. coli. Hlavním původcem humánních yersinióz je Yersinia enterocolitica, méně často Y. pseudotuberculosis [3, 4].
Rod Yersinia prošel v posledních letech několika taxonomickými změnami: byl zařazen do nové čeledi Yersiniaceae, řád Enterobacterales [5] a na základě celogenomové sekvenace bylo vytvořeno 6 nových druhů [6]. V současnosti (září 2021) tak rod Yersinia zahrnuje 26 druhů [7], z nichž pro člověka jsou klinicky významné 3 druhy: Y. enterocolitica a Y. pseudotuberculosis jako původci yersiniózy a Y. pestis způsobující dýmějový, septický a plicní mor. Rod Yersinia zahrnuje například také druh Y. aldovae, pojmenovaný podle významné české mikrobioložky Evy Aldové (1922–2018).
Morfologicky jsou yersinie podobné zástupcům čeledi Enterobacteriaceae. Jedná se o krátké, gramnegativní, nesporulující tyčky až kokotyčky, z nichž některé tvoří pouzdra [8]. Většina kmenů je pohyblivá a více biochemicky aktivní při kultivační teplotě 25–30 °C, při kultivační teplotě 37 °C mohou yersinie pohyblivost i biochemické a sérologické vlastnosti ztrácet [6, 9]. Na rozdíl od zástupců čeledi Enterobacteriaceae jsou yersinie psychrotolerantní a rostou v širokém teplotním rozmezí 0–45 °C [10]. Prospívají a množí se i při teplotě kolem 4 °C a jsou schopny přežívat i více než rok ve zmrzlé nebo ledové vodě [11]. Optimálně však rostou při teplotě 28–29 °C, čehož lze využít v laboratorní diagnostice. Pro růst Y. enterocolitica aY. pseudotuberculosis je optimální pH 7,6 (avšak mohou růst v rozmezí pH 4−10). Oba druhy jsou ničeny pasterizací [12].
Y. enterocolitica i Y. pseudotuberculosis jsou závažnými patogeny pro člověka. Oba druhy produkují celou řadu faktorů virulence, které zprostředkovávají bakteriální adhezi, invazi, kolonizaci hostitelských buněk a schopnost jejich přežití v těle hostitele [1]. Hlavním původcem yersiniózy lidí je druh Y. enterocolitica, který přestavuje heterogenní skupinu kmenů. Na základě biochemických a genetických vlastností jsou tyto kmeny klasifikovány do šesti biotypů (1A, 1B, 2, 3, 4, 5), více než 70 sérotypů [13] a 2 subtypů (Y. enterocolitica subsp. enterocolitica a subsp. palearctica) [14]. Sérologicky se kmeny liší podle geografické oblasti: sérotypy O:3 a O:9 převládají v Evropě, sérotyp O:8 byl dlouhodobě dominantní v USA, sérotypy O:5 a O:7 převládaly v Japonsku a Kanadě [15]. V současnosti se sérotyp O:3 stává dominantním v Severní Americe i v ostatních částech světa [8], zatímco sérotyp O:8 původně nazývaný „Americký kmen“ v posledních letech dramaticky stoupá v Polsku [16].
Y. pseudotuberculosis je vzácnějším původcem humánní yersiniózy. V Americe i v Evropě je uveden tento původce u 1 % ze všech hlášených yersinióz. Je nejčastější patogenní yersinií izolovanou od zvířat [17].
Y. enterocolitica i Y. pseudotuberculosis jsou hojně rozšířené v přírodním prostředí (půda, voda) a v gastrointestinálním traktu řady živočichů. Významným reservoáremY. enterocolitica jsou prasata domácí, která jsou v Evropě často asymptomatickými nosiči biotypu 4 (sérotyp O:3) a biotypu 2 (sérotypu O:9 a O:5,27) [3, 18, 19]. Dalšími rezervoáry jsou pak nejčastěji hlodavci, zajíci, psy a kočky [20], ale také drůbež, hovězí dobytek, ovce, kozy, koně, a volně žijící zvířata [17, 21]. Hlavním rezervoárem Y. pseudotuberculosis jsou hlodavci, zajíci, jeleni a ptáci, kteří mohou být asymptomatickými nosiči, dále mohou být zdrojem infekce také psi, kočky, prasata, kozy, ovce, hovězí dobytek a drůbež [17, 20].
K nákaze dochází fekálně-orální cestou, a to zejména nepřímo kontaminovanými potravinami nebo vodou, případně přímým kontaktem s infikovanými zvířaty. Spektrum rizikových potravin je široké: kromě syrového či nedostatečně tepelně opracovaného vepřového masa a výrobků z něj sem patří maso jehněčí, kozí, hovězí, kuřecí, nepasterizované mléko, mléčné výrobky, ryby, mořské plody, tofu a zelenina [20, 22]. Ke kontaminaci masa a dalších masných produktů dochází během porážky a při následném zpracování masa z nakažených zvířat. Veterinární prohlídka před porážkou a po ní nemusí přítomnost enteropatogenních yersinií odhalit [23]. Yersinie se mohou pomnožit v chladu během skladování. V případě Y. pseudotuberculosis je za rizikovou pro přenos nejčastěji uváděna kontaminovaná zelenina [1]. Popsané byly také nozokomiální infekce [24]. Ojediněle byl zaznamenán přenos infekce krevní transfuzí, s následnou vysokou mortalitou [25, 26]. Důvodem těchto přenosů je nedetekované malé množství yersinií v krvi asymptomatického dárce, které se může pomnožit při delším uskladnění krve při chladničkové teplotě [8].
Infekční dávka je udávána 108–109 bakterií; inkubační doba v rozmezí 1–11 dní v případěY. enterocolitica, v případě Y. pseudotuberculosis až 21 dní [8]. Po ingesci se bakterie ve střevě vážou na M-buňky Peyerových plátů, kde se množí, mohou tvořit mikroabscesy, destruovat lymfatickou tkáň nebo se dále šířit do mezenteriálních lymfatických uzlin a dalších orgánů [8]. Hlavními projevy yersiniózy jsou akutní gastroenteritida, terminální ileitida a mezenteriální lymfadenitida. Tyto projevy mohou být doprovázeny horečkou a bolestí břicha imitující apendicitidu [8]. Infekce postihuje všechny věkové skupiny, avšak v případě onemocnění způsobenéY. enterocolitica jsou klinické příznaky daleko výraznější u dětí. Typický je vodnatý průjem, který může být až krvavý a bývá doprovázen zvracením a horečkou. V případě onemocnění způsobeného Y. pseudotuberculosis průjem často zcela chybí a klinické projevy nejsou věkově limitovány [2]. Tyto infekce mívají závažnější průběh, o kterém svědčí delší doba hospitalizace, častější záchyt v invazivně odebraných vzorcích a vyšší smrtnost [2]. U imunokompetentních jedinců onemocnění většinou spontánně odezní. U imunokompromitovaných osob může dojít k bakteriemii se vznikem sekundárních ložisek zánětu (faryngitidy, pneumonie, osteomyelitidy, empyémy aj.). V těchto případech je vhodné nastavit antibiotickou terapii podle citlivosti. Predispozičními faktory pro závažný průběh infekce jsou diabetes mellitus, cirhóza jater, hemochromatóza a nádorové onemocnění [27]. Mezi možné pozdní následky infekce patří reaktivní artritida a erythema nodosum; tyto mohou přetrvávat i několik měsíců po infekci [8].
Detekce yersinií z klinických vzorků probíhá v mikrobiologických laboratořích standardními kultivačními metodami. Vhodným materiálem je (v závislosti na průběhu onemocnění) stolice, krev, nebo lymfatické uzliny či jiný intraoperačně získaný biologický materiál [20]. Yersinie rostou na většině běžných médií inkubovaných při teplotě 25–37 °C po dobu 24–48 hodin. Pro identifikaci yersinií a jejich následné zařazení do biotypů je používána řada biochemických testů. Dobrou senzitivitu a specificitu při teplotě 25–28 °C vykazuje např. kombinované použití API20E a API50CH testů (bioMérieux) [6]. Hmotnostní spektrometrie MALDI-TOF je rovněž rychlou a spolehlivou metodou pro identifikaci rodu, méně pak druhu yersinií [28]. Některé nově popsané druhy však nelze kvůli jejich blízké genetické příbuznosti těmito metodami odlišit a pro jejich jednoznačnou identifikaci je nutné využít sekvenačních metod [6]. V poslední době je však stále častěji prezentován názor upustit od biotypizace yersinií, zejména z důvodu náročnosti provedení a nejasnosti závěru s ohledem na patogenitu kmene. Konvenční sérotypizace je prováděna sklíčkovou aglutinací čerstvé kultury s O-antigenními specifickými antiséry. V posledních letech je vyvíjena snaha nahradit konvenční metody molekulárními: např. pomocí multiplexní PCR je možné určit sérotyp společně s různými faktory virulence [29]. Právě molekulární metody se ukazují jako nezbytné k určení míry patogenity analyzovaných kmenů yersinií, a to na základě průkazu genů kódujících různé faktory virulence. Další možností je využití metod celogenomové sekvenace, které kromě podrobné typizace kmenů umožňují také srovnání genetické podobnosti/příbuznosti kmenů v případě suspektních epidemií. Široké používání těchto nových metod doporučuje i Evropské středisko pro prevenci a kontrolu nemocí (European Centre for Disease Prevention and Control, ECDC), vzhledem k možnosti cíleného šetření přímých souvislostí mezi záchyty z humánních případů, veterinárních případů a záchyty z potravin [3]. Kromě přímého průkazu yersinií je v rámci diagnostiky yersiniózy možné sérologické vyšetření protilátek, které se objevují v průběhu prvního týdne onemocnění a přetrvávají cca 3–6 měsíců. Specificita tohoto vyšetření se pohybuje okolo 82–95 %, z důvodu možné zkřížené reakce s některými zástupci čeledi Enterobacteriaceae, případně dalšími patogenními rody jako Brucella, Borrelia, Vibrio a Chlamydia [20].
Při podezření a zjištění každého jednotlivého případu humánní yersiniózy v ČR existuje povinnost tento nahlásit v rámci systému epidemiologické bdělosti podle zákona č. 258/2000 Sb., o ochraně veřejného zdraví, a vyhlášky č. 473/2008 Sb., o systému epidemiologické bdělosti pro vybrané infekce. Pro ČR jsou dále závazné předpisy EU a Světové zdravotnické organizace. Zpravodajskou jednotkou je každý lékař (zdravotnické zařízení), který zjistil infekční onemocnění podléhající hlášení. Hlásí se potvrzené onemocnění, podezření z onemocnění, nosičství, úmrtí. Jednotlivé případy jsou statisticky sledovány podle MKN-10. Účelem zjišťování je získávání informací o výskytu infekčních onemocnění k posouzení vývoje epidemiologické situace na území ČR, ke sledování zdravotního stavu obyvatelstva a k řízení poskytovaní zdravotní péče.
METODY
Byla provedena deskriptivní analýza případů humánní yersiniózy hlášených v rámci systému pro hlášení infekčních onemocnění (ISIN) v ČR v letech 2018–2020. Povinnost hlášení infekčních onemocnění v ČR je dána zákonem č. 258/2000 Sb., o ochraně veřejného zdraví, ve znění pozdějších předpisů, v souladu s vyhláškou č. 473/2008 Sb., o systému epidemiologické bdělosti pro vybrané infekce. Hodnocena byla diagnóza „A04.6 Enterokolitida, původce Y. enterocolitica“ (podle Mezinárodní klasifikace nemocí a přidružených zdravotních problémů,10. revize). V rámci této diagnózy byly analyzovány základní epidemiologické charakteristiky: pohlaví, věk, kraj, hospitalizace, sezonnost a úmrtí. Případy infekce Y. pseudotuberculosis jsou vykazovány pod diagnózou „A04.8 Jiná určená bakteriální střevní infekce“. Případy extraintestinálních yersinióz jsou vykazovány pod diagnózou „A28.2“. Tyto diagnózy jsou uvedeny ve výsledcích samostatně.
Systém pro hlášení infekčních onemocnění v ČR (ISIN) není primárně určen k vykazování úmrtnosti a zadání těchto informací v rámci epidemiologických surveillance systémů nemusí být kompletní. Data o úmrtí osob, která byla v rámci tohoto systému zaznamenána, byla analyzována s vědomím, že výsledky nebudou zcela odpovídat situaci (smrtnosti na dané onemocnění) v populaci. Za sporadické případy a rodinné výskyty byly považovány ty, které nebyly v ISINu označeny jako epidemie. Data byla zpracována v MS Excel 2010. Incidence onemocnění byla přepočítána na 100 000 obyvatel středního stavu obyvatelstva ČR podle odhadu stavu obyvatelstva Českého statistického úřadu vždy k 1. červenci daného roku.
VÝSLEDKY
V ČR bylo v letech 2018–2020 zaznamenáno celkem 1 686 případů humánní yersiniózy, v roce 2018 – 634 případů, v roce 2019 – 616 případů a v roce 2020 – 436 případů (incidence 6,0; 5,8 a 4,1 na 100 000 obyvatel) – obr. 1. Podle věkových skupin byl největší počet případů zaznamenán ve věkové skupině 1–4 roky (n = 425) a ve věkových skupinách 5–9 let (n = 239) a 25–34 let (n = 210), nicméně incidence podle věkových skupin byla nejvyšší ve věkové skupině 1–4 roky (31,3/100 000 obyv.) a ve skupině 0letých (26,9/100 000 obyv.) – obr. 2. Podle krajů bylo za sledované tříleté období nejvíce případů hlášeno v kraji Jihomoravském (n = 325, incidence 9,1/100 000 obyvatel) a v kraji Moravskoslezském (n = 271, incidence 7,5/100 000 obyvatel). Nejméně případů bylo hlášeno v kraji Karlovarském (n = 15, incidence 1,7/100 000 obyvatel) – obr. 3. Podle pohlaví bylo ve sledovaném období detekováno celkem 942 případů u mužů a 744 u žen, incidence 6,0/100 000 obyvatel a 4,6/100 000 obyvatel. Hospitalizováno bylo 14,3 % hlášených případů (n = 241). Úmrtí nebylo zaznamenáno. Epidemie nebyly hlášeny. Souvislost nebyla zjištěna nebo zjišťována v 1619 případech, v 55 případech byla uvedena souvislost onemocnění s rodinou, přáteli, kolektivem nebo sousedy, v ostatních případech nebyl údaj uveden. Podle zaměstnání nejčastěji onemocněli děti (věk 0–14 let, n = 588), žáci a studenti (věk 5–26 let, n = 506), jiné povolání (věk 1–74 let, n = 367) a starobní důchodci (60–93 let, n = 60). Import byl zaznamenán ve 31 případech: z Belgie (1), Bosny a Hercegoviny (1), Egypta (2), Chorvatska (4), Itálie (3), Kuby (4), Libanonu (1), Maďarska (1), Nizozemska (1), Polska (1), Rumunska (2), Slovenska (1), USA (1), Srbska (1), Španělska (1), Thajska (2), Ukrajiny (3) a Spojeného království (1). Sezonnost humánní yersiniózy nebyla v ČR prokázána, více případů se objevuje vždy v lednu a v druhé polovině roku (viz obr. 1).
Image 1. Počet případů yersiniózy podle měsíce a roku hlášení v ČR v letech 2018–2020
Figure 1. Yersiniosis cases by month and year of reporting, CZ, 2018–2020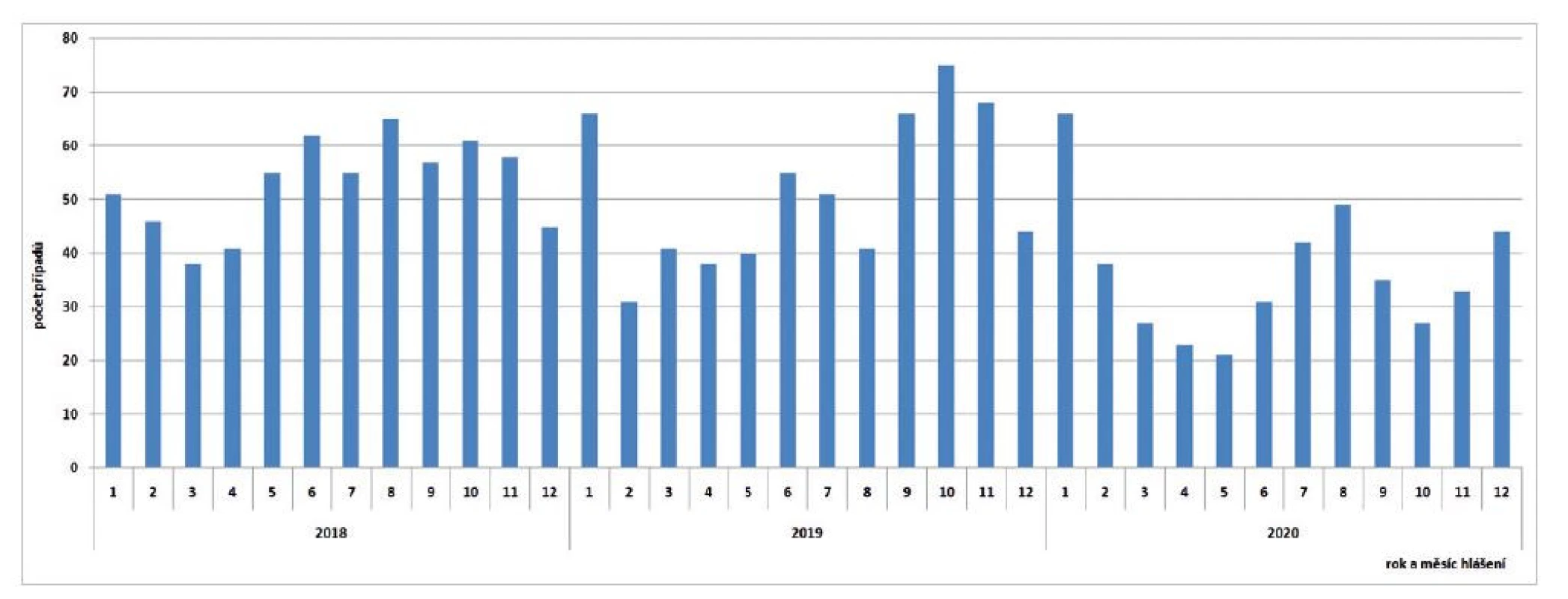
Image 2. Počet případů a incidence yersiniózy podle věkových skupin v ČR v letech 2018–2020
Figure 2. Yersiniosis cases and incidence by age group, CZ, 2018–2020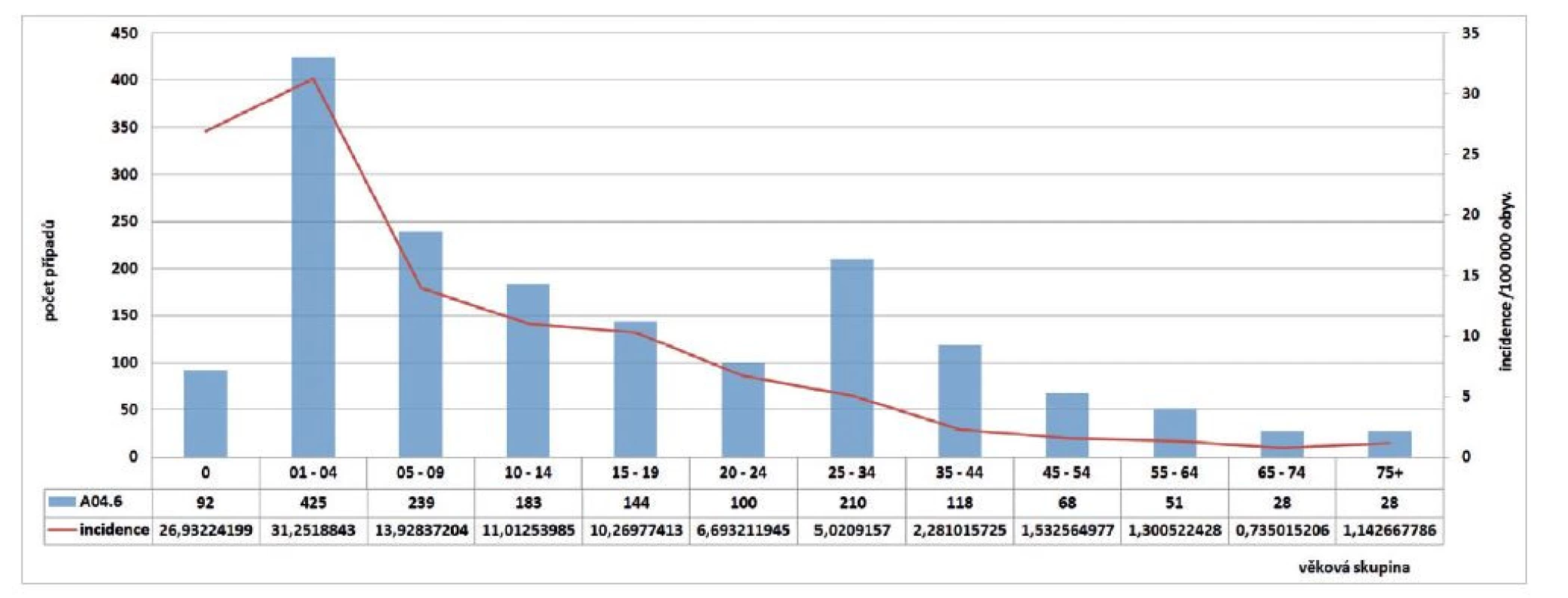
Image 3. Počet případů a incidence yersiniózy podle krajů a roku hlášení v ČR v letech 2018–2020
Figure 3. Yersiniosis cases and incidence by administrative region and year of reporting, CZ, 2018–2020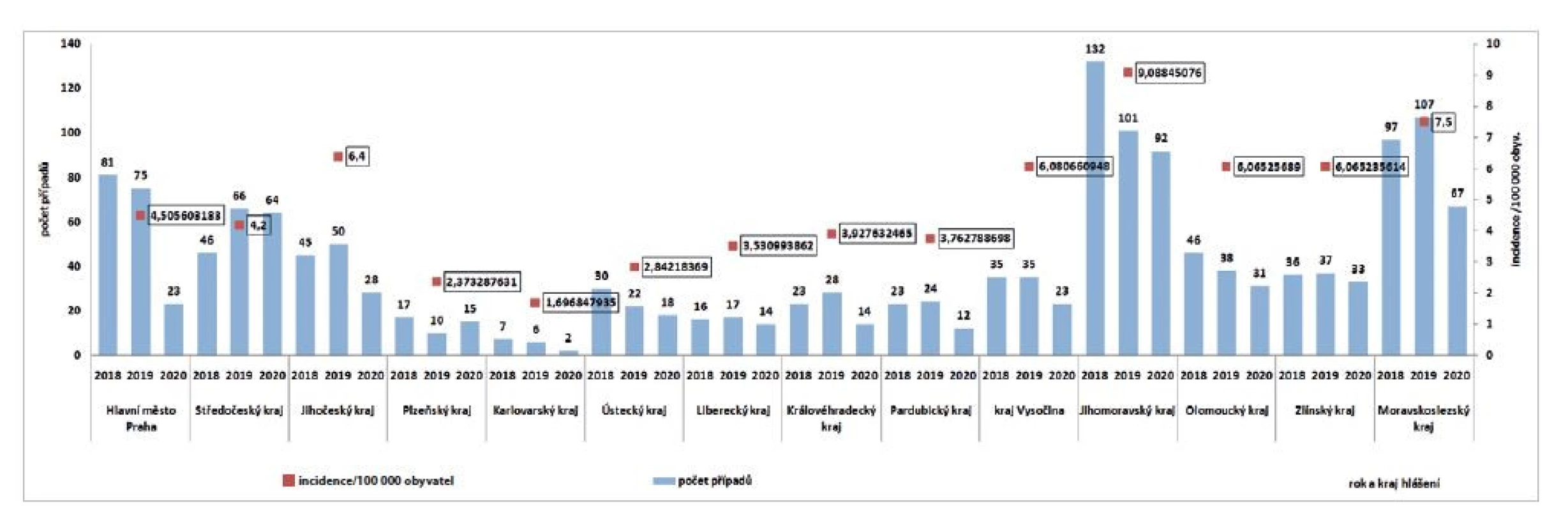
Ve sledovaném období byly v ISINu dále pod diagnózou A04.8 hlášeny dva případy Y. pseudotuberculosis. Jeden případ byl zjištěn v květnu roku 2019 u 55leté ženy z Ústí nad Orlicí. Tato žena pracuje v potravinářství a pro onemocnění byla hospitalizována. Druhý případ byl hlášen v červenci 2020 u 11letého chlapce z Trutnova, s infekcí byl izolován doma. Dále byl v ISINu zaznamenán jeden případ nespecifikované yersiniózy s hospitalizací v červenci 2020 u 84letého starobního důchodce z Prahy 5. Tyto případy nebyly importovány, nikdo z těchto lidí nezemřel.
Dále bylo v ISINu zaznamenáno 8 případů extra-intestinální yersiniózy pod diagnózou A28.2 : 3 po třech případech v letech 2018 a 2019 a dva případy v roce 2020. Jednalo se o 4 muže a 4 ženy, ve věkovém rozmezí 35 až 66 let (medián 57,5 roku). Čtyři zaznamenané případy (3 v roce 2019 a 1 v roce 2020) byly hlášeny územním pracovištěm Krajské hygienické stanice v Písku, po jednom pak z Prachatic, Frýdku-Místku, Zlína a Ústí nad Labem. Dvě osoby byly hospitalizovány, nikdo nezemřel. Ve čtyřech případech se jednalo o starobní důchodce, pouze dvakrát byl uveden pobyt v kolektivu, epidemiologická souvislost v žádném případě nebyla nebo nemohla být zjištěna. Rodinný výskyt nebyl zjištěn.
Informace o sérotypech kmenů izolovaných od pacientů v ČR jsou do ISINu hlášeny jen sporadicky, nejvyšší výskyt vykazuje sérotyp O3. Údaje o biotypizaci chybí úplně.
DISKUSE
Hlášení humánní yersiniózy je povinné ve 23 zemích Evropské unie/Evropského hospodářského prostoru (European Union, EU/European Economic Area, EEA), nepovinné je v Belgii, Francii, Řecku, Itálii a Lucembursku. Země Spojeného království mají jiný systém hlášení a v Nizozemí žádné hlášení yersinióz neexistuje. Země hlásí výskyt onemocnění celoplošně na národní úrovni, kromě Francie, Itálie a Španělska. Členské země v současné chvíli používají různé definice pro surveillance onemocnění, většina zemí nadále používá definici EU z roku 2012, zatímco 4 země používaly pro rok 2019 již definici z roku 2018, některé země (n = 6) používají definici ještě starší, z roku 2008 a některé používají jinou než EU definici. Je tudíž obtížné hlášená data srovnávat. Informace o detekovaném biotypu je u hlášených případů yersiniózy dostupná pouze v šesti členských zemích.
Podle posledních shrnutí ECDC bylo v letech 2018 a 2019 ve 29 zemích EU/EEA hlášeno celkem 6 806 a 7 048 potvrzených humánních případů yersiniózy, 53 a 54 % u mužů a 47 a 46 % u žen. Průměrná incidence byla 1,6 a 1,7/100 000 obyvatel [3, 30]. Nejvyšší incidence byla v obou letech zaznamenána ve Finsku, Litvě a ČR, a v roce 2018 také v Dánsku, a to zejména u dětí ve věku 0–4 let (23 % všech hlášených případů), s průměrnou genderově specifickou incidencí pro rok 2019 v této věkové skupině 7,2/100 000 u mužů a 5,9/100 000 u žen. Nejvyšší počty případů byly zaznamenány v Německu a Francii, což je vzhledem k velikosti zde žijící populace očekávané. V ČR byla v letech 2018–2020 zaznamenána průměrná roční incidence yersiniózy 5/100 000 obyvatel, což je třikrát vyšší výskyt onemocnění na stejný počet obyvatel, než je průměr hlášený za země EU. Vyšší výskyt je v ČR pozorován i pro jiná alimentární onemocnění, jako jsou např. salmonelóza (5krát vyšší nemocnost) nebo kampylobakterióza (4krát vyšší nemocnost než je průměr zemí EU). Výskyt některých dalších alimentárních onemocnění v ČR je však pod průměrem EU (například Shiga-toxin produkující E. coli, listeriózy), nelze tedy jednoduše vysvětlit tuto vyšší incidenci kvalitou hlášení v rámci aktivního systému surveillance těchto nákaz v ČR. Nicméně fakt, že je v ČR hlášen nižší podíl hospitalizovaných, by tuto hypotézu podpořil. Z případů, u kterých byl údaj k dispozici, bylo v EU v roce 2018 a 2019 hospitalizováno celkem 29,3 a 34 % a smrtnost byla 0,08 a 0,05 %. V ČR bylo hospitalizováno 14,3 % (n = 241) všech hlášených případů a úmrtí nebylo zaznamenáno. Podíl hlášených hospitalizací velmi výrazně ukazuje na fakt, že v ČR systém surveillance zachycuje daleko častěji i případy u osob s mírnějším průběhem, tedy těch osob, které nemusely být a nebyly hospitalizovány, což se pravděpodobně v jiných zemích EU tolik neděje. Zdá se, že většina členských zemí EU hlásí s větší pravděpodobností pouze případy se závažnějším průběhem. Ostatní hypotézy pro vyšší výskyt onemocnění v porovnání s ostatními zeměmi EU, například změna klimatu, kvalitativně i kvantitativně nedostačující veterinární kontroly či zvýšená obliba konzumace vepřového masa, se jeví nepravděpodobné. Avšak vepřové maso patří mezi hlavní konzumované potravinové komodity v Čechách a při jeho kontaminaci by tato vysoká míra konzumace na výskyt humánní yersiniózy mohla mít významný vliv [31]. V zahraniční literatuře je pak popisován významný sezonní výskyt onemocnění, kdy incidence yersiniózy stoupá v chladnějších měsících roku [21], což by mohlo korelovat s obdobím domácích zabijaček, česká ani evropská hlášená data však výraznou sezonnost nevykazují. O něco více případů, než je měsíční průměr, bylo v zemích EU/EEA zachyceno v květnu, červenci a říjnu. V ČR byl vyšší výskyt zaznamenán také v lednu. Trend výskytu onemocnění zůstával v zemích EU/EEA v letech 2015–2019 stabilní (obr. 4).
Image 4. Distribuce potvrzených humánních případů yersiniózy v zemích EU/EEA v letech 2015–2019 (zdroj ECDC 2019)
Figure 4. Distribution of confirmed human yersiniosis cases by country, EU/EEA, 2015–2019 (source: ECDC 2019)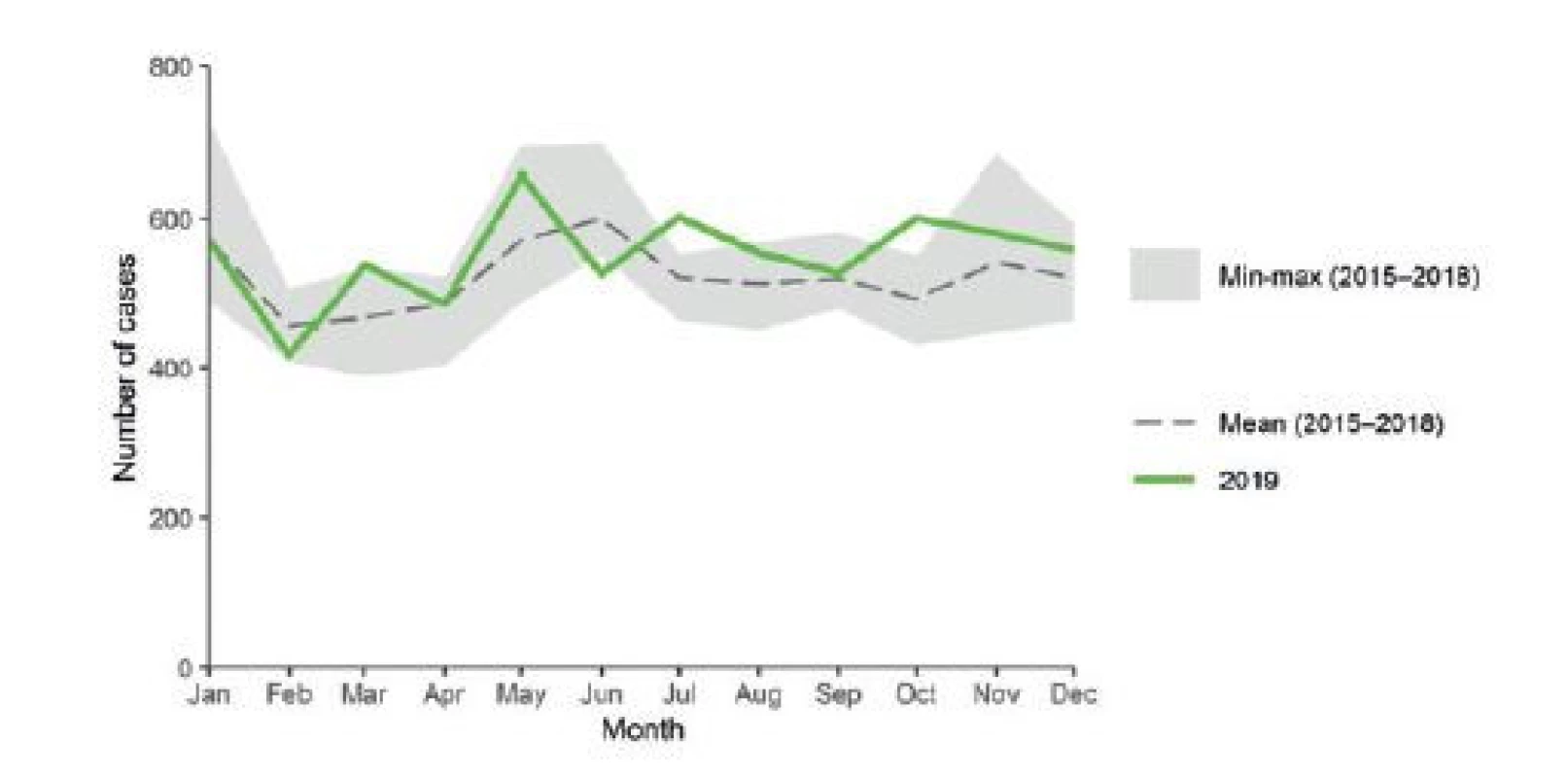
Průměrná věkově specifická incidence byla v ČR nejvyšší ve věkové skupině 1–4 roky (31,3/100 000 obyvatel) a potom u 0letých (26,9/100 000 obyvatel), podobně jako v EU, nicméně průměrná věkově specifická incidence zemí EU je pro věkovou skupinu 0–4letých 6,7/100 000 obyvatel [4], což je 4,5krát nižší incidence než incidence zjištěná v ČR. U mužů byla v Evropě i v ČR zjištěna o něco vyšší incidence onemocnění než u žen. Tento rozdíl však není významný.
Kontaminované potraviny jsou hlavním vehikulem přenosu infekce. Rizikové je především nedostatečně tepelně opracované vepřové maso [3, 18, 21, 32]. U prasat jsou yersinie lokalizovány v gastrointestinálním traktu včetně dutiny ústní. Ke kontaminaci masa může dojít při porážce a dále při bourání a zpracování masa, stahování. Ke zvýšenému riziku kontaminace masa yersiniemi přispívá fakt, že jejich rezervoáry jsou převážně zvířata bez klinických příznaků, v důsledku čehož nejsou makroskopickým vyšetřením jatečně upravených těl detekovány [33]. Technika porážky a hygienické podmínky mohou značně ovlivnit míru kontaminace masa během porážky zvířat. V provozovnách a prodejnách může při nedodržení správné hygienické praxe dojít ke zkřížené kontaminaci [34], a to zejména vzhledem k faktu, že yersinie přežívají a mohou se množit i v chladničkových teplotách [35, 36]. Diskutuje se o rizikovosti domácích zabijaček a jejich produktů (např. tlačenky). Rizikovými mohou být také další druhy masa (hovězí, jehněčí, kozí, kuřecí i ryby), nepasterizované mléko a výrobky z něj a rostlinné produkty (např. zelenina) kontaminované závlahovými vodami.
V roce 2019 šetřily Evropský úřad pro bezpečnost potravin (European Food Safety Authority, EFSA) spolu s ECDC 15 epidemií způsobených Y. enterocolitica čítajících celkem 149 případů [37], v roce 2018 to bylo 12 epidemií s celkem 58 případy [38]. Prostřednictvím Epidemického informačního systému ECDC byly ve stejném roce řešeny dvě mezinárodní epidemie Y. enterocolitica: Švédsko hlásilo 37 případů biosérotypu 4/O:3 v období únor až duben a Dánsko v březnu oznámilo 20 případů stejného biosérotypu. Celogenomovou analýzou byl v obou těchto epidemiích potvrzen genetický příbuzný kmen, přičemž za cestu přenosu infekce byl v rámci provedených epidemiologických studií označen čerstvý špenát [39]. Další šetření provádělo Norsko, které zjistilo 13 geneticky podobných případů sérotypu O:3 v období květen až červen, a Švédsko zjistilo dalších pět případů, které geneticky úzce souvisely s případy norskými. Společná expozice nebyla zjištěna. Stále častěji jsou epidemieY. enterocolitica i Y. pseudotuberculosis zjišťovány v souvislosti s konzumací syrové zeleniny, zejména kořenové zeleniny, která může být v chladu skladována i po dobu několika měsíců [3]. Yersinie byly ojediněle zjištěny také ve vakuově balených chlazených potravinách, ovoci, nepasterizovaných mléčných výrobcích, tofu a plodech moře [20, 40]. Je zřejmé, že vedle vepřového masa je i zelenina možnou cestou přenosu tohoto onemocnění. V ČR byla dosud jediná zaznamenaná epidemie yersiniózy zjištěna v roce 2012 [41]. Onemocnělo 62 osob (děti i zaměstnanci) Dětské psychiatrické léčebny Opařany, bez úmrtí. Vehikulem byla masová pomazánka připravená v místní kuchyni. Vzhledem k vysoké incidenci yersiniózy v ČR je možné, že výskyt dalších epidemií nebyl podchycen, a to z důvodu absence laboratorních dat (zejména z celogenomového sekvenování), kterými by kmeny mohly být vzájemně porovnány.
Pro kontrolu yersinií v potravinách existují konkrétní potravinářské normy, např. v únoru 2020 aktualizovaná ČSN EN ISO 10273 „Mikrobiologie potravinového řetězce – horizontální metoda průkazu patogenních Y. enterocolitica“. Tento dokument specifikuje horizontální metodu průkazu bakterie v potravinách, krmivech a ve vzorcích prostředí z míst výroby potravin a nakládání s nimi (www.agentura-cas.cz). Povinnost hlásit výskyt yersinií u zvířat ve většině zemí EU neexistuje [41], avšak rozšíření těchto bakterií v přírodním prostředí je v Čechách pravděpodobné [42, 43]. Také v Polsku bylo zjištěno, že vysoká zvěř je dalším, méně významným, potenciálním zdrojem infekce [44].
Sérotypizace je v ČR provedena jen zřídka a údaje v ISIN chybí. Údaje o biotypizaci v systému nejsou k dispozici vůbec, a to pravděpodobně z důvodu pracného a finančně nákladního provedení (nutno kombinovat vícero biochemických kitů, nebo použít dlouhou řadu konvenčních biochemických testů) a zároveň nejasné výpovědní hodnoty ohledně patogenity kmenů. Kmeny yersinií k bližšímu dourčení lze zaslat do Národní referenční laboratoře (NRL) pro E. coli a shigely Státního zdravotního ústavu v Praze, která se zabývá diagnostikou yersinií od roku 2011 (do té doby spadala problematika yersinií pod NRL pro yersinie pod vedením RNDr. E. Aldové). Ročně je takto do NRL zasláno k dourčení jenom kolem 5 % všech yersinií nahlášených do informačního systému ISIN, proto nelze z dat NRL vyvozovat statistické závěry. Ve Francii například, ačkoliv hlášení humánních yersinióz není povinné, všechny detekující laboratoře posílají své vzorky yersinií do národní referenční laboratoře k dourčení [17].
Podle Světové zdravotnické organizace je jednou z příčin šíření tohoto onemocnění u lidí nedostatečná prevence: nedostatečná informovanost na úrovni primární lékařské péče a rovněž veřejnosti o tom, jak správně dodržovat základní hygienická pravidla, především při manipulaci se syrovým masem [45]. Yersinie jsou ničeny pasterizací a při dostatečné tepelné úpravě pokrmů. V rámci prevence onemocnění probíhají kontroly u zvířat a dochází ke zlepšování technologie výroby. V domácnosti je nutné dodržovat základní hygienická pravidla; neomývat zakoupené maso pod tekoucí vodou (vzniká aerosol, který potřísní a kontaminuje okolní plochy a předměty); striktně oddělit kuchyňské pomůcky a nástroje pro práci se syrovým masem od ostatních, které jsou určeny ke zpracování pokrmů pro přímou konzumaci; časté mytí rukou teplou vodou a mýdlem (zejména před jídlem a přípravou pokrmů, po kontaktu se zvířaty, po manipulaci se syrovým masem a také před kontaktem s kojenci nebo jejich hračkami), dezinfekce rukou a pracovních ploch, dostatečná tepelná úprava pokrmů (i uvnitř pokrmů) bezprostředně před požitím; syrové (nepasterizované) mléko převařit; při skladování oddělovat potraviny určené k přímé spotřebě od masných produktů a vajec.
ZÁVĚR
Od roku 2015 do roku 2019 byl v EU zaznamenán stagnující (plochý) trend výskytu humánní yersiniózy, s průměrnou incidencí 1,7/100 000 obyv. Nejvyšší incidence byla zaznamenána ve Finsku, Litvě a Česku [3]. ČR hlásí až trojnásobnou incidenci avšak 2,5 nižší podíl hospitalizovaných oproti průměru zemí EU. Děti do čtyř let tvoří téměř čtvrtinu všech hlášených případů tohoto onemocnění.
Hlavním rezervoárem yersinií jsou domácí prasata a vehikulem zejména nedostatečně tepelně upravené kontaminované vepřové maso [3, 18, 21, 32]. V Čechách je obliba konzumace vepřového masa značná [31]. Při jeho možné kontaminaci by na relativně vysoký výskyt humánní yersiniózy mohla mít tato konzumace významný vliv. Dále se na výskytu onemocnění mohou podílet domácí zabijačky. Kontaminace na jatkách je při dodržení přísných hygienických pravidel nepravděpodobná. U epidemií byla coby vehikulum nejčastěji popsána syrová zelenina (např. hlávkový salát a mrkev) skladovaná po dlouhou dobu v chladničkových teplotách. Křížová kontaminace potravin umístěných v lednici a potravin během manipulace se syrovým vepřovým masem je možná, proto je nutné dodržovat základní hygienická pravidla skladování potravin, přípravy a konzumace pokrmů. Vepřové maso by mělo být před konzumací řádně tepelně upraveno, zejména je-li podáváno malým dětem.
Biotypy a sérotypy kmenůY. enterocolitica jsou v EU (včetně ČR) hlášeny jen zřídka. Vzhledem k relevanci tohoto patogenu pro veřejné zdraví je bližší dourčení humánních izolátů velmi vhodné. Kmeny yersinií k bližšímu dourčení lze zaslat například do Národní referenční laboratoře (NRL) pro E. coli a shigely Státního zdravotního ústavu v Praze.
Do redakce došlo dne 10. 5. 2021.
Adresa pro korespondenci:
MUDr. Michaela Špačková, Ph.D.
Oddělení epidemiologie infekčních nemocí, CEM
Státní zdravotní ústav Praha
Šrobárova 48
100 00 Praha 10
e-mail: michaela.spackova@szu.cz
Sources
1. Galindo CL, Rosenzweig JA, Kirtley ML, et al. Pathogenesis of Y. enterocolitica and Y. pseudotuberculosis in Human Yersiniosis. J Pathog., 2011;182051.
2. Long C, Jones TF, Vugia DJ, et al. Yersinia pseudotuberculosis and Y. enterocolitica infections, FoodNet, 1996–2007. Emerg Infect Dis., 2010;16(3):566–567.
3. European Centre for Disease Prevention and Control. Yersiniosis. In: ECDC. Annual epidemiological report for 2019. Stockholm: ECDC; 2021.
4. European Centre for Disease Prevention and Control. The Surveillance Atlas of Infectious Diseases [online]. 2017 [cit. 2020-10-05]; Dostupné na www: https://www.ecdc.europa.eu/ en/surveillance-atlas-infectious-diseases.
5. Adeolu M, Alnajar S, Naushad S et al. Genome-based phylogeny and taxonomy of the ‚Enterobacteriales‘: proposal for Enterobacterales ord. nov. divided into the families Enterobacteriaceae, Erwiniaceae fam. nov., Pectobacteriaceae fam. nov., Yersiniaceae fam. nov., Hafniaceae fam. nov., Morganellaceae fam. nov., and Budviciaceae fam. nov. Int J Syst Evol Microbiol., 2016;66(12):5575–5599.
6. Le Guern A-S, Savin C, Angermeier H, et al. Yersinia artesiana sp. nov., Yersinia proxima sp. nov., Yersinia alsatica sp. nov., Yersina vastinensis sp. nov., Yersinia thracica sp. nov. and Yersinia occitanica sp. nov., isolated from humans and animals. Int J Syst Evol Microbiol., 2020;70(10):5363–5372.
7. Leibniz Institute DSMZ. LPSN – List of Prokaryotic names with Standing in Nomenclature. 2020 [cit. 2020-12-06]; Dostupné na www: https://lpsn.dsmz.de/genus/yersinia.
8. Bottone EJ. Yersinia enterocolitica: revisitation of an enduring human pathogen. Clin Microbiol Newsletter, 2015;37(1):1–8.
9. Aldová E. Standardní metody laboratorní diagnostiky nákaz vyvolaných druhem Yersinia enterocolitica. Acta hygienica, epidemiologica et microbiologica, 1981; Příloha č. 6/1981.
10. Keto-Timonen R, Pöntinen A, Aalto-Araneda M, et al. Growth of Yersinia pseudotuberculosis strains at different temperatures, pH values, and NaCl and ethanol concentrations. J Food Prot., 2018;81(1):142–149.
11. Guan TT, Holley RA. Pathogen survival in swine manure environments and transmission of human enteric illness – a review. J Environ Qual., 2003;32(2):383–392.
12. de W Blackburn C, McClure PJ. Characteristics of the genus Yersinia. In: Foodborne pathogens (second edition): hazards, risk analysis and control. Foodborne Pathogens Hazards, Risk Analysis and Control. Woodhead Publishing Series in Food Science, Technology and Nutrition. 2009, ISBN: 9781845696337.
13. Wauters G, Kandolo K, Janssens M. Revised biogrouping scheme of Yersinia enterocolitica. Contrib Microbiol Immunol., 1987;9 : 14–21.
14. Neubauer H, Hensel A, Aleksic S, et al. Identification of Yersinia enterocolitica within the genus Yersinia. Syst Appl Microbiol., 2000;23(1):58–62.
15. Fredriksson-Ahomaa M, Cernela N, Hächler H, et al. Yersinia enterocolitica strains associated with human infections in Switzerland 2001–2010. Eur J Clin Microbiol Infect Dis., 2012;31(7):1543 – 1550.
16. Rastawicki W, Szych J, Gierczyński R, et al. A dramatic increase of Yersinia enterocolitica serogroup O:8 infections in Poland. Eur J Clin Microbiol Infect Dis., 2009;28(5):535–537.
17. Le Guern A-S, Martin L, Savin C, et al. Yersiniosis in France: overview and potential sources of infection. Int J Infect Dis., 2016;46 : 1–7.
18. Fredriksson‐Ahomaa M, Meyer C, Bonke R, et al. Characterization of Yersinia enterocolitica 4/O:3 isolates from tonsils of Bavarian slaughter pigs. Lett Appl Microbiol., 2010;50(4):412–418.
19. von Altrock A, Roesler U, Waldmann K-H. Herd factors associated with the serological Yersinia prevalence in fattening pig herds. Foodborne Pathog Dis., 2011;8(12):1249–1255.
20. Kingry LC, Tarr CL, Petersen JM. Yersinia In: Manual of Clinical Microbiology, K.C. Carroll and M.A. Pfaller, Editors. Washington: ASM Press; 2019. ISBN: 978-1-555-81983-5.
21. Fredriksson-Ahomaa M. Isolation of enteropathogenic Yersinia from non-human sources. Adv Exp Med Biol., 2012;954 : 97–105.
22. Bari M, Hossain MA, Isshiki K, et al. Behavior of Yersinia enterocolitica in Foods. J Pathog., 2011;42073223.
23. Felin E, Hälli O, Heinonen M, et al. Assessment of the feasibility of serological monitoring and on-farm information about health status for the future meat inspection of fattening pigs. Prev Vet Med., 2019;162 : 76–82.
24. Toivanen P, Olkkonen L, Toivanen A, et al. Hospital outbreak of Yersinia enterocolitica infection. Lancet, 1973;1(7807):801–803.
25. Frati P, Busardò FP, Di Stefano MA, et al. A fatal case of post-transfusion sepsis caused by Yersinia enterocolitica after delivery. Blood Transfus., 2015;13(3):528–531.
26. Guinet F, Carniel E, Leclercq A. Transfusion-transmitted Yersinia enterocolitica sepsis. Clin Infect Dis., 2011;53(6):583–591.
27. Wunderink HF, Oostvogel PM, Frénay IH, et al. Difficulties in diagnosing terminal ileitis due to Yersinia pseudotuberculosis. Eur J Clin Microbiol Infect Dis., 2014;33(2):197–200.
28. Stephan R, Cernela N, Ziegler D, et al. Rapid species specific identification and subtyping of Yersinia enterocolitica by MALDI-TOF mass spectrometry. J Microbiol Methods, 2011;87(2):150–153.
29. Garzetti D, Susen R, Fruth A, et al. A molecular scheme for Yersinia enterocolitica patho-serotyping derived from genome-wide analysis. Int J Med Microbiol., 2014;304(3-4):275–283.
30. European Centre for Disease Prevention and Control. Yersiniosis. In: ECDC. Annual epidemiological report for 2018. Stockholm: ECDC; 2019.
31. Šrédl K, Prášilová M, Severová L, et al. Social and economic aspects of sustainable development of livestock production and meat consumption in the Czech Republic. Agriculture, 2021;11(2):102.
32. Martinez PO, Fredriksson-Ahomaa M, Pallotti A, et al. Variation in the prevalence of enteropathogenic Yersinia in slaughter pigs from Belgium, Italy, and Spain. Foodborne Pathog Dis., 2011;8(3):445–450.
33. Proroková Z. Mikrobiologická (ne)bezpečnost zvěřiny [online]. Pardubice, 2020 [cit. 2021-09-15]. Dostupné na www: https://theses. cz/id/nk7ck5/. Bakalářská práce. Univerzita Pardubice, Fakulta chemicko-technologická. Vedoucí práce Ing. David Šilha, Ph.D.
34. Tan LK, Ooi PT, Thong KL. Prevalence of Yersinia enterocolitica from food and pigs in selected states of Malaysia. Food control, 2014;35(1):94–100.
35. Tauxe RV. Salad and pseudoappendicitis: Yersinia pseudotuberculosis as a foodborne pathogen. J Infect Dis., 2004;189(5):761–763.
36. Vasala M, Hallanvuo S, Ruuska P, et al. High frequency of reactive arthritis in adults after Yersinia pseudotuberculosis O: 1 outbreak caused by contaminated grated carrots. Ann Rheum Dis., 2014;73(10):1793–1796.
37. Boelaert F, Stoicescu A, Amore G, et al. The European Union One Health 2019 Zoonoses Report. EFSA J, 2021;19(2).
38. European Food Safety Authority, European Centre for Disease Prevention Control. The European Union one health 2018 zoonoses report. EFSA J, 2019;17(12):e05926.
39. Espenhain L, Riess M, Müller L, et al. Cross-border outbreak of Yersinia enterocolitica O3 associated with imported fresh spinach, Sweden and Denmark, March 2019. Euro Surveill., 2019;24(24):1900368.
40. Huovinen E, Sihvonen LM, Virtanen MJ, et al. Symptoms and sources of Yersinia enterocolitica-infection: a case-control study. BMC Infect Dis., 2010;10(1):1–9.
41. Parůžková P. Enteropatogenní Yersinia spp. – detekce, charakterizace a zdroje pro člověka [online]. Brno, 2014 [cit. 2021-09-15]. Dostupné na www: https://is.muni.cz/th/ywz27/. Bakalářská práce. Masarykova univerzita, Přírodovědecká fakulta. Vedoucí práce Alena Lorencová.
42. Lorencová A, Verbíková V, Michná V, et al. Výskyt enteropatogenních yersinií u prasat divokých v České republice. Maso, 2015(4).
43. Lorencova A, Babak V, Lamka J. Serological prevalence of enteropathogenic Yersinia spp. in pigs and wild boars from different production systems in the Moravian region, Czech Republic. Foodborne Pathog Dis., 2016;13(5):275–279.
44. Syczyło K, Platt-Samoraj A, Bancerz-Kisiel A, et al. The prevalence of Yersinia enterocolitica in game animals in Poland. PLoS One, 2018;13(3):e0195136.
45. Bancerz-Kisiel A, Szweda W. Yersiniosis-a zoonotic foodborne disease of relevance to public health. Ann Agric Environ Med., 2015;22(3).
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2022 Issue 1-
All articles in this issue
- Prevalence of SARS-COV-2 antibodies in the Thomayer University Hospital staff after the first wave of COVID-19
- Decreasing neutralization antibody levels following vaccination against SARS-CoV-2 in the elderly: an observational study in Southern Moravia, Czech Republic
- Characteristics of homeless persons hospitalized in health care facilities in the Czech Republic in 2006–2015
- Overview of basic epidemiological characteristics and descriptive analysis of the incidence of human yersiniosis in the Czech Republic in 2018–2020
- Measles outbreaks in 2017–2019 – molecular surveillance started in the Czech Republic
- Next generation probiotics: an overview of the most promising candidates
- Detection of Borrelia miyamotoi in Ixodes ricinus ticks in Southern Moravia – risk for public health
- Blahopřání k životnímu jubileu RNDr. Petra Petráše, CSc.
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Next generation probiotics: an overview of the most promising candidates
- Overview of basic epidemiological characteristics and descriptive analysis of the incidence of human yersiniosis in the Czech Republic in 2018–2020
- Characteristics of homeless persons hospitalized in health care facilities in the Czech Republic in 2006–2015
- Decreasing neutralization antibody levels following vaccination against SARS-CoV-2 in the elderly: an observational study in Southern Moravia, Czech Republic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

