-
Medical journals
- Career
Genotypy norovirů u pacientů Fakultní nemocnice v Plzni, Česká republika, 2017–2020
Authors: P. Pazdiora 1,2; P. Vašíčková 3; M. Krzyžánková 3
Authors‘ workplace: Oddělení epidemiologie Fakultní nemocnice v Plzni, Plzeň 1; Ústav epidemiologie Lékařské fakulty v Plzni, Univerzita Karlova, Plzeň 2; Výzkumný ústav veterinárního lékařství, Brno 3
Published in: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 4, s. 233-240
Category: Original Papers
Overview
Cíl práce: Noroviry patří do čeledi Caliciviridae. V současnosti jsou tyto viry klasifikovány minimálně do 10 genoskupin. Význam norovirů v České republice není zatím intenzivně sledován. Cílem studie bylo přispět ke znalostem o jejich cirkulaci v naší populaci na základě určení jednotlivých genotypů u pacientů, u kterých byla norovirová infekce diagnostikována rutinním vyšetřením během hospitalizace ve Fakultní nemocnici v Plzni.
Materiál a metody: Od června 2017 do března 2020 byla diagnóza norovirové infekce potvrzena u 118 pacientů. Laboratorní vyšetření: Vzorky nativní stolice nemocných s projevy gastroenteritidy byly rutinně zpracovány kvalitativním imunochromatografickým testem RIDAQuick Norovirus (R-Biopharm AG) na stanovení noroviru genoskupiny I a II podle pokynu výrobce. Následně byla provedena molekulárně-biologická analýza vzorků. Ze vzorků stolice byla připravena 10% suspenze v roztoku fosfátového pufru, ze které byla soupravou QIAamp Viral RNA Mini Kit (Qiagen) izolována nukleová kyselina podle návodu výrobce. Dále byla provedena reverzní transkripce a amplifikace (PCR) specifické oblasti genomu norovirů (tzv. region C). PCR produkty o specifické velikosti byly přečištěny pomocí QIAquick PCR Purification Kit (Qiagen) a odeslány na sekvenování (Eurofins Genomics). Získané sekvence byly analyzovány v programu MEGA verze X. Zařazení prokázaných virů do jednotlivých genotypů bylo ověřeno s použitím Norovirus Typing Tool Version 2.0 (https://www.rivm.nl/mpf/typingtool/norovirus/).
Výsledky: Během sledovaného období bylo prokázáno 14 různých genotypů, resp. variant z genoskupin GI, GII a GIX (dříve GII.15). Nejčastěji byly potvrzeny infekce vyvolané noroviry (NoV) GII.4 Sydney-2012, které vyvolaly 70,3 % onemocnění. Tato varianta norovirů byla prokázána ve 24 měsících z celkového počtu 34 měsíců sledování. Norovirové infekce se vyskytovaly především v podzimních a zimních měsících (říjen-březen), v tomto období bylo diagnostikováno 68, tj. 57,6 % onemocnění. Norovirová infekce byla potvrzena ve všech věkových skupinách, věk pacientů se pohyboval od 0 do 96 let (medián 8, průměr 27,9 let). Analýza zastoupení nejčastější varianty NoV GII.4 Sydney-2012 potvrdila statisticky významný rozdíl ve výskytu této varianty ve věkové skupině 0-4 let při porovnání se staršími osobami (χ2 = 5,37, P = 0,02). Pacienti s norovirovou infekcí měli bydliště vesměs v okrese Plzeň-město (51 osob). Z anamnézy nemocných vyplynulo, že 35 z nich (29,7 %) mělo v době prvních příznaků dalšího nemocného s příznaky gastroenteritidy v rodině.
Závěr: Studie je prvním pokusem o zmapování molekulární epidemiologie norovirů nejen v Plzeňském kraji, ale v celé České republice. I přes relativně nízké počty oficiálně hlášených onemocnění patří nepochybně noroviry i u nás k velmi důležitým původcem gastroenteritid, je proto žádoucí rozšiřovat spektrum našich znalostí o jejich cirkulaci.
Klíčová slova:
noroviry – genotypy – sezonní výskyt – gastroenteritida – infekce dětí
ÚVOD
Noroviry patří do čeledi Caliciviridae. Virus měří 27 až 40 nm. Jednořetězcový RNA genom zahrnuje 3 ORF (open reading frame), které kódují nestrukturální polyprotein a strukturální virové proteiny VP1 a VP2. Vysoká genetická proměnlivost je spojena především s částí P2 VP1. V současnosti jsou noroviry (NoV) klasifikovány minimálně do 10 genoskupin, tj. GI–GX. Jednotlivé genoskupiny jsou dále rozděleny na 48 genotypů [12, 13]. Od 90. let minulého století jsou ve světě nejvíce rozšířeny noroviry genoskupiny/genotypu GII.4. Viry jsou velmi stabilní a k jejich přenosu dochází přímo mezi osobami nebo nepřímo prostřednictvím kontaminovaných potravin, vody či prostředí.
Norovirové infekce se vyskytují celoročně v celém světě, postihují všechny věkové skupiny. Celosvětově se odhaduje, že noroviry vyvolávají zhruba 18 % všech akutních gastroenteritid, současně jsou nejčastějším původcem epidemií gastroenteritid [1, 25]. Významná je i klinická závažnost těchto onemocnění. Odhaduje se, že každý rok dochází na celém světě v jejich důsledku k 19 494–212 489 úmrtím [7, 15]. Variabilita odhadů je významně ovlivněna používanou metodologií [27]. V USA se předpokládá, že každoročně způsobí 16 000 až 214 000 hospitalizací a 500–3 250 úmrtí [2]. Na základě údajů z let 2007–2012 se odhaduje, že v Německu je každoročně hospitalizováno s norovirovou infekcí 53 000–90 000 osob a 170–260 umírá [21]. V rámci Evropské unie se kalkuluje u dětí do 5 let s každoročním počtem 53 000 hospitalizací a 102 úmrtími [20].
Diagnostika těchto infekcí se vyvíjí, ve světě se dnes nejčastěji používá EIA (enzyme immune assay) a RT-PCR (reverse transcription polymerase chain reaction). Sekvenační metody se vyznačují vysokou citlivostí, specificitou a navíc umožňují bližší identifikaci virů [34]. S rozvojem diagnostiky a její dostupností v posledních 20 letech dochází k bouřlivému rozvoji poznatků o norovirových infekcích.
Význam norovirů v České republice (ČR) není zatím intenzivně sledován. V letech 2016–2020 bylo do informačního systému infekčních onemocnění hlášeno v jednotlivých letech 1 543–4 495 onemocnění. Publikovány byly údaje o klinice těchto onemocnění [30], jejich významu v etiologii gastroenteritid [6], laboratorní diagnostice gastrointestinálních patogenů [23], průkazu norovirů v potravinách a odpadní vodě [10, 14]. Problematice cirkulace jednotlivých genoskupin, resp. genotypů při dlouhodobém sledování zatím nebyla věnována pozornost. Cílem naší studie bylo přispět ke znalostem o cirkulaci norovirů v naší populaci na základě určení jednotlivých genotypů u pacientů, u kterých byla norovirová infekce diagnostikována rutinním vyšetřením během hospitalizace ve Fakultní nemocnici (FN) v Plzni v období 2017–2020.
SOUBOR NEMOCNÝCH A METODIKA
Od června 2017 do března 2020 byla diagnóza norovirové infekce potvrzena u 118 pacientů, kteří dali písemný souhlas s následným dalším zpracováním jejich pozitivní stolice. Indikace rutinního vyšetření byla vesměs prováděna u pacientů Kliniky infekčních nemocí a cestovní medicíny a Dětské kliniky FN Plzeň.
Laboratorní vyšetření: Vzorky nativní stolice nemocných s projevy gastroenteritidy byly rutinně zpracovány v laboratoři Ústavu mikrobiologie Lékařské fakulty a FN v Plzni kvalitativním imunochromatografickým testem RIDAQuick Norovirus (R-Biopharm AG) na stanovení noroviru genoskupiny I a II podle pokynů výrobce. Pozitivní stolice byly zamraženy při teplotě -28 °C a po získání písemného souhlasu infikovaných pacientů, resp. jejich zákonných zástupců, byly průběžně přepravovány do laboratoře v Brně, kde byla provedena molekulárně-biologická analýza vzorků. Ze vzorků stolice byla připravena 10% suspenze v roztoku fosfátového pufru, ze které byla soupravou QIAamp Viral RNA Mini Kit (Qiagen) izolována nukleová kyselina podle návodu výrobce. Následně byla provedena reverzní transkripce a amplifikace (PCR) specifické oblasti genomu norovirů (tzv. region C). PCR produkty o dané velikosti (noroviry řazené do genoskupiny I 329 bp, noroviry náležící do genoskupiny II 343 bp) [17] byly přečištěny pomocí QIAquick PCR Purification Kit (Qiagen) a odeslány na sekvenování (Eurofins Genomics). Získané sekvence byly analyzovány v programu MEGA verze X [24]. Fylogenetická analýza byla provedena metodou Neighbor - Joining. Ke genotypizaci prokázaných norovirů byly pro genoskupinu I použity referenční sekvence: NoV GI.1 (M87661), NoV GI.2 (L07418), NoV GI.3 (U04469), NoV GI.4 (AB042808), NoV GI.5 (AJ277614), NoV GI.6 (AF093797), NoV GI.7 (AJ277609), NoV GI.8 (AF538679) a NoV GI.9 (HQ637267). U genoskupiny II byly užity referenční sekvence: NoV GII.1 (U07611), NoV GII.2 (X81879), NoV GII.3 (U02030), NoV GII.4 (X76716), NoV GII.5 (AJ277607), NoV GII.6 (AJ277620), NoV GII.7 (AJ277608), NoV GII.8 (AF195848), NoV GII.9 (AY038599), NoV GII.10 (AF427118), NoV GII.11 (AB074893), NoV GII.12 (AJ277618), NoV GII.13 (AY113106), NoV GII.14 (AY130761), NoV GII.16 (AY502010), NoV GII.17 (AY502009), NoV GII.18 (AY823304), NoV GII.19 (AY823306), NoV GII.20 (EU373815), NoV GII.21 (AY675554), NoV GII.22 (AB083780), NoV GII.23 (KT290889), NoV GII.24 (KY225989), NoV GII.25 (GQ856469), NoV GII.26 (KU306738), NoV GII.27 (MG495077) [12]. Zařazení prokázaných virů do jednotlivých genotypů bylo ověřeno aplikací Norovirus Typing Tool Version 2.0 (https:// www.rivm.nl/mpf/typingtool/norovirus/) [22].
Z dokumentace pacientů FN v Plzni byly získány údaje o epidemiologické anamnéze, bydlišti a hospitalizaci.
Statistické výpočty byly prováděny χ2 testem s hladinou významnosti p=0,05 (Epi info 6, v. 6.04d).
VÝSLEDKY
Během sledovaného období bylo prokázáno 14 různých genotypů, resp. variant genoskupin GI, GII a GIX – dříve GII.15. Nejčastěji byly potvrzeny infekce vyvolané NoV GII.4 Sydney-2012, které vyvolaly 70,3 % potvrzených onemocnění. Tato varianta norovirů byla potvrzena ve 24 měsících z celkového počtu 34 měsíců sledování. Dlouhodoběji (více než 3 měsíce) cirkulovaly dále NoV GII.3 (5 měsíců), GII.13 a GI.6 (4 měsíce), ostatní genotypy se objevily výjimečně a krátkodobě. Zastoupení potvrzených genotypů v jednotlivých čtvrtletích let 2017–2020 ukazuje graf na obrázku 1.
Image 1. Výskyt genoskupin/genotypů norovirů ve Fakultní nemocnici Plzeň (červen 2017 až březen 2020)
Figure 1. The occurrence of norovirus genogroups/genotypes at the Pilsen University Hospital (June 2017–March 2020)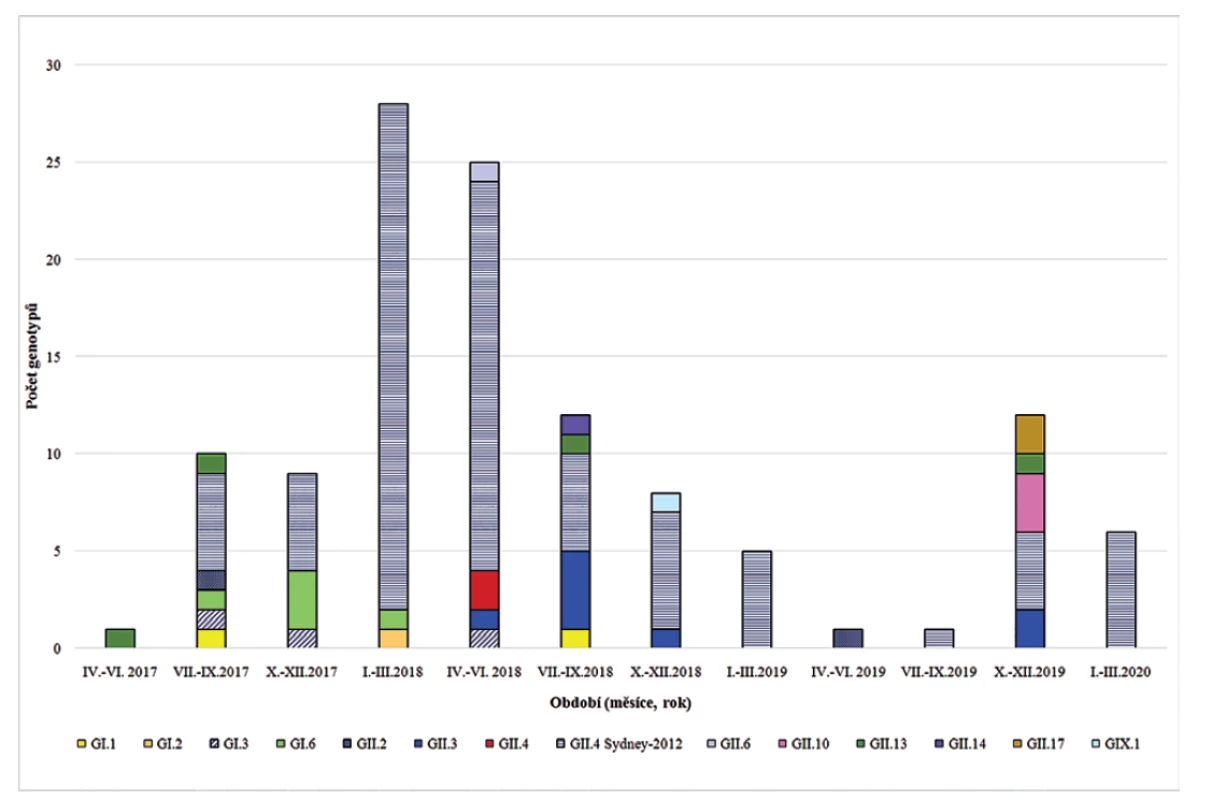
Tyto výsledky také znázorňují obrázky 2 a 3. Obrázek 2 shrnuje fylogenetickou analýzu specifických oblastí genomu (ORF2, region C, 291 nt) norovirů, které jsou zařazeny do genoskupiny I (NoV GI) a byly prokázány v rámci této studie. Získané a zanalyzované sekvence jsou značeny podle roku jejich původu. Obdobně výsledky fylogenetické analýzy specifických oblastí genomu (ORF2, region C, 302 nt) norovirů řazených do genoskupiny II (NoV GII) znázorňuje obrázek 3. Vzhledem k přehlednosti fylogenetického stromu byla většina jeho části zahrnující NoV GII.4 komprimována.
Image 2. Výsledky fylogenetické analýzy specifické oblasti genomu (ORF2, region C, 291 nt) norovirů řazených do genoskupiny I (NoV GI) prokázaných v rámci této studie
Figure 2. Results of phylogenetic analysis of a specific part of the norovirus genogroup I genome (ORF2, region C, 291 nt) detected in the present study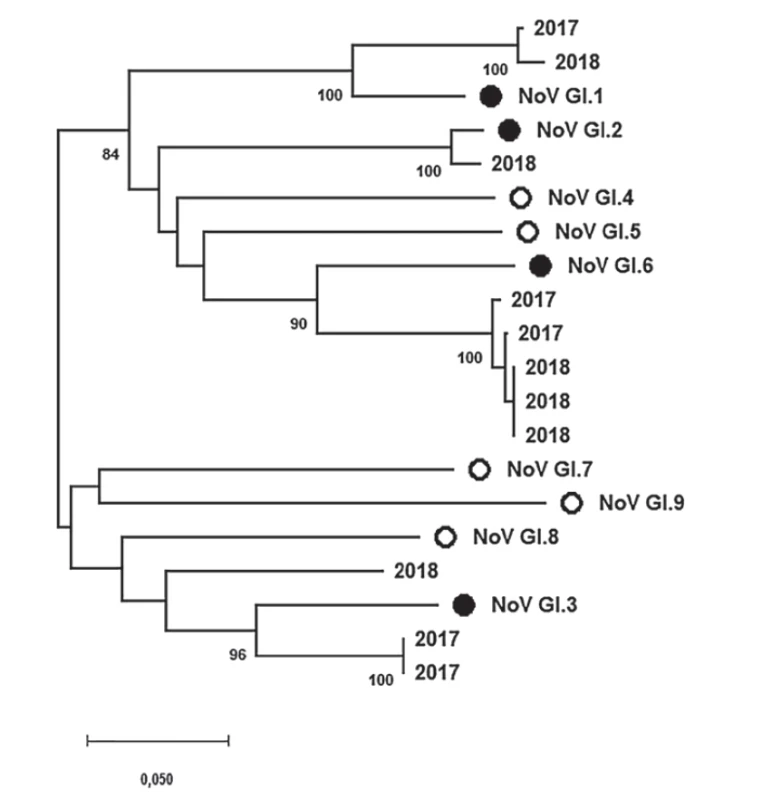
Image 3. Výsledky fylogenetické analýzy specifické oblasti genomu (ORF2, region C, 302 nt) norovirů řazených do genoskupiny II (NoV GII) prokázaných v rámci této studie
Figure 3. Results of phylogenetic analysis of a specific part of the norovirus genogroup II genome (ORF2, region C, 302 nt) detected in the present study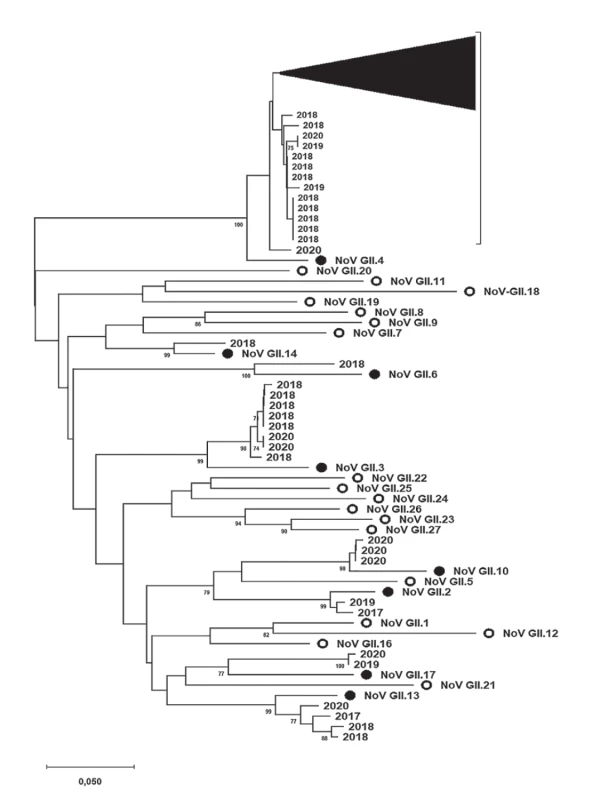
Z výsledků je zřejmé, že norovirové infekce se vyskytovaly především v podzimních a zimních měsících (říjen – březen), v tomto období bylo diagnostikováno 68, tj. 57,6 % onemocnění. Norovirová infekce byla potvrzena ve všech věkových skupinách (tab. 1), věk pacientů se pohyboval od 0 do 96 let (medián 8, průměr 27,9 let). Analýza zastoupení nejčastějšího genotypu NoV GII.4 potvrdila statisticky významný rozdíl ve výskytu tohoto genotypu ve věkové skupině 0–4 let při porovnání se staršími osobami (χ2 = 3,95, P = 0,047).
Table 1. Výskyt genoskupin/genotypů norovirů v jednotlivých věkových skupinách (FN Plzeň, červen 2017 až březen 2020)
Table 1. Distribution of norovirus genogroups/genotypes by age group (Pilsen University Hospital, June 2017–March 2020)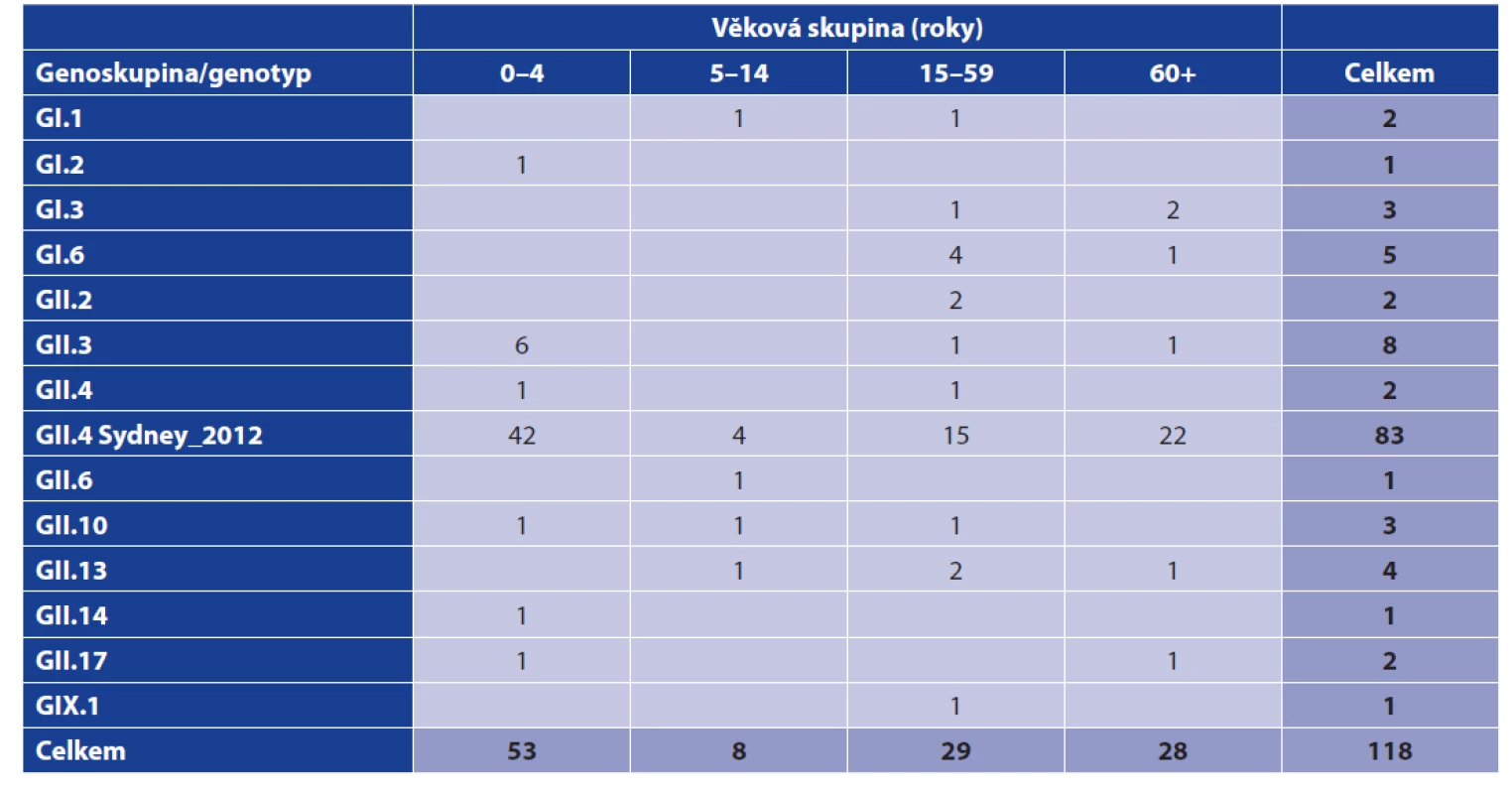
Pacienti s norovirovou infekcí měli bydliště vesměs v okrese Plzeň-město (51 osob), při porovnání výskytu převažující varianty nebyl zjištěn statisticky významný rozdíl mezi nemocnými z Plzně-města a z jiných okresů. Z anamnézy nemocných vyplynulo, že 35 z nich (29,7 %) mělo v době prvních příznaků dalšího nemocného s příznaky gastroenteritidy v rodině – u 26 osob byly prokázány NoV GII.4 Sydney-2012; rozdíl v zastoupení této varianty nebyl statisticky významný při porovnání s pacienty bez gastroenteritidy u rodinných příslušníků.
DISKUSE
Podobně jako v jiných studiích [3, 8, 26, 31, 33, 35] se potvrdilo, že i ve sledované populaci pacientů z plzeňské fakultní nemocnice dlouhodobě převažují noroviry z genoskupiny/genotypu GII.4. Ve sledovaném období byla dominantní varianta GII.4 Sydney-2012, která byla zachycena ve většině měsíců sledovaného období. Noroviry GII.4 jsou celosvětově dominantní již od 90. let minulého století. Viry z této genoskupiny jsou velmi proměnlivé a na základě malých a velkých změn genomu dochází k jednotlivým mutacím a rekombinacím s významnou změnou každé 2–3 roky. Jejich dominantní výskyt je spojován i s jednotlivými pandemiemi, které světem prošly od 90. let. V posledních 10 letech se staly pandemickými NoV GII.4 Sydney-2012 a GII.4 Sydney-2015. Po rozšíření nového kmene GII.17 Kawasaki v Asii v letech 2014–2015 se předpokládalo rozšíření této varianty celosvětově; na jiných kontinentech je však tato varianta prokazována zatím méně často. V našem souboru byla zachycena jen 2x – koncem roku 2019. Podobně byl výjimečný i záchyt NoV GII.2, který se znovu rozšířil ve světě na konci roku 2016 a mj. je hojně zastoupen v Německu [11, 28].
Genotyp GII.4 je spojován většinou s přímým přenosem mezi lidmi vzhledem k jeho menší odolnosti vůči zevním podmínkám [5]. Nepřímo to potvrzují i naše výsledky, výskyt tohoto genotypu byl významně častější v nejmladší věkové skupině, u které se dá předpokládat úzký kontakt především s rodinnými příslušníky; přenos vodou či potravinami by měl být v této věkové skupině v našich podmínkách při dodržování základních hygienických podmínek méně pravděpodobný. K přímému přenosu napomáhá i popisovaný častější výskyt zvracení, větší počty průjmových stolic a masivnější vylučování norovirů tohoto genotypu [5, 9]; u dětí se zpravidla jedná o primární infekce [4]. Výskyt NoV non-GII.4 na rozdíl od GII.4 bývá krátkodobý a po objevení rychle mizí. V našem souboru byly pouze 3 další genotypy prokazovány déle než 3 měsíce.
Během sledování byly potvrzeny 4 genotypy genoskupiny I – pouze u 11 osob, tj. 9,3 %. Významná převaha kmenů z genoskupiny II může souviset s jejich častějším vyvoláváním klinických onemocnění s potřebou hospitalizace, naopak genoskupina I bývá spojována s mírnějšími, případně asymptomatickými infekcemi [16, 18]. Poměrně výjimečný výskyt genoskupiny GI odpovídá i epidemiologické situaci v Plzeňském kraji ve sledovaném období – v uvedených letech nebyla prokázána vodní epidemie, resp. hromadný přenos vodou, který by byl spojen s nutností hospitalizace.
Překvapující je vysoký počet prokázaných genotypů, resp. jejich variant. V relativně malé spádové oblasti bylo potvrzeno během 34měsíčního sledování 14 rozdílných genotypů, resp. variant. Během sledování v Číně v období 2013–2018 byla potvrzena cirkulace 10 genotypů z genoskupiny GII a 3 genotypů z genoskupiny I [11]. Ve studii, která probíhala více než 10 let v Belgii, bylo podchyceno 17 genotypů – z nich patřilo 7 do genoskupiny I [35]. Ve 2 španělských studiích bylo potvrzeno během 4 let 13 genotypů (pouze 4 z GI), resp. během ročního sledování 8 genotypů GII [4, 26]; v běloruské studii bylo zjištěno během 5 let 7 genotypů, resp. variant pouze z GII [29]. Ve studiích v dětské populaci bylo v Řecku během 30 měsíců prokázáno 9 genotypů, 8 z nich z genoskupiny II [32], ve Finsku během 12 měsíců 5 genotypů s převahou GII [31], ve Velké Británii bylo během 12měsíčního sledování podchyceno 10 genotypů s 87% podílem GII [3]. Naopak během čtyřletého sledování korejských pacientů bylo potvrzeno 31 genotypů – 85,4 % vzorků bylo z genoskupiny II [18]. Při 12letém sledování cirkulace norovirů v 19 zemích Evropy, Asie, Oceánie a Afriky bylo podchyceno 26 různých genotypů; 91,7 % analyzovaných vzorků patřilo do GII [33].
Norovirové infekce se častěji vyskytují v chladnějších měsících – napomáhá tomu především častější déšť, vyšší vlhkost a nižší teploty [19, 31, 33, 35, 36]. Japonští autoři zdokumentovali tuto sezonnost při ročním monitorování výskytu norovirů v řece [16]. Této obecné charakteristice odpovídají i naše výsledky; 57,6 % onemocnění bylo potvrzeno v období říjen–březen. Rozdílný sezonní výskyt může být ovlivněn nejen objevením se nových genoskupin, resp. genotypů, ale i uplatněním odlišných cest přenosu. V našem souboru nebyla nalezena geografická korelace, nejčastěji zastoupená varianta GII.4 Sydney-2012 se vyskytovala stejně často u pacientů s bydlištěm v krajském městě či v ostatních okresech. Podobně jako v jiných studiích byl potvrzen vyšší výskyt u dětí do 5 let a u osob starších než 60 let – v těchto 2 věkových skupinách je uváděna i nejvyšší klinická závažnost [19, 20, 36].
Studie je prvním pokusem o zmapování molekulární epidemiologie norovirů nejen v Plzeňském kraji, ale v celé České republice. I přes relativně nízké počty oficiálně hlášených onemocnění patří nepochybně noroviry i u nás k velmi důležitým původcům gastroenteritid. Dříve nebo později bude i v našich podmínkách diskutováno využití vakcín proti norovirovým infekcím a je proto žádoucí mít při zavádění očkování co nejvíce informací nejen globálních, ale pokud možno i z jednotlivých zemí, resp. jejich regionů.
Projekt č. 17-31921A byl podpořen AZV ČR. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Za technickou spolupráci patří poděkování pracovnicím Ústavu epidemiologie LF v Plzni, UK J. Čechové, Bc. Š. Merhoutové a zdravotním sestrám Kliniky infekčních nemocí a cestovní medicíny.
Do redakce došlo dne 18. 5. 2021.
Adresa pro korespondenci:
prof. MUDr. Petr Pazdiora, CSc.
Dr. E. Beneše 13
305 99 Plzeň
e-mail: pazdiora@fnplzen.cz
Sources
1. Ahmed SM, Hall AJ, Robinson AE, et al. Global prevalence of norovirus in cases of gastroenteritis: a systematic review and meta-analysis. Lancet Infect Dis, 2014;14(8):725–730.
2. Bartsch SM, O‘Shea KJ, Lee BY. The Clinical and Economic Burden of Norovirus Gastroenteritis in the United States. J Infect Dis, 2020;222(11):1910–1919.
3. Brown JR, Shah D, Breuer J. Viral gastrointestinal infections and norovirus genotypes in a paediatric UK hospital, 2014–2015. J Clin Virol, 2016;84 : 1–6.
4. Carmona-Vicente N, Fernández-Jiménez M, Ribes JM, et al. Norovirus infections and seroprevalence of genotype GII.4-specific antibodies in a Spanish population. J Med Virol, 2015;87(4):675 – 682.
5. de Graaf M, van Beek J, Koopmans MP. Human norovirus transmission and evolution in a changing world. Nat Rev Microbiol, 2016;14(7):421–433.
6. Fajfr M, Štěpánová V, Plíšková L, et al. Virové gastroenteritidy v regionu východních Čech (Viral gastroenteritis in Eastern Bohemia Region of the Czech Republic). Epidemiol Mikrobiol Imunol, 2014;63(2):88–91.
7. GBD 2016 Diarrhoeal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhoea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis, 2018;18(11):1211–1228.
8. Hasing ME, Lee BE, Qiu Y, et al. Changes in norovirus genotype diversity in gastroenteritis outbreaks in Alberta, Canada: 2012 – 2018. BMC Infect Dis, 2019;19(1):177.
9. Huhti L, Szakal ED, Puustinen L, et al. Norovirus GII-4 causes a more severe gastroenteritis than other noroviruses in young children. J Infect Dis, 2011;203(10):1442–1444.
10. Huvarova V, Kralik P, Vasickova P, et al. Tracing of Selected Viral, Bacterial, and Parasitic Agents on Vegetables and Herbs Originating from Farms and Markets. J Food Sci, 2018;83(12):3044 – 3053.
11. Chen C, Yan JB, Wang HL, et al. Molecular epidemiology and spatiotemporal dynamics of norovirus associated with sporadic acute gastroenteritis during 2013–2017, Zhoushan Islands, China. PLoS One, 2018;13(7):e0200911.
12. Chhabra P, de Graaf M, Parra GI, et al. Updated classification of norovirus genogroups and genotypes. J Gen Virol, 2019;100(10):1393–1406.
13. Chhabra P, Graaf M, Parra GI, et al. Corrigendum: Updated classification of norovirus genogroups and genotypes. J Gen Virol, 2020;101(8):893.
14. Kaevska M, Videnska P, Vasickova P. Changes in Microbial Composition of Wastewater During Treatment in a Full-Scale Plant. Curr Microbiol, 2016;72(2):128–132.
15. Kirk MD, Pires SM, Black RE, et al. World Health Organization Estimates of the Global and Regional Disease Burden of 22 Foodborne Bacterial, Protozoal, and Viral Diseases, 2010: A Data Synthesis. PLoS Med, 2015;12(12):e1001921.
16. Kitajima M, Oka T, Haramoto E, et al. Seasonal distribution and genetic diversity of genogroups I, II, and IV noroviruses in the Tamagawa River, Japan. Environ Sci Technol, 2010;44(18):7116 – 7122.
17. Kitajima M, Haramoto E, Phanuwan C, et al. Molecular detection and genotyping of human noroviruses in influent and effluent water at a wastewater treatment plant in Japan. J of Appl Microbiol, 2012; 112 : 605–613.
18. Koo HS, Lee MO, Ku PT, et al. Molecular epidemiology of norovirus in asymptomatic food handlers in Busan, Korea, and emergence of genotype GII.17. J Microbiol, 2016;54(10):686 – 694.
19. Korcinska MR, Dalsgaard Bjerre K, Dam Rasmussen L, et al. Detection of norovirus infections in Denmark, 2011–2018. Epidemiol Infect, 2020;148:e52.
20. Kowalzik F, Riera-Montes M, Verstraeten T, et al. The burden of norovirus disease in children in the European Union. Pediatr Infect Dis J, 2015;34(3):229–234.
21. Kowalzik F, Binder H, Zöller D, et al. Norovirus Gastroenteritis among Hospitalized Patients, Germany, 2007–2012. Emerg Infect Dis, 2018;24(11):2021–2028.
22. Kroneman A, Vennema H, Deforche K, et al. An automated genotyping tool for enteroviruses and noroviruses. J Clin Virol, 2011; 51(2):121–125.
23. Krutova M, Briksi A, Tkadlec J, et al. Evaluation of a Gastrointestinal Pathogen Panel Immunoassay in Stool Testing of Patients with Suspected Clostridioides (Clostridium) difficile Infection. J Clin Microbiol, 2019;57(10):e00710–00719.
24. Kumar S, Stecher G, Li M, et al. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms. Mol Biol Evol, 2018;35 : 1547–1549.
25. Lopman BA, Steele D, Kirkwood CD, et al. The Vast and Varied Global Burden of Norovirus: Prospects for Prevention and Control. PLoS Med, 2016;13(4):e1001999.
26. Manso CF, Romalde JL. Molecular epidemiology of norovirus from patients with acute gastroenteritis in northwestern Spain. Epidemiol Infect, 2015;143(2):316–324.
27. Mattison CP, Cardemil CV, Hall AJ. Progress on norovirus vaccine research: public health considerations and future directions. Expert Rev Vaccines, 2018;17(9):773–784.
28. Niendorf S, Jacobsen S, Faber M, et al. Steep rise in norovirus cases and emergence of a new recombinant strain GII.P16-GII.2, Germany, winter 2016. Euro Surveill, 2017;22(4):30447.
29. Paklonskaya NU, Amvrosieva TV, Dziadziulia KL, et al. Norovirus infection in Belarus: occurrence and molecular epidemiology. Cent Eur J Public Health, 2015;23(1):69–72.
30. Pazdiora P, Táborská J, Švecová M, et al. Diagnostika norovirových infekcí u hospitalizovaných dětí a mladistvých s akutní gastroenteritidou. Plzeňská studie (The diagnosis of norovirus infections in hospitalized children and adolescents with acute gastroenteritis: a study from Pilsen, Czech Republic. Epidemiol Mikrobiol Imunol, 2009;58(4):167–172.
31. Puustinen L, Blazevic V, Salminen M, et al. Noroviruses as a major cause of acute gastroenteritis in children in Finland, 2009–2010. Scand J Infect Dis, 2011;43(10):804–808.
32. Siafakas N, Zerva L, Hatzaki D, et al. Molecular epidemiology of noroviruses in children in South Greece, 2013–2015. J Med Virol, 2018;90(11):1703–1711.
33. van Beek J, de Graaf M, Al-Hello H, et al. NoroNet. Molecular surveillance of norovirus, 2005-16: an epidemiological analysis of data collected from the NoroNet network. Lancet Infect Dis, 2018;18(5):545–553.
34. Vinjé J. Advances in laboratory methods for detection and typing of norovirus. J Clin Microbiol, 2015;53(2):373–381.
35. Wollants E, De Coster S, Van Ranst M, et al. A decade of norovirus genetic diversity in Belgium. Infect Genet Evol, 2015;30 : 37–44.
36. Zhou H, Wang S, von Seidlein L, et al. The epidemiology of norovirus gastroenteritis in China: disease burden and distribution of genotypes. Front Med, 2020;14(1):1–7.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2021 Issue 4-
All articles in this issue
- Studie rodinných clusterů s výskytem covid-19 v Ústeckém kraji se zaměřením na děti – klinický obraz, sekundární přenos, protilátková odpověď
- Genotypy norovirů u pacientů Fakultní nemocnice v Plzni, Česká republika, 2017–2020
- Sledování rezistence chřipkových virů na oseltamivir – naše dosavadní zkušenosti
- Prevalence a kontrola arteriální hypertenze v populaci 25–64 let v České republice s ohledem na pacienty s diabetes mellitus
- Příušnice a jejich výskyt v České republice a na Slovensku
- Možnosti sledování subpopulací B lymfocytů v periferní krvi v rutinní imunologické laboratoři
- K osmdesátinám profesora Jiřího Městeckého
- Udělení Řádu T. G. Masaryka I. třídy in memoriam prof. MUDr. Karel Raška, DrSc. (17. 11. 1909–21. 11. 1987)
- Covid-19 u dětí spojený s dětským zánětlivým multisystémovým syndromem (PIMS)
- Corynebacterium sp. izolovaný z hemokultury bakteriemického pacienta. Potvrdí se předpoklady o novém korynebakteriu?
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Možnosti sledování subpopulací B lymfocytů v periferní krvi v rutinní imunologické laboratoři
- Příušnice a jejich výskyt v České republice a na Slovensku
- Corynebacterium sp. izolovaný z hemokultury bakteriemického pacienta. Potvrdí se předpoklady o novém korynebakteriu?
- Prevalence a kontrola arteriální hypertenze v populaci 25–64 let v České republice s ohledem na pacienty s diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

