-
Medical journals
- Career
Individualizované dávkování vankomycinu u geriatrických pacientů
Authors: H. Suchánková 1,2; K. Lečbychová 3; J. Strojil 1; T. Fürst 4
Authors‘ workplace: Ústav farmakologie, Lékařská fakulta Univerzity Palackého v Olomouci 1; II. interní klinika – gastroenterologická a geriatrická FN Olomouc 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní menocnice Ostrava 3; Katedra matemetické analýzy a aplikací matematiky, Přírodovědecká fakulta Univerzity Palackého v Olomouci 4
Published in: Epidemiol. Mikrobiol. Imunol. 69, 2020, č. 4, s. 172-180
Category: Original Papers
Overview
Východiska a cíle: Farmakoterapie u seniorů vyžaduje individuální přístup zohledňující multimorbiditu pacientů, polypragmazii, vyšší riziko nežádoucích účinků, změny farmakokinetiky a farmakodynamiky. Terapeutické monitorování koncentrací léčiv umožňuje individualizaci dávkování s cílem snížit toxicitu a maximalizovat účinnost léčby. Při terapii vankomycinem je doporučováno rutinně provádět terapeutické monitorování jeho koncentrací. Podle doporučení Rybaka et al. z roku 2009 je pro terapeutické monitorování koncentrací vankomycinu dostačující monitorovat pouze údolní koncentrace, přičemž tato doporučení uvádějí vyšší cílová rozmezí.
Cílem této práce bylo popsat terapeutické monitorování vankomycinu u geriatrických (≥ 65 roků) a negeriatrických pacientů, zhodnotit adekvátnost úprav dávkování založených výhradně na naměřených údolních koncentracích (v porovnání s metodou využívající farmakokinetické modelování s výpočtem AUC) a určit kovariáty umožňující předpovědět optimální iniciální udržovací dávkování vankomycinu u seniorů.
Metodika: Byla provedena retrospektivní analýza všech koncentrací vankomycinu změřených během pětiletého období u pacientů léčených intravenózně vankomycinem ve Fakultní nemocnici Olomouc. Hemodialyzovaní pacienti byli vyloučeni. Koncentrace byly zhodnoceny podle uvedených doporučení a následně s využitím farmakokinetického modelování a výpočtem hodnot AUC24.
Výsledky: Ve studii bylo zhodnoceno celkem 1 458 koncentrací, což představovalo 799 jednotlivých monitorování vankomycinu provedených u 380 pacientů. Nejčastější indikací pro vankomycin byla sepse (41,6 % pacientů). Méně citlivé etiologické agens s hodnotou MIC > 1 mg/l bylo identifikováno u 16,7 % pacientů. Iniciální empirické dávkování bylo optimální ve 37,8 % případů.
Úprava dávkování podle uvedených doporučení Rybaka et al. by se shodovala s doporučením podle farmakokinetického modelování v 65 % případů monitorování. V 19,1 % případů byly údolní koncentrace pod terapeutickým rozmezím podle doporučení Rybaka et al. z roku 2009 navzdory tomu, že hodnoty AUC24/MIC byly dostatečné (≥ 400); v dalších 6,1 % případů by byly supraterapeutické koncentrace klasifikovány jako optimální.
Iniciální dávkování vankomycinu bylo u 62,9 % pacientů 1 g každých 12 hodin, za optimální by však bylo považováno pouze u 32,1 % pacientů. Zatímco pro 48 % pacientů v negeriatrické kohortě by optimální dávkování bylo vyšší (3–4 g denně), pro 56 % geriatrických pacientů by za optimální bylo považováno dávkování nižší (do 1,5 g denně).
Ve farmakokinetickém modelu byla odhadovaná glomerulární filtrace nejvýznamnějším kovariátem umožňujícím tvorbu dávkovacího nomogramu.
Závěr: Úprava dávkování vankomycinu založená na hodnocení pouze údolních koncentrací bez farmakokinetické analýzy může být neadekvátní a vést k supraterapeutickému dávkování u více než čtvrtiny pacientů. Jednoduchý nomogram využívající odhadovanou glomerulární filtraci může zvýšit procento empiricky správně dávkovaných pacientů.
Klíčová slova:
vankomycin – farmakokinetika – farmakodynamika – modelování – TDM – koncentrace – senior
ÚVOD
Infekční choroby představují významný zdroj morbidity a mortality u geriatrické populace. Senioři mají zvýšené riziko infekcí nejen v domácím prostředí a v ústavech ošetřovatelské péče, ale jsou oproti mladší populaci také častěji ohroženi nozokomiálními infekcemi. V těchto případech je mnohdy indikováno podání vankomycinu, který má nezastupitelné místo v terapii infekcí vyvolaných meticilin-rezistentními kmeny stafylokoků, včetně Stafylococcus aureus (MRSA), a v empirické terapii grampozitivních infekcí při nemožnosti užití jiných antibiotik [1, 2].
Řada fyziologických i patologických procesů vyvolává u seniorů změny farmakokinetiky (PK) a farmakodynamiky (PD), které je třeba respektovat při individualizaci dávkování jakožto nedílné součásti racionální farmakoterapie. Důležitým nástrojem umožňujícím v určitých případech optimalizaci dávkování je terapeutické monitorování koncentrací léčiv (Therapeutic Drug Monitoring, TDM), jehož cílem je zvýšit účinnost léčby a zároveň minimalizovat její toxicitu. TDM pomáhá i redukovat náklady na léčebnou péči a v případě antibiotik může omezit rozvoj bakteriální rezistence [3]. Stanovení koncentrace léčiva v krvi je předpokladem pro určení PK parametrů u konkrétního pacienta, na základě kterých je pak možné pomocí PK modelování predikovat optimální individuální dávkování s ohledem na klinickou indikaci. Po případné úpravě dávkování může být provedena kontrola plazmatických koncentrací k potvrzení správnosti predikce.
Při systémové terapii vankomycinem se rutinní provádění TDM ukázalo být účelné a ve svém důsledku ekonomicky výhodné a je jednoznačně doporučováno [4, 5]. Z farmakokineticko-farmakodynamického hlediska je účinnost vankomycinu závislá na expozici. Prediktorem účinnosti je poměr velikosti plochy pod křivkou koncentrace v závislosti na čase (Area Under the concentration-time Curve, AUC) vůči minimální inhibiční koncentraci (MIC) vyvolávajícího patogena. Za cílovou je považována hodnota indexu AUC24/MIC ≥ 400 mg ∙ h/l, vycházející z animálních studií a klinických studií s bakterémií a pneumonií vyvolanou MRSA kmeny [6, 7] a bývá extra-polována i pro další klinické indikace a patogeny citlivé k vankomycinu [4, 8]. Jelikož výpočet AUC24/MIC je obtížný a pro běžnou klinickou praxi nevhodný, pro optimalizaci dávkování vankomycinu se využívá měření plazmatických koncentrací před (údolní koncentrace, Cmin) a po podání (vrcholová koncentrace, Cmax) infuze, přičemž doporučená rozmezí těchto koncentrací jsou odvozena z cílových hodnot parametru AUC24/MIC.
V roce 2009 byla na základě společné iniciativy expertů amerických společností infektologů a farmaceutů vydána doporučení pro TDM vankomycinu u dospělých (dále doporučení Rybaka et al. z roku 2009) [7]. Jejich cílem byla standardizace používání vankomycinu a jeho monitorování ve světle stále narůstající rezistence patogenů. Zásadní inovací bylo doporučení monitorovat pouze Cmin s cílovým rozmezím 15–20 mg/l v případě invazivních infekcí a/nebo méně citlivých patogenů a 10–15 mg/l v ostatních případech. To zvedlo nesouhlasnou vlnu v odborných kruzích, kdy někteří autoři namítali, že hodnota Cmin je nespolehlivým prediktorem AUC24 a tento přístup vystaví pacienty neúměrně vysokému dávkování s vyšším rizikem toxicity [9–11].
Cílem této práce bylo:
a) popsat samotnou praxi TDM vankomycinu ve Fakultní nemocnici Olomouc (FNOL),
b) zhodnotit adekvátnost úprav dávkování založených výhradně na naměřených hodnotách Cmin (v porovnání s metodou využívající PK modelování s kalkulací hodnot AUC24),
c) určit optimální individuální dávkování vankomycinu a identifikovat kovariáty (vysvětlující proměnné) využitelné pro jeho predikci u seniorů.
METODIKA
Terapeutické monitorování vankomycinu ve FNOL
Byla provedena retrospektivní analýza všech plazmatických koncentrací vankomycinu stanovených v průběhu 5 let (leden 2012 až prosinec 2016) u pacientů léčených intravenózně podávaným vankomycinem ve FNOL. Vylučovacími kritérii byla nemožnost zjištění doby odběru s ohledem na dobu podání antibiotika, nedostupnost demografických a klinických údajů potřebných k interpretaci koncentrací vankomycinu a náhrada funkce ledvin v době měření, ať už kontinuálními metodami či intermitentní hemodialýzou.
Z elektronické dokumentace byla získána tato demografická a klinická data pacientů nezbyná pro TDM: věk, výška, tělesná hmotnost, hodnota sérového kreatininu a odhadované glomerulární filtrace, klinická indikace pro vankomycin včetně pravděpodobného vyvolávajícího agens s jeho citlivostí (hodnotou MIC zjištěnou standardní mikrodiluční metodou), dávkování vankomycinu a den antibiotické terapie, kdy byla koncentrace vankomycinu měřena. Následně byla data anonymizována a dále již anonymně zpracovávána. V případě, kdy byla koncentrace měřena před i po podání antibiotika, bylo toto hodnoceno jako jedno terapeutické monitorování.
Studie byla schválena Etickou komisí FNOL č. 183/14 a proběhla v souladu s etickými principy Helsinské deklarace. Všechna data byla získána z nemocničního informačního systému. Odběry vzorků k měření koncentrací byly prováděny na základě indikace ošetřujícího lékaře jako součást standardní péče o pacienty. Vzhledem k non-intervenčnímu retrospektivnímu designu studie nebyl písemný informovaný souhlas požadován.
Adekvátnost úpravy dávkování vankomycinu na základě hodnot Cmin
Aktuální dávkování u daného pacienta bylo klasifikováno podle doporučení Rybaka et al. z roku 2009 s ohledem na koncentraci antibiotika, indikaci a citlivost etiologického agens, a to vždy jako subterapeutické, optimální, anebo supraterapeutické. Následně bylo provedeno u každého pacienta PK modelování s využitím 2-kompartmentového modelu vankomycinu v baysovském programu MW\Pharm++ (verze 1.4, Mediware, Praha) k určení hodnot indexu AUC24/MIC v den monitorování (cílové rozmezí 400–700 mg . h/l pro MIC ≤ 1 mg/l, resp. AUC24 600–800 pro MIC > 1 mg/l) a aktuální dávkování bylo opět klasifikováno do jedné z uvedených kategorií s přihlédnutím k tomu, zda již bylo dosaženo rovnovážného stavu. Byla hodnocena shoda mezi těmito přístupy.
Určení optimálního dávkování vankomycinu
S využitím programu MW\Pharm++ bylo u každého pacienta určeno optimální udržovací dávkování, které by vedlo k cílovým hodnotám AUC24/MIC. Optimální dávkovací režim pro každého pacienta byl nejprve stanoven se zohledněním MIC konkrétního patogena. Následně byl stanoven i pro teoretickou normalizovanou hodnotu MIC = 1 mg/l k očištění od vlivu lokální epidemiologické situace, přičemž jednotlivé dávky byly voleny tak, aby odpovídaly komerčně dostupným přípravkům (0,5 g a 1 g) a aby dávkovací intervaly respektovaly běžně užívanou praxi (6, 8, 12 a 24 h).
Tato data získaná na základě farmakokinetického modelování byla poté zdrojem pro mnohorozměrnou lineární regresi testující výše uvedené demografické a klinické charakteristiky pacientů s cílem identifikovat ty kovariáty, které v klinické praxi za použití jednoduchého nomogramu zvýší pravděpodobnost výběru optimálního dávkování u geriatrické populace.
Statistické metody
K testování normality distribuce dat byl použit Kolmogorovův-Smirnovův test; normálně distribuovaná data pak byla hodnocena pomocí nepárového t-testu, data s nenormálním rozložením pomocí Mannova--Whitneyova U-testu. K identifikaci odlehlých hodnot byl použit Dixonův Q-test. Chí-kvadrát test byl použit k testování ordinálních dat. Hodnoty P < 0,05 byly považovány za signifikantní pro všechny testy. Pro všechny tři cíle byla provedena subanalýza pro negeriatrickou (< 65 let) a geriatrickou (≥ 65 let) populaci.
VÝSLEDKY
Terapeutické monitorování vankomycinu ve FNOL
Během sledovaného období bylo stanoveno celkem 2 054 plazmatických koncentrací vankomycinu, z nichž s ohledem na vstupní a vylučovací kritéria bylo do naší studie zařazeno 1 458 koncentrací, což představovalo 799 jednotlivých monitorování provedených u 380 pacientů. U 17 pacientů jsme zaznamenali během sledovaného období opakovanou terapii vankomycinem s měřením koncentrací; každý cyklus terapie byl hodnocen zvlášť.
V našem souboru bylo 63,4 % mužů a 36,6 % žen (P < 0,001). U negeriatrické kohorty bylo zastoupení mužů 69,2 % vs. 30,8 % žen (P < 0,001); u geriatrických pacientů 58,7 % mužů vs. 41,3 % žen (P = 0,09). Základní charakteristiky pacientů jsou uvedeny v tabulce 1.
Table 1. Demografické, biochemické a klinické charakteristiky pacientů
Table 1. Demographic, biochemical, and clinical characteristics of patients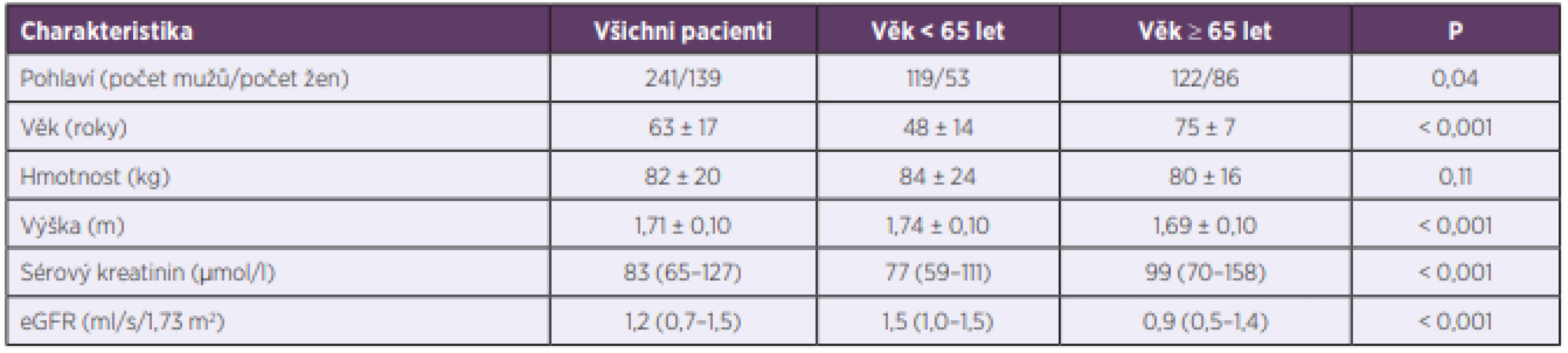
Data jsou vyjádřena jako průměrné hodnoty ± standardní odchylky, resp. mediány (1. – 3. kvartil). P; statistický rozdíl mezi negeriatrickou (< 65 let) a geriatrickou (≥ 65 let) kohortou. eGRF; glomerulární filtrace odhadovaná pomocí rovnice Modification of Diet in Renal Disease.
Data are expressed as the average values ± standard deviations or medians (1st – 3rd quartiles). P; statistical difference between the non-geriatric (< 65 years) and geriatric (≥ 65 years) cohorts. eGFR; estimated glomerular filtration rate according to the modification of diet in renal disease (MDRD) equation.Nejčastější indikací pro podávání vankomycinu byla suspektní či prokázaná sepse/bakterémie, a to u 41,6 % pacientů. Následovaly infekce kůže a měkkých tkání (15 %), artritida/osteomyelitida (12,1 %), pneumonie (7,6 %) a endokarditida (7,3 %). Etiologické agens (včetně stanovení MIC vankomycinu) bylo identifikováno u 89,7 % pacientů (tab. 2); u 16,7 % pacientů šlo o méně citlivé agens s hodnotou MIC > 1 mg/l, přičemž MRSA kmen s MIC > 1 mg/l byl identifikován pouze v jednom případě. Celkově MRSA kmeny představovaly 6,2 % všech izolátů. V případě méně citlivých patogenů (MIC > 1 mg/l) dosáhlo 43 % pacientů terapeutických koncentrací (optimální AUC). Mezi negeriatrickou a geriatrickou kohortou nebyly statisticky významné rozdíly v zastoupení jednotlivých klinických diagnóz a patogenů (P > 0,05) s výjimkou zastoupení kmenů s MIC > 1 mg/l, kde byl rozdíl na hranici významnosti (19,2 % vs. 12,0 %; P = 0,048).
Table 2. Pravděpodobná etiologická agens a jejich minimální inhibiční koncentrace (MIC) vankomycinu ve sledovaném souboru
Table 2. Possible etiological agents and their minimum inhibitory concentrations (MIC) for vancomycin in the study patients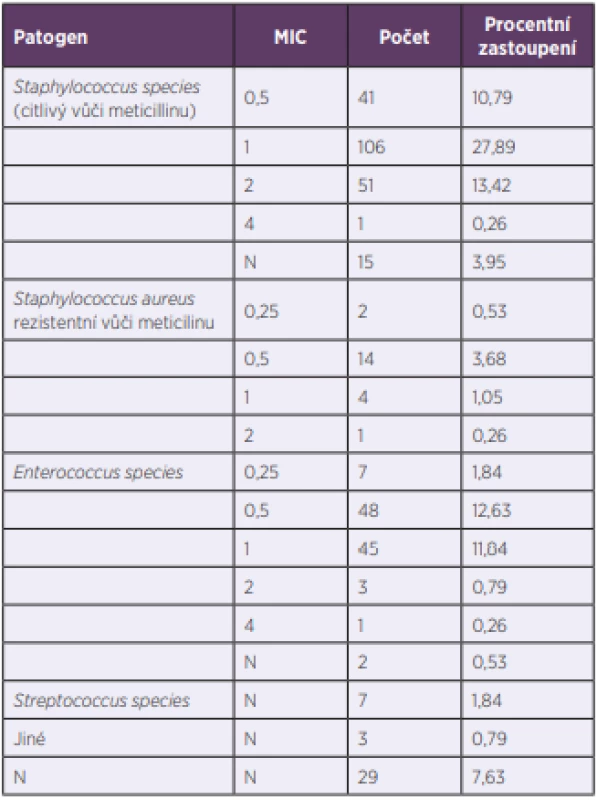
N – nezjištěno
N – not determinedU téměř dvou třetin pacientů (62,9 %) bylo úvodní dávkování vankomycinu 1 g každých 12 hodin. Druhým nejčastějším režimem byl 1 g každých 8 hodin (14,7 %). Další dávkovací režimy, které se vyskytovaly alespoň u 5 % pacientů, byly 1 g každých 24 hodin (7,1 %), 0,5 g každých 8 hodin (6,1 %) a 0,5 g každých 12 hodin (5,5 %). Jiná dávkovací schémata byla užita sporadicky. Vankomycin byl vždy podáván intermitentní infuzí. Pouze jedenácti pacientům byla podána nasycovací dávka.
Koncentrace vankomycinu byla poprvé monitorována nejčastěji druhý (28,7 %), třetí (26,8 %) a čtvrtý (17,6 %) den terapie s průměrem 4,1 ± 3,2 dne. Ojediněle bylo zaznamenáno první měření koncentrací i 20., 21. a 23. den terapie.
Adekvátnost úpravy dávkování vankomycinu na základě hodnot Cmin
Podle doporučení Rybaka et al. z roku 2009 založených na hodnocení pouze údolních koncentrací by bylo dávkování v době monitorování kategorizováno jako subterapeutické v 40,7 % případů, optimální u 23,2 % a supraterapeutické u 36,2 %. S využitím PK modelování pomocí softwaru MW/Pharm++ a kalkulací hodnot AUC24/MIC by bylo dávkování označeno za subterapeutické u 24,4 % monitorování, za optimální u 37,8 % a u zbylých 37,8 % za supraterapeutické (P < 0,001) – obrázek 1.
Image 1. Dávkování vankomycinu v době monitorování koncentrací v prezentovaném souboru
Figure 1. Vancomycin dosing during concentration monitoring in the study cohort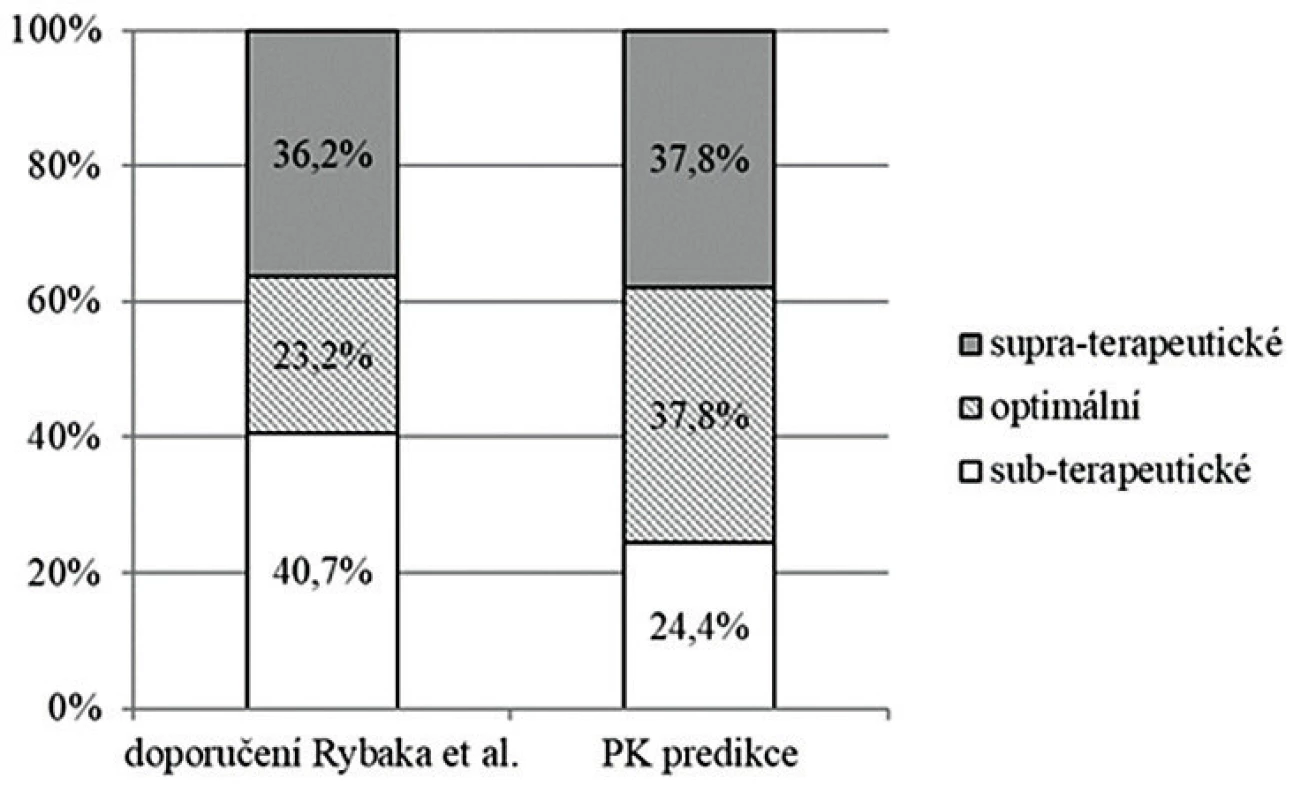
Hodnoceno podle doporučení Rybaka et al. z roku 2009 [7] a podle farmakokinetické predikční analýzy s využitím PK modelování.
PK – farmakokinetický
Assessed based on the guidelines by Rybak et al. from 2009 [7] and pharmacokinetic prediction using PK modelling.
PK – pharmacokineticKategorizace dávkování (a tedy doporučení zvýšit, ponechat či snížit dávkování u konkrétního pacienta) vycházející z doporučení Rybaka et al. z roku 2009 byla shodná s těmi založenými na PK predikci a kalkulaci hodnot indexu AUC24/MIC v 65 % monitorování. V případě neshody měl přístup založený na monitorování pouze Cmin tendenci spíše podhodnocovat skutečnou expozici vankomycinu: v 19,1 % ze všech monitorování byly hodnoty Cmin pod minimálním cílem navrženým uvedenými doporučeními (dávkování by bylo označeno za subterapeutické) navzdory tomu, že expozice vankomycinu byla dostatečná (AUC24/MIC bylo ≥ 400). V dalších 6,1 % případů by byly supraterapeutické koncentrace klasifikovány jako optimální (přístup založený na Cmin by nerozpoznal předávkování). Tendence doporučení Rybaka et al. z roku 2009 podhodnocovat reálnou expozici vankomycinu byla nezávislá na věku pacienta, jak ukazují tabulky 3a-c.
Table 3. Shoda kategorizace dávkování mezi doporučeními Rybaka et al. z roku 2009 [7] a farmakokinetickou (PK) predikcí
Table 3. Agreement in dosage categorization between the guidelines by Rybak et al. from 2009 [7] and pharmacokinetic (PK) prediction![Shoda kategorizace dávkování mezi doporučeními Rybaka et al. z roku 2009 [7] a farmakokinetickou (PK) predikcí<br>
Table 3. Agreement in dosage categorization between the guidelines by Rybak et al. from 2009 [7] and pharmacokinetic (PK) prediction](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1998c6090e381bdba26b7e8ae1e036d2.png)
Šedě stínovaná políčka označují ty pacienty, u kterých doporučení Rybaka et al. z roku 2009 podhodnocují skutečnou expozici vankomycinu.
a) celá populace
b) negeriatrická kohorta (věk < 65 let)
c) geriatrická kohorta (věk ≥ 65 let)
The shaded grey boxes indicate the patients whose actual vancomycin exposure is underestimated by the guidelines by Rybak et al. from 2009.
a) the whole study population
b) non-geriatric cohort (aged < 65 years)
c) geriatric cohort (aged ≥ 65 years)Při hodnocení založeném na odhadované AUC24/MIC byly zaznamenány statisticky významné rozdíly v procentuálním zastoupení jednotlivých kategorií u negeriatrické a geriatrické kohorty pacientů. U negeriatrické populace by bylo dávkování označeno za subterapeutické, optimální, a supraterapeutické u 41,2 %, 34,7 % a 24,0 % monitorování, na rozdíl od geriatrické kohorty, u které byla zastoupení následující: 12,1 %, 40,0 % a 47,8 % (P < 0,001) – obrázek 2.
Image 2. Dávkování vankomycinu v době monitorování koncentrací u negeriatrické (< 65 let) a geriatrické (≥ 65 let) kohorty, hodnoceno pomocí PK predikce s kalkulací hodnot AUC24/MIC
Figure 2. Vancomycin dosing during concentration monitoring in the non-geriatric (< 65 years) and geriatric (≥ 65 years) cohorts, based on PK prediction with the calculation of AUC24/MIC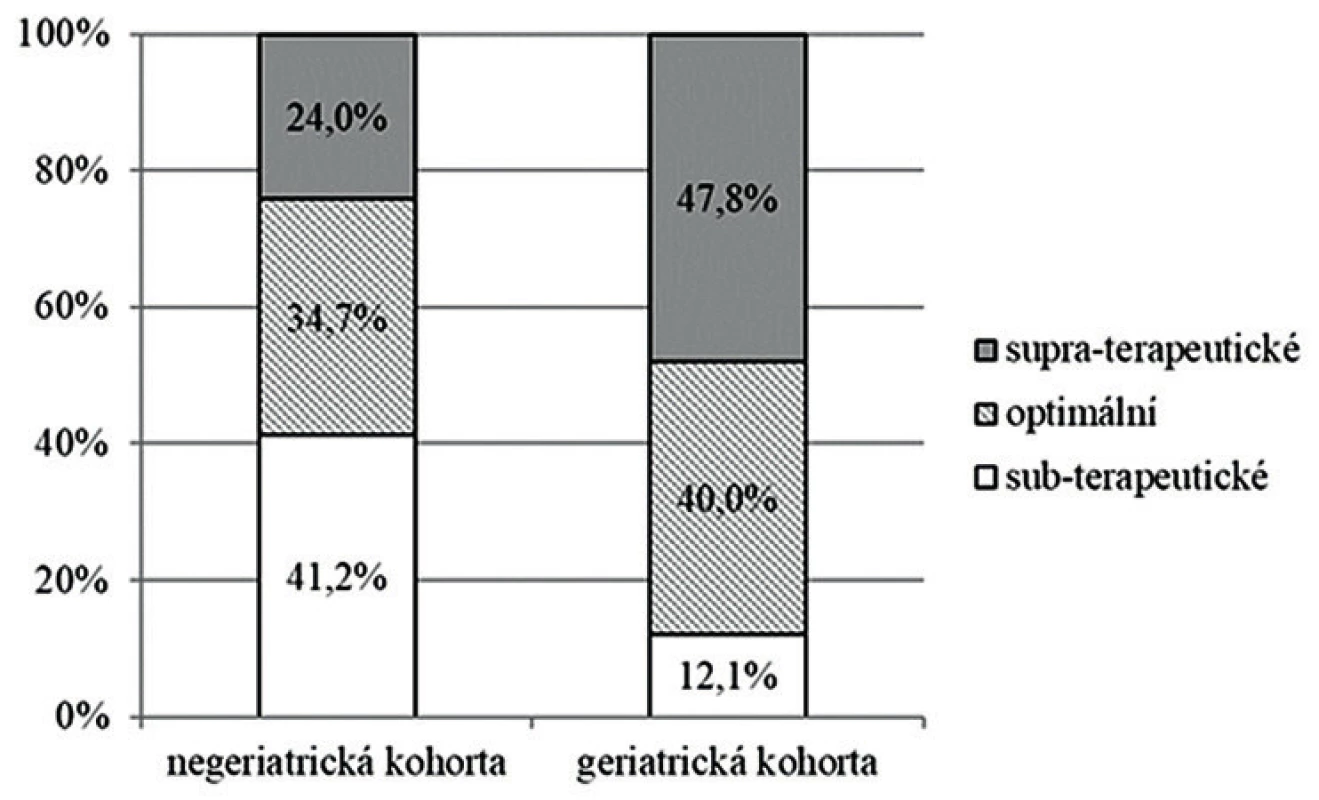
Určení optimálního dávkování vankomycinu
Četnosti reálně podaných dávkovacích režimů u negeriatrické a geriatrické kohorty se významně nelišily (P = 0,10) – obrázek 3. Nejčastějším předepsaným dávkovacím režimem byl 1 g každých 12 hodin, který byl indikován ošetřujícím lékařem u 62,9 % pacientů. Toto dávkování by však vedlo k optimální expozici při zohlednění citlivosti identifikovaného patogena pouze u 32,1 % pacientů.
Image 3. Četnost nejčastějších předepsaných dávkovacích režimů vankomycinu u geriatrické (šedá) a negeriatrické kohorty (červená)
Figure 3. Frequency of vancomycin dosing regimens most often prescribed in the geriatric (grey) and non-geriatric (red) cohorts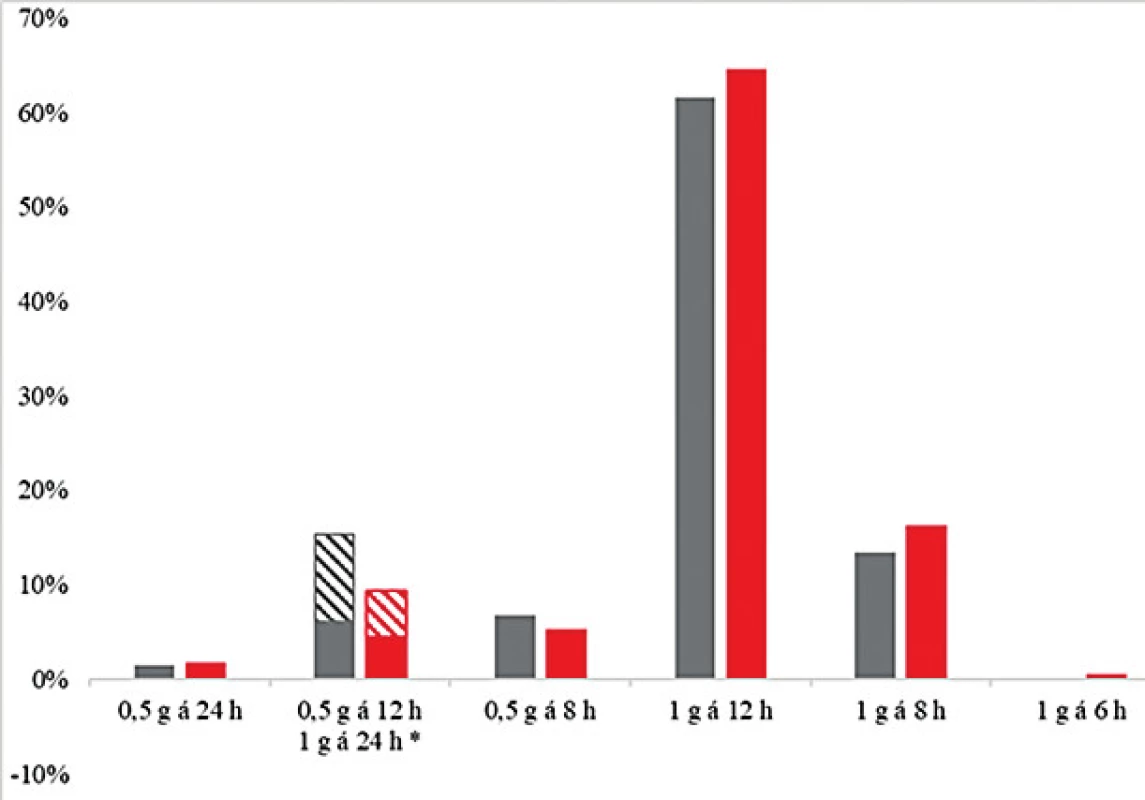
*Dávkovací režimy odpovídající denní dávce 1 gram jsou uvedeny společně, šrafovaná část sloupce reprezentuje dávku 0,5 g každých 12 hodin. Dávkovací režim 1 g každých 6 hodin nebyl použit u žádného geriatrického pacienta.
*Dosing regimens of 1 gram once daily are presented together, the hatched part of the column represents the dose of 0.5 g every 12 hours. The dosing regimen of 1 g every 6 hours was not used in any of the geriatric patients.Graf na obrázku 4 ukazuje srovnání četností optimálních dávkovacích režimů modelovaných pro standardizovanou MIC = 1 mg/l v geriatrické a negeriatrické kohortě, kde jsou již rozdíly zřetelné a statisticky významné (P < 0,001), četnosti dávkovacích režimů pro standardizovanou MIC byly srovnatelné s četností zohledňující reálné MIC [data nezobrazena]. Pro obě kohorty je nejčastěji používané dávkování optimální jen ve třetině případů, ale zatímco pro téměř polovinu (48 %) pacientů v negeriatrické populaci by optimální dávka byla vyšší, tj. 1 g každých 8 nebo 6 hodin, pro nadpoloviční většinu populace geriatrické (56 %) se naopak jako optimální jeví dávka nižší (0,5 g každých 8, 12 nebo 24 hodin). Dávkovací režim 1 g každých 6 hodin nebyl použit u žádného geriatrického pacienta, a stejně tak by v této kohortě nebyl považován za optimální ani v jednom případě.
Image 4. Četnost optimálních dávkovacích režimů modelovaných pro standardizovanou MIC = 1 mg/l v geriatrické (šedá) a negeriatrické kohortě (černá)
Figure 4. Frequency of optimum dosing regimens modelled for a standardized MIC of 1 mg/l in the geriatric (grey) and non-geriatric (black) cohorts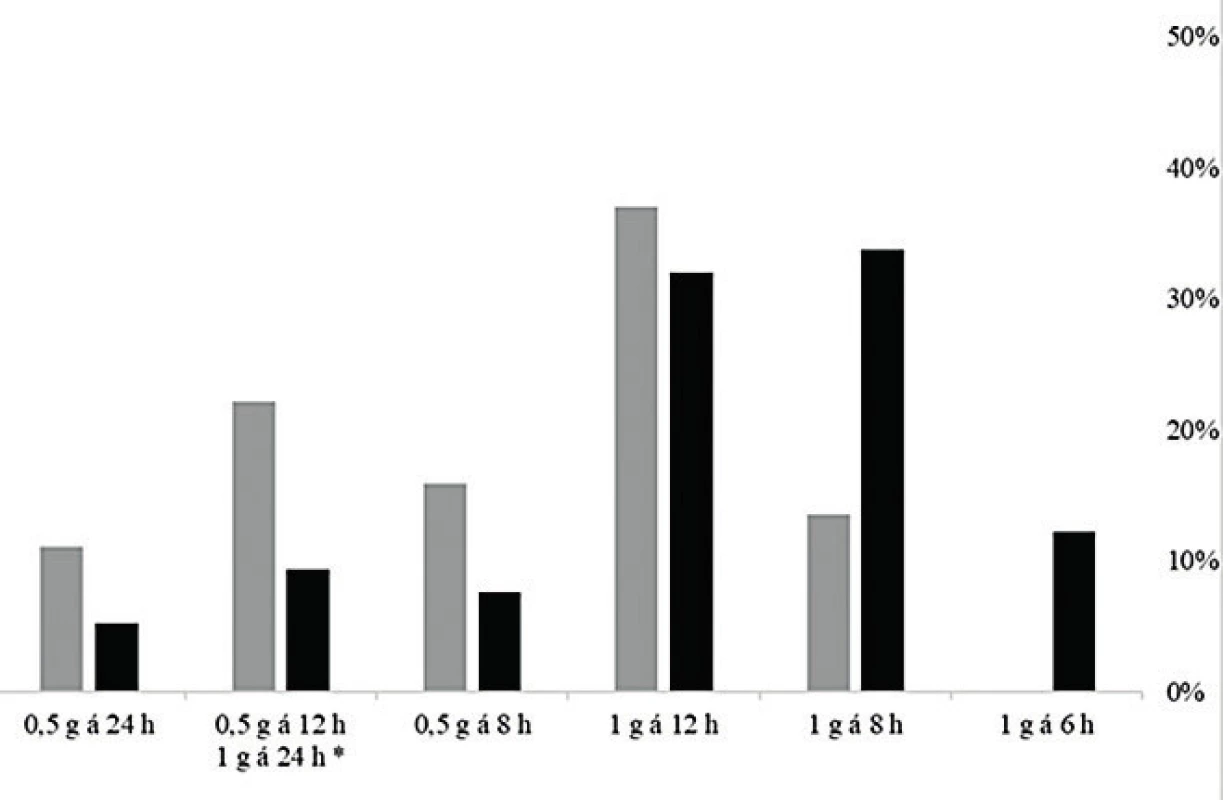
Dávkovací režim 1 g každých 6 hodin by nebyl považován za optimální u žádného geriatrického pacienta.
The dosing regimen of 1 g every 6 hours was not considered as optimal for any of the geriatric patients.Z mnohorozměrné lineární regresní analýzy dat vyplynulo, že na farmakokinetiku vankomycinu měl významný vliv (P < 0,05) věk, pohlaví, výška pacienta a jeho renální funkce; odhadovaná glomerulární filtrace však byla jednoznačně nejvýznamnějším kovariátem (P < 0,001). Iterativním procesem byly ve statistickém modelu eliminovány kovariáty, které nezlepšovaly predikci dávkování, a byly potvrzeny následující vazby: poddávkovaní pacienti byli mladší a vyšší (a to i v rámci obou kohort); šlo o confounding přes odhadovanou glomerulární filtraci (mladší pacienti měli vyšší glomerulární filtraci) a přes pohlaví (ženy byly menší a měly nižší glomerulární filtraci). Hmotnost nehrála významnou roli ve statistickém modelu.
Graf na obrázku 5 ukazuje pro jednotlivé dávkovací režimy rozmezí hodnot odhadované glomerulární filtrace jako surogát clearance kreatininu geriatrických pacientů, u kterých by daný režim vedl k optimální expozici vankomycinu. Na základě kvantifikace popsané závislosti mezi odhadovanou glomerulární filtrací a optimálním dávkováním byl odvozen nomogram pro volbu iniciálního dávkování vankomycinu u geriatrických pacientů, který je uveden v tabulce 4. Interní validace nomogramu ukázala schopnost predikce adekvátního dávkování 50–80 % v závislosti na přísnosti nastavení cílových hodnot PK/PD parametru.
Image 5. Závislost odhadované glomerulární filtrace jako surogátu clearance kreatininu a optimálního dávkování
Figure 5. Dependence of estimated glomerular filtration rate as a surrogate for creatinine clearance and an optimum dosing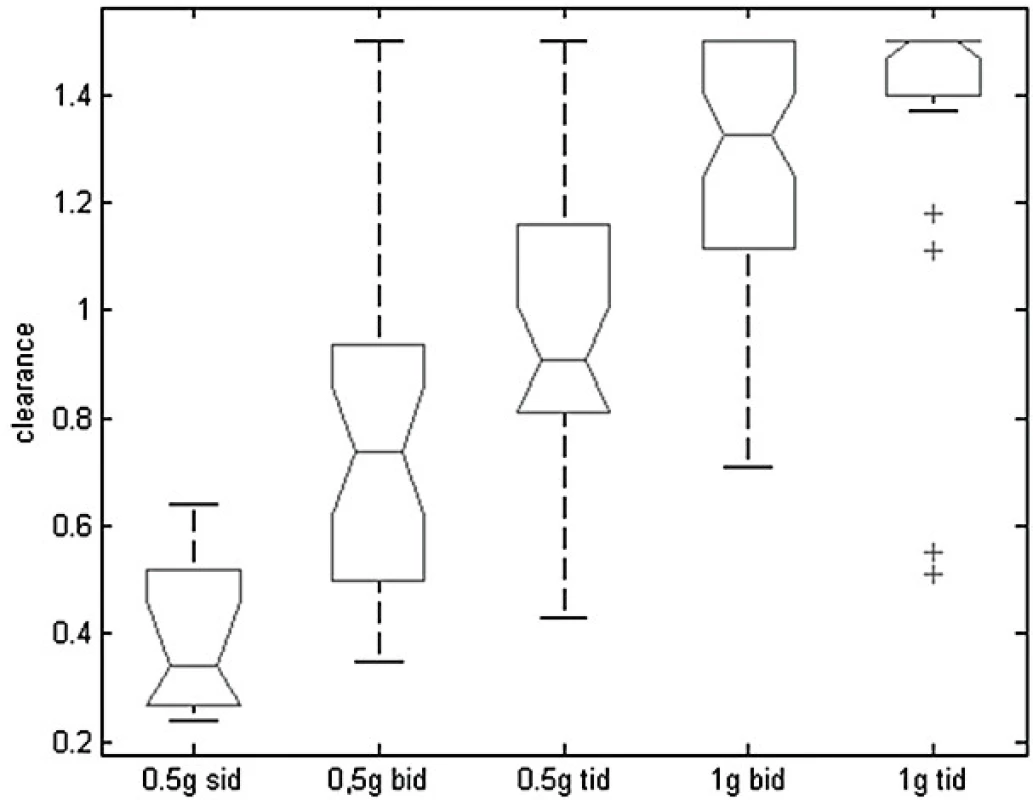
Sid – každých 24 hodin, bid – každých 12 hodin, tid – každých 8 hodin Pro každý dávkovací režim je zobrazen medián (horizontální úsečka), interkvartilní rozmezí (box ohraničený plnou čarou) a rozptyl dat (přerušovaná úsečka). Odlehlé hodnoty jsou označeny křížky.
Sid – every 24 hours, bid – every 12 hours, tid – every 8 hours For each dosing regimen, the median (horizontal segment), interquartile range (box delimited by a continuous line), and dispersion of data (dashed segment) are provided. Outliers are marked with crosses.Table 4. Nomogram pro predikci iniciálního udržovacího dávkování vankomycinu u geriatrických pacientů
Table 4. A nomogram for the prediction of initial vancomycin maintenance dosing in geriatric patients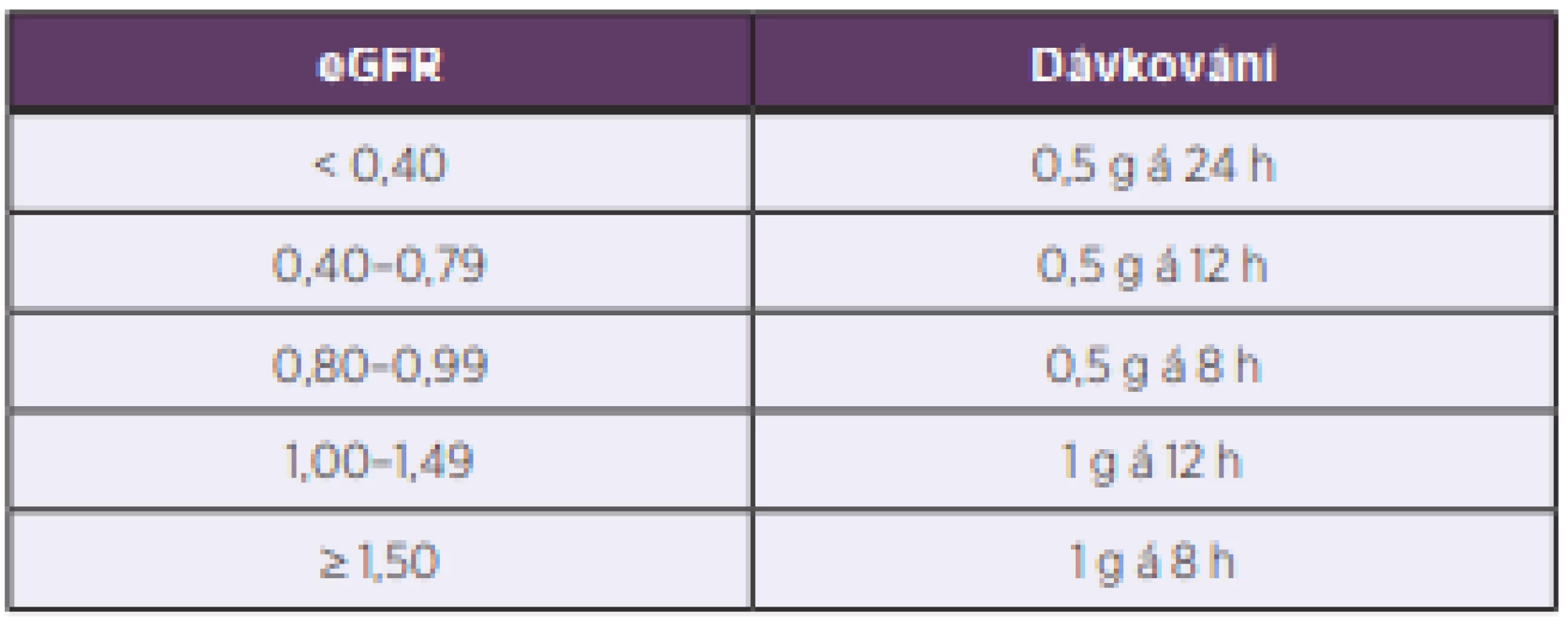
eGFR, odhadovaná glomerulární filtrace podle rovnice Modification of Diet in Renal Disease, uvedeno v ml/s/1,73 m2
eGFR – estimated glomerular filtration rate according to the modification of diet in renal disease (MDRD) equation, in ml/s/1,73 m2DISKUSE
Infekce představují závažné komplikace u geriatrických pacientů a významně se podílejí na mortalitě. Tito pacienti mají oslabený imunitní systém, vyšší prevalenci komorbidit a snížené fyziologické rezervy nutné pro boj s infekcí. Přibližně jedna ze sedmi hospitalizací u seniorů je právě z důvodu infekce. Oproti mladším pacientům bylo u geriatrických pacientů pozorováno významně vyšší riziko rozvoje některých nozokomiálních infekcí (ventilátorové pneumonie, sekundární bakterémie či uroinfekce v terénu permanentního močového katétru); senioři, zejména institucionalizovaní, mají až pětinásobně zvýšené riziko kolonizace a následné infekce kmeny MRSA [1, 12, 13]. Vankomycin je v těchto situacích mnohdy lékem volby.
Terapeutické monitorování vankomycinu bylo původně zavedeno jako metoda sloužící k redukci toxicity. Později byla potvrzena další výhoda, a sice možnost zvýšit účinnosti antibiotika a omezit rozvoj rezistence. Výsledky metaanalýzy z roku 2013 ukázaly, že u pacientů, u kterých bylo prováděno TDM vankomycinu, byla terapie signifikantně častěji klinicky úspěšná a také riziko nefrotoxicity bylo u těchto pacientů signifikantně nižší než u non-TDM skupin [4]. Terapeutické monitorování vankomycinu může také výrazně zkrátit dobu do dosažení cílových koncentrací, snížit počet odběrů a zkrátit délku léčby vancomycinem i délku nemocničního pobytu [8, 14]. Z literárních údajů vyplývá, že empirické dávkování vede k dosažení cílových terapeutických koncentrací pouze u přibližně 40 % pacientů [15, 16], podobně jako se ukázalo v naší práci. Individualizace iniciálního dávkování a rutinní provádění TDM tak mohou zvýšit šance na dosažení cílových hodnot a zkrátit čas k tomu potřebný.
Mezi odbornou veřejností panuje shoda, že z PK/PD hlediska je nejlepším prediktorem účinnosti vankomycinu poměr AUC24/MIC s cílovou hodnotou indexu ≥ 400 mg . h/l pro pneumonie a bakterémie/sepse vyvolané kmeny MRSA [7]. Pro jiné patogeny a klinické indikace vankomycinu jsou data méně robustní a cílová rozmezí tak jasně stanovena nebyla a jsou stále předmětem debat; řada prací uvádí rozmezí stejná [4, 8]. Výpočet AUC není jednoduchý, vyžaduje opakované měření koncetrací léčiva v krátkých časových odstupech s následným určením hodnoty AUC pomocí lineárně-trapezoidální metody. Alternativně lze na základě jedné až dvou změřených koncentrací s vysokou přesností odhadnout AUC, vyžaduje to však buď znalost PK rovnic, nebo optimálně dostupnost bayesovského softwaru, který využívá populační PK modelování [10]. Citovaná skupina amerických expertů proto ve svých doporučeních uvádí, že dávkování vankomycinu by se mělo řídit podle Cmin, neboť tento parametr může dobře nahradit AUC a je jednodušší jej určit [7]. Je však potřeba si uvědomit, že Cmin je jedním bodem na koncentrační křivce na konci dávkovacího intervalu, zatímco AUC odráží průběh celé této křivky, který nemůže samotná Cmin popsat [10].
Neely et al. provedli PK/PD modelování vankomycinu a zjistili, že predikce AUC jen podle Cmin podhodnotila skutečnou AUC o 25 % a s ohledem na interindividuální variabilitu farmakokinetiky u pacientů může být toto číslo v reálné praxi ještě vyšší. Autoři dále uvádějí, že přibližně 50–60 % dospělých pacientů s normálními renálními funkcemi může dosahovat požadovaného parametru AUC24/MIC ≥ 400 mg . h/l i při hodnotách Cmin < 15 mg/l, a pokud by u nich bylo dávkování upravováno pouze podle změřených Cmin, mohli by být vystaveni zbytečně vysokým koncentracím s vyšším rizikem toxicity. Autoři se totiž domnívají, že nejen účinnost vankomycinu je závislá na expozici, ale pravděpodobně i toxicita; její riziko signifikantně narůstá při AUC24 > 700 mg . h/l [11]. V naší práci byly za supraterapeutické považovány hodnoty indexu AUC24/MIC > 700 mg . h/l u kmenů s hodnotami MIC ≤ 1; u méně citlivých kmenů potom AUC24 > 800 mg . h/l [8, 17].
U geriatrických pacientů byl ve studii Fukumoriho et al. pozorován vyšší výskyt nefrotoxicity při Cmin > 15 mg/l, a podle autorů by proto u geriatrických pacientů údolní koncentrace tuto hodnotu neměly přesahovat vůbec [18]. Výsledky dalších klinických studií [8, 15, 19] jsou v souladu se závěry výše zmíněné simulační PK studie [11]. Výsledky naší studie také podporují hypotézu, že hodnocení adekvátnosti aktuálního dávkování jen podle změřených Cmin bez provedení prediktivní PK analýzy může být zavádějící. Během přípravy manuskriptu byla publikována Rybakem et al. nová doporučení, která od úprav dávkování vankomycinu výhradně podle hodnot Cmin již odrazují [17].
V reálné praxi je navíc koncentrace před podáním antibiotika mnohdy odebírána v nestandardní čas, což může vést k neadekvátním úpravám dávkování, je-li změřená koncetrace porovnávána s rozmezím stanoveným striktně pro hodnoty údolních koncentrací [8, 11].
Výhodou parametru AUC24/MIC je také lepší individualizace PK/PD cíle podle lokální epidemiologické situace či individuální citlivosti identifikovaného patogenu. K výběru odpovídající dávky, která s maximální pravděpodobností povede k dosažení stanoveného cíle, je však potřeba zohledit inter - a intraindividuální variabilitu farmakokinetiky vankomycinu u konkrétního pacienta [20].
Distribuční objem vankomycinu závisí na celkové tělesné hmotnosti. Populace seniorů je značně heterogenní, co se hmotnosti a tělesné stavby týče, což ztěžuje volbu správného dávkování. V naší studii nebyl potvrzen vliv hmotnosti na optimální dávkování, což je poněkud v rozporu s teoretickými předpoklady a také s doporučeními pro dávkování vankomycinu (např. [7], souhrny údajů o přípravku [SPC], řada nomogramů), ve kterých vystupuje clearance kreatininu/glomerulární filtrace a hmotnost pacienta. Pravděpodobně je za tento výsledek zodpovědné zkreslení (confounding) prostřednictvím dalších kovariátů, které s hmotností souvisejí (věk, výška, glomerulární filtrace), vzájemné vazby viz výše.
Geriatrická anorexie a malnutrice a také řada komorbidit může u starších pacientů vést ke snížení sérové koncentrace albuminu a tím ke zvětšení distribučního objemu a prodloužení poločasu vankomycinu [21]. S ohledem na charakter zdrojových dat nebylo možné v naší studii vliv sérové koncentrace albuminu na dosažení PK/PD cíle hodnotit.
Renální vylučování je hlavní cestou eliminace vankomycinu; změny renálních funkcí vyvolané věkem a/nebo komorbiditami pacienta mají tedy na farmakokinetiku vankomycinu významný vliv. Obecně lze očekávat u seniorů až 3násobně prodloužený eliminační poločas vankomycinu oproti mladším pacientům [1]. V naší studii byly renální funkce představované hodnotami odhadované clerance kreatininu faktorem nejlépe predikujícím optimální dávkování u konkrétního pacienta. V odborné literatuře je často diskutována otázka, jak hodnotit clearance kreatininu/glomerulární filtraci a zda vůbec je tato vhodným parametrem k posouzení renálních funkcí, obzvláště u nestabilních pacientů, pacientů s extrémní tělesnou hmotností a u seniorů. V naší nemocnici byla v době studie a zčásti stále je standardní metodou užívanou pro odhad glomerulární filtrace rovnice Modification of Diet in Renal Disease, která patří mezi nejběžněji používané, přestože má své limitace [22].
V roce 2018 došlo k aktualizaci SPC léčivých přípravků s obsahem vankomycinu, především co se týká dávkování u dospělé a pediatrické populace. Pro populaci geriatrickou však v SPC žádná doporučení nejsou, přestože je s ohledem na výše diskutované zřejmé, že tito pacienti vyžadují specifický přístup, což naše závěry potvrzují. Hlavním cílem naší práce bylo najít spolehlivou metodu pro určení iniciálního udržovacího dávkování vankomycinu u seniorů, která by zároveň byla co nejjednodušší a uživatelsky přívětivá a použitelná v běžné klinické praxi.
Nasycovací dávky nebylo s ohledem na charakter zdrojových dat možné hodnotit. Velikost nasycovací dávky nicméně primárně závisí na tělesné hmotnosti a je nezávislá na eliminačních parametrech, její určení je tedy v klinické praxi snazší.
Interní validace nomogramu ukázala dobrou schopnost predikce udržovacího dávkování vedoucího k dosažení PK/PD cíle. Následujícím krokem je ověření schopnosti našeho nomogramu predikovat vhodné dávkování na simulované populaci vytvořené pomocí metody Monte Carlo s využitím vhodného populačního modelu a poté prospektivní validace v klinické studii.
ZÁVĚR
Předkládaná práce si kladla za cíl popsat TDM vankomycinu ve Fakultní nemocnici Olomouc, porovnat dvě metody individualizace dávkování podle změřených koncentrací a konečně najít jednoduchý, dostatečně přesný návod pro výběr iniciálního udržovacího dávkování vankomycinu pro geriatrickou populaci pacientů, který by zvýšil šance dosažení terapeutických koncentrací antibiotika v prvních dnech terapie.
Stejná dávka pro všechny je stále zažitou praxí při terapii vankomycinem. Takřka dvě třetiny všech pacientů byly léčeny dávkou 1 g každých 12 hodin, ačkoli tato by byla optimální pouze pro polovinu z nich. Pro nadpoloviční většinu všech geriatrických pacientů by bylo optimální dávkování nižší, u poloviny mladších pacientů naopak vyšší než 2 gramy za den.
Doporučení Rybaka et al. z roku 2009 mají tendenci podhodnocovat skutečnou expozici vankomycinu a často vedou k neadekvátně vysokému dávkování. Přes jejich jednoduchost je tedy nelze považovat za dostatečně spolehlivou alternativu k volbě dávkování pomocí parametru AUC24/MIC.
Na farmakokinetiku vankomycinu mají nejvýznamnější vliv renální funkce, i když vliv věku, pohlaví a výšky pacienta je také významný. Celkově bylo iniciální empirické dávkování optimální jen ve 37,8 % případů. Jednoduchý a uživatelsky příjemný nomogram využívající odhadovanou glomerulární filtraci má potenciál zvýšit procento empiricky správně dávkovaných pacientů až na dvojnásobek.
Zpracováno s institucionální podporou grantu MZ ČR – RVO (FNOL, 00098892) a AZV 17-31540A. Výsledky práce byly zčásti prezentovány na 17th European Congress of Internal Medicine ve Wiesbadenu, Německu, 2018 a na 14th International Congress of the European Geriatric Medicine Society v Berlíně, Německu, 2018.
Autoři děkují MUDr. Martině Machačové, MUDr. Tereze Vavříkové, MUDr. Tereze Filipi a RNDr. Jitce Proškové za asistenci při sběru dat.
Do redakce došlo dne 28. 4. 2020.
Adresa pro korespondenci:
MUDr. Hana Suchánková, Ph.D.
II. interní klinika – gastroenterologická a geriatrická FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: hana.suchankova@fnol.cz
Sources
1. Barber KE, Bell AM, Stover KR, et al. Intravenous Vancomycin Dosing in the Elderly: A Focus on Clinical Issues and Practical Application. Drugs Aging, 2016;33(12):845–854.
2. Solis-Hernandez P, Vidales-Reyes M, arza-Gonzalez E, et al. Hospital-Acquired Infections in Elderly Versus Younger Patients in an Acute Care Hospital. Int J Infect, 2016;3(1):e32620.
3. Eliasson E, Lindh JD, Malmström RE, et al. Therapeutic drug monitoring for tomorrow. Eur J Clin Pharmacol, 2013;69(Suppl 1):25–32.
4. Ye Z-K, Tang H-L, Zhai S-D. Benefits of therapeutic drug monitoring of vancomycin: a systematic review and meta-analysis. PloS One, 2013;8(10):e77169.
5. Tabah A, De Waele J, Lipman J, et al. The ADMIN-ICU survey: a survey on antimicrobial dosing and monitoring in ICUs. J Antimicrob Chemother, 2015;70(9):2671–2677.
6. Moise-Broder PA, Forrest A, Birmingham MC, et al. Pharma-codynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections. Clin Pharmacokinet, 2004;43(13):925–942.
7. Rybak M, Lomaestro B, Rotschafer JC, et al. Therapeutic monitoring of vancomycin in adult patients: a consensus review of the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Diseases Pharmacists. Am J Health-Syst Pharm AJHP Off J Am Soc Health-Syst Pharm, 2009;66(1):82–98.
8. Neely MN, Kato L, Youn G, et al. Prospective Trial on the Use of Trough Concentration versus Area under the Curve To Determine Therapeutic Vancomycin Dosing. Antimicrob Agents Chemother, 2018;62(2): e02042–17.
9. Mizokami F, Shibasaki M, Yoshizue Y, et al. Pharmacodynamics of vancomycin in elderly patients aged 75 years or older with methicillin-resistant Staphylococcus aureus hospital-acquired pneumonia. Clin Interv Aging, 2013;8 : 1015–1021.
10. Pai MP, Neely M, Rodvold KA, et al. Innovative approaches to opti-mizing the delivery of vancomycin in individual patients. Adv Drug Deliv Rev, 2014;77 : 50–57.
11. Neely MN, Youn G, Jones B, et al. Are Vancomycin Trough Concentrations Adequate for Optimal Dosing? Antimicrob Agents Chemother, 2014;58(1):309–316.
12. Videcnik ZJ, Lusa L, Strle F, et al. Bacterial infection in elderly nursing home and community-based patients: a prospective cohort study. Infection, 2013;41(5):909–916.
13. Mouton C, Bazaldua O, Pierce B, et al. Common infections in older adults. Am Fam Physician, 2001;63(2):257–268.
14. Cardile AP, Tan C, Lustik MB, et al. Optimization of time to initial vancomycin target trough improves clinical outcomes. SpringerPlus, 2015;4 : 364.
15. Bel Kamel A, Bourguignon L, Marcos M, et al. Is Trough Con-centration of Vancomycin Predictive of the Area Under the Curve? A Clinical Study in Elderly Patients. Ther Drug Monit, 2017;39(1):83–87.
16. Abulfathi AA, Chirehwa M, Rosenkranz B, et al. Evaluation of the Effectiveness of Dose Individualization to Achieve Therapeutic Vancomycin Concentrations. J Clin Pharmacol, 2018;58(9):1134–1139.
17. Rybak MJ, Le J, Lodise TP, et al. Therapeutic monitoring of vancomycin for serious methicillin-resistant Staphylococcus aureus infections: A revised consensus guideline and review by the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists. Am J Health-Syst Pharm AJHP Off J Am Soc Health-Syst Pharm, 2020;77(11):835–864.
18. Fukumori S, Tsuji Y, Mizoguchi A, et al. Association of the clinical efficacy of vancomycin with the novel pharmacokinetic parameter area under the trough level (AUTL) in elderly patients with hospital-acquired pneumonia. J Clin Pharm Ther, 2016;41(4):399–402.
19. Zahálková J, Strojil J, Petejová N, et al. Dávkování vankomycinu při kontinuální náhradě funkce ledvin. Klin Farmakol Farm, 2011;25(3):116–120.
20. Sera LC, McPherson ML. Pharmacokinetics and pharmacodynamic changes associated with aging and implications for drug therapy. Clin Geriatr Med, 2012;28(2):273–286.
21. Mizuno T, Mizokami F, Fukami K, et al. The influence of severe hypo-albuminemia on the half-life of vancomycin in elderly patients with methicillin-resistant Staphylococcus aureus hospital-acquired pneumonia. Clin Interv Aging, 2013;1323–1328.
22. Šálek T. Odhadovaná glomerulární filtrace dospělých pacientů. Klin Farmakol Farm, 2015;29(4):153–155.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2020 Issue 4-
All articles in this issue
- Severe community-acquired pneumonia in intensive care
- Data from the first wave of Covid-19 from the Central Military Hospital, Prague, Czech Republic
- Individualized dosing of vancomycin in geriatric patients
- MAIT cells, their biological and medical significance
- 29. Pečenkovy epidemiologické dny v Plzni, 2020
- Zomrel prof. MUDr. Štefan Straka, DrSc.
- Health literacy on HIV infection among adolescents in the Czech Republic: a case study of two Czech cities Plzeň and České Budějovice
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Data from the first wave of Covid-19 from the Central Military Hospital, Prague, Czech Republic
- Severe community-acquired pneumonia in intensive care
- Individualized dosing of vancomycin in geriatric patients
- MAIT cells, their biological and medical significance
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

