-
Medical journals
- Career
Výskyt gramnegativních bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc
Authors: Holý Ondřej 1; Matoušková Ivanka 1; Raida Luděk 2
Authors‘ workplace: Ústav preventivního lékařství, Lékařská fakulta Univerzity Palackého v Olomouci 1; Hemato-onkologická klinika, Fakultní nemocnice Olomouc 2
Published in: Epidemiol. Mikrobiol. Imunol. 61, 2012, č. 4, s. 103-109
Overview
Studie s názvem „Surveillance of Infectious Complications in Hemato-Oncological Patients“ probíhala na oddělení 5C Hemato-onkologické kliniky FN Olomouc. Byla zahájena 1. července 2010 s dobou ukončení k 31. srpnu 2011. V tomto období bylo na oddělení hospitalizováno celkem 96 pacientů, z toho bylo 63 pacientů transplantovaných. V 43 případech se jednalo o transplantaci autologní, ve zbývajících případech o transplantaci alogenní. V uvedeném období bylo prováděno monitorování mikrobiální kontaminace prostředí u vybraných povrchů a ovzduší na výše uvedeném oddělení. Současně byla monitorována mikrobiální kontaminace aktuálně přítomného personálu (stěr pravé ruky a vlasů, výtěr z nosu). Z kultivačně prokázaných mikrobiálních agens, byly vybrány gramnegativní oportunně patogenní bakteriální kmeny.
Klíčová slova:
gramnegativní bakterie – imunosuprese – rezistence – biofilmÚVOD
Problematika gramnegativních bakterií jako původců nemocničních infekcí nabývá poslední dobou na významu. Zvláště u imunosuprimovaných pacientů, u nichž právě díky kompromitovanému imunitnímu systému mohou být tyto infekce velmi závažné až fatální. Dalším velmi významným faktorem je nutnost použití centrálních venózních katétrů u těchto pacientů, kdy hrozí zavlečení infekčního agens z povrchu kůže a zároveň zde hraje velmi významnou roli schopnost tvorby biofilmu. Z tohoto vyplývá nutnost neustálého monitorování jak prostředí, ve kterém se pacient nachází, tak i personálu, který pacienta ošetřuje. Infekce se podílejí na úmrtí pacientů po alogenní transplantaci kostní dřeně 17 %, respektive 21 % u autologních transplantací kostní dřeně [1].
Cílem studie bylo zjištění mikrobiální kontaminace prostředí a personálu na oddělení 5C Hemato-onkologické kliniky FN Olomouc pomocí pravidelného měsíčního monitorování. Toto oddělení je koncipováno jako reverzní izolace se 4 izolačními boxy pro pacienty po autologní, alogenní příbuzenské nebo nepříbuzenské transplantaci periferních kmenových buněk nebo kostní dřeně. Základní podmínkou zajištění stanovených parametrů boxů pro reverzní izolaci je fungující vzduchotechnika, která zajišťuje centrálně regulovaný přísun upraveného vzduchu. Popis stavebního rozložení oddělení 5C vychází z technické zprávy; oddělení je označeno jako JIP (4 izolační boxy pacientů a příslušející sociální zařízení) a vše ostatní včetně filtrů před jednotlivými pokoji je označeno jako zázemí JIP, které zahrnuje následující prostory: filtr u každého z pokojů, předsíň (filtr při vstupu na toto oddělení), čisticí místnost, sklad materiálu, kuchyňku, pokoj lékaře, chodbu a sesternu. Pokoje JIP odpovídají třídou čistoty superaseptickému operačnímu sálu, FED-STD-209E (USA) – 10 000. Na sociálním zařízení jednotlivých pokojů JIP je umístěna odsávací vyústka, výměna vzduchu je zajištěna odvodem 150 m3/h a je zajištěn podtlak vůči pokoji JIP a filtru u pokoje JIP. Místnosti zázemí JIP jsou považovány za čisté prostory s třídou čistoty FED-STD-209E (USA) – 100 000.
MATERIÁL A METODIKA
Šetření mikrobiální kontaminace ovzduší, povrchů a personálu na oddělení 5C probíhalo od srpna 2010 do července 2011 formou monitorování v měsíčních intervalech. Na každém odběrovém místě bylo v průběhu studie provedeno celkem 36 odběrů vzorků vnitřního vzduchu a na místě samém byla měřena teplota a relativní vlhkost vnitřního vzduchu přístrojem Testo 625 (GER). Zjišťování mikrobiální kontaminace vnitřního ovzduší bylo provedeno aktivním nasáváním pomocí aeroskopu MERCK-100 (GER). Odběry byly prováděny na krevní agar (Trios, spol. s r. o., CZE), následovala kultivace 48 hodin při 37 °C a kultivací prokázané kolonie byly sečteny. Podle nomogramu jejich konečné počty byly stanoveny pro m3 vnitřního ovzduší.
Kontrola mikrobiální kontaminace povrchů byla provedena stěry z plochy cca 10 x 10 cm sterilní výtěrovkou (CLASSIQSwabsTM, Copan, ITA) smočenou ve sterilním fyziologickém roztoku a následně vložené do zkumavky s 5 ml thioglykolátového bujonu (Trios spol. s r. o., CZE). Kultivace probíhala po dobu 48 hodin při 37 °C, následně bylo provedeno vyočkování na pevnou půdu (krevní agar a Endova půda) (Trios spol. s r. o., CZE) a prokázané bakteriální kmeny ve formě kolonií byly biochemicky identifikovány. U aktuálně přítomného personálu byly provedeny tři stěry (pravá ruka, vlasy a výtěr obou nosních dírek). Kultivace opět probíhala po dobu 48 hodin při 37 °C, následně bylo provedeno vyočkování na pevnou půdu (krevní agar a Endova půda) a prokázané bakteriální kmeny ve formě kolonií byly biochemicky identifikovány. Identifikace probíhala pomocí BD PhoenixTM PID Panel na Phoenix Automated Microbiology System Instrument (USA). Pro stanovení citlivosti na antibiotika byl použit set pro stanovení minimálních inhibičních koncentrací (MIC) standardní mikrometodou v mikrotitrační destičce. Byla použita sestava antibiotik pro gramnegativní bakterie (I. a II. řada ATB) (Trios, spol. s r.o., CZE).
VÝSLEDKY
Mezi nejčastěji izolované gramnegativní bakteriální kmeny patřily Pseudomonas aeruginosa, Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Burkholderia cepacia a Klebsiella pneumoniae. Z dalších lze jmenovat např. Stenotrophomonas maltophilia, Klebsiella oxytoca, popř. Citrobacter freundii. Kompletní seznam izolovaných gramnegativních bakteriálních kmenů uvádějí obrázky 1–3.
Image 1. Počty izolovaných gramnegativních bakteriálních kmenů z prostředí Fig 1. Counts of Gram-negative bacterial strains isolated from the environment 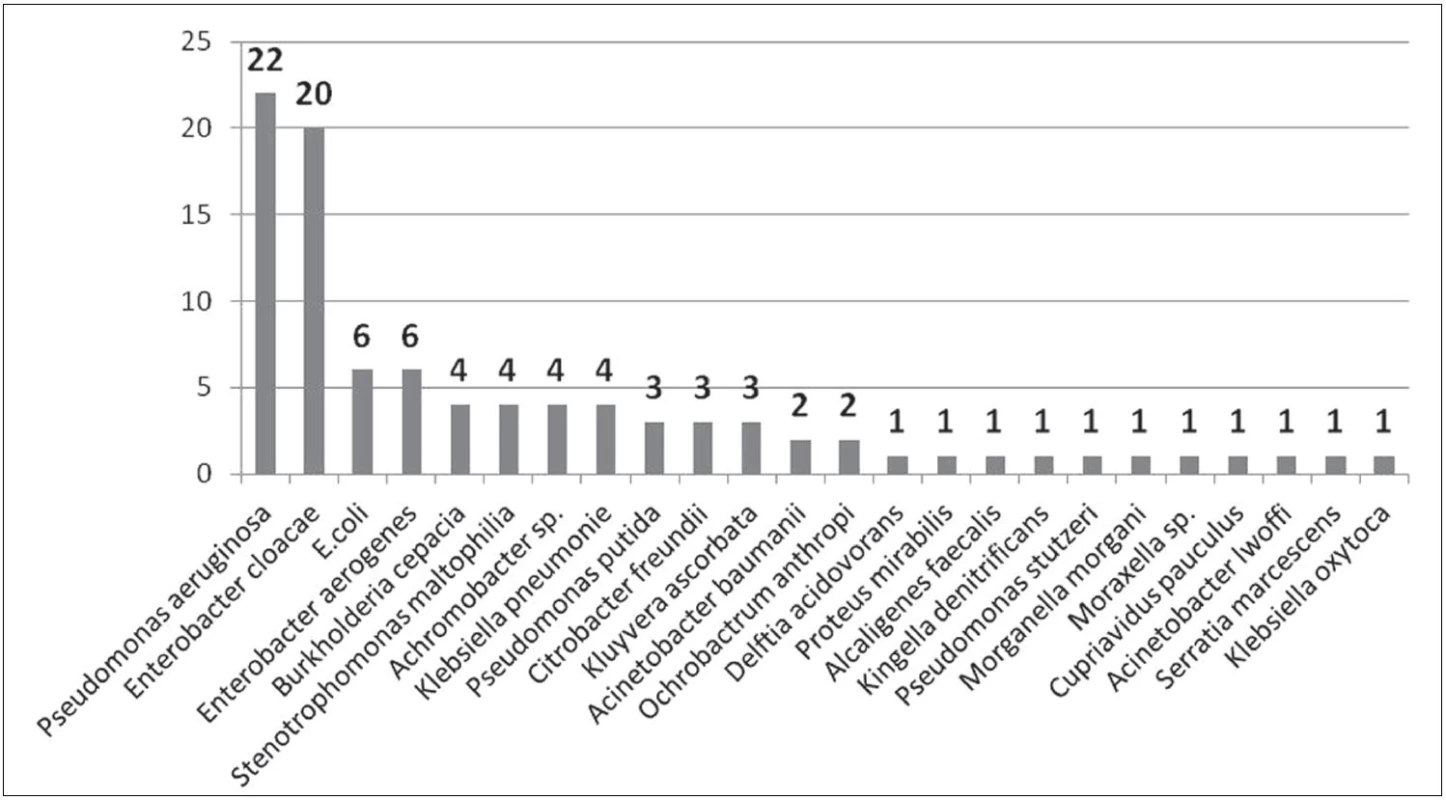
Image 2. Počty izolovaných gramnegativních bakteriálních kmenů z ošetřujícího personálu Fig. 2. Counts of Gram-negative bacterial strains isolated from health care providers 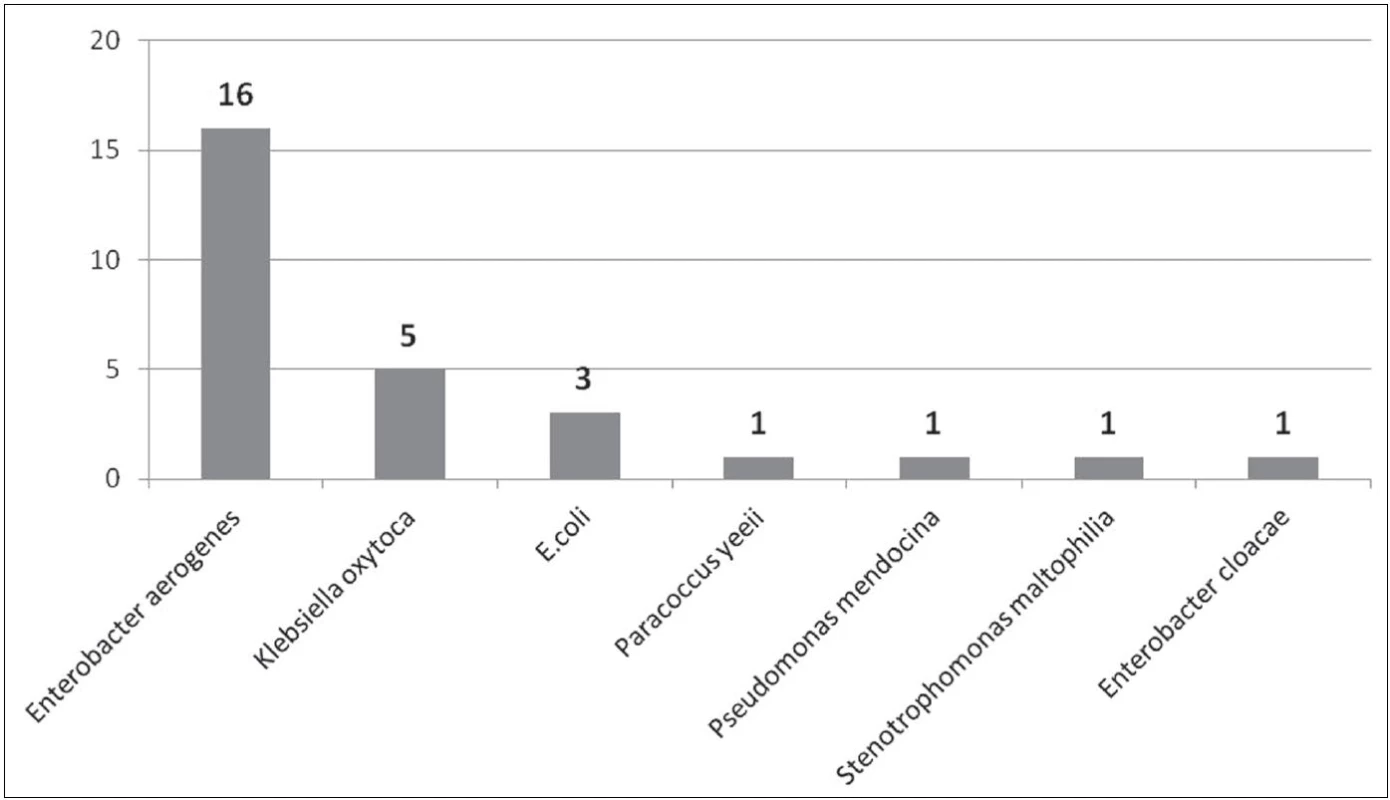
Image 3. Gramnegativní bakterie izolované od ošetřujícího personálu Fig. 3. Gram-negative bacteria recovered from health care providers 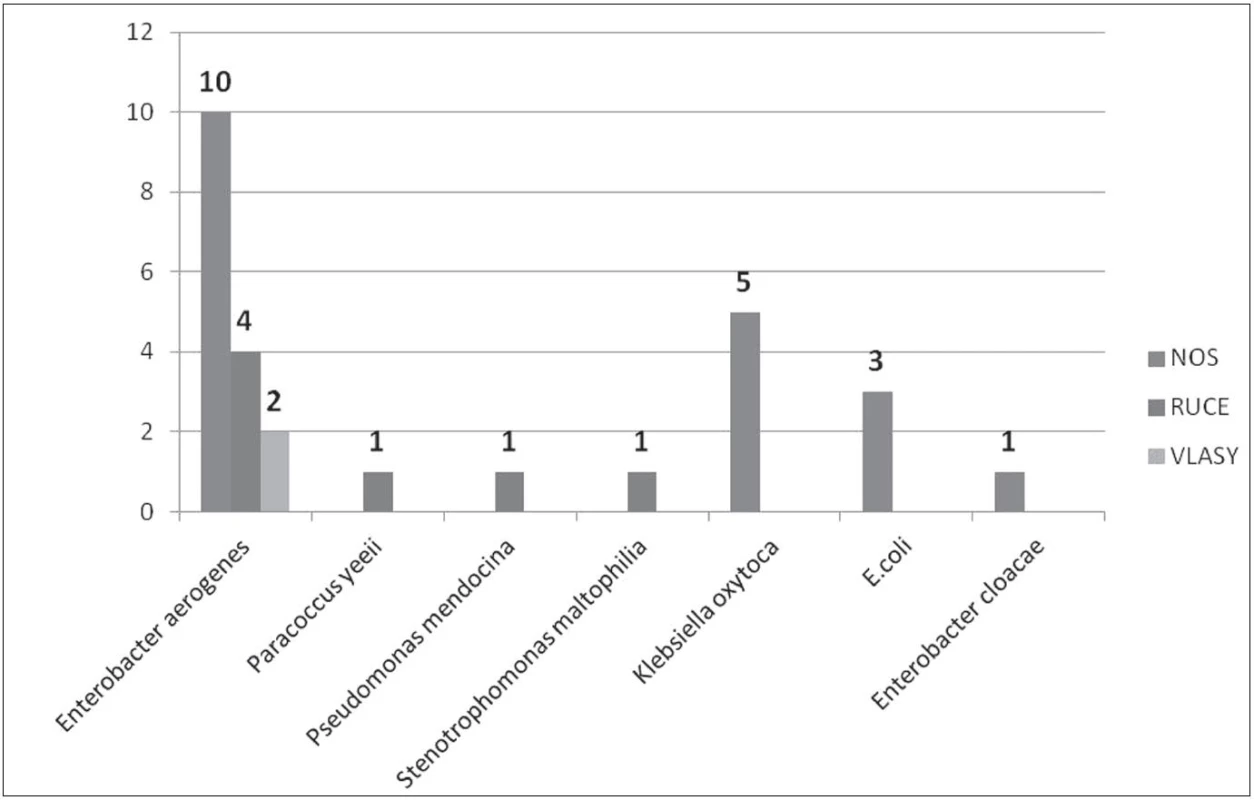
Enterobacter aerogenes
Jedná se o gramnegativní tyčku, oxidáza negativní, kataláza pozitivní, citrát pozitivní, indol negativní, patřící do čeledi Enterobacteriaceae. Enterobacter aerogenes je součástí běžné střevní flóry. U imunosuprimovaných pacientů může vyvolávat závažné bakteriální infekce, jako jsou pneumonie, močové infekce a sepse, zvláště ve spojitosti s centrálními venózními katétry [2]. Významnou vlastností je přirozená rezistence k různým antibiotikům a schopnost tvorby biofilmu [3]. Během naší studie byl tento bakteriální kmen izolován celkem 22krát, přičemž u personálu 16krát a v prostředí 6krát. Na sociálním zařízení vedle pokoje pacienta byl E. aerogenes izolován ze stěru z žebrování elektrického přímotopu, z vnitřku lednice, telefonu u lůžka a výpusti sprchy. U personálu byl E. aerogenes izolován 10krát z nosní sliznice, 4krát z rukou a 2krát z vlasů.
Enterobacter cloacae
Jedná se o pohyblivou kataláza pozitivní, oxidáza negativní gramnegativní tyčku, patřící do čeledi Enterobacteriaceae. Běžně se vyskytuje v půdě a vodě. Je součástí střevní mikroflóry střevního traktu. Původce závažných nemocničních infekcí, nejčastěji močového a respiračního traktu [4]. Případná léčba infekcí vyvolaných tímto bakteriálním agens je komplikována přirozenou rezistencí na antibiotika a zároveň schopnost formovat biofilm [5]. Během naší studie byl tento bakteriální kmen izolován celkem 21krát, přičemž v prostředí to bylo 20krát. Na pokojích pacientů se jednalo 6krát o výpusť sprchy, 2krát o vodu v míse WC a jednou o roztok na zubní kartáček. V zázemí to byl stěr z nesterilních rukavic, výpusť umyvadla na sesterně, ve skladu materiálu a v personálním filtru. Na kuchyňce byl E. cloacae izolován 3krát ve výpusti umyvadla, 2krát v lednici personálu a jednou na houbičce na nádobí. U personálu byl izolován 1krát z nosní sliznice.
Pseudomonas aeruginosa
Je gramnegativní tyčka z čeledi Pseudomonadaceae. Běžně se vyskytuje ve vodě a půdě. Jakožto oportunní patogen je původcem nemocničních infekcí. Podmínkami vzniku onemocnění jsou poruchy fagocytózy, rozsáhlé popáleniny, maligní procesy (hlavně leukémie), podávání cytostatik, imunosupresiv, kortikoidů, dlouhodobé podávání antibiotik, které umožní osídlení rezistentními pseudomonádami, těžké operativní výkony, dlouhodobé zavedení cévních katétrů nebo močových katétrů, diabetes [6, 7, 8]. Závažná je infekce u nemocných s cystickou fibrózou, kdy dýchací cesty jsou kolonizovány mukoidními kmeny s vysokou produkcí proteolytických enzymů [9]. Nemocní umírají na pneumonii bez příznaků septikémie. Ohroženi jsou také novorozenci, zvláště nedonošení (enterokolitida, sepse a meningitida). Z povrchové kolonizace může vzniknout systémové onemocnění. Léčba je komplikována nejen přirozenou rezistencí na antibiotika, ale také významnou schopností tvorby biofilmu [10, 11]. Tento bakteriální kmen byl izolován pouze z prostředí, a to celkem 22krát. Na pokojích pacientů se jednalo 8krát o výpusť sprchy nebo umyvadla, stěr z povrchu křesla, lištový odtah vzduchu, stěr z žebrování elektrického přímotopu a vodu v míse WC. V zázemí se jednalo o výpusť dřezu na kuchyňce pro personál (2krát), výpusť umyvadla na sesterně (2krát), stěry z úklidového nářadí – mopy, stěrky (3krát), výpusť umyvadla ve skladu materiálu, stěr z povrchu telefonu a stěr z láhve na infuze uložené ve skříni. Tyto kmeny byly přirozeně rezistentní na AMP, AMS, AMC a cefalosporiny 1. a 2. generace. Byly však izolovány také multirezistentní kmeny, které byly ze všech testovaných antibiotik citlivé pouze na COL, OFL a CIP.
Pseudomonas putida
Je gramnegativní, aerobní, saprofytická, pohyblivá tyčka z čeledi Pseudomonadaceae, běžně se vyskytující v půdě a vodním prostředí. Kolonizuje rostliny, se kterými je v mutuálním vztahu. P. putida je psychrofilní a nemnoží se při teplotě lidského těla. Význam však spočívá v riziku kontaminace infuzních nebo jiných roztoků [12]. P. putida byla izolována u pacienta s chronickou sinusitidou, dále může vyvolávat např. konjunktivitidu nebo septikémie [13, 14]. Společně s P. aeruginosa byly popsány outbreaky infekcí na odděleních hematoonkologie [15]. P. putida byla izolována celkem 3krát z prostředí. Dvakrát se jednalo o vodu v míse WC na pokoji pacienta a jednou o výpusť umývadla v personálním filtru.
Pseudomonas stutzeri
Gramnegativní, pohyblivá, půdní tyčka z čeledi Pseudomonadaceae, vyskytující se jak v půdním, tak vodním prostředí. Vyskytuje se také v nemocničním prostředí, kde se může uplatňovat jako oportunní patogen, který byl poprvé zachycen jako původce bakteriémie, septikémie, meningitid, endokarditid, pneumonií a infekcí močového traktu [16, 17, 18, 19, 20]. Na rozdíl od P. aeruginosa bývá dobře citlivá na většinu antibiotik. Ovšem kmeny izolované od imunosuprimovaných pacientů byly stejně rezistentní jako kmeny P. aeruginosa [21]. Stejně jako P. aeruginosa má i tento bakteriální kmen schopnosti tvorby biofilmu. Během naší studie byla P. stutzeri izolována 1krát ve výpusti umyvadla čistící místnosti.
Pseudomonas mendocina
Pseudomonas mendocina je gramnegativní, nefermentující tyčka z čeledi Pseudomonadaceae. Poprvé byla izolována v roce 1970 z půdy a vody. Tento environmentální bakteriální kmen je vzácně popisován jako lidský patogen. Byly však popsány případy, kdy byla P. mendocina označena jako původce sepsí a endokarditid [22, 23, 24]. Během našeho šetření byla izolována jednou z rukou osoby ošetřujícího personálu.
Escherichia coli
Jedná se o gramnegativní, fakultativně anaerobní, pohyblivou tyčku, řadící se do čeledi Enterobacteriaceae. Je součástí běžné střevní flóry člověka a slouží jako nejběžnější indikátor fekální kontaminace pitné vody. E. coli je popisována jako původce průjmových onemocnění hlavně u novorozenců, ale také nemocničních infekcí, nejčastěji bakteriémií, infekcí močových cest a pneumonií [25, 26, 27]. U těchto extraintestinálních infekcí je zdrojem bakterií tlusté střevo. Problémem při léčbě je však narůstající rezistence vůči antibiotikům a schopnost formování biofilmy. Během našeho šetření byla E. coli izolována celkem 9krát, přičemž 6krát z prostředí a 3krát od ošetřujícího personálu. V případě prostředí se jednalo 3krát o vodu v míse WC na pokoji pacienta, výpusť umyvadla na pokoji pacienta, stěr z nesterilních rukavic a stěr z vnitřku lednice na pokoji pacienta. U personálu byla E. coli 3krát izolována z nosní sliznice.
Klebsiella pneumoniae
Je gramnegativní, nepohyblivá, fakultativně anaerobní tyčka. Je součástí běžné flóry v ústech a trávicím traktu. Řadí se do čeledi Enterobacteriaceae. Přirozeně se vyskytuje v půdě. Typicky vyvolává pneumonie a infekce močových cest, a to jak v komunitním, tak nemocničním prostředí [28]. Zároveň se uplatňuje jako původce bakteriémií, a to hlavně u imunosuprimovaných pacientů. Mezi nejrizikovější faktory pro akvírování K. pneumoniae a rozvoj infekce byla označena transplantace orgánů, dialýza a onkologická onemocnění [29]. Velmi závažných problémem se jeví narůstající rezistence na antibiotika a také tvorba biofilmu. Během naší studie byla K. pneumoniae izolována 4krát z prostředí. Jednalo se 2krát o výpusť sprchy a vodu v míse WC na pokoji pacienta a výpusť dřezu na kuchyňce personálu.
Klebsiella oxytoca
Jedná o gramnegativní, nepohyblivou tyčku. Po K. pneumoniae jde o druhý nejvýznamnější klinický kmen rodu Klebsiella. Byla popsána jako původce bakteriémií, septických stavů, zvláště u imunosuprimovaných pacientů [30]. Problémem je i v tomto případě narůstající rezistence na antibiotika [31]. K. oxytoca byla v našem případě izolována pouze jednou, a to z povrchu láhve na glukózu uloženou ve skříni.
Burkholderia cepacia
Jedná se o nefermentující gramnegativní bakterii, patřící do čeledi Bukrholderiaceae. Vyskytuje se ve vodě, v půdě a na rostlinách. B. cepacia je spojována s nemocničními infekcemi dýchacích cest, zvláště u pacientů s cystickou fibrózou, ale nejenom s ní [32]. Je přirozeně rezistentní k aminoglykosidům, kolistinu a také běžným dezinfekčním prostředkům [33]. Dalším problémem je schopnost tvorby biofilmu. Během našeho šetření byla B. cepacia izolována celkem 4krát z prostředí. Jednalo se o výpusť sprchy a umyvadla na pokoji pacienta, stěr z vnitřku lednice lékařů a z košíku na přípravu injekcí na sesterně. Tento kmen, kromě přirozených rezistencí na AMP, AMS, AMC, kolistin a cefalosporiny 1. a 2. generace, vykazoval značnou rezistenci na fluorochinolony.
DISKUSE
Všechny námi izolované gramnegativní bakteriální kmeny představují pro imunosuprimované pacienty riziko vzniku infekcí s možnými závažnými až fatálními následky [34].
Jelikož jsme v ovzduší žádnou gramnegativní bakterii neprokázali (všechna šetření byla bez přítomných gramnegativních bakterií), lze předpokládat, že tyto bakterie izolované z vlasů personálu, jsou kontaminací pocházející z rukou. Dále je nutné počítat s tím, že pseudomonády jsou odolné vůči dezinfekčním prostředkům na bázi kvarterních amoniových solí, ve kterých se mohou dokonce i množit [12]. Všichni námi izolovaní zástupci z čeledi Pseudomonaceae jsou v literatuře popsáni jako schopni tvořit biofilmu. Schopnost formovat biofilmu je velmi závažným problémem, a to jak v souvislosti se zavedenými centrálními venózními katétry, tak i s jejich nálezem v prostředí, jako jsou výpusti umyvadel a sprch. Zvyšuje rezistenci jednotlivých bakterií vůči antibiotikům a dezinfekčním prostředkům [10, 11, 35]. V této souvislosti je naprosto nezbytná ne jenom důkladná chemická dekontaminace, ale i mechanická očista, která je jako jediná skutečně účinná proti tvorbě biofilmy. S tím však souběžně souvisí i náležitá antibiotická terapie pacientů, správná implementace sterilizačních metod a dodržování postupů pro kontrolu a prevenci vzniku infekcí. Prostředí těchto oddělení je specifické svým obrovským selekčním tlakem na veškeré mikroorganismy, ať už je způsoben antibiotiky nebo dezinfekčními prostředky. Během studie byly popsány kmeny jednak dobře citlivé na antibiotika, ale i kmeny multirezistentní (např. Pseudomonas aueruginosa, Burkholderia cepacia, Enterobacter cloacae). Jelikož většinou byly tyto kmeny izolovány z vlhkého prostředí, jako např. výpusti sprch a umyvadel, lze předpokládat, že ve zvýšené rezistenci na antibiotika se zde výrazně uplatňuje právě role tvorby biofilmu. Zajímavostí je, že téměř všechny izolované bakteriální kmeny, byly rezistentní na tetracyklin. Obecně lze říci, že kmeny izolovány z prostředí z povrchů, byly více citlivé, než kmeny izolované v místech typu výpusti sprch, umyvadel atd. Za tímto zjištěním může právě schopnost formovat biofilm.
ZÁVĚR
Studie, v souladu se současnými literárními údaji, potvrdila na oddělení 5C Hemato-onkologické kliniky FN Olomouc promořenost personálu a výskyt v prostředí gramnegativních kmenů, přičemž tyto mají schopnost tvorby biofilmu. Tyto kmeny jsou považovány za významné oportunní patogeny, které u imunosuprimovaných pacientů mohou vyvolat život ohrožující infekce, které mohou mít až fatální následky.
Seznam zkratek
AMC – amoxicillin + kyselina klavulanová
AMP – ampicilin
AMS – ampicilin + sulbactam
CIP – ciprofloxacin
COL – kolistin
OFL – ofloxacin
Práce byla podpořena grantovým projektem Research Support Foundation, Vaduz - Surveillance of Infectious Complications in Hemato-Oncological Patients [801100021/39].
Do redakce došlo dne 29. 6. 2012.
Kontaktní adresa:
Mgr. Ondřej Holý
Ústav preventivního lékařství
Lékařská fakulta Univerzity Palackého v Olomouci
Hněvotínská 3
77515 Olomouc
e-mail: holy.ondrej@seznam.cz
Sources
1. Hayes-Lattin, B., Leis, J. F., Maziarz, R. T. Isolation in the allogeneic transplant environment: how protective is it? Bone Marrow Transplant., 2005, 36, p. 373–381.
2. Zhuang, L., Zhou, S., Yuan, Y., Liu, T. et al. Development of Enterobacter aerogenes fuel cells: from in situ biohydrogen oxidization to direct electroactive biofilm. Bioresour Technol., 2011, 102, p. 284–289.
3. Valyshev, A. V., Valysheva, I. V., Geĭde, I. V. [Formation of biofilms by fecal strains of enterobacteria and yeast fungi from Candida genus].[Article in Russian]. Zh. Mikrobiol. Epidemiol. Immunobiol., 2009, 4, p. 44–46.
4. Musil, I., Jensen, V., Schilling, J., Ashdown, B. et al. Enterobacter cloacae infection of an expanded polytetrafluoroethylene femoral-popliteal bypass graft: a case report. J. Med. Case Rep., 2010, 9, p. 131.
5. Kim, S. M., Lee, H. W., Choi, Y. W., Kim, S. H. et al. Involvement of curli fimbriae in the biofilm formation of Enterobacter cloacae. J. Microbiol., 2012, 50, p. 175–178.
6. Rau, M. H., Marvig, R. L., Ehrlich, G. D., Molin, S. et al. Deletion and acquisition of genomic content during early stage adaptation of Pseudomonas aeruginosa to a human host environment. Environ. Microbiol., 2012, 14, p. 2200–2211.
7. Gharabaghi, M. A., Abdollahi, S. M., Safavi, E., Abtahi, S. H. Community acquired Pseudomonas pneumonia in an immune competent host. BMJ Case Rep., 2012, 26.
8. Jefferies, J. M., Cooper, T., Yam, T., Clarke, S. C. Pseudomonas aeruginosa outbreaks in the neonatal intensive care unit - a systematic review of risk factors and environmental sources. J. Med. Microbiol., 2012, 61, p. 1052–1061.
9. Chotirmall, S. H., Smith, S. G., Gunaratnam, C., Cosgrove, S. et al. Effect of estrogen on pseudomonas mucoidy and exacerbations in cystic fibrosis. N. Engl. J. Med., 2012, 366, p. 1978–1986.
10. Morfin-Otero, R., Tinoco-Favila, J., Sader, H., Salcido-Gutierrez, L. et al. Resistance trends in gram-negative bacteria: surveillance results from two Mexican hospitals 2005–2010. BMC Res. Notes, 2012, 5, p. 277.
11. Bridier, A., Briandet, R., Thomas, V., Dubois-Brissonnet, F. Resistance of bacterial biofilms to disinfectants: a review. Biofouling, 2011, 27, p. 1017–1032.
12. Krbková, L. Pseudomonádové infekce. In Beneš, J. Infekční lékařství. Praha: Galén, 2009, s. 250–252.
13. Perz, J. F., Craig, A. S., Stratton, C. W., Bodner, S. J. et al. Pseudomonas putida septicemia in a special care nursery due to contaminated flush solutions prepared in a hospital pharmacy. J. Clin. Microbiol., 2005, 43, p. 5316–5318.
14. Zuberbuhler, B., Carifi, G. Pseudomonas putida infection of the conjunctiva. Infection, 2012, 40, p. 579–580.
15. Aumeran, C., Paillard, C., Robin, F., Kanold, J. et al. Pseudomonas aeruginosa and Pseudomonas putida outbreak associated with contaminated water outlets in an oncohaematology paediatric unit. J. Hosp. Infect., 2007, 65, p. 47–53.
16. Goetz, A., Yu, V. L., Hanchett, J. E., Rihs, J. D. Pseudomonas stutzeri bacteremia associated with hemodialysis. Arch. Intern. Med., 1983, 143, p. 1909–1912.
17. Potvliege, C., Jonckheer, J., Lenclud, C., Hansen, W. Pseudomonas stutzeri pneumonia and septicemia in a patient with multiple myeloma. J. Clin. Microbiol., 1987, 25, p. 458–459.
18. Roig, P., Orti, A., Navarro, V. Meningitis due to Pseudomonas stutzeri in a patient infected with human immunodeficiency virus. Clin. Infect. Dis., 1996, 22, p. 587–588.
19. Stan, R. J., Lim, E. W., Sakazaki, R. Unusual cause of urinary tract infection by Pseudomonas stutzeri in Singapore. Jpn. J. Exp. Med., 1977, 47, p. 311–313.
20. Rosenberg, I., Leibovici, L., Mor, F., Block, C., Wysenbeek, A. J. Pseudomonas stutzeri causing late prosthetic valve endocarditis. J. R. Soc. Med., 1987, 80, p. 457–459.
21. Lalucat, J., Bennasar, A., Bosch, R., García-Valdés, E. et al. Biology of Pseudomonas stutzeri. Microbiol. Mol. Biol. Rev., 2006, 70, p. 510–547.
22. Nseir, W., Taha, H., Abid, A., Khateeb, J. Pseudomonas mendocina sepsis in a healthy man. Isr. Med. Assoc. J., 2011, 13, p. 375–376.
23. Suel, P., Martin, P., Berthelot, G., Robaday, S. et al. [A case of Pseudomonas mendocina endocarditis]. [Article in French]. Med. Mal. Infect., 2011, 41, p. 109–110.
24. Mert, A., Yilmaz, M., Ozaras, R., Kocak, F., Dagsali, S. Native valve endocarditis due to Pseudomonas mendocina in a patient with mental retardation and a review of literature. Scand. J. Infect. Dis., 2007, 39, p. 615–616.
25. Uvizl, R., Hanulik, V., Husickova, V., Sedlakova, M. H. et al. Hospital-acquired pneumonia in ICU patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2011, 155, p. 373–378.
26. Gaytán-Martínez, J., Mateos-García, E., Sánchez--Cortés, E., González-Llaven, J. et al. Microbiological findings in febrile neutropenia. Arch. Med. Res., 2000, 31, p. 388–392.
27. Garnica, M., Maiolino, A., Nucci, M. Factors associated with bacteremia due to multidrug-resistant Gram-negative bacilli in hematopoietic stem cell transplant recipients. Braz. J. Med. Biol. Res., 2009, 42, p. 289–293.
28. Magliano, E., Grazioli, V., Deflorio, L., Leuci, A. I. et al. Gender and age-dependent etiology of community-acquired urinary tract infections. ScientificWorldJournal, 2012, [Epub].
29. Linares, L., Cervera, C., Hoyo, I., Sanclemente, G. et al. Klebsiella pneumoniae infection in solid organ transplant recipients: epidemiology and antibiotic resistence. Transplant. Proc., 2010, 42, p. 2941–2943.
30. Al-Anazi, K. A., Al-Jasser, A. M., Al-Zahrani, H. A., Chaudhri, N. et al. Klebsiella oxytoca bacteremia causing septic shock in recipients of hematopoietic stem cell transplant: Two case reports. Cases J., 2008, 18, p. 160.
31. Decré, D., Burghoffer, B., Gautier, V., Petit, J. C. et al. Outbreak of multi-resistant Klebsiella oxytoca involving strains with extended-spectrum beta-lactamases and strains with extended-spectrum activity of the chromosomal beta-lactamase. J. Antimicrob. Chemother., 2004, 54, p. 881–888.
32. Ondrovcík, P., Svoboda, J., Woznicová, V. [Elastase activity of gram-negative non-fermenting bacteria and two variations of a simple method for their detection]. [Article in Czech]. Epidemiol. Mikrobiol. Imunol., 1999, 48, p. 117–121.
33. Hanulik, V., Chroma, M., Webber, M. A., Uvizl, R. et al. Záchyt kmenů Burkholderia cepacia komplex ve Fakultní nemocnici Olomouc. Klin. Mikrobiol. Infek. Lek., 2012, 18, s. 4–8.
34. Ram, R., Farbman, L., Leibovici, L., Raanani, P., et al. Characteristics of initial compared with subsequent bacterial infections among hospitalised haemato-oncological patients. Int. J. Antimicrob. Agents, 2012, 40, p. 123–126.
35. Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol. Rev., 2012, 36, p. 893–916.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2012 Issue 4-
All articles in this issue
- Vrozený zarděnkový syndrom – kazuistika
- Výskyt gramnegativních bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc
- Výskyt gramnegativních nefermentujících bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc
-
Třicet let od popsání prvních případů AIDS – historie a současnost
Část III. - Mikrobiálna dekontaminácia koreňových kanálikov devitálnych zubov
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mikrobiálna dekontaminácia koreňových kanálikov devitálnych zubov
- Vrozený zarděnkový syndrom – kazuistika
- Výskyt gramnegativních nefermentujících bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc
- Výskyt gramnegativních bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

