-
Medical journals
- Career
Laboratórna diagnostika pandemickej chrípky na Odbore lekárskej mikrobiológie Regionálneho úradu verejného zdravotníctva so sídlom v Banskej Bystrici v sezóne 2009/2010
Authors: R. Kissová; L. Maďarová; C. Klement
Authors‘ workplace: Regionálny úrad verejného zdravotníctva so sídlom v Banskej Bystrici, Odbor lekárskej mikrobiológie
Published in: Epidemiol. Mikrobiol. Imunol. 60, 2011, č. 1, s. 32-37
Overview
Odbor lekárskej mikrobiológie na Regionálnom úrade verejného zdravotníctva v Banskej Bystrici pracuje ako spádové virologické laboratórium pre stredoslovenský a v chrípkovej sezóne 2009/2010 aj pre východoslovenský región.
Materiál a metódy:
Vzorky (nazofaryngálne výtery a pitevné materiály) boli odoberané od sentinelových aj nesentinelových lekárov, od pacientov so suspektným chrípkovým ochorením. Vzorky boli vyšetrované rýchlotestom a následne RT-PCR metódou na diagnostiku chrípky A, resp. B. Na subtypizáciu pandemickej chrípky A/H1N1 bola použitá real-time PCR metóda.Výsledky:
Od mája 2009 do júna 2010 laboratórium vyšetrilo 2497 vzoriek na prítomnosť vírusov chrípky A a B a predovšetkým na prítomnosť pandemickej chrípky A/H1N1. Z 589 vzoriek pozitívnych na chrípku A bolo 537 vzoriek subtypizovaných ako pandemická chrípka A/H1N1. Predstavuje to 21,5 % zo všetkých vyšetrených vzoriek a 91,2 % zo vzoriek pozitívnych na chrípku A.Záver:
V chrípkovej sezóne 2009/2010 na strednom a východnom Slovensku jednoznačne dominovala nová pandemická chrípka A/H1N1. PCR metódy sa stali kľúčovými pri vyšetrovaní pacientov s podozrením na pandemickú chrípku v laboratóriu zapojenom do surveillance chrípky a chrípke podobných ochorení v SR.Kľúčové slová:
pandemická chrípka A/H1N1 – respiračné vírusy – PCR diagnostika – surveillance chrípky.Úvod
Chrípková sezóna 2009/2010 sa niesla v znamení novej pandemickej chrípky A/H1N1, ktorá sa prvýkrát objavila v Mexiku a v Kalifornii (USA) koncom marca 2009 a postupne sa rozšírila do celého sveta. Väčšina prípadov novej chrípky sa vyskytla u inak zdravých ľudí mladšieho a stredného veku, čo je odlišná situácia od sezónnej chrípky. Laboratórne bol vírus identifikovaný ako nový podtyp chrípkového vírusu A/H1N1, ktorý je kombináciou prasacieho, vtáčieho a ľudského vírusu chrípky. Chrípkový kmeň dostal názov A/California/7/2009 (H1N1) – pandemic virus [3, 4, 5, 9, 18]. Dňa 28. 5. 2009 bol na Slovensku laboratórne potvrdený prvý prípad nového chrípkového vírusu. Dňa 11. 6. 2009 vyhlásila Svetová zdravotnícka organizácia (ďalej SZO) pandemickú fázu č. 6, najvyšší stupeň pandémie. Vyhlásenie tohto stupňa pandemickej pohotovosti bolo podmienené predovšetkým rýchlym šírením infekcie a nárastom počtu infikovaných vo svete [5, 19].
Oddelenia virológie a molekulárnej biológie na odbore lekárskej mikrobiológie Regionálneho úradu verejného zdravotníctva v Banskej Bystrici (ďalej OLM RÚVZ) pracujú ako spádové laboratóriá pre celý stredoslovenský región v rámci virologickej surveillance chrípkových vírusov v SR [10]. V 2. polovici roka 2009 a v roku 2010, v súvislosti s objavením sa novej chrípky, sa vyšetrovali nazofaryngálne výtery od sentinelových lekárov, infekčných oddelení, oddelení intenzívnej starostlivosti, ako aj vzorky pitevných materiálov z okresov Banskobystrického, Žilinského, Košického a Prešovského kraja, t. j. pre regióny stredného a východného Slovenska [10, 16].
Materiál a metódy
Materiál
Najčastejšie vyšetrovaným materiálom boli nazofaryngálne výtery, odobraté do odberového média, na detekciu, resp. izoláciu vírusov chrípky [6, 10, 17].
Pitevný materiál (časti trachey, bifurkácie bronchov a pľúc z okraja zápalového ložiska, prípadne z mozgu z okolia komôr s ependýmom, pečene a sleziny) bol odoberaný od zomretých na akútne respiračné ochorenie [2, 16].
Odberové súpravy pripravovalo a dodávalo príslušné laboratórium. Odber pitevného materiálu a iných druhov biologického materiálu (spútum, bronchoalveolárna laváž) sa vykonával po dohode s laboratóriom, v súlade s doporučeniami Národného referenčného centra pre chrípku (NRC pre chrípku) a podľa manuálu SZO [16, 17, 19].
Metódy
Vzorky sa vyšetrovali rýchlotestom a definitívne potvrdenie výsledku u všetkých vzoriek poskytli RT-PCR, resp. real--time PCR metódy, ktoré umožňujú detegovať vírusy chrípky typu A a B aj jednotlivé subtypy chrípky typu A [8, 10, 11, 12, 15, 19]. Uvedené metódy boli používané na základe doporučení NRC pre chrípku.
V laboratóriu OLM RÚVZ v Banskej Bystrici sa vykonávala konvenčná RT-PCR na detekciu chrípky typu A a B ako aj real-time PCR na dôkaz prítomnosti novej pandemickej chrípky A/H1N1.
Izolácia nukleových kyselín sa vykonávala pomocou High Pure Viral Nucleic Acid Isolation Kit (Roche).
Na dôkaz prítomnosti RNA vírusov chrípky sa používali komerčne dodávané diagnostické súpravy Amplisens® Influenza A + B (Interlabservice, Ukrajina). Na priebeh samotnej reakcie sa používal Hybaid PCR express thermal cycler© firmy Hybaid Limited. Po ukončení amplifikácie sa vzniknuté PCR produkty analyzovali pomocou UV svetla po prebehnutí elektroforézy v agarózovom géle. Výsledok jedného zo stanovení je znázornený na obr. 1. Alternatívou bola diagnostická súprava Argene Influenza A + B (Argene, Francúzsko) na real--time PCR. V tomto prípade real-time PCR prebiehala na prístroji Light Cycler© firmy Roche.
Image 1. Vyhodnotenie vyšetrenia RT-PCR, po prebehnutí elektroforézy v agarózovom géle, na prítomnosť vírusov chrípky typu A a B Neznáma vzorka označená číslom 1 bola negatívna na prítomnosť vírusu chrípky typu B a zároveň pozitívna na prítomnosť vírusu chrípky typu A, bez bližšej identifikácie. Následne bola u tejto vzorky vykonaná real-time PCR na potvrdenie prítomnosti pandemickej chrípky typu A/ H1N1. Vzorka č. 2 bola negatívna na prítomnosť vírusov chrípky typu A aj B. Popis jednotlivých dráh: 1 – neznáma vzorka, chrípka A; 2 – negatívna kontrola, chrípka A; 3 – pozitívna kontrola, chrípka A; 4 – neznáma vzorka, chrípka B; 5 – negatívna kontrola, chrípka B; 6 – pozitívna kontrola, chrípka B; 7 – molekulový štandard Fig. 1. Evaluation of RT-PCR analysis, following agarose gel electrophoresis, for the detection of type A and B influenza viruses. The unknown specimen numbered 1 was influenza B virus negative while influenza A virus positive, without further identification. Subsequently, the specimen was tested by real-time PCR for the confirmation of pandemic influenza A/H1N1. Specimen 2 was influenza A and B virus negative. Lanes: 1 – unknown specimen, influenza A; 2 – negative control, influenza A; 3 – positive control, influenza A; 4 – unknown specimen, influenza B; 5 – negative control, influenza B; 6 – positive control, influenza B; 7 – molecular standard 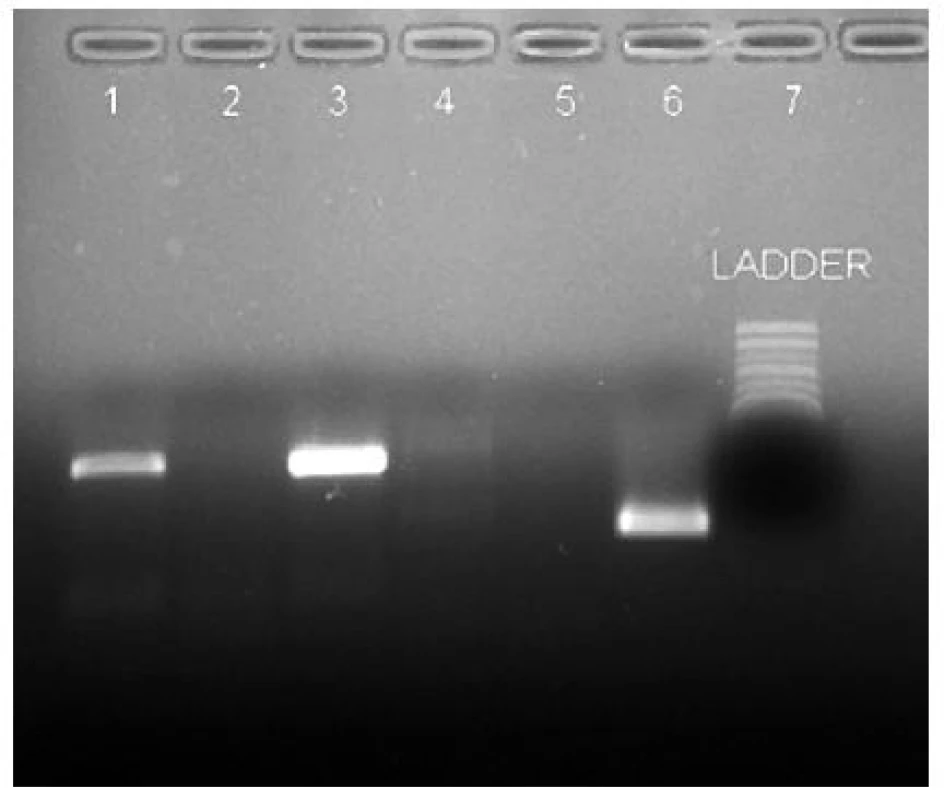
Na bližšiu identifikáciu subtypu novej pandemickej chrípky A/H1N1 sa vykonávala real-time PCR, pomocou testov Invitrogen A/H1N1 a Invitrogen Superscript III RT-Platinum (Invitrogen, California), na prístroji Light Cycler firmy© Roche, resp. CFX96 firmy BioRad [8, 11, 13, 19]. Pomocou real--time PCR sa dokazovala prítomnosť 4 génov pomocou rôznych primerov a sond:
- vnútorná kontrola priebehu real-time PCR;
- primery a sondy dokazujúce prítomnosť vírusu chrípky typu A;
- primery a sondy dokazujúce prítomnosť prasacej chrípky typu A (SwA);
- primery a sondy dokazujúce prítomnosť prasacej chrípky typu A/H1 (SwH1) [21].
Priebeh každej reakcie bol kontrolovaný použitím pozitívnej a negatívnej kontroly. Ako pozitívna kontrola slúžila RNA izolovaná z pandemického typu vírusu chrípky A/H1N1, potvrdená v NRC pre chrípku na Úrade verejného zdravotníctva Slovenskej republiky (ÚVZ SR) v Bratislave. Ako negatívna kontrola bola použitá deionizovaná H2O určená na PCR. Vzorka bola pozitívna v prípade pozitívneho merania zaznamenaného počas vyšetrenia vnútornej kontroly, génu pre chrípku typu A a aspoň jedného génu charakteristického pre pandemickú chrípku. Pozitívne meranie sa prejavilo nárastom fluorescenčných kriviek. U negatívnych vzoriek musel byť zaznamenaný nárast fluorescencie v prípade vyšetrenia vnútornej kontroly, všetky ostatné gény boli neprítomné a teda meranie bolo negatívne, fluorescenčné krivky boli lineárne. Priebeh jedného z vyšetrení je znázornený na obr. 2.
Image 2. Vyhodnotenie vyšetrenia vzoriek pomocou real-time PCR na dôkaz prítomnosti vírusu chrípky typu A/ H1N1 pandemickej. Počas amplifikácie dochádza ku nárastu fluorescenčných kriviek u vyšetrovanej vzorky číslo 1 ako aj u pozitívnej kontroly, meranie je pozitívne, čo dokazuje prítomnosť génov chrípky typu A/H1N1 pandemickej. Naopak, v prípade vyšetrenia vzorky 2 ako aj v prípade negatívnej kontroly fluorescenčné krivky sú lineárne, čo vylučuje prítomnosť génov chrípky typu A/H1N1 pandemickej. U vnútornej kontroly vzorky 1 došlo k nárastu fluorescencie, čo potvrdzuje správny priebeh real-time PCR. 1 – PK vnútorná kontrola; 2 – PK chrípka typu A; 3 – PK SwA; 4 – PK SwH1; 5 – vzorka 1 vnútorná kontrola; 6 – vzorka 1 chrípka typu A; 7 – vzorka 1 SwA; 8 – vzorka 1 SwH1; 9 – vzorka 2 vnútorná kontrola; 10 – vzorka 2 chrípka typu A; 11 – vzorka 2 SwA; 12 – vzorka 2 SwH1; 13 – NK vnútorná kontrola; 14 – NK chrípka typu A; 15 – NK SwA; 16 – NK SwH1 Fig. 2. Evaluation of results of real-time PCR for the detection of A/ H1N1 pandemic influenza virus. Amplification results in increase in fluorescence curves for both specimen 1 and positive control, measurement is positive, which indicates the presence of the genes of the A/H1N1 pandemic influenza virus. Conversely, both specimen 2 and negative control yield linear lines which exclude the presence of the genes of the A/H1N1 pandemic influenza virus. The specimen 1 internal control showed increase in fluorescence which indicates that the real-time PCR is performed properly. 1 – positive control, internal control; 2 – positive control, type A influenza; 3 – positive control, SwA; 4 – positive control, SwH1; 5 – specimen 1 internal control; 6 – specimen 1 type A influenza; 7 – specimen 1 SwA; 8 – specimen 1 SwH1; 9 – specimen 2 internal control; 10 – specimen 2 type A influenza; 11 – specimen 2 SwA; 12 – specimen 2 SwH1; 13 – negative control, internal control; 14 – negative control, type A influenza; 15 – negative control, SwA; 16 – negative control, SwH1 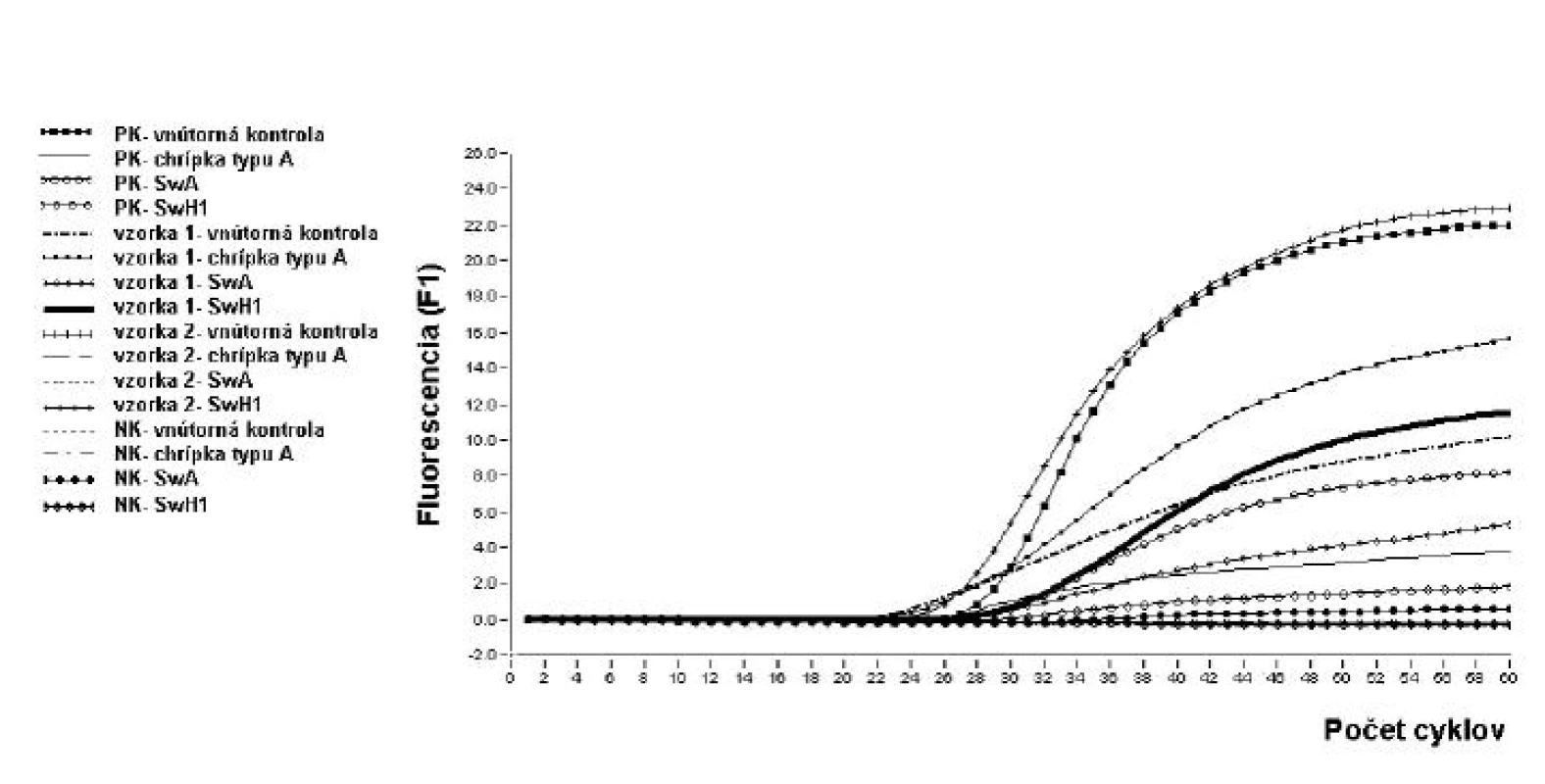
Rýchle diagnostické testy poskytujú orientačný výsledok (chrípka A alebo chrípka B) už v priebehu 30 minút [1, 12, 14, 20].
Na OLM RÚVZ v B. Bystrici sa v sezóne 2009/2010 používali rýchle diagnostické testy Directigen EZ Flu A+B (Becton Dickinson).
Tieto testy sme od mája do októbra roku 2009 vykonávali u všetkých vzoriek odobratých na diagnostiku novej chrípky od pacientov s pozitívnou cestovateľskou anamnézou. Neskôr sa, v rámci racionalizácie opatrení, v súlade s usmernením hlavného hygienika SR, rýchlotestami vyšetrovali iba závažné prípady respiračných infekcií, resp. SARI (Severe Acute Respiratory Infection) [16].
Všetky používané diagnostické metódy boli vo vyššie uvedených laboratóriách vykonávané štandardnými virologickými a molekulárno-biologickými technikami a v súlade s manuálom SZO [7, 8, 19].
Výsledky
Od mája 2009 do júna 2010 laboratórium vyšetrilo 2497 vzoriek na prítomnosť vírusov chrípky A a B a predovšetkým na prítomnosť pandemickej chrípky A/H1N1. Z 589 vzoriek pozitívnych na chrípku A bolo 537 vzoriek subtypizovaných ako pandemická chrípka A/H1N1. Predstavuje to 21,5 % zo všetkých vyšetrených vzoriek a 91,2 % zo vzoriek pozitívnych na chrípku A.
Table 1. Algoritmus vyšetrovania vzoriek od pacientov s chrípkou alebo chrípke podobným ochorením odobratých v sentinelovej sieti pre chrípkovú sezónu 2009/2010 (upravené podľa [19]) Table 1. Algorithm of analysis of specimens from patients with influenza or influenza-like illness collected in the sentinel network for the influenza season 2009/10 (derived from [19]) ![Algoritmus vyšetrovania vzoriek od pacientov s chrípkou alebo chrípke podobným ochorením odobratých v sentinelovej sieti pre chrípkovú sezónu 2009/2010 (upravené podľa [19])
Table 1. Algorithm of analysis of specimens from patients with influenza or influenza-like illness collected in the sentinel network for the influenza season 2009/10 (derived from [19])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bb7b19f1c47e4e7219ceafedff6ac44f.jpg)
Vysvetlivky: H1 a H3 = vírusy epidemickej chrípky A/H1N1, resp. A/H3N2, H1v = vírus novej pandemickej chrípky, RSV = respiračný syncytiálny vírus, WHO = Svetová zdravotnícka organizácia (SZO), NRC = národné referenčné centrum, HIT = hemaglutinačno-inhibičný test, BSL2 a BSL3 = stupeň biobezpečnosti v laboratóriu Explanatory note: H1 and H3 = epidemic influenza A/H1N1 or A/H3N2 viruses, H1v = new pandemic influenza virus, RSV = respiratory syncytial virus, WHO = World Health Organization, NRC = National Reference Centre, HIT = hemagglutination inhibition test, BSL2 and BSL3 = laboratory biosafety levels V tabuľke 2 sú výsledky priamej diagnostiky pandemickej chrípky v roku 2009. V tomto roku bolo vyšetrených 1953 vzoriek biologického materiálu od pacientov so suspektnou novou chrípkou. U 473 (24,2 %) vzoriek bola potvrdená prítomnosť nového pandemického kmeňa chrípky A/H1N1. U 52 vzoriek bola potvrdená prítomnosť chrípky A metódou RT-PCR bez bližšej identifikácie. Ďalšia subtypizácia nebola u týchto vzoriek vykonaná.
Table 2. Virologická diagnostika pandemickej chrípky A/H1N1 na RÚVZ v BB – rok 2009 Table 2. Virological diagnosis of pandemic influenza A/H1N1 at the RAPH in Banská Bystrica – 2009 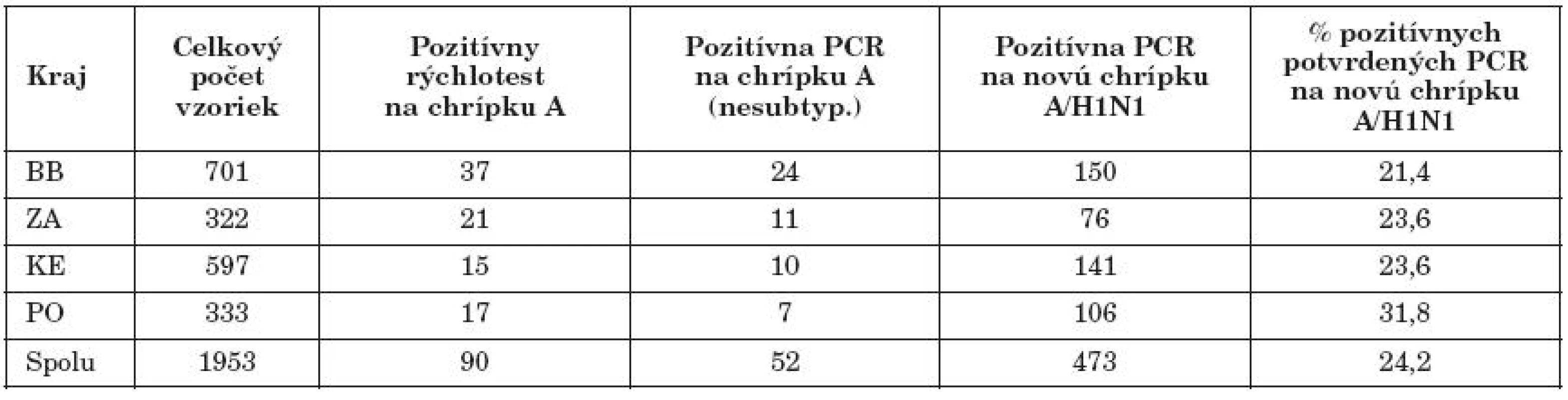
Vysvetlivky: BB = Banskobystrický kraj, ZA = Žilinský kraj, KE = Košický kraj, PO = Prešovský kraj Note: BB = Banská Bystrica Region, ZA = Žilina Region, KE = Košice Region, PO = Prešov Region V tabuľke 3 sú výsledky priamej diagnostiky chrípky v 1. polroku 2010 (1. 1.–30. 6. 2010). V tomto roku bolo celkovo vyšetrených 544 vzoriek biologického materiálu od pacientov so suspektnou chrípkou. Všetkých 64 (11,8 %) izolovaných vírusov chrípky A, bolo PCR metódami špecifikovaných ako pandemický vírus A/H1N1.
Table 3. Virologická diagnostika pandemickej chrípky A/H1N1 na RÚVZ v BB – 1. polrok 2010 Table 3. Virological diagnosis of pandemic influenza A/H1N1 at the RAPH in Banská Bystrica – first half 2010 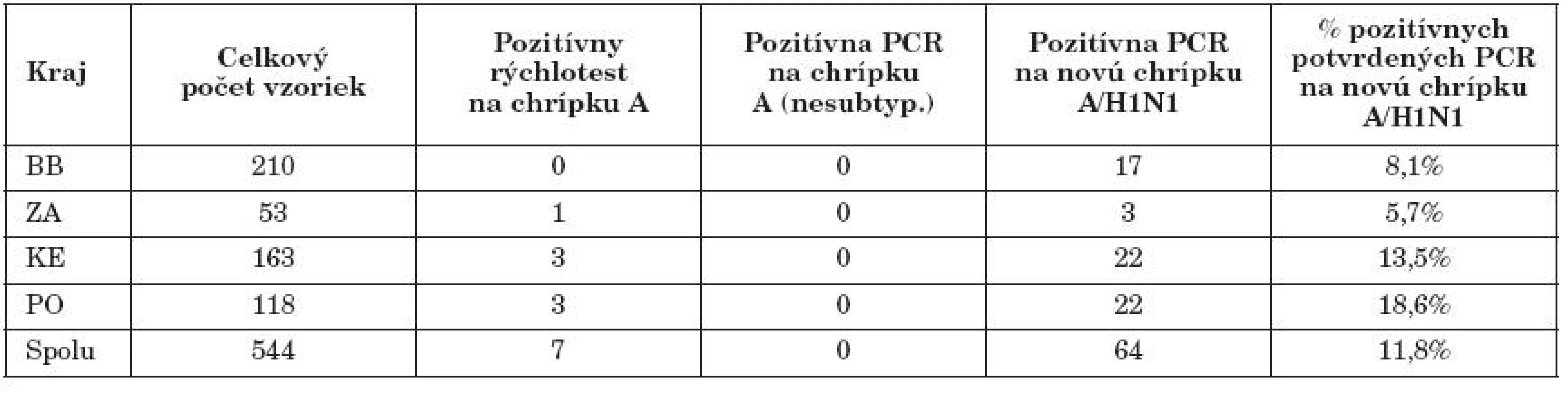
Vysvetlivky: BB = Banskobystrický kraj, ZA = Žilinský kraj, KE = Košický kraj, PO = Prešovský kraj Note: BB = Banská Bystrica Region, ZA = Žilina Region, KE = Košice Region, PO = Prešov Region U všetkých vyšetrovaných vzoriek uvedených v tabuľkách 1 a 2 bola vykonávaná aj RT-PCR diagnostika na prítomnosť chrípky B. U týchto vzoriek nebol potvrdený žiadny pozitívny prípad chrípky B.
Diskusia
Rok 2009 bol, čo sa týka vyšetrovania vzoriek na respiračné vírusy, výnimočný, a to vďaka objaveniu sa nového pandemického vírusu chrípky A/H1N1. Vzhľadom k tomu sa oproti minulým rokom vyšetrovala chrípka počas celého roka, nielen v období chrípkovej sezóny. Zaznamenali sme enormný (cca 10-násobný) nárast počtu vzoriek oproti predchádzajúcim rokom. Vrchol tejto chrípkovej sezóny bol v období november-december 2009 (viď tab. 2 a 3), čo je odlišné oproti predchádzajúcim chrípkovým sezónam, keď cirkulovali epidemické kmene chrípky a ich výskyt kulminoval v období február-marec [5].
Novinkou bolo aj zavedenie metódy real-time PCR do diagnostiky novej chrípky v našom laboratóriu a vyšetrovanie vzoriek nielen z regiónu stredného, ale aj východného Slovenska.
Celkový čas potrebný na spracovanie vzorky, priebeh samotnej RT-PCR (resp. real-time PCR), elektroforézu a vyhodnotenie reakcie si vyžaduje minimálne 2–6 hodín, je však omnoho kratší ako pri kultivácii. Tento postup si vyžaduje veľmi dobrú laboratórnu prax, zručnosť a v neposlednej miere vhodné prístrojové vybavenie [7, 8, 14].
Rýchlotesty poskytnú výsledok za 30 minút, nevýhodou však je ich nízka senzitivita a špecificita. Tieto testy sú konštruované ako rýchla orientačná diagnostika pri lôžku pacienta, aby bolo možné, v prípade pozitívneho výsledku, čo najskôr zahájiť terapiu a protiepidemické opatrenia. Výsledky rýchlotestu je potrebné verifikovať (pozitívne aj negatívne) použitím PCR metód, resp. vírusovou kultiváciou [11, 14, 20].
Nespornou výhodou molekulárno-biologických metód (PCR) oproti klasickým metódam (kultivácia) je rýchlosť a vyššia citlivosť. Tieto metódy sa vzhľadom k potrebe BSL-3 vybavenia potrebného na kultiváciu nového chrípkového vírusu, stali kľúčovými pri vyšetrovaní pacientov s podozrením na pandemickú chrípku. Pri vhodnom personálnom ako aj prístrojovom vybavení laboratória tvoria tieto metódy účinný nástroj zefektívnenia diagnostiky chrípky a chrípke podobných ochorení [7, 8, 12, 19]. Metódy vírusovej kultivácie však naďalej ostávajú neoddeliteľnou súčasťou surveillance chrípky a chrípke podobných ochorení [7, 19].
Záver
Pre úspešnú izoláciu a detekciu chrípkových vírusov je okrem zvolenia vhodných laboratórnych metód zásadným správny a včasný odber biologického materiálu, ako aj jeho adekvátna a rýchla doprava do virologického laboratória a teda úzka spolupráca laboratórnych a epidemiologických zložiek zainteresovaných do surveillance cirkulácie chrípkových vírusov v SR [7, 8, 19].
Do redakce došlo dne 30. 8. 2010.
Adresa pro korespondenci:
RNDr. Renáta Kissová
vedúca oddelenia lekárskej virológie OLM
Regionálny úrad verejného zdravotníctva so sídlom v Banskej Bystrici
Cesta k nemocnici 25
975 56 Banská Bystrica
e-mail: renata.kissova@vzbb.sk
Sources
1. Baden, L. R., Drazen, J. M., Kritek, P. A. et al. H1N1 Influenza A Disease – Information for Health Professionals. The New England Journal of Medicine [online], 2009. Dostupné na WWW: www. nejm.org, May 2009 (10.1056/NEJMe0903992).
2. Doporučené metody ve virologické diagnostice. Acta Hygienica, Epidemiologica et Microbiologica, 2000, 1, p. 32–36.
3. Fabiánová, K. Prasečí chřipka [online], 2009. Dostupné na WWW: http://www.szu.cz/tema/prevence/praseci-chripka.
4. Influenza A/H1N1 – Daily situation updates and maps [online], 2009. Dostupné na WWW: http://www.who.int/ csr/disease/swineflu/en/index.html.
5. Informácie o výskyte ochorení vyvolaných novým vírusom A(H1N1) (prasacia chrípka) [online], 2009. Dostupné na WWW: http://www.uvzsr.sk/index.html.
6. Johnson, F. B. Transport of viral specimens. Clinical microbiology Reviews, 1990, 4, p. 120–131.
7. Klement, C. a kol. Medzinárodné zdravotné predpisy. Teória, legislatíva, implementácia, súvislosti. Banská Bystrica: PRO, 2009. 438 s., ISBN 978-80-89057-24-5.
8. Maďarová, L., Feiková, S., Kissová, R., Klement, C. et al. Polymerase Chain Reaction (PCR) – an Efficient Tool for Diagnosis of Influenza and Acute Respiratory Illnesses during Influenza season. Central European Journal of Public Health, 2008, 2, 17, p. 59–64.
9. Novel Swine-Origin Influenza A(H1N1) Virus Investigation Team: Emergence of a Novel Swine-Origin Influenza A(H1N1) Virus in Humans [online], 2009. Dostupné na www: www.nejm.org,May7,2009 (10.1056/ NEJMoa0903810).
10. Odborné usmernenie o vykonávaní surveillance chrípky a chrípke podobných akútnych respiračných ochorení č. HH SR/9534/2001. Vestník Ministerstva zdravotníctva Slovenskej republiky, 2001, čiastka 40–44.
11. Pérez-Ruiz, M., Yeste, R., Ruiz-Pérez, M. J., Ruiz-Bravo, A., Rosa-Fraile, M. et al. Testing of Diagnostic Methods for Detection of Influenza Virus for Optimal Performance in the Context of an Influenza Surveillance Network. Journal of Clinical Microbiology, 2007, 9, p. 3109–3110.
12. Petric, M., Comanor, L., Petti, C. A. Role of the Laboratory in Diagnosis of Influenza during Seasonal Epidemics and Potential Pandemics. The Journal of Infectious Diseases, 2006, 194, Suppl., p. 98–110.
13. Rozhodnutie o povinnosti osôb, ktoré vstupujú na územie SR z krajín s potvrdeným výskytom nového vírusu chrípky A (H1N1), podrobiť sa preventívnemu lekárskemu vyšetreniu a následným potrebným diagnostickým vyšetreniam, terapeutickým zásahom a nariadeným protiepidemickým opatreniam, č. OPL/3778/ 2009 z 30. apríla 2009.
14. Ruest, A., Michaud, S., Deslandes, S., Frost, E.H. Comparison of the Directigen Flu A+B Test, the QuickVue Influenza Test, and Clinical Case Definition to Viral Culture and Reverse Transcription-PCR for Rapid Diagnosis of Influenza Virus Infection. Journal of Clinical Microbiology, 2003, 8, p. 3487–3493.
15. Swine Influenza SwoA(H1N1) [online], 2009. Dostupné na www: http://www.eiss.org/html/influenza_swoh1n1. html.
16. Usmernenie Hlavného hygienika SR o úprave opatrení v súvislosti s pandemickým vírusom chrípky A(H1N1) 2009. Platné od 11.12.2009.
17. World Health Organization, Department of Communicable Disease Surveillance and Response Manual on Animal Influenza Diagnosis and Surveillance. WHO/CDS/CSR/NCS/2002.5, [online]. Dostupné na www: http://www.who.int/vaccine_research/diseases/ influenza/ WHO_manual_on_animal-diagnosis_and_ surveillance_ 2002_5.pdf.
18. WHO Preparing for the second wave: lessons from current outbreaks. Pandemic (H1N1)2009 briefing note 9 [online], 2009. Dostupné na www: http://www.who. int/csr/disease/swineflu/notes/h1n1_second_wave_20090828/en/print.html.
19. WHO Regional Office for Europe WHO European guidance for influenza surveillance in humans [online], 2009. Dostupné na WWW: http://www.euro.who.int
20. WHO WHO recommendations on the use of rapid testing for influenza diagnosis [online], 2008. Dostupné na www: http://www.who.int/csr/disease/avian_influenza/ guidelines/RapidTestInfluenza_web.pdf.
21. WHO CDC Real-time RT-PCR Swine H1 Assay [online], 2009. Dostupné na www: http://www.who.int/csr/ resour ces/publications/swineflu/CDCRealtimeRTPCR_SwineH1Assay-2009_20090430.pdf
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2011 Issue 1-
All articles in this issue
- Účinnost tří nových odvšivovacích přípravků na veš dětskou (Pediculus capitis L.) v in vitro testech – krátké sdělení
- Lymská borelióza a demyelinizačné ochorenie CNS
- Hrabák J., Žemličková H., Bergerová T., Urbášková P.: Interpretation of the Susceptibility Test Results in Enterobacteria Producing 3rd- and 4th-Generation Cephalosporin- or Carbapenem-Hydrolyzing β-Lactamases
- Antibiotická rezistence Streptococcus pneumoniae a Streptococcus pyogenes v letech 1996–2009
- Lůžková péče o uživatele a závislé na návykových látkách v ČR ve zdravotnické statistice od r. 1959
- Laboratórna diagnostika pandemickej chrípky na Odbore lekárskej mikrobiológie Regionálneho úradu verejného zdravotníctva so sídlom v Banskej Bystrici v sezóne 2009/2010
- Novinky na poli poliomyelitidy – krátké sdělení
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antibiotická rezistence Streptococcus pneumoniae a Streptococcus pyogenes v letech 1996–2009
- Lymská borelióza a demyelinizačné ochorenie CNS
- Hrabák J., Žemličková H., Bergerová T., Urbášková P.: Interpretation of the Susceptibility Test Results in Enterobacteria Producing 3rd- and 4th-Generation Cephalosporin- or Carbapenem-Hydrolyzing β-Lactamases
- Laboratórna diagnostika pandemickej chrípky na Odbore lekárskej mikrobiológie Regionálneho úradu verejného zdravotníctva so sídlom v Banskej Bystrici v sezóne 2009/2010
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

