-
Medical journals
- Career
Perniciózní anémie – diagnostický přínos detekce autoprotilátek proti vnitřnímu faktoru a terčovému antigenu parietálních buněk žaludku H+/K+ ATPáze
: Lenka Sedláčková; L. Dubská; M. Průcha
: Oddělení klinické biochemie, hematologie a imunologie, Nemocnice Na Homolce, Praha
: Epidemiol. Mikrobiol. Imunol. 59, 2010, č. 3, s. 126-132
Úvod:
Perniciózní anémie je autoimunitní onemocnění vyvolávající deficit vitaminu B12. Diagnostika zahrnuje typické změny v krevním obraze, nízkou hladinu vitaminu B12, endoskopické a histologické známky gastritidy a průkaz autoprotilátek proti terčovým antigenům – H+/K+ ATPáza parietálních buněk a vnitřní faktor.Cíl studie:
Cílem práce bylo zavést imunologickou metodu detekce autoprotilátek proti terčovým antigenům – H+/K+ ATPáze parietálních buněk a vnitřnímu faktoru a vyhodnotit jejich přínos pro diagnostiku perniciózní anémie.Materiál a metodika:
Bylo vyšetřeno 95 pacientských sér na protilátky proti H+/K+ ATPáze a vnitřnímu faktoru multiplexovou metodou luminex. Výsledky byly porovnány s imunofluorescenční metodou průkazu protilátek proti parietálním buňkám žaludku a s diagnózou.Výsledky:
Senzitivita protilátek proti H+/K+ ATPáze parietálních buněk pro diagnózu perniciózní anémie byla 68,2%, specificita 91,7%. Senzitivita protilátek proti vnitřnímu faktoru byla 40,9%, specificita 98,6%. Senzitivita kombinace vyšetření obou autoprotilátek byla 86,36%, specificita 90,28%, pozitivní prediktivní hodnota 73,08% a negativní prediktivní hodnota 95,59%.Závěr:
Oba testy jsou velice přínosné v diagnostice perniciózní anémie a jejich souběžné stanovení zvyšuje senzitivitu vyšetření.Klíčová slova:
perniciózní anémie – autoimunitní gastritida – vnitřní faktor – parietální buňky.Úvod
Perniciózní anémie je chronické onemocnění s nedostatečným vstřebáváním vitaminu B12, asociované s chronickou atrofickou gastritidou, autoimunitního původu.
Incidence je odhadována na 0,1%. Výskyt stoupá s věkem, v populaci nad 60 let na 2% [4], u žen je o něco častější než u mužů (poměr 1,5 : 1), vyšší je též v oblasti Skandinávie a u národů s keltskými předky [13].
Projevuje se megaloblastovou anémii, která se rozvíjí velmi pomalu, průměrně s latencí 20–30 let od počátku choroby, s příznaky slabosti, únavnosti, dušnosti a bušením srdce. Vedle postižení krvetvorby má komplikace neurologické v podobě postižení zadních míšních provazců s poruchou vibračního a polohového čití, nestabilitou, v pokročilém stadiu jsou možné i paměťové změny a deprese. Typickým příznakem je pálení jazyka, který je rudý a vyhlazený – Hunterova glositida [13].
V patogenezi se pojí autoimunitní zánět v oblasti těla a fundu žaludku vedoucí k destrukci parietálních buněk s autoimunitní reakcí vůči vnitřnímu faktoru. Terčovým antigenem protilátek i CD4 T-lymfocytů na parietálních buňkách je H+/K+ATPáza [9, 15]. Spouštěcím faktorem autoimunitní reakce může být infekce Helicobacter pylori [7, 14]. Následkem je autoimunitní gastritida a nedostatečná tvorba kyseliny chlorovodíkové, achlorhydrie. Nedostatečná žaludeční kyselost umožňuje přerůstání bakterií v tenkém střevě, může vést k malabsorpci a průjmům. Dále vede ke zvýšení produkce hormonu gastrinu a tím zvyšuje riziko vzniku hormonálně aktivního nádoru zažívacího traktu – karcinoidu. U části pacientů dochází k intestinální metaplazii a trojnásobnému zvýšení rizika adenokarcinomu žaludku [2, 6, 8, 10]. Vnitřní faktor je 60 kD glykoprotein produkovaný parietálními buňkami žaludku nutný po vzájemné vazbě ke vstřebávání vitaminu B12 v terminálním ileu. Malabsorpce vitaminu B12 je následkem absolutního (nedostatečná tvorba vlivem poškození parietálních buněk) nebo funkčního nedostatku vnitřního faktoru (imunitní reakce vůči vnitřnímu faktoru) [13]. Protilátky proti vnitřnímu faktoru jsou dvojího typu. Typ I blokuje vazebné místo pro vitamin B12 a znemožňuje jeho navázání [15]. Typ II se váže na vnitřní faktor v jiném místě a brání vazbě komplexu vnitřní faktor-vitamin B12 na vazebné místo v terminalním ileu. Výsledkem je deficit vitaminu B12 a konsekventní porucha krvetvorby – megaloblastová přestavba kostní dřeně, v periferní krvi makrocytární anémie, hypersegmentace jader neutrofilů [13].
Diagnostika perniciózní anémie zahrnuje typické změny v krevním obraze, pro průkaz poruchy vstřebávání byl jako zlatý standard používán Schillingův test. Intramuskulárně podaný vitamin B12 vysytí receptory ve tkáních. Potom se podá radionuklidem značený vitamin B12 perorálně. Při neporušeném vstřebávání se radioaktivní vitamin z velké části vyloučí močí, v opačném případě stolicí [13]. Dostupnost tohoto funkčního testu je v současné době velmi omezená. K diagnostice deficitu lze použít stanovení v periferní krvi (vitamin B12 nebo jeho aktivní metabolit holotranskobalamin). Typická je snížená hladina sérového pepsinogenu a zvýšená hladina sérového gastrinu. Citlivým, ač nespecifickým ukazatelem deficitu vitaminu B12 je též zvýšená hladina homocysteinu v plazmě. Autoimunitní atrofická gastritida se prokazuje endoskopickým vyšetřením a histologicky, k průkazu achlorhydrie se používá barvení Kongo červení při endoskopii. Imunologické vyšetření umožňuje stanovit autoprotilátky v periferní krvi. Protilátky proti parietálním buňkám se prokazují nepřímou imunofluorescencí na řezu krysím žaludkem, protilátky proti terčovému antigenu – H+/K+ATPáze lze stanovit metodou ELISA nebo luminex (multiplexová imunoesej na mikrosférických partikulích s fluorescenční detekcí). Bývají přítomny u 90 % pacientů [15]. Protilátky proti vnitřnímu faktoru lze stanovit metodami ELISA, imunochemiluminiscencí (např. na analyzátoru Access) nebo luminexovou analýzou. Většina dostupných diagnostických souprav stanovuje protilátky proti vnitřnímu faktoru typu I, vyskytují se u cca 70 % pacientů [3, 5]. Obě autoprotilátky jsou též přítomny u blízkých příbuzných a 2–10 % zdravých lidí, výskyt stoupá s věkem. Perniciózní anémie může provázet další orgánově specifické a systémové autoimunitní choroby jako Hashimotovu tyroiditidu, Graves-Basedowovu tyreotoxikózu, inzulin dependentní diabetes mellitus, hypoparatyreoidismus, polyglandulární syndromy, Sjögrenův syndrom, revmatoidní artritidu, myastenii gravis. U těchto chorob je rovněž vyšší asymptomatický výskyt autoprotilátek proti parietálním buňkám [1, 12, 14, 15].
Léčba perniciózní anémie spočívá v pravidelné substituci vitaminu B12, obvykle intramuskulární cestou. Prognóza při léčbě je příznivá, dochází k plné normalizaci krvetvorby [13]. Přetrvává mírně zvýšené riziko tumoru žaludku a následky achlorhydrie v podobě přerůstání bakterií ve vyšších etážích střeva.
Cíl práce
Cílem práce bylo rozšířit vyšetření autoprotilátek proti parietálním buňkám v diagnostice perniciózní anémie o protilátky proti vnitřnímu faktoru a terčovému antigenu parietálních buněk H+/K+ ATPáze a ověřit jejich přínos. Ve vzorcích pacientů rutinně odebraných na vyšetření protilátek proti parietálním buňkám nepřímou imunofluorescencí byly stanoveny protilátky proti vnitřnímu faktoru a H+/K+ ATPáze parietálních buněk luminexovou metodou. Retrospektivní analýzou byly výsledky dále zpracovány statisticky, porovnána shoda průkazu autoprotilátek použitými metodami navzájem, zhodnocena senzitivita a specificita vyšetření jednotlivých autoprotilátek pro diagnostiku perniciózní anémie a srovnána s dalšími laboratorními markery (makrocytóza, nízká hladina vitaminu B12). Dále byl sledován souhlas nových laboratorních testů s histologickým nálezem u pacientů gastroskopicky vyšetřených.
Materiál a metoda
Soubor tvoří pacienti z hematologické, metabolické, imunologické a gastroenterologické ambulance odeslaní na vyšetření protilátek proti parietálním buňkám v imunologické laboratoři. Důvody k vyšetření byly: diferenciální diagnostika anémie, hyperhomocysteinémie, syndrom únavy a chronická gastritida. Vyšetřeno bylo celkem 95 vzorků (62 žen, 33 mužů, věk 10–92 let) na protilátky proti parietálním buňkám nepřímou imunofluorescencí, na protilátky proti vnitřnímu faktoru a proti H+/K+ ATPáze parietálních buněk luminexovou metodou. Retrospektivně byly zhodnoceny výsledky a další souběžně či dříve stanovené parametry: maximální objem erytrocytů v krevním obraze (91 pacientů) a minimální hladina aktivního metabolitu vitaminu B12 – holotranskobalaminu (57 pacientů). Gastroskopicky bylo vyšetřeno 29 pacientů našeho souboru.
Stanovení protilátek proti vnitřnímu faktoru a H+/K+ ATPáze parietálních buněk bylo provedeno multiplexovou luminexovou metodou (diagnostická souprava FIDIS Gastric firmy BMD). Principem metody je použití 2 typů částic s navázanými antigeny vnitřního faktoru a H+/K+ ATPázy. Částice jsou odlišitelné červeným laserem. V první fázi se inkubují částice s vyšetřovaným sérem. Při přítomnosti pacientových protilátek proti navázaným antigenům se tyto ze séra naváží na částice, zbytek séra je při promývání odstraněn. Poté jsou částice inkubovány se sekundární protilátkou proti lidskému imunoglobulinu G konjugovanou s fluorochromem, který je detekovatelný zeleným laserem. Nakonec přístroj FIDIS firmy BMD na principu průtokové cytometrie kvantifikuje autoprotilátky na částicích. Hranice pozitivity je 40 AU/ml, výsledek 30–40 AU/ml je hraniční (šedá zóna), výsledek < 30 AU/ml je hodnocen jako negativní.
Stanovení protilátek proti parietálním buňkám žaludku bylo provedeno ze séra metodou nepřímé imunofluorescence na kombinaci řezů krysím žaludkem, játry a ledvinou (diagnostická souprava firmy BioSystems) s kvalitativním odečtem (pozitivní nebo negativní) ve fluorescenčním mikroskopu Olympus AX70.
Krevní obraz a objem erytrocytů byl stanoven hematologickým analyzátorem Advia 2120 firmy Bayer.
Hladina holotranscobalaminu byla stanovena metodou fluorescenční imunoeseje (FPIA) diagnostickou soupravou Axim Active B12 Reagent Pack na přístroji AxSYM firmy Abbott.
Statistické zpracování bylo provedeno pomocí software Medcalc (Belgie), verze 9.6.
Výsledky
Z celkem 95 vyšetřených vzorků jsme prokázali přítomnost protilátek proti parietálním buňkám nepřímou imunofluorescencí u 28 pacientů. Přítomnost protilátek proti H+/K+ ATPáze parietálních buněk luminexovou metodou jsme zaznamenali u 24 pacientů, suspektní přítomnost u 1 pacienta (výsledek v šedé zóně). Přítomnost protilátek proti vnitřnímu faktoru luminexovou metodou jsme nalezli u 11 pacientů, u dalších 3 pacientů byla suspektní (šedá zóna). Pro vzájemné porovnání metod byly hraniční výsledky přiřazeny k pozitivním.
Porovnání metod navzájem
Porovnání výsledků protilátek proti parietálním buňkám (nepřímá imunofluorescence, kvalitativní hodnocení) a proti jejich cílovému antigenu H+/K+ ATPáze (luminexová metoda, kvantitativní hodnocení): souhlas obou metod byl nalezen u 86 vzorků (90,5 %). Diskrepantní nález zastižen u 9 vzorků (9,5 %), z toho 6krát pozitivní protilátky proti parietálním buňkám při negativním výsledku protilátek proti H+/K+ ATPáze (6,3 %) a 3krát pozitivní protilátky proti H+/K+ ATPáze při negativním výsledku nepřímé fluorescence (3,2 %).
Porovnání výsledků protilátek proti parietálním buňkám nepřímou imunofluorescencí a protilátek proti vnitřnímu faktoru luminexovou metodou: 69krát shoda (72,6 %), 26krát nesouhlas (27,4 %).
Porovnání protilátek proti vnitřnímu faktoru a H+/K+ ATPáze luminexovou metodou: 75krát shoda (78,9 %), 20krát nesouhlas (21 %). Korelace metod je statisticky významná, r = 0,4622, p < 0,0001.
Porovnání metod s diagnózou
Diagnóza perniciózní anémie byla na základě zhodnocení klinického průběhu a výsledků laboratorních a dalších vyšetření potvrzena u 22 pacientů z našeho souboru, nepotvrzena u 72 pacientů a nehodnocena pro nedostatek údajů u 1 pacienta. Tento 1 pacient je z dalšího zpracování vyřazen. Charakteristika souboru pacientů je uvedena v tabulce 1, výsledky jsou znázorněny v grafech 1 a 2.
1. Charakteristika souborů podle diagnózy Table 1. Detection of anti-H+/K+ ATPase and anti-intrinsic factor autoantibodies by diagnosis 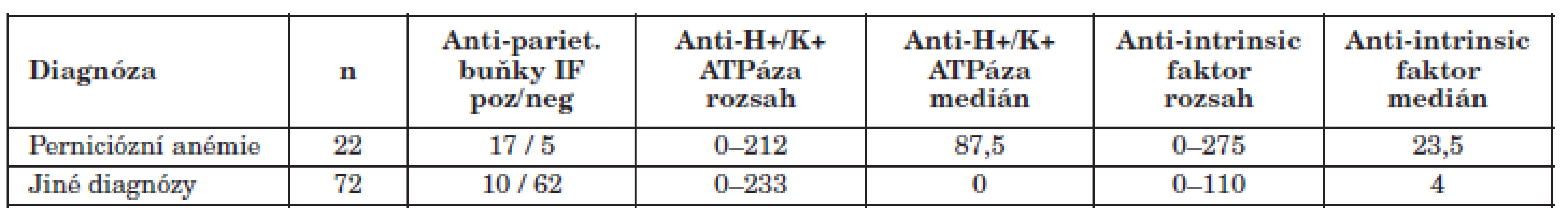
Výsledky luminexové metody uvedeny v AU/ml. Výsledky nepřímé imunfluorescence uvedeny v počtech pozitivních a negativních výsledků. Results of the multiplex Luminex assays are given in AU/ml. Results of the immunofluorescence assay are given as the positivity to negativity ratio. 1. Porovnání výsledků protilátek proti H+/K+ ATPáze u pacientů s perniciózní anémií a u pacientů s jinou diagnózou Fig. 1. Levels of anti-H+/K+ ATPase antibodies in patients with pernicious anaemia and other diagnoses 
2. Porovnání výsledků protilátek proti vnitřnímu faktoru u pacientů s perniciózní anémií a u pacientů s jinou diagnózou Fig. 2. Levels of anti-intrinsic factor antibodies in patients with pernicious anaemia and other diagnoses 
Vyšetření protilátek proti parietálním buňkám nepřímou imunofluorescencí mělo v našem souboru senzitivitu 77,27 %, specificitu 86,11 %, pozitivní prediktivní hodnotu 62,96 % a negativní prediktivní hodnotu 92,54 %.
Vyšetření protilátek proti terčovému antigenu parietálních buněk H+/K+ ATPáze luminexovou metodou: v našem souboru byla zjištěna senzitivita 68,2 % a specificita 91,7 %, pozitivní prediktivní hodnota 70,83 % a negativní prediktivní hodnota 92,86 % pro výrobcem doporučenou hodnotu cut-off 40 AU/ml. Optimální vypočítaná hodnota cut-off je 23 AU/ml (senzitivita 81,8%, specificita 88,9%), plocha pod křivkou je 0,889. ROC křivka je v grafu 3.
3. ROC křivka pro protilátky proti H+/K+ ATPáze Fig. 3. ROC curve for anti-H+/K+ ATPase antibodies 
Vyšetření protilátek proti vnitřnímu faktoru luminexovou metodou: pro výrobcem doporučenou hodnotu cut-off (40 AU/ml) je v našem souboru senzitivita 40,9 %, specificita 98,6 %, pozitivní prediktivní hodnota 76,92 % a negativní prediktivní hodnota 85,19 %. Pro náš soubor je optimální vypočítaná hodnota cut-off 17 AU/ml (senzitivita 59,1 %, specificita 93,1 %), plocha pod křivkou je 0,754. ROC křivka je v grafu 4.
4. ROC křivka pro protilátky proti vnitřnímu faktoru Fig. 4. ROC curve for anti-intrinsic factor antibodies 
Senzitivita pro kombinaci vyšetření protilátek proti vnitřnímu faktoru a H+/K+ ATPáze (pozitivita alespoň jedné autoprotilátky) byla v našem souboru 86,36 %, specificita 90,28 %, pozitivní prediktivní hodnota 73,08 % a negativní prediktivní hodnota 95,59 %.
Přínos dalších laboratorních parametrů pro stanovení diagnózy byl hodnocen dále pro maximální objem erytrocytů a minimální hladinu aktivního metabolitu vitaminu B12, holotranskobalaminu. Objem erytrocytů statisticky zpracován u 90 pacientů z našeho souboru, z nich 22 s diagnózou perniciózní anémie, u 68 tato diagnóza nebyla potvrzena. Pro tento soubor je optimální vypočítaná hodnota cut-off 97,6 m3 (senzitivita 63,6%, specificita 86,8%), plocha pod křivkou 0,769. Hladina holotranskobalaminu vyšetřena u 55 pacientů našeho souboru, z toho bylo 22 s diagnózou perniciózní anémie a 33 pacientů bez perniciózní anémie. Pro tento soubor je optimální vypočítaná hodnota cut-off 17 pmol/l (senzitivita 81,8%, specificita 93,9%), plocha pod křivkou 0,867.
Gastroskopické vyšetření bylo provedeno u 29 pacientů z našeho souboru, z toho 23 pacientů mělo prokázáno makro - či mikroskopické známky zánětu a 6 pacientů mělo normální nález. Patologické nálezy obvykle nebyly dostatečně informativní k odlišení etiologie přítomné gastritidy, jelikož indikace vyšetření žaludku a jeho načasování byly různorodé. Variabilní byla přítomnost Helicobacter pylori a jen u malé části byl proveden test s Kongo červení k průkazu achlorhydrie. Jelikož součástí autoimunitní gastritidy je přítomnost protilátek proti parietálním buňkám a terčovým antigenem je H+/K+ ATPáza, hodnotili jsme přítomnost těchto protilátek v kontextu gastroskopického nálezu. Všech 6 pacientů s normálním nálezem v žaludku mělo negativní protilátky proti H+/K+ ATPáze (100% shoda), u 23 patologických gastroskopických nálezů byly protilátky proti ATPáze přítomny u 52 % (12 pacientů) a neprokázány u 48 % (11 pacientů). Všichni pacienti s pozitivními protilátkami proti H+/K+ ATPáze (12) měli známky gastritidy v endoskopickém vyšetření (100 %). Obdobně jsme provedli hodnocení pro protilátky proti vnitřnímu faktoru: všech 6 pacientů s normálním nálezem žaludku mělo negativní protilátky proti vnitřnímu faktoru (100%), z 23 patologických gastroskopických nálezů byly protilátky proti vnitřnímu faktoru přítomny u 34,8% (8 pacientů) a nepřítomny u 65,2% (15 pacientů). Všichni pacienti s pozitivními protilátkami proti vnitřnímu faktoru (8) měli patologický žaludeční nález (100%). Podle očekávání byly u pacientů s patologickým nálezem v žaludku častější protilátky proti H+/K+ ATPáze (více než polovina případů) než protilátky proti vnitřnímu faktoru (asi třetina případů v našem souboru).
Diskuse
Imunologická diagnostika perniciózní anémie je tradičně zastoupena detekcí protilátek proti parietálním buňkám nepřímou imunofluorescencí. Toto vyšetření je přínosné, ale má některé nevýhody:
- a) nepostihuje protilátky proti vnitřnímu faktoru, které jsou významným patogenetickým faktorem;
- b) odečet je závislý na zkušenosti odečítajícího pracovníka;
- c) u malé části pacientů znemožňuje správné hodnocení souběžná přítomnost protilátek proti mitochondriím, která by při nevhodně volené kombinaci substrátu (chybění ledvin) mohla vést i k falešně pozitivnímu hodnocení u pacientů s primární biliární cirhózou.
Luminexová metoda souběžného stanovení protilátek proti vnitřnímu faktoru a zároveň terčovému antigenu parietálních buněk žaludku H+/K+ ATPáze přináší výhody multiplexových metod – úspora množství vzorku, reagencií, času a ceny vyšetření, umožňuje automatizované provedení a nevyžaduje speciální erudici laboratorního personálu.
Detekce protilátek proti vnitřnímu faktoru, jež jsou součástí patogenetického mechanismu choroby, je nepochybným přínosem pro diagnostiku, což potvrzují i naše výsledky. Vyšetření má vysokou specificitu (98,6%) a nižší senzitivitu (v našem souboru 40,9%). Senzitivita i specificita obou luminexových metod v našem souboru odpovídá výsledkům ostatních autorů [11, 14, 15]. Stanovení protilátek proti terčovému antigenu parietálních buněk – H+/K+ ATPáze odstraňuje některé nedostatky nepřímé fluorescence, v našem souboru to potvrzuje vyšší specificita (91,7 %) a vyšší pozitivní prediktivní hodnota (70,83 %). Senzitivita protilátek proti H+/K+ ATPáze (68,2 %) je v našem souboru nižší než senzitivita nepřímé imunofluorescence. Teprve přidáme-li k pozitivním výsledkům i výsledky hraniční (cut-off 30 AU/ml), bude senzitivita stejná (77,27 %), pro optimální cut-off dle ROC křivky by byla pro protilátky proti terčovému antigenu vyšší (81,8 %). U obou luminexových metod je v našem souboru zřetelný trend významnosti i nižších hodnot, což ukazují obě ROC křivky. Přinejmenším je třeba při hodnocení přihlížet i k hraničním výsledkům. Nejvýhodnější je kombinace obou vyšetření – protilátek proti vnitřnímu faktoru a proti terčovému antigenu parietálních buněk žaludku – H+/K+ ATPáze. Tento postup zvyšuje senzitivitu (v našem souboru na 86% pro doporučené cut-off obou autoprotilátek 40 AU/ml), neboť ne všichni pacienti mají souběžně obě autoprotilátky. Tyto nálezy se shodují s literárními [3].
Přítomnost protilátek proti H+/K+ ATPáze i vnitřnímu faktoru je silně asociován s gastritidou (v našem souboru 100 %), v souladu s literaturou [11]. Pozitivní nález by měl být ověřen gastroskopicky i u pacientů bez jakýchkoli zažívacích potíží.
Určitým omezením naší studie je výběr pacientů, „naředění“ souboru jinými typy anémií (mikrocytárními), dalšími diagnózami (jiné příčiny únavového syndromu, vředová choroba gastroduodena apod.), což je dáno zejména retrospektivním charakterem práce. Rovněž načasování odběru pacientů s diagnózou perniciózní anémie nebylo stejné – různé stadium nemoci a léčby. Částečně jsme to zohlednili ve výběru minimálních hodnot vitaminu B12 a maximálních hodnot objemu erytrocytů, jelikož tyto hodnoty se po zahájení léčby rychle normalizují. Pro přesné hodnocení přínosu těchto vyšetření k diagnostice perniciózní anémie jsou nutná prospektivní data s časováním odběru v době stanovení diagnózy před zahájením léčby, což v našem souboru nemohlo být zabezpečeno. Uvedené senzitivity a specificity objemu erytrocytů a hladin holotranskobalaminu jsou proto orientační a předpokládáme jejich vyšší hodnoty při správném načasování vyšetření. Přítomnost autoprotilátek obvykle předchází rozvoj nemoci a přetrvává déle, takže na jejich výsledky by tato nejednotnost neměla mít významný vliv.
Závěr
Rozšíření spektra autoprotilátek o vyšetření protilátek proti vnitřnímu faktoru a cílovému antigenu parietálních buněk žaludku H+/K+ ATPáze zlepšuje diagnostiku perniciózní anémie. Protilátky proti H+/K+ ATPáze mají vysokou senzitivitu při velmi dobré specificitě, protilátky proti vnitřnímu faktoru mají velmi vysokou specificitu při nižší senzitivitě. Jejich kombinace je tedy vhodným nástrojem v diferenciální diagnostice perniciózní anémie. Konečné stanovení diagnózy musí být vždy komplexní a musí spojovat výsledky klinických a laboratorních vyšetření.
MUDr. Lenka Sedláčková
Oddělení klinické biochemie, hematologie a imunologie
Nemocnice Na Homolce
Roentgenova 2
150 30 Praha 5
e-mail: lenka.sedlackova@homolka.cz
Sources
1. Blizzard, R. M., Chee, D., Davis, W. The incidence of parathyroid and other antibodies in the sera of patients with idiopathic hypoparathyroidism. Clin. Exp. Immunol., 1966, 1, p. 119–128.
2. Brinton, L. A., Gridley, G., Hrubec, Z., Hoover, R. et al. Cancer risk following pernicious anaemia. Br. J. Cancer, 1989, 59, p. 810–813.
3. Carmel, R. Reassessment of the relative prevalences of antibodies to gastric parietal cell and to intrinsic factor in patients with pernicious anaemia: influence of patient age and race. Clin. Exp. Immunol., 1992, 89, p. 74–77.
4. Carmel, R. Prevalence of undiagnosed pernicious anemia in the elderly. Arch. Intern. Med., 1996, 156, 10, p. 1097–1100.
5. Davidson, R. J. L., Atrah H. I., Sewell, H. F. Longitudinal study of circulating gastric antibodies in pernicious anaemia. J. Clin. Pahtol., 1989, 42, p. 1092–1095.
6. Elsborg, L., Mosbech, J. Pernicious anaemia as a risk factor in gastric cancer. Acta Med. Scand., 1979, 206, 4, p. 315–318.
7. Hershko, Ch., Patz, J., Ronson, A. The anemia of achylia gastrica revisited. Blood Cells, Molecules, and Diseases, 2007, 39, p. 178–183.
8. Hsing, A. W., Hansson, L. E., McLaughlin, J. K., Nyren, O. et al. Pernicious anemia and subsequent cancer. A population-based cohort study. Cancer, 1993, 1, 71, 3, p. 745–750.
9. Karlsson, F. A., Burman, P., Loof, L., Mardh, S. Major Parietal Cell Antigen in Autoimmune Gastritis with Pernicious Anemia is the Acid-producing H+, K+ -Adenosine Triphosphatase of the Stomach. J. Clin. Invest., 1988, 81, p. 475–479.
10. Kokkola, A., Sjoblom, S. M., Haapiainen, R., Sipponen, P. et al. The Risk of Gastric Carcinoma and Carcinoid Tumours in Patients with Pernicious Anaemia. A Prospective Follow-Up Study. Scan. J. Gastroenterol., 1998, 33, p. 88–92.
11. Lahner, E., Norman, G. L., Severi, C., Encabo, S. et al. Reassessment of Intrinsic Factor and Parietal Cell Autoantibodies in Atrophic Gastritis With Respect to Cobalamin Deficiency. Am. J. Gastroenterol., 2009, 104, 8, p. 2071–2079.
12. Mardh, S., Ma, J. Y., Song Y. H., Aly, A. et al. Occurrence of autoantibodies against intrinsic factor, H, K -ATPase, and pepsinogen in atrophic gastritis and rheumatoid arthritis. Scand. J. Gastroenterol., 1991, 26, 16, p. 1089–1096.
13. Penka, M., Buliková, A., Matýšková, M., Zavřelová, J. Hematologie I. Praha : GRADA Publishing, 2001. p. 29–32, ISBN 80-247-0023-9.
14. Presotto, F., Sabini, B., Cecchetto, A., Plebani, M. et al. Helicobacter pylori Infection and Gastric Autoimmune Diseases: Is There a Link? Helicobacter, 2003, 8, 6, p. 578–584.
15. Toh, B., Alderuccio, F. Pernicious Anaemia. Autoimmunity, 2004, 37, 4, p. 357–361.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2010 Issue 3-
All articles in this issue
- The Use of Molecular Genetics Techniques in Clinical Microbiology – Final Report from the Workshop of the Molecular Microbiology Working Group TIDE
- Examination of Mosquitoes Collected in Southern Moravia in 2006–2008 Tested for Arboviruses
- Tick-Borne Encephalitis in the East Bohemia Region and its Microbiological Diagnostic Pitfalls
-
Lipophilic Yeasts of the Genus Malassezia and Skin Diseases.
I. Seborrhoeic Dermatitis - Pernicious Anaemia – Diagnostic Benefit of the Detection of Autoantibodies against Intrinsic Factor and Gastric Parietal Cells Antigen H+/K+ ATPase
- Prevalence of Anti-Epstein-Barr Virus Antibodies in Children and Adolescents with Secondary Immunodeficiency
- Herpes zoster in the Czech Republic – Epidemiology and Clinical Manifestations
- A Simple Method for the Detection of CD154 (CD40L) on Peripheral Blood Lymphocytes
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Lipophilic Yeasts of the Genus Malassezia and Skin Diseases.
I. Seborrhoeic Dermatitis - Pernicious Anaemia – Diagnostic Benefit of the Detection of Autoantibodies against Intrinsic Factor and Gastric Parietal Cells Antigen H+/K+ ATPase
- Herpes zoster in the Czech Republic – Epidemiology and Clinical Manifestations
- Prevalence of Anti-Epstein-Barr Virus Antibodies in Children and Adolescents with Secondary Immunodeficiency
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

