-
Medical journals
- Career
Laboratórna diagnostika toxoplazmózy
: J. Strhársky; L. Maďarová; C. Klement
: Regionálny úrad verejného zdravotníctva, Banská Bystrica
: Epidemiol. Mikrobiol. Imunol. 58, 2009, č. 2, s. 51-62
Toxoplazmóza predstavuje v našich klimatických podmienkach jedno z najčastejších parazitárnych ochorení človeka. Laboratórna diagnostika toxoplazmózy v súčasnosti disponuje širokým spektrom metód priameho a nepriameho dôkazu pôvodcu infekcie. Cieľom tohto článku je podať prehľad o histórii objavenia pôvodcu toxoplazmózy, o tom ako sa postupne vyvíjali a zdokonaľovali laboratórne diagnostické metódy. Hlavný dôraz je kladený na súčasné možnosti diagnostiky Toxoplasma gondii, predovšetkým na sérologickú diagnostiku, ako aj na nové progresívne trendy s využitím techník molekulárnej biológie.
Kľúčové slová:
toxoplazmóza – Toxoplasma gondii – protilátky – diagnostika – PCR.Toxoplazmóza je infekčné ochorenie zvierat prenosné na človeka (zoonóza). Pôvodcom ochorenia je obligátny intracelulárny parazitický prvok, Toxoplasma gondii. Parazit je rozšírený kozmopolitne a nakoľko nie je druhovo špecifický, je schopný infikovať väčšinu teplokrvných stavovcov, vrátane človeka. Sérologické prehľady o prevalencii toxoplazmózy v populácii svedčia o tom, že toxoplazmóza patrí k najčastejším parazitárnym ochoreniam na svete [23, 35, 68, 69].
Práve v tomto roku ubehlo od objavenia pôvodcu toxoplazmózy rovných 100 rokov. Za toto obdobie sa stala toxoplazmóza jedným z najsledovanejších parazitárnych ochorení a to nielen vo vzťahu k zvieratám, ale predovšetkým vo vzťahu k človeku a jeho zdraviu. Po objavení skutočnosti, že aj človek môže byť jedným z mnohých medzihostiteľov parazita, sa postupne začala venovať toxoplazmóze zvýšená pozornosť zo strany lekárov a výskumných pracovníkov.
Úspešne sa podarilo opísať tak kompletný životný cyklus prvoka s jeho špecifikami, ako aj cesty jeho prenosu, čo uľahčilo jeho taxonomické zaradenie. V oblasti medicíny a epidemiológie boli opísané klinické príznaky toxoplazmovej infekcie a cesty prenosu infekcie na človeka. Postupne boli vyselektované rizikové skupiny ľudí - tehotné ženy a ich plod, novorodenci, osoby s imunodeficienciou, onkologickí a transplantovaní pacienti. Predovšetkým u osôb s oslabeným imunitným systémom môže dôjsť k reaktivácii už existujúcej latentnej toxoplazmózy. Toxoplazmóza bola identifikovaná ako jedno z najčastejších oportúnnych ochorení u ľudí s AIDS.
Významný pokrok bol zaznamenaný aj v oblasti diagnostiky toxoplazmózy. Veľký rozvoj ešte aj dnes zaznamenáva sérologická diagnostika. V súčasnosti laboratóriá disponujú širokým spektrom diagnostických testov, ktoré umožňujú rozlíšiť akútne štádium toxoplazmózy od chronického, resp. latentného štádia. Sérologická diagnostika sa postupne vyvíjala od náročných a zložitých pracovných postupov smerom k rýchlej a plne automatizovanej diagnostike. Hlavne v posledných rokoch sa do popredia dostávajú metódy molekulárnej biológie zamerané na priamy dôkaz DNA parazita v biologickom materiáli. Tieto metódy sú vysoko špecifické a poskytujú rýchly výsledok [42].
Aj v súčasnej dobe toxoplazmóza zaujíma popredné miesto vo výskume medicínskych a biologických odborov. Napriek veľkému pokroku v poznaní a diagnostike ešte ani dnes nie je problematika toxoplazmózy definitívne vyriešená. Mnohé otázky už boli zodpovedané, no stále vyvstávajú nové, na ktoré sa odborníci pokúšajú nájsť presvedčivú odpoveď.
Doposiaľ nebola vyvinutá účinná a bezpečná vakcína pre použitie v humánnej medicíne. Bráni tomu zložitá štruktúra parazita, antigénna rôznorodosť, zmena antigénnej skladby v závislosti od vývinového štádia, ako aj intracelulárna lokalizácia parazita [9, 33, 40, 55]. Nedoriešená zostáva stále otázka reaktivácie latentnej infekcie u imunodeficientných pacientov a tehotných žien, sérologický monitoring darcov a príjemcov transplantovaných orgánov, ako aj vývoj nových, rýchlych a spoľahlivých diagnostických metód. V poslednom období boli publikované články o možnom vplyve latentnej toxoplazmózy na telesnú hmotnosť gravidných žien, ľudské správanie, charakteristiku osobnosti, psychomotorické reakcie a iné [15, 16, 34, 39, 65].
História objavenia a počiatky diagnostiky
História toxoplazmózy sa spája s menami troch vedcov, ktorí sa podieľali na objavení pôvodcu ochorenia. V roku 1908 Nicolle a Manceaux z Pasteurovho ústavu v Tunise objavili u severoafrického hlodavca (Ctenodyctylus gondii) dovtedy neznámeho parazitického prvoka a pomenovali ho Toxoplasma gondii [37, 69]. V tom istom roku v Brazílii nezávisle od nich izoloval parazita z mozgu králika aj Splendore [66].
Dôležitým medzníkom vo vzťahu parazita k zdraviu človeka bola práca českého oftalmológa Janků, ktorý v roku 1923 prvýkrát pozoroval parazitárne cystické útvary v histologických rezoch z ťažko poškodenej sietnice 11-mesačného chlapca s hydrocefalom, ľavostranným mikroftalmom a obojstrannými degeneratívnymi ložiskami v oblasti žltej škvrny. Nález uverejnený v odbornom lekárskom časopise však zostal z neznámych príčin nepovšimnutý a bez náležitého ohlasu [31, 37]. Janků ukázal preparáty Francúzovi Levaditimu, ktorý spoznal prvoka T. gondii, dovtedy známeho iba u zvierat, a v roku 1928 v odbornom článku uverejnil fotografiu histologického rezu sietnice s typickou toxoplazmovou cystou. Na počesť Dr. Janků sa preto v staršej literatúre píše o toxoplazmóze ako o chorobe Janků (morbus Janků, Janků disease) [37].
Rodový názov Toxoplasma je odvodený z gréckeho slova toxon (oblúk, luk) pre typický rožkovitý tvar vegetatívnej formy parazita. Rod Toxoplasma taxonomicky patrí do kmeňa Apicomplexa, ktorý zahŕňa intracelulárne parazitické prvoky s charakteristickou bunkovou štruktúrou a usporiadaním organel a cytoskeletového komplexu na apikálnom konci bunky [3].
Životný cyklus T. gondii sa však podarilo skompletizovať pomerne neskoro, až v roku 1969, kedy Hutchison et al. ako prví objasnili zložitý biologický cyklus parazita a poukázali na epidemiologický význam mačky ako definitívneho hostiteľa [26, 27, 28].
Podľa spôsobu získania infekcie rozoznávame dve základné formy toxoplazmózy – kongenitálnu (vrodenú) a akvirovanú (získanú postnatálne), ktoré sa líšia priebehom aj klinickými príznakmi. Kongenitálna toxoplazmóza vzniká ako následok transplacentárneho prenosu infekcie z matky na plod. Kongenitálna forma toxoplazmózy bola pre jej typické symptómy známa podstatne skôr ako získaná toxoplazmóza. Je charakterizovaná triádou príznakov – hydrocefalus, cerebrálne kalcifikácie, chorioretinitída [73], ku ktorým sa môžu pridružiť aj kŕče a poruchy CNS - tzv. Sabinova tetráda [62]. Najčastejšou a najtypickejšou formou postnatálne akvirovanej toxoplazmózy je uzlinová forma. Siim ako prvý opísal v roku 1951 prípady uzlinovej formy získanej toxoplazmózy. Podarilo sa mu izolovať niekoľko kmeňov T. gondii z lymfatických uzlín [63, 64].
Základy sérologickej diagnostiky toxoplazmózy položili v roku 1948 Sabin a Feldman, ktorí použili na dôkaz protilátok neutralizačný test [61]. Sabin-Feldmanov test (SFT, dye test) je dodnes považovaný za „zlatý štandard“ v sérologickej diagnostike toxoplazmózy a v mnohých krajinách sa používa ako základný screeningový test. Postupne boli vyvíjané a zdokonaľované novšie sérologické metódy založené na rôznych princípoch stanovenia protilátok. Komplement fixačnú reakciu (KFR) do diagnostiky zaviedli Nicolau a Ravelo (1937) a postupne ju zdokonalili Warren so Sabinom (1942) ako aj Steen, Kaas a Westphal (1951). Frenkel (1948) použil na zistenie prekonanej toxoplazmovej infekcie intradermálny test (IDT), v ktorom použil toxoplazmový antigén - toxoplasmin. Imunofluorescenčný test zaviedol do diagnostiky toxoplazmózy Goldman (1957), ktorý zistil, že je možné dokázať protilátky za pomoci fluoresceínom značenej protilátky - tzv. konjugátu [19, 20, 21]. Postupne boli zavedené aj ďalšie sérologické metódy, ako nepriama hemaglutinácia (Jacobs a Lunde, 1957), mikroprecipitácia v agarovom géli - MPA a aglutinačná reakcia [37].
V súčasnej dobe majú v diagnostike toxoplazmózy dominantné zastúpenie metódy enzýmovej imunoanalýzy a jej modifikácie (ELISA, ELISA capture), metódy proteínovej analýzy (Western-blot) a v neposlednom rade aj molekulárno-biologické metódy (PCR, real-time PCR).
V bývalom Československu zaviedol diagnostiku toxoplazmózy v roku 1948 Havlík [37]. Na Slovensku položil základy výskumu toxoplazmózy Čatár [7, 8, 9]. V súčasnosti sa toxoplazmóze na Slovensku intenzívne venuje Ondriska [50, 51, 52, 53].
Laboratórna diagnostika
Laboratórna diagnostika toxoplazmózy (obr. 1) je založená na sérologickom vyšetrení, histologickom vyšetrení tkanív, lymfatických uzlín a placenty, priamom dôkaze DNA metódami molekulárnej biológie (PCR), alebo na izolácii T. gondii pokusom na laboratórnych myšiach [47, 57].
1. Laboratórna diagnostika toxoplazmózy – schéma vyšetrovacích postupov Fig. 1. Laboratory diagnosis of toxoplasmosis – scheme of test procedures 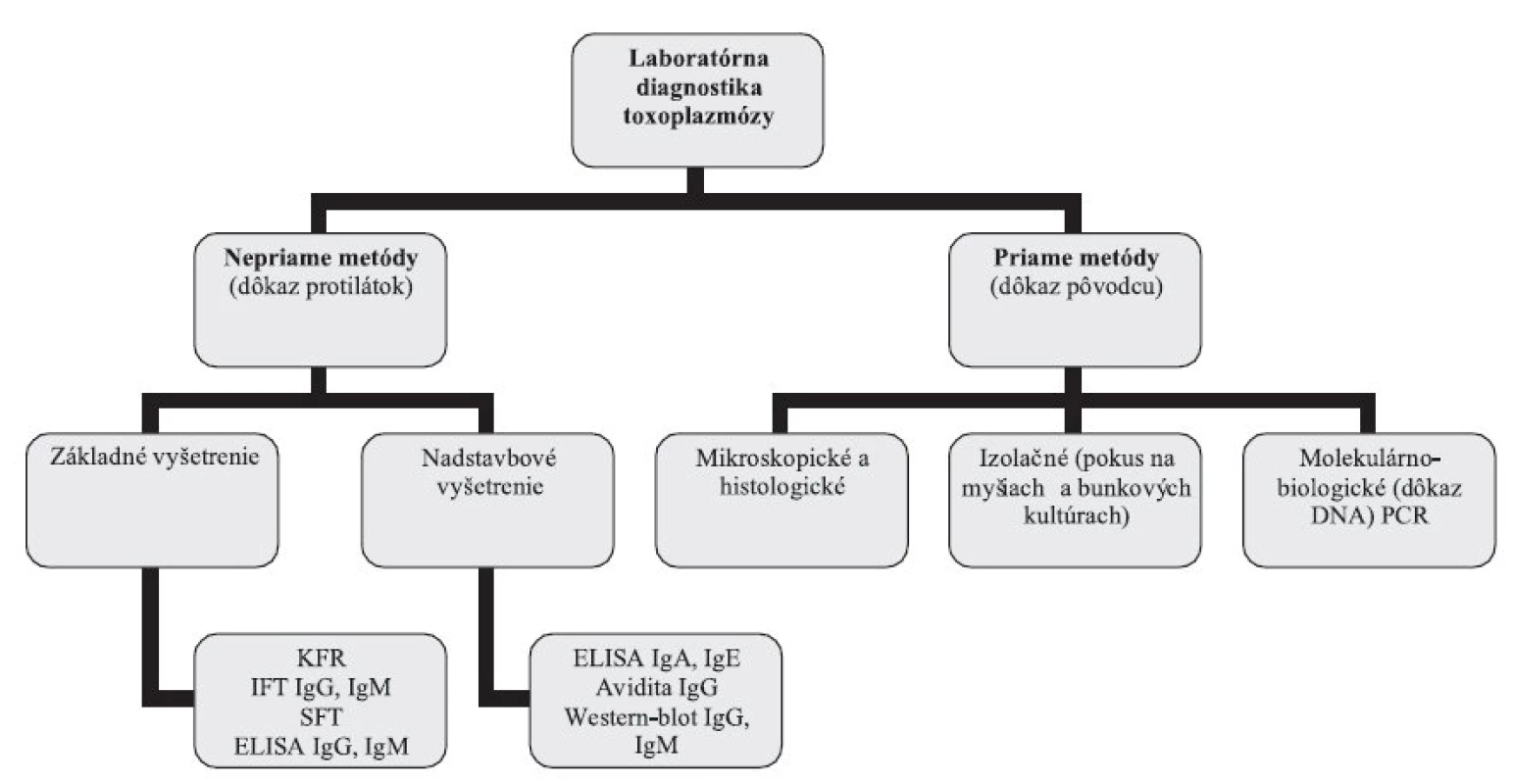
Diagnostika toxoplazmózy je na základe klinických príznakov značne problematická, pretože neexistuje žiadny typický symptóm, ktorý by jednoznačne určoval diagnózu. Klinické prejavy môžu byť veľmi rozmanité, od bezpríznakového priebehu až po ťažké klinické stavy. Vzhľadom na vysokú rozmanitosť klinických prejavov musí byť vybraná vhodná vyšetrovacia metóda. Často je limitujúcim faktorom overenia klinickej diagnózy iba diferenciálne laboratórne vyšetrenie. Rutinná laboratórna diagnostika sa opiera predovšetkým o nepriame diagnostické metódy na dôkaz toxoplazmových protilátok v sére [7, 51].
K určeniu diagnózy napomáhajú aj fyzikálne diagnostické metódy ako je sonografia, magnetická rezonancia, počítačová tomografia, oftalmologické a neurologické vyšetrenie.
V súčasnosti je diagnostika toxoplazmózy v Slovenskej republike legislatívne upravená Odborným usmernením MZ SR o diagnostike toxoplazmózy [49].
Metódy priameho dôkazu – mikroskopia, izolácia pokusom na myšiach
V začiatkoch laboratórnej diagnostiky sa parazit v suspektnom biologickom materiáli diagnostikoval výlučne priamym dôkazom – mikroskopicky. Vhodným materiálom sú zväčšené uzliny, likvor, plodová voda, placenta a pitevný materiál, z ktorých sa pripravia histologické preparáty. Preparáty sa farbia hematoxylín-eozínom alebo podľa Giemsu. Mikroskopickým vyšetrením je možné dokázať voľné tachyzoity, pseudocysty a tkanivové cysty.
Tachyzoity predstavujú rýchlo sa deliace vegetatívne štádium parazita, merajú 2x6 μm a majú rožkovitý tvar s jedným ostrým a jedným tupým pólom. Mimo bunky môžu dosahovať väčšie rozmery 4x10 μm. Tachyzoity sa môžu v hostiteľských bunkách pomnožiť a vytvárať toxoplazmové pseudocysty. Majú zložitú vnútrobunkovú štruktúru s typickým apikálnym komplexom. Tachyzoity sa po určitom čase diferencujú na pomaly sa deliace bradyzoity. V tkanivách medzihostiteľa sa vytvárajú sférické tkanivové cysty, ktoré obsahujú desiatky až stovky bradyzoitov. Tkanivové cysty majú rôznu veľkosť. Mladé tkanivové cysty sú veľké približne 5 μm, kým staršie merajú 70-100 μm. Najčastejšie sú lokalizované v nervovom tkanive a svaloch, vrátane mozgu, oka a srdcového svalu [11]. Citlivosť mikroskopického vyšetrenia je možné zvýšiť použitím imunofluorescenčnej techniky [37, 47].
Mikroskopický dôkaz parazita neznamená vždy stopercentnú záruku úspechu a je vhodný iba v akútnom štádiu ochorenia. V rutinnej diagnostike toxoplazmózy sa dnes mikroskopia využíva málo. Nevýhodu v tomto smere môže predstavovať požiadavka na vysoko školený personál, nakoľko správne zhodnotenie mikroskopického nálezu si vyžaduje určitú prax a erudíciu.
V čase akútneho štádia je možné vykonať aj izoláciu parazita pokusom na laboratórnych myšiach, tkanivových kultúrach alebo kuracích embryách. Takáto diagnostika priameho dôkazu parazita je veľmi náročná a v podmienkach rutinnej diagnostiky bežne nedostupná. Použité myši musia pochádzať z kontrolovaného chovu a musia byť pred pokusom sérologicky vyšetrené na neprítomnosť toxoplazmových protilátok. Sterilne odobratý materiál sa inokuluje myšiam intraperitoneálne. Ak je vo vyšetrovanom materiáli prítomný virulentný kmeň T. gondii, myši hynú spravidla do 6–10 dní. V peritoneálnom exudáte, mozgu a slezine je možné nájsť voľné tachyzoity a neskôr aj tkanivové cysty. Pokiaľ myši prežívajú, infekcia je dokázateľná až po niekoľkých týždňoch sérologicky. Izolácia na myšiach je vysoko citlivá, nevýhodou je ale skutočnosť, že je časovo náročná a výsledky sú dostupné až po 4-6 týždňoch. Izolácia parazita na bunkových kultúrach je menej citlivá, ale výsledok je dostupný už po 10 dňoch [7, 37, 47].
Pozitívny mikroskopický alebo kultivačný dôkaz je potrebné hodnotiť vždy v spojení so sérologickým vyšetrením.
Dôkaz DNA Toxoplasma gondii (PCR)
Aj napriek širokým možnostiam nepriamej diagnostiky môže byť interpretácia sérologických výsledkov v niektorých prípadoch problematická, a to hlavne u gravidných žien, novorodencov, imunosuprimovaných a imunodeficientných pacientov, alebo pri očnej forme toxoplazmózy. V takýchto prípadoch je možné pre jednoznačné potvrdenie diagnózy využiť techniky molekulárnej biológie a vykonať priamy dôkaz parazita. Zavedenie polymerázovej reťazovej reakcie (Polymerase Chain Reaction, PCR) výrazne prispelo k zdokonaleniu prenatálnej diagnostiky kongenitálnej toxoplazmózy a toxoplazmózy u imunodeficientných pacientov [2].
Ako laboratórna technika bola PCR koncipovaná v roku 1983 v laboratóriách Cetus Corporation Kary Mullisom, ktorý dostal v roku 1993 za tento objav Nobelovu cenu za chémiu [48].
PCR je dostatočne citlivá, rýchla a vysoko špecifická metóda na priamy dôkaz DNA T. gondii. Napriek nižšej senzitivite, ktorá sa pohybuje od 60 do 80 %, špecifickosť a pozitívna prediktívna hodnota PCR je až 100 % [59]. Jej princíp spočíva v označení špecifického úseku DNA pomocou primerov a namnožení veľkého počtu kópií za účelom jeho nasledovnej identifikácie. Cyklus amplifikácie sa skladá z troch čiastkových reakcií (denaturácia, anelácia, elongácia), pričom každá si vyžaduje inú špecifickú teplotu. Po prebehnutí dostatočného počtu cyklov (20-60 cyklov) sa fragmenty namnoženej DNA pomocou elektroforézy v agarózovom géle rozdelia a vizualizujú sa za pomoci etídium bromidu a UV svetla [41]. Celkový čas potrebný na spracovanie vzorky, priebeh samotnej PCR, elektroforézu a vyhodnotenie reakcie si vyžaduje približne 5-6 hodín.
V súčasnosti sa do popredia dostáva metóda real-time PCR, teda PCR prebiehajúca v reálnom čase, ktorá je kombináciou klasickej PCR a metódy dôkazu pomocou fluorescenčne značených sond. Kombinuje kroky amplifikácie a detekcie produktov do jedného kroku a skracuje čas potrebný na vyšetrenie na približne 1,5-3 hodiny. Celý proces samotnej reakcie je plne automatizovaný a jej priebeh sa zobrazuje na monitore počítača vo forme grafu. Amplifikácia aj detekcia prebiehajú na rozdiel od klasickej PCR v uzavretej sklenenej kapiláre, čím sa značne znižuje riziko kontaminácie analyzovanej vzorky. Je možné ju vykonávať tak kvalitatívne ako i kvantitatívne [5, 10, 41, 45].
Na detekciu T. gondii pomocou PCR sa využíva niekoľko cieľových miest. Najčastejšie sa dokazujú 3 cieľové miesta, medzi ktorými neboli zistené štatisticky významné rozdiely.
- B1 gén, ktorý sa v genóme T. gondii nachádza v 35 kópiách
- sekvencia AF146527, v 200-300 kópiách
- fragment ribozomálnej podjednotky 18S rDNA, v 110 kópiach.
Na dôkaz je možné použiť aj ďalšie známe cieľové miesta DNA parazita, napr. gén kódujúci hlavný povrchový antigén P30, gény pre α-tubulín a β-tubulín a nekódujúcu repetitívnu sekvenciu TGR1, od ktorej použitia sa dnes už upúšťa [2, 6, 14, 56].
PCR techniky je možné s výhodou aplikovať pri dôkaze T. gondii zo vzoriek plodovej vody, fetálnej a pupočníkovej krvi a placenty v prípade podozrenia na kongenitálnu toxoplazmózu, likvoru v prípade podozrenia na neurotoxoplazmózu, očnej tekutiny v prípade podozrenia na očnú formu toxoplazmózy, moču a plnej krvi (leukocytárna frakcia) v akútnej fáze ochorenia [2, 5, 6, 17, 29].
Najväčšou nevýhodou PCR je skutočnosť, že neexistuje štandardizácia metódy. Naopak, existuje veľa tzv. „home made“ pracovných postupov, ktoré využívajú rôzne primery a rôzne cieľové miesta, vrátane rôzneho spracovania vzorky a extrakcie DNA. Dôležité je zabrániť riziku kontaminácie vyšetrovanej vzorky „cudzou“ DNA, prípadne nežiaducim vplyvom rôznych inhibítorov.
Podmienky transportu materiálu, jeho trvácnosť a minimálny požadovaný objem na PCR vyšetrenie toxoplazmózy sú uvedené v tab. 1.
1. Požiadavky na odber, transport a uchovávanie vzoriek určených na PCR vyšetrenie Upravené, zdroj: (http://www.pamf.org/serology/requirements.html) Table 1. Sampling, transport and storage requirements applicable to specimens for PCR testing Adapted, source: (http://www.pamf.org/serology/requirements.html) 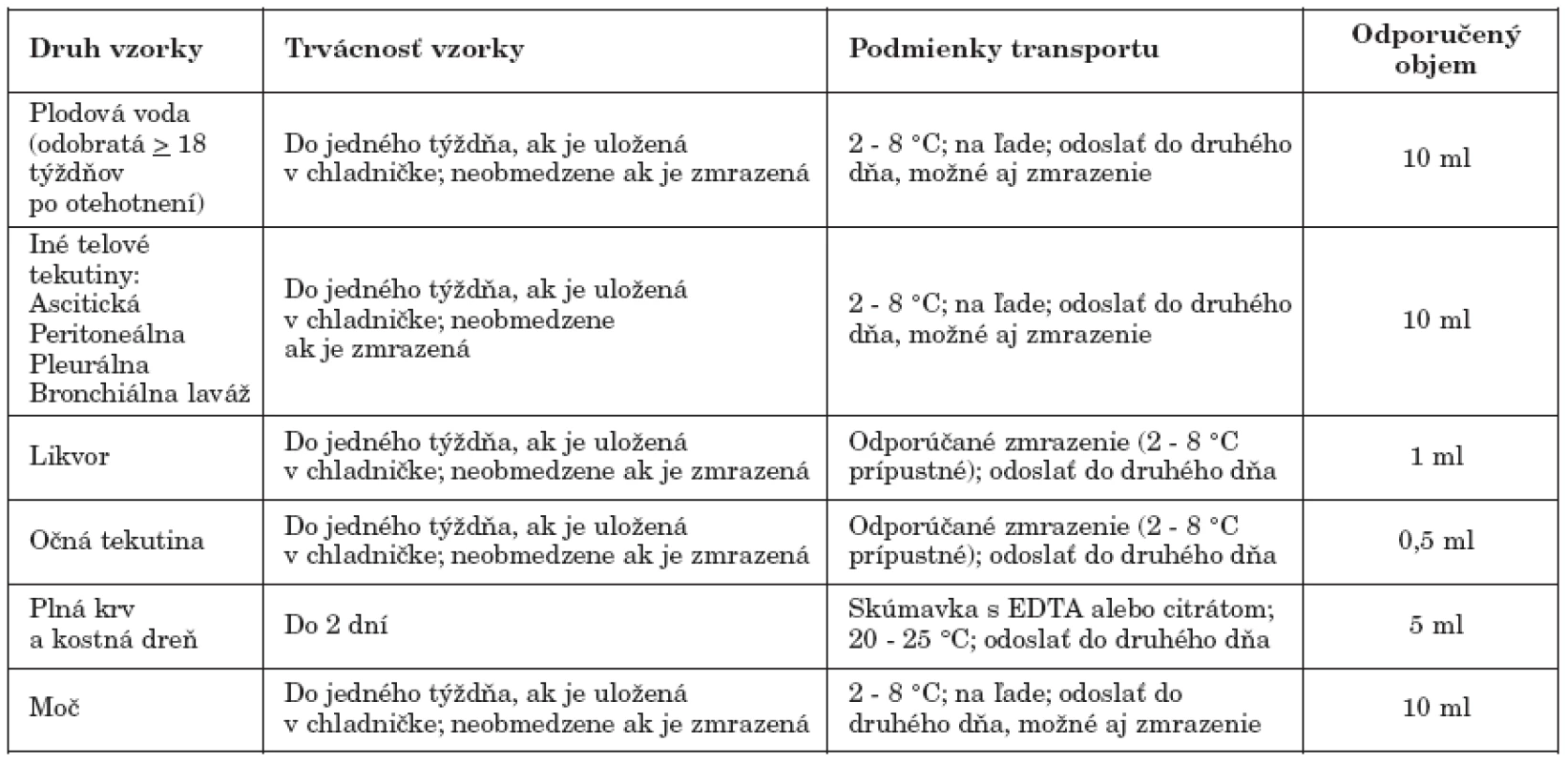
Metódy nepriameho dôkazu – sérologické metódy
Využitie priamych metód detekcie v bežných laboratóriách je značne limitované ich finančnou nákladnosťou a vysoko školeným personálom. Z toho dôvodu sa základná laboratórna diagnostika opiera predovšetkým o dôkaz toxoplazmových protilátok v sére, plazme, likvore a očnej tekutine.
Zavedenie sérologických metód znamenalo obrovský prínos v diagnostike toxoplazmózy. Diagnostickým medzníkom bolo zavedenie Sabin-Feldmanovho neutralizačného testu a komplement fixačnej reakcie. Postupne boli vyvinuté aj ďalšie sérologické metódy. Niektoré sa už dnes nepoužívajú, ale stále sa objavujú nové progresívnejšie metódy s vysokou citlivosťou a špecifickosťou.
Keďže sa veľká časť populácie počas svojho života stretla s toxoplazmovou infekciou, a určité hladiny protilátok pretrvávajú po celý život, nestačí iba zistiť, či pacient má alebo nemá vytvorené protilátky. Úlohou sérologickej diagnostiky je rýchle a správne určenie štádia infekcie, pokiaľ možno z jednej vzorky séra, čo je rozhodujúcim predpokladom pre začatie adekvátnej terapie. Vyšetrenia môžeme rozdeliť do dvoch úrovní – základnej a nadstavbovej diagnostiky. Prvý krok je nasmerovaný na tzv. screeningovú detekciu prítomnosti toxoplazmovej infekcie. V druhom kroku je nutné pomocou vhodne zvolených metód určiť o aké štádium infekcie sa jedná. Kombináciou vhodných testov umožňujúcich stanovenie jednotlivých tried imunoglobulínov a sledovaním dynamiky tvorby protilátok možno odlíšiť akútnu infekciu od latentnej, neaktívnej infekcie [51].
V našich podmienkach sa ako základné screeningové vyšetrenie celkových protilátok používa komplement fixačná reakcia (KFR), prípadne nepriamy imunofluorescenčný test (IFT). V iných štátoch (USA, niektoré krajiny západnej Európy) sa ako screeningová metóda používa neutralizačný test in vitro podľa Sabin–Feldmana (SFT). Na dôkaz jednotlivých imunoglobulínových tried sú najvhodnejšie metódy enzýmovej imunoanalýzy (ELISA) a jej modifikácie. Medzi novšie konfirmačné metódy sa zaraďuje proteínová analýza protilátok Western-blot. Menej časté metódy detekcie sú latexová aglutinácia, ISAGA (Immunosorbent Agglutination Assay) a iné. V minulosti sa tiež používala imunoelektroforéza v agare [25] a nepriama hemaglutinácia. Nedávno bola publikovaná neinvazívna screeningová metóda dôkazu špecifických IgG protilátok v slinách [67].
Protilátky IgM sú markerom akútnej infekcie. Dajú sa zistiť už 2-4 týždne po objavení sa klinických príznakov a vymiznú do 9 mesiacov po nákaze. U niektorých pacientov však môžu pretrvávať v nízkych hladinách oveľa dlhšiu dobu (viac ako 12 mesiacov od infekcie) a podstatne tak komplikovať interpretáciu vyšetrenia.
Prítomnosť IgA protilátok je dôležitým potvrdením akútnej infekcie, pretože IgA spravidla vymiznú skôr ako IgM (do 6-9 mesiacov). Protilátky triedy IgA majú diagnostický význam pre detekciu kongenitálnej toxoplazmózy, reaktivácie infekcie, určenie recentnej infekcie u tehotných žien. Stanovenie IgA je nevyhnutné v sporných prípadoch, kedy IgM neposkytuje jednoznačnú informáciu. V niektorých prípadoch sa pozoruje, podobne ako pri IgM, ich dlhodobá nešpecifická perzistencia po dobu viac ako 12 mesiacov.
V poslednom čase našli svoje miesto v diagnostike aj IgE protilátky, ktoré podľa niektorých autorov dobre korelujú s počiatkom infekcie a rovnako ako IgA a IgM sú markerom akútnej infekcie. Navyše majú rýchlu kinetiku, vďaka čomu ich hladina v sére klesá pod detekčný limit už do 4 mesiacov od infekcie. Ich stanovenie sa používa ako komplementárny test pri diagnostike včasnej akútnej infekcie, reaktivácii latentnej toxoplazmózy, kongenitálnej toxoplazmózy a toxoplazmovej chorioretinitídy a encefalitídy. Nedokázali sa u ľudí s chronickou toxoplazmózou [22, 47, 54, 71]. Naopak, iné publikované práce nepotvrdili tvrdenia o rýchlom poklese IgE protilátok, pričom poukázali na individuálne rozdiely v imunitnej odpovedi a na ich možnú nešpecifickú perzistenciu spolu s IgM a IgA protilátkami [52, 74].
Významným zistením je skutočnosť, že markery akútnej infekcie (IgM, IgA, IgE) neprechádzajú cez placentárnu bariéru z matky na dieťa, čo má veľký význam pri diagnostike akútnej toxoplazmózy novorodenca [47, 58].
Protilátky IgG sa v sére objavujú neskôr, vrchol dosahujú po 6 mesiacoch a len pozvoľne klesajú. V nízkych titroch potom pretrvávajú niekoľko rokov, často aj po celý život. Prítomnosť IgG protilátok u imunokompetentných osôb svedčí skôr pre odznievajúcu ako akútnu infekciu. Materské IgG protilátky klesajú po narodení a vymiznú za 6-12 mesiacov.
Na presné určenie fázy ochorenia sa s úspechom využíva stanovenie avidity IgG protilátok, ktoré významne napomáha odlíšeniu práve prebiehajúcej infekcie od starej chronickej, prípadne latentnej infekcie. Avidita vyjadruje pevnosť väzby medzi antigénom a protilátkou. Protilátky, ktoré sa tvoria v prvých fázach infekcie sa neviažu k antigénu príliš pevne, ich avidita je nízka – tzv. nízkoavidné protilátky (index avidity < 30 %). V priebehu infekcie postupne imunitná odpoveď vyzrieva a avidita protilátok narastá [38, 57, 75]. U menej ako 5 % pacientov, ktorí prekonali toxoplazmózu, sa ani po 4 mesiacoch od infekcie avidita nezvyšuje napriek tomu, že sa zjavne nejedná o akútnu toxoplazmózu. Dokonca boli zaznamenané prípady produkcie nízko avidných protilátok aj 11 mesiacov po infekcii [1, 57].
Porovnaním hladín jednotlivých imunoglobulínových tried možno vo väčšine prípadov odlíšiť akútnu a chronickú infekciu. Pri akútnej toxoplazmóze hladiny protilátok stúpajú (IgM a IgA strmo, IgG pozvoľne), takže v sére je možné zistiť vysoký titer špecifických protilátok typu IgM a IgA prípadne IgE, zatiaľ čo hladiny IgG sú spočiatku nízke. Vzostup titra protilátok svedčí o aktívnej infekcii, stabilne vysoké titre o nedávnej odznievajúcej infekcii a stabilne nízke titre o chronickej, latentnej infekcii. Po doznení akútnej fázy sú titre celkových protilátok stabilné alebo klesajú, hladiny IgM a IgA postupne klesajú až na hranicu citlivosti stanovenia, zatiaľ čo IgG sa dlhodobo udržujú na vysokých hodnotách a klesajú len pomaly. U osôb s latentnou toxoplazmózou sú titre celkových protilátok nízke, trvalo sa udržujú nízke hladiny IgG, kým IgA a IgM nie sú v sére vôbec prítomné [36].
Napriek hore uvedeným skutočnostiam je častokrát ťažké urobiť jednoznačný záver na základe jedného vyšetrenia. V prípade akýchkoľvek nejasností sa odporúča vyšetrenie opakovať s odstupom 2-3 týždňov a sledovať dynamiku tvorby protilátok (pokles alebo vzostup titra), jednak celkových, ako aj jednotlivých imunoglobulínových tried.
Komplement fixačná reakcia (KFR)
Komplement fixačnú reakciu do diagnostiky zaviedli Nicolau a Ravelo už v roku 1937 a postupne bola zdokonaľovaná a modifikovaná. KFR predstavuje spoľahlivú screeningovú metódu v základnej diagnostike toxoplazmózy. V bývalom Československu zaviedol KFR do používania Jíra et al. v roku 1957 [32]. Na reakciu sa používa kvalitný purifikovaný antigén, ktorý sa získava tween-éterovou extrakciou T. gondii [56]. Metóda prešla postupne viacerými zmenami a v súčasnosti sa používa jej mikromodifikácia podľa Zástěru et al. [77]. Metóda je dobre štandardizovaná, má dlhoročnú tradíciu a je preverená dlhodobým používaním.
Nevýhodou KFR je nemožnosť odlíšenia protilátok triedy IgG, IgM a IgA, časová náročnosť a náročnosť na presnosť práce a erudíciu. Na druhej strane, získané výsledky sú štandardné, dobre reprodukovateľné a výborne korelujú s ostatnými metódami. Opakované vyšetrenie vzoriek umožňuje sledovať dynamiku tvorby protilátok. Pre akútnu infekciu svedčí aspoň štvornásobný vzostup titra. Už jedno vyšetrenie však poskytne základnú predstavu o tom, či je pacient vôbec infikovaný a v akom štádiu ochorenia sa pravdepodobne nachádza [36]. Používanie KFR (IFT) v diagnostike toxoplazmózy má význam aj v tom, že slúži ako paralelná metóda k prevereniu a porovnaniu výsledkov získaných metódou ELISA, nakoľko má úplne odlišný princíp a umožňuje tak odhaliť prípadné nešpecifické alebo falošne negatívne/pozitívne výsledky získané imunoanalytickými testami. KFR predstavuje optimálnu screeningovú metódu pre vyšetrovanie toxoplazmózy a je vhodná aj na epidemiologické štúdie [37].
Protilátky dokazované KFR sa začínajú objavovať 2-3 týždne po nákaze s maximom o 5-6 mesiacov. Potom postupne klesajú a pretrvávajú v nízkych titroch po celý život. U imunokompetentných osôb je možné konštatovať, že nízke titre KFR (1 : 8, 1 : 16, 1 : 32) svedčia o latentnej toxoplazmóze, kým vysoké titre (>1 : 256) svedčia o akútnej infekcii. KFR sa využíva ako základný screeningový test, ktorým by malo byť vyšetrené každé sérum. V prípade pozitívnych výsledkov je potrebné doplniť vyšetrenie o ďalšie metódy stanovenia [50].
V poslednom období sa však aj na Slovensku prejavuje vplyv zavádzania rýchlych, menej prácnych a časovo nenáročných metód (ELISA IgG) a KFR sa dostáva postupne do úzadia.
Neutralizačný „dye test“ podľa Sabin-Feldmana
Je založený na princípe zmeny morfológie a farbiteľnosti živých trofozoitov alkalickým roztokom metylénovej modrej vplyvom protilátok imúnneho séra. Je to veľmi citlivá a špecifická metóda a protilátky deteguje už veľmi krátko po infekcii [61]. SFT sa v našich podmienkach nepoužíva, pretože jeho praktické prevedenie je komplikované a navyše sa pracuje zo živými kmeňmi T. gondii, takže hrozí riziko nákazy laboratórnych pracovníkov [51]. Rovnako je potrebné udržiavať pasážovaním na laboratórnych myšiach živý kmeň T. gondii. V štátoch západnej Európy a USA však predstavuje základný screeningový test a dodnes je považovaný za „zlatý štandard“ v sérologickej diagnostike toxoplazmózy [47].
Metódy enzýmovej imunoanalýzy (ELISA)
ELISA testy (Enzyme linked immunosorbent assay) sú dnes najpoužívanejšími metódami v sérologickej diagnostike toxoplazmózy. Umožňujú ako kvalitatívne, tak aj kvantitatívne stanovenie protilátok. Ich výhodou je, že umožňujú odlíšiť jednotlivé typy imunoglobulínových tried – IgA, IgM, IgG a IgE, majú vysokú citlivosť a špecifickosť. Pracujú s mikro objemami, nakoľko reakcia prebieha v jamke mikroplatničky. ELISA metódy sú nenáročné na čas a výsledky sú k dispozícii už za pár hodín. Celý proces, od riedenia sér až po vyhodnotenie výsledkov je možné plne automatizovať a významne tak minimalizovať prácnosť, či možnosť vzniku chýb pri nepresnom pipetovaní. Vhodnou kombináciou ELISA testov je možné vo väčšine prípadov odlíšiť akútnu infekciu od latentnej. Na trhu existuje celý rad rôznych variant a modifikácií ELISA testov od rôznych výrobcov, ale ich citlivosť a špecifickosť v závislosti od výrobcu značne varíruje.
Na stanovenie IgG protilátok sa používa jednoduchá (sandwich) ELISA metóda, kedy je na povrch jamky naviazaný solubilný antigén. Do jamky sa aplikuje vyšetrované sérum. Ak sú v sére prítomné protilátky, tieto sa viažu na antigén. V druhom kroku sa do reakcie pridá protilátka (konjugát) proti ľudskému IgG značená vhodným enzýmom. Vytvorené komplexy antigén - protilátka sa potom vizualizujú tak, že enzým katalyzuje premenu pridávaného bezfarebného substrátu na farebný produkt. Množstvo vytvoreného produktu je priamo úmerné množstvu dokazovanej protilátky. Medzi najčastejšie používané značkovacie enzýmy patrí chrenová peroxidáza a alkalická fosfatáza. Intenzita reakcie sa odčíta vizuálne alebo sa zmeria absorbancia na spektrofotometri.
Na stanovenie protilátok typu IgA, IgM, prípadne IgE sa požíva tzv. „ELISA capture“ (double sandwich), kedy je enzýmom značená sekundárna protilátka. Povrch jamky je potiahnutý myšacou monoklonálnou IgG protilátkou proti ľudskému IgA, IgM či IgE, ktorá vyviaže dokazovanú protilátku z vyšetrovanej vzorky. V prvom kroku dochádza k väzbe všetkých protilátok príslušnej triedy, vrátane špecifických toxoplazmových, a v nasledujúcom kroku sa aplikuje „enzyme tracer“ – t.j. komplex antigénu a sekundárnej monoklonálnej IgG protilátky značenej enzýmom. Pomocou „ELISA capture“ je možné vylúčiť prípadnú falošnú pozitivitu IgM protilátok a eliminovať tak vplyv reumatoidného faktora, resp. falošnú negativitu pri vysokých hladinách IgG protilátok [47].
Proteínová analýza Western-blot
Proteínová analýza Western-blot (imunoblot) je založená na použití purifikovaných rekombinantných antigénov tachyzoitov a bradyzoitov parazita. Najčastejšie sa používajú povrchový antigén SAG1, roptriový antigén ROP1, granulárne antigény GRA7 a GRA8 a matrixový antigén MAG1.
Antigény Toxoplasma gondii sú elektroforeticky separované a imobilizované na nitrocelulózovej membráne. Jednotlivé prúžky sa inkubujú s vyšetrovanou vzorkou, pričom dochádza k väzbe špecifických protilátok prítomných vo vyšetrovanej vzorke na príslušné antigény. Značenie je, podobne ako u ELISA metódy, enzymatické. Väzba je vizualizovaná za pomoci substrátového roztoku. Je to vysoko citlivá a vysoko špecifická kvalitatívna metóda na dôkaz IgM, IgA a IgG špecifických protilátok, ktorá sa požíva ako konfirmačný test pre odlíšenie akútnej a chronickej fázy infekcie. Modifikovaný Western-blot je možné použiť aj na stanovenie avidity IgG protilátok [75].
Ondriska et al. [53] poukázali na fakt, že protilátky IgA a IgM detegované imunoblotom kopírujú protilátky dokazované ELISA testom aj v prípade ich nešpecifickej perzistencie. Stanovenie IgG protilátok metódou Western-blot má však veľký význam v diagnostike kongenitálnej toxoplazmózy. Proteínová analýza umožňuje porovnať sérologický profil matky a novorodenca, a tým diferencovať prenesené materské IgG protilátky od novo syntetizovaných protilátok novorodenca v prvých mesiacoch života [58, 76].
Interpretácia výsledkov u rizikových skupín
Nakoľko je sérologická diagnostika toxoplazmózy komplikovaná, v mnohých štátoch boli odborníkmi vypracované algoritmy vyšetrovacích postupov pre jednotlivé rizikové skupiny pacientov, spolu s interpretáciou výsledkov a odporúčaním pre klinického pracovníka [36, 47, 49, 51].
Dôležitou súčasťou sérologickej diagnostiky je vyšetrovanie gravidných žien. Nebezpečná je hlavne primoinfekcia, kedy sa žena prvýkrát infikuje až v priebehu tehotenstva alebo krátko pred otehotnením. Pravdepodobnosť prenosu infekcie rastie so štádiom gravidity, kým závažnosť poškodenia plodu a klinickej manifestácie infekcie klesá [12, 51]. V praxi sa osvedčuje screening vychádzajúci zo schémy, kedy sú budúce matky prvýkrát vyšetrené čo najskôr po potvrdení tehotenstva (celkové protilátky, IgG, IgM). Ženy, ktorých nález zodpovedá prekonanej toxoplazmóze sa už ďalej nesledujú, pretože nákaza prekonaná pred tehotenstvom má protektívny účinok na plod. Naopak, ženy úplne negatívne by mali byť vyšetrené minimálne raz v každom trimestri, nakoľko nie je vylúčené, že sa v priebehu gravidity toxoplazmózou nakazia. Dôležité je aj overenie anamnestických údajov ako je kontakt s mačkou, pôdou, konzumácia nedostatočne tepelne upraveného alebo surového mäsa. Ak sa zistia vysoké titre celkových protilátok a pozitívne IgM, je potrebné urobiť nadstavbové vyšetrenie na dôkaz IgA, IgE protilátok a avidity IgG metódou ELISA, prípadne Western-blot. Pre akútnu toxoplazmózu je charakteristický prudký vzostup titra celkových protilátok, pozitívny nález markerov akútnej infekcie – IgM, IgA, IgE a nízkoavidné IgG protilátky. Nakoľko hrozí nebezpečenstvo infekcie plodu, je potrebné vykonať prenatálne vyšetrenie a zahájiť terapiu [8, 47]. Diagnostickým problémom komplikujúcim správnu interpretáciu je pomalý pokles vysokých titrov protilátok a nešpecifická perzistencia markerov akútnej infekcie, ktorá vedie často k mylnej interpretácii výsledkov. V prípade podozrenia na kongenitálnu infekciu a pri nejednoznačných výsledkoch sérologického vyšetrenia sa odporúča priamy dôkaz DNA parazita v plodovej vode alebo fetálnej krvi pomocou vysoko špecifickej a rýchlej PCR metódy. Počas prvého trimestra je intenzita transplacentárneho prenosu parazita nízka. Z toho dôvodu je zaznamenávaná aj nižšia senzitivita PCR v tomto štádiu, čo má za následok vysokú negatívnu prediktívnu hodnotu. Preto sa amniocentéza a PCR vyšetrenie plodovej vody odporúča až v druhom trimestri gravidity, po 18. týždni gravidity a minimálne 4 týždne po odhadovanej infekcii. [24, 60]. Negatívny výsledok metódou PCR však nevylučuje možnosť kongenitálnej infekcie a musí byť posudzovaný vždy v spojení s inými diagnostickými metódami [10, 18, 24, 57, 59, 60].
Postnatálna sérodiagnostika kongenitálnej toxoplazmózy je komplikovaná tým, že u novorodencov ešte nie je dostatočne vyvinutý imunitný systém. IgA, IgM a IgE protilátky, na rozdiel od IgG, neprechádzajú cez placentu. Preto už aj veľmi nízke hladiny týchto špecifických protilátok v krvi novorodenca môžu signalizovať infekciu. Prítomnosť IgA a IgM v pupočníkovej krvi a neonatálnom sére je diagnosticky významná, nakoľko môže indikovať fetálnu syntézu protilátok. Avšak u 30-40 % kongenitálne infikovaných novorodencov nemusia byť IgM a IgA protilátky vôbec prítomné, preto negatívny nález IgA a IgM ešte nevylučuje kongenitálnu infekciu [51, 58]. S určitou obozretnosťou je potrebné pristupovať aj k interpretácii pozitívneho nálezu IgA a IgM v pupočníkovej krvi, pretože mohlo dôjsť iba k prenosu matkiných protilátok na novorodenca počas pôrodu [57]. V literatúre sa uvádza, že až 12-22 % vzoriek pupočníkovej krvi novorodencov môže byť „kontaminovaných“ krvou matky. Pozitívny nález IgM je potrebné znovu potvrdiť s odstupom 2-4 dní a v prípade IgA s odstupom 10 dní od prvého vyšetrenia [47, 58]. Dôkaz IgG protilátok v krvi novorodenca ešte nemusí svedčiť o kongenitálnej infekcii, nakoľko IgG protilátky môže novorodenec získať pasívne od matky. V takomto prípade je potrebné vylúčiť transplacentárny prenos protilátok paralelným vyšetrením krvi matky aj novorodenca [8]. Ako vhodná metóda sa javí proteínová analýza IgG protilátok metódou Western-blot, ktorá umožňuje porovnať sérologický profil matky a novorodenca. Identický sérologický profil svedčí len o pasívnom prenose protilátok. Rovnako sa odporúča vyšetrenie avidity IgG protilátok [4]. Pasívne prenesené protilátky vymiznú z krvi novorodenca do 6-12 mesiacov života. Negatívny výsledok IgG protilátok po roku života v zásade vylučuje kongenitálnu toxoplazmózu [47, 57].
Očná forma toxoplazmózy u imunokompetentných osôb zvyčajne súvisí s kongenitálnou infekciou. Väčšina prípadov očnej toxoplazmózy je výsledkom periodickej reaktivácie infekcie z prenatálneho obdobia [30]. Práce publikované v poslednom období však naznačujú, že očná toxoplazmóza nemusí mať vždy príčinu v kongenitálnej infekcii, ako sa pôvodne predpokladalo. Boli popísané prípady očnej toxoplazmózy v súvislosti s akvirovanou akútnou infekciou. [46]. Diagnostika očnej toxoplazmózy sa opiera predovšetkým o klinický oftalmologický nález [70]. Pri toxoplazmovej infekcii oka je produkcia systémových protilátok minimálna a zaznamenávané sú iba nízke titre sérových protilátok. Sérologické vyšetrenie má v tomto prípade iba druhoradý význam, aj keď môže diagnózu potvrdiť. Významnejšie je stanovenie lokálnej produkcie toxoplazmových IgG protilátok v očnej tekutine a PCR vyšetrenie, ktoré dá jednoznačný dôkaz o prebiehajúcej aktívnej infekcii v oku. Intraokulárnu produkciu špecifických IgG protilátok je možné potvrdiť porovnaním titra špecifických IgG v očnej tekutine s titrom špecifických IgG v sére, pričom pomer by mal byť vztiahnutý k hladine celkových IgG (Goldmann-Witmer koeficient). Ak je pomer > 2, je to signifikantný nález svedčiaci o tom, že v oku dochádza k lokálnej produkcii protilátok [13]. Nevyhnutné je však vylúčiť možnosť pasívneho prenikania sérových protilátok do očného moku cez porušenú hemato-retinálnu bariéru transudáciou [51, 70]. V prípade zistenia protilátok v očnom moku, je považovaný za pozitívny výsledok aj nález nízkych hladín protilátok akejkoľvek triedy, vrátane nízkych hladín IgG a nízkych titrov KFR. IgM protilátky zvyčajne nie sú prítomné [36, 47, 70].
Zvláštnu pozornosť je potrebné venovať osobám so zníženou imunitou (onkologickí a transplantovaní pacienti) a HIV pozitívnym pacientom, u ktorých toxoplazmóza predstavuje život ohrozujúce ochorenie. U týchto rizikových skupín je predmetom záujmu latentná (chronická) toxoplazmóza, ktorá sa môže v dôsledku oslabenia imunity reaktivovať [7, 43]. Pri interpretácii sérologických výsledkov u tejto rizikovej skupiny osôb je na mieste určitá obozretnosť. Je potrebné brať do úvahy alteráciu imunitnej odpovede v dôsledku imunosupresívnej liečby, či postupujúcej HIV infekcie [43]. Najčastejšie sa dokazujú IgG protilátky, IgM nemusia byť prítomné. Rovnako vyšetrenie avidity IgG protilátok je v takýchto prípadoch nespoľahlivé [44]. O reaktivácii infekcie svedčí aj dôkaz IgA, príp. IgE protilátok. Ako doplňujúce vyšetrenie je možné použiť metódu Western-blot. V takýchto prípadoch nemá tvorba a dynamika protilátok typický priebeh a za pozitívny výsledok sa považuje už aj nález nízkych hladín protilátok, vrátane nízkych hladín IgG a titrov KFR [36]. V prípade neurotoxoplazmózy, je pre potvrdenie intratekálnej produkcie protilátok vhodné vyšetriť paralelne sérum aj likvor pacienta [51]. Pre jednoznačnú konfirmáciu infekcie sa odporúča vyšetrenie likvoru, plnej krvi, príp. moču metódou PCR. Diagnostike môže napomôcť aj stanovenie celkového počtu CD4+ lymfocytov, ktorých pokles pod 200 v ml krvi sa objavuje s reaktiváciou infekcie [47, 72].
Záver
Toxoplazmóza je stále aktuálna a naďalej si vyžaduje našu pozornosť. Napriek veľkému pokroku v poznaní a diagnostike ešte ani dnes nie je problematika toxoplazmózy úplne vyriešená. V súčasnosti je hlavné úsilie zamerané na zdokonalenie laboratórnej diagnostiky toxoplazmózy, ako aj na vývoj nových, rýchlych a presných diagnostických metód, ktoré by umožňovali ľahšie a spoľahlivejšie odlíšenie štádia infekcie.
Zavedenie progresívnych diagnostických metód, založených na princípoch molekulárnej biológie významne prispelo k uľahčeniu diagnostiky pri nejednoznačných sérologických výsledkoch. Využitie poznatkov molekulárnej biológie a genetiky už nie je v súčasnosti novinkou a doménou výskumných a vývojových pracovísk, ale čoraz častejšie sa aplikujú aj do diagnostickej praxe v laboratóriách klinickej mikrobiológie. Tieto vysoko špecifické metódy poskytujú rýchly výsledok, čo je dôležité hlavne z hľadiska skorého začatia terapie.
Vzhľadom na závažnosť toxoplazmózy je nevyhnutné, aby tieto náročné vyšetrenia vykonávali iba pracoviská, ktoré sú nielen náležite technicky vybavené, ale predovšetkým používajú overené štandardné pracovné postupy, ich činnosť je pravidelne kontrolovaná zapájaním sa do medzilaboratórnych porovnávacích testov, a majú erudovaný personál, schopný výsledky správne interpretovať. Nemenej dôležitá je aj vzájomná úzka spolupráca laboratórneho pracovníka - parazitológa s klinickými lekármi. Záverom je potrebné zdôrazniť, že iba kvalifikovaná interpretácia sérologických výsledkov môže pomôcť správnemu rozhodnutiu ošetrujúceho lekára a predísť tak prípadným nedorozumeniam a zbytočnému stresovaniu pacienta.
Do redakce došlo 24. 10. 2008
RNDr. Jozef Strhársky
Regionálny úrad verejného zdravotníctva
Cesta k nemocnici 25
975 56 Banská Bystrica
Slovenská republika
e-mail: jozef.strharsky@vzbb.sk
Sources
1. Ashburn, D., Joss, A. W. L., Pennington, T. H., Ho-Yen, D. O. Do IgA, IgE, and IgG avidity tests have any value in the diagnosis of Toxoplasma infecton in pregnancy? J Clin Pathol, 1998, 51, 312-315.
2. Bastien, P. Molecular diagnosis of toxoplasmosis. Trans R Soc Trop Med Hyg, 2002, 96, 205-215.
3. Black, M. W., Boothroyd, J. C. Lytic cycle of Toxoplasma gondii. Microbiol Mol Biol Rev, 2000, 64, 3, 607-623.
4. Buffolano, W., Lappalainen, M., Hedman, L., Ciccimara, F. et al. Delayed maturation of IgG avidity in congenital toxoplasmosis. Eur J Clin Microbiol Infect Dis, 2004, 23, 825-830.
5. Contini, C., Seraceni, S., Cultera, R., Incorvaia, C. et al. Evaluation of a real-time PCR-based assay using the lightcycler system for detection of Toxoplasma gondii bradyzoite genes in blood specimens from pacients with toxoplasmic retinochoroiditis. Int J Parasitol, 2005, 35, 275-283.
6. Costa, J. M., Dardé, M. L., Assouline, B., Vidaud, M., Bretagne, S. Microsatellite in beta-tubulin gene of Toxoplasma gondii as a new genetic marker for use in direct screenining of amniotic fluids. J Clin Microbiol, 1997, 35, 10, 2542-2545.
7. Čatár, G., Červeň, D., Jalili, N.A. Toxoplasma gondii. Bratisl Lek Listy, 1998, 99, 11, 579-583.
8. Čatár, G., Valent, M. Toxoplazmóza a jej význam v pôrodníctve a gynekológii. Prakt Gynek, 1994, 1, 1, 7-10.
9. Čatár, G. Possibilities of vaccination against toxoplasmosis. Klin Mikrobiol Infekc Lek, 1997, 3, 4, 103-105.
10. Delhommeau, F., Forestier, F. Quantification of Toxoplasma gondii in amniotic fluid by rapid cycle real-time PCR. In: Reischl U., Wittwer C., Cockerill F. Rapid cycle real-time PCR-methods and application, Springer Verlag Berlin Heidelberg, 2002, 133-138.
11. Dubey, J. P., Lindsay, D. S., Speer, D. A. Structures of Toxoplasma gondii tachyzoites, bradyzoites, and sporozoites and biology and development of tissue cysts. Clin Microbiol Rev, 1998, 11, 267-299.
12. Fajfrlík, K., Brejchová, H. Zkušenosti s vyšetřováním těhotných žen na přítomnost protilátek proti Toxoplasma gondii. Remedia - Klinická mikrobiologie, 1998, 2, 7, 227-229.
13. Fekkar, A., Bodaghi, B., Touafek, F., Le Hoang, P. et al. Comparison of immunoblotting, calculation of the Goldmann-Witmer coefficient, and real-time PCR using aqueous humor samples for diagnosis of ocular toxoplasmosis. J Clin Microbiol, 2008, 46, 6, 1965-1967.
14. Filisetti, D., Gorcii, M., Pernot-Marino, E., Villard, O., Candolfi, E. Diagnosis of congenital toxoplasmosis: Comparison of targets for detection of Toxoplasma gondii by PCR. J Clin Microbiol, 2003, 41, 10, 4826-4828.
15. Flegr, J., Hrdá, Š., Kodym, P. Influence of latent asymptomatic toxoplasmosis on body weight of pregnant women. Folia Parasitol, 2005, 52, 199-204.
16. Flegr, J. Effects of Toxoplasma on human behavior. Schizophr Bull, 2007, 33, 3,757-760.
17. Fuentes, I., Rodriguez, M., Domingo, C. J., Del Castillo, F. et al. Urine sample used for congenital toxoplasmosis diagnosis by PCR. J Clin Microbiol, 1996, 34, 10, 2368-2371.
18. Gay-Andrieu, F., Marty, P., Pialat, J., Sournies, G. et al. Fetal toxoplasmosis and negative amniocentesis: necessity of an ultrasound follow-up. Prenat Diagn, 2003, 23, 558-560.
19. Goldman, M. Staining Toxoplasma gondii with fluorescein–labeled antibody. I. The reaction in smears of peritoneal exudate. J Exp Med, 1957,105, 549-556.
20. Goldman, M. Staining Toxoplasma gondii with fluorescein–labeled antibody. II. A new serologic test for antibodies to Toxoplasma besed upon inhibition of specific staining. J Exp Med, 1957,105, 557-573.
21. Goldman, M. Staining Toxoplasma gondii with fluorescein–labeled antibody. III. The reaction in frozen and paraffin sections. Am J Clin Pathol, 1959, 32, 159-164.
22. Gross, U., Keksel, O., Dardé, M. L. Value of detecting immunoglobulin E antibodies for the serological diagnosis of Toxoplasma gondii infection. Clin Diagn Lab Immunol, 1997, 4, 3, 247-251.
23. Hejlíček, K., Literák, I., Vostalová, E., Křešnička, J. Protilátky proti Toxoplasma gondii u gravidních žen v okrese České Budějovice. Epidemiol Mikrobiol Imunol, 1999, 48, 3, 102-105.
24. Hohlfeld, P., Daffos, F., Costa, J. M., Thulliez, P. et al. Prenatal diagnosis of congenital toxoplasmosis with a polymerase chain reaction test on amniotic fluid. N Engl J Med, 1994, 331, 11, 695-699.
25. Hübner, J., Uhlíková, M. Use of the microprecipitation in agar gel (MPA) method in the diagnostics of toxoplasmosis. I. Serological animal tests in isolation experiments using MPA. J Hyg Epidemiol Microbiol Immunol, 1969, 13, 4, 514-520.
26. Hutchison, W. M., Dunachie, J. F., Siim, J. C., Work, K. Life cycle of Toxoplasma gondii. Br Med J, 1969, 4, 5686, 806.
27. Hutchison, W. M., Dunachie, J. F., Work, K., Siim, J. C. The life cycle of the coccidian parasite, Toxoplasma gondii, in the domestic cat. Trans R Soc Trop Med Hyg, 1971, 65, 3, 380-399.
28. Hutchison, W. M. Experimental transmission of Toxoplasma gondii. Nature, 1965, 4, 987, 961-962.
29. Chabbert, E., Lachaud, L., Crobu, L., Bastien, P. Comparison of two widely used PCR primer system for detection of Toxoplasma in amniotic fluid, blood, and tissues. J Clin Microbiol, 2004, 42, 4, 1719-1722.
30. Chapman, D. J., Ashburn, D., Ogston, S. A., Ho-Yen, D. O. The relatioship between ocular toxoplasmosis and levels of specific Toxoplasma antibodies. Epidemiol Infect, 1999, 122, 299-303.
31. Janků, J. Pathogenesa a patotlogická anatomie tak nazvaného vrozeného kolobomu žluté skvrny v oku normálně velikém, mikropthalmickém s nálezem parazitu v sítnici. Čas Lek Čes, 1923, 39-43, 1021-1027, 1054-1059, 1081-1085, 1111-1115, 1138-1143.
32. Jíra, J., Bozděch, V. Complement fixation reaction in toxoplasmosis. I. Basic method with antigen from moise ascites. Čas Lek Česk., 1957, 96, 44, 1396-1401.
33. Jongert, E., De Craeye, S., Dewit, J., Huygen, K. GRA7 provides protective imunity in cocktail DNA vaccines against Toxoplasma gondii. Parasite Immunol, 2007, 29, 445-453.
34. Kaňková, Š., Šulc, J., Nouzová, K., Fajfrlík, K. et al. Women infected with parasite Toxoplasma have more sons. Naturwissenschaften, 2007, 94, 2, 122-127.
35. Kodym, P., Malý, M., Švandová, E., Ležatková, H. et al. Toxoplasma in the Czech Republic 1923-1999: first case to widespread outbreak. In: Petersen E., Pollak A., Reiter-Owona I. Recent trends in research on congenital toxoplasmosis. Int J Parasitol, 2001, 31, 115-144.
36. Kodym, P., Tolarová, V. Laboratorní diagnostika toxoplazmózy. Remedia - Klinická mikrobiologie, 1998, 2, 7, 224-226.
37. Kouba, K., Jíra, J., Hübner, J. Toxoplazmóza. 1. vyd. Praha: Avicenum, 1974. 312 s.
38. Lappalainen, M., Koskela, P., Koskiniemi, M., Ämmälä, P. et al. Toxoplasmosis aquired during pregnancy: Impruved serodiagnosis based on avidity of IgG. J Infect Dis, 1993, 167, 691-697.
39. Lindová, J., Novotná, M., Havlícek, J., Jozífková, E. et al. Gender differences in behavioural changes induced by latent toxoplasmosis. Int J Parasitol, 2006, 36, 14, 1485-1492.
40. Lüder, C. G., Gross, U. Toxoplasmosis: from clinics to basic science. Parasitol Today, 1998, 14, 2, 43-45.
41. Maďarová, L., Klement C. Využitie molekulárno-biologických metód v mikrobiologických laboratóriách verejného zdravotníctva I. Hygiena, 2006, 51, 3-4, 110-115.
42. Maďarová, L. Využitie molekulárno-biologických metód v mikrobiologických laboratóriách verejného zdravotníctva II. Laboratórna diagnostika vybraných druhov agens – Bordetella pertussis, Bacillus antracis, Toxoplasma gondii. Hygiena, 2007, 52, 4, 118-125.
43. Machala, L., Kodym, P., Rozsypal, H, Staňková, M., Sedláček, D. Doporučený postup diagnostiky a terapie toxoplazmózy u osob s HIV infekcí. Klin Mikrobiol Infekc Lek, 2007, 13, 6, 248-252.
44. Mechain, B., Garin, Y. J., Robert-Gangneux, F., Dupouy-Camet, J., Derouin, F. Lack of utility of specific immunoglobulin G antibody avidity for serodiagnosis of reactivated toxoplasmosis in immunocompromised patients. Clin Diagn Lab Immunol, 2000, 7, 4, 703-705.
45. Mei-Hui Lin, Tse-Ching Chen, Tseng-Tong Kuo, Ching-Chung Tseng, Ching-Ping Tseng. Real-Time PCR for quantitative detection of Toxoplasma gondii. J Clin Microbiol, 2000, 38, 11, 4121-4125.
46. Montoya, J. G., Remington, J. S. Toxoplasmic chorioretinitis in the setting of acute acquired toxoplasmosis. Clin Infect Dis, 1996, 23, 277-282.
47. Montoya, J. G. Laboratory diagnosis of Toxoplasma gondii infection and toxoplasmosis. J Infect Dis, 2002, 185, 73-82.
48. Mullis, K. B, Faloona, F. A. Specific synthesis of DNA in vitro via a Polymerase chain reaction, Methods Enzymol, 1987, 155, 335-350.
49. Odborné usmernenie Ministerstva zdravotníctva Slovenskej republiky o diagnostike toxoplazmózy. Vestník MZ SR, 2006, čiastka 52-53, ročník 54, 406-410.
50. Ondriska, F., Čatár, G., Vozárová, G. The significance of complement fixation test in clinical diagnosis of toxoplasmosis. Bratisl Lek Listy, 2003, 104, 6, 189-196.
51. Ondriska, F., Jalili, N., Čatár, G. The diagnostic procedures in toxoplasmosis. Bratisl Lek Listy, 2000, 101, 5, 294-301.
52. Ondriska, F., Vozárová, G., Ondrušková, M. Hodnota dôkazu IgE protilátok v diagnostike toxoplazmózy. Lek Obz, 2003, 52, 50-56.
53. Ondriska, F., Vozárová, G., Šišák, M., Hoffman, J. et al. Hodnota Western-blotu pre klinickú diagnostiku toxoplazmózy. Prakt Gynek, 2004, 11, 2, 69-76.
54. Pinon, J. M., Toubas, D., Marx, C., Mougeot, G. et al. Detection of specific immunoglobulin E in patients with toxoplasmosis. J Clin Microbiol, 1990, 28, 8, 1739-1743.
55. Plotkin, S. A., Orenstein, W. A. Vaccines, 4th edition, Elsevier Inc., 2004, 1291-1295.
56. Pokorný, J., Fruhbauer, Z., Čuřík, B., Zástěra, M. A tween-ether preparation of Toxoplasma gondii antigen for the complement fixation test. Bull World Health Organ, 1972, 46, 1, 127-130.
57. Remington, J. S., Thulliez, P., Montoya, J. G. Recent developments for diagnosis of toxoplasmosis. J Clin Microbiol, 2004, 42, 3, 941-945.
58. Rilling, V., Dietz, K., Krczal, D., Knotek, F., Enders, G. Evaluation of a commercial IgG/IgM western blot assay for early postnatal diagnosis of congenital toxoplasmosis. Eur J Clin Microbiol Infect Dis, , 2003, 22, 174-180.
59. Robert-Gangneux, F., Gavinet, M. F., Ancelle, T., Raymond, J. et al. Value of prenatal diagnosis of congenital toxoplasmosis: Retrospective study of 110 cases. J Clin Microbiol, 1999, 37, 9, 2893-2898.
60. Romand, S., Wallon, M., Franck, J., Thulliez, P. et al. Prenatal diagnosis using polymerase chain reaction on amniotic fluid for congenital toxoplasmosis. Obstet Gynecol, 2001, 97, 2, 296-300.
61. Sabin, A. B., Feldman, H. A. Dyes as microchemical indicators of a new imunity phenomen affecting a protozoan parasite (Toxoplasma). Science, 1948, 108, 660-663.
62. Sabin, A. B. Toxoplasmic encephalitis in children. J Am Med Assoc, 1941, 116, 807-814.
63. Siim, J. C. Acquired toxoplasmosis; report of 7 cases with strongly positive serologic reactions. J Am Med Assoc, 1951, 147, 17, 1641-1645.
64. Siim, J. C. Studies on acquired toxoplasmosis. II. Report of a case with pathological changes in a lymph node removed at biopsy. Acta Pathol Microbiol Scand, 1952, 30, 1, 104-108.
65. Skallová, A., Kodym, P., Frynta, D., Flegr, J. The role of dopamine in Toxoplasma-induced behavioural alterations in mice: an ethological and ethopharmacological study. Parasitology, 2006, 133, 5, 525-535.
66. Splendore, A. Un nuovo protozoa parassita dei conigli. Incontrato nelle lesioni anatomiche d’una malattia che ricorda in molti punti il Kala-azar dell’uomo. Rev Soc Sci Sčo Paulo, 1908, 3, 109-112.
67. Stroehle, A., Schmid, K., Heinzer, I., Naguleswaran, A., Hemphill, A. Performance of western immunoblot assay to detect specifi anti-Toxoplasma gondii IgG antibodies in human saliva. J Parasitol, 2005, 91, 3, 561-563.
68. Studeničová, C., Benčaiová, G., Holková, R. Seroprevalence of Toxoplasma gondii antibodies in healthy population from Slovakia. Eur J Intern Med, 2006, 17, 470-473.
69. Tenter, A. M., Heckeroth, A. R., Weiss, L. M. Toxoplasma gondii from animals to humans. Int J Parasitol, 2000, 30, 1217-1258.
70. Villard, O., Filisetti, D., Roch-Deries, F., Garweg, J. et al. Comparison of Emzyme-Linked Immunosorbent Assay, Immunoblotting, and PCR for diagnosis of toxoplasmic chorioretinitis. J Clin Microbiol, 2003, 41, 8, 3537-3541.
71. Villena, I., Aubert, D., Brodard, V., Quereux, C. et al. Detection of specific immunogliobulin E during maternal, fetal, and congenital toxoplasmosis. J Clin Microbiol, 1999, 37, 11, 3487-3490.
72. Walker, M., Zunt, J. R. Parasitic central nervous system infections in immunocompromised hosts. Clin Infect Dis, 2005, 40, 1005-1015.
73. Wolf, A., Cowen, D., Paige, B. H. Toxoplasmic encephalomyelitis III. A new case of granulomatous encephalitis due to a protozoon. Am J Pathol, 1939, 15, 657-694.
74. Wong, S. Y., Hajdu, M. P., Ramirez, R., Thulliez, P. et al. Role of specific immunoglobulin E in diagnosis of acute toxoplasma infection and toxoplasmosis. J Clin Microbiol, 1993, 31, 11, 2952-2959.
75. Woznicová, V. Avidita imunoglobulinů G u infekčných onemocnění. Epidemiol Mikrobiol Imunol, 2004, 53, 1, 4-11.
76. Yamamoto, Y. I., Mineo, J. R., Meneghisse, C. S., Gumaraes, A. C. S. Detection in human sera of IgG, IgM and IgA to excreted/secreted antigens from Toxoplasma gondii by use of dot-ELISA and immunoblot assay. Ann Trop Med Parasitol, 1998, 92, 23-30.
77. Zástěra, M., Pokorný, J., Jíra, J., Valkoun, A. Doplněk standardních metodik laboratorní diagnostiky toxoplasmózy. Acta Hyg Epidemiol Microbiol, Príloha č.3/1987, Institut hygieny a epidemiologie Praha, 1986.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2009 Issue 2-
All articles in this issue
- Genotypic Heterogeneity of Hepatitis C virus (HCV) from Blood Donors in the Czech Republic
- Effects of Sudden Air Temperature and Pressure Changes on Mortality in the Czech Republic
- Current Situation and Trends in the Hepatitis C Virus Genotype Distribution among Injecting Drug Users in the Czech Republic
- Borrelia burgdorferi sensu lato in Ixodid Ticks from Ostrava Slag Heaps
- Alimentary Transmission of Tick-borne Encephalitis in the Czech Republic (1997–2008)
- Laboratory Diagnosis of Toxoplasmosis
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratory Diagnosis of Toxoplasmosis
- Effects of Sudden Air Temperature and Pressure Changes on Mortality in the Czech Republic
- Genotypic Heterogeneity of Hepatitis C virus (HCV) from Blood Donors in the Czech Republic
- Alimentary Transmission of Tick-borne Encephalitis in the Czech Republic (1997–2008)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

