-
Medical journals
- Career
Novinky ve WHO klasifikaci renálních nádorů 2022
Authors: Ondřej Hes 1,2; Květoslava Michalová 1,2; Kristýna Pivovarčíková 1,2
Authors‘ workplace: Šiklův ústav patologie, Lékařská fakulta Univerzity Karlovy v Plzni a Fakultní nemocnice Plzeň, Česká republika 1; Bioptická laboratoř s. r. o., Plzeň, Česká Republika 2
Published in: Čes.-slov. Patol., 58, 2022, No. 4, p. 187-191
Category: Reviews Article
Overview
V 5. edici WHO klasifikace nádorů ledvin dospělých bylo uvedeno několik změn u klasických renálních jednotek a byly představeny nádory nové.
Papilární renální karcinom (RK) se již nedělí na typ 1 a typ 2. Typ 1 je nově nazván klasickou variantou, typ 2 již není, po dlouhých diskuzích, dále rozpoznáván. Tumory se tedy označují jako papilární RK (subtyp/variantu je možné uvést v popisu).
Důležitou změnou je vyřazení světlobuněčného papilárního karcinomu z kategorie karcinomů. Nový název je světlobuněčný papilární tumor. Neexistují totiž přesvědčivé důkazy o metastazujících či recidivujících případech. Všechny takové v minulosti popsané léze jsou nejspíše špatně diagnostikovanými světlobuněčnými RK. U sporných případů je doporučeno využít genetické analýzy VHL genu.
Novou kapitolou jsou „ostatní onkocytické tumory“, kategorie vytyčená pro nádory z tzv. šedé zóny mezi renálním onkocytomem (RO) a chromofobocelulárním RK. Název „hybridní“ onkocytický tumor je vyhrazen pro hereditární tumory v rámci Birth-Hogg-Dubé syndromu. Jsou zmíněny potenciálně nové jednotky: eosinofilní vakuolizovaný tumor (EVT) a „low-grade“ onkocytický tumor (LOT), k dobré znalosti těchto tumorů umožňujících jejich zařazení mezi nové nádorové jednotky je však zatím k dispozici málo odborných dat.
Kompletně nová kategorie „molekulárně definované karcinomy“ zahrnuje řadu jednotek. Translokační karcinomy byly rozděleny na RK s přestavbou TFE3 genu (variabilní morfologie závislá na fúzním partnerovi) a na RK s přestavbou TFEB genu. Tato skupina je tvořena indolentními RK s TFEB translokací a potencionálně agresivními RK s amplifikací TFEB genu. Dále je zde uveden RK s přestavbou ALK genu, vedený jako potencionálně nová jednotka v WHO klasifikaci z roku 2016. Morfologické spektrum je široké a rovněž závisí na fúzních partnerech. ELOC (TCEB1) mutovaný RK je nádor tvořený světlobuněčnými elementy a objemným fibromyomatózním stromatem. U těchto nádorů je nutný komplexní diagnostický přístup zahrnující imunohistochemii (včetně vyšetření CK 7) a molekulárně genetické vyšetření. Existují morfologicky prakticky identické tumory s mutacemi v genech MTOR signální dráhy, které nelze bez molekulárně genetického vyšetření rozpoznat.
Poslední novou jednotkou z této skupiny je SMARCB1 deficientní medulární karcinom. Jde o „high-grade“ invazivní adenokarcinom u pacientů se srpkovitou anémií a SMARCB1 deficiencí.
Klíčová slova:
dospělí – ledvina – renální tumor – WHO 2022 klasifikace
V březnu letošního roku (2022) vyšla po relativně delších přípravách zatím online verze nové klasifikace Světové zdravotnické organizace (WHO) nádorů urogenitálního traktu a mužského pohlavního systému (1). Této klasifikaci předcházela celá řada diskuzí a tzv. consensus konferencí. V tomto přehledovém článku představíme pouze změny týkající se klasifikace nádorů ledvin.
Nádory ledvin jsou jednou z nejrychleji se rozvíjejících kapitol nádorové patologie, od poslední klasifikace WHO z roku 2016 došlo k popisu celé řady nových jednotek, z nichž velká část se objevuje právě v nové WHO klasifikaci z roku 2022 (1). Tak jako v ostatních oborech lidské patologie i v patologii renálních nádorů samozřejmě velkou roli hraje molekulární genetika a využití molekulárně genetických vlastností ke klasifikaci či lepší stratifikaci nádorů ledvin. Vlastní tvorbě klasifikace předcházela práce na tzv. doporučení odborných skupin (Society Statement), které bylo vypracováno společností International Society of Urologic Pathology řešící zejména molekulární genetiku nádorů ledvin (2). Hned další stanovisko zaujala Genitourinary Pathology Society (GUPS), toto bylo publikováno ve dvou objemných přehledových článcích v Modern Pathology v roce 2021 (3,4). WHO klasifikace 2022 přejala převážnou většinu přístupů a názorů, které byly publikovány právě v těchto článcích. Autorské kolektivy se samozřejmě výrazně překrývaly, není tedy divu, že diagnostické přístupy ISUP/GUPS a WHO jsou si velmi podobné.
Kapitoly zabývající se nádory ledvin jsou členěny identicky tak, jak je to v celém 5. vydání WHO klasifikace nádorů standardní. Nedílnou součástí každé kapitoly je právě i molekulárně genetická část. Co se týká podstatných změn v klasifikaci WHO 2016, došlo k vytvoření zcela nových kategorií a nádorových jednotek, změnil se i pohled na celkové členění nádorů a zásadně se změnil pohled na některé z „tradičních“ nádorových jednotek. Nyní podrobněji k jednotlivým kapitolám:
PAPILÁRNÍ RENÁLNÍ KARCINOM
Papilární renální karcinom (RK) byl členěn velice dlouhou dobu na tzv. „typ 1“ a tzv. „typ 2“. Tato klasifikace byla výborná v době své publikace (5), postupně však, vzhledem k novým poznatkům a popisům nových variant a podjednotek mezi renálními karcinomy obecně, byla již obtížně obhajitelná. Hlavním problémem byla nízká reprodukovatelnost a to zejména při diagnostikování tzv. „typu 2“ (3). „Typ 1“, tedy papilární renální karcinom tak, jak jej známe nejčastěji a nejběžněji, zůstává platnou variantou, pouze se změnil název a dřívější „typ 1“ se dnes označuje jako klasický typ/varianta.
Dále existuje celá řada dříve popsaných, tzv. morfologických variant, které jsou následující: papilární renální karcinom se světlobuněčnými elementy připomínající světlobuněčný RK, bifazický typ se skvamoidními buňkami a emperipolézou, Warthin-like papilární RK a celá řada dalších variant (1).
Další rozpoznatelný typ papilárního renálního karcinomu je tzv. papilární neoplazie s reverzní polaritou. Je otázkou, zda tento tumor bude v budoucích klasifikacích dále řazen mezi papilární renální karcinomy či zda bude vyčleněn do samostatné kategorie. Tento tumor totiž má celou řadu vlastností, které ho staví stranou od klasických papilárních renálních karcinomů.
Celkovým souhrnem těchto změn je konsensus, že název papilárního renálního karcinomu zůstává. Jednotka se tedy jmenuje papilární renální karcinom. Je možné doplnit podvariantu, případně použít termín NOS (Not Otherwise Specified). Nejdůležitější je odlišení nádorů, které dříve byly mylně jako papilární renální karcinom diagnostikovány (zejména „typ 2“) a které podle současných poznatků s touto skupinou nádorů nemají nic společného. Naprosto zásadní je odlišit fumarát hydratáza deficientní (FH) deficientní RK. Velká část tzv. papilárních renálních karcinomů tzv. „typu 2“ je ve skutečnosti translokační renální karcinom, nejčastěji TFE3 translokační renální karcinom. Dále byly tyto nádory někdy zaměňovány za renální karcinomy s přestavbou genu ALK. Kritické je tedy vždy odlišit tyto „jiné“ renální karcinomy a nezaměňovat je za papilární renální karcinomy.
OSTATNÍ ONKOCYTICKÉ TUMORY
Další změnou je zavedení skupiny ostatních onkocytických nádorů. Samozřejmě nadále rozpoznáváme renální onkocytom a chromofobní RK.
Právě v diagnostice těchto onkocytických lézí došlo k obrovskému rozvoji poznatků a velkému množství publikací (4). Proto byla zavedena kategorie ostatní onkocytické tumory ledviny. Do této skupiny spadají léze, které stojí na pomezí morfologie mezi renálním onkocytomem a chromofobním renálním karcinomem, popř. se ve svém spektru blíží více či méně jedné z těchto kategorií (1). Tyto léze jsou z drtivé většiny neagresivní, přestože mohou vytvářet buňky s velmi polymorfními jádry, které, pokud by byly formálně gradovány, pohybovaly by se minimálně v kategorii 3 (ISUP/WHO grade). V této skupině nádorů se vyskytují tumory spojené s Birt-Hogg-Dubé syndromem (BHD). Tyto léze jsou většinou bilaterální, mnohotné, připomínají svojí stavbou jak onkocytom, tak chromofobní karcinom. Další jednotky, které spadají do této podkategorie, jsou relativně nedávno popsané. Jednak se jedná o eosinofilní vakuolizovaný tumor (EVT). Tato léze přesně spadá do kategorie nádorů stojících mezi renálním onkocytomem a chromofobním RK. Těchto tumorů byla v krátké době (první popis v roce 2018) publikována celá řada (6). Tyto nádory mají „high-grade“ morfologii, přesto se chovají neagresivně a zatím není znám žádný metastazující či lokálně agresivní případ (Obr. 1). Tumory mají abnormality v genech pro mTOR signální dráhu a vzácně se vyskytují jako součást tuberózní sklerózy (7). Nádorem ze stejné kategorie je tzv. „low-grade“ onkocytický tumor (LOT), který rovněž ze všeho nejvíce připomíná eosinofilní variantu chromofobního renálního karcinomu (Obr. 2A). Liší se však velmi charakteristickým imunofenotypem (difúzní silná pozitivita CK7, negativita s CD117) (8) (Obr. 2B). Podobně jako EVT se tyto nádory chovají neagresivně, vzácně mohou být spojeny s tuberózní sklerózou a mají bez výjimky abnormality v mTOR signální dráze (9). Samozřejmě existují léze, které nespadnou ani pod kategorii hybridních renálních tumorů spojených s BHD, ani do EVT či LOT. Tyto nádory je možné klasifikovat jako tzv. další onkocytické tumory ledviny.
Image 1. EVT je solidní tumor tvořený objemnými onkocytickými buňkami s velkými vakuolami a „high-grade“ jádry. 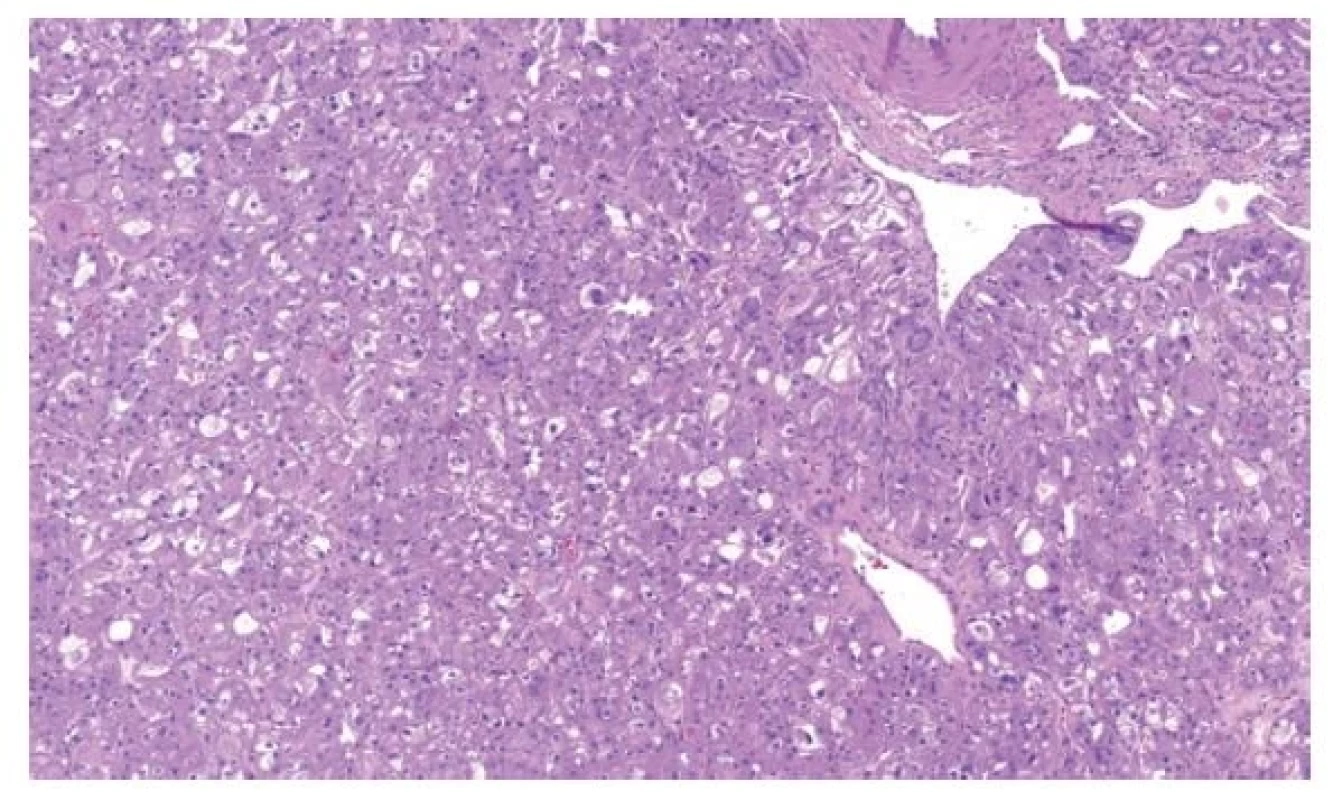
Image 2. A. LOT je solidní, velmi kompaktní tumor tvořený pravidelnými onkocytickými elementy. Obr. 2B. LOT vykazuje velmi charakteristický imunofenotyp s pozitivitou s CK7 a negativitou s CD117. Na obrázku je reakce s CK7. 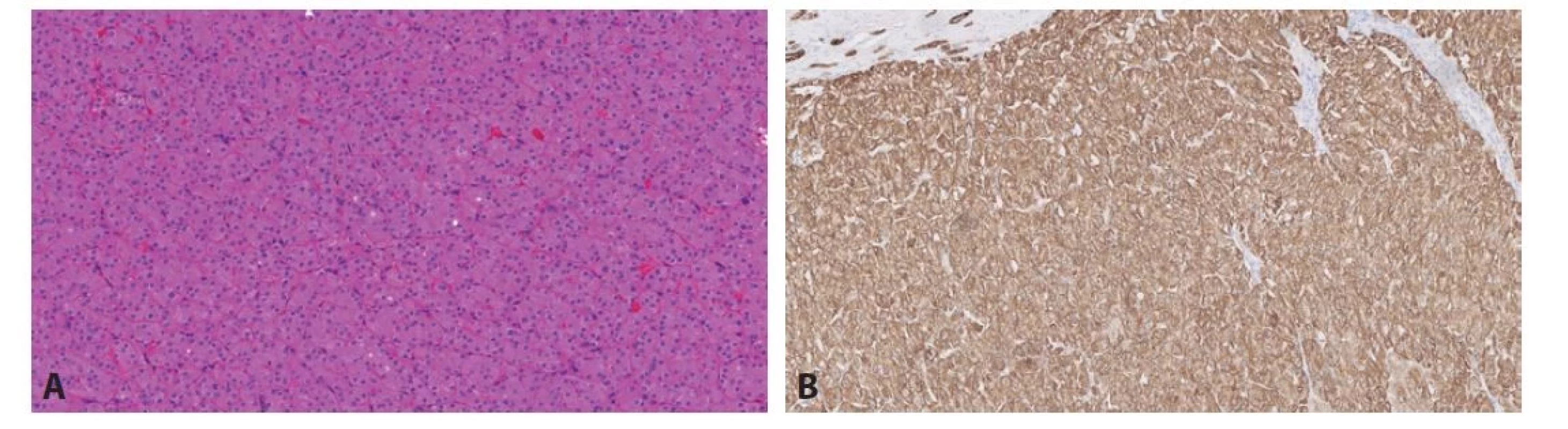
PAPILÁRNÍ SVĚTLOBUNĚČNÝ TUMOR
Další velkou a zásadní změnou je odlišný pohled na tzv. světlobuněčný papilární renální „karcinom“.
Tato léze byla popsána v roce 2000 pod názvem benigní myoadenomatózní tumor ledviny, následně byla popsána v roce 2006 pod termínem světlobuněčný papilární renální karcinom. Velice dlouhou dobu se vedly diskuse o tom, zda jde o tumor s maligním potenciálem či nikoliv. Tyto diskrepance byly způsobovány zejména inkonzistentním přístupem k diagnostice (3). V průběhu let došlo k zpřesnění diagnostických kritérií a v současné době lze tento tumor diagnostikovat prakticky vždy. Kromě klasické morfologie je nutné tumor vždy barvit s cytokeratinem 7, pozitivita musí být difúzní a silná. Karboanhydráza 9 může napomoci, avšak není pro diagnostiku zásadní. U lézí, které nejsou morfologicky ani imunohistochemicky perfektní, je třeba využít molekulárně-genetické diagnostické metody a to zejména vyšetření VHL genu, a to nejen na přítomnost mutací, ale i na tzv. metylační status. Dále je nutno vyšetřit ztrátu heterozygozity 3p (LOH3p). Všechna tato 3 vyšetření musí být negativní. Vzhledem k tomu, že ve světové literatuře neexistuje žádný biopticky ověřený metastazující papilární světlobuněčný „karcinom“ a při velmi pečlivých analýzách jsou známy pouze jednotlivé případy (biopticky neověřené) s potenciální generalizací, bylo přikročeno ke změně názvu a tato léze se v nové WHO klasifikaci označuje jako světlobuněčný papilární renální tumor (1).
EOSINOFILNÍ SOLIDNÍ A CYSTICKÝ RENÁLNÍ KARCINOM
Další novou jednotkou je tzv. eosinofilní solidní a cystický renální karcinom. Jedná se o tumor, který není nikterak vzácný. Původně byl popsán u pacientů s tuberózní sklerózou. Následně byla publikována velká série sporadických případů, které se vyskytují především u starších žen (10). Podobně jako např. EVT i tento nádor má formálně vysoký grade (ISUP/WHO) (4).
Tumor je charakteristický svojí solidní a cystickou komponentou, tumory jsou tvořeny objemnými eosinofilními buňkami (Obr. 3A-C). Zajímavá je velice častá exprese cytokeratinu 20 za současné negativity cytokeratinu 7. CK20 exprimuje různě intenzivně více než 85 % případů. Podobně jako EVT a LOT jsou tyto tumory spojeny s abnormalitami v genech mTOR signální dráhy. Popsány jsou zcela raritní případy s metastázami především do spádových lymfatických uzlin (1).
Image 3. A. ESC je tumor s typickou kombinací solidní a cystické architektury. Obr. 3B. Solidní komponenta je tvořena objemnými buňkami s eosinofilní cytoplasmou a „high-grade“ jádry. Obr. 3C. Cysty bývají vyplněné eosinofilní tekutinou, stěna cyst je složena z eosinofilních buněk, podobně jako solidní komponenta. 
MOLEKULÁRNĚ-GENETICKY DEFINOVANÉ RENÁLNÍ KARCINOMY
Zcela novou podskupinou nádorů jsou tzv. molekulárně definované renální karcinomy. Skupina „translokačních RK“ uvedená v WHO klasifikaci z roku 2016 byla rozdělena na RK s přestavbou TFE3 genu (11). Nově byly logicky vyčleněny RK s TFEB abnormalitami (1).
Renální karcinomy s přestavbou TFEB genu
Nově byly odděleny RK s přestavbou TFEB genu. Kromě klasických případů s přestavbou TFEB genu sem patří ještě nová skupina nádorů s amplifikací TFEB genu. Vyčlenění této kategorie je poměrně důležité, jelikož obecně se TFEB translokační karcinomy v převážné většině případů chovají zcela benigně (1). Naopak tumory s amplifikací TFEB genu jsou agresivní s významným metastatickým potenciálem. Morfologický vzhled RK s přestavbou TFEB genu je velmi polymorfní. Tyto nádory mají samozřejmě klasickou morfologii (TFEB translokované) s objemnými lehce eosinofilními buňkami s pseudorozetami (12). Vlivem přítomnosti jiných fúzních partnerů však morfologie může být zcela odlišná, tumory mohou být solidní, mohou být dokonce světlobuněčné, mohou vytvářet i papilární či cystické struktury. Pseudorozety mohou být velmi nenápadné nebo dokonce chybět. Ještě složitější situace je u TFEB amplifikovaných renálních karcinomů, kde spektrum je od solidních až po papilární léze. Tumory jsou většinou eosinofilní (Obr. 4). Velmi často exprimují některé z melanotických markerů (melan A nebo HMB45). Důležité je tyto nádory cíleně vyšetřovat, protože při standardním vyšetření zaměřeném pouze na detekci zlomu TFEB genu pomocí FISH není amplifikace diagnostikována.
Image 4. Převážně solidně uspořádaný renální karcinom s amplifikací TFEB genu. 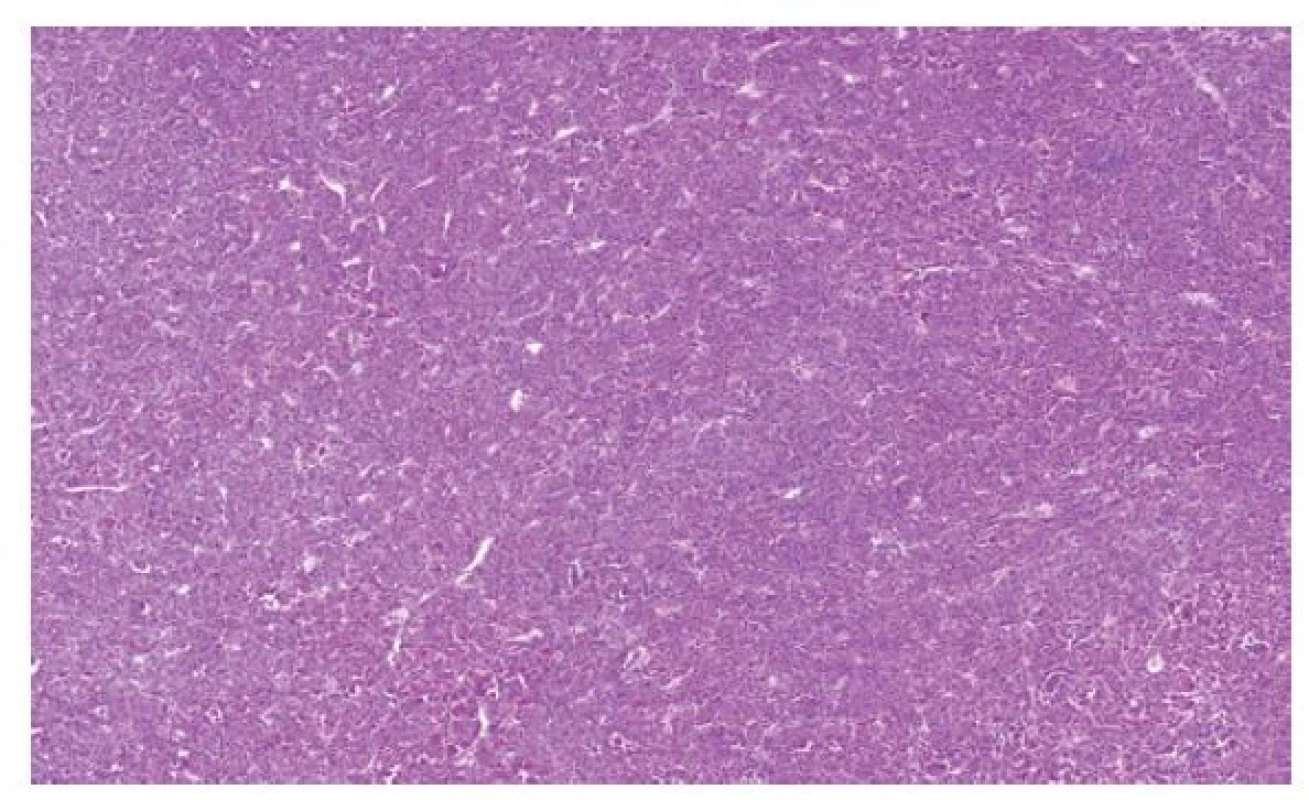
ELOC (TCEB1) mutovaný renální karcinom
Jedná se o renální karcinomy, které se primárně prezentují jako karcinomy světlobuněčné, kromě obvyklé populace světlobuněčných elementů obsahují ještě objemné fibroleiomyomatózní stroma (4) (Obr. 5). Tumory jsou relativně vzácné a spíše se vyskytují u mužských pacientů. Při diagnostice těchto nádorů je nutné využít kombinaci znaků morfologických, imunohistochemických a molekulárně-genetických. Tyto tumory pozitivně reagují s CK7, pozitivita je obvykle difúzní, méně často fokální. U těchto případů je nutné provést molekulárně-genetické vyšetření a to cíleně na mutaci genu ELOC (TCEB1). Velice blízko těmto tumorům stojí morfologicky neodlišitelné nádory s mutací v oblasti genu mTOR signální dráhy. Zde je nutno cílit minimálně na geny mTOR, TSC1, TSC2 (13).
Image 5. RK s mutací genu ELOC jsou světlobuněčné s nápadným fibromyomatózním stromatem. 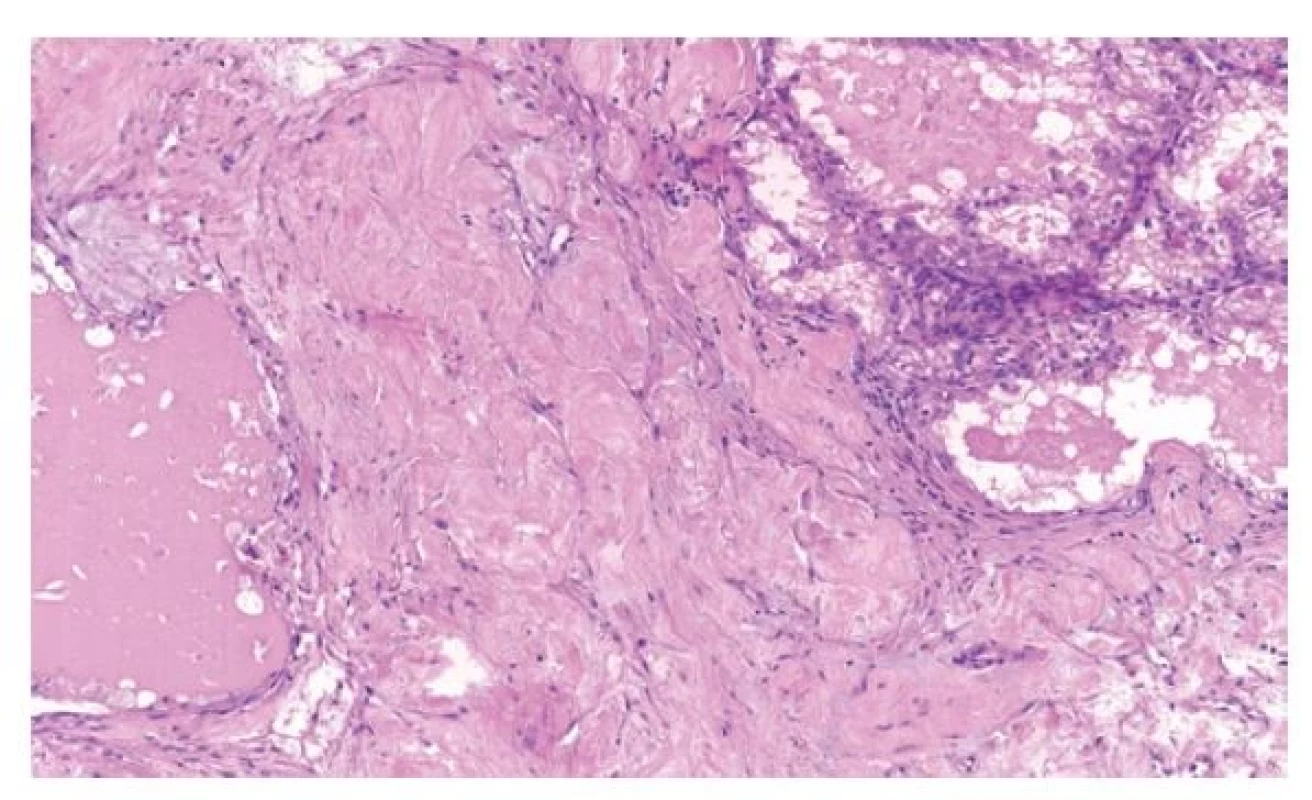
Velká část tumorů s podobnou morfologií (CK7 pozitivita je však fokální, pokud tkáň vůbec reaguje) jsou ve své podstatě klasické světlobuněčné renální karcinomy, které pouze vytvořily fibroleiomyomatózní stroma. Přítomnost tohoto stromatu není nikterak diagnostická ani specifická, objemnější stroma mohou vyprodukovat i jiné renální tumory (13). Velká část těchto tumorů se chová neagresivně, u ELOC mutovaných karcinomů je již doložen případ s metastatickým postižením regionálních lymfatických uzlin, u tumorů s abnormalitami v mTOR signální dráze tomu zatím tak není. Zdá se tedy nejpodstatnější vyloučit světlobuněčný renální karcinom se stromatem a pak lze konstatovat velmi pravděpodobně příznivou prognózu u pacientů (1).
Renální karcinomy s přestavbou ALK genu
Tyto tumory byly v předcházející WHO 2016 klasifikaci řazeny mezi tzv. „emerging“ jednotky. Jedná se o karcinomy vycházející z renálního parenchymu, které mají velice polymorfní stavbu. Tyto léze bývají papilární, mohou však být i solidní. Někdy obsahují myxoidní změny ve stromatu či produkují „mucin“ ve své glandulární komponentě (Obr. 6A). Relativně často tyto nádory připomínají metanefrické adenomy a jsou popsány případy, které jsou s metanefrickým adenomem zcela totožné (morfologie, imunohistochemie) (Obr. 6B). Vzácně mohou naopak připomínat mucinózní vřetenobuněčný a tubulární renální karcinom (4, 14). Vyskytují se jak u dětských pacientů, tak u pacientů dospělých. V případě, že myslíme na diagnózu renálního karcinomu s přestavbou ALK genu, je nutné pokusit se takové případy vyšetřit pomocí imunohistochemie a diagnózu následně potvrdit molekulární genetikou. Prognosticky jde o nádory, které se dokáží chovat velmi agresivně. Publikované jsou případy s dramatickou odpovědí na ALK inhibitory, což ukazuje na úspěšnou cílenou léčbu těchto nádorů (1).
Image 6. A. RK s přestavbou ALK genu jsou polymorfní, zde s produkcí mucinu v epitelové komponentě. Obr. 6B. Některé RK s přestavbou ALK genu jsou neodlišitelné od metanefrického adenomu. 
SMARCB1 deficientní renální medulární karcinom
Jedná se o jednotku, která se v České republice vyskytne pravděpodobně raritně (pokud vůbec). Tyto tumory jsou lokalizované v oblasti renální dřeně a většinou se vyskytují u pacientů se srpkovitou anémií. Jsou vždy „high-grade“, rostou v pruzích, mikrocystách, tubulech. Někdy rostou pod kribriformním obrazem. Velice často je přítomna významná desmoplazie s myxoidními změnami. Tumory nereagují se SMARCB1 (INI1) protilátkou. Typicky však reagují s PAX8 a s cytokeratiny (1).
Smíšený epiteliální stromální tumor ledviny (MEST)
Zde došlo k drobné změně. Tumory, které jsou multicystické (makroskopicky připomínají včelí plástev) se označují jako adultní cystické nefromy. Smíšený epiteliální stromální tumor ledviny (MEST) je termín, který je rezervován pro tumory se solidní komponentou (Obr. 7). Celkový pohled na tuto jednotku zůstává beze změn (1).
Image 7. MESTK je podle WHO 2022 název pro tumory s objemnou solidní komponentou, naopak termín adultní cystický nefrom je rezervován pro léze cystické. 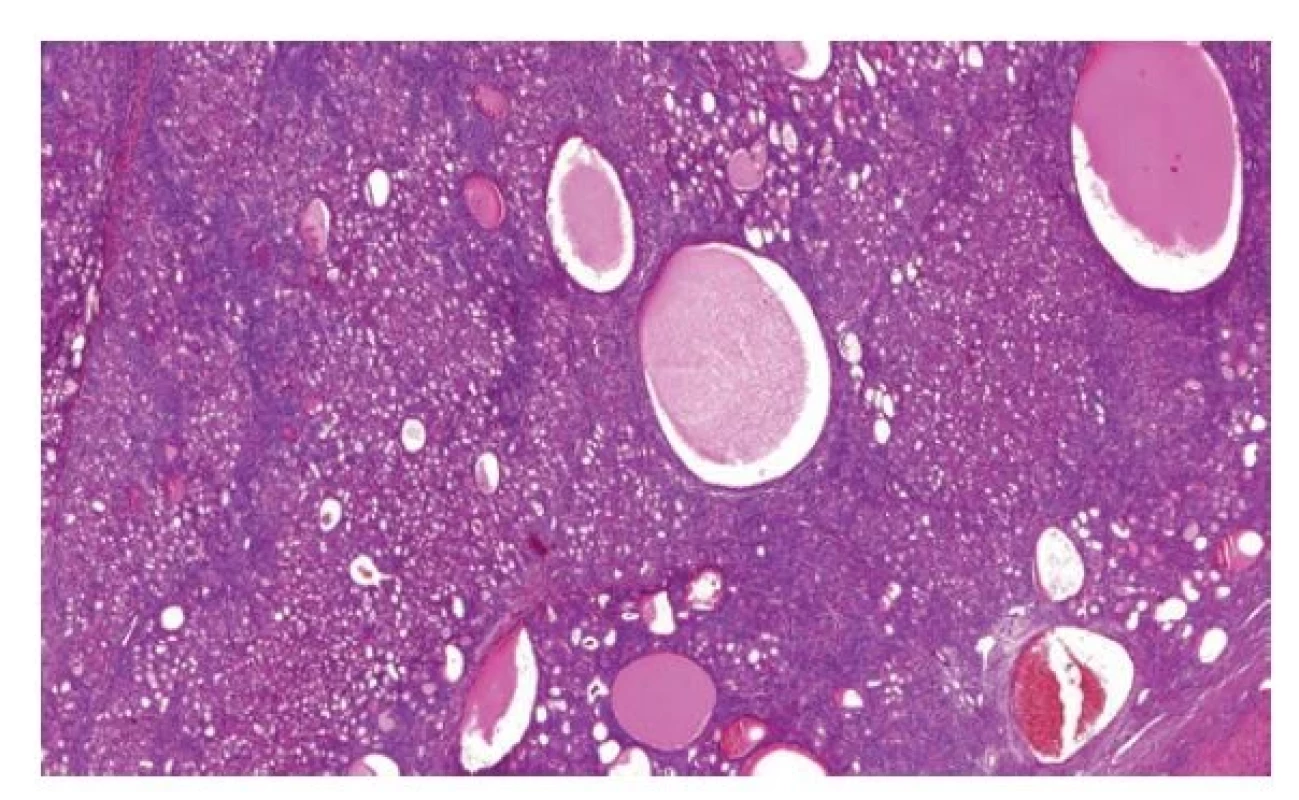
ZÁVĚR
Nová WHO klasifikace renálních tumorů je opět bohatší o několik jednotek. Je to trend, který je zjevný ve všech nádorových kategoriích napříč spektrem lidské patologie. Je možné, že některé jednotky budou časem přehodnoceny. Je však daleko pravděpodobnější, že v příštích WHO klasifikacích se objeví nádory nové, které jsou v současné době již popsané, ale kde chybí dostatečný objem informací, aby bylo možné tyto nádory bez větších problémů rozpoznat a diagnostikovat.
PODĚKOVÁNÍ
Karlova Universita Praha, Lékařská fakulta Plzeň (Cooperation Program, SURG), Institucionální výzkum Fakultní nemocnice Plzeň (FNPl 00669806)
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Kristýna Pivovarčíková, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Alej Svobody 80, 30460 Plzeň
tel. +420377404633
e-mail: pivovarcikovak@fnplzen.cz
Sources
1. Raspollini MR, Moch H, Tan PH, Amin MB, Turajlic S. Tumours of kidney. In: WHO Classification of Tumours Editorial Board. Urinary and male genital tumours. Lyon (France): International Agency for Research on Cancer; 2022. (WHO classification of tumours series, 5th ed.; vol. 8).
2. Williamson SR, Gill AJ, Argani P, Chen YB, Egevad L, Kristiansen G, et al. Report From the International Society of Urological Pathology (ISUP) Consultation Conference on Molecular Pathology of Urogenital Cancers: III: Molecular Pathology of Kidney Cancer. Am J Surg Pathol 2020; 44(7): e47-e65.
3. Trpkov K, Hes O, Williamson SR, Adeniran AJ, Agaimy A, Alaghehbandan R, et al. New developments in existing WHO entities and evolving molecular concepts: The Genitourinary Pathology Society (GUPS) update on renal neoplasia. Mod Pathol 2021; 34(7): 1392 - 1424.
4. Trpkov K, Williamson SR, Gill AJ, Adeniran AJ, Agaimy A, Alaghehbandan R, et al. Novel, emerging and provisional renal entities: The Genitourinary Pathology Society (GUPS) update on renal neoplasia. Mod Pathol 2021; 34(6): 1167-1184.
5. Delahunt B, Eble JN. Papillary renal cell carcinoma: a clinicopathologic and immunohistochemical study of 105 tumors. Mod Pathol 1997; 10(6): 537-544.
6. He H, Trpkov K, Martinek P, Isikci OT, Maggi - Galuzzi C, Alaghehbandan R, et al. “High - grade oncocytic renal tumor”: morphologic, immunohistochemical, and molecular genetic study of 14 cases. Virchows Arch 2018; 473(6): 725-738.
7. Farcas M, Gatalica Z, Trpkov K, Swensen J, Zhou M, Alaghehbandan R, et al. Eosinophilic vacuolated tumor (EVT) of kidney demonstrates sporadic TSC/MTOR mutations: next-generation sequencing multi-institutional study of 19 cases. Mod Pathol 2022; 35(3): 344-351.
8. Trpkov K, Williamson SR, Gao Y, Martinek P, Cheng L, Sangoi AR, et al. Low-grade oncocytic tumour of kidney (CD117-negative, cytokeratin 7-positive): a distinct entity? Histopathology 2019; 75(2): 174-184.
9. Morini A, Drossart T, Timsit MO, Sibony M, Vasiliu V, Gimenez-Roqueplo AP, et al. Low-grade oncocytic renal tumor (LOT): mutations in mTOR pathway genes and low expression of FOXI1. Mod Pathol 2022; 35(3): 352-360.
10. Trpkov K, Hes O, Bonert M, Lopez JI, Bonsib SM, Nesi G, et al. Eosinophilic, Solid, and Cystic Renal Cell Carcinoma: Clinicopathologic Study of 16 Unique, Sporadic Neoplasms Occurring in Women. Am J Surg Pathol 2016; 40(1): 60-71.
11. Tretiakova MS. Chameleon TFE3-translocation RCC and How Gene Partners Can Change Morphology: Accurate Diagnosis Using Contemporary Modalities. Adv Anat Pathol 2022; 29(3): 131-140.
12. Argani P, Hawkins A, Griffin CA, Goldstein JD, Haas M, Beckwith JB, et al. A distinctive pediatric renal neoplasm characterized by epithelioid morphology, basement membrane production, focal HMB45 immunoreactivity, and t(6;11)(p21.1;q12) chromosome translocation. Am J Pathol 2001; 158(6): 2089 - 2096.
13. Shah RB. Renal Cell Carcinoma With Fibromyomatous Stroma-The Whole Story. Adv Anat Pathol 2022; 29(3): 168-177.
14. Kuroda N, Trpkov K, Gao Y, Tretiakova M, Liu YJ, Ulamec M, et al. ALK rearranged renal cell carcinoma (ALK-RCC): a multi-institutional study of twelve cases with identification of novel partner genes CLIP1, KIF5B and KIAA1217. Mod Pathol 2020; 33(12): 2564 - 2579.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2022 Issue 4-
All articles in this issue
- Ondřej Hes, 21. 7. 1968 – 2. 7. 2022
- ONDŘEJ HES, 1968-2022
- 'PULMOPATOLOGIE
- 'CYTODIAGNOSTIKA
- 'HEPATOPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'PATOLOGIE CNS
- 'PATOLOGIE GIT
- 'KARDIOPATOLOGIE
- 'HEMATOPATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE ORL OBLASTI
- 'HISTORIE PATOLOGIE
- New insights in the new WHO classification of adult renal tumors
- Tumor lesions of penis and scrotum according to WHO classification 2022
- Key changes in WHO classification 2022 of testicular tumors
- The changes and updates in the fifth edition of the WHO Classification of prostate tumors
- The 5th edition of WHO classification of the urinary tract tumors – what is new?
- Cystic trophoblastic tumour of the testis: Case report
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- New insights in the new WHO classification of adult renal tumors
- Tumor lesions of penis and scrotum according to WHO classification 2022
- Key changes in WHO classification 2022 of testicular tumors
- The changes and updates in the fifth edition of the WHO Classification of prostate tumors
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

