-
Medical journals
- Career
Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
Authors: Kristýna Pivovarčíková 1; Tomáš Pitra 2; Ondřej Hes 1
Authors‘ workplace: Šiklův ústav patologie LF UK a FN Plzeň 1; Urologická klinika LF UK a FN Plzeň 2
Published in: Čes.-slov. Patol., 55, 2019, No. 1, p. 34-41
Category: Reviews Article
Overview
Močová cytologie je neinvazivní metodou sloužící k mikroskopické detekci nádorových buněk v moči, jejímž úskalím je i přes dobrou senzitivitu a specificitu v záchytu high-grade uroteliálního karcinomu, nízká senzitivita vyšetření při detekci low-grade lézí. V minulosti byla vypracována řada klasifikačních systémů pro hodnocení močové cytologie. Ve snaze dosáhnout konsenzu a připravit klasifikaci postavenou na jasných diagnostických kritériích vznikla v roce 2016 tzv. Pařížská klasifikace. Její neopomenutelnou předností je především globální standardizace popisování močových nálezů.
Klíčová slova:
moč – cytologie – uroteliální karcinom – Pařížská klasifikace
Nádory močového měchýře jsou ve světovém měřítku sedmou nejčastější malignitou. Nejvíce zastoupeným histologickým typem je uroteliální karcinom (UC), který v industrializovaných zemích tvoří až 90 % všech nádorů močového měchýře (1). Uroteliální karcinom je dobře znám vysokou četností recidiv a tedy nutností pečlivé dispenzarizace postižených pacientů. Vlastní dispenzarizace (i prvozáchyt) uroteliálních lézí se v současnosti opírá o močovou cytologii, zobrazovací vyšetření a především cystoskopii, která je nenahraditelným zlatým standardem. Cystoskopie je však vyšetřením invazivním, doprovázeným dobře známými riziky a dyskomfortem pro pacienta, i proto nadále přetrvává snaha najít neinvazivní a spolehlivý způsob pro pravidelné sledování pacientů.
Močová cytologie slouží k mikroskopické detekci nádorových buněk v moči. Je dobře dostupným vyšetřením, jehož hlavní výhodou je právě neinvazivita a relativně nízká cena. Úskalím této metody je i přes dobrou senzitivitu a specificitu v záchytu high-grade UC (senzitivita okolo 79 %, specifita až 100 %) nízká senzitivita vyšetření při detekci low-grade lézí (senzitivita 25 – 40 % a specificita přibližně 98 %) (2-4).
V minulosti byly vypracovány různé klasifikační systémy pro hodnocení močové cytologie, u většiny z nich pak byl profit pro pacienta (spočívající v eventuální možnosti využití dané klasifikace při rozhodování o dalším managementu) přinejmenším sporný.
Ve snaze dosáhnout konsenzu a připravit klasifikaci postavenou na jasných diagnostických kritériích vznikla tzv. Pařížská klasifikace pro hodnocení močových cytologií (The Paris System for Reporting Urinary Cytology). Její neopomenutelnou předností je i globální standardizace popisování močových nálezů.
TYPY MOČOVÝCH CYTOLOGIÍ
Podle typu uskutečněného odběru (z klinického pohledu) je rozlišována moč spontánně vymočená a moč získaná instrumentací močových cest (katetrizovaná a výplachová). Moč spontánně vymočená, stejně jako moč katetrizovaná, podává přehled o stavu močového traktu jako celku. Moč výplachová pak může informovat o jak o stavu celého vývodného systému, tak pouze o jednotlivých etážích vývodných močových cest (např. při selektivním výplachu pánvičky, močovodu). Informace o typu odběru na průvodním listu k cytologickému vyšetření je důležitým údajem, neboť různé typy vzorků se liší v objemu, celularitě i zastoupením jednotlivých buněčných populací. Například pro moč výplachovou je typická přítomnost četných urotelií z hlubších a hlubokých vrstev sliznice, které pokud jsou přítomny ve vzorku spontánně vymočené moči ve velkém množství, mohou upozorňovat na litiázu, předchozí instrumentaci močových cest a pokud současně vykazují i atypie, mohou vzbudit podezření na přítomnost high-grade ploché uroteliální léze (typu carcinoma in situ). Pro cytologické hodnocení je z hlediska celularity a zachování buněk nejlepší moč výplachová, hned poté moč katetrizovaná. Moč spontánně vymočená (ač typem nejrozšířenějším) je zachováním buněk a celularitou z jmenovaných nejhorší (5).
Dle metody použité při zpracování vzorku rozlišujeme močovou cytologii konvenční a liquid-based cytologii (LBC).
Mluvíme-li o konvenční cytologii, máme v drtivé většině případů na mysli moč zpracovanou pomocí cytocentrifugace. Jedná se o klasickou, dobře známou a rutinně využívanou cytopreparační techniku uplatňovanou většinou laboratoří, a to i přes dobře známý fakt, že během centrifugace dochází ke ztrátě významného množství buněčného materiálu (6-8). Úskalím cytocentrifugace je nízká celulární výtěžnost, preparáty zhotovené touto technikou vykazují nepravidelné rozprostření buněk, místy s nakupením buněk v několika řadách a významným (diagnostiku znesnadňujícím) překryvem, někdy i s denzním rušivým pozadím a špatným zachováním (9). Míra zachovalosti buněk je závislá na rychlém transportu a časném zpracování vzorku – tedy proměnných, které např. v ambulantní urologické praxi nelze snadno ovlivnit. Nedostatky metodiky jsou dále značně ovlivněny i zkušenostmi a dovednostmi provádějícího laboratorního personálu (7). Ke konvenčním metodám ve zpracování močové cytologie se dále řadí i „Millipore“ filtrace a nátěrové preparáty (7,9), tyto metody však jsou k vyšetření močové cytologie užívány jen velmi zřídka.
LBC je v 90. létech rozvíjející se alternativa ke konvenční cytologii. Při LBC je moč fixována pomocí speciálního cytoprotektivního média a zpracována automaticky jednou ze dvou různých cytopreparačních technik, založených buď na filtraci (např. systém ThinPrep®, MonoPrep2, CellprepPlus®) či sedimentaci (AutoCyte PREPTM, SurePathTM) (9). Všechny jmenované metody jsou řazeny mezi tzv. thin/mono-layer metody. Metodika našla užití především v cervikální cytologii, postupně se však začala uplatňovat i v negynekologických cytologiích (10). LBC poskytuje lepší zachování buněk (díky užití cytoprotektivního média), automatická a standardizovaná technika zpracování vede k uniformní distribuci materiálu bohatého na buňky v tenké buněčné vrstvě s relativně čistým pozadím (9). LBC (v porovnání s konvenčně užívaným cytospinem) zvyšuje celularitu preparátu, odstraňuje rušivé elementy na pozadí, zlepšuje morfologii buněk a snižuje množství nedostatečných a suboptimálních vzorků (7,8,11). Užití zcela automatizované cytopreparační techniky vede k jednoduchosti a uniformitě LBC metodiky a eliminuje závislost na dovednostech provádějícího personálu, u kterého je potřebný jen minimální tréning. Wright a Halford rovněž stanovili, že pro detekci uroteliálních abnormalit je srovnatelný jeden preparát zhotovený metodou LBC s celkem čtyřmi preparáty zhotovenými cytospinem. Speciální cytofixační médium umožňuje skladování vzorku a jeho postupné zpracování (7), zbytkový materiál může být použit k dalšímu testování (imunohistochemické barvení či molekulárně genetické testy)(9). Nevýhodou metody je nutnost počáteční investice do přístrojového vybavení, což se odráží i ve vyšší ceně vyšetření, které v současnosti zdravotní pojišťovny nehradí.
Velké množství studií porovnávajících konvenční močovou cytologii a různé typy LBC metod dospělo k velmi konfliktním závěrům (12). Práce se sice ve většině shodují na faktu, že LBC metodikou lze dosáhnout buněčnějšího vzorku lepší kvality než při užití cytocentrifugace, studie se však výrazně rozcházejí v názoru, která z metod je lepší ve vlastním záchytu uroteliálních abnormalit (7,11,13-17). Největší provedená metaanalýza, zahrnující 19 publikací porovnávajících LBC a konvenční cytospin u močových cytologií, však neprokázala signifikantní zvýšení sensitivity vyšetření při užití LBC metod (18). Prozatím byla publikována jen jediná studie v hodnocení vzorků využívající Pařížský systém klasifikace močových cytologií a současně vyhodnocující obě metody (konkrétně ThinPrep® a konvenční cytospinovou cytologii). Autoři dospěli k závěru, že obě metody jsou identicky úspěšné při záchytu high-grade UC, naopak kategorii „atypické uroteliální buňky“ (AUC) Pařížské klasifikace lze, dle autorů, snadněji stanovit při užití LBC, kdy diagnóza AUC z LBC dobře koreluje s negativním nálezem či diagnózou low-grade UC v definitivní biopsii (12).
PAŘÍŽSKÁ KLASIFIKACE PRO HODNOCENÍ MOČOVÝCH CYTOLOGIÍ
Pařížská klasifikace je klinickými lékaři i patology dlouhou dobu očekávaný klasifikační systém hodnocení močové cytologie, publikovaný v roce 2016. Klasifikace rozeznává celkem sedm kategorií (Tab. 1), každá kategorie má svá jasně vymezená diagnostická kritéria (Tab. 2), což celkově minimalizuje interobservační variabilitu v hodnocení. Za cíl si klade s jistotou detekovat karcinom, který je klinicky signifikantní, orientuje se tedy především na záchyt pacientů s high-grade UC. Tomu jsou i jasně uzpůsobené jednotlivé kategorie této klasifikace.
Table 1. Diagnostické kategorie Pařížského systému (5). 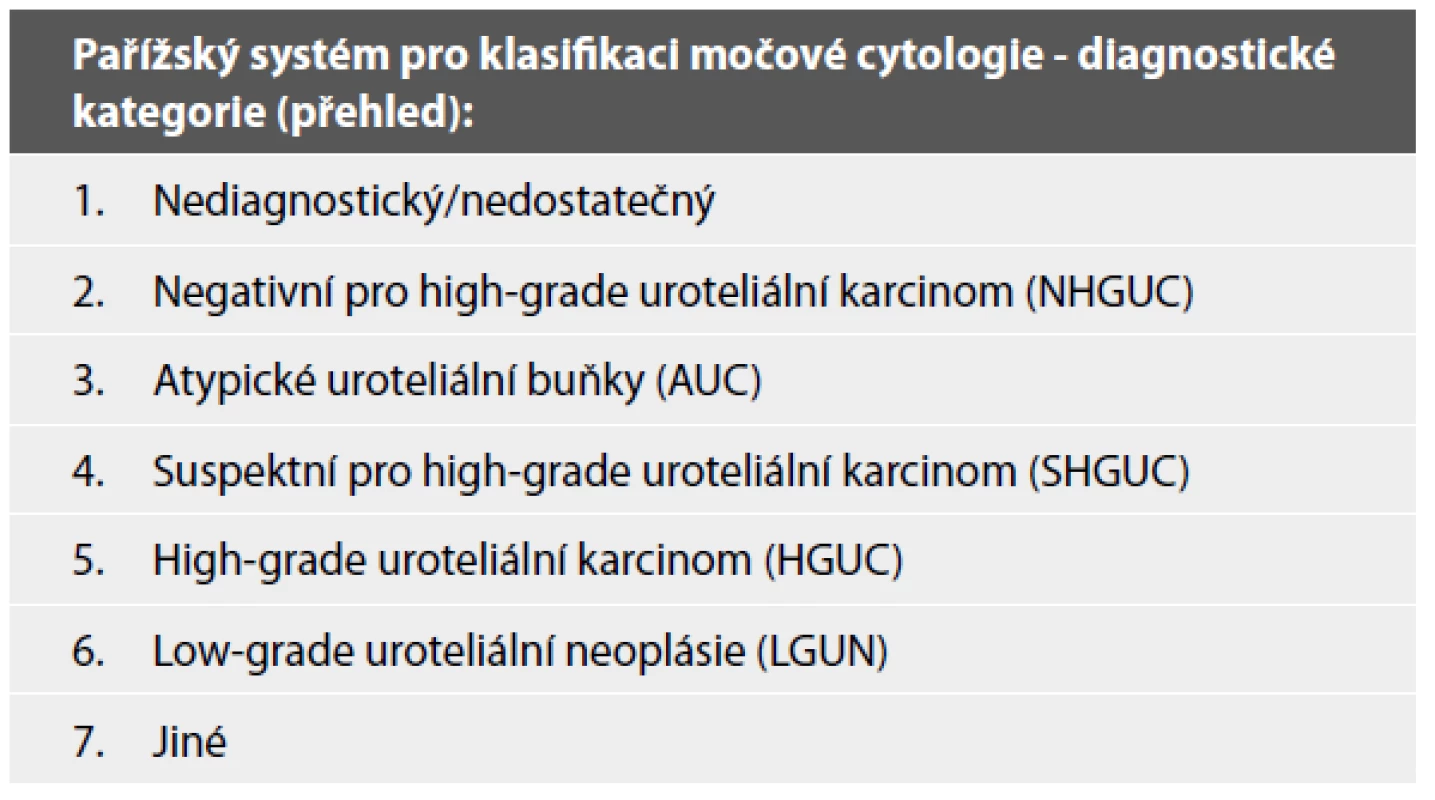
Table 2. Diagnostická kritéria jednotlivých kategorií Pařížského systému – přehled (46). 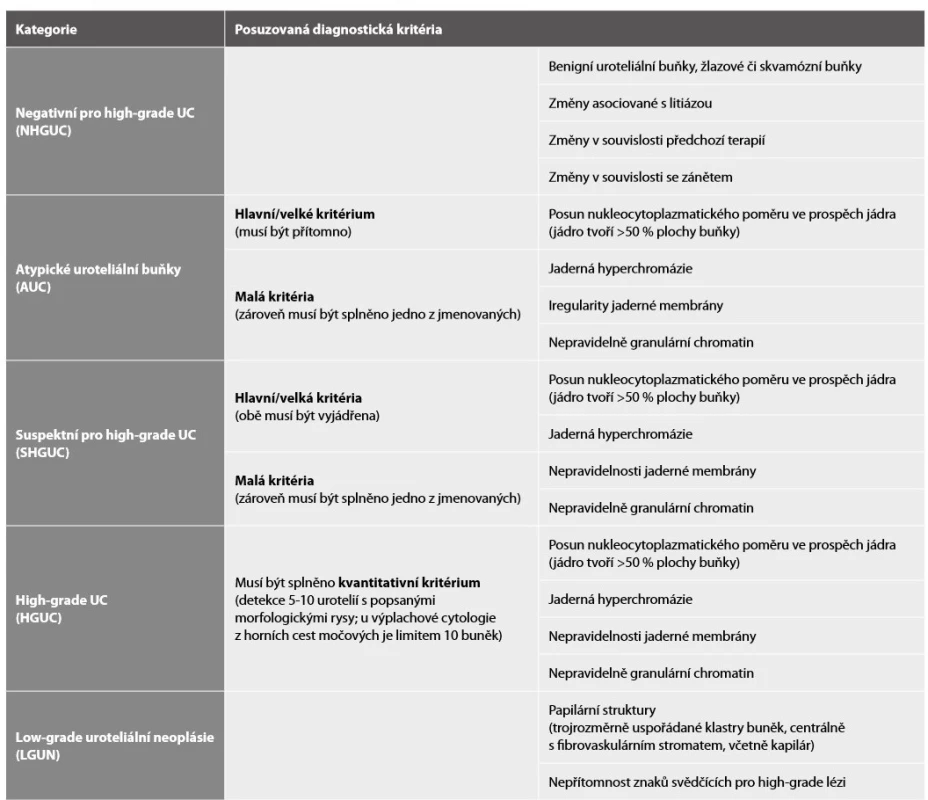
Užití klasifikace při rutinní diagnostice není podmíněno určitým typem odběru či cytopreparační technikou užitou při zpracování (viz výše), k hodnocení za užití této klasifikace je však vyžadováno barvení dle Papanicolaoua.
Nediagnostický/nedostatečný
Pařížská klasifikace nově do klasifikačních systémů zavádí pojem „adekvátnosti“ vzorku. Ta je determinována typem odběru, objemem vzorku, celularitou a cytomorfologickými rysy. Cytomorfologické parametry jsou pak superiorním kritériem, kdy přítomnost atypických, suspektních či dokonce maligních buněk činí vzorek adekvátní pro hodnocení za každých okolností, bez ohledu na zbylá kritéria (5). Situace však není jednoduchá, jednoznačně vymezená a definovaná kritéria pro adekvátnost vzorku v literatuře v současné době prozatím chybí.
Objem vzorku je z pochopitelných důvodů rozdílný u různých typů odběru (viz výše), při hodnocení ho nutno brát v potaz, jednoznačná kritéria pro objem však neexistují. Jedná-li se o moč spontánně vymočenou je objem dle dostupných dat relativně významným faktorem, neboť frekvence výskytu maligních a suspektních diagnóz je nižší u maloobjemových vzorků v porovnání se vzorky s velkým objemem (19). Naopak objem moči získané výplachem (výplachová cytologie) je velmi závislý na objemu tekutiny instilované do vývodných močových cest během výkonu, logicky tedy kritéria pro adekvátní objem u těchto vzorků nelze ani orientačně stanovit (5).
Totéž platí i pro celularitu. U výplachové moči je buněčnost ovlivněna vlastním provedením výkonu a dovednostmi urologa. Existuje ojedinělá publikace stanovující optimální celularitu výplachové cytologie, uvádějící, že výplachová cytologie splňující kritéria pro adekvátnost vzorku by měla obsahovat minimálně 20 dobře zachovaných urotelíí na 10 HPF (20), tento limit je však stanoven pouze pro materiál zpracovaný pomocí LBC metodiky (ThinPrep®), kterou drtivá většina laboratoří v Čechách ani na Slovensku nedisponuje, pro užití v našich podmínkách tedy nepřichází v úvahu. Absenci kritérií pro hodnocení celularity nalézáme i u vzorků moči spontánně vymočené.
Pařížská klasifikace tak zřetelně ukazuje na publikační mezeru týkající se hodnocení adekvátnosti vzorků, na kterou do budoucna jistě soustředí pozornost velká řada autorů, což postupně povede k nastolení pevných diagnostických kritérií i v této oblasti.
Negativní pro high-grade uroteliální karcinom (NHGUC)
To, že Pařížská klasifikace specificky cílí na záchyt především high-grade uroteliálních lézí, se odráží již v názvu této kategorie. Tato pak zahrnuje kromě jasně benigních nálezů i entity s alterací morfologického vzhledu urotelií, bez vztahu k high-grade UC (obr. 1). Jednodušeji řečeno, i pokud jsou ve vzorku přítomny “atypické“ urotelie a pokud je současně známa i specifická příčina/origo morfologické alterace těchto buněk (např. atypie urotelií v souvislost s předchozí radioterapií, reaktivní atypie při současně probíhajícím zánětu vývodných močových cest, alterace urotelií v souvislost s litiázou atd. – tedy jasně non-neoplastické změny), je vzorek klasifikován v kategorii NHGUC (5,21).
Image 1. Spontánně vymočená moč od pacienta s mikroskopickou hematurií; přítomny jsou normální urotelie z různých vrstev sliznice a četné neutrofilní leukocyty, nález odpovídá akutnímu zánětu ve vývodných močových cestách; kategorie: NHGUC. 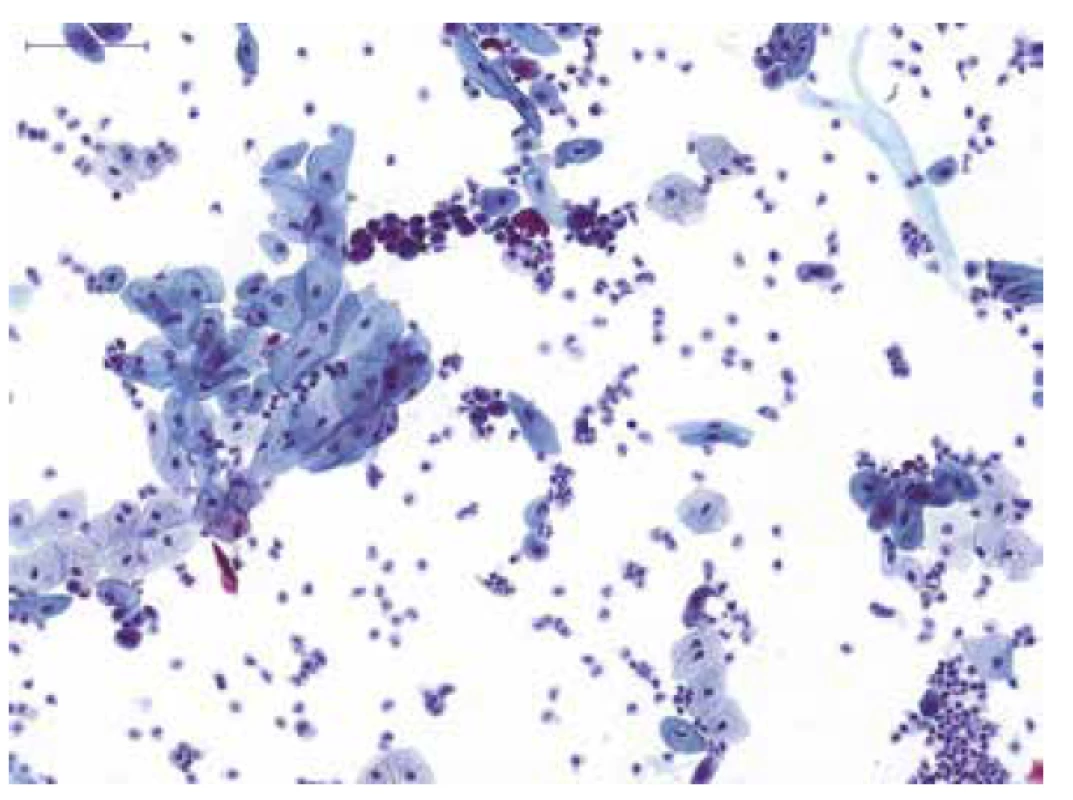
To je rozdíl oproti předchozím klasifikačním systémům, neboť velká část močových cytologií s atypiemi urotelií byla klasifikována spíše v kategorii atypické, nikoliv benigní. Pařížská klasifikace dále zdůrazňuje, že do atypické kategorie by neměly být řazeny cytologie jen proto, že nevypadají dostatečně „normálně“ (5).
Atypické uroteliální buňky (AUC)
Kategorie v názvu s označením „atypické urotelie“ mají svou tradici i v dřívějších klasifikacích, jsou však dobře známy jako velmi problematická skupina (22), která neposkytuje klinickým lékařům potřebné informace o riziku výskytu UC, nemá žádaný diagnostický a terapeutický dopad a patologům obyčejně sloužila pouze jako směsná/zbytková kategorie pro nejasné případy.
Pařížská klasifikace se nově snaží dát atypické kategorii význam, minimalizovat užití tohoto označení pouze na jasně vymezené případy morfologicky alterovaných urotelií (s mírnými až středními cytologickými atypiemi, bez známé příčiny) a tím propůjčit kategorii klinickou výpovědní hodnotu. To je možné jen přidělením přesné definice založené na kvalitativních diagnostických kritériích.
Vlastní kritéria jsou dělena na tzv. velká/hlavní a malá. Hlavním/velkým kritériem je posun nukleocytoplazmatického poměru ve prospěch jádra (jádro tvoří více než 50 % z celkové plochy buňky). Jaderná hyperchromázie, nepravidelnosti jaderné membrány a nepravidelně granulární chromatin jsou kritérii malými. Pro stanovení diagnózy AUC musí být vždy splněno velké kritérium současně s jedním z kritérií malých (přítomnost více než jednoho malého kritéria však nález posouvá spíše směrem k maligní diagnóze, ať už SHGUC či přímo HGUC, viz níže). Pokud je tedy u urotelií zvýšen pouze nukleocytoplazmatický poměr, nález dle Pařížské klasifikace nemá být řazen k AUC. Kvantitativní kritéria nejsou v kategorii AUC stanovena (5).
Je předpokládáno, že při důsledné aplikaci kritérií jmenovaných výše, by se velká část originálně atypických diagnóz měla přesunout spíše do skupiny NHGUC a SHGUC (užití AUC kategorie se sníží), což se odrazí i ve změně v dispenzarizaci a managementu pacientů (5).
Suspektní z high-grade uroteliálního karcinomu (SHGUC)
Kategorie taktéž s jednoznačně stanovenými kvalitativními a kvantitativními kritérii. Hlavními/velkými kritérii (pro stanovení diagnózy SHGUC musí být vždy obě splněna) jsou posun nukleocytoplazmatického poměru minimálně na 0,5-0,7 (u výplachové cytologie hraniční hodnota spíše 0,7) a jaderná hyperchromázie. Z malých kritérií (kterými jsou nepravidelně granulární chromatin a iregularity jaderné membrány) musí být v této kategorii splněno alespoň jedno. Rozdílem mezi diagnózou SHGUC a HGUC je počet abnormálních buněk s popsanými znaky (viz níže) (5).
High-grade uroteliální karcinom (HGUC)
Pro stanovení diagnózy HGUC musí být splněna všechna výše popsaná morfologická kritéria (posun nukleocytoplazmatického poměru >0,7, jaderná hyperchromázie, granulární chromatin a iregularity jaderné membrány) (obr. 2). Zároveň musí být splněno i kvantitativní kritérium, tedy detekce alespoň 5-10 maligních urotelií ve vzorku (u výplachových cytologií z horních cest močových je limitem přítomnost minimálně 10 nádorových buněk) (5).
Image 2. Pacient s makroskopickou hematurií při prvozáchytu tumoru močového měchýře na CT.
(A,B) Spontánně vymočená moč; na krevnatém pozadí zastiženy normální urotelie z různých vrstev sliznice a atypické suspektní urotelie s posunutým nukleocytoplazmovým poměrem ve prospěch jádra, hyperchomázií, nepravidelnostmi jaderné membrány a granulárním chromatinem; dle Pařížské klasifikace kategorie: HGUC
(C) Definitivní histologický materiál u pacienta získaný TURT s odstupem měsíce po pozitivní močové cytologii; zastižen je invazivně rostoucí špatně diferencovaný uroteliální karcinom, dle WHO 1973 grade 3, dle WHO 2016 high-grade infiltrující uroteliální karcinom.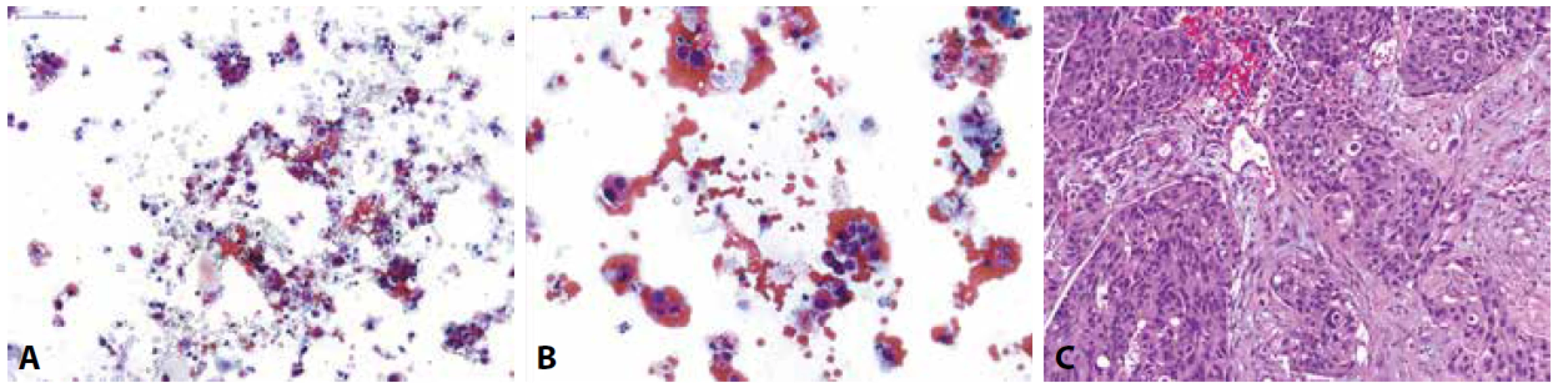
Low-grade uroteliální neoplázie (LGUN)
Cytologická kategorie LGUN v sobě zahrnuje jak low-grade papilární léze (uroteliální papilom, uroteliální papilární neoplázii nízkého maligního potenciálu, low-grade UC) tak i low-grade ploché léze (uroteliální dysplázie) (1), tyto léze na podkladě cytologie nelze v žádném případě rozlišit (5).
Cytologická diagnóza LGUN je podmíněná mikroskopickým průkazem papilárních struktur (trojrozměrně uspořádané trsy buněk, centrálně s fibrovaskulárním stromatem, včetně kapilár) ve vzorku moči, současně bez přítomnosti znaků svědčících pro high-grade lézi (5). Podle většiny cytologů je přítomnost papilárních struktur v močové cytologii relativně raritním nálezem, patrně detekovatelným pouze v materiálu z výplachové cytologie (23). Takto velmi striktně nastavená morfologická kritéria tedy bude schopno splnit jen opravdu velmi malé procento močových cytologií pocházejících od pacientů s low-grade lézí.
Pokud jsou v močové cytologii přítomny 3D formace monotónních urotelií, s mírnou morfologickou alterací (jaderné iregularity, mírný posun nukleocytoplazmatického poměru), avšak centrálně bez fibrovaskulárního stromatu (obr. 3), léze nemůže být klasifikována v kategorii LGUN, neboť nejsou splněna diagnostická kritéria, nález by měl být hodnocen kategorií NHGUC s komentářem, že léze je suspektní pro LGUN (5).
Image 3. Pacientka s makroskopickou hematurií a dilatací dutého systému levé ledviny na USG.
(A) Selektivní výplachová cytologie z levého močovodu; na krevnatém pozadí jsou urotelie z hlubších vrstev sliznice (osamoceně i v plachtovitých shlucích) a 3D trsy urotelií (bez fibrovaskulárního stromatu) s minimálním morfologickou alterací; kategorie: NHGUC, avšak přítomnost low-grade léze je vysoce suspektní.
(B) Definitivní histologický materiál od pacientky (TURT s odstupem dvou měsíců po cytologii); zastižen neinvazivní exofyticky rostoucí uroteliální karcinom, dle WHO 1973 grade 1, dle WHO 2016 low-grade neinvazivní papilární uroteliální karcinom.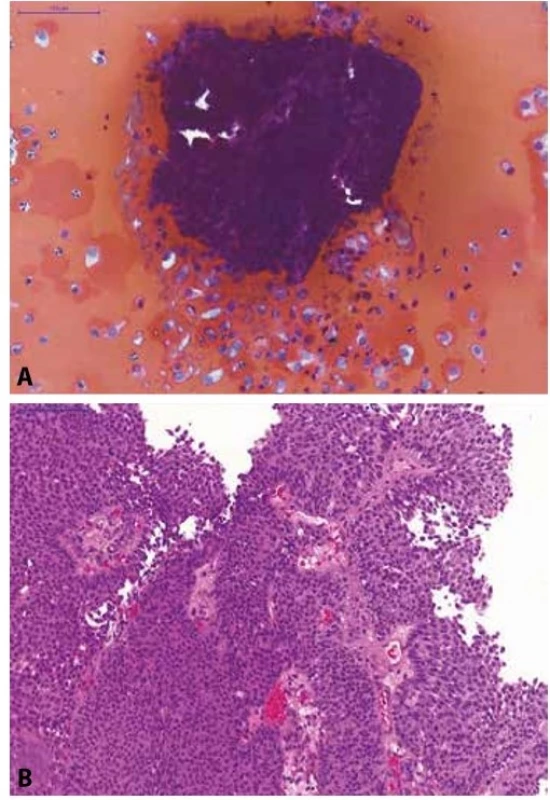
Je tedy nutné dobře vysvětlit klinických lékařům, že low-grade uroteliální lézi lze z moči stanovit jen velmi obtížně. Pokud je u pacienta s močovou cytologií opakovaně klasifikovanou jako NHGUC při následné cystoskopii a transuretrální resekci objeven tumor (histologicky verifikovaný jako low-grade uroteliální léze), nejedná se o chybu odečítajícího patologa, ale o jedno z úskalí močové cytologie. Pařížská klasifikace se celkem správně orientuje na přesnou detekci hlavně high-grade karcinomů (které lze z močové cytologie rozpoznat s relativní jistotou). V diagnostice low-grade lézí však čelí výrazným limitacím, které nejsou vinou klasifikace samotné, ale odrazem skutečnosti, že diagnózu low-grade UC je za jistých okolností obtížná i z definitivního histologického preparátu.
Jiné
Ve vzácných případech může být močová cytologie nápomocna při detekci i jiných nádorů než je UC, ať už primárních či sekundárních. Jedná se však o raritní případy, které jsou vždy diagnostickou výzvou a jsou s definitivní platností diagnostikovány až na podkladě zobrazovacích vyšetření a histologického vyšetření bioptického materiálu (obr. 4). Význam cytologie je tedy u těchto případů opomenutelný.
Image 4. Pacientka s mikroskopickou hematurií a dilatací dutého systému pravé ledviny na USG.
(A, B) Spontánně vymočená moč; normální urotelie a záplava výrazně atypických relativně malých elementů s hyperchromázií a nepravidelnostmi jader, při minimálním množství cytoplazmy, jedná se o neoplastické elementy, avšak na základě morfologie nelze s jistotou potvrdit jejich uroteliální origo; kategorie: jiné.
(C, D) Definitivní histologický materiál (TURT jeden měsíc po pozitivní močové cytologii) od pacientky; histologicky zastiženy dvě odlišné komponenty, přítomna je jednak uroteliální neoplasie, naznačeně papilárně rostoucí, místy vytvářející struktury spíše ploché léze (karcinoma in situ), reagující pozitivně s cytokeratinem CK7, CK20 a AE1/3. Dále zastižena objemná, většinová komponenta tvořená malobuněčnou lézí, která je negativní v průkazu vimentinu, CD26, CD79a, CD3, CD45, S-100 proteinem, CD99, HMB45; reaguje pouze tečkovitě pozitivně s cytokeratinem OSCAR, pozitivní jsou nádorové struktury v průkazu synaptofyzinu
(E), CD56 a chromograninu (F). Jedná se o malobuněčný karcinom s neuroendokrinními rysy vycházející z urotelu.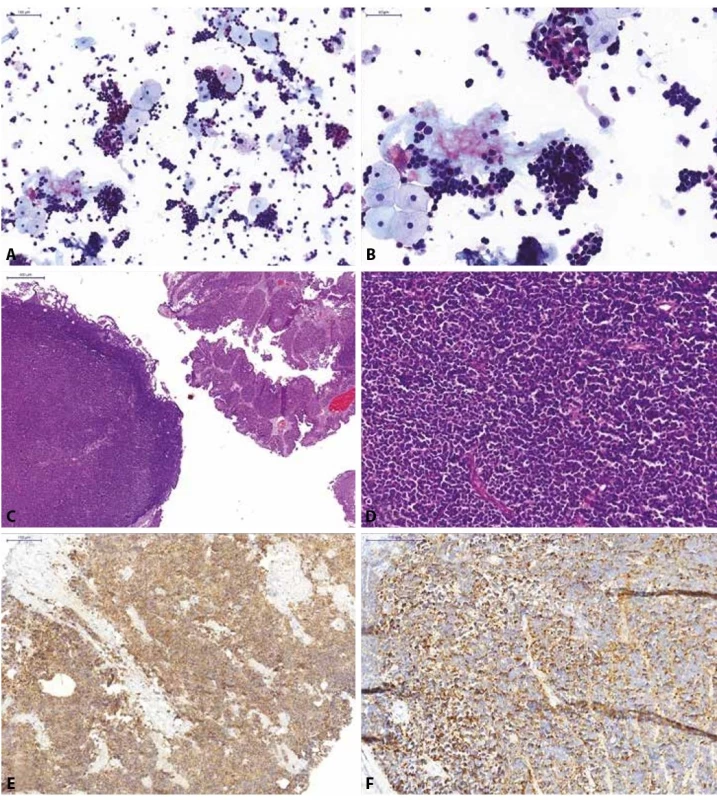
DISKUZE
Při vyšetřování rizikových pacientů a rozhodování o další léčbě je pro urology zlatým standardem provedení invazivní cystoskopie a histologická diagnostika materiálu získaného transuretrální resekcí (TURT). Vlastní močová cytologie je vyšetřením často spíše orientačním, výsledek většinou jen minimálně ovlivní další rozhodování o léčebném postupu u pacienta. Oficiální doporučené postupy Evropské asociace urologů (EAU) v rámci různých diagnostických modalit užívaných při diagnostice uroteliálních lézí řadí cytologické vyšetření moče svým významem logicky až za cystoskopii a zobrazovací vyšetření. Důvody jsou jasné, močová cytologie je nízce senzitivní při záchytu low-grade lézí, v rámci patologické obce jsou běžně užívány různé klasifikační systémy (24), což vede k nesourodosti a nejednoznačnosti cytologických zpráv. Skeptický pohled některých urologů na močovou cytologii může být dále též podněcován nadužíváním nic neříkajících „atypických“ kategorií, které nevede ke klinickému přínosu. Doporučené postupy EAU jasně uvádějí, že cystoskopie nemůže být nahrazena cytologií či jiným neinvazivním testem a cytologie je pouhým dodatkem k provedené cystoskopii. Nález pozitivních buněk ve spontánně vymočené moči může indikovat přítomnost uroteliálního tumoru kdekoliv v močovém traktu, avšak negativita cytologického vyšetření přítomnost tumoru v močovém traktu nevylučuje (25-27).
V minulosti bylo publikováno velké množství klasifikačních systémů močové cytologie, které se pokoušely do praxe uvést co možná nejvhodnější klasifikaci (22,28-30), snahy však celkově přispěly spíše k chaosu v tomto odvětví cytologie. Zmíněné klasifikace se často snažily reflektovat aktuální postoj k histologické klasifikaci uroteliálních lézí, který se v posledních 50 letech taktéž velmi měnil (22). Poslední WHO klasifikace uroteliálních lézí z roku 2016 se oproti té předešlé (z roku 2004) v základním dělení prakticky neliší (1,31). Pařížská klasifikace je pak vystavěna na základech aktuální WHO klasifikace. Z pohledu urologa je však WHO klasifikace (z roku 2016) relativně komplikovaná a spíše než vystavěna pro účely urologů, odráží snahy patologů o přesnou klasifikaci uroteliálních lézí a minimalizaci interobservační variability (1).
Toho, aby do budoucna byla močová cytologie při rozhodování o terapeutickém postupu u pacienta směrodatnou a důvěryhodnou diagnostickou metodou a nahradila tak invazivní diagnostické vyšetření (cystoskopie), bohužel nelze dosáhnout ani důslednou aplikací Pařížské klasifikace. To je podmíněno jednak skutečností, že močová cytologie není schopná stratifikovat pacienty podle doporučených postupů EAU (cytologie nedokáže odpovědět na základní dotazy urologů potřebné k zaklasifikování pacienta do určité kategorie doporučených postupů), dále pak tato klasifikace patrně nepovede ke zvýšení sensitivity v záchytu low-grade lézí. Doporučené postupy EAU celkem překvapivě stále vycházejí z WHO klasifikace z roku 1973 (25-27), tedy klasifikace vyznávající zcela jiný gradingový systém než WHO 2016 a Pařížský systém pro hodnocení močové cytologie (kategorie dobře/středně/špatně diferencovaný UC ve WHO 1973, vs. low-grade a high-grade UC ve WHO 2016 i Pařížské klasifikaci) (1,32). Další překážkou v implementaci močové cytologie do rozhodování o léčbě je dobře známý fakt, že cytologickým vyšetřením v žádném případě nelze odlišit invazivní a neinvazivní UC. Krevnaté pozadí, zánětlivé elementy i nekrotické hmoty jsou relativně častým nálezem u pozitivních močových cytologií, avšak tyto znaky nevypovídají nic o možném invazivním růstu (křehké, exofyticky roustoucí, keříčkovité nádorové hmoty se často odlamují a léze krvácí, což podmiňuje i jeden z prvních klinických příznaků UC u pacienta - mikroskopickou/makroskopickou hematurii (33)). Invazivita/neinvazivita léze, přesněji pak invaze/nepřítomnost invaze do muscularis propria (muscle invasive bladder cancer – MIBC / non-muscle invasive cancer – MNIBC) je též jedním z rozhodujících kritérií doporučených postupů EAU (25, 27), které z cytologie stanovit nelze. Konečně, záchyt low-grade lézí v cytologii je limitován histologicky dobře známou minimální cytologickou alterací urotelu u low-grade papilárních lézí, u nichž o histologické diagnóze z biopsie rozhoduje často spíše architektonická alterace u neoplastického urotelu než cytomorfologické znaky. To je i jasným důvodem špatné senzitivity močové cytologie v záchytu low-grade lézí.
Výsledek cytologie tedy, i přes důslednou aplikaci Pařížského klasifikačního systému, povede nejspíše ke stejnému klinickému závěru jako doposud: I přes negativní močovou cytologii pacient podstoupí dispenzární cystoskopii pro potvrzení negativního nálezu, při pozitivním močovém nálezu pacient podstoupí cystoskopii s terapeutickou a zároveň diagnostickou resekcí tumoru pro stanovení rizik a plánování dalších dispenzárních a terapeutických postupů.
V usilovné snaze najít neinvazivní metodu spolehlivé detekce a monitorování uroteliálních malignit byla vyvinuta celá řada dalších, tzv. pomocných testů, využívajících při analýze spontánně vymočenou moč a molekulárně genetické metody. Ač se jedná o metody velmi ambiciózní, netěší se příliš velkému užití, na vině je jejich horší dostupnost a vysoká cena za vyšetření. Toto odvětví se i přes to rychle rozrůstá a těší se velké publikační popularitě. Identifikována byla široká škála molekulárních uroteliálních markerů teoreticky využitelných při detekci UC, jen některé byly posléze uvedeny do klinické praxe (5). Žádný z těchto testů však není inkorporován v doporučených postupech EAU (5), sledování pacientů založené na pomocných testech není doporučováno (34). Mezi nejznámější pomocné testy jsou řazeny UroVysion® a ImmunoCyt/UCyt+® (tzv. „cell-based“ testy) a dále testy založené na nemorfologické analýze moči (tzv. „liquid-based“ testy), např. BTATM test, NMP22TM test. UroVysion® je test založený na FISH detekci numerických a strukturálních aberací, které jsou jedním ze znaků UC (aneuploidie chromosomů 3, 7, 17; status 9p21 pro gen p16), tato metoda je obecně považována za nejvíce slibný pomocný test (5), zejména v případech negativního cystoskopického nálezu při současném nálezu AUC v močové cytologii (34). ImmunoCyt/UCyt+® je na immunoflourescenci založený test detekující tři proteiny (19A211, M344 a LDQ10), preferenčně exprimováné u UC (5). V porovnání s UroVision® by test měl být více sensitivní v detekci low-grade lézí (35). BTATM test detekuje (pomocí imunoeseje) od lidského komplementového faktoru H odvozený protein (hCFHrp), jehož hladina v moči je u pacientů s UC zvýšena (36). NMP22TM testem je pomocí imunoeseje vyšetřována hladina proteinu jaderného mitotického aparátu (nuclear mitotic apparatus protein 22 – NMP22), který je uvolňován z apoptických buněk (37). S nástupem Next Generation Sequencing (NGS) se pak otevírají úplně nové možnosti neinvazivní detekce UC. Recentní práce ukazují, že low-grade MNIBC, karcinoma in situ, high-grade MNIBC i MIBC obsahují různé mutace a molekulárně genetický profil je velmi heterogenní (38). Proto se zdá, že spolehlivý molekulárně genetický test by měl být širokospektrý, postaven na panelu biomarkerů pokrývajících diverzitu UC (39). Nejčastěji mutované geny u UC jsou FGFR3 a TERT (39-41). TERT je mutován zhruba u 65-72% UC (42,43), bez ohledu na grade a stage onemocnění (42). Zcela novou metodiku pak představuje volná nádorová DNA v tekutých biopsiích, metoda mající velký potenciál jako neinvazivní biomarker (44,45).
Na závěr bychom rádi uvedli několik obecných pravidel:
- Močová cytologie má řadu omezení.
- Je však poměrně jednoduchá, levná a při dodržování základních pravidel může napomoci při rozhodování o léčbě, popřípadě další diagnostické práci.
- Na straně urologů je vyžadován správný odběr dostatečně objemného vzorku a jeho urychlené zaslání do laboratoře v odpovídajících podmínkách.
- V laboratoři je pak nutné zacházet s močí dle pokynů, veškeré technologické prohřešky se okamžitě promítnou do kvality cytospinových preparátů. Je ideální, pokud je močová cytologie odečítána specialistou.
- Výsledky vyšetření musí urolog hodnotit vždy v kontextu s klinickým nálezem a eventuálně i s výsledky dalších pomocných vyšetření.
- Pouze tak má indikace cytologického vyšetření moči význam a nejde pouze o splnění požadavků guidelines.
ZÁVĚR
Z pohledu patologa je Pařížská klasifikace jednoduchá, snadno aplikovatelná a pohodlná, žádný klasifikační systém však nedokáže odfiltrovat výše jmenované vlastní limitace močové cytologie. Tato nově nastolená klasifikace patrně nepovede k výrazným změnám v ošetřování pacientů s UC ani příliš neovlivní doporučené postupy EAU. Velmi cennou je však snaha globálně ujednotit hodnocení a hlášení močových cytologií, snížit interobservační variabilitu a srozumitelností pak i zjednodušit práci klinickým lékařům.
PODĚKOVÁNÍ
Podpořeno programem rozvoje vědních oborů Karlovy univerzity (Projekt Q39) a MZ ČR RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Kristýna Pivovarčíková, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Alej Svobody 80, 30460 Plzeň
tel.: +420377404633
e-mail: pivovarcikovak@fnplzen.cz
Sources
1. Moch H, Humphrey PA, Ulbright TM, Reuter VE. WHO classification of tumours of the urinary system and male genital organs. Lyon: IARC; 2016.
2. Koss LG, Deitch D, Ramanathan R, Sherman AB. Diagnostic value of cytology of voided urine. Acta Cytol 1985; 29(5): 810-816.
3. Raab SS, Lenel JC, Cohen MB. Low grade transitional cell carcinoma of the bladder. Cytologic diagnosis by key features as identified by logistic regression analysis. Cancer 1994; 74(5): 1621-1626.
4. Bastacky S, Ibrahim S, Wilczynski SP, Murphy WM. The accuracy of urinary cytology in daily practice. Cancer 1999; 87(3): 118-128.
5. Rosenthal DL, Wojcik EM, Kurtycz DFI. The Paris System for Reporting Urinary Cytology. Switzerland Springer; 2016.
6. Barrett DL, King EB. Comparison of cellular recovery rates and morphologic detail obtained using membrane filter and cytocentrifuge techniques. Acta Cytol 1976; 20(2): 174-180.
7. Wright RG, Halford JA. Evaluation of thin-layer methods in urine cytology. Cytopathology 2001; 12(5): 306-313.
8. Hwang EC, Park SH, Jung SI, et al. Usefulness of liquid-based preparation in urine cytology. Int J Urol 2007; 14(7): 626-629.
9. Son SM, Koo JH, Choi SY, et al. Evaluation of Urine Cytology in Urothelial Carcinoma Patients: A Comparison of CellprepPlus(R) Liquid-Based Cytology and Conventional Smear. Korean J Pathol 2012; 46(1): 68-74.
10. Linder J. Recent advances in thin-layer cytology. Diagn Cytopathol 1998; 18(1): 24-32.
11. Laucirica R, Bentz JS, Souers RJ, et al. Do liquid-based preparations of urinary cytology perform differently than classically prepared cases? Observations from the College of American Pathologists Interlaboratory Comparison Program in Nongynecologic Cytology. Arch Pathol Lab Med 2010; 134(1): 19-22.
12. Straccia P, Bizzarro T, Fadda G, Pierconti F. Comparison between cytospin and liquid-based cytology in urine specimens classified according to the Paris System for Reporting Urinary Cytology. Cancer Cytopathol 2016; 124(7): 519-523.
13. Luthra UK, Dey P, George J, et al. Comparison of ThinPrep and conventional preparations: urine cytology evaluation. Diagn Cytopathol 1999; 21(5): 364-366.
14. Nassar H, Ali-Fehmi R, Madan S. Use of ThinPrep monolayer technique and cytospin preparation in urine cytology: a comparative analysis. Diagnostic Cytopathol 2003; 28(3): 115-118.
15. Elsheikh TM, Kirkpatrick JL, Wu HH. Comparison of ThinPrep and cytospin preparations in the evaluation of exfoliative cytology specimens. Cancer 2006; 108(3): 144-149.
16. Kim JY, Kim HJ. A Comparison Between ThinPrep Monolayer and Cytospin Cytology for the Detection of Bladder Cancer. Korean J Urol 2014; 55(6): 390-394.
17. Granados R, Butron M, Santonja C, et al. Increased risk of malignancy for non-atypical urothelial cell groups compared to negative cytology in voided urine. Morphological changes with LBC. Diagn cytopathol 2016; 44(7): 582-590.
18. Luo Y, She DL, Xiong H, Yang L, Fu SJ. Diagnostic Value of Liquid-Based Cytology in Urothelial Carcinoma Diagnosis: A Systematic Review and Meta-Analysis. PloS one 2015; 10(8): e0134940.
19. VandenBussche CJ, Rosenthal DL, Olson MT. Adequacy in voided urine cytology specimens: The role of volume and a repeat void upon predictive values for high-grade urothelial carcinoma. Cancer cytopathol 2016; 124(3): 174-180.
20. Prather J, Arville B, Chatt G, et al. Evidence-based adequacy criteria for urinary bladder barbotage cytology. J Am Soc Cytopathol 2015; 4(2): 57-62.
21. Wojcik EM. What should not be reported as atypia in urine cytology. J Am Soc Cytopathol 2016; 4(1): 30-36.
22. Owens CL, Vandenbussche CJ, Burroughs FH, Rosenthal DL. A review of reporting systems and terminology for urine cytology. Cancer Cytopathol 2013; 121(1): 9-14.
23. Renshaw AA, Nappi D, Weinberg DS. Cytology of grade 1 papillary transitional cell carcinoma. A comparison of cytologic, architectural and morphometric criteria in cystoscopically obtained urine. Acta Cytol 1996; 40(4): 676-682.
24. Ondič O, Slunéčko R, Švajdler M. Postavenie a význam cytológie moča v diagnostike uroteliálnych nádorov. Cesk Patol 2014; 50(4): 142-145.
25. Babjuk M, Burger M, Compérat E, et al. EAU Guidelines on Non-muscle-invasive Bladder Cancer (TaT1 and CIS). Edn presented at the EAU Annual Congress London 2017. Arnhem: EAU Guidelines Office; 2017.
26. Rouprêt M, Babjuk M, Burger M, et al. EAU Guidelines on Urothelial Carcinoma of the Upper Urinary Tract Edn presented at the EAU Annual Congress London 2017. Arnhem: EAU Guidelines Office; 2017.
27. Witjes JA, Compérat E, Cowan NC, et al. EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer. Edn presented at the EAU Annual Congress London 2017. Arnhem: EAU Guidelines Office; 2017.
28. Koss LG, Bartels PH, Sychra JJ, Wied GL. Diagnostic cytologic sample profiles in patients with bladder cancer using TICAS system. Acta Cytol 1978; 22(5): 392-397.
29. Murphy WM, Soloway MS, Jukkola AF, Crabtree WN, Ford KS. Urinary cytology and bladder cancer. The cellular features of transitional cell neoplasms. Cancer 1984; 53(7): 1555-1565.
30. Ooms EC, Veldhuizen RW. Cytological criteria and diagnostic terminology in urinary cytology. Cytopathology 1993; 4(1): 51-54.
31. Eble JN, Epstein JI, Sesterhenn IA. World Health Organization Classification of Tumours Pathology and Genetics Tumours of the Urinary System and Male Genital Organs. IARC Press Lyon. 2004.
32. Mostofi FK, Sobin LH, Torloni H. International histological classification of tumors. Geneva: World Health Organization; 1973.
33. Grossfeld GD, Litwin MS, Wolf JS Jr, et al. Evaluation of asymptomatic microscopic hematuria in adults: the American Urological Association best practice policy--part II: patient evaluation, cytology, voided markers, imaging, cystoscopy, nephrology evaluation, and follow-up. Urology 2001; 57(4): 604-10.
34. Kamat AM, Hegarty PK, Gee JR, et al. ICUD-EAU International Consultation on Bladder Cancer 2012: Screening, diagnosis, and molecular markers. Eur Urol 2013; 63(1): 4-15.
35. Sullivan PS, Nooraie F, Sanchez H, et al. Comparison of ImmunoCyt, UroVysion, and urine cytology in detection of recurrent urothelial carcinoma: a “split-sample” study. Cancer 2009; 117(3): 167-173.
36. Kinders R, Jones T, Root R, et al. Complement factor H or a related protein is a marker for transitional cell cancer of the bladder. Clin Cancer Res 1998; 4(10): 2511-2520.
37. Soloway MS, Briggman V, Carpinito GA, et al. Use of a new tumor marker, urinary NMP22, in the detection of occult or rapidly recurring transitional cell carcinoma of the urinary tract following surgical treatment. J Urol 1996; 156(2 Pt 1) :363-7.
38. Knowles MA, Hurst CD. Molecular biology of bladder cancer: new insights into pathogenesis and clinical diversity. Nat Rev Cancer 2015; 15(1): 25-41.
39. Ward DG, Baxter L, Gordon NS, et al. Multiplex PCR and Next Generation Sequencing for the Non-Invasive Detection of Bladder Cancer. PloS one 2016; 11(2): e0149756.
40. Cappellen D, De Oliveira C, Ricol D, et al. Frequent activating mutations of FGFR3 in human bladder and cervix carcinomas. Nat Genet 1999; 23(1): 18-20.
41. Allory Y, Beukers W, Sagrera A, et al. Telomerase reverse transcriptase promoter mutations in bladder cancer: high frequency across stages, detection in urine, and lack of association with outcome. Eur Urol 2014; 65(2): 360-366.
42. Rachakonda PS, Hosen I, de Verdier PJ, et al. TERT promoter mutations in bladder cancer affect patient survival and disease recurrence through modification by a common polymorphism. Proc Natl Acad Sci U S A 2013; 110(43): 17426-17431.
43. Pivovarcikova K, Pitra T, Vanecek T, et al. Comparative study of TERT gene mutation analysis on voided liquid-based urine cytology and paraffin-embedded tumorous tissue. Ann Diagn pathol 2016; 24 : 7-10.
44. Ward DG, Bryan RT. Liquid biopsies for bladder cancer. Transl Androl Urol 2017; 6(2): 331-335.
45. Birkenkamp-Demtroder K, Christensen E, Nordentoft I, et al. Monitoring Treatment Response and Metastatic Relapse in Advanced Bladder Cancer by Liquid Biopsy Analysis. Eur Urol In press 2017.
46. Lindsey KG, Chajewski OS, Wojcik EM. Urine Cytology: Purpose, Practice, and Paris. AJSP: Reviews & Reports 2016; 21 : 279-283.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2019 Issue 1-
All articles in this issue
- Pneumologická cytodiagnostika – state of the art 2019
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Primární maligní obrovskobuněčný nádor pažní kosti mikroskopicky napodobující chondroblastom – kazuistika
- Noonanovej syndróm z pohľadu fetopatológa
- Imunohistochemická diagnostika morbus Hirschsprung pomocí kalretininu
- Jaká je vaše diagnóza?
- Nový systém pro sjednocené hodnocení tenkojehlových aspiračních cytologií slinných žláz: Co nového přinesl „tzv. Milánský systém reportování“ do cytodiagnostiky lézí slinných žláz?
- Jaká je vaše diagnóza? Odpověď: Difúzny leptomeningeálny glioneuronálny tumor (diffuse leptomeningeal glioneuronal tumor)
- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Noonanovej syndróm z pohľadu fetopatológa
- Pneumologická cytodiagnostika – state of the art 2019
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

