-
Medical journals
- Career
Peroperačné vyšetrenie pankreasu, žlčníka, extrahepatálnych žlčových ciest, pečene a gastrointestinálneho traktu
: Peter Švajdler 1; Ondřej Daum 2,3; Magdaléna Dubová 2,3; Bohuslava Šašková 2,3; Boris Rychlý 4; Marián Švajdler 2,3
: Oddelenie patológie, Univerzitná nemocnica Louisa Pasteura, Košice, Slovenská Republika 1; Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň, Česká republika 2; Bioptická laboratoř, s. r. o., Plzeň, Česká republika 3; Cytopathos, s. r. o., Bratislava 4
: Čes.-slov. Patol., 54, 2018, No. 2, p. 63-71
: Reviews Article
Hlavnými indikáciami na peroperačné vyšetrenie gastrointestinálneho traktu, pečene a pankreatobiliárneho systému sú zhodnotenie resekčných okrajov a histologická diagnóza lézií, u ktorých nie je z rôznych príčin známa predoperačná diagnóza. Špeciálnym vyšetrením je zhodnotenie prítomnosti steatózy alebo zápalových zmien v pečeni darcu, alebo prítomnosti gangliových buniek v stene hrubého čreva pred vykonaním anastomózy u pacientov s Hirschprungovou chorobou. Najväčšími diagnostickými pascami sú rozpoznanie duktálneho karcinómu pankreasu od chronickej pankreatitídy, odlíšenie karcinómu žlčníka a extrahepatálnych žlčovodov od reaktívnych zmien spôsobených zápalom a rozoznanie prítomnosti difúzneho adenokarcinómu na resekčnom okraji pažeráka a žalúdka.
Kľúčové slová:
peroperačná biopsia – gastrointestinálny trakt – pečeň – žlčník – extrahepatálne žlčové cesty – pankreas
Indikácií na peroperačné vyšetrenie gastrointestinálneho traktu, pečene, žlčových ciest, alebo pankreasu je pomerne málo. Napriek tomu patrí peroperačné vyšetrenie týchto oblastí medzi najčastejšie. Patológ pracujúci v stredne veľkej, alebo veľkej nemocnici sa s požiadavkou na vyšetrenie resekčných okrajov resekátu, alebo peroperačnú diagnózu patologickej lézie stretne prakticky každý deň. Základom úspechu je rešpektovanie indikácií, aspoň rámcová znalosť operačného postupu, dobrá komunikácia s chirurgom, dostatočné klinické údaje a uvedomenie si limitov vyšetrovania zmrazených rezov.
PEROPERAČNÉ VYŠETRENIE PANKREASU
Medzi typické indikácie na peroperačné vyšetrenie pankreasu patrí (1-3):
Potvrdenie diagnózy malignity. V súčasnosti je v mnohých prípadoch diagnóza karcinómu pankreasu stanovená pred operáciou pomocou tenkoihlovej biopsie. V niektorých prípadoch však ani opakovaná biopsia nie je diagnostická. Mnoho chirurgov, aj v prípade, že malignita nie je histologicky potvrdená, vykoná radikálnu resekciu, ak je šanca na kuratívnu resekciu vysoko suspektného karcinómu (masa spôsobujúca symptómy musí byť aj tak odstránená). Niektorí operatéri však pred resekciou vyžadujú potvrdenie malignity. Patológ môže na peroperačné vyšetrenie dostať malú klinovitú biopsiu, alebo (menej často) ihlovú biopsiu. Častokrát je potrebné vyšetrenie viac ako jednej vzorky. Vyšetrovanie prítomnosti karcinómu v resekáte, keď je dokončená Whippleova resekcia, distálna pankreatektómia, alebo totálna pankreatektómia, nemá žiadny praktický význam, navyše môže byť príčinou narušenia orientácie materiálu, a malo by byť odmietnuté.
Vyšetrenie suspektných metastáz, najčastejšie v pečeni. Metastatické ochorenie je považované za inoperabilné (4). Výnimkou je metastatický neuroendokrinný tumor (NET). Diagnóza NET-u je väčšinou jednoduchá, ľahko však za NET možno zameniť acinárny karcinóm pankreasu (obr. 1).
1. (A) Prevažne solídne rastúci dobre diferencovaný neuroendokrinný tumor, tvorený bunkami s eozinofilnou cytoplazmou, uniformnými okrúhlymi excentricky umiestnenými jadrami, bez mitóz. (B) Peroperačný cytologický náter potvrdzujúci diagnózu – diskohezívna populácia blandných plazmocytoidných buniek s blandným chromatínom, bez nápadnejších jadierok. (C, D) Pseudoglandulárne, trabekulárne a acinárne usporiadanie niektorých NET-ov môže spôsobiť diagnostické ťažkosti. Podobnú architektoniku môže mať acinárny karcinóm. (E) Acinárny karcinóm pankreasu. Tumor má difúzne acinárne usporiadanie, s bazálne lokalizovanými jadrami. (F) Výrazná mitotická aktivita (6 mitóz v jednom poli) je v dobre diferencovaných NET-och vzácna. Prominentné jadierka typické pre acinárny karcinóm v zmrazenom reze neboli dobre viditeľné. 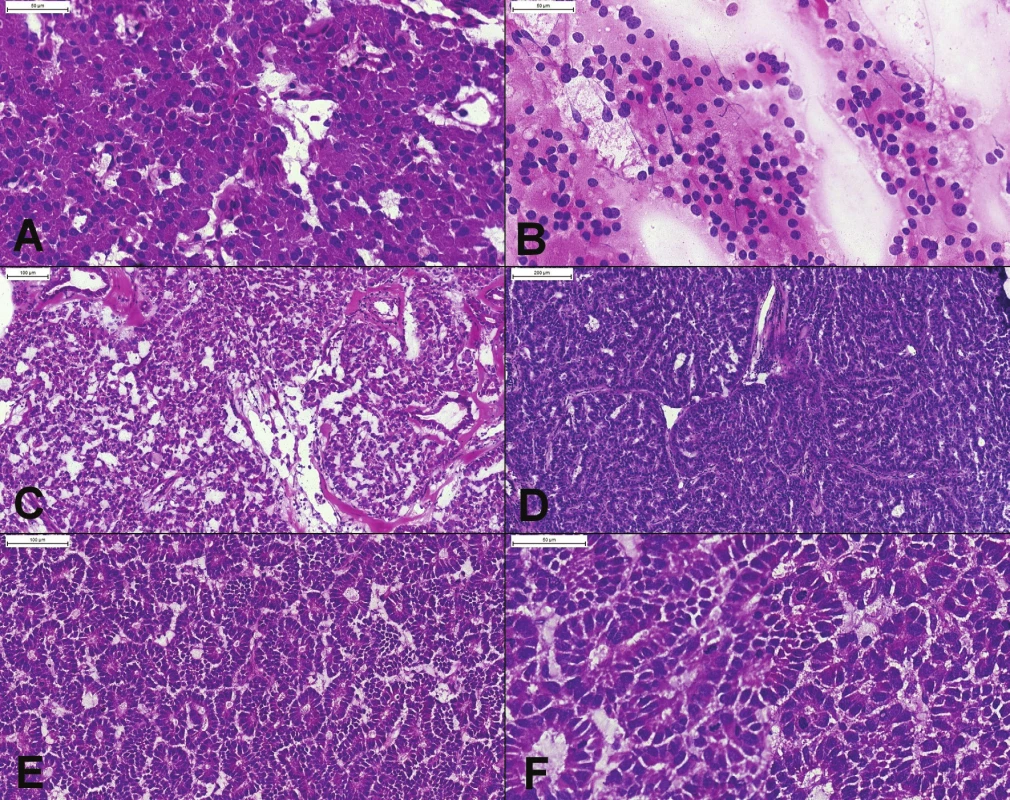
Vyšetrenie resekčných okrajov. Význam vyšetrenia okrajov a rozšírenia okraja v prípade pozitivity je však v poslednej dobe spochybňovaný (5-7).
Peroperačné vyšetrenie pankreasu, predovšetkým odlíšenie chronickej pankreatitídy a dobre diferencovaného duktálneho karcinómu patrí medzi najťažšie vyšetrenia v diagnostickej patológii (8,9). Žliazky dobre diferencovaného duktálneho karcinómu môžu vyzerať úplne benígne a pankreatidída môže imitovať karcinóm. Obraz chronickej pankreatitídy je takmer vždy prítomný v okolí duktálneho karcinómu (alebo iných lézií, ktoré spôsobia obštrukciu vývodov), takže jej nález v predoperačnej, alebo peroperačnej biopsii diagnózu malignity nevylučuje. Chronická pankreatitída je charakterizovaná variabilnou atrofiou duktálnych a acinárnych štruktúr, ktoré sú nahradené perilobulárnou a interlobulárnou fibrózou (obr. 2A-C). V pokročilejších štádiách môžu acinárne štruktúry úplne chýbať a reziduálne psudohyperplastické Langerhansove ostrovčeky a proliferujúce dukty s reaktívnymi atypiami môžu imitovať nádorové štruktúry rastúce v dezmoplastickej stróme (obr. 2D). Langerhansove ostrovčeky navyše niekedy majú pseudoglandulárnu morfológiu a môžu byť prítomné v blízkosti nervov. Dukty sú často cysticky dilatované, môže v nich byť prítomná skvamózna alebo mucinózna metaplázia (9). Najdôležitejšími diferenciálno-diagnostickými znakmi na odlíšenie karcinómu od pankreatitídy v peroperačnej biopsii sú: náhodné usporiadanie žliazok, inkompletne formované žliazky, kribriformné žliazky, infiltrácia po jednotlivých bunkách, variácia veľkosti jadier 4 : 1, veľké nepravidelné jadierka, nekrotický debris v žliazkach, mitózy (najmä atypické), žliazky v hladkej svalovine duodéna bez periduktálnej strómy, žliazky v interlobulárnej fibrotickej stróme, perineurálna alebo vaskulárna invázia, žliazky v susedstve muskulárnych artérií a „nahé“ žliazky v tukovom tkanive (obr. 3)(3,10-12).
2. (A) Chronická pankreatitída. Aj v oblastiach ťažkej atrofie (vľavo hore) je stále viditeľné organoidné lobulárne usporiadanie. (B) Oblasť s miernou až stredne výzaznou atrofiou a fibrózou. Je prítomná proliferácia duktov, ktoré sú však lokalizované v centre pankreatického acinu. (C) Ťažká atrofia (acinárne štruktúry úplne chýbajú) s proliferáciou duktov s hyperplastickým epitelom. Lobulárne usporiadanie je známkou pankreatitídy, nejedná sa o karcinóm. (D) Psudohyperplastické Langerhansove ostrovčeky a proliferujúce dukty s reaktívnymi atypiami môžu imitovať karcinóm v dezmoplastickej stróme. 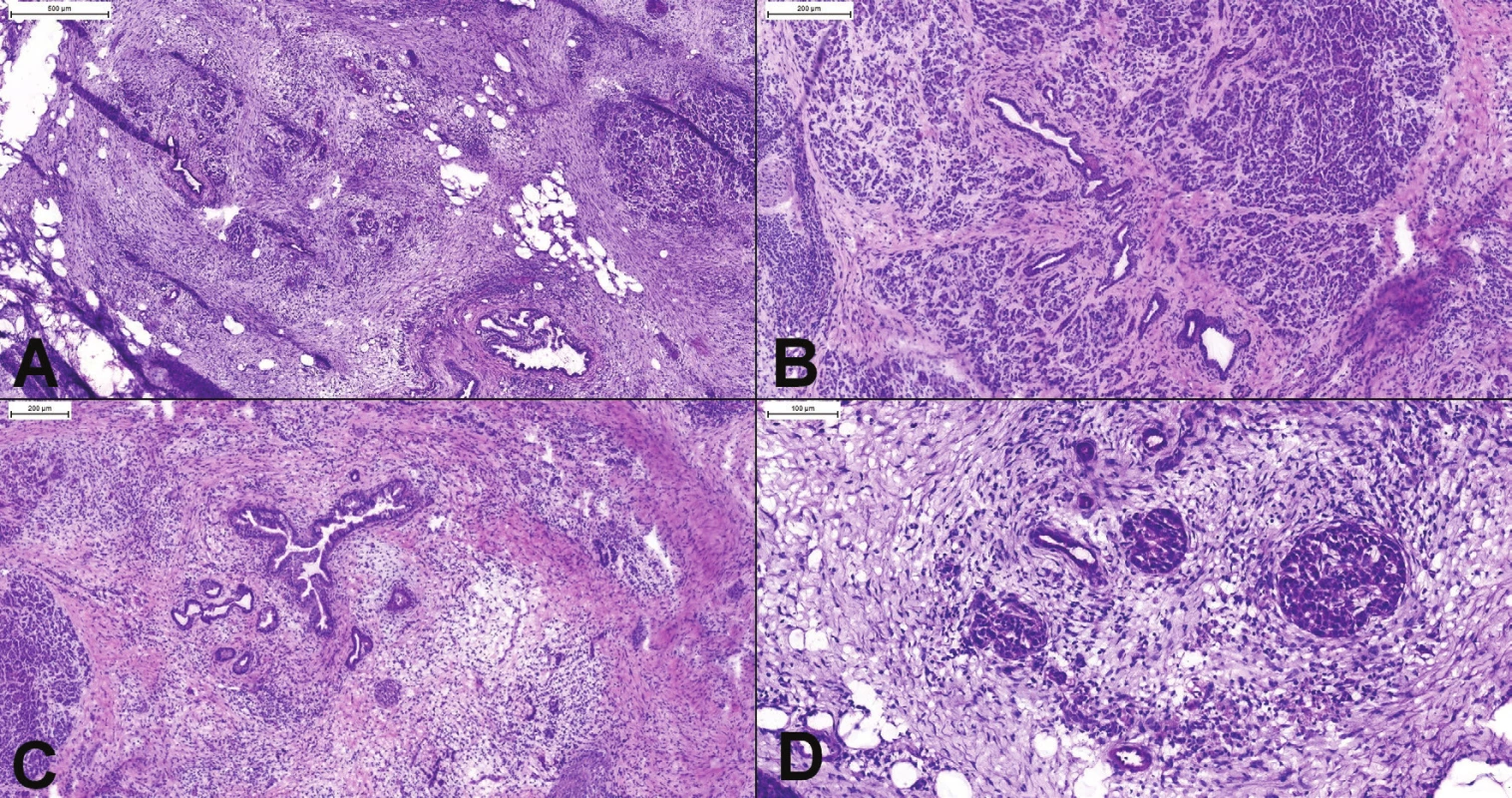
3. (A) Duktálny karcinóm pankreasu. Vo väčšine prípadov je diagnóza ľahká. Chaoticky usporiadané žliazky s cytologickými atypiami a debris v lúmenoch sú jednoznačnou známkou malignity. (B, C) Žliazky karcinómu lokalizované vo fibrotických interlobulárnych septách (), v blízkosti muskulárnych artérií (*). V normálnom pankrease dukty a väčšie cievy nikdy nemajú spoločný priebeh. (D) Nekrotický debris v atypickej žliazke. (E) Variácia veľkosti jadier 4:1, inkopletne formované žliazky a infiltrácia po jednotlivých bunkách. (F) Perineurálna invázia 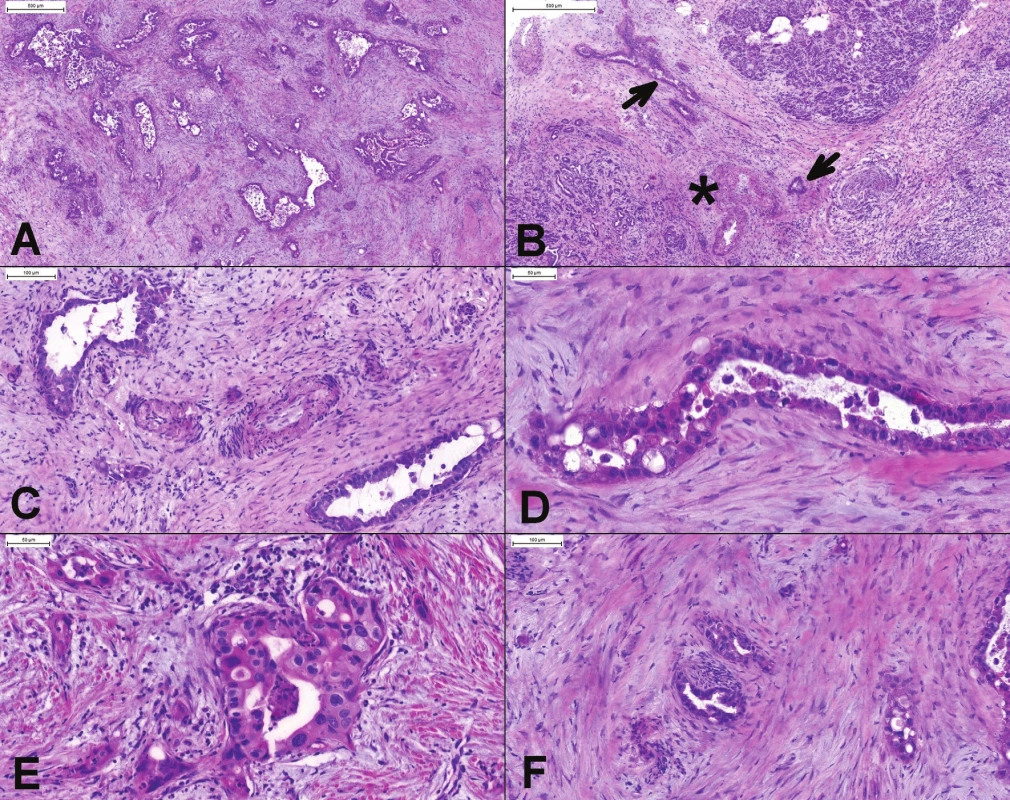
Napriek pochybnostiam o význame vyšetrenia okrajov je toto vyšetrenie na väčšine pracovísk stále rutínne vykonávané. Ide predovšetkým o vyšetrenie parenchýmového okraja pankreasu, štandardne býva vyšetrený aj okraj choledochu. Retroperitoneálny okraj je dôležitý pri konečnom stagingu ochorenia, peroperačné vyšetrenie však nemá zmysel, pretože ďalšia resekcia tkaniva nie je aj tak možná. V prípade nálezu pankreatickej intraepitelovej neoplázie (PanIN) 1-2 je okraj považovaný za čistý. V minulosti bol nález PanIN-3 na okraji považovaný za signifikantný nález (a za indikáciu na rozšírenie okraja), zdá sa však, že PanIN-3 na okraji v prípade R0 resekcie nemá väčší prognostický význam (13). Doporučujeme nález PanIN-3 na okraji individuálne prediskutovať s operatérom (na zváženie môže byť dodatočná resekcia napr. u mladšieho pacienta s R0 resekciou). Nález intraduktálnej papilárnej mucinóznej neoplázie (IPMN) s vysokým stupňom dysplázie na resekčnom okraji je indikáciou na rozšírenie okraja. IPMN s nízkym stupňom dysplázie nevyžaduje ďalší manažment (14).
Celková presnosť peroperačného vyšetrenia pankreasu je udávaná v rozmedzí 83 % - 98,5 % (11,15,16). Vyššia presnosť vyšetrenia je popisovaná pre vyšetrenie okrajov a nižšia pre hodnotnie metastáz a diagnózu primárneho tumoru.
PEROPERAČNÉ VYŠETRENIE ŽLČNÍKA A EXTRAHEPATÁLNYCH ŽLČOVÝCH CIEST
Požiadavka na peroperačné vyšetrenie žlčníka alebo extrahepatálnych žlčových ciest je podľa našich skúseností menej častá. Typickými indikáciami sú (1,2,17):
- Vyšetrenie žlčníka ak je pri operácii (alebo predoperačne) zistená polypoidná slizničná lézia, alebo podozrivé zhrubnutie steny. Peroperačné potvrdenie malignity zvyčajne znamená konverziu laparoskopickej operácie na operáciu otvoreným spôsobom, resekciu lôžka žlčníka a pátranie po suspektných lymfatických uzlinách. Dôležité je vyšetrenie resekčného okraja.
- Niektorí autori doporučujú peroperačné vyšetrenie všetkých žlčníkov, ktoré sú resekované u pacientov s obrazom akútnej cholecystitídy, keďže je výskyt incidentálneho karcinómu v týchto prípadoch vyšší ako v neakútnych prípadoch a schopnosť makroskopického rozpoznania karcinómu chirurgom je nedostatočná (18).
- Vyšetrenie extrahepatálnych žlčových ciest je vo väčšine prípadov vykonávané za účelom potvrdenia klinicky suspektnej malignity. Veľmi často sa jedná o nádory v pokročilom štádiu, keď radikálna resekcia už nie je možná a chirurg vykoná iba paliatívny zákrok (napr. založenie stentu). Ak je možná resekcia nádoru, okrem potvrdenia diagnózy je mimoriadne dôležité vyšetrenie resekčných okrajov - vylúčenie prítomnosti invazívneho karcinómu (19-21). Prítomnosť biliárnej intraepiteliálnej neoplázie (BilIN) na resekčnom okraji nemá klinický význam (21-23). Resekáty nádorov proximálnej časti extrahepatálnych žlčovodov zahŕňajú aj časť parenchýmu pečene, ktorý predstavuje proximálny resekčný okraj, ktorý by tiež mal byť peroperačne vyšetrený.
Pri vyšetrovaní žlčníka je niekedy ťažké odlíšiť reaktívne zmeny, prípadne extenziu dysplastického epitelu do Rokitanskeho-Aschoffovych sinusov a invazívny karcinóm (17,24). Problematická môže byť ruptúra dilatovaných sinusov s extravazáciou mucínu, dezmoplastickou reakciou, alebo dislokáciou epitelu do tesnej blízkosti nervov. Jednoznačná diagnóza môže byť ťažká aj v definitívnej biopsii. Rokitanskeho-Aschoffove sinusy sú orientované kolmo na slizničný povrch, sú ostro ohraničené, ale extenzívne vetvenie môže vytvoriť tubuly orientované paralelne s lúmenom. Je prítomná komunikácia s luminálnym povrchom a cysticky dilatované žliazky nevykazujú výraznejšie atypie. Naproti tomu, žliazky adenokarcinómu sú angulované, náhodne rozmiestnené, paralelne s luminálnym povrchom a majú cytologické atypie (obr. 4)(17). Ďalšou diagnostickou pascou sú aberantné Lushkeho biliárne žliazky, vyskytujúce sa v mieste lôžka žlčníka a v prípadoch chronickej cholecystitídy aj v subseróznom spojivovom tkanive (17). Makroskopicky a aj mikroskopicky môže karcinóm imitovať xantogranulomatózna cholecystitída. Presnosť peroperačnej diagnózy je v prípade xantogranulomatóznej cholecystitídy signifikantne vyššia (~91 %) ako presnosť makroskopickej chirurgickej diagnózy (50 %)(25).
4. (A, B) Peroperačné vyšetrenie polypoidnej lézie žlčníka, ktorá bola zistená radiologickým vyšetrením pred odberom orgánov od žijúceho darcu. Okrem polypoidnej lézie boli vo svalovej vrstve prítomné náhodne rozmiestnené angulované žliazky, niektoré s horizontálnym priebehom. (C) V polypoidnej časti boli jednoznačne prítomné high-grade dysplatické zmeny (BilIN-3). (D) Atypické žlazky v tesnej blízkosti muskulárnej artérie. Diagnóza dobre diferencovaného adenokarcinómu bola potvrdená aj definitívnym vyšetrením. Odber orgánov bol zrušený. 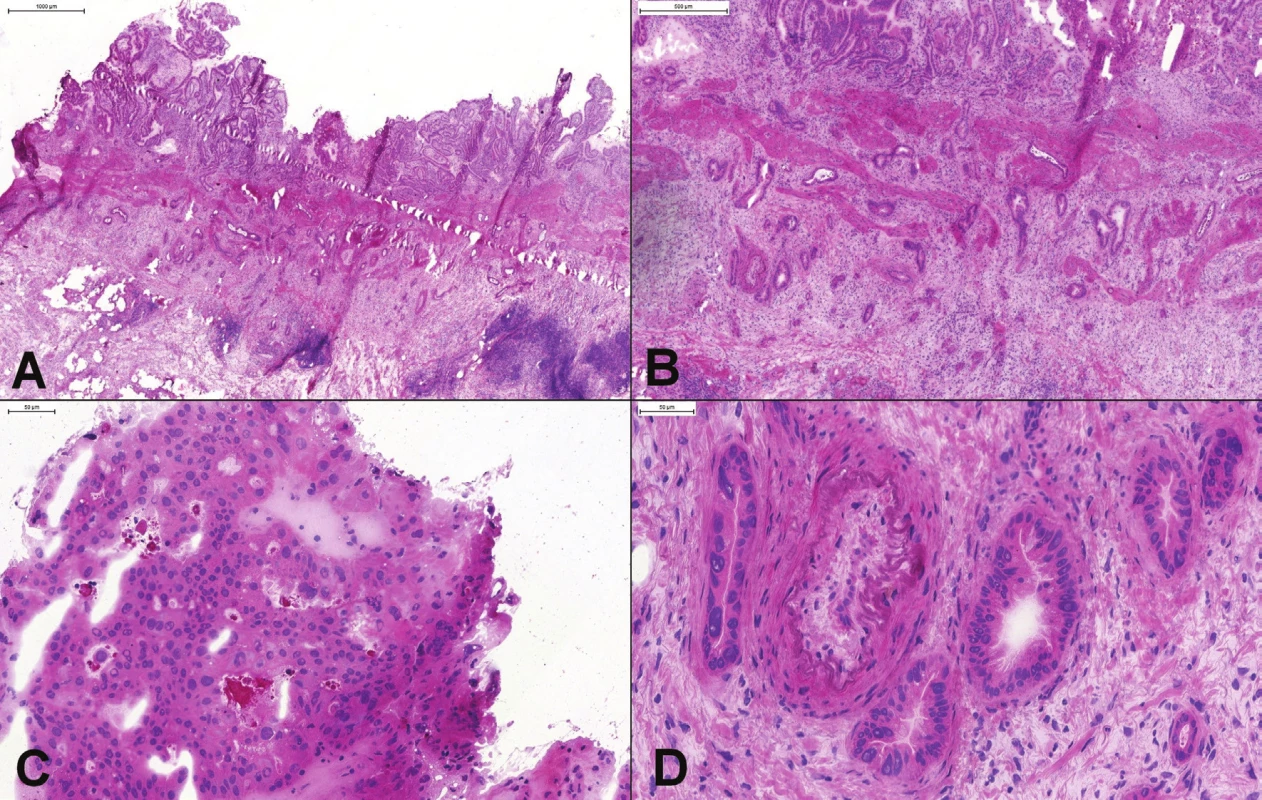
Peribiliárne žliazky v žlčových cestách, často s reaktívnymi atypiami v zápalovo zmenenom žlčovode, môžu imitovať karcinóm (26). Dobrým vodítkom pre diagnózu malignity je prítomnosť perineurálnej infiltrácie, prítomnosť žliazok v blízkosti veľkých (muskulárnych) artérií, dvojitá populácia žliazok, dezmoplázia, fúzovanie a kribriformné formácie žliazok, formovanie solídnych hniezd, náhodné usporiadanie žliazok (aj keď lobulárne usporiadanie normálnych žliazok môže byť mierne narušené zápalom a fibrózou) a celulárne atypie - stratifikácia jadier so stratou polarity, zväčšenie, hyperchromázia a nepravidelnosti jadier, aspoň štvornásobná variácia veľkosti jadier, veľké jadierka, apotózy a mitózy, atypické mitózy (obr. 5)(2,17,27).
5. (A) Peroperačné vyšetrenie okraja choledochu. Náhodne usporiadané žliazky karcinómu (pravá časť obrázku), ktorý infiltruje celú stenu choledochu. Lobulárne usporiadané reziduálne peribiliárne žliazky (v krúžku). (B) Chaoticky usporiadané angulované žliazky karcinómu, cytologicky iba mierne atypické. (C) Perineurálna invázia. 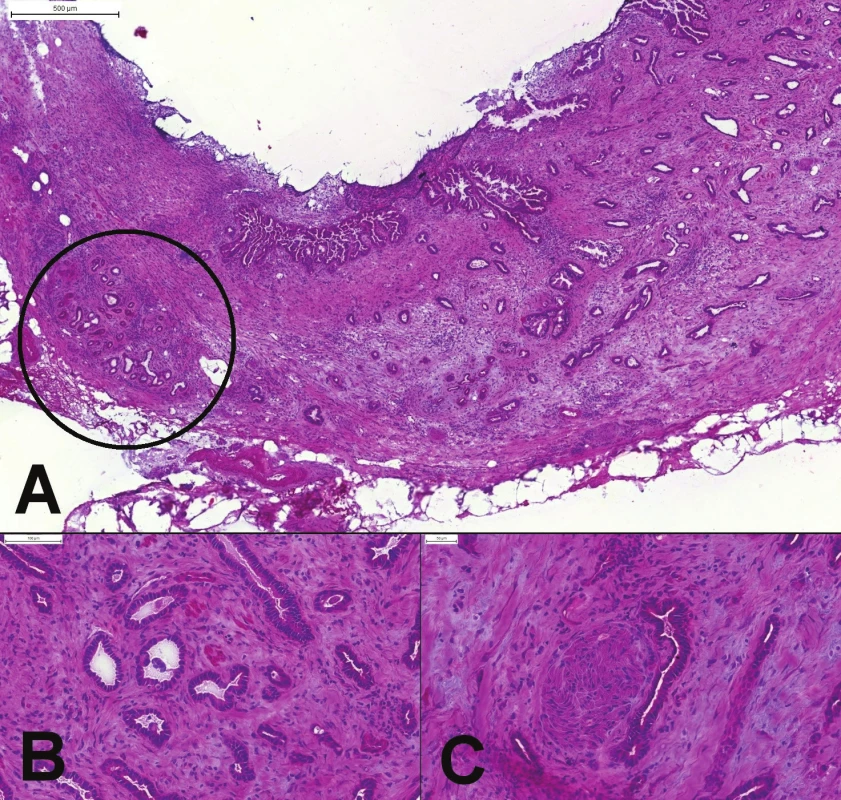
Štúdie hodnotiace presnosť peroperačného vyšetrenia žlčníka dokazujú, že celková presnosť vyšetrenia je vysoká (95,3 %), ale je nižšia pri polypoidných léziách (91 %) ako pri nepolypoidných (intramurálnych) léziách (98 %)(28). V štúdii 990 peroperačne vyšetrených žlčníkov bolo peroperačne diagnostikovaných 983 prípadov ako benígne, pričom v štyroch prípadoch bola definitívna diagnóza zmenená na malígnu. Všetkých sedem malignít diagnostikovaných peroperačne bolo potvrdených aj definitívnym vyšetrením. Senzitivita a špecificita peroperačného vyšetrenia pre malígnu diagnózu bola teda 64 % a 100 % (24).
Obtiažnosť hodnotenia okraja resekátu žlčových ciest demonštrujú pomerne nepriaznivé údaje o diagnostickej zhode. V jednej práci bolo v 9 % prípadov peroperačne „benígnych“ okrajov v definitívnej biopsii diagnostikovaný karcinóm (19). V ďalších štúdiách bola diagnostická zhoda medzi peroperačným a definitívnym vyšetrením ešte horšia, iba na úrovni 75 % a 56,5 % (29,30). Aj po stanovení histologickej klasifikácie a „tréningu“ hodnotenia okrajov resekátov žlčových ciest bol diagnostická zhoda pre intraepiteliálne a intramurálne (infiltratívne) lézie na proximálnom a distálnom okraji resekátu iba 73%, 85%, 78 % a 87 % (27).
PEROPERAČNÉ VYŠETRENIE PEČENE
Hlavnými indikáciami na peroperačné vyšetrenie pečene sú (1,2,17,31-33):
- Stanovenie diagnózy v prípade ložiskovej lézie. Môže sa jednať o solitárne ložisko, prípadne viacero ložísk. Klinicky dôležité môže byť potvrdenie metastatického ochorenia v prípade známeho nádorového ochorenia. Mnohé malignity sú v tomto štádiu považované za inoperabilné, aj keď „debulking“ stále môže byť pre pacienta prínosný. V prípade malignity s neznámym origom môže histologické potvrdenie malignity a histologického typu ďalej nasmerovať chirurga v pátraní po pôvode metastázy. Morfológia metastáz, väčšinou adenokarcinómov gastrointestinálneho traktu, však v mnohých prípadoch neumožňuje presnejšie stanovenie pôvodu metastázy. V týchto prípadoch postačí diagnóza malignity a potvrdenie reprezentatívnosti tkaniva, ktoré je po definitívnom spracovaní ďalej vyšetrované imunohistochemicky, prípadne geneticky. V prípade, že sa jedná o primárnu hepatocelulárnu léziu (fokálna nodulárna hyperplázia, hepatocelulárny adenóm – HCA alebo hepatocelulárny karcinóm - HCC), nie je ďalej nutné pátrať po origu a operatér sa môže sústrediť na resekciu lézie.
- V prípade, že je solitárna lézia (prípadne niekoľko lézií) technicky vhodná na resekciu (lobektómia, parciálna hepatektómia), je dôležité posúdenie resekčných okrajov.
- Zhodnotenie pečene donora pred transplantáciou.
Okraje resekátu pečene je nutné ofarbiť tušom, pretože často majú veľmi nepravidelný tvar a aj lézie, ktoré sa javia makroskopicky ako odstránené celé, sú mikroskopicky často blízko okraja, alebo na resekčnej línii.
Patológ by mal mať informáciu, či sa jedná o léziu v teréne cirhózy alebo v normálnej pečeni. Dôležité sú aj ďalšie klinické informácie – diagnóza alebo podozrenie na primárnu malignitu, alebo výsledky serologických vyšetrení (alfa fetoprotein, markery vírusových hepatitíd).
V normálnej pečeni je najčastejšou léziou metastáza a jej diagnóza je v drvivej väčšine prípadov jednoduchá, aj keď stanovenie origa nemusí byť ľahké. Vo väčšine prípadov operatérovi postačí potvrdenie diagnózy, prípadne s dodatkom, že nález je „kompatibilný s klinicky udávaným origom“. Odlíšenie primárneho intrahepatálneho cholangiokarcinómu od metastázy nie je peroperačne a väčšinou ani v definitívnej biopsii možné. V tomto prípade je možné formulovať peroperačný záver napr. takto: „štruktúry adenokarcinómu, po vylúčení metastatického pôvodu lézie kompatibilného s diagnózou primárneho cholangiocelulárneho karcinómu“ (obr. 6A). Pomerne často peroperačne vyšetrovanou léziou je biliárny adenóm (bile duct adenoma) a biliárny hamartóm (bile duct hamartoma/von Meyenburg complex). Ide o subkapsulárne lokalizované, relatívne drobné (typicky niekoľko mm, adenóm však môže byť veľký aj niekoľko cm) lézie bielej farby, ktoré klinicky môžu imitovať metastázy (obr. 6B-D). Za nekroticky zmenený karcinóm, alebo nešpecifické reparatívne zmeny je niekedy peroperačne zamenená alveolárna echinokokóza (obr. 6E)(34). Správna diagnóza je nesmierne dôležitá, pretože ak je to technicky možné, ložisko echinokokózy by malo byť kompletne odstránené.
6. (A) Metastáza adenokarcinómu choledochu v pečeni. Až po vylúčení metastatického origa by mohol tumor byť považovaný za primárny intrahepatický cholangiokarcinóm. (B, C) Subkapsulárne ložisko u pacienta so suspektným tumorom žalúdka. Ostro ohraničené ložisko, tvorené pravidelnými žliazkami v kolagénnej stróme s lymfocytmi, bez mitóz a cytologických atypií. Peroperačná a definitívna biopsia: biliárny adenóm. (D) Subkapsulárne ložisko u pacienta s karcinómom žalúdka. Nepravidelne anastomozujúce cysticky dilatované priestory vystlané blandným plochým až kubickým biliárnym epitelom. Peroperačná a definitívna diagnóza: biliárny hamartóm (von Meyenburg complex). (E) Tumor pečene u 55-ročného muža. Mikroskopicky zachytené výrazné fibroproduktívne zmeny s mnohopočetnými cystickými štruktúrami. Vo veľkom zväčšení (vložený obrázok) charakteristická laminárna membrána. Peroperačná a definitívna diagnóza: alveolárna echinokokóza. (F) Tumor pečene u 60-ročného muža. Aj keď sú nádorové bunky cytologicky relatívne málo atypické, architektonika (široké trámce a pseudoglandulárne formácie) umožňujú spoľahlivú peroperačnú diagnózu hepatocelulárneho karcinómu. 
V prípade hepatocelulárnej lézie v necirhotickej pečeni je pravdepodobnejšia diagnóza HCA, aj keď sa HCC vzácne môže vyskytovať aj v normálnom parenchýme (typicky fibrolamelárny typ HCC). Diagnóza HCC zvyčajne nerobí väčšie ťažkosti (obr. 6F)v prípade dobre diferencovanej lézie je však odlíšenie HCA od HCC často možné až v definitívnom vyšetrení s použitím imunohistochémie alebo genetiky (35).
V teréne cirhózy sú metastázy vzácne a ak sa jedná o hepatocelulárnu léziu, v diferenciálnej diagnóze je makroregeneratívny uzol, dysplastický uzol alebo hepatocelulárny karcinóm. Presná peroperačná diagnóza opäť nemusí byť vždy možná a ani potrebná (chirurg by sa vo všetkých prípadoch mal pokúsiť o kompletnú resekciu lézie).
Fokálna nodulárna hyperplázia je benígna nenádorová lézia vyskytujúca sa signifikantne častejšie u žien. Histologicky výrazne pripomína cirhózu, preto je klinická informácia, že sa jedná o ložiskovú léziu v necirhotickom parenchýme pre diagnózu zásadná.
Aj keď sa údaje z rôznych publikácií rozchádzajú a klinický význam steatózy v darcovskej pečeni je stále predmetom diskusií, makrovezikulárna steatóza je vo všeobecnosti považovaná za faktor zodpovedný za primárnu afunkciu alebo výraznú dysfunkciu po transplantácii (36). Steatóza pečene je relatívne častá, vyskytuje sa u 9-26 % darcov. Príčiny sú rôzne a zahŕňajú starší vek, obezitu, diabetes mellitus a alkoholizmus. Grafty s makrovezikulárnou steatózou postihujúcou >60 % parenchýmu by nemali byť použité na transplantáciu, pokiaľ sa nejedná o urgentnú situáciu (dočasné premostenie obdobia pred transplantom vhodnejšieho graftu). Transplantácia pečene s miernym stupňom steatózy (<30 %) je porovnateľná s graftami bez steatózy, najmä ak nie sú prítomné iné rizikové faktory. Výsledok transplantácie orgánov so stredným stupňom steatózy (30-60 %) je závislý od ďalších rizikových faktorov darcu a príjemcu. Prítomnosť mikrovezikulárnej steatózy (aj výraznej) nemá na výsledok transplantácie žiadny vplyv (36,37). Pri reportovaní steatózy je preto nevyhnutné vždy popísať typ a rozsah steatózy. Štandardom je ofarbenie zmrazených rezov hematoxylínom-eozínom, pretože kvalita špeciálnych farbení (Sudán, Oil red O) veľmi závisí od farbiacej techniky a kvality laboratória, môže spôsobiť výrazné nadhodnotenie stupňa steatózy a následné odmietnutie potenciálne použiteľného orgánu (37). Ďalšie zmeny, ktoré by mali byť v predtransplantačnej biopsii popísané je prítomnosť nekróz hepatocytov, zápalovej aktivity, prípadne fibrózy (2,17). Grafty HCV-pozitívnych donorov so stredne aktívnou interface hepatitídou a lobulárnou aktivitou a/alebo „bridging“ fibrózou sú považované za nevhodné na transplantáciu (17).
Podľa práce autorov Rakha a spol. je peroperačné vyšetrenie lézií pečene porovnateľne spoľahlivé ako vyšetrenie iných oblastí. Celková presnosť vyšetrenia bola približne 95 %, so senzitivitou a špecificitou 96,9 % a 99,1 %. Najčastejšou príčinou falošne pozitívnej diagnózy bol biliárny adenóm (38).
PEROPERAČNÉ VYŠETRENIE GASTROINTESTINÁLNEHO TRAKTU
Peroperačné vyšetrenie gastrointestinálneho traktu (GIT) je pomerne časté, ale obmedzené na niekoľko málo situácií (31,39-42):
- Stanovenie diagnózy u lézií, ktoré nebolo možné vyšetriť predoperačne pomocou endoskopickej alebo ihlovej biopsie, alebo bol bioptický záver nejednoznačný. Môže sa jednať o vyšetrenie lézií GIT bežne neprístupných pre endoskopické vyšetrenie (napr. tenké črevo, appendix), alebo lézie, ktoré sú uložené v hlbších častiach steny (napr. gastrointestinálne stromálne tumory). Indikáciou môže byť aj napr. klinicky suspektná rozsiahla vredová lézia žalúdka, aj keď bola v predoperačnej biopsii benígna.
- Vyšetrenie resekčných okrajov resekátu.
- Vyšetrenie prítomnosti gangliových buniek pri Hirschprungovej chorobe.
Kritické je správne posúdenie okrajov najmä pri resekcii pažeráka a žalúdka. Čistý okraj znižuje výskyt lokálnych rekurencií, aj keď pravdepodobne nemá vplyv na celkové prežívanie (43,44). Vždy by mali byť kompletne vyšetrené aj makroskopicky nesuspektné okraje, najmä proximálny. Mikroskopické vyšetrenie môže odhaliť propagáciu nádoru v submukóze, alebo hlbších častiach steny (obr. 7A). Distálny okraj je často tvorený dostatočne dlhým segmentom žalúdka, resp. duodéna a mikroskopické vyšetrenie je nutné iba ak je okraj menší ako 5 cm (31). Dôležité je nezameniť zmrazením zväčšené a mierne atypicky vyzerajúce zápalové bunky (najmä plazmocyty) za diskohezívne rastúci adenokarcinóm. V prípade pochybností je možné peroperačne použiť histochemický dôkaz mucínu, alebo imunohistochemický dôkaz cytokeratínov. Významným nálezom na okraji je aj prítomnosť dysplastických zmien a intestinálnej metaplázie (Barrettov pažerák).
Pri resekátoch hrubého čreva pre kolorektálny adenokarcinóm možno bezpečne vykonať iba makroskopické zhodnotenie okrajov (bez mikroskopického vyšetrenia) v prípade, že je nádor od okraja vzdialený minimálne 25 mm (39). Nezriedka nádorové ochorenie napodobuje divertikulóza s prasknutým divertiklom a zápalovým pseudotumorom – histologická diagnóza by nemala robiť väčšie problémy. Adenokarcinóm môže napodobovať aj napr. endometrióza (obr. 7B). Histologická diagnóza môže byť ťažká aj v definitívnej biopsii (45).
Za najvhodnejší spôsob liečby niektorých „veľmi včasných“ (cT1, Haggit 1-3, sm 1) adenokarcinómov rekta (väčšinou ide o tzv. malígne polypy) je v súčasnosti považovaná minimálne invazívna chirurgia - transanálna endoskopická mikrochirurgia (TAEM)(46). V prípade, že je resekčný okraj čistý, nejedná sa o zle diferencovaný karcinóm a nie je prítomná ani angiolymfatická invázia, zákrok je považovaný za kuratívny. V opačnom prípade je doporučená okamžitá radikálna totálna mezorektálna resekcia (46). Na správnu diagnostiku „high risk“ polypov určených na ďalšiu liečbu je nevyhnutné dokonalé spracovanie tkaniva po minimálne 24 hodinovej fixácii (prevencia fragmentácie tkaniva). Správny predoperačný výber pacientov vhodných na TAEM (46,47) nemôže byť nahradený peroperačným vyšetrením a patológ by ho mal po dohode s operatérom odmietnuť.
Peroperačné vyšetrenie nie je doporučované ani ako iniciálne diagnostické vyšetrenie v prípadoch suspektnej Hirschprungovej choroby (48). Peroperačné hodnotenie prítomnosti gangliových buniek je však bežne vykonávané pred vykonaním dočasnej kolostómie, a predovšetkým pred definitívnou anastómózou čreva, v súčasnosti často v rámci jednej procedúry s resekciou aganglionárneho úseku a primárnou kolo-rektálnou anastomózou (42,49). Správne rozpoznanie prítomnosti gangliových buniek zabráni zbytočnej resekcii čreva. Na druhej strane, nesprávne rozpoznanie aganglionárneho úseku znamená nutnosť reoperácie a môže mať pre dieťa fatálne dôsledky (predlžovanie malnutrície, sepsa)(41,48,50,51). Dôležité je mať k dispozícii dostatočne veľké (aspoň 5 mm) vzorky celej steny čreva (49), resp. 10 mm dlhé a 3-5 mm hlboké seromusklárne excízie (42). Užitočné môže byť peroperačné histochemické vyšetrenie – dôkaz acetylcholínesterázy v cholínergných nervových vláknach v mukóze aganglionárneho úseku (52). Problematické môže byť rozpoznanie imatúrnych gangliových buniek u veľmi malých detí (do dvoch rokov života) – gangliové bunky sú menšie, majú menej cytoplazmy a menej nápadné jadierka (obr. 7C a D)(48). V definitívnej biopsii je možná detekcia nezrelých gangliových buniek pomocou imunohistochémie (BCL2, MAP-2), ale práce ktoré by zhodnotili prínos peroperačnej imunohistochémie podľa našich vedomosti neexistujú (51,53). Kvantifikácia počtu gangliových buniek (rozpoznanie hypoganglionózy) alebo diagnóza iných foriem tzv. intestinálnych neuronálnych dysplázií nie je v peroperačnom vyšetrení spravidla možná.
7. (A) Proximálny resekčný okraj resekátu adenokarcinómu ezofago-gastrickej junkcie. Slizničný povrch bol makroskopicky aj mikroskopicky „čistý“, v kapilárach lamina propria však boli zachytené zhluky nádorových buniek (v krúžku). (B) Tumor rekta u 25 ročnej ženy. Mikroskopicky boli zachytené mitoticky aktívne, mierne „atypické“ žliazky, vzdialene pripomínajúce kolorektálny adenokarcinóm. Kľúčom k správnej diagnóze endometriózy je rozpoznanie endometriálnej strómy. (C) Hirschprungova choroba: chýbanie gangliových buniek v plexus submucosus a myentericus. (D) Imatúrne gangliové bunky v plexus myentericus. 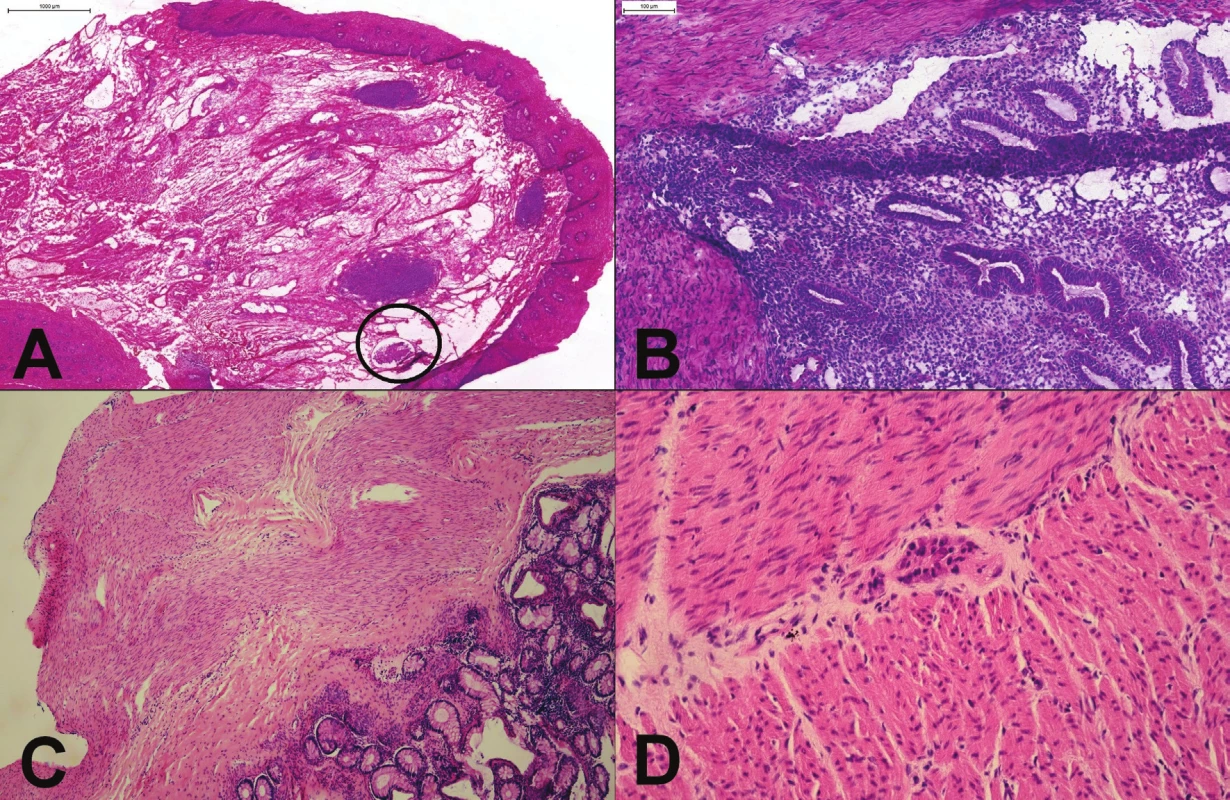
Celkovo je peroperačné vyšetrenie lézií GIT spoľahlivé s diskordantnými diagnózami iba v 3,4-5,8 % prípadov (40,54). Najproblematickejšie je hodnotenie proximálneho resekčného okraja pažeráka a žalúdka v prípadoch difúzneho (signet ring cell) karcinómu (55).
ZÁVER
Peroperačné vyšetrenie resekčných okrajov čreva, alebo potvrdenie metastatického ochorenia patrí medzi ľahšie typy peroperačnej konzultácie. Naopak, diagnostika lézií pankreatobiliárneho traktu patrí medzi najťažšie. V rukách dobre trénovaného patológa, ktorý dobre pozná záludnosti a limity zmrazených rezov, však ide o relatívne spoľahlivé vyšetrenie.
PREHLÁSENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikácií tohto článku nie v konflikte záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlasenie sa týka i všetkých spoluautorov.
Adresa pre korešpondenciu:
MUDr. Marián Švajdler, Ph.D.
Bioptická laboratoř, s.r.o.
Mikulášske nám. 4
326 00 Plzeň, Česká republika
tel.: +420 737220036
e-mail: svajdler@yahoo.com
Sources
1. Lechago J. Frozen section examination of liver, gallbladder, and pancreas. Arch Pathol Lab Med 2005; 129(12): 1610-1618.
2. Pai RK, Wilcox R, Noffsinger A, Hart J. Liver, extrahepatic biliary tree, gallbladder, and pancreas. In: Taxy JB, Husain AN, Montag AG, eds. Biopsy interpretation: the frozen section. Philadelphia, PA, Lippincott Williams & Wilkins; 2014 : 230–270.
3. Campbell F, Verbeke CS. Pathology of the Pancreas. A practical approach. London, Springer-Verlag; 2013.
4. Ducreux M, Cuhna AS, Caramella C, et al.; ESMO Guidelines Committee. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 Suppl 5: v56-68.
5. Pang TC, Wilson O, Argueta MA, et al. Frozen section of the pancreatic neck margin in pancreatoduodenectomy for pancreatic adenocarcinoma is of limited utility. Pathology 2014; 46(3): 188-192.
6. Kooby DA, Lad NL, Squires MH 3rd, et al. Value of intraoperative neck margin analysis during Whipple for pancreatic adenocarcinoma: a multicenter analysis of 1399 patients. Ann Surg 2014; 260(3): 494-501.
7. Petrucciani N, Nigri G, Debs T, et al. Frozen section analysis of the pancreatic margin during pancreaticoduodenectomy for cancer: Does extending the resection to obtain a secondary R0 provide a survival benefit? Results of a systematic review. Pancreatology 2016; 16(6): 1037-1043.
8. Hermanová M, Lenz J. Diferenciální diagnostika chronické pankreatitidy a duktálního adenokarcinomu pankreatu. Cesk Patol 2012; 48(3): 135-140.
9. Theisen BK, DiCianno R, Singhi AD. Pancreatic frozen section nightmares. Diagn Histopathol 2016; 22(6): 236-242.
10. Hyland C, Kheir SM, Kashlan MB. Frozen section diagnosis of pancreatic carcinoma. A prospective study of 64 cases. Am J Surg Pathol 1981; 5(2): 179–191.
11. Cioc AM, Ellison EC, Proca DM, Lucas JG, Frankel WL. Frozen section diagnosis of pancreatic lesions. Arch Pathol Lab Med 2002; 126(10): 1169-1173.
12. Sharma S, Green KB. The pancreatic duct and its arteriovenous relationship: an underutilized aid in the diagnosis and distinction of pancreatic adenocarcinoma from pancreatic intraepithelial neoplasia. A study of 126 pancreatectomy specimens. Am J SurgPathol 2004; 28(5): 613-620.
13. Matthaei H, Hong SM, Mayo SC, et al. Presence of pancreatic intraepithelial neoplasia in the pancreatic transection margin does not in fluence outcome in patients with R0 resected pancreatic cancer. Ann Surg Oncol 2011; 18(12): 3493–3499.
14. Tanaka M, Fernández-Del Castillo C, Kamisawa T, et al. Revisions of international consensus Fukuoka guidelines for the management of IPMN of the pancreas. Pancreatology 2017; 17(5): 738-753.
15. Nelson DW, Blanchard TH, Causey MW, Homann JF, Brown TA. Examining the accuracy and clinical usefulness of intraoperative frozen section analysis in the management of pancreatic lesions. Am J Surg 2013; 205(5): 613-617.
16. Doucas H, Neal CP, O‘Reilly K, Dennison AR, Berry DP. Frozen section diagnosis of pancreatic malignancy: a sensitive diagnostic technique. Pancreatology 2006; 6(3): 210-213.
17. Yantiss RK, ed. Frozen section library: Liver, extrahepatic biliary tree and gallbladder. New York, Springer; 2011.
18. You Z, Ma WJ, Deng YL, et al. Histological examination of frozen sections for patients with acute cholecystitis during cholecystectomy. Hepatobiliary Pancreat Dis Int 2015; 14(3): 300-304.
19. Endo I, House MG, Klimstra DS, et al. Clinical significance of intraoperative bile duct margin assessment for hilar cholangiocarcinoma. Ann Surg Oncol 2008; 15(8): 2104-2112.
20. Ribero D, Amisano M, Lo Tesoriere R, Rosso S, Ferrero A, Capussotti L. Additional resection of an intraoperative margin-positive proximal bile duct improves survival in patients with hilar cholangiocarcinoma. Ann Surg 2011; 254(5): 776-781.
21. Wakai T, Shirai Y, Moroda T, Yokoyama N, Hatakeyama K. Impact of ductal resection margin status on long-term survival in patients undergoing resection for extrahepatic cholangiocarcinoma. Cancer 2005; 103(6): 1210-1216.
22. Igami T, Nagino M, Oda K, et al. Clinicopathologic study of cholangiocarcinoma with superficial spread. Ann Surg 2009; 249(2): 296-302.
23. Matthaei H, Lingohr P, Strässer A, et al. Biliary intraepithelial neoplasia (BilIN) is frequently found in surgical margins of biliary tract cancer resection specimens but has no clinical implications. Virchows Arch 2015; 466(2): 133-141.
24. Aoki T, Tsuchida A, Kasuya K, Inoue K, Saito H, Koyanagi Y. Is frozen section effective for diagnosis of unsuspected gallbladder cancer during laparoscopic cholecystectomy? Surg Endosc 2002; 16(1): 197–200.
25. Deng YL, Cheng NS, Zhang SJ, et al. Xanthogranulomatous cholecystitis mimicking gallbladder carcinoma: An analysis of 42 cases. World J Gastroenterol 2015; 21(44): 12653-12659.
26. Furukawa T, Higuchi R, Yamamoto M. Clinical relevance of frozen diagnosis of ductal margins in surgery of bile duct cancer. J Hepatobiliary Pancreat Sci 2014; 21(7): 459-462.
27. Konishi M, Ochiai A, Ojima H, et al. A new histological classification for intra-operative histological examination of the ductal resection margin in cholangiocarcinoma. Cancer Sci 2009; 100(2): 255-260.
28. Yamaguchi K, Chijiiwa K, Saiki S, Shimizu S, Tsuneyoshi M, Tanaka M. Reliability of frozen section diagnosis of gallbladder tumor for detecting carcinoma and depth of its invasion. J Surg Oncol 1997; 65(2): 132–136.
2.9 Okazaki Y, Horimi T, Kotaka M, Morita S, Takasaki M. Study of the intrahepatic surgical margin of hilar bile duct carcinoma. Hepatogastroenterology 2002; 49(45): 625-627.
30. Yamaguchi K, Shirahane K, Nakamura M, et al. Frozen section and permanent diagnoses of the bile duct margin in gallbladder and bile duct cancer. HPB 2005; 7(2): 135-138.
31. Miedema JR, Hunt HV. Practical issues for frozen section diagnosis in gastrointestinal and liver diseases. J Gastrointestin Liver Dis 2010; 19(2): 181-185.
32. Biesterfeld S, Knapp J, Bittinger F, Götte H, Schramm M, Otto G. Frozen section diagnosis in donor liver biopsies: observer variation of semiquantitative and quantitative steatosis assessment. Virchows Arch 2012; 461(2): 177-1783.
33. Jun MJ, Shim JH, Kim SY, et al. Clinical implications of preoperative and intraoperative liver biopsies for evaluating donor steatosis in living related liver transplantation. Liver Transpl 2014; 20(4): 437-445.
34. Jůza T, Jůzová A, Gajdošová T. Kazuistika: Diagnóza až pod mikroskopem - diseminovaná echinokokóza multilokulárního vzhledu s protoskolexy. Cesk Patol 2016; 52(3): 168-172.
35. Honsová E, Lodererová A, Gottfriedová H. Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie). Cesk Patol 2013; 49(4): 149-152.
36. Busuttil RW, Tanaka K. The utility of marginal donors in liver transplantation. Liver Transpl 2003; 9(7): 651-663.
37. Wang HL, Anderson CD, Glasgow S, et al. Liver. In: Liapis H, Wang HL, eds. Pathology of solid organ transplantation. Springer-Verlag Berlin Heidelberg 2011, 199-314.
38. Rakha E, Ramaiah S, McGregor A. Accuracy of frozen section in the diagnosis of liver mass lesions. J Clin Pathol 2006; 59(4): 352-354.
39. Younes M. Frozen section of the gastrointestinal tract, appendix, and peritoneum. Arch Pathol Lab Med 2005; 129(12): 1558-1564.
40. Chatelain D, Shildknecht H, Trouillet N, Brasseur E, Darrac I, Regimbeau JM. Intraoperative consultation in digestive surgery. A consecutive series of 800 frozen sections. J Visc Surg 2012; 149(2): e134-142.
41. Panarelli NC, Yantiss RK, eds. Frozen section library: Appendix, colon, and anus. New York, Springer; 2010.
42. Kapur RP. Practical pathology and genetics of Hirschsprung‘s disease. Semin Pediatr Surg 2009; 18(4): 212-223.
43. Squires MH 3rd, Kooby DA, Pawlik TM, et al. Utility of the proximal margin frozen section for resection of gastric adenocarcinoma: a 7-institution study of the US Gastric Cancer Collaborative. Ann Surg Oncol 2014; 21(13): 4202-4210.
44. Shen JG, Cheong JH, Hyung WJ, Kim J, Choi SH, Noh SH. Intraoperative frozen section margin evaluation in gastric cancer of the cardia surgery. Hepatogastroenterology 2006; 53(72): 976-978.
45. Dimoulios P, Koutroubakis IE, Tzardi M, Antoniou P, Matalliotakis IM, Kouroumalis EA. A case of sigmoid endometriosis difficult to differentiate from colon cancer. BMC Gastroenterol 2003; 3 : 18.
46. Glimelius B, Tiret E, Cervantes A, Arnold D; ESMO Guidelines Working Group. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24 Suppl 6: vi81-8.
47. Maeda K, Koide Y, Katsuno H. When is local excision appropriate for „early“ rectal cancer? Surg Today 2014; 44(11): 2000-2014.
48. Maia DM. The reliability of frozen-section diagnosis in the pathologic evaluation of Hirschsprung‘s disease. Am J Surg Pathol 2000; 24(12): 1675-1677.
49. Berrebi D, Fouquet V, de Lagausie P, et al. Duhamel operation vs neonatal transanal endorectal pull-through procedure for Hirschsprung disease: which are the changes for pathologists? J Pediatr Surg 2007; 42(4): 688-691.
50. Shayan K, Smith C, Langer JC. Reliability of intraoperative frozen sections in the managementof Hirschsprung‘s disease. J Pediatr Surg 2004; 39(9): 1345-1348.
51. Park SH, Min H, Chi JG, Park KW, Yang HR, Seo JK. Immunohistochemical studies of pediatric intestinal pseudo-obstruction: bcl2, a valuable biomarker to detect immature enteric ganglion cells. Am J Surg Pathol 2005; 29(8): 1017-1024.
52. Agrawal RK, Kakkar N, Vasishta RK, Kumari V, Samujh R, Rao KL. Acetylcholinesterase histochemistry (AChE) -A helpful technique in the diagnosis and in aiding the operative procedures of Hirschsprung disease. Diagn Pathol 2015; 10 : 208.
53. Burtelow MA, Longacre TA. Utility of microtubule associated protein-2 (MAP-2) immunohistochemistry for identification of ganglion cells in paraffin-embedded rectal suction biopsies. Am J Surg Pathol 2009; 33(7): 1025-1030.
54. White VA, Trotter MJ. Intraoperative consultation/final diagnosis correlation: relationship to tissue type and pathologic process. Arch Pathol Lab Med 2008; 132(1): 29-36.
55. Spicer J, Benay C, Lee L, et al. Diagnostic accuracy and utility of intraoperative microscopic margin analysis of gastric and esophageal adenocarcinoma. Ann Surg Oncol 2014; 21(8): 2580-2586.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2018 Issue 2-
All articles in this issue
- Frozen section: history, indications, contraindications and quality assurance
- Frozen section examination of pancreas, gallbladder, extrahepatic biliary tree, liver, and gastrointestinal tract
- Intraoperative diagnosis of the head and neck lesions, thyroid and parathyroid gland, bone and soft tissue, and genitourinary tract
- Esophageal dysplasia and adenocarcinoma: a study with double immunostaining for intestinal and gastric markers
- Results of morphological screening for Lynch syndrome during the period 2013-2016
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Frozen section: history, indications, contraindications and quality assurance
- Frozen section examination of pancreas, gallbladder, extrahepatic biliary tree, liver, and gastrointestinal tract
- Intraoperative diagnosis of the head and neck lesions, thyroid and parathyroid gland, bone and soft tissue, and genitourinary tract
- Results of morphological screening for Lynch syndrome during the period 2013-2016
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

