-
Medical journals
- Career
Myxoidní nádory měkkých tkání
: Karel Veselý
: AeskuLab patologie, k. s. - Laboratoř Brno, Brno.
: Čes.-slov. Patol., 53, 2017, No. 2, p. 71-80
: Reviews Article
Myxoidní nádory měkkých tkání představují široké spektrum lézí s různým biologickým chováním, od zcela benigních po vysoce agresivní malignity. Jejich společným jmenovatelem je přítomnost bohaté myxoidní matrix, překrývající se histopatologické znaky a imunohistochemické nálezy, a z toho vyplývající diagnostické problémy. Tento přehledový článek se pokouší o co nejúplnější výčet myxoidních lézí měkkých tkání, s krátkou charakteristikou makroskopických a mikroskopických vlastností, relevantními imunohistochemickými a molekulárně biologickými nálezy a s uvedením diferenciální diagnózy.
Klíčová slova:
myxoidní nádory – měkké tkáně – myxom – sarkom
Existuje jistě mnoho (nebo nekonečně mnoho?) mikroskopických obrazů, které dokáží v člověku vyvolat přinejmenším rozporuplné pocity. Domnívám se, že nebudu hovořit jenom za sebe, pokud napíšu, že takový smíšený pocit spolehlivě vyvolá léze, která je převážně málo buněčná, ale s oblastmi vyšší celularity, s buňkami s nezřetelnou cytoplazmou, drobnými jádry, kdy ale místy pozorovatel nabývá dojmu, že jádra nejsou až tak uniformní, a které jsou uložené v hojné hlenovité matrix, tedy mezibuněčné hmotě, která se prakticky nebarví, nebo se barví jen velmi slabě hematoxylinem v H&E.
Přítomnost myxoidní matrix je nespecifickým nálezem, který můžeme pozorovat v reaktivních lézích, v benigních tumorech i sarkomech měkkých tkání (1), tedy v afekcích různého biologického chování. Termíny hlen (mucin) či myxoidní materiál jsou užívány synonymicky pro označení mezibuněčné hmoty bohaté na polysacharidové glykosaminoglykany (GAG), dle starší nomenklatury kyselé mukopolysacharidy, sulfátované (zejména chondroitin sulfát, dále keratan sulfát a dermatansulfát) nebo nesulfátované (hyaluronová kyselina); a na glykoproteiny. V histologických řezech se GAG a glykoproteiny barví alciánovou modří (obr. 1) a Haleho koloidálním železem, glykoproteiny jsou charakterizovány navíc purpurovou tinkcí v barvení PAS. V barvení hematoxylin-eozinem (HE) jsou nesulfátované GAG pouze lehce bazofilní a nemusí být patrné, zatímco sulfátované GAG a glykoproteiny jsou výrazněji bazofilní a snadněji rozpoznatelné. Mucinózní substance mohou být někdy v HE řezech i eozinofilní. Z praktického pohledu jsou mezenchymální hleny PAS negativní nebo velmi slabě PAS pozitivní, ale barví se alciánovou modří a Haleho koloidálním železem. Inkubace tkání s hyaluronovou kyselinou vede k degradaci nesulfátovaných GAG a ruší jejich pozitivitu v barvení alciánovou modří a Haleho koloidálním železem, což ovšem neplatí pro sulfátované GAG, které komponují mezibuněčnou hmotu chrupavky. Epiteliální hleny jsou pozitivní v metodě PAS, alciánové modři i Haleho koloidálním železe. Ošetření epiteliálních hlenů s hyaluronidázou neruší jejich pozitivní reakci (2). Složení myxoidní extracelulární matrix je v myxoidních nádorech heterogenní v závislosti na histotypu nádoru a na histologickém gradu (3).
1. Společným znakem myxoidních nádorů měkkých tkání je hojné množství mezibuněčné hmoty, která se barví modře při speciálním barvení alciánovou modří. Intramuskulární myxom, původní zvětšení 200x. 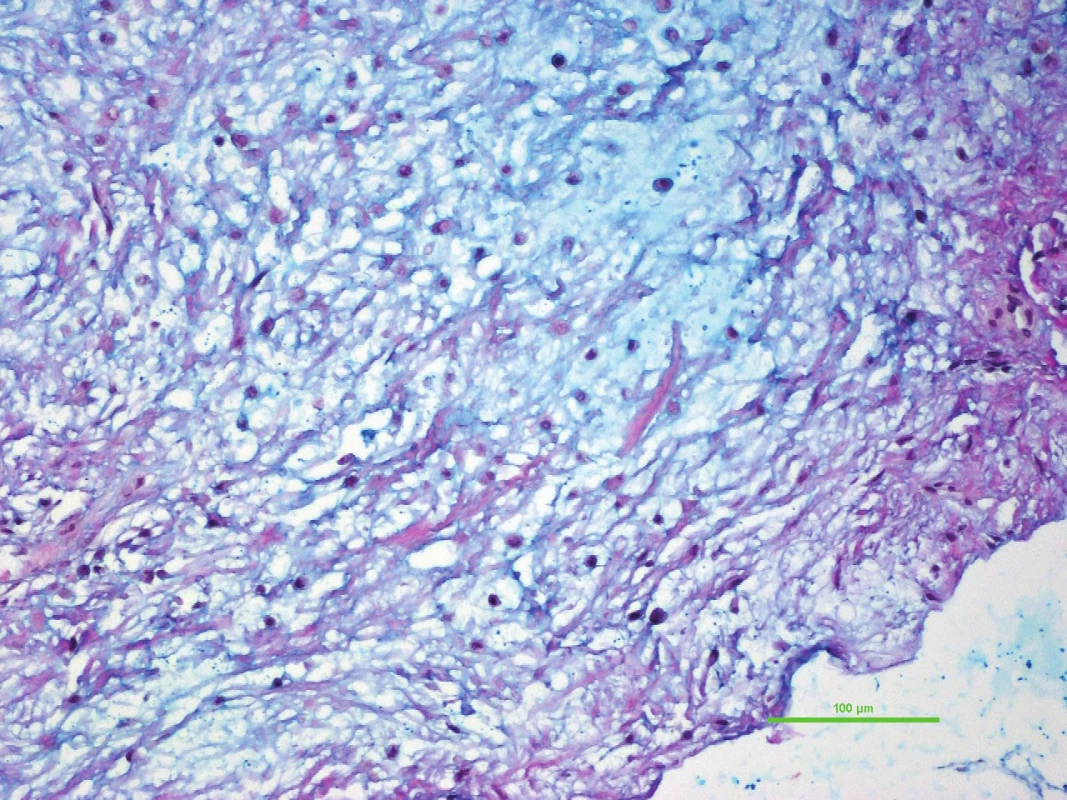
Makroskopicky jsou myxoidní léze charakterizovány hlenovitým či gelatinózním vzhledem a mikroskopicky hojnou mezibuněčnou hmotou. Pro korektní klasifikaci myxoidních lézí měkkých tkání je základem morfologický obraz v kvalitních H&E řezech, další informace mohou dodat doplňující vyšetření imunohistochemické a molekulárně biologické. Velmi žádoucí je znalost klinického kontextu a výsledků vyšetření zobrazovacími metodami.
Diferenciální diagnóza myxoidních nádorů měkkých tkání je rozsáhlá pro překrývající se morfologické rysy mnoha nádorů (4), přičemž mnoho z myxoidních nádorů nemá charakteristický imunofenotyp, což generuje diagnostické problémy (5). Tumory měkkých tkání mohou být intrinsicky myxoidní, a dále existují myxoidní varianty nádorů, které postrádají typické znaky nemyxoidních variet, což vede k potížím při jejich rozpoznávání (6). Myxoidní léze tak mohou být rozděleny na: a) běžné myxomy měkkých tkání; b) myxomy lokalizované mimo měkké tkáně; c) myxoidní nádory nebo nádorovité léze, neoznačované jako myxomy per se; d) myxoidní lipomatózní léze; d) tumory měkkých tkání, které jsou oportunně výrazně myxoidní; e) nádory měkkých tkání, u kterých mohou být patrná myxoidní ložiska; a konečně f) nenádorové myxoidní léze měkkých tkání (2).
MYXOM
Myxomy jsou charakterizovány svojí hypocelularitou, i když obraz může být komplikován zvýšenou buněčností u celulární varianty intramuskulárního myxomu (1). Většinou mají nádorový původ, u juxtaartikulárního myxomu je však zvažována reaktivní povaha.
Intramuskulární myxom
Intramuskulární myxom (IM) postihuje obvykle pacienty ve středním věku, objevuje se ve svalech proximálních části končetin a končetinových pletenců. Obvykle je sporadický, ale může být součástí syndomů (Mazabraudův syndrom s myxomy a fibrózní dysplazií; McCuneův-Albrightův syndrom s myxomy, fibrózní dysplazií, kožními pigmentacemi a endokrinními abnormalitami). U sporadických i syndromických IM byla prokázána mutace genu GNAS (1).
Makroskopicky mají IM šedou barvu, na řezu myxoidní a dobře ohraničený vzhled, což kontrastuje s mikroskopickým obrazem hypocelulární léze infiltrující okolní kosterní svalovinu, s disperzními drobnými blandními vřetenitými, stelárními, oválnými či okrouhlými buňkami s denzními jádry a málo zřetelným lemem růžové, někdy vakuolizované cytoplazmy, bez organizované vaskulatury, někdy s úseky kolagenizovaného stromatu, s hojnou myxoidní matrix, občas s drobnými cystoidními prostory (obr. 1 a 2). Histiocyty mohou být tu a tam četné a imitovat lipoblasty. V periferii mohou být reziduální degenerovaná vlákna kosterního svalu (2). Mitotické figury a nekrózy nejsou přítomné. Subtypem je celulární IM, s minoritními oblastmi klasického hypocelulárního myxomu, kdy diagnóza vyžaduje nepřítomnost jaderného plemorfismu a hyperchromazie, nekrózy a četnějších mitotických figur. Fibrotizace je obvykle minimální, ale v některých případech jsou přítomny pruhy a trabekuly kolagenního stromatu, separující IM do lobulů.
2. Intramuskulární myxom je charakterizován hypocelularitou a blandní cytologií. 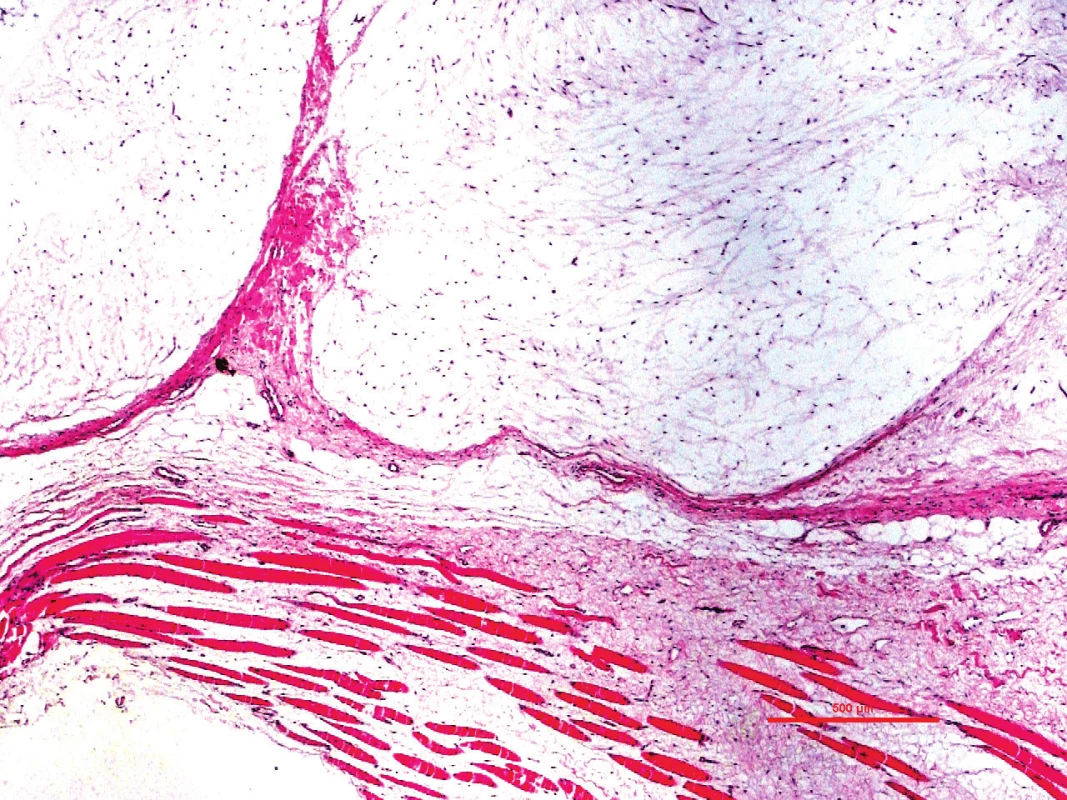
Na snímku dole patrny svazky kosterního svalu. Barveno hematoxylin-eozinem, původní zvětšení 40x Diferenciálně diagnosticky je nutné odlišit juxta-artikulární myxom, který může být histomorfologicky neodlišitelný, zvláště pokud invaduje kosterní sval. Nejspolehlivějším vodítkem je lokalizace, a tendence být méně homogenní, s výraznější fibroblastickou a cystoidní komponentou u juxta-artikulárního myxomu. Myxofibrosarkom grade 1 je prakticky vždy subkutánní, v hluboké lokalizaci jsou obvykle nepřehlédnutelné cytonukleární atypie. Low-grade fibromyxoidní sarkom je charakterizován kolagenizovanými regiony, střídající se s myxoidními noduly. Myxoidní liposarkom má arborizující kapilární sít a je buněčnější než IM. Imunohistochemické metody nejsou v diferenciální diagnóze příliš užitečné, IM bývá fokálně CD34 a SMA +, stejně tak i myxofibrosarkom. Myxoidní liposarkom je CD34-, může být S100+.
Juxta-artikulární myxom
Juxta-artikulární myxom (JAM) je převážně solidní myxoidní léze lokalizovaná v blízkosti kloubů, nejčastěji v oblasti kolene, méně ramene, lokte, hlezna a kyčelního kloubu u pacientů v širokém věkovém rozmezí (2). Histologicky připomíná IM, ale postihuje zejména šlachy, ligamenta, kloubní pouzdro, svaly a přilehlé podkoží. Oproti IM má tendenci k recidivám, a i přes značnou mikroskopickou podobnost má variabilnější histomorfologii, s častějšími cystoidními oblastmi, nápadnější fokální vaskularizací, periferní fibroblastickou proliferací, a příležitostně s kolekcemi mírně atypicky vyhlížejících a dvoujaderných histiocytoidních buněk. Stěna cystoidních prostor je lemována úzkou vrstvou fibrinu nebo denzní fibrózní tkáně. JAM je špatně ohraničený a infiltruje okolní měkké tkáně. Mohou být oblasti zvýšené buněčnosti, mitózy však chybí nebo jsou vzácné. Častá jsou ložiska hemoragií, depozit hemosiderinu, zánětlivých buněk, organizujícího se fibrinu a fibrózy. V diferenciální diagnóze je zejména IM, myxofibrosarkom, low-grade fibromyxoidní sarkom a myxoidní liposarkom, se stejnými odlišujícími rysy, které byly popsány u IM.
Superficiální angiomyxom
Supeficiální angiomyxom (SAM), též známý jako kutánní myxom, postihuje zejména trup a hlavu a krk obvykle pacientů středního věku (ve sporadické formě), syndromické případy se objevují u mladších jedinců, ale může se objevit v jakémkoli věku. Morfologicky je podobný intramuskulárnímu myxomu, objevuje se v dermis nebo v podkoží jako multinodulární masa, relativně dobře ohraničená či špatně ohraničená, velikosti 0,5 – 15 cm (2). Může být patrná cystoidní transformace. Mikroskopicky většina postihuje dermis i podkoží, okraje jsou obvykle špatně ohraničené proti okolním tkáním. V oblasti tváře může být postižení příčně pruhovaného svalu v důsledku jeho superficiální lokalizace. Hojná myxoidní matrix někdy s tvorbou mikrocystoidních prostor a nepravidelných štěrbin je disperzně kolonizována drobnými buňkami, lehce pleomorfními, někdy vícejadernými, stelárními a vřetenitými, často s intranukleárními cytoplazmatickými inkluzemi, nezřetelnou cytoplazmou, a vyšším počtem krevních cév od malých kapilár po tenkostěnné angiektázie. Může být nevýrazná perivaskulární hyalinizace, fibrinové tromby, perivaskulární lymfocyty, extravazáty erytrocytů, sidereofágy a disperzní řídké zánětlivé buňky. Disperzní perivaskulární neutrofily při absenci nekrózy nebo ulcerace jsou obvyklé, a jejich přítomnost je užitečným diagnostickým vodítkem (2). Naneštěstí nejsou přítomny vždy. Ve čtvrtině případů jsou v lézi patrné zachycené adnexální kutánní elementy, příležitostně s tvorbou skvamózních cyst vyplněných keratinem, nebo tvorbou trámců skvamózních či bazaloidních epitelií. V myxoidní matrix jsou často disperzní akutní a/nebo chronické zánětlivé buňky. Imunohistochemicky je obvyklá CD34 pozitivita, příležitostná pozitivita hladkosvalového aktinu, a negativita nebo pouze slabá reaktivita S-100 proteinu. Diagnóza SAM, zvláště u mnohočetných lézí či při lokalizaci v prsu nebo zevním uchu, může vést k úvahám o Carneyho komplexu (5). Pacienti s autosomálně dominantně dědičným Carneyho komplexem trpí výskytem kutánních a kardiálních myxomů, kožními pigmentacemi, a různými endokrinními abnormalitami.
Diferenciální diagnóza zahrnuje digitální myxoidní cystu, superficiální akrální fibromyxom, myxofibrosarkom, mladší pacienty postihuje myxoidní neurothekeom v oblasti hlavy a krku nebo horních končetinách. Součástí diferenciální diagnózy kutánního myxomu je dále myxom nervové pochvy a low-grade myxofibrosarkom s buněčnými atypiemi a myxoidní liposarkom, který je obvykle v hluboké lokalizaci. Přítomnost epiteliální komponenty může vést k úvahám o kutánním adnexálním tumoru (2). U genitálních případů SAM je v diferenciální diagnóze rovněž agresivní angiomyxom. Zvláště problematickou diferenciální diagnózou je fokální dermální mucinóza, která je méně ohraničená, má méně prominentní vaskulaturu a postrádá neutrofily.
Superficiální akrální fibromyxom
Vzácný superficiální akrální fibromyxom (SAFM), známý rovněž jako digitální fibromyxom, se vyskytuje v charakteristických lokalizacích, na dlaních, ploskách a prstech periunguálně v širokém věkovém rozmezí (4–86 let) (6,7). Manifestuje se jako uzlovitý pomalu rostoucí nádor velikosti od 0,5 – 5 cm, dobře nebo špatně ohraničený, neopouzdřený, s postižením celé dermis a s možným šířením do subkutis. Ve třetině případů je postižení kosti, obvykle ve formě aroze, vzácně v podobě osteolytická léze. Některé případy jsou vysoce myxoidní, jiné mají hojnější kolagen (5). Mikroskopicky je tumor středně buněčný, s vřetenitou a hvězdicovitou cytomorfologií, s myxoidní a/nebo kolagenizovanou matrix s akcentovanou mikrovaskulaturou. Nádorové buňky jsou uspořádané necharakteristicky, storiformně a v krátkých volných svazcích. Nádorové buňky jsou bez atypií, středně výrazné atypie jsou vzácně. Přibližně u poloviny případů byly pozorovány mnohojaderné stromální buňky. Ve většině případů jsou alternující fibrózní a myxoidní oblasti, přičemž jednotlivé komponenty mohou převládat. Okraje tumoru jsou expanzivní nebo infiltrativní. Kryjící epidermis může být hyperkeratotická. Mohou být prominentní stromální mastocyty. Imunohistochemicky jsou nádorové buňky CD34 a CD99 pozitivní, variabilní je exprese EMA, hladkosvalového aktinu, desminu, většina tumorů exprimuje CD10. Nebyla zaznamenána pozitivita MUC4, S-100, GFAP, keratinů nebo HMB45.
Diferenciální diagnóza SAFM zahrnuje myxoidní neurofibrom (je S-100 pozitivní), fibrom šlachové pochvy (nemá myxoidní matrix, má štěrbinovité vaskulární prostory), obrovskobuněčný nádor šlachové pochvy, který je charakterizován typický obrovskými mnohojadernými buňkami, pěnitými makrofágy, depozity hemosiderinu, nemá myxoidní stroma. Odlišení superficiálního angiomyxomu pomůže především odlišná anatomická lokalizace. Dermatofibrosarcoma protuberans může mít myxoidní matrix, a je CD34 pozitivní, nicméně obvykle obsahuje i typické oblasti s perfektní storiformitou, je infiltrativnější, a lokalizace na rukou a nohou je neobvyklá. Myxoinflamatorní fibroblastický sarkom je popsán níže. Superficiální low-grade fibromyxoidní sarkom velmi vzácně postihuje prsty, přechody mezi myxoidními a kolagenizovanými partiemi jsou více abruptní, a je MUC4 pozitivní. Perineuriom se SAFM sdílí CD34 a EMA pozitivitu, odlišuje se vírovitou lamelární či storiformní architekturou růstu.
Agresivní angiomyxom
Agresivní angiomyxom (AAM) je vzácný tumor postihující převážně měkké tkáně pánve a perineum, většinou dospělých ženského pohlaví (10). Klinické chování je lokálně agresivní, metastázy byly popsány výjimečně. Nádor se manifestuje jako perineální nebo vulvární masa, a často je klinicky zaměněn s běžnějšími chorobami, jako je cysta Bartholiniho žlázy, vaginální cysta, absces, leiomyom, lipom, fibroepitelový polyp, a inguinální nebo perineální hernie. Skutečný rozsah AAM je často iniciálně podhodnocen z důvodu toho, že viditelná část tumoru představuje pouze menší frakci extenzivnějšího postižení hlubokých měkkých tkání pánve a retroperitonea. AAM by měl být rovněž uvažován v diferenciální diagnóze tumorů v analogických lokalizacích u mužů. AAM byl popsán ve skrotu, semenném provazci a perineu.
Makroskopicky je AAM neopouzdřený, špatně ohraničený, a může přecházet v okolní měkkou tkáň. Velikosti nádoru je vysoce variabilní, od 1 do 60 cm, a na řezu má gelatinózní kvalitu. Mikroskopicky je AAM málo až středně buněčný, s bledým až eozinofilním stromatem, s četnými náhodně distribuovanými krevními cévami, které kolísají ve velikosti od tenkostěnných kapilár, přes venuly po větší muskulární arterie, někdy s perivaskulární kondenzací nádorových buněk. Stroma je myxoidní, s jemnými vlákny kolagenu, s perivaskulárními charakteristickými víry a krátkými svazky vřetenitých hladkosvalových buněk s eozinofilní cytoplazmou, bez návaznosti na cévní stěnu, a s extravazáty erytrocytů. Nápadným znakem mohou být perivaskulární prstence kondenzovaného kolagenu. Běžná je infiltrace měkkých tkání, se zachycením původní svalové a tukové tkáně, a nervových svazků. Cytologicky jsou nádorové buňky blandní, vřetenité, ovoidní nebo stelární, s nezřetelnými cytoplazmatickými membránami, pravidelně dispergovaným chromatinem, s žádnými nebo minimálními atypiemi. Mitotické figury jsou vzácné, nejsou atypické. Vzácně může AAM infiltrovat močových měchýř, tlusté střevo, nebo dokonce kost.
Imunohistochemicky je difúzní pozitivita vimentinu a desminu. Hladkosvalový aktin koloruje myoidní svazky a může být pozitivní v izolovaných nádorových buňkách. Zřejmě nejcharakterističtějším znakem je pozitivita estrogenového a progesteronového receptoru. Nádor je S-100 protein negativní. Geneticky je v AAM přítomna přestavba genu HMGA2, která se vyskytuje u různých mezenchymálních nádorů, jako jsou lipomy, liposarkomy, leiomyomy a plicní hamartomy. Diferenciální diagnóza AAM zahrnuje angiomyofibroblastom, superficiální angiomyxom, fibroepitelové stromální polypy, myxoidní lipomatózní tumory, a myxoidní leiomyom. Angiomyofibroblastom (AMF) má superficiální lokalizaci, je dobře ohraničený, a obvykle menší než 5 cm. Histologicky je AMF charakterizován hypocelulárními a hypercelulárními regiony s cytologicky blandními buňkami, které jsou objemnější a více epiteloidní než buňky AAM, a často se kondenzují kolem cév. Mnohojaderné obrovské buňky s lineárně uspořádanými jádry jsou dalším klíčovým histologickým rysem. Superficiální angiomyxom vyrůstá v kůži nebo podkoží, obvykle v extragenitálních lokalizacích, a má typickou lobulární nebo multinodulární architekturu. Histologicky postrádá cévy většího kalibru, které jsou přítomné u AAM, a imunohistochemicky obvykle postrádá estrogenové a progesteronové receptory. Fibroepitelové stromální polypy (FSP) jsou běžné léze vulvovaginálního regionu, které mohou být mnohočetné a jsou spojeny s těhotenstvím nebo administrací exogenních hormonů. Stroma je prosáklé nebo myxoidní, s různě velkými cévami, a mnohojadernými stromálními buňkami. Příležitostně mohou mít FSP sarkomatózní rysy s hypercelularitou, cytologickými atypiemi a se zvýšenou mitotickou aktivitou s přítomností atypických mitotických figur, a jsou označovány jako pseudosarkomatózní FSP. Navzdory alarmující morfologii jde o benigní léze. V důsledku přítomnosti nativní tukové tkáně v AAM v diferenciální diagnóze nelze opominout myxolipom a myxoidní liposarkom.
Myxom nervové pochvy
Objevuje se u pacientů v širokém věkovém rozmezí, s vrcholem incidence ve 4. dekádě, rovnoměrně u obou pohlaví, se silnou predilekcí končetin, zvláště prstů a oblasti kolene (8). Pouze něco málo přes 10 % případů postihuje trup a oblast hlavy a krku. Makroskopicky je myxom nervové pochvy (MNP) superficiální tumor kůže či podkoží, multinodulární, velikosti 0,5 – 5 cm. Mikroskopicky při přehledném zvětšení je patrná multinodulární architektura s fibrózními septy, které separují jednotlivé uzly, které jsou kolonizovány nádorovou populací se znaky Schwannových buněk, které jsou vřetenité, epiteloidní a někdy stelární, příležitostně s prstencovitou morfologií, v trámcích, hnízdech a synciciálních agregátech, a jsou uložené v hojné myxoidní matrix. Místy jsou nádorové buňky mírně atypické, mohou být mnohojaderné buňky, mitotická aktivita je nízká. Imunohistochemicky je MNP silně S-100 pozitivní, GFAP pozitivní, obecně slabě CD57 pozitivní, v periferii uzlů mohou být patrné EMA pozitivní perineurální buňky a CD34 pozitivní fibroblasty.
V literatuře bývá MNP zaměňován se subtypem neurothekeomu (myxoidní hypocelulární varianta), ale neurothekeom, pod kterým byl dříve MNP veden, je konzistentně S-100 a GFAP negativní a představuje odlišnou jednotku. V diferenciální diagnóze MNP je již zmíněný, superficiální angiomyxom, vzácně perineuriom, superficiální akrální fibromyxom a myxofibrosarkom. Všechny jednotky v diferenciální diagnóze jsou S-100 negativní.
Neurothekeom
Oproti myxomu nervové pochvy postihuje převážně děti a mladé dospělé v jiných lokalizacích, zejména v oblasti hlavy a krku, ramen a proximálních částí paží, jako dermální papula nebo uzel (9). Mikroskopicky je neurothekeom tvořen buňkami vřetenitými nebo epiteloidními, uspořádanými v charakteristických vírech, které jsou separované fibrózními pruhy. Nejsou vzácné obrovské buňky. Problémem je morfologická variabilita, nádor může vykazovat jiné typy růstu, kromě celulárních variant existují i hypocelulární myxoidní subtypy, morfologicky prakticky neodlišitelné od myxomu nervové pochvy. Může rovněž imitovat plexiformní fibrohistiocytární tumor a uvažuje se o možném vztahu obou nádorů. Imunohistochemicky je neurothekeom S-100 a GFAP negativní, pozitivita CD10, NKI/C3 a S100A6 podporují diagnózu.
VŘETENOBUNĚČNÝ/PLEOMORFNÍ LIPOM
Klasickou lokalizací je oblast šíje u mužů středního a vyššího věku, kde se manifestuje jako podkožní nádor. Byly však popsány i případy s multicentrickým výskytem a dokonce familiární formy (6). Vřetenobuněčný/pleomorfní lipom (SC/PL) se může objevit i v překvapujících místech, jako jsou končetiny, tvář, nebo dokonce dutina ústní. Může rovněž vzniknout i v dermis. Mikroskopicky je SC/PL tvořen drobnými vřetenitými buňkami v krátkých svazech, maturovanými adipocyty a charakteristickými zprohýbanými svazky „drátovitého“ či „gelatinózního“ kolagenu v různých proporcích v kolagenizovaném či myxoidním stromatu. Někdy myxoidní stroma převládá, s malou komponentou maturované tukové tkáně, kdy buňky mohou být náhodně uspořádané bez tvorby charakteristických krátkých svazků. Přítomnost charakteristických svazků kolagenu je však konstantním znakem. Mitotické figury jsou vzácné, značnou opatrnost však vyžadují případy, u kterých se vyskytují abnormální mitotické figury či buňky podobné lipoblastům. SC/PL je podkladem i mnoha „myxolipomů“, u kterých se předpokládá degenerativní původ myxoidních změn, ale při adekvátním vyšetření se u mnoha těchto lézí odhalí vřetenobuněčná komponenta a „gelatinózní“ kolagen (5). Diagnostické problémy mohou vyvolat případy s minimální adipocytární komponentou. Imunohistochemicky je SC/PL prakticky vždy CD34 pozitivní, S100 demonstruje maturované adipocyty, ale vřetenité nebo „květinové“ buňky jsou negativní. Ve výčtu diferenciální diagnózy SC/PL je superficiální angiomyxom, myxoidní dermatofibrosarcoma protuberans, a myxofibrosarkom. Při odlišení napomáhá zejména typická lokalizace SC/PL, a konzistentní přítomnost gelatinózního kolagenu. V případech SC/PL s nepravidelnými mitotickými figurami a buňkami podobnými lipoblastům nutno zvážit možnost pleomorfního liposarkomu, který má nicméně výraznější atypie, pleomorfní lipoblasty a postrádá gelatinózní kolagen.
LOW-GRADE MYXOFIBROSARKOM
Myxofibrosarkom (MFS) je nejčastější sarkom starších pacientů, postihující obvykle podkoží končetin a oblasti končetinových pletenců. Je vzácný na trupu, hlavě a krku a rukou a nohou. Stejně jako MLS, nevyskytuje se v retroperitoneu jako primární nádor. Obvykle má superficiální lokalizaci v dermis nebo podkoží, i když někdy se šíří do hlubokých měkkých tkání. Tumor je vysoce infiltrativní, často se šíří podél fascií, což je příčinou obtíží při pokusu o chirurgické radikální odstranění.
Mikroskopicky je morfologické spektrum MFS široké. Obvykle je klíčovým znakem multinodulární růst s myxoidními uzly a charakteristickou arkádovitou vaskulaturou. Buňky MFS jsou fusiformní s eozinofilní neostře ohraničenou cytoplazmou. Jádra mohou být značně pleomorfní, s hrubě granulárním hyperchromním chromatinem, což je klíčový znak při odlišení od myxomu nebo myxoidního liposarkomu. Navíc nejsou vzácné u MFS polylobulizovaná jádra nádorových buněk či vícejaderné buňky. Běžné jsou nádorové buňky s cytoplazmatickou vakuolizací, obsahující hlenový materiál (pseudolipoblasty). Nádorové buňky jsou náhodně uspořádané v myxoidní matrix, s přítomností elongovaných, někdy arkádovitých kapilár, často s perivaskulární kondenzací nádorových buněk. Tumor je vysoce infiltrativní, což kontrastuje s makroskopickým ošidným dojmem ohraničenosti. Low-grade MFS je hypocelulární, cytonukleární atypie mohou být diskrétní, počet mitotických figur je nízký (obr. 3 a 4). Léze vyššího grade jsou charakterizovány oblastmi solidní proliferace, nekróz, hemoragií, vyšším stupněm buněčných atypií, a četnými mitotickými figurami. V některých případech je prominentní zánětlivý infiltrát plazmocytů, lymfocytů, neutrofilů nebo eozinofilů. Existuje epiteloidní varianta MFS s buňkami s okrouhlými jádry s nápadnými jadérky a objemnou eozinofilní cytoplazmou.
3. Myxoidní maligní nádor měkkých tkání může mít ošidně nevinný vzhled při přehledném zvětšení. Myxofibrosarkom grade 1, barveno hematoxylin-eozinem. 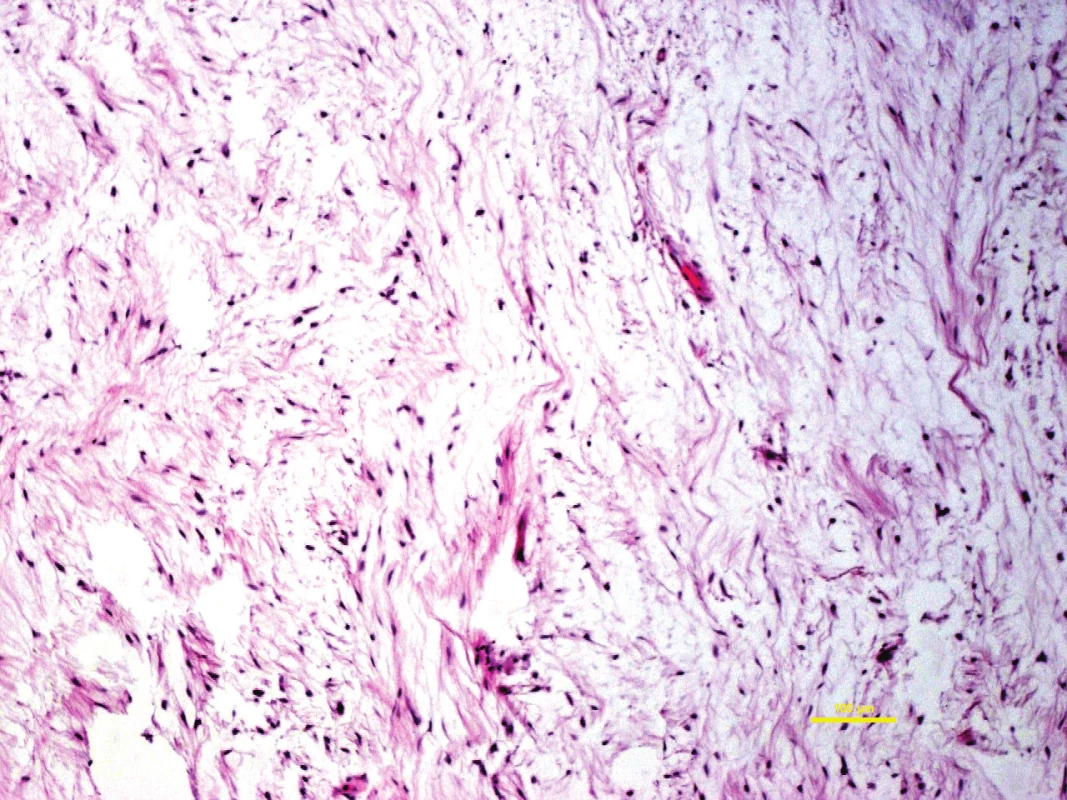
Původní zvětšení 100x 4. Tentýž tumor jako na obr. 3. Zvětšení 400x odhaluje mírné nukleární atypie a nepravidelnou mitotickou figuru. 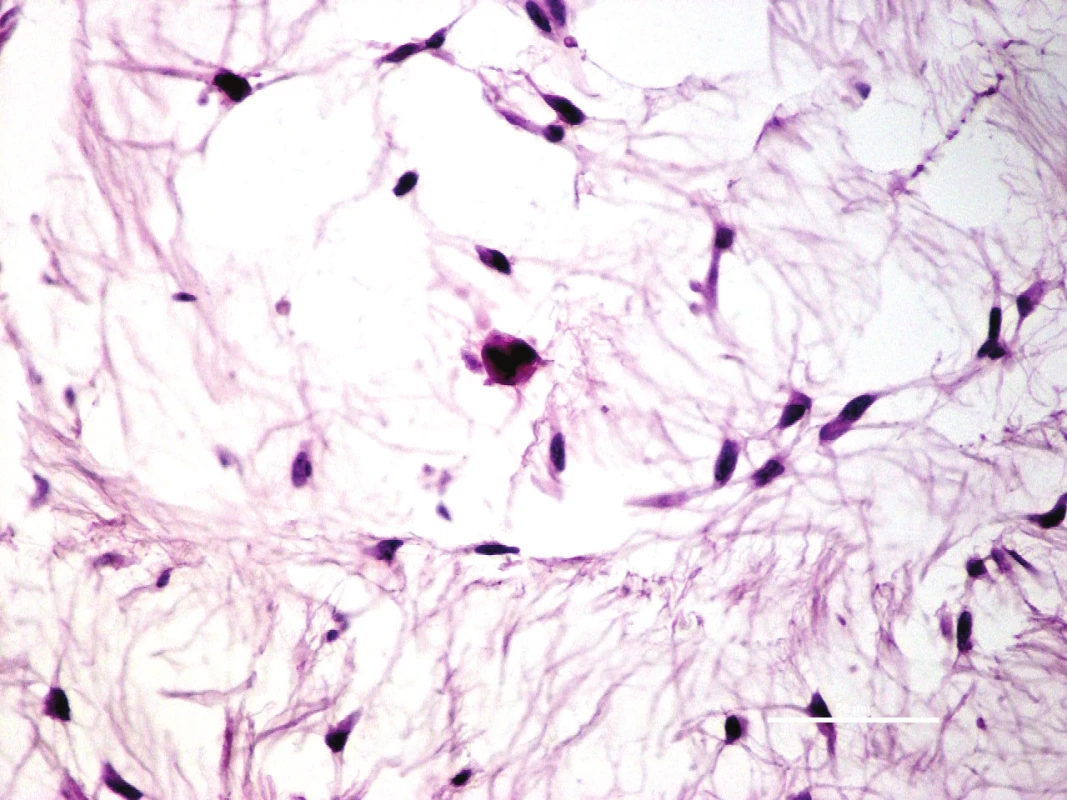
Barveno hematoxylin-eozinem. Imunohistochemické a molekulárně biologické nálezy jsou u MFS necharakteristické. MFS bývá fokálně pozitivní při užití protilátky proti hladkosvalovému aktinu a část případů je CD34 pozitivní. Vzácně byla popsána pozitivita cytokeratinů a p63 (6).
Diferenciální diagnóza low-grade myxofibrosarkomu je široká, zahrnuje myxoidní liposarkom, obvyklý v hluboké lokalizaci, u kterého chybí plemorfismus a perivaskulární kondenzace. Ke konfúzi může přispět přítomnost pseudolipoblastů u MFS. Superficiální angiomyxom a myxoidní vřetenobuněčný lipom postrádají arkádovitou vaskulaturu a atypické buňky. Myxoidní varianta dermatofibrosarcoma protuberans má pravidelněji řazené buňky, které jsou extrémně uniformní a imunohistochemicky silně CD34 pozitivní. U high-grade MFS je v diferenciální diagnóze zejména dediferencovaný liposarkom, jehož diagnóza je stanovena, pokud má tumor komponentu dobře diferencovaného liposarkomu nebo při lokalizaci v retroperitoneu. U končetinových případů při rozlišení pomůže imunohistochemie s CDK4, mdm-2 a p16, které jsou u high-grade MFS negativní. Low-grade fibromyxoidní sarkom je obvyklejší u mladších, má zřetelnější fibrózní a myxoidní regiony, a exprimuje MUC4.
MYXOIDNÍ LIPOSARKOM
Myxoidní liposarkom (MLS) představuje až 10 % všech sarkomů měkkých tkání dospělých. Makroskopicky vytváří nebolestivou masu nejčastěji v oblasti stehen a hýždí u mladších dospělých, je velmi vzácný u dětí a adolescentů. Má tendenci metastázovat do neobvyklých lokalizací, jako je retroperitoneum (nevyskytuje se zde jako primární nádor!) nebo axila (11). Mikroskopicky jde o lobulizovaný nádor s buněčností akcentovanou na periferii lobulů. Množství extracelulárního hlenu může být tak značné, že vytváří jezírka až s mikrocystickým či pseudoacinárním vzhledem (někdy přirovnáván ke vzhledu lymfangiomu). Vlastní buňky MLS jsou drobné, uniformní, okrouhlé až oválné či krátce vřetenité, uložené v myxoidním stromatu, typicky s bohatou kapilární arborizující sítí, přirovnávanou k pletivu pro drůbež (obr. 5). U low-grade myxoidního liposarkomu by měl chybět plemorfismus jader, obrovské buňky a prominentní vřetenobuněčná morfologie. Při progresi MLS v high-grade lézi se velikost buněk mírně zvětšuje, a výrazně se zvyšuje jejich množství, s obrazem hypercelulárního kulatobuněčného nádoru. Přesto by měla být buněčná populace uniformní. Pokud kulatobuněčná komponenta tvoří více než 5 % nádoru, tumor již není low-grade (31). Molekulárně je MLS charakterizován rekurentní translokací t(12;16) s fúzí FUS-DDIT3 (DDIT3 je známý rovněž jako CHOP), která je nacházena u 90 – 95 % případů MLS. Variantní je t(12;22) s fúzí EWSR1 a DDIT3. Obě translokace je možné využít jako senzitivní a specifický diagnostický nástroj např. detekcí pomocí fluorescenční in situ hybridizace (FISH) (4).
5. Klasickým zástupcem maligních myxoidních nádorů měkkých tkání je myxoidní liposarkom, obvykle snadno rozpoznatelný pro svoji charakteristickou plexiformní kapilární síť. 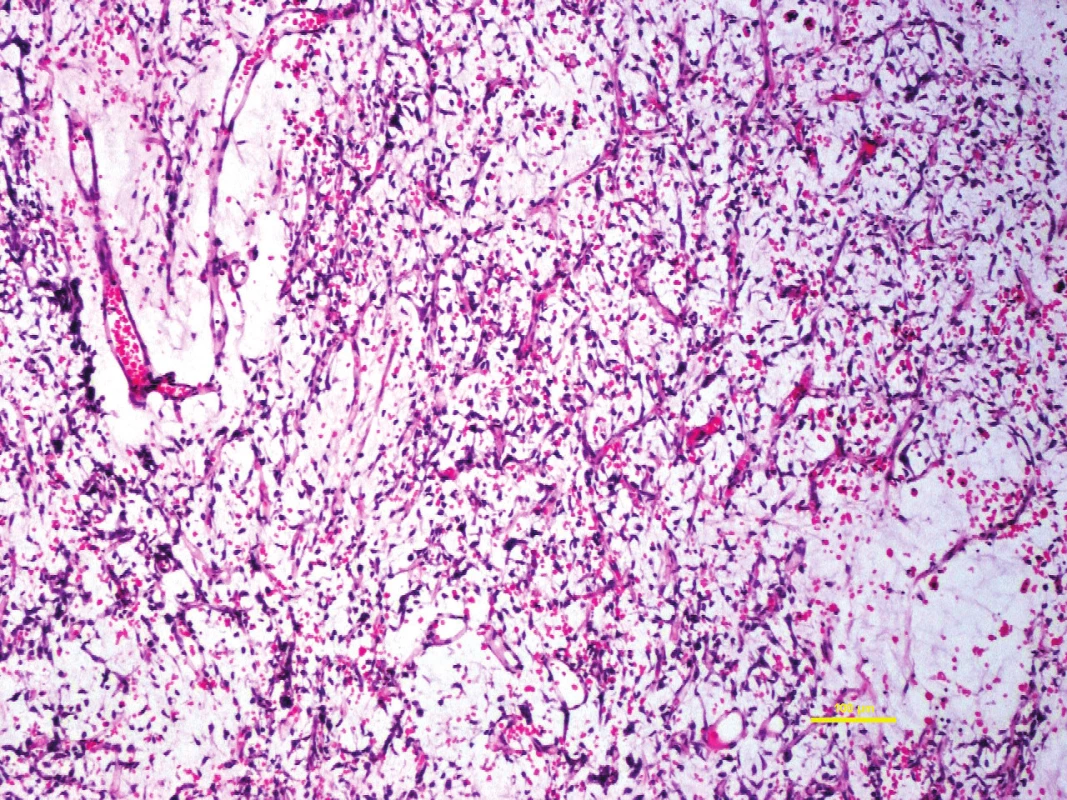
Barveno hematoxylin-eozinem, původní zvětšení 100x. Diferenciální diagnóza MLS zahrnuje intramuskulární myxom, který však postrádá typickou vaskulaturu a rovněž pravé lipoblasty. Obtížné může být rovněž odlišení dobře diferencovaného liposarkomu s myxoidními změnami, který by však měl mít výraznější pleomorfii nádorových buněk a oblasti fibrózy až sklerózy stromatu. Napomoci může rovněž imunohistochemie, kdy dobře diferencovaný liposarkom je CDK4 a mdm-2 pozitivní, a molekulární analýza, kdy MLS má charakteristickou translokaci DDIT3. Položkou v diferenciální diagnóze je i extraskeletální myxoidní chondrosarkom, s buňkami s eozinofilní cytoplazmou a bez nápadnější vaskulatury; a myxofibrosarkom s výraznější pleomorfií a bez arborizující kapilární sítě.
EXTRASKELETÁLNÍ MYXOIDNÍ CHONDROSARKOM
Extraskeletální myxoidní chondrosarkom (EMC) je, podobně jako MLS, obvykle hluboce uložený měkkotkáňový lobulizovaný tumor. Postihuje proximální části končetin a oblast končetinových pletenců. EMC cílí na poněkud starší věkovou skupinu než MLS. Mikroskopicky jde o lobulárně rostoucí tumor, jehož buňky bývají uniformní, s úzkým dvorcem eozinofilní cytoplazmy, a rostou v hnízdech a trámcích s tvorbou retikulárních formací (obr. 6). Někdy je pozorována nízce diferencovaná morfologie nebo dediferenciace v high-grade pleomorfní sarkom. Imunohistochemicky jediným konzistentně exprimovaným markerem je vimentin. V části případů byla popsána kompletní ztráta imunoreaktivity při užití protilátky proti INI1 (známý rovněž jako hSNF5, SMARCB1 a BAF47 a který je podjednotkou ATP-dependentního chromatin remodelujícího komplexu s funkcí mobilizovat nukleosomy a exponovat DNA pro transkripci). Molekulárně je charakterizován translokací t(9;22) s přestavbou genu EWSR1 asi v 75 % případů (4), s tvorbou fúzního genu EWSR1-NR4A3 a variantními translokacemi t(9;17) s fúzí TAF15-NR4A3 v 15 % případů EMC a t(9;15) s fúzí TCF12-NR4A3. NR4A3 je konstantní partner všech přestaveb u EMC, a je tak při vyšetření metodou FISH senzitivnější marker (13). Diferenciálně diagnosticky je nutné odlišit zejména chordom, který se vyskytuje v axiální lokalizaci, s pozitivitou S-100, EMA a cytokeratinů a myoepiteliální tumory, s pozitivitou epiteliálních a svalových markerů.
6. Extraskeletální myxoidní chondrosarkom je méně obvyklá malignita s nejistou histogenezí. 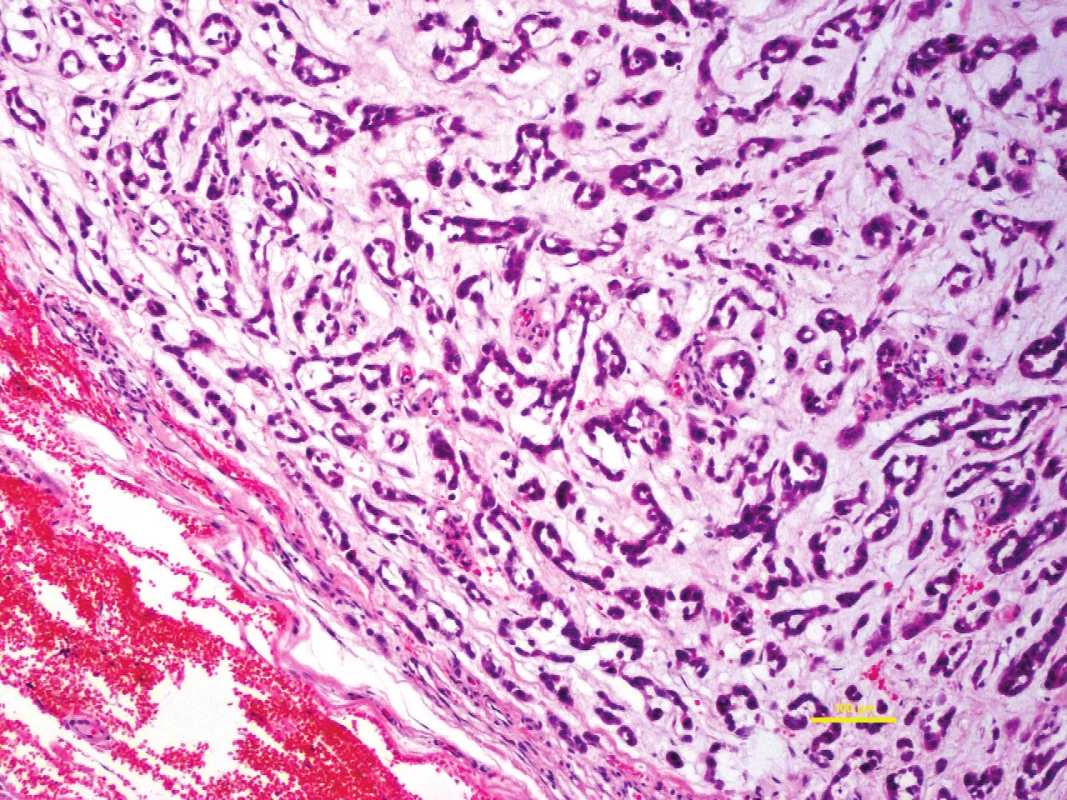
Barveno hematoxylin- eozinem, původní zvětšení 100x. LOW-GRADE FIBROMYXOIDNÍ SARKOM
Low-grade fibromyxoidní sarkom (LGFMS) postihuje téměř výlučně hluboké měkké tkáně u mladších pacientů (6). Nejsou úplně vzácné pediatrické případy (14). Asi 10 % tumorů postihuje podkoží a kůži. Mikroskopicky ve srovnání s jinými myxoidními lézemi, LGFMS má kolagenizovanější stroma a často připomíná desmoidní fibromatózu. Má ošidně nevinnou histomorfologii s nízkou až střední celularitou, s alternací hypocelulárních kolagenizovaných oblastí s buněčnějšími poněkud myxoidními regiony. V části případů LGFMS jsou přítomny rozety („hyalinizující vřetenobuněčný tumor s obrovskými rozetami“). Konstituující buňky jsou typicky velmi blandní a uniformní a rostou v fascikulárně a ve vírech. Vzácně může být přítomna metaplastická osifikace, sporadicky až k obrazu periferního lemu kostní tkáně, imitující osifikující fibromyxoidní tumor. Může se vyskytnout oblast dediferenciace s morfologií anaplastického hypercelulárního kulatobuněčného sarkomu. Imunohistochemicky jsou nádorové buňky MUC4 pozitivní, s variabilní pozitivitou EMA. Negativní je desmin, SMA, S-100, cytokeratiny a CD34. Molekulárně geneticky je u LGFMS rekurentní translokace t(7;16) s fúzí FUS-CREB3L2 nebo variantní t(11;16) s fúzí FUS-CREB3L1 v 90 – 95% případů (4).
High-grade fibromyxoidní sarkom (sklerózující epiteloidní fibrosarkom) postrádá myxoidní stroma.
Diferenciální diagnóza LGFMS zahrnuje benigní i maligní myxoidní nádory a rovněž desmoidní fibromatózu, jež se objevuje v obdobných věkových skupinách a lokalizacích jako LGFMS. Desmoidní fibromatóza je charakteristická růstem blandních vřetenitých buněk ve dlouhých svazcích, fibroblasty fibromatózy mají homogenní jemně granulární chromatin jader s drobnými jadérky, oproti LGFMS, jehož buňky mají denznější více barvitelná jádra. Imunohistochemicky je znakem desmoidní fibromatózy nukleární pozitivita β-cateninu; LGFMS je MUC4 pozitivní. Perineuriom měkkých tkání sdílí s LGFMS četné znaky, ale postrádá abruptní přechody kolagenizovaných a myxoidních oblastí. Low-grade myxofibrosarkom je oproti LGFMS ryzeji myxoidní, má výraznější cytonukleární atypie a je MUC4 negativní.
MYXOINFLAMATORNÍ FIBROBLASTICKÝ SARKOM
Byl původně popsán pod označením inflamatorní myxohyalinní tumor distálních končetin s virocyty nebo buňkami podobnými Reed-Sternbergovým (RS) buňkám; inflamatorní myxoidní tumor měkkých částí s bizarními obrovskými buňkami a akrální myxoinflamatorní fibroblastický sarkom (6,16). Myxoinflamatorní fibroblastický sarkom (MIFS) je vzácný tumor měkkých tkání s vrcholem incidence ve středním věku, s predilekcí pro ruce, nohy, zápěstí a kotníky. Biologické chování je indolentní, s rizikem lokálních recidiv a s minimální metastatickou potencí.
Morfologicky MIFS obvykle postihuje podkoží a hluboké měkké tkáně, typicky v podobě multinodulárního tumoru se špatným ohraničením, běžně s postižením kosterního svalu, šlachových pochev či synoviálních membrán. Cytologicky jsou přítomny stelární a vřetenité buňky s velkými pleomorfními vezikulárními jádry s nápadnými inkluzoidními jadérky a mnohojaderné buňky podobné Reed-Sternbergovým buňkám a prominentní zánětlivá komponenta zahrnující lymfocyty, granulocyty, histiocyty a plazmatické buňky, někdy neutrofily a eozinofily (16). Mohou být přítomné obrovské mnohojaderné osteoklastoidní buňky, histiocyty včetně pěnitých, toutonoidní obrovské buňky a rovněž vakuolizované buňky s cytoplazmatickým hlenem, imitující lipoblasty (pseudolipoblasty). V high-grade variantách byla popsána emperipoléza zánětlivých buněk nádorovými buňkami jako konstantní jedinečný znak, přičemž nádorové buňky s pohlcenými zánětlivými buňkami byly snadno demonstrovatelné imunohistochemií s protilátkami proti cyklinu D1 (17). Mezibuněčná hmota je variabilně fibrózní a myxohyalinní. Mohou být nápadná depozita hemosiderinu.
Imunohistochemicky je popisován nekonzistentní imunofenotyp s pozitivitou nádorových buněk v hladkosvalovém aktinu, a fokální CD34, CD68 a HHF35 (muskulárně specifický aktin) pozitivita, EMA, S-100, CD30, HMB45 a keratin negativita. Molekulárně geneticky byla popsána t(1;10) s přestavbou TGFBR3-MGEA5, která byla rovněž popsána u hemosiderotického fibrolipomatózního tumoru (HFLT) a pleomorfního hyalinizujícího angiektatického tumoru (PHAT), což spolu s hybridními případy produkuje úvahy o možném vztahu těchto jednotek (18), které však jiné studie rozporují s poukazem na to, že přestavba TGFBR3-MGEA5 v klasických případech MIFS může být méně frekventní a že hybridní případy HFLT-MIFS mohou představovat pouze formu nádorové progrese v sarkom (19). Diferenciální diagnóza zahrnuje zejména myxofibrosarkom, který se však objevuje proximálnějších lokalizacích, vlastní arkádovitou vaskulaturu a naopak buňky podobné RS elementům.
OSIFIKUJÍCÍ FIBROMYXOIDNÍ TUMOR
Osifikující fibromyxoidní tumor (OFMT) je nádor nejisté histogeneze (6). Obvykle postihuje dospělé, medián věku je přibližně 50 let. Nejčastější lokalizací jsou končetiny, následované trupem a hlavou a krkem, podkoží nebo hluboké měkké tkáně. Dermální výskyt je vzácný. Mikroskopicky až v 80 % je v periferii nekompletní lem kostní tkáně, neosifikující případy mívají silnou fibrózní pseudokapsulu. Okraj nádoru může být expanzivní či infiltrativní, někdy se satelitními uzly. Celková architektura OFMT je multinodulární, s monomorfními okrouhlými až vřetenitými buňkami v hnízdech, pruzích a trámcích rostoucími ve variabilně fibromyxoidním stromatu. Buňky mají okrouhlá až oválná jádra, nenápadná jadérka, úzký lem eozinofilní neostře ohraničené cytoplazmy. Může se vyskytnout metaplastická chrupavka, perivaskulární hyalinizace, nebo dokonce palisádování jader. Možná nekróza a vaskulární invaze nejsou prognosticky nepříznivým znakem. Maligní OFMT je charakterizován vysokým nukleárním grade nebo kombinací vysoké buněčnosti a zvýšené mitotické aktivity s více než 2 mitotickými figurami na 50 zorných polí. I histopatologicky typický OFMT však může vzácně metastazovat, patří tedy mezi low-grade vzácně metastazující nádory, kdežto maligní OFMT má významnou tendenci k recidivám a tvorbě vzdálených metastáz. Imunohistochemicky je v 70 % případů přítomna S-100 reaktivita, často ložiskově. Pozitivita v maligních případech je obvykle limitovaná. Desmin je pozitivní ve 40 % případů. Imunoreaktivita cytokeratinů a EMA je pouze příležitostná. MUC4 může být pozitivní ve 20 %. Diferenciální diagnóza OFMT obsahuje především myoepiteliom a extraskeletální myxoidní chondrosarkom. Myoepiteliom obvykle nemá lem metaplastické kosti, cytologicky je pestřejší oproti uniformní buněčné populaci OFMT, a je častěji CK a EMA pozitivní. Extraskeletální myxoidní chondrosarkom rovněž postrádá kostní lem, je S-100, CK a desmin negativní. FISH s detekcí přestavby NR4A3 je diagnostická.
MYOEPITELIOM – MYOEPITELIÁLNÍ KARCINOM
Myoepiteliální nádory měkkých tkání se vyskytují v širokém věkovém rozmezí, s vrcholem výskytu v mladé dospělosti (6). Mikroskopicky může být tumor dobře nebo špatně ohraničený, a může invadovat do svalu, tukové tkáně nebo dokonce kosti. Většina případů má multinodulární architekturu, s růstem buněk trabekulárně a retikulárně v chondromyxoidním nebo hyalinizovaném až sklerotickém stromatu. Cytologicky jsou myoepiteliální tumory (MET) pestré, vřetenobuněčné až epiteloidní či plazmocytoidní, v některých případech jasnobuněčné. V některých případech mohou být přítomny buňky s hojnou eozinofilní cytoplazmou a nápadnými cytoplazmatickými vakuolami, podobné fyzaliformním buňkám chordomu. Není výjimečná chrupavčitá či kostní metaplazie nebo adipocytární metaplazie. Myoepiteliální karcinom je definován přítomností středně výrazných až těžkých jaderných atypií s pleomorfismem, hrubou kresbou chromatinu a nápadnými nukleoly, častější jsou nekrózy a jsou vyšší počty mitotických figur.
Imunohistochemicky jsou MET pozitivní nejméně v jednom epiteliálním markeru (CK, EMA), ve většině případů je S-100 pozitivita, v polovině případů GFAP pozitivita. Ze svalových markerů je nejcitlivější calponin, méně často je přítomný SMA, v malém počtu případů desmin. Jadernou p63 je možné pozorovat ve čtvrtině případů. Až ve 40 % maligních myoepiteliálních tumorů u měkkých tkání u dětí a v 10 % u dospělých byla identifikována ztráta INI1 (12). Molekulárně je v 50 % nonsalivárních MET přestavba EWSR1. Diferenciálně diagnosticky je nutné odlišit celou řadu jednotek pro morfologickou pestrost MET, zejména chordom, osifikující fibromyxoidní tumor, extraskeletální myxoidní chondrosarkom, epiteloidní sarkom.
VELMI VZÁCNÉ JEDNOTKY S PRAVIDELNOU MYXOIDNÍ MORFOLOGIÍ
Primární plicní myxoidní sarkom
Primární plicní myxoidní sarkom (PPMS) je velmi vzácný tumor plic pacientů středního a vyššího věku, rostoucí jako lobulizovaná 1,5 – 4 cm velká masa, mikroskopicky připomínající extraskeletální myxoidní chondrosarkom, se vztahem k bronchu, často převážně s endobronchiálním růstem, s infiltrativním šířením do okolního alveolárního parenchymu (20). Imunoistochemicky je exprese vimentinu a slabě fokálně EMA. Molekulárně v 70 % případů byla detekovaná fúze EWSR1 s CREB1, která je rovněž vlastností angiomatoidního fibrózního histiocytomu (AFH) a tumoru gastrointestinálního traktu podobného světlobuněčnému sarkomu a části případů konvenčního světlobuněčného sarkomu měkkých tkání.
High-grade endometriální stromální sarkom s ZC3H7B-BCOR fúzí
High-grade endometriální stromální sarkom (HG-ESS) s fúzí ZC3H7B-BCOR morfologicky a imunohistochemicky imituje myxoidní leiomyosarkom, a je možné, že část popsaných myxoidních leiomyosarkomů představuje ve skutečnosti tuto jednotku (21). Postihuje ženy v mladém až středním věku.
Mikroskopicky je tvořen převážně vřetenitými buňkami s okrouhlými až oválnými jádry s nepravidelnými konturami a s hyperchromním až jasným chromatinem, s vysokou mitotickou aktivitou, s fokální fascikulární architekturou, myxoidním stromatem. Vaskulatura zahrnuje tenkostěnné kapiláry, bez perivaskulárního vírovitého uspořádaní nádorových buněk. V periferii tumor roste expanzivně a jazykovitě infiltrativně. Imunohistochemicky je difúzní CD10 pozitivita, s možnou expresí ER, PgR, SMA a desminu. Molekulárně geneticky je následkem t(X;22) fúze ZC3H7B-BCOR.
VZÁCNÉ JEDNOTKY S VARIANTNÍ MYXOIDNÍ MORFOLOGIÍ
Myxoidní dermatofibrosarcoma protuberans
Myxoidní dermatofibrosarcoma protuberans (DFSP), varianta nejběžnějšího dermálního sarkomu, je tvořen převážně (> 50 %) nebo zcela myxoidními oblastmi (6). Klinicky se manifestuje obdobně jako jeho typický DFSP, v podobě pomalu rostoucích plátů, nodulů v různých lokalizacích, s výjimkou akrálních, které jsou raritní. Většina pacientů je ve středním věku, ale věkové rozmezí je velmi široké, od kojenců po velmi staré jedince.
Mikroskopicky je vybaven uniformně distribuovanými, uniformními vřetenitými až hvězdicovitými buňkami s bledou až eozinofilní cytoplazmou v myxoidním stromatu. Obvyklá je nápadnější vaskulatura tvořená četnými drobnými tenkostěnnými kapilárami, někdy napodobující cévy v myxoidním liposarkomu. Mohou být disperzní mastocyty a neutrofily. Mitózy jsou obvykle vzácné. Nekrózy chybí. Nádor může mít expanzivní okraj, ale septální infiltrace tukové tkáně je konstantně přítomna. Oblasti konvenčního DFSP jsou přítomné až u 60 % případů. Mohou být přítomny disperzní mnohojaderné buňky, podobě jako u obrovskobuněčného fibroblastomu. V myxoidním DFSP byly rovněž popsány oblasti typického obrovskobuněčného fibroblastomu, pigmentovaného DFSP (Bednářův tumor), a fibrosarkomatózní transformace.
Imunohistochemicky je pozitivita CD34, negativita S-100. Diagnosticky užitečná může být rovněž fúze COL1A1-PDGFB. Diferenciálně diagnosticky je nutné odlišit myxoidní liposarkom, který je obvykle v hluboké lokalizaci, často jsou lipoblasty a jiné molekulárně genetické charakteristiky. Myxofibrosarkom postrádá uniformní buňky DFSP. Ve výčtu diferenciální diagnózy je rovněž kutánní myxom a superficiální angiomyxom.
Myxoidní atypický fibrózní fibroxanthom
Atypický fibrózní fibroxanthom (AFX) je nádor typicky postihující kůži starších v exponovaných oblastech, nejčastěji v oblasti hlavy a krku, který má mnoho histologických variant, mezi kterými je i subtyp s hojnou myxoidní mezibuněčnou matrix (22). AFX je poněkud kontroverzní jednotkou s neznámou histogenezí, jehož diagnóza je stanovena po vyloučení možnosti zejména maligního melanomu a sarkomatoidního dlaždicového karcinomu, v případě myxoidní varianty se diferenciální diagnóza rozšiřuje o další jednotky, jako je nodulární fasciitis, myxoidní dermatofibrosarcoma protuberans, myxofibrosarkom a myxoinflamatorní fibroblastický sarkom.
Myxoidní solitární fibrózní tumor
Myxoidní solitární fibrózní tumor (SFT) je velmi vzácnou jednotkou, která může vést k diagnostickým obtížím při široké diferenciální diagnóze, do které lze zahrnout LGFMS, myxoidní vřetenobuněčný lipom, myxoidní monofázický synoviální sarkom, myxoidní maligní tumor periferní nervové pochvy, a myxoidní liposarkom (23). Myxoidní SFT je definován myxoidní změnou nejméně v 50 % tumoru. Histomorfologicky je myxoidní SFT komponován blandními krátce vřetenitými buňkami separovanými jemnými vlákny kolagenních fibril na myxoidním pozadí. Nádorové buňky jsou uspořádané necharakteristicky, fascikulárně, v plachtách, nebo storiformně. Typické jsou parožnaté cévy. Imunohistochemicky je myxoidní SFT STAT6, CD34, bcl-2 a CD99 pozitivní; keratiny, EMA a S-100 jsou negativní. LGFMS může být fokálně CD34 pozitivní, odliší se imunohistochemickou reaktivitou s MUC4, případně průkazem t(7;16) nebo t(11;16).
Inflamatorní myofibroblastický tumor
Inflamatorní myofibroblastický tumor (IMT) může vykazovat extenzivní myxoidní změnu; vyskytuje se spíše u mladších osob, mikroskopicky je spojen s přítomností zánětlivého lymfoplazmocytárního infiltrátu a imunoreaktivity s ALK1 (24).
Myxoidní monofázický synoviální sarkom
Myxoidní monofázický synoviální sarkom je tvořen uniformními buňkami s homogenním denzním chromatinem, nezřetelnou cytoplazmou, ve svazech a plachtách, s predominancí myxoidního stromatu, což může vést k diagnostickým konfúzím zvláště s MPNST (25). Imunohistochemicky je fokální exprese EMA a keratinů, v konjunkci s expresí TLE1 a molekulárně geneticky je definován t(X;18).
Myxoidní maligní tumor periferní nervové pochvy
Vyskytuje se obvykle u dospělých, typicky v hluboké lokalizaci, 30 % případů se vyskytuje v rámci neurofibromatózy, kdy je ovšem výskyt v časnějším věku (5). Pro maligní tumor periferní nervové pochvy je rovněž typická alternace celulárních svazků a myxoidních regionů. Asi v 10 % jsou tumory extenzivně myxoidní. Buňky jsou vřetenité, často se zvlněnými jádry, může být palisádování jader, mitózy jsou obvykle zřetelné. Je možný výskyt heterologních elementů. MPNST obvykle nedisponuje parožnatými cévami a v 50 % případů je S-100 pozitivní. Odlišení myxoidního liposarkomu by neměl být problém pro jeho charakteristickou arborizující kapilární vaskulaturu. Diferenciálně diagnosticky je nutné odlišit myxoidní neurofibrom na základě mitotické aktivity a cytonukleárních atypií. Myxom nervové pochvy se odlišuje superficiální lokalizací, organoidní strukturou a difúzní S-100 pozitivitou.
Myxoidní leiomyosarkom
Myxoidní leiomyosarkom (LMS) je vzácný tumor, dobře popsaný a definovaný v děložní lokalizaci, s možným výskytem v neviscerálních měkkých tkáních (26). Postihuje převážně končetiny, ale i zevní genitálie, trup i hlavu a krk pacientů v širokém věkovém rozmezí od třetí dekády výše, většinou v hluboké lokalizaci. Myxoidní stroma by mělo tvořit více než 50% tumoru. Architektonika růstu jinak cytomorfologicky typických nádorových buněk s hladkosvalovou diferenciací (na pólech tupě zakončená jádra, objemnější elongovaná dobře ohraničená sytě eozinofilní cytoplazma) se poté odlišuje od alternativně fascikulárního uspořádání konvenčního LMS, myxoidní matrix produkuje volně fascikulární uspořádání, které je obtížněji rozpoznatelné. Některé případy mají mikrocystický nebo retikulární vzhled. Možný je multinodulární růst upomínající na myxofibrosarkom. Nejméně fokálně je přítomný obvyklá typická fascikulární architektura, což podtrhuje význam adekvátního počtu vyšetřených mikroskopických řezů z různých oblastí tumoru. Imunohistochemicky jsou myxoidní LMS pozitivní nejméně v jednom ze svalových markerů, nejčastěji je to hladkosvalový aktin, jehož exprese je obvykle difúzní a intenzivní; méně často je to desmin. Komplikací může být exprese epiteliálních znaků, EMA a nízkomolekulárních cytokeratinů, v části případů, což platí obecně pro hladkosvalové nádory. Diferenciální diagnóza myxoidního LMS je nepřekvapivě široká se spektrem benigních i maligních afekcí. Schwannom se liší přítomností fibrózního pouzdra, hyalinizovaných cév, S-100 imunoreaktivitou a odlišnými cytomorfologickými znaky. Nodulární fasciitis má buňky s bledší cytoplazmou, stromální zánětlivé buňky, extravazáty erytrocytů, a krátce fascikulární architekturu růstu. Myxoidní leiomyom v hlubokých měkkých tkáních je výjimečný, hladkosvalový tumor v hluboké lokalizaci s jakoukoli mitotickou aktivitou by měl být označen jako leiomyosarkom. Myxoidní liposarkom má charakteristickou vaskulaturu a obvykle lipoblasty; myxofibrosarkom arkádovité cévy a pseudolipoblasty, a obvykle není tak extenzivně pozitivní v imunoreakcích s protilátkami proti hladkosvalovým antigenům. Extraskeletální myxoidní chondrosarkom má buňky chudší na cytoplazmu, může být S-100 pozitivní a svalové markery při imunohistochemickém vyšetření chybí. Maligní tumor periferní nervové pochvy se liší cytomorfologií se zvlněnými jádry buněk s bledší cytoplazmou, a absencí exprese hladkosvalových markerů.
Myxoidní epiteloidní sarkom
Epiteloidní sarkom (ES) může raritně mít myxoidní fenotyp (27). Potom je nutné jej odlišit zejména od myoepitelových nádorů měkkých tkání, čemuž může napomoci CD34 pozitivita u části ES, a extenzivnější pozitivita hladkosvalových markerů u myoepitelomu. Rovněž S-100 pozitivita MET může být diskriminujícím znakem. Do diferenciální diagnózy myxoidního ES patří i extraskeletální myxoidní chondrosarkom, charakterizovaný negativitou epiteliálních markerů, a s expresí S-100 v části případů. Epiteliální markery postrádá i epiteloidní myxofibrosarkom, na rozdíl od epiteloidního hemangioendoteliomu, u kterého je však možné demonstrovat přítomnost CD31. Ke konfúzím může vést skutečnost, že část případů ES, myoepiteliálních karcinomů měkkých tkání i u extraskeletálního myxoidního chondrosarkomu jsou INI1 deficientní (12).
Myxoidní nodulární fasciitis
Nodulární fasciitis (NF) je dosti běžná benigní převážně subkutánní proliferace fibroblastů a myofibroblastů, která se může vyskytnout i intravaskulární lokalizaci a může být myxoidně transformována (5,28). Klinicky se projevuje zduřením, obvykle u mladších dospělých, s krátkou anamnézou 1–3 měsíce. Malá část lézí může být intramuskulární, vzácně je postižen periost nebo dermis. Mikroskopicky jsou tyto myxoidní léze dobře ohraničené, tvořené fibroblasty a myofibroblasty v krátkých a neuspořádaných svazcích v hojné myxoidní matrix, což propůjčuje lézi klasicky popisovaný „zpeřený“ vzhled (obr. 7, 8). Ve stromatu je řídký převážně lymfocytární zánětlivý infiltrát a extravazáty erytrocytů, často je určitý stupeň cystoidní transformace. Imunohistochemický profil odpovídá původu lezionálních buněk, s expresí hladkosvalového aktinu a svalově specifického aktinu, s příležitostnou pozitivitou desminu. Molekulárně geneticky je NF charakterizována přestavbou genu USP6, kterou je možné využít i diagnosticky (29). Diferenciálně diagnosticky je nutné odlišit zejména myxoidní neurofibrom, myxoidní DFSP, a low-grade myxofibrosarkom.
7. Nodulární fasciita může mít značně myxoidní vzhled. Pro svoji hypercelularitu, mitotickou aktivitu a někdy alarmující vzhled aktivovaných fibroblastů bývá zaměněna za maligní nádor. 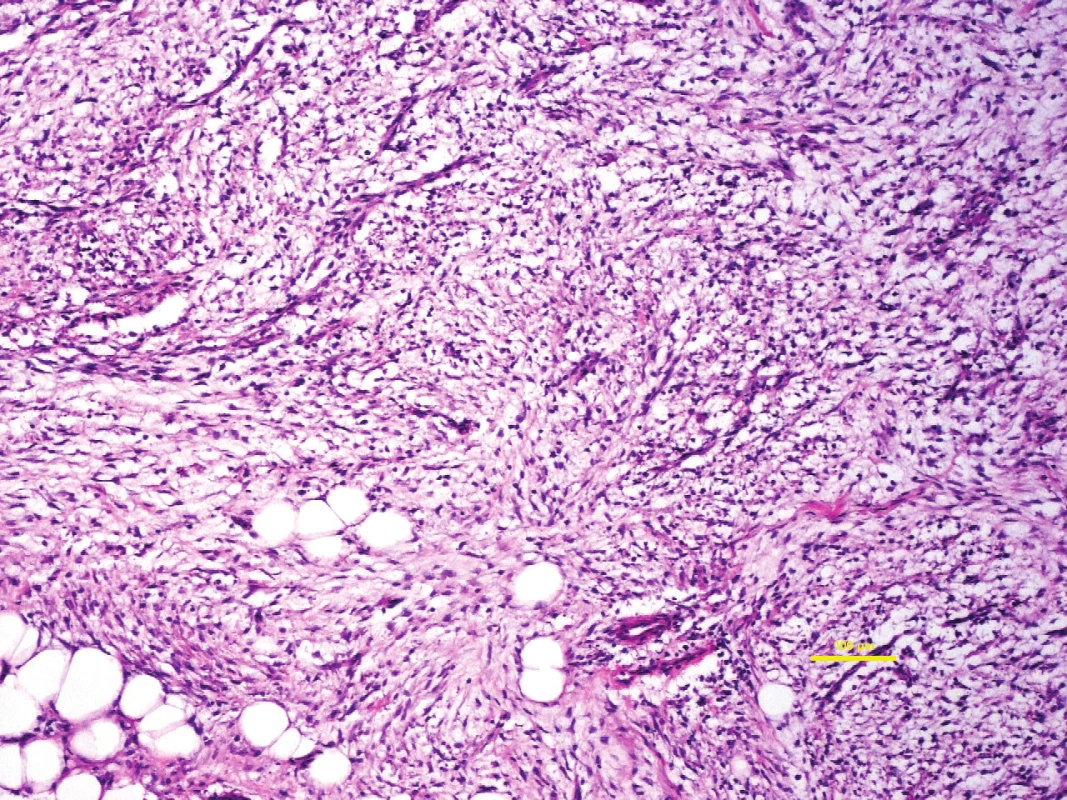
Barveno hematoxylin-eozinem, původní zvětšení 100x. 8. Při velkém zvětšení mikroskopu jsou patrné charakteristické znaky nodulární fasciitidy – „zpeřený“ vzhled, disperzní malé lymfocyty, extravazáty erytrocytů a fibroblasty s absencí hyperchromních jader s nepravidelnými konturami. 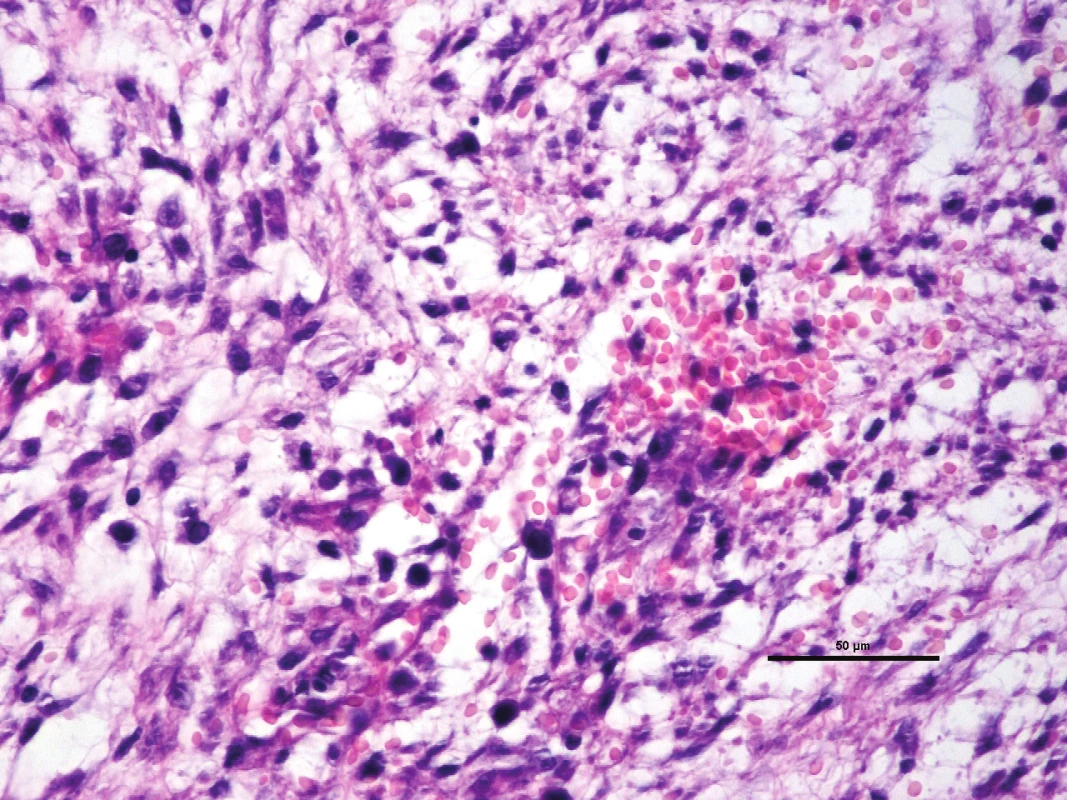
Barveno hematoxylin-eozinem, původní zvětšení 400x. Myxoidní angiomatoidní fibrózní histiocytom
Angiomatoidní fibrózní histiocytom (AFH) je intermediárně maligní tumor postihující končetiny mladých pacientů a má široké morfologické spektrum, zahrnující i myxoidní/retikulární variantu (30). Diagnóza tak může být extrémně obtížná, protože se může vyskytnout v neobvyklých věkových skupinách a s neočekávanými histopatologickými rysy. Naštěstí jsou přítomny nejméně dva typické rysy, zejména fibrózní pseudokapsula s lymfoidním pláštěm s možnou tvorbou germinálních center. Méně často se vyskytují hemoragie, depozita hemosiderinu a pseudovaskulární prostory. Imunohistochemicky je část případů CD68, EMA a desmin pozitivních. Molekulárně biologicky je ve více než 70 % případů t(2;22) s fúzí EWSR1-CREB1, méně běžnou je t(12;16) s fúzí FUS-ATF1.
Myxoidní neurofibrom
Většina neurofibromů je solitární dermální nebo subkutánní tumor bez vazby na neurofibromatózu (5). Objevují se obvykle u dospělých, v jakékoli lokalizaci. Histologicky jsou relativně dobře ohraničené, bez opouzdření. Myxoidní varianta není častá, je často hlouběji uložená na končetinách, charakterizovaná hojným myxoidním stromatem. Buňky jsou elongované, s blandními, zvlněnými či zprohýbanými jádry, a bledou nezřetelnou cytoplazmou. Mitózy chybí. Intralezionální nervová vlákna nebo axony jsou diagnosticky velmi užitečné. Imunohistochemicky je ložisková přesvědčivá S-100 pozitivita. Diferenciálně diagnosticky je nutné odlišit maligní tumor periferní nervové pochvy na základě mitotické aktivity, myxom nervové pochvy, a myxoidní variantu schwannomu.
Retikulární perineuriom
Je charakterizován abundantním myxoidním stromatem, s tvorbou mikrocystického nebo retikulárního uspořádání (31). Pro diagnózu jsou nutná doplňující vyšetření, imunohistochemie s pozitivitou EMA, claudinu 1 a GLUT1. Je nutné vyloučit zejména low-grade fibromyxoidní sarkom, obvykle s ostrými přechody kolagenizovaných a myxoidních oblastí a MUC4 pozitivitou. K omylu může vést EMA pozitivita sdílená oběma lézemi.
MYXOIDNÍ LÉZE MIMO KATEGORII NÁDORŮ MĚKKÝCH TKÁNÍ
Myxoidní transformací mohou příležitostně značně překvapit jiné než měkkotkáňové tumory. Byla popsána myxoidní varianta anaplastického velkobuněčného lymfomu (32), maligního melanomu (33), vřetenobuněčného skvamocelulárního karcinomu (34) či maligního mezoteliomu (35).
MYXOIDNÍ NENÁDOROVÉ AFEKCE
Synoviální cysta (kutánní myxoidní cysta či digitální myxom) je častá myxoidní léze kůže (2). Obvykle je lokalizována na prstu, vzniká v důsledku herniace synoviální membrány z interfalangeálního kloubu. Jsou obecně cystoidní, ale solidní mukoidní oblasti mohou překrývat cystoidní komponentu. Kutánní myxoidní cysty mají zřejmě blízký vztah ke ganglion a k juxta-artikulárnímu myxomu. Objevuje se u dospělých, histologicky je tvořena hojnou hypocelulární a avaskulární mezibuněčnou hmotou, s blandními vřetenitými a stelárními fibroblasty (5). V diferenciální diagnóze je zejména superficiální angiomyxom, proti kterému diagnózu digitálního myxomu favorizuje jeho specifická lokalizace, hypovaskularita a absence neutrofilních granulocytů.
Ganglion je běžná myxoidní a cystoidní léze, objevující se u dospělých převážně kolem kloubů a šlach ruky a nohy. Častá je anamnéza traumatu. Dle různých teorií vznikají následkem myxoidní degenerace pojivových tkání kloubního pouzdra, nebo herniací synoviální membrány, metaplastickou tvorbou synoviálních buněk či extravazací synoviální tekutiny (5). Mikroskopicky jsou tvořeny myxoidními ložisky obvykle s cystoidními prostory, které mohou být vystlané plochými buňkami, a s obsahem bazofilními mucinu či fibrinózního materiálu. Cystické oblasti jsou obklopeny různým množstvím vazivové tkáně s možným podílem chronického zánětlivého infiltrátu.
ZÁVĚR
Myxoidní nádory měkkých tkání mohou vyvolávat výrazné diagnostické rozpaky z nejrůznějších důvodů, zejména pro jejich navzájem se překrývající morfologické a imunohistochemické rysy a často blandní histomorfologii maligních tumorů. Další příčinou může být malé množství tkáně dostupné pro vyšetření (např. vzorek z biopsie silnou jehlou). Popularita jehlových biopsií patrně dále poroste a tento přístup vyžaduje užití senzitivní a specifické doplňkové molekulárně genetické metody, jako je např. FISH s možností aplikace na rutinní formol – parafinový materiál (5). Základem korektní diagnózy však zůstává pečlivé morfologické hodnocení z kvalitních rutinních histologických preparátů.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Karel Veselý, Ph.D.
Aeskulab patologie, k.s. – Laboratoř Brno
CTZone, Škrobárenská 502/1,
617 00 Brno
tel.: 515 511 441
email: vesely.karel@aeskulab.cz
Sources
1. Pittman ME, Montgomery EA. Distinctive clinicopathologic features of the common myxoid soft-tissue lesions. Diagn Histopathol 2015; 21(11): 438–444.
2. Allen PW. Myxoma is not a single entity: a review of the concept of myxoma. Ann Diagn Pathol 2000; 4(2): 99-123.
3. Willems SM, Schrage YM, Baelde JJ et al. Myxoid tumours of soft tissue: the so-called myxoid extracellular matrix is heterogeneous in composition. Histopathology 2008; 52(4): 465-474.
4. Downs-Kelly E, Goldblum JR, Patel RM et al. The utility of fluorescence in situ hybridization (FISH) in the diagnosis of myxoid soft tissue neoplasms. Am J Surg Pathol 2008; 32(1): 8-13.
5. Graadt van Roggen JF, Hogendoorn PC, Fletcher CD. Myxoid tumours of soft tissue. Histopathology 1999; 35(4): 291-312.
6. Zou Y, Billings SD. Myxoid cutaneous tumors: a review. J Cutan Pathol 2016; 43(10): 903-918.
7. Ashby-Richardson H, Rogers GS, Stadecker MJ. Superficial acral fibromyxoma: an overview. Arch Pathol Lab Med 2011; 135(8): 1064-1066.
8. Fetsch JF, Laskin WB, Miettinen M. Nerve sheath myxoma: a clinicopathologic and immunohistochemical analysis of 57 morphologically distinctive, S-100 protein - and GFAP-positive, myxoid peripheral nerve sheath tumors with a predilection for the extremities and a high local recurrence rate. Am J Surg Pathol 2005; 29(12): 1615-1624.
9. Wang GY, Nazarian RM, Zhao L et al. Protein gene product 9.5 (PGP9.5) expression in benign cutaneous mesenchymal, histiocytic, and melanocytic lesions: comparison with cellular neurothekeoma. Pathology 2017; 49(1): 44-49.
10. Sutton BJ, Laudadio J. Aggressive angiomyxoma. Arch Pathol Lab Med 2012; 136(2): 217-221.
11. Kilpatrick SE, Doyon J, Choong PF, Sim FH, Nascimento AG. The clinicopathologic spectrum of myxoid and round cell liposarcoma. A study of 95 cases. Cancer 1996; 77(8): 1450-1458.
12. Hollmann TJ, Hornick JL. INI1-deficient tumors: diagnostic features and molecular genetics. Am J Surg Pathol 2011; 35(10): e47-63.
13. Benini S, Cocchi S, Gamberi G et al. Diagnostic utility of molecular investigation in extraskeletal myxoid chondrosarcoma. J Mol Diagn 2014; 16(3): 314-323.
14. Odem JL, Oroszi G, Bernreuter K et al. Deceptively benign low-grade fibromyxoid sarcoma: array-comparative genomic hybridization decodes the diagnosis. Hum Pathol 2013; 44(1): 145-150.
15. Fetsch JF, Laskin WB, Miettinen M. Superficial acral fibromyxoma: a clinicopathologic and immunohistochemical analysis of 37 cases of a distinctive soft tissue tumor with a predilection for the fingers and toes. Hum Pathol 2001; 32(7): 704-714.
16. Yasuda T, Kanamori M, Nobukiyo M, Nogami S, Hori T, Kimura T. Acral myxoinflammatory fibroblastic sarcoma of the foot. J Exp Clin Cancer Res 2007; 26(2): 277-280.
17. Michal M, Kazakov DV, Hadravský L, Kinkor Z, Kuroda N, Michal M. High-grade myxoinflammatory fibroblastic sarcoma: a report of 23 cases. Ann Diagn Pathol 2015; 19(3): 157-163.
18. Michal M, Kazakov DV, Hadravský L, et al. Pleomorphic hyalinizing angiectatic tumor revisited: all tumors manifest typical morphologic features of myxoinflammatory fibroblastic sarcoma, further suggesting 2 morphologic variants of a single entity. Ann Diagn Pathol 2016; 20 : 40-43.
19. Zreik RT, Carter JM, Sukov WR et al. TGFBR3 and MGEA5 rearrangements are much more common in “hybrid” hemosiderotic fibrolipomatous tumor-myxoinflammatory fibroblastic sarcomas than in classical myxoinflammatory fibroblastic sarcomas: a morphological and fluorescence in situ hybridization study. Hum Pathol 2016; 53 : 14-24.
20. Thway K, Nicholson AG, Lawson K et al. Primary pulmonary myxoid sarcoma with EWSR1-CREB1 fusion: a new tumor entity. Am J Surg Pathol 2011; 35(11): 1722-1732.
21. Hoang LN, Aneja A, Conlon N, et al. Novel high-grade endometrial stromal sarcoma: a morphologic mimicker of myxoid leiomyosarcoma. Am J Surg Pathol 2017; 41(1): 12-24.
22. Patton A, Page R, Googe PB, King R. Myxoid atypical fibroxanthoma: a previously undescribed variant. J Cutan Pathol 2009; 36(11): 1177-1184.
23. Dantey K, Cooper K. Myxoid solitary fibrous tumour: instructive case and literature review. Diagn Histopathol 2013; 19(2): 67–70.
24. Burch DM, Tavassoli FA. Myxoid leiomyosarcoma of the uterus. Histopathology 2011; 59(6): 1144-1155.
25. Krane JF, Bertoni F, Fletcher CD. Myxoid synovial sarcoma: an underappreciated morphologic subset. Mod Pathol 1999; 12(5): 456-462.
26. Rubin BP, Fletcher CD. Myxoid leiomyosarcoma of soft tissue, an underrecognized variant. Am J Surg Pathol 2000; 24(7): 927-936.
27. Flucke U, Hulsebos TJ, van Krieken JH, Mentzel T. Myxoid epithelioid sarcoma: a diagnostic challenge. A report on six cases. Histopathology 2010; 57(5): 753-759.
28. Wang L, Wang G, Wang L, Gao T. Myxoid intravascular fasciitis. J Cutan Pathol 2011; 38(1): 63-66.
29. Shin C, Low I, Ng D, Oei P, Miles C, Symmans P. USP6 gene rearrangement in nodular fasciitis and histological mimics. Histopathology 2016; 69(5): 784-791.
30. Bohman SL, Goldblum JR, Rubin BP, Tanas MR, Billings SD. Angiomatoid fibrous histiocytoma: an expansion of the clinical and histological spectrum. Pathology 2014; 46(3): 199-204.
31. Rodriguez FJ, Folpe AL, Giannini C, Perry A. Pathology of peripheral nerve sheath tumors: diagnostic overview and update on selected diagnostic problems. Acta Neuropathol 2012; 123(3): 295-319.
32. Gable AD, Clark SH, Magro CM. Myxoid variant of anaplastic large cell lymphoma involving the skin: a case report. J Cutan Pathol 2012; 39(8): 787-790.
33. Inoue T, Misago N, Narisawa Y. Metastatic myxoid melanoma with partial regression of the primary lesion. J Cutan Pathol 2007; 34(6): 508-512.
34. Yang A, Hanley A, Velazquez EF, Cassarino DS. Primary cutaneous myxoid spindle cell squamous cell carcinoma: a clinicopathologic study and review of the literature. J Cutan Pathol 2010; 37(4): 465-474.
35. Shia J, Qin J, Erlandson RA et al. Malignant mesothelioma with a pronounced myxoid stroma: a clinical and pathological evaluation of 19 cases. Virchows Arch 2005; 447(5): 828-834.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2017 Issue 2-
All articles in this issue
- Giant cell-rich lesions of bone and their differential diagnosis
- Myxoid tumors of soft tissues
- Identification of an optimal algorithm for effective diagnostics of non-small cell lung cancer with ALK gene rearrangement – implementation of the method and practical experiences with routine diagnostics
-
Hybrid peripheral nerve sheath tumors:
A review - Mature teratoma of the uterine corpus: A case report
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Myxoid tumors of soft tissues
- Giant cell-rich lesions of bone and their differential diagnosis
-
Hybrid peripheral nerve sheath tumors:
A review - Mature teratoma of the uterine corpus: A case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

