-
Medical journals
- Career
Přehled dosavadních zkušeností s mezinárodní klasifikací tenkojehlové aspirační cytologie štítné žlázy Bethesda 2010
Authors: Marie Ludvíková 1,2; Ivana Kholová 3
Authors‘ workplace: Ústav biologie LF UK Plzeň 1; Ústav patologie 1. LF UK a VFN Praha 2; Patologie, Fimlab Laboratoře, Univerzitní nemocnice v Tampere, Tampere, Finsko 3
Published in: Čes.-slov. Patol., 50, 2014, No. 3, p. 155-160
Category: Reviews Article
Overview
V hodnocení tenkojehlové aspirační cytologie štítné žlázy se používá 6-ti stupňová standardizovaná mezinárodní klasifikace Bethesda System for Reporting Thyroid Cytopathology (BSRTC), která byla oficiálně představena v roce 2010. Pro jednotlivé kategorie této klasifikace jsou stanoveny morfologické charakteristiky, riziko malignity a je navržen další klinický postup. Na základě několikaletého používání Bethesda systému v rutinní praxi se ukazují jeho přednosti i nevýhody, které jsou v článku souhrnně představeny. Významným přínosem této klasifikace v mezinárodním měřítku je sjednocení terminologie a diagnostických kategorií a zjednodušení srovnatelnosti cytologických závěrů mezi pracovišti. Nejproblematičtější se jeví kategorie zahrnující nálezy Atypie nejistého významu/Folikulární léze nejistého významu (AUS/FLUS). Jedná se o značně heterogenní skupinu, která je v rutinní praxi nadměrně využívána, ačkoliv neumožňuje jednoznačný klinický postup. Jsou diskutovány možnosti dalšího zpřesnění této i ostatních kategorií Bethesda klasifikace. Slibné je zejména použití diagnostických, prognostických a prediktivních markerů, které nejsou v Bethesda systému dosud zahrnuty. Dále jsou krátce zmíněny možnosti molekulárních přístupů a alternativních technik jako biopsie tlustou jehlou.
Klíčová slova:
tenkojehlová aspirační cytologie – štítná žláza – klasifikace Bethesda 2010 - výhody - nedostatkyTenkojehlová aspirační cytologie (FNAC) se postupně stala od poloviny minulého století významnou předoperační metodou v klinicko-patologické diagnostice lézí štítné žlázy. Jako každá diagnostická metoda má také FNAC své přednosti a úskalí, jejichž znalost vede ke správnému indikování tohoto vyšetření v klinické praxi. Interpretace FNAC ve štítné žláze je obtížná, s četnými limitacemi procedurálního i diagnostického charakteru, a musí být vždy založena na vzájemné kombinaci cytologického a klinického obrazu a ultrazvukového vyšetření. Navíc dlouhou dobu neexistovala jednotná mezinárodní terminologie.
VÝCHODISKA PRO ZAVEDENÍ JEDNOTNÉ MEZINÁRODNÍ KLASIFIKACE FNAC VE ŠTÍTNÉ ŽLÁZE
Největší úskalí při hodnocení materiálu z tenkojehlové aspirace štítné žlázy představují od zavedení této metody do klinické praxe zejména tyreoidální uzly folikulárního charakteru zahrnující nenádorové i nádorové (benigní i maligní) léze. Jsou nejčastější příčinou falešně negativních výsledků FNAC ve štítné žláze. Tyto afekce byly v FNAC nálezech popisovány neurčitými termíny jako „folikulární léze“, „folikulární neoplazie“ nebo „proliferující mikrofolikulární léze“ a spadaly do indeterminované kategorie nálezů, v níž výskyt malignity dosahoval až 40 % (1). Uvedená terminologie odrážela známou skutečnost, že diferenciální diagnóza mezi folikulárním adenomem a minimálně invazivním folikulárním karcinomem štítné žlázy je založena pouze na histologickém průkazu kapsuloinvaze a/nebo angioinvaze a nemůže být tudíž stanovena na cytologické úrovni (2).
Dříve používaná diagnostická schémata a terminologie v tyreoidální cytologické diagnostice byly nejednotné jak na národní, tak i na mezinárodní úrovni. Cytopatologové u nás hodnotili FNAC štítné žlázy většinou dle 4-stupňové klasifikace, která zahrnovala diagnostické kategorie: neadekvátní, suspektní (nejistý, indeterminovaný) z hlediska neoplazie/malignity, benigní a maligní (1). Na jiných pracovištích se naopak osvědčil 5-ti stupňový systém rozlišující indeterminovanou a suspektní kategorii (3,4). Roztříštěnost klasifikačního systému FNAC ztěžovala reprodukovatelnost, vzájemné porozumění a porovnání nálezů, a proto postupně sílily snahy o standardizaci hodnocení (5). Některé odborné společnosti zaměřené na cytopatologii (např. Papanicolaou Society of Cytopathology; the American Thyroid Association) přistoupily ke stanovení a zveřejnění doporučení pro hodnocení tenkojehlové aspirační cytologie štítné žlázy, avšak žádný z těchto systémů nebyl v širším měřítku akceptován (6,7).
V říjnu roku 2007 uspořádal National Cancer Institute v Bethesdě (Maryland, USA) interdisciplinární konferenci zaměřenou na tenkojehlovou aspirační cytologii štítné žlázy. Konferenci předcházelo online diskusní fórum. Hlavní náplní konference byla rozprava o problémech tyreoidální cytodiagnostiky s cílem nalézt shodu v terminologii a morfologických kritériích FNAC a usnadnit tak interpretaci cytologických diagnostických závěrů nejen mezi jednotlivými laboratořemi, ale též mezi cytopatology a kliniky. Cílem nové klasifikace cytologických nálezů bylo rovněž snížit počet operací z důvodů benigních lézí. Závěry této konference byly následně široce diskutovány odbornou veřejností a publikovány (8). Na evropské úrovni se první diskuze odehrála na 35. Evropském cytologickém kongresu v Lisabonu v roce 2009, kde se jen část členů pracovní skupiny přikláněla k názoru na kompletní převzetí Bethesda klasifikace, jiní preferovali pouze provedení korelace mezi navrhovaným systémem hodnocení a lokálně používanou terminologií nebo národními klasifikacemi (9). Bylo zde konstatováno, že v Evropě s výjimkou Velké Británie a Itálie chybí standardizované národní terminologie. Přehled vybraných klasifikací je uveden v tabulce (tab. 1) (6,7,10-13).
Table 1. Porovnání systémů hodnocení tenkojehlové aspirační cytologie štítné žlázy. 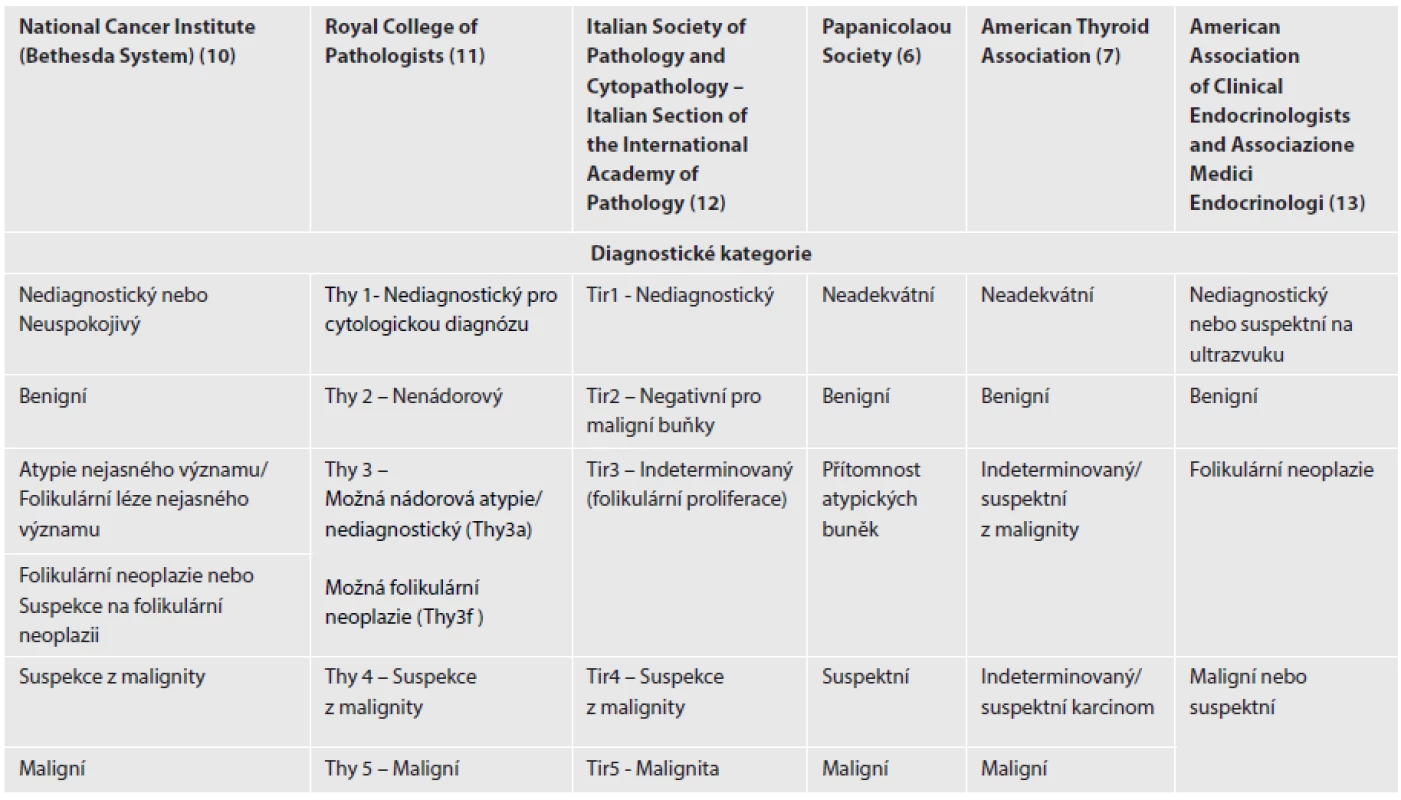
Výsledkem snah o unifikaci cytologických nálezů se stal šestistupňový mezinárodní standardizovaný systém „Bethesda System for Reporting Thyroid Cytopathology“ (BSRTC), který je mezi cytology známý jako Bethesda (klasifikace) 2010. Kategorie systému s přesným vymezením zařazovaných lézí a s komentáři byly postupně představeny cytologům i klinikům a publikovány jak knižně, tak formou vědeckých článků na mezinárodní i národní úrovni (10,14-16).
CHARAKTERISTIKA BETHESDA KLASIFIKACE 2010
BSRTC představuje novou kategorizaci cytologických nálezů, která zahrnuje celkem 6 diagnostických kategorií uvedených v tab. 2. Z klinického hlediska je důležité, že nová klasifikace vychází z pravděpodobnostního přístupu a pro jednotlivé kategorie uvádí rizika malignity a zároveň doporučuje algoritmy dalšího postupu v péči o pacienta s onemocněním štítné žlázy (tab. 2). Významnou novinkou BSRTC bylo rozčlenění původně u nás užívané „indeterminované kategorie“ do 3 skupin (AUS/FLUS; SFN/FN; suspektní z malignity), které se liší v cytomorfologii, v riziku malignity a v doporučení pro další klinický postup. Dále byla nově vytýčena kritéria pro adekvátní vzorek, který musí obsahovat nejméně 6 skupin dobře identifikovatelných folikulárních buněk, přičemž každá skupina se skládá minimálně z 10 buněk. Znamená to tedy, že došlo ke zpřísnění kritérií (dříve požadavek na minimálně 5 skupin po 5 folikulárních buňkách). Výjimkou, kdy není vyžadován minimální počet folikulárních buněk ve vzorku, je přítomnost atypických folikulárních buněk, přítomnost převahy koloidu a zánětlivých buněk (8,10,14).
Table 2. Standardní mezinárodní klasifikace FNAC štítné žlázy – Bethesda 2010. 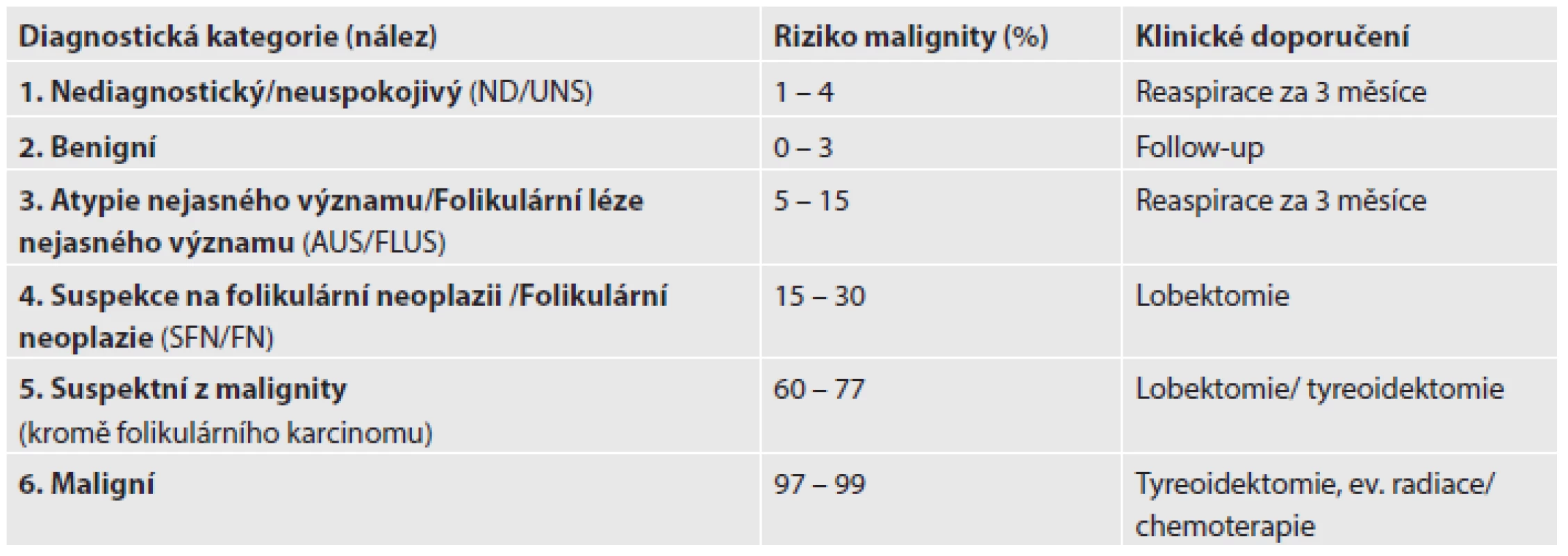
BSRTC nebyla zvláště v Evropě přijata bez výhrad ve všech zemích a všemi pracovišti. Jedním z důvodů k váhavému přijetí nové nomenklatury v některých evropských zemích je začlenění poněkud striktních amerických medicínských a legislativních požadavků do klasifikačních kritérií, což se projevilo např. v požadavcích na reprezentativnost vzorku. Používání Bethesda 2010 je nadále předmětem diskuze na evropských i amerických cytologických kongresech. Na 36. Evropském cytologickém kongresu v Istanbulu (září 2011) byla BSRTC věnována plenární sekce. V jejích závěrech se konstatovalo, že v Evropě nadále existuje nejednotnost v systému diagnostických kategorií od plného přijetí systému Bethesda ve Francii, Řecku, Portugalsku, Turecku a Finsku až po její kompletní odmítnutí (17-19). Dosud používané 5-ti stupňové národní systémy klasifikace cytologií ve štítné žláze (Thy1-5; Tir 1-5) ve Velké Británii a Itálii jsou postupně vylepšovány (tab. 1). Ve Velké Británii nedávno doporučili rozdělení indeterminované kategorie (Thy3) na podkategorie Thy3a (atypické léze) a Thy3b (folikulární proliferace), což by mělo zlepšit další výběr pacientů k chirurgické intervenci (11,20). V Itálii se podobná úprava právě připravuje (12,21).
Na 37. Evropském cytologickém kongresu v Cavtatu v roce 2012 byl zorganizován vědeckou sekcí EFCS (European Federation of Cytology Societies) workshop, kde přední evropští experti diagnostikovali vybrané případy. Výsledky workshopu byly prezentovány na následné sekci a vyvolaly širokou diskuzi, která ukázala, že nejen cytologická, ale také bioptická diagnostika lézí štítné žlázy má svá úskalí. Na kongresu International Academy of Cytology v květnu 2013 v Paříži byla plenární sekce věnována personalizaci medicíny v diagnostice a léčbě nádorů štítné žlázy. Bethesda systém byl tématem ranní sekce Meet the Expert, která ukázala na postupné přijetí tohoto systému širokou odbornou veřejností.
PŘEDNOSTI A NEDOSTATKY BSRTC VYPLÝVAJÍCÍ Z KLINICKÉ PRAXE
Bethesda klasifikace jako nová standardizovaná nomenklatura tyreoidální cytopatologie je implementována do rutinní praxe od roku 2010, avšak některá především zahraniční pracoviště mají delší než pětileté zkušenosti s užíváním systému (22-25). Praxe potvrdila přednosti a odhalila nedostatky hodnotících schémat.
Předností BSRTC je zejména vytvoření robustních diagnostických kritérií se sjednocenou terminologií a stanovením jednotného algoritmu klinického postupu. Bethesda klasifikace 2010 významně přispěla ke zlepšení reprodukovatelnosti cytopatologických nálezů a jejich výpovědní hodnoty pro kliniky, což vedlo ke snížení počtu operací štítné žlázy (26). Účinnost tohoto systému klasifikace potvrdila i meta-analytická studie, která zkoumala vztah BSRTC a klinického přístupu a rizika malignity po zavedení standardizovaného hodnocení a která ukázala, že problémy přetrvávají pouze v kategorii AUS/FLUS (vysoký počet nediagnostických případů, vysoká variabilita rizika malignity) (27). V neposlední řadě BSRTC usnadnila srovnávání výsledků v oblasti tyreoidální cytopatologie v národním i v mezinárodním měřítku. Vymezení folikulárních lézí je však bezesporu nejlepším rysem nového systému.
Nedostatkem BSRTC je zejména značná intra - a interpersonální variabilita. Čtyři experti ve studii 107 případů dosáhli shody pouze v 72 případech (67,3 %). Nejvíce rozdílů bylo v kategorii AUS/FLUS, kde z původních 9 případů pouze 2 byly takto diagnostikovány ostatními panelisty. Konsenzus pro maligní léze byl 80 % a pro benigní kategorii 73 % (18). V jiné studii byl zjištěn intrapersonální nesouhlas mezi AUS/FLUS a folikulární neoplazií a lézemi suspektními z malignity a maligními, interpersonální nesouhlas byl prokázán mezi AUS/FLUS a suspektními lézemi. Na základě výsledků autoři navrhli sloučení kategorií „AUS/FLUS“ a „folikulární neoplazie“ a kategorií „suspektní z malignity“ a „maligní“ (28).
Dalším předmětem kritiky systému Bethesda 2010 jsou kritéria pro reprezentativnost vzorku, kdy striktní požadavky výrazně zvyšují počet reaspirací. Problémem zůstávají cystické papilární karcinomy, které by při diagnostické kategorii cysta zůstaly nediagnostikovány. Papilární karcinom (PTC) může být v BSRTC zařazen do 5 kategorií v závislosti na reprezentativnosti vzorku. Vzorek z cystické léze bez přítomnosti epitelií odpovídá kategorii „ND“. Suboptimálně aspirované nádory jsou zařazovány do skupiny AUS/FLUS. Reprezentativní vzorky pak spadají do kategorií „suspektní z malignity“ či „malignita“ (29). Folikulární varianta papilárního karcinomu je pak navíc mnohdy diagnostikována v kategorii „folikulární neoplazie“ (FN) (30).
Navrhovaná opatření k překonání výše uvedených nedostatků kladou důraz zejména na kontinuální vzdělávání, využívání reprezentativního edukačního materiálu a cytohistologických korelací a na zvyšování praktických zkušeností a dovedností při odběru materiálu a manipulaci s ním (31,32).
Kategorie AUS/FLUS je nejvíce spornou a diskutovanou skupinou v nové mezinárodní klasifikaci. Je to jedna z indeterminovaných diagnostických kategorií BSRTC, která byla vymezena pro případy, které nemohou být interpretovány jako benigní pro přítomnost zvláštních cytologických a architektonických atypií a které zároveň nesplňují jednoznačná kritéria pro kategorie FN/SFN a SM. Je to značně heterogenní skupina na jedné straně zahrnující benigní léze s hraniční celularitou, na druhé straně skutečné atypie ze suboptimálně punktované malignity, což ovlivňuje výsledné riziko malignity a znesnadňuje klinický postup. Objevují se proto návrhy na modifikaci kategorie AUS/FLUS na základě subklasifikace, při níž oddělíme léze podle nízkého a vysokého rizika malignity. Riziko malignity u AUS/FLUS lézí s jadernými rysy papilárního karcinomu je významně vyšší než u lézí obsahujících onkocyty nebo se vyznačujících architektonickými atypiemi (29,33-35). Histologická diagnoza papilárního karcinomu byla u cytologického nálezu FLUS zjištěna v 73,3 %, z čehož 57,1 % představovala folikulární varianta papilárního karcinomu. Naopak histologická malignita (folikulární karcinom) u AUS/FLUS s architektonickými atypiemi dosahovala pouze 21,1 % (36). Přítomnost onkocytů výrazněji zvyšuje zastoupení kategorií AUS/FLUS a FN/SFN i výskyt malignit v těchto skupinách (37). Většina studií týkajících se BSRTC se dosud zaměřovala na diagnostické (zejména indeterminované) kategorie, jejich riziko malignity a klinický přístup u dospělých pacientů (29,33-36). Pouze Smith et al. analyzovali uplatnění BSRTC u dětí a riziko malignity v AUS/FLUS a dalších indeterminovaných kategoriích (38). Na základě cytohistologické korelace prokázali větší zastoupení malignit v těchto skupinách než u dospělých a nutnost cytologické subklasifikace kategorie AUS/FLUS. Subklasifikace kategorie AUS/FLUS by tak mohla zlepšit výběr pacientů pro chirurgickou intervenci (38).
Ve většině publikovaných studií je zmiňována tendence k nadužívání kategorie AUS/FLUS nad doporučených 7 % z celkového počtu provedených vyšetření. Rozpětí procentuálního zastoupení AUS/FLUS ve vybraných studiích je uvedeno v tabulce č. 3, některé studie dosáhly až 17,8 % (22-24,34,39-43). Naopak Mondal et al. v nedávno zveřejněné práci referují v souboru 1020 FNAs pouze 1% frekvenci diagnózy AUS/FLUS a zdůvodňují to skutečností, že si cytologové sami pod sonografickou kontrolou odebírají adekvátní materiál, který umožňuje přesnější diagnostické zařazení vzorků. V této studii bylo současně prokázáno vysoké zastoupení benigních diagnóz než je běžně v BSRTC obvyklé (87,5 %) (44).
Table 3. Procentuelní zastoupení AUS/FLUS: výsledky vybraných studií užívajících Bethesda systém. 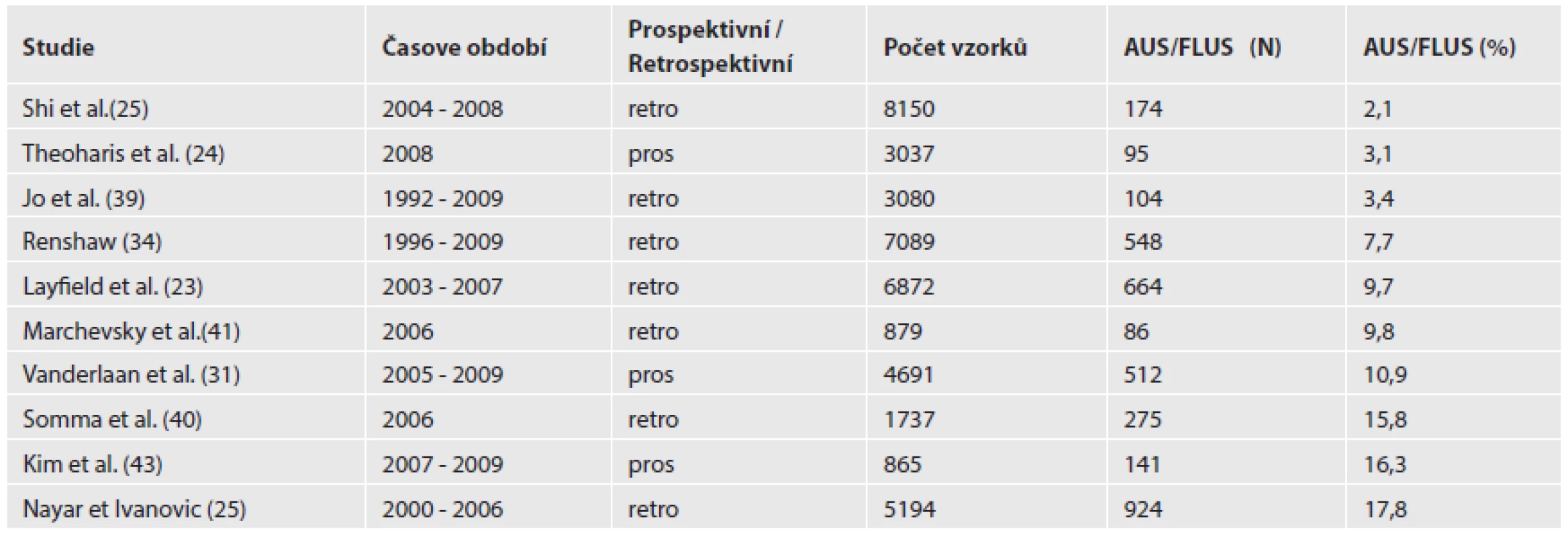
N - počet AUS/FLUS diagnóz; % - procentuální zastoupení AUS/FLUS diagnóz; pros -prospektivní; retro - retrospektivní Bethesda klasifikace vychází především z cytomorfologie a další možnosti jejího zpřesňování v tomto ohledu jsou již pravděpodobně vyčerpány. Je jisté, že je nutné hledat další způsoby v podobě proteomické a molekulární analýzy buněk. O těchto možnostech se současná BRSTC vůbec nezmiňuje, ačkoliv diagnostické i prediktivní markery nádorů štítné žlázy jsou známy. Hlavním úkolem pro další rozvoj klinického uplatnění BRSTC je zavedení doplňkových diagnostických testů aplikovatelných na FNAC vzorcích do rutinní praxe za účelem zpřesnění diagnostiky, resp. odhalení malignity. Již řadu let se v tyreoidální diagnostice rutinně užívají imunohistochemicky detekovatelné markery jako tyreoidální transkripční faktor-1 (TTF-1) k potvrzení původu léze ze štítné žlázy, kalcitonin při podezření na medulární karcinom, parathormon k potvrzení původu léze z příštítných tělísek či dipeptidyl peptidáza IV (DPPIV) a galectin-3 jako markery malignity (45-48). Další možné využití doplňkových imunohistochemických a molekulárně biologických metod je pro odhady agresivity maligních nádorů. Na základě samotné Bethesda klasifikace není možné predikovat prognózu u malignit. VanderLaan et al. (2012) předpokládali, že agresivita PTC stoupá v závislosti na Bethesda kategorii III-VI (III, IV – low-risk; V, VI – high risk) (49). Vzhledem k tomu, že většina PTC cytologicky zařazených do kategorie AUS/FLUS a FN/SFN byly folikulární varianty papilárních karcinomů, které mají všeobecně příznivější prognózu, nepotvrdila se prediktivní role jednotlivých kategorií BSRTC (50).
V současné době se pozornost cytologů soustřeďuje na možnost využití molekulární diagnostiky. Panel obsahující mutace BRAF a RAS a chromozomální přestavby RET/PTC a PAX8/PPARγ byl úspěšně testován na cytologických vzorcích s indeterminovaným morfologickým výsledkem. Sensitivita vyšetření dosahla 80 % oproti 44 % při použití pouze morfologie (51). Stejná skupina vědců nyní opublikovala výsledky panelu ThyroSeq, který detekuje 284 mutaci ve 12 nádorových genech. Nejčastejší detekované mutace po BRAF a RAS byly PIK3CA, TP53, TSHR, PTEN, GNAS, CTNNB1 and RET (52). 30 – 40 % dobře diferencovaných karcinomů štítné žlázy však neobsahuje žádnou z dosud známých mutací (53). Na druhou stranu BRAF pozitivita má prognostický význam a znamená zvýšené riziko metastazování a recidivy choroby (53). Klasifikátor genové exprese Afirma byl studován multicentrickou studií a je komerčně dostupný. Metoda je postavena na genech typických pro benigní léze (53,54). Použití genových panelů je některými experty doporučováno (53,55), vědecké společnosti zatím zaujímají konzervativnějsí přístup (56).
Další cestou je hledání možností, jak zvýšit diagnostickou výtěžnost zejména u případů, kde je indikováno opakovat FNAC. Alternativně k tenkojehlové reaspiraci se v poslední době začíná doporučovat biopsie tlustou jehlou (core needle biopsy) (CNB). Mnohé reference ukazují na některé její přednosti. Jednak vede ke zvýšení počtu diagnostických odběrů (ve srovnání s opakovanou FNA při dříve nejasném výsledku FNA), jednak zvyšuje senzitivitu pro malignitu a umožňuje lépe aplikaci doplňkových diagnostických, prognostických a prediktivních imunohistochemických a molekulárních metod. Nepřináší však žádné zlepšení v diagnostice folikulárních lézí (57-59).
ZÁVĚR
Bethesda systém přinesl jednotnou klasifikaci lézí štítné žlázy: vedle diagnostických kritérií obsahuje i doporučený klinický postup. Klasifikace zpřísnila kriterium pro diagnostický vzorek. Zavedení Bethesda systému klasifikace tyreoidálních cytologií do praxe potvrdilo přednosti a odhalilo nedostatky tohoto hodnocení. Velkým přínosem je sjednocení systému hodnocení na mezinárodní úrovni a zavedení jednotné terminologie. Kategorie AUS/FLUS je heterogenní a nejvíce diskutována v odborných kruzích. Na morfologické úrovni se zdají možnosti dalšího zlepšování tohoto systému vyčerpány. Bethesda klasifikace 2010 však neobsahuje začlenění prognostických a prediktivních markerů a molekulární analýzu, které představují slibnou platformu pro další zlepšování tyreoidální cytodiagnostiky.
Poděkování
Práce byla podpořena projektem Program rozvoje vědních oborů Karlovy Univerzity (projekt P36).
Adresa pro korespondenci:
Doc. MUDr. Marie Ludvíková, Ph.D.
Ústav biologie LF UK Plzeň
Karlovarská 48
323 01 Plzeň
Tel: +420 377 593 270
e-mail: ludvikova.m@email.cz; Marie.Ludvikova@lfp.cuni.cz
Sources
1. Čáp J, Ryška A. Aspirační cytologie štítné žlázy. NUCLEUS HK; 2003 : 31-36; 86-102.
2. Fonseca E, Sobrinho-Simoes M. Diagnostic problems in differentiated carcinomas of the thyroid. Pathol Res Pract 1995; 191(4): 318-331.
3. Poller DN, Ibrahim AK, Cummings MH, Mikel JJ, Boote D, Perry M. Fine-needle aspiration of the thyroid. Cancer 2000; 90(4): 239-244.
4. Yoder BJ, Redman R, Massoll NA. Validation of a five-tier cytodiagnostic system for thyroid fine needle aspiration biopsies using cytohistologic correlation. Thyroid 2006; 16 : 781-786.
5. Bongiovanni M, Krane JF, Cibas ES, Faquin WC. The atypical thyroid fine-needle aspiration: past, present, and future. Cancer Cytopathol 2012; 120(2): 73-86.
6. Guidelines of the Papanicolaou Society of Cytopathology for fine-needle aspiration procedure and reporting. The Papanicolaou society of cytopathology task force on standards of practice. Diagn Cytopathol 1997; 17 : 239-247.
7. Cooper DS, Doherty GM, Haugen BR, et al. American Thyroid Association Guidelines Taskforce. Management guidelines for patiens with thyroid nodules and differentiated cancer. Thyroid 2006; 16(2): 109-142.
8. Baloch ZW, LiVolsi VA, Asa SL, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: a synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of Science Conference. Diagn Cytopathol 2008; 36 : 425-437.
9. Kocjan G, Cochand-Priollet B, de Agustin PP, et al. Diagnostic terminology for reporting thyroid fine needle aspiration cytology: European Federation of Cytology Societies thyroid working party symposium, Lisbon 2009. Cytopathology 2010; 21 : 86-89.
10. Cibas ES, Ali SZ. The Bethesda System for reporting thyroid cytopathology. Am J Clin Pathol 2009; 132(5): 658-665.
11. Cross PA, Chandra A, Giles T, Johnson S, Kocjan G, Poller D, Stephenson T. Guidance in the reporting of thyroid cytology specimens. Royal College of Pathologists, November 2009.
12. Fadda G, Basolo F, Bondi A, et al. Cytological classification of thyroid nodules: proposal of the SIAPEC-IAP Italian Consensus Working Group. Pathologica 2010; 102 : 405-408.
13. Gharib H, Papini E, Valcavi R, et al. AACE/AME Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. Endocr Pract 2006; 12(1): 63-102.
14. Ali ZS, Cibas ES. The Bethesda System for Reporting Thyroid Cytopathology. New York, Springer, 2010.
15. Dušková J. Nový systém pro sjednocené hodnocení tenkojehlových aspiračních biopsií štítné žlázy – Bethesda 2010. Cesk Patol 2011; 47(1): 8-14.
16. Dušková J. Nový systém mezinárodně sjednoceného hodnocení tenkojehlových aspiračních biopsií štítné žlázy: Bethesda klasifikace 2010. DMEV 2010; 13(4), 191-195.
17. Arola J, Kholová I, Timonen T, Krogerus L. Reporting of thyroid fine needle samples is changing in Finland--the Bethesda system in thyroid cytology. Duodecim 2010; 126(20): 2449-2453.
18. Cochand-Priollet B, Schmitt FC, Tötsch M, Vielh P. The Bethesda terminology for reporting thyroid cytopathology: from theory to practice in Europe. Acta Cytol 2011; 55(6): 507-511.
19. Cochand-Priollet B, Vielh P, Royer B, Belleannée G, Collet JF, Goubin-Versini I, Leteurtre E. Sous l’égide de la Société française de cytologie clinique. Ann Pathol 2012; 32(3): 177-183
20. British Thyroid Association, Royal College of Physicians. Guidelines for the management of thyroid cancer (Perros P, ed) 2nd edition. Report of the Thyroid Cancer Guidelines Update Group. London: Royal College of Physicians and MacMillan Cancer Support; 2007.
21. Pagni F, Prada M, Goffredo P, Isimbaldi G, Crippa S, Di Bella C, Leone BE. „Indeterminate for malignancy“ (Tir3/Thy3 in the Italian and British systems for clasification) thyroid fine needle aspiration (FNA) cytology reporting: morphological criteria and clinical impact. Cytopathology 2014. In press.
22. Nayar R, Ivanovic M. The indeterminate thyroid fine-needle aspiration: experience from an academic center using terminology similar to that proposed in the 2007 National Cancer Institute Thyroid Fine Needle Aspiration State of the Science Conference. Cancer Cytopathol 2009; 117(3): 195-202.
23. Layfield LJ, Morton MJ, Cramer HM, Hirschowitz S. Implications of the proposed thyroid fine-needle aspiration category of “follicular lesion of undetermined significance”: A five-year multi-institutional analysis. Diagn Cytopathol 2009; 37(10): 710-714.
24. Theoharis CG, Schofield KM, Hammers L, Udelsman R, Chhieng DC. The Bethesda thyroid fine-needle aspiration classification system: year 1 at an academic institution. Thyroid 2009; 19(11): 1215-1223.
25. Shi Y, Ding X, Klein M, Sugrue C, Matano S, Edelman M, Wasserman P. Thyroid fine-needle aspiration with atypia of undetermined significance: a necessary or optional category? Cancer Cytopathol 2009; 117(5): 298-304.
26. Hambleton C, Kandil E. Appropriate and accurate diagnosis of thyroid nodules: a review of thyroid fine-needle aspiration. Int J Clin Exp Med 2013; 6(6): 413-422.
27. Bongiovanni M, Spitale A, Faquin WC, Mazzucchelli L, Baloch ZW. The Bethesda system for reporting thyroid cytopathology: a meta-analysis. Acta Cytologica 2012; 56 : 333-339.
28. Walts AE, Bose S, Fan X, et al. A simplified Bethesda system for reporting thyroid cytopathology using only four categories improves intra - and inter-observer diagnostic agreement and provides non-overlapping estimates of malignancy risks. Diagn Cytopathology 2012; 40: E62-E68.
29. Singh RS, Wang HH. Eliminating the “atypia of undetermined significance/follicular lesion of undetermined significance” category from the Bethesda system for reporting thyroid cytopathology. Am J Clin Pathol 2011; 136 : 896-902.
30. Kurian EM, Dawlett M, Wang J, Gong Y, Guo M. The triage efficacy of fine needle aspiration biopsy for follicular variant of papillary thyroid carcinoma using the Bethesda reporting guidelines. Diagn Cytopathology 2012; 40 Suppl 1: E69-73.
31. VanderLaan PA, Krane JK, Cibas ES. Atypia of undetermined significance in thyroid fine-needle aspiration: characterizing cytopathologist practice patterns. Mod Pathol 2011; 24 (1 suppl): 107A.
32. Jing X, Knoepp SM, Roh MH et al. Group consensus review minimizes the diagnosis of “follicular lesion of undetermined significance” and improves cytohistologic concordance. Diagn Cytopathol 2012; 40(12): 1037-1042.
33. VanderLaan PA, Marqusee E, Krane JF. Usefulness of diagnostic qualifiers for thyroid fine-needle aspirations with atypia of undetermined significance. Am J Clin Pathol 2011; 136(4): 572-577.
34. Renshaw AA. Should “atypical follicular cells” in thyroid fine-needle aspirates be subclassified? Cancer Cytopathol 2010; 118 : 186-189.
35. Önder S, Firat P, Ates D. The Bethesda system for reporting thyroid cytopathology: an institutional experience of the outcome of indeterminate cytegories. Cytopathology 2014; 25(3); 177-184.
36. Walts AE, Mirocha J, Bose S. Follicular lesion of undetermined significance in thyroid FNA revisited. Diagn Cytopathol 2014; 42(1): 18-22.
37. Yazgan A, Balci S, Dincer N, et al. Hurthle cell presence alters the distribution and outcome of categories in the Bethesda system for reporting thyroid cytopathology. Cytopathology 2014; 25(3); 185-189.
38. Smith M, Pantanowitz L, Khalbuss WE, Benkovich VA, Monaco SE. Indeterminate pediatric thyroid fine needle aspirations: a study of 68 cases. Acta Cytol 2013; 57 : 341-348.
39. Jo VY, Stelow EB, Dustin SM, Hanley KZ. Malignancy risk for fine-needle aspiration of thyroid lesions according to the Bethesda System for Reporting Thyroid Cytopathology. Am J Clin Pathol 2010; 134(3): 450-456.
40. Somma J, Schlecht NF, Fink D, Khader SN, Smith RV, Cajigas A. Thyroid fine needle aspiration cytology: follicular lesions and the gray zone. Acta Cytol 2010; 54(2): 123-131.
41. Marchevsky AM, Walts AE, Bose S, et al. Evidence-based evaluation of the risks of malignancy predicted by thyroid fine-needle aspiration biopsies. Diagn Cytopathol 2010; 38(4): 252-259.
42. VanderLaan PA, Marqusee E, Krane JF. Clinical outcome for atypia of undetermined significance in thyroid fine-needle aspirations: should repeated FNA be the preferred initial approach? Am J Clin Pathol 2011; 135(5): 770-775.
43. Kim SK, Hwang TS, Yoo YB, et al. Surgical results of thyroid nodules according to a management guideline based on the BRAF V600E mutation status. J Clin Endocrinol Metab 2011; 96 : 658-664.
44. Mondal SK, Sinha S, Basak B, Roy DN, Sinha SK. The Bethesda system for reporting ttyroid fine needle aspirates: A cytologic study with histologic follow-up. J Cytol 2013; 30(2): 94-99.
45. Absher KJ, Truong LD, Khurana KK, Ramzy I. Parathyroid cytology: avoiding diagnostic pitfalls. Head Neck 2002; 24 : 157-164.
46. Bhanot P, Yang J, Schnadig VJ, et al. Role of FNA cytology and immunochemistry in the diagnosis and management of medullary thyroid carcinom: report of six cases and review of the literature. Diagn Cytopathol 2007; 35 : 285-292.
47. Bartolazzi A, Orlandi F, Saggiorato E, et al. Galectin-3-expression analysis in the surgical selection of follicular thyroid nodules with indeterminate fine-needle aspiration cytology: a prospective multicentre study. Lancet Oncol 2008; 9 : 543-549.
48. Kholová I, Ryška A, Ludvíková M, Čáp J, Pecen L. Dipeptidyl peptidase IV expression in thyroid cytology: retrospective histologically confirmed study. Cytopathology 2003; 14(1): 27-31.
49. VanderLaan PA, Marqusee E, Krane JF. Features associated with locoregional spread of papillary carcinoma correlate with diagnostic category in the Bethesda System for reporting thyroid cytopathology. Cancer Cytopathol 2012; 120(4): 245-253.
50. Kleiman DA, Beninato T, Soni A, Shou Y, Zarnegar R, Fahey TJ. Does Bethesda Category Predict Aggressive Features in Malignant Thyroid Nodules? Ann Surg Oncol 2013; 20(11): 3484-3490.
51. Nikiforov YE, Steward DL, Robinson-Smith TM, et al. Molecular testing for mutations in improving the fine-needle aspiration diagnosis of thyroid nodules. J Clin Endocrinol Metab 2009; 94(6): 2092-2098.
52. Nikiforova MN, Wald AI, Roy S, Durso MB, Nikiforov YE. Targeted next-generation sequencing panel (ThyroSeq) for detection of mutations in thyroid cancer. J Clin Endocrinol Metab 2013; 98(11): E 1852-1860.
53. Xing M, Haugen BR, Schlumberger M. Progress in molecular-based management of differentiated thyroid cancer. Lancet 2013; 381(9871): 1058-1069.
54. Alexander EK, Kennedy GC, Baloch ZW, et al. Preoperative diagnosis of benign thyroid nodules with indeterminate cytology. N Engl J Med 2012; 367(8): 705-715.
55. Ali SZ, Fish SA, Lanman R, Randolph GW, Sosa JA. Use of the afirma® gene expression classifier for preoperative identification of benign thyroid nodules with indeterminate fine needle aspiration cytopathology. PLoS Curr. In press 2013.
56. Hodak SP, Rosenthal DS. American Thyroid Association Clinical Affairs Committee. Information for clinicians: commercially available molecular diagnosis testing in the evaluation of thyroid nodule fine-needle aspiration specimens. Thyroid 2013; 23(2): 131-134.
57. Na DG, Kim J, Sung JY, Baek JH, Jung KC, Lee H, Yoo H. Core-needle biopsy is more useful than repeat fine-needle aspiration in thyroid nodules read as nondiagnostic or atypia of undetermined significance by the Bethesda system for reporting thyroid cytopathology. Thyroid 2012; 22(5): 468-474.
58. Hakala T, Kholova I, Sand J, Saaristo R, Kellokumpu-Lehtinen P. A core needle biopsy provides more malignancy-specific results than fine-needle aspiration biopsy in thyroid nodules suspicious for malignancy. J Clin Pathol 2013; 66(12): 1046-1050.
59. Hahn SY, Shin JH, Han BK, Ko EY, Ko ES. Ultrasonography-guided core needle biopsy for the thyroid nodule: does the procedure hold any benefit for the diagnosis when fine-needle aspiration cytology analysis shows inconclusive results? Br J Radiol 2013; 86(1025): 20130007.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2014 Issue 3-
All articles in this issue
- Extraintestinálna oxyuriáza – popis troch prípadov a prehľad literatúry
- Přehled dosavadních zkušeností s mezinárodní klasifikací tenkojehlové aspirační cytologie štítné žlázy Bethesda 2010
- Komplexní přístup v diagnostice lymfomů v praktických příkladech
- Molekulární testování melanocytárních lézí
- Nádory měkkých tkání očima molekulárního patologa
- Intestinální metaplazie žaludku a jícnu: imunohistochemická studie 60 případů včetně porovnání expresí hlenů v normální a zánětlivě změněné sliznici střeva
- Myxoidní varianta epiteloidního maligního mezoteliomu peritonea. Popis případu.
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intestinální metaplazie žaludku a jícnu: imunohistochemická studie 60 případů včetně porovnání expresí hlenů v normální a zánětlivě změněné sliznici střeva
- Nádory měkkých tkání očima molekulárního patologa
- Přehled dosavadních zkušeností s mezinárodní klasifikací tenkojehlové aspirační cytologie štítné žlázy Bethesda 2010
- Komplexní přístup v diagnostice lymfomů v praktických příkladech
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

