-
Medical journals
- Career
Prekancerózní léze vulvy
Authors: P. Škapa 1; Helena Robová 2; Lukáš Rob 2; J. Zámečník 1
Authors‘ workplace: Ústav patologie a molekulární medicíny UK 2. LF a FN Motol, Praha, Česká republika 1; Gynekologicko-porodnická klinika UK 2. LF a FN Motol, Praha, Česká republika 2
Published in: Čes.-slov. Patol., 48, 2012, No. 1, p. 15-21
Category: Reviews Article
Overview
Klasifikace prekancerózních lézí vulvy je založena na konceptu vulvární intraepiteliální neoplázie (VIN) s třístupňovým hodnocením závažnosti dysplastických změn (VIN I, II a III). Na základě histologického vzhledu se dysplázie vulvy dělí na VIN obvyklého typu (u-VIN) a VIN diferencovaného typu (d-VIN), které reprezentují dvě základní cesty patogeneze dlaždicobuněčného karcinomu vulvy. Zatímco je u-VIN etiologicky spojená s infekcí lidským papillomavirem (HPV) a histologickým vzhledem odpovídá cervikální intraepiteliální neoplázii, představuje d-VIN HPV negativní směr karcinogeneze spojený s vulvárními dermatózami typu lichen sclerosus (LS) a lichen simplex chronicus (LSC). u-VIN většinou postihuje relativně mladé ženy s anamnézou dalších prekanceróz děložního hrdla, vagíny nebo vulvy. Typickou pacientkou s d-VIN je naopak postmenopauzální žena bez anamnestických dat ostatních dysplastických lézí dolního ženského pohlavního systému. d-VIN převyšuje u-VIN v tendenci ke stromální invazi a biologickým chováním odpovídá karcinomu in situ (VIN III). Paradoxně se v histologickém vyšetření d-VIN jeví jako nenápadná léze s atypiemi v buňkách bazální vrstvy a s dobře zachovanou diferenciací povrchových partií dlaždicového epitelu, proto bývá při bioptickém vyšetření zaměňována za u-VIN I, LS anebo LSC. Především z důvodu nízké diagnostické reproducibility kategorie u-VIN I, pro pochybnosti o jejím maligním potenciálu a také kvůli problematickému rozlišení u-VIN II a III byla v roce 2004 předložena revidovaná klasifikace VIN, ve které bylo od gradingu prekancerózních lézí vulvy upuštěno - jednotka u-VIN I byla zrušena a u-VIN II a III byly spojeny do jediné kategorie. Termín u-VIN tedy v novém názvosloví reprezentuje high grade prekancerózní léze vulvy asociované s HPV (dříve u-VIN II a III) a d-VIN i nadále odpovídá HPV negativním high grade dyspláziím.
Klíčová slova:
vulvární intraepiteliální neoplázie – VIN obvyklého typu – VIN diferencovaného typu – lichen sclerosus – lichen simplex chronicus – HPVSPOLEČNÝ KONCEPT PREKANCERÓZ DOLNÍHO ŽENSKÉHO POHLAVNÍHO SYSTÉMU
Vulva, vagína a děložní hrdlo tvoří komplexní anatomickou jednotku s obdobnou histologickou stavbou a predispozicí ke stejným rizikovým faktorům pro vznik prekancerózních lézí a karcinomů. V anglosaské literatuře existuje pro výše popsanou anatomickou oblast termín lower female genital tract (LFGT) odpovídající zřídka užívanému českému ekvivalentu dolní ženský pohlavní systém. Základním pojítkem v histologické stavbě orgánů LFGT je přítomnost povrchového dlaždicového epitelu, který je vnímavý k sexuálně přenesené infekci lidským papilomavirem (HPV). Nízce rizikové (LR) HPV typy (např. 6 a 11) jsou příčinou benigních afekcí bez prekancerózního potenciálu charakteru condylomata acuminata nebo plochých kondylomatózních lézí, zatímco vysoce rizikové (HR) typy (např. 16 a 18) mohou za určitých podmínek vyvolat sekvenci dysplastických změn směřujících až k invazivnímu dlaždicobuněčnému karcinomu (SCC) (1). Klinicky důležitou vlastností HPV pozitivních prekanceróz a karcinomů LFGT je jejich multicentrický výskyt nejen v rámci jednotlivého orgánu, ale i v rozsahu celého LFGT (včetně oblasti anu), kde se mohou v libovolných kombinacích rozvíjet simultánně nebo sukcesivně (2,3). Tento jev je popisován termínem multicentrická neoplázie dolního ženského pohlavního systému a v širším kontextu zahrnuje nejen dlaždicobuněčné léze LFGT, ale i glandulární dysplastické změny a invazivní adenokarcinomy endocervikální části děložního hrdla. Určitou výjimku v konceptu LFGT představuje pouze vulva, kde se ve významné míře kromě lézí asociovaných s HPV vyskytují i HPV negativní prekancerózy a karcinomy vznikající odlišnou etiopatogenetickou cestou (4–6).
Dysplastické léze dlaždicového epitelu LFGT jsou již tradičně popisovány v konceptu tzv. intraepiteliální neoplázie a dle anatomické lokalizace tedy odpovídají vulvární (VIN), vaginální (VaIN) a cervikální (CIN) intraepiteliální neoplázii. Závažnost dysplastických změn je ve shodě s aktuální WHO klasifikací vyjádřena třístupňovým gradingem (I, II a III) podle vertikálního rozsahu ztráty diferenciace, cytologických atypií a mitotické aktivity (7).
KLASIFIKACE PREKANCERÓZNÍCH LÉZÍ VULVY
Terminologie VIN vytěsnila z histopatologické praxe starší anebo vágně definované diagnostické jednotky charakteru Bowenova choroba, bowenoidní atypie, bowenoidní dysplázie, bowenoidní karcinom in situ, bowenoidní papulóza, erythroplasia de Queyrat a carcinoma in situ simplex. Moderní klasifikace dysplastických lézí vulvy vychází z návrhu International Society for the Study of Vulvovaginal Disease (ISSVD) (8), která byla předložena v roce 1986 a následně akceptována WHO jako diagnostický standard (7). Na rozdíl od CIN a VaIN jsou VIN heterogenní skupinou prekanceróz, které lze na základě jejich histologického vzhledu rozdělit do dvou základních jednotek: VIN obvyklého typu (usual VIN; u-VIN) a VIN diferencovaného (resp. simplexního) typu (differentiated VIN; d-VIN) (7,9). Tyto diagnostické jednotky se liší svými klinicko-patologickými vlastnostmi (tab. 1) a reprezentují dvě základní cesty etiopatogeneze SCC vulvy (obr. 1) (4,5).
Image 1. Grafické znázornění dvou hlavních cest etiopatogeneze SCC vulvy. u-VIN – vulvární intraepiteliální neoplázie obvykleho typu; d-VIN – vulvární intraepiteliální neoplázie diferencovaného typu; LS – lichen sclerosus; LSC – lichen simplex chronicus; SCC – dlaždicobuněčný karcinom; HPV – lidský papillomavirus; HR HPV – vysoce rizikové typy lidského papilomaviru 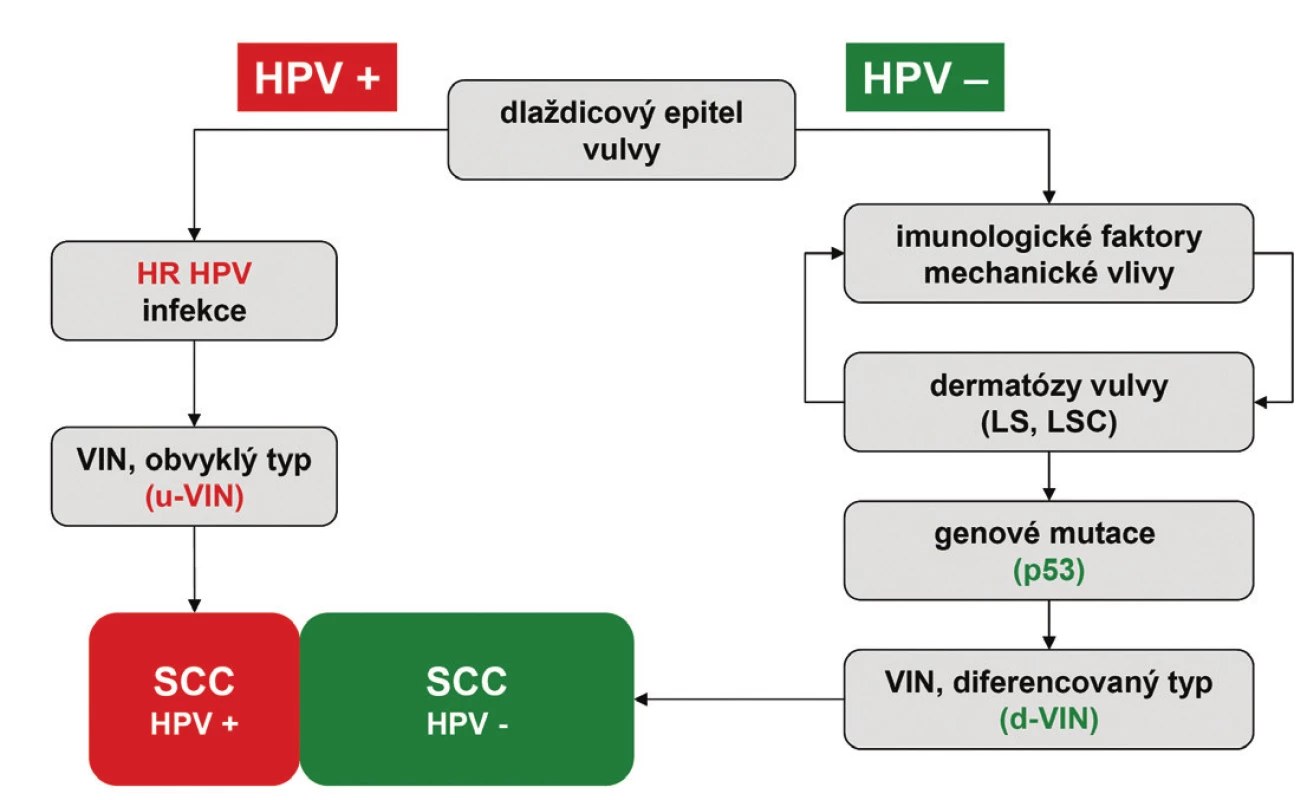
Table 1. Porovnání dvou základních typů vulvárních prekanceróz (u-VIN a d-VIN). 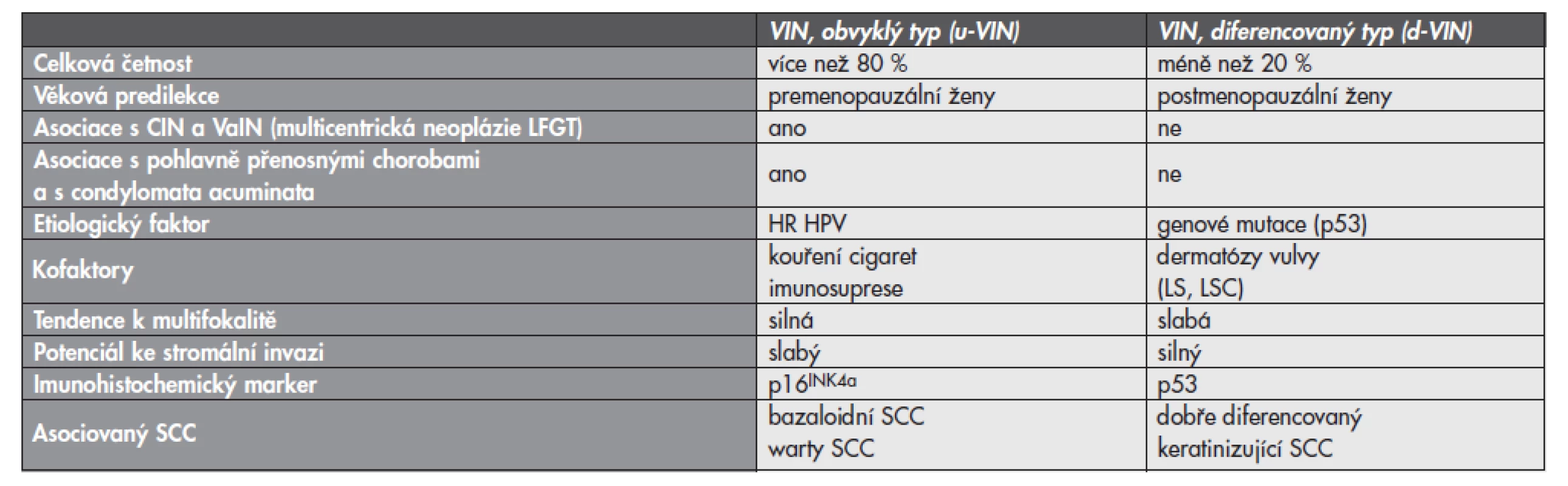
VIN – vulvární intraepiteliální neoplázie; CIN – cervikální intraepiteliální neoplázie; VaIN – vaginální intraepiteliální neoplázie; LFGT – lower female genital tract; HR HPV – high risk typy lidskeho papillomviru; LS – lichen sclerosus; LSC – lichen simplex chronicus; SCC – dlaždicobuněčný karcinom VIN obvyklého typu (u-VIN)
Hlavním etiologickým faktorem vzniku u-VIN je sexuálně přenesená infekce HR HPV (3,10,11). Nejpočetnější rizikovou skupinu proto tvoří relativně mladé ženy premenopauzálního věku, které mají i vyšší riziko vzniku ostatních dysplastických a nádorových procesů LFGT a častější výskyt pohlavních chorob (12). SCC asociované s u-VIN jsou též HPV pozitivní, rozvíjejí se v mladším věku a představují asi 30–40 % všech karcinomů vulvy (12). Histologicky odpovídají bazaloidním a warty variantám SCC (obr. 2).
Na základě histologického obrazu lze rozlišit 3 hlavní podtypy u-VIN: bazaloidní, warty (kondylomatózní) a smíšený (warty/bazaloidní) (tab. 2) (obr. 2) (9). Z praktického hlediska však toto členění postrádá většího významu, protože se od sebe jednotlivé subtypy u-VIN neliší klinickým chováním ani spektrem přítomných HPV typů (9). Identifikace u-VIN II a III jako dysplastické léze je většinou bezproblémová (13), protože u-VIN histologicky připomíná ostatní prekancerózy LFGT charakterizované ztrátou zralosti keratinocytů, cytologickými atypiemi, zvýšenou mitotickou aktivitou a případně známkami HPV infekce. Interpersonální a intrapersonální reproducibilita diagnózy u-VIN I je naopak velmi nízká (13) a bude blíže diskutována níže v souvislosti se změnami v klasifikaci VIN. Při jakýchkoli pochybnostech o diagnóze u-VIN doporučujeme provést imunohistochemický průkaz proteinu p16INK4a, který se jako inhibitor cyklin dependentní kinázy uplatňuje v regulaci buněčného cyklu a bývá imunohistochemicky prokazatelný v dysplastických lézích a karcinomech vulvy asociovaných s HR HPV infekcí (5,14). K interpretaci nálezu ve smyslu p16INK4a pozitivity je nutná silná difuzní jaderná anebo současně jaderná a cytoplazmatická pozitivita, fokální slabé přibarvování cytoplazmy neopravňuje k hodnocení léze jako pozitivní (5,14).
Image 2. Prekancerózní léze vulvy a dlaždicobuněčné karcinomy asociované s HPV infekcí. A – u-VIN III, warty (HE, 40x); B – u-VIN III, warty (HE, 400x); C – SCC, warty (HE, 200x); D – u-VIN III, bazaloidní (HE, 100x); E – u-VIN III, bazaloidní (HE, 400x); F – SCC, bazaloidní (HE, 100x) 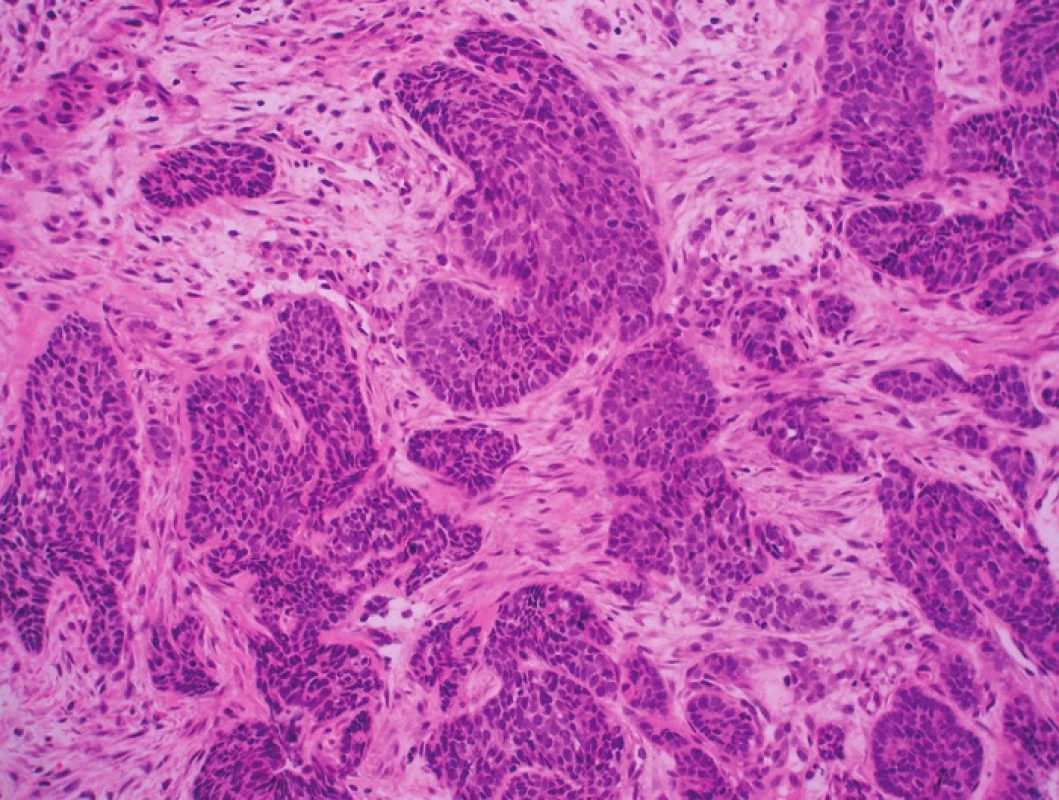
Table 2. Základní histologické charakteristiky prekancerózních lézí vulvy a dalších asociovaných afekcí. 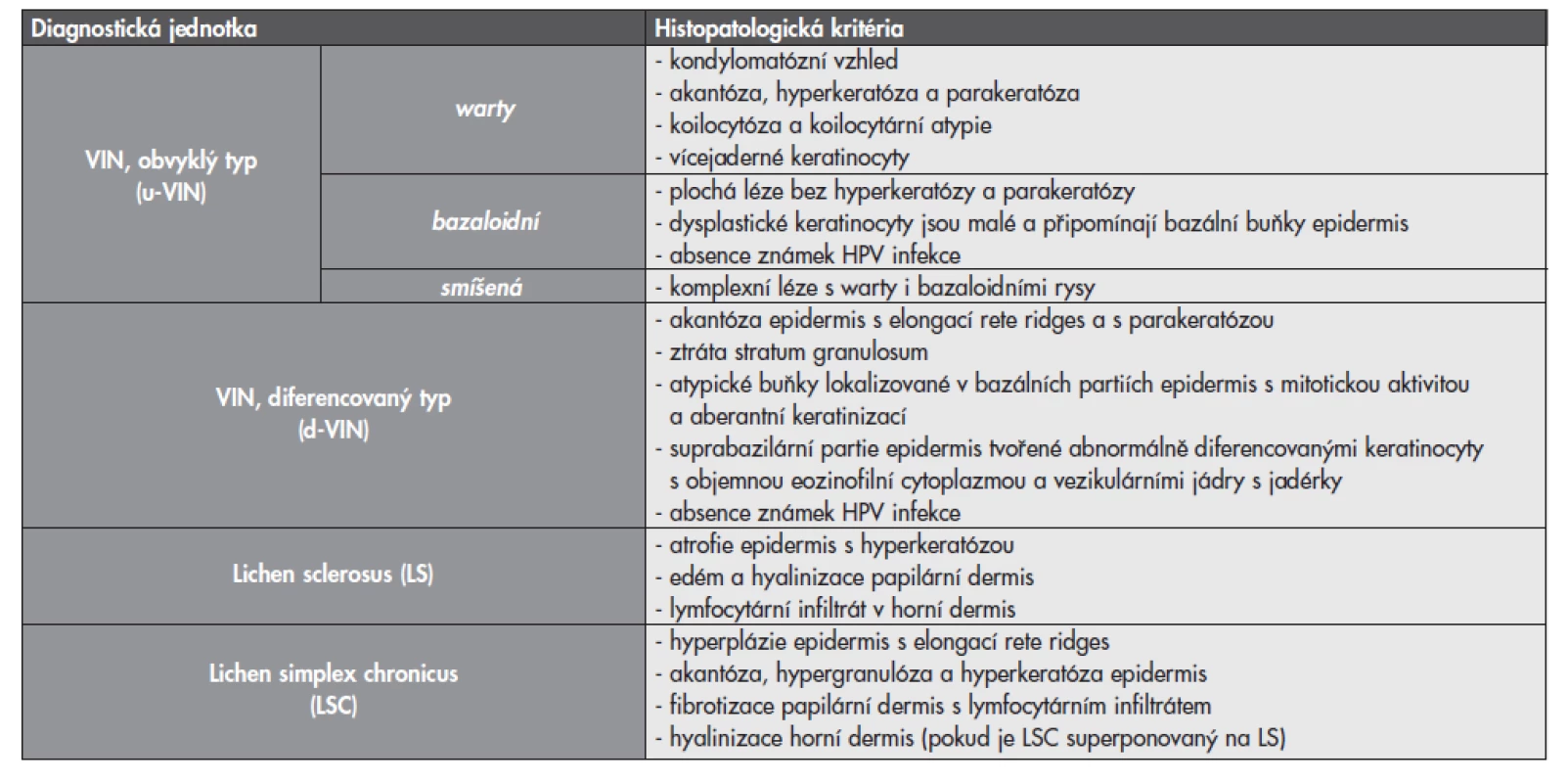
Pagetoidní VIN je vzácná vulvární prekanceróza připomínající Pagetovu chorobu vulvy, která je většinou autorů vnímána jako histologická varianta u-VIN (9). Léze je charakterizovaná přítomností atypických buněk se světlou cytoplazmou, které se intraepiteliálně šíří ve formě jednotlivých buněk anebo buněčných skupin. Diferenciálně diagnostickými rozdíly oproti Pagetově chorobě jsou nepřítomnost intracytoplazmatického mucinu a imunohistochemická negativita GCDFP-15, cytokeratinu 7 a karcinoembryonálního antigenu (CEA) (9).
VIN diferencovaného typu (d-VIN)
Jako samostatná diagnostická jednotka byla d-VIN poprvé popsána už v 60. letech 20. století jako carcinoma in situ simplex, ale do povědomí širší odborné veřejnosti se dostává až v posledních letech. Jde o poměrně vzácnou dysplastickou lézi s frekvencí výskytu kolísající v rozsahu 2–18 % všech prekanceróz vulvy, která postihuje především postmenopauzální ženy a nemá etiopatogenetický vztah k HPV infekci (10,15). Vyvolávající faktory d-VIN nebyly dosud zcela jednoznačně identifikovány, jako nejpravděpodobnější se však jeví genové mutace v terénu vulvárních dermatóz typu lichen sclerosus (LS) a lichen simplex chronicus (LSC), které se rozvíjejí v terénu imunologické predispozice (16). Pruritus způsobený vulvární dermatózou vede k chronické mechanické iritaci vulvy s možností vzniku ulcerací, reaktivní proliferací epitelu a následnému zhoršení vyvolávající vulvární dermatózy. Tento efekt se v literatuře někdy označuje jako itch-scratch cyklus (16). V pokročilé fázi onemocnění bývá jeho následkem většinou LSC, který může být superponován na LS (tab. 2). Termín „dlaždicobuněčná hyperplázie“ používaný dříve v gynekopatologii pro hyperplastické dermatózní procesy vulvy je pouze popisné vyjádření histologického vzhledu epidermis a v naprosté většině případů odpovídá právě nozologické jednotce LSC (17). Ve vulvární dermatóze je při chronické mechanické iritaci vyšší riziko vzniku genových mutací především v tumor supresorovém genu p53 (18). Následkem je rozvoj d-VIN a progrese v keratinizující typ SCC, který bývá většinou dobře diferencovaný, HPV negativní a reprezentuje asi 60–70% všech karcinomů vulvy (16,19). Literární údaje dokládají, že až 2–6 % pacientek s diagnózou LS rozvine SCC vulvy (12).
d-VIN je makroskopicky i histologicky velmi nenápanou lézí, u které nemusí být na první pohled patrné, že se jedná o dysplázii (tab. 2) (obr. 3, 4) (15). Pokročilý stupeň histologické diferenciace a epiteliální maturace ostatně naznačuje již vlastní název této diagnostické jednotky. S relativně klidným histologickým vzhledem d-VIN však ostře kontrastuje její biologické chování, které odpovídá karcinomu in situ. Léze tedy automaticky spadá do kategorie VIN III a grading v pravém slova smyslu s hodnocením rozsahu ztráty vyzrávání, cytologických atypií a mitotické aktivity se proto neprovádí. Pro d-VIN je typický větší invazivní potenciál spojený s kratší intraepiteliální fází a rychlejší progresí do SCC ve srovnání s u-VIN (15).
Pro gynekologa je d-VIN v terénu kožních změn při vulvární dermatóze obtížně identifikovatelná, zvláště pokud se jedná o lézi solitární. Podobný problém čeká i patologa během histologického vyšetření, protože dlaždicový epitel d-VIN směrem k povrchu dostatečně vyzrává a celá léze tak připomíná vulvární dermatózu. Podle našich zkušeností bývá přechod mezi d-VIN a dermatózou náhlý a je charakterizován následujícími histologickými znaky (obr. 3 a obr. 4):
- výskyt cytologických atypií a zvýšená mitotická aktivita v bazální zóně epidermis,
- dyskeratotické změny v bazálních a suprabazilárních zónách epidermis,
- výskyt suprabazilárních keratinocytů s objemnou eozinofilní cytoplazmou a vezikulárními jádry,
- ztráta granulární vrstvy epidermis,
- přechod superficiální hyperkeratózy do parakeratózy.
Image 3. Obr. 3. Nenádorové, prekancerózní a nádorové léze vulvy sdružené v HPV negativní cestě karcinogeneze. A – LS (HE, 100x); B – LSC (HE, 40x); C – pfiechodová zóna mezi LSC a d-VIN (HE, 200x); D – d-VIN (HE, 40x); E – d-VIN (HE, 400x); F – SCC keratinizující (HE, 200x) 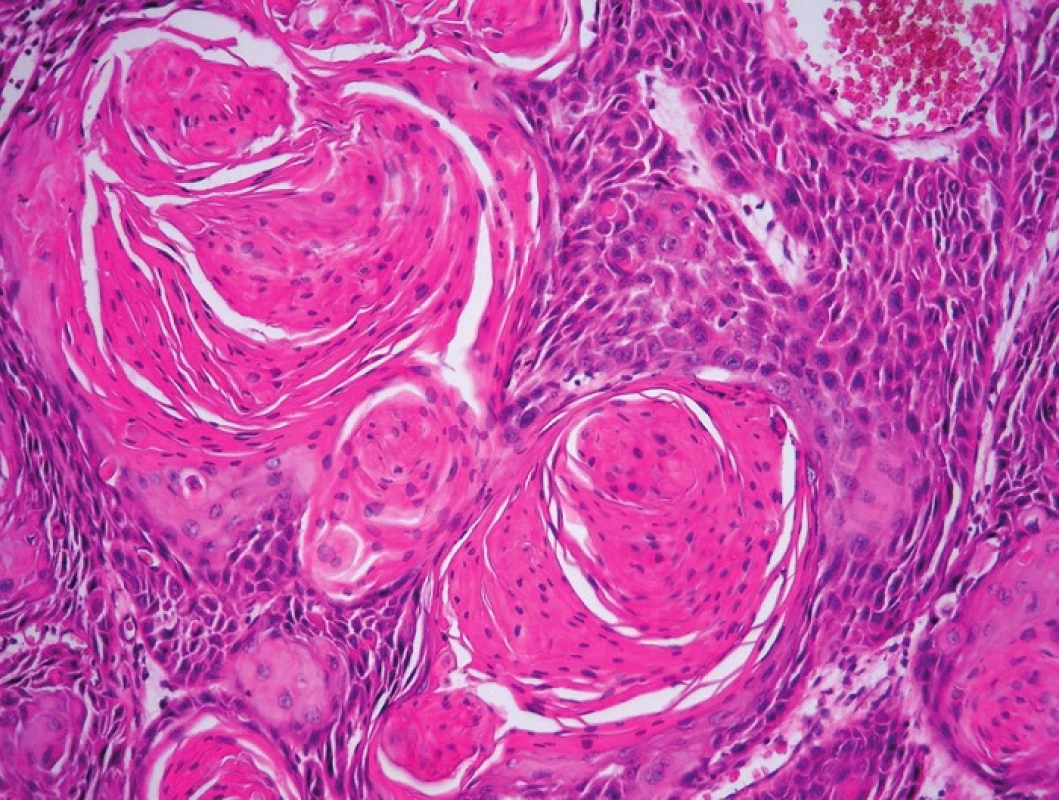
Image 4. Biopsie vulvy zastihující komplexní HPV negativní lézi tvořenou prekancerózou (d-VIN) v přímé kontinuitě s vulvarni dermatózou (LSC) a dlaždicobuněčným karcinomem (SCC). Imunohistochemické vyšetření antigenu p53 demonstruje téměř difuzní pozitivitu jader nádorových buněk v SCC a pozitivitu buněk bazálních vrstev epitelu d-VIN se suprabazilární extenzí. Povšimněte si též silné jaderné pozitivity p53 v bazálních a suprabazilárních partiích LSC, která je v přechodové zóně intenzivnější než pozitivita v d-VIN. Nález příkladem z praxe demonstruje problematickou specificitu imunohistochemického vyšetření p53 pro diagnózu d-VIN (blíže diskutováno v textu). A – kontinuálni přechod LSC – d-VIN – SCC s vyznačením jednotlivých zón (20x); B1 – SCC (HE, 40x), B2 – SCC (p53, 40x); C1 – d-VIN (HE, 100x); C2 – d-VIN (p53, 100x); D1 – přechodová zóna mezi LSC a d-VIN (HE, 100x); D2 – přechodová zóna mezi LSC a d-VIN (p53, 100x) 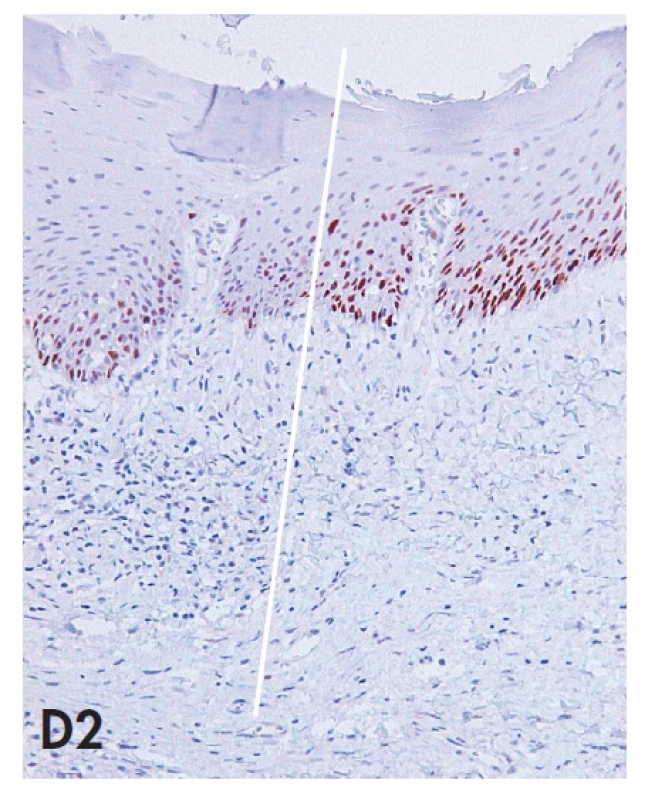
K diagnóze d-VIN je nutná kombinace výše uvedených kritérií, protože žádné z nich není samo o sobě specifické pro d-VIN a mohou se vyskytovat při výraznější iritaci a proliferaci i v dermatózách vulvy. To platí i pro atypie v buňkách bazální vrstvy epitelu, které jsou někdy popisovány ve vulvárních dermatózách a je pro ně vyhrazen termín atypický lichen sclerosus (19,20). Obtížnost diferenciální diagnózy mezi d-VIN a vulvární dermatózou typu LS anebo LSC je tedy zřejmá. Z praktického hlediska doporučujeme patologům zaměřit se při skenovacím prohlížení preparátu především na náhlou transformaci hyperkeratózy v parakeratózu a s tím související ztrátu granulární vrstvy epidermis a tyto suspektní úseky dále důkladně vyšetřit při větším zvětšení s důrazem na morfologické změny v bazálních vrstvách epitelu. V případě diagnostických pochybností lze provést imunohistochemické vyšetření proteinového produktu tumor supresorového genu p53, které bývá v případě mutace genu pozitivní (15,18). Ke správné interpretaci imunohistochemického nálezu je však nutno mít na vědomí, že v bazálních vrstvách epitelu vulvárních dermatóz dochází nejspíše z důvodu oxidačního stresu k přibarvování jader keratinocytů (21) a že p53 pozitivita d-VIN je proto definována suprabazilární extenzí pozitivity a zvýšeným labeling indexem (poměr počtu p53 pozitivních jader k jádrům negativním) často až nad 90 % (15). Specificita a senzitivita imunohistochemického průkazu p53 však není optimální (22), proto je význam tohoto vyšetření některými autory zpochybňován (21). Z naší zkušenosti můžeme potvrdit, že imunohistochemická pozitivita markeru p53 bývá u části d-VIN skutečně variabilní nebo neprůkazná a že p53 pozitivitu lze často pozorovat i v bazálních partiích epitelu vulvárních dermatóz (obr. 4). Při obtížnější diferenciální diagnóze mezi d-VIN a u-VIN lze s úspěchem provést imunohistochemický průkaz proteinu p16INK4a, jehož pozitivita svědčí pro u-VIN a negativita pro d-VIN (5). Materiálně náročnější metodou může být stanovení přítomnosti HR HPV metodou polymerázové řetězové reakce (PCR). Pokud přes veškerou snahu není možno prekancerózu vulvy zařadit ani do jedné ze dvou základních kategorií, doporučujeme lézi klasifikovat jako VIN, blíže nezařazenou (VIN, NOS).
Nesoulad mezi procentuálním zastoupením u-VIN a d-VIN a téměř opačným poměrem četnosti HPV pozitivních a HPV negativních SCC vulvy lze vysvětlit výrazným poddiagnostikováním d-VIN (15). Příčinou je makroskopická i histologická podobnost s dermatózami vulvy, proto je d-VIN často přehlédnuta gynekologem a uniká bioptickému vyšetření nebo je nesprávně klasifikována patologem jako vulvární dermatóza. K nižšímu záchytu d-VIN dále vede i vyšší věk pacientek, který je spojen se sporadickou frekvencí návštěv gynekologa. V neposlední řadě má vliv i vysoký sklon d-VIN ke stromální invazi, což vede ke zkrácení intervalu, kdy je možno lézi klinicky zachytit a biopticky ověřit.
I když je existence d-VIN většinou gynekopatologů v současnosti přijímána, objevují se i názory, které ji zpochybňují jako samostatnou diagnostickou jednotku a považují ji pouze za intraepiteliální šíření simultánně se vyskytujícího SCC (21,23). Proti tomuto tvrzení však svědčí dobře zdokumentovaná pozorování rychlé progrese d-VIN do SCC (24,25).
MODIFIKACE KLASIFIKAČNÍHO SYSTÉMU VULVÁRNÍCH INTRAEPITELIÁLNÍCH NEOPLÁZIÍ
V předchozích odstavcích jsme nastínili etiologickou i histologickou podobnost u-VIN s CIN, nicméně v tomto srovnání existují i určité podstatné rozdíly, které v konečném důsledku vedly ke změně klasifikace vulvárních prekanceróz. Hlavní nesoulad tkví v rozdílu frekvencí low grade dysplázií děložního hrdla a vulvy (CIN I a u-VIN I) (9). CIN I je běžnou skupinou lézí, mezi které se v širším kontextu mohou řadit i HPV indukované změny charakteru plochého kondylomu. Ploché kondylomatózní léze jsou však v oblasti vulvy velmi vzácné a naopak se zde často vyskytuje condyloma acuminatum, které postrádá maligní potenciál a diagnosticky nespadá do kategorie u-VIN I. Naprostou většinu případů u-VIN tedy tvoří high grade dysplastické léze a u-VIN I je v biopsiích vulvy diagnostikována zřídka, často pouze v přímé kontinuitě s u-VIN II a III. Solitárně se vyskytující u-VIN I bez asociace s u-VIN II a III jsou výjimečným nálezem a jejich interpersonální a intrapersonální reproducibilita při histopatologickém vyšetření je velmi nízká (13). Při retrospektivní expertní analýze souboru u-VIN I byla podstatná část těchto lézí překlasifikována a striktní diagnostická kritéria jich splnilo pouze 19 % (26). Další poměrně častou chybou v interpretaci atypií buněk bazální vrstvy epitelu ve vulvární biopsii je záměna u-VIN I s d-VIN anebo s vulvární dermatózou charakteru LS anebo LSC (15). Z důvodu nepřesné histopatologické diagnostiky proto může být v rutinní praxi kategorie u-VIN I tvořena směsí lézí s různým prekancerózním potenciálem, což poněkud snižuje její význam jako samostatné diagnostické jednotky. Dalším problémem v histopatologickém gradingu u-VIN je nízká reproducibilita odlišení kategorií u-VIN II a III. Jejich rozpoznání je často obtížné až zcela nemožné, neboť část lézí je komplexně stavěná a tvořená oběma komponentami.
Výše uvedené skutečnosti vedly v uplynulé dekádě k pokusům o změnu klasifikačního schématu VIN s hlavním cílem zlepšit diagnostickou reproducibilitu jednotlivých kategorií. Výsledkem této snahy je klasifikace ISSVD 2004 a klasifikace vycházející z cytologické Bethesda terminologie.
Klasifikace ISSVD 2004
V roce 2004 ISSVD předložila zjednodušenou verzi původní ISSVD 1986 klasifikace (tab. 3) (27). Mezi původní a modifikovanou klasifikací VIN jsou dva zásadní rozdíly:
- bylo zcela upuštěno od gradingu VIN a
- byla zrušena diagnostická jednotka u-VIN I.
Table 3. Srovnávací tabulka klasifikace ISSVD 1986 (aktuální WHO terminologie), modifikovaného schématu ISSVD 2004 a historických termínů dříve užívaných ke klasifikaci vulvárních prekanceroz prekanceróz 
VIN – vulvární intraepiteliální neoplázie; ISSVD – International Society for the Study of Vulvovaginal Disease Základní rozdělení VIN na u-VIN a d-VIN zůstává zachováno, termín u-VIN je však vyhrazen pouze pro high grade dysplastické léze asociované s HPV, které dříve odpovídaly kategoriím u-VIN II a u-VIN III. Epiteliální proliferace s histologickým vzhledem u-VIN I již nejsou považovány za dysplázie, ale měly by se popisovat pouze jako reaktivní změny anebo projevy HPV infekce (koilocytóza, plochá kondylomatózní léze).
Modifikovaná klasifikace VIN bohužel nenabízí adekvátní terminologickou alternativu pro vzácné vulvární léze s (atypickou) koilocytózou a ztrátou diferenciace, atypiemi a známkami proliferace v bazálních vrstvách epitelu, které tak splňují všechny morfologické podmínky pro dysplázii. Tyto léze jsou nyní v souladu se schématem ISSVD 1986 klasifikovány jako u-VIN I a v části z nich byla prokázána přítomnost HR HPV (10,11). Proto byly vysloveny pochybnosti o oprávněnosti zrušení diagnostické kategorie u-VIN I (10,28). Upuštění od rozlišování u-VIN II a III se může v dlouhodobém horizontu také jevit poněkud problematickým. Lze to demonstrovat na modelovém příkladu CIN II, která je v současnosti vnímána jako heterogenní skupina lézí s různým potenciálem k regresi anebo transformaci do CIN III a eventuálně SCC (29). Z pohledu klinika je tedy CIN II nárazníkovou zónou, která je terapeuticky řešena stejným způsobem jako CIN III pouze z „bezpečnostních důvodů“ (30). S rostoucími diagnostickými možnostmi a definováním nových imunohistochemických nebo molekulárních markerů se však léčebný přístup k CIN II může v budoucnu změnit. Obdobná situace může nastat i v případě u-VIN II, jejíž heterogenita na základě obsažených typů HPV byla též pozorována (10). Spojením u-VIN II a III do jedné kategorie tedy může dojít k začlenění minimálně progresivních u-VIN II mezi vysoce agresivní u-VIN II a III. Z výše popsaných důvodů by měla být původní ISSVD 1986 klasifikace dle našeho názoru i nadále používána.
Diagnostické schéma ISSVD 1986 je v současnosti pro histopatologický popis VIN stále závazné, neboť je součástí aktuálně platné WHO klasifikace chorob ženského genitálu. Některá pracoviště však používají terminologii ISSVD 2004 v rutinní praxi již nyní a existují silné tendence k jejímu začlenění do WHO klasifikace. Před tímto zásadním krokem by však bylo vhodné ověřit biologické chování u-VIN I a II dalšími studiemi.
Klasifikace VIN vycházející z Bethesda terminologie
Alternativně lze pro popis prekanceróz děložního hrdla použít dvoustupňovou terminologii vycházející z Bethesda cytologické klasifikace – low grade (LSIL) a high grade (HSIL) skvamózní intraepiteliální léze. Snaha o revizi klasifikace VIN vedla k obdobnému návrhu s představením termínů low grade (LGVIL) a high grade (HGVIL) vulvární intraepiteliální léze (31). Do kategorie LGVIL měly být zahrnuty nejen u-VIN I a ploché kondylomatózní léze vulvy, ale i klasická condylomata acuminata. Oba hlavní typy high grade dysplastických lézí vulvy (u-VIN II, III a d-VIN) měly být sdruženy do společné jednotky HGVIL. Návrh Bethesda-like klasifikace však nebyl širší gynekopatologickou obcí akceptován, protože v dostatečné míře nevyčleňoval HPV negativní prekancerózy a řadil léze postrádající maligní potenciál mezi procesy dysplastické (12).
ZÁVĚR
V rutinní bioptické praxi se patolog může setkat nejen s HPV pozitivními prekancerózami vulvy (u-VIN), které mají dobře známý histologický vzhled připomínající dysplázie děložního hrdla, ale i s HPV negativními prekancerózními lézemi (d-VIN), které jsou mikroskopicky velmi diskrétní, a proto obtížně identifikovatelné. Přesné učení typu VIN je však nedílnou součástí každé histopatologické diagnózy dysplázie vulvy. Tato informace je pro ošetřujícího lékaře důležitá, neboť klinické chování u-VIN a d-VIN se v některých faktorech liší, a to především v riziku progrese do invazivního karcinomu. Dokud nedojde k začlenění revidované terminologie ISSVD 2004 do WHO klasifikace VIN, mělo by být součástí bioptické diagnózy u-VIN i určení stupně diferenciace léze. Doporučujeme však zvážit možnost pokračovat v gradingu u-VIN i v budoucnosti. Obě klasifikace VIN jsou totiž dobře převoditelné a údaj o gradu u-VIN může být potenciálně využit k modifikaci terapie pacientek s lézemi s variabilním maligním potenciálem (u-VIN II).
Poděkování
Publikace byla podpořena výzkumným záměrem Ministerstva zdravotnictví ČR. MZ0FNM2005
Adresa pro korespondenci:
MUDr. Petr Škapa
Ústav patologie a molekulární medicíny
UK 2. LF a FN Motol
V Úvalu 84, 150 06 Praha 5
tel: +420-224 435 623
fax: +420-224 435 620
e-mail: petr.skapa@lfmotol.cuni.cz
Sources
1. Munoz N, Castellsague X, de Gonzales AB, Gissmann L. Chapter 1: HPV in the etiology of human cancer. Vaccine 2006; 24 Suppl 3: S1–10.
2. van Beurden M, ten Kate FW, Tjong AHSP, et al. Human papillomavirus DNA in multicentric vulvar intraepithelial neoplasia. Int J Gynecol Pathol 1998; 17 : 12–16.
3. Hampl M, Sarajuuri H, Wentzensen N, Bender HG, Kueppers V. Effect of human papillomavirus vaccines on vulvar, vaginal, and anal intraepithelial lesions and vulvar cancer. Obstet Gynecol 2006; 108 : 1361–1368.
4. van der Avoort IA, Shirango H, Hoevenaars BM, et al. Vulvar squamous cell carcinoma is a multifactorial disease following two separate and independent pathways. Int J Gynecol Pathol 2006; 25 : 22–29.
5. Hoevenaars BM, van der Avoort IA, de Wilde PC, et al. A panel of p16(INK4A), MIB1 and p53 proteins can distinguish between the 2 pathways leading to vulvar squamous cell carcinoma. Int J Cancer 2008; 123 : 2767–2773.
6. Toki T, Kurman RJ, Park JS, et al. Probable nonpapillomavirus etiology of squamous cell carcinoma of the vulva in older women: a clinicopathologic study using in situ hybridization and polymerase chain reaction. Int J Gynecol Pathol 1991; 10 : 107–125.
7. Wilkinson EJ, Teixeira MR. Epithelial tumours of the vulva. In: Tavassoli FA, Devilee P, eds. Pathology and genetics of tumours of the breast and female genital organs. Lyon: IARC Press; 2003 : 316–325.
8. Wilkinson EJ, Kneale B, Lynch PJ. Report of the ISSVD terminology committee. J Reprod Med 1986; 31 : 973.
9. Hart WR. Vulvar intraepithelial neoplasia: historical aspects and current status. Int J Gynecol Pathol 2001; 20 : 16–30.
10. Škapa P, Zámečník J, Hamšíková E, et al. Human papillomavirus (HPV) profiles of vulvar lesions: possible implications for the classification of vulvar squamous cell carcinoma precursors and for the efficacy of prophylactic HPV vaccination. Am J Surg Pathol 2007; 31 : 1834–1843.
11. Srodon M, Stoler MH, Baber GB, Kurman RJ. The distribution of low and high-risk HPV types in vulvar and vaginal intraepithelial neoplasia (VIN and VaIN). Am J Surg Pathol 2006; 30 : 1513–1518.
12. van de Nieuwenhof HP, van der Avoort IA, de Hullu JA. Review of squamous premalignant vulvar lesions. Crit Rev Oncol Hematol 2008; 68 : 131–156.
13. Preti M, Mezzetti M, Robertson C, Sideri M. Inter-observer variation in histopathological diagnosis and grading of vulvar intraepithelial neoplasia: results of an European collaborative study. Br J Obstet Gynaecol 2000; 107 : 594–599.
14. Santos M, Montagut C, Mellado B, et al. Immunohistochemical staining for p16 and p53 in premalignant and malignant epithelial lesions of the vulva. Int J Gynecol Pathol 2004; 23 : 206–214.
15. Yang B, Hart WR. Vulvar intraepithelial neoplasia of the simplex (differentiated) type: a clinicopathologic study including analysis of HPV and p53 expression. Am J Surg Pathol 2000; 24 : 429–441.
16. Scurry J. Does lichen sclerosus play a central role in the pathogenesis of human papillomavirus negative vulvar squamous cell carcinoma? The itch-scratch-lichen sclerosus hypothesis. Int J Gynecol Cancer 1999; 9 : 89–97.
17. Ambros RA, Malfetano JH, Carlson JA, Mihm MC, Jr. Non-neoplastic epithelial alterations of the vulva: recognition assessment and comparisons of terminologies used among the various specialties. Mod Pathol 1997; 10 : 401–408.
18. Pinto AP, Miron A, Yassin Y, et al. Differentiated vulvar intraepithelial neoplasia contains Tp53 mutations and is genetically linked to vulvar squamous cell carcinoma. Mod Pathol 2010; 23 : 404–412.
19. Chiesa-Vottero A, Dvoretsky PM, Hart WR. Histopathologic study of thin vulvar squamous cell carcinomas and associated cutaneous lesions: a correlative study of 48 tumors in 44 patients with analysis of adjacent vulvar intraepithelial neoplasia types and lichen sclerosus. Am J Surg Pathol 2006; 30 : 310–318.
20. van de Nieuwenhof HP, Bulten J, Hollema H, et al. Differentiated vulvar intraepithelial neoplasia is often found in lesions, previously diagnosed as lichen sclerosus, which have progressed to vulvar squamous cell carcinoma. Mod Pathol 24 : 297–305.
21. Liegl B, Regauer S. p53 immunostaining in lichen sclerosus is related to ischaemic stress and is not a marker of differentiated vulvar intraepithelial neoplasia (d-VIN). Histopathology 2006; 48 : 268–274.
22. Choschzick M, Hantaredja W, Tennstedt P, et al. Role of TP53 Mutations in Vulvar Carcinomas. Int J Gynecol Pathol 2011; 30 : 497–504.
23. Poulsen H, Junge J, Vyberg M, Horn T, Lundvall F. Small vulvar squamous cell carcinomas and adjacent tissues. A morphologic study. APMIS 2003; 111 : 835–842.
24. Roma AA, Hart WR. Progression of simplex (differentiated) vulvar intraepithelial neoplasia to invasive squamous cell carcinoma: a prospective case study confirming its precursor role in the pathogenesis of vulvar cancer. Int J Gynecol Pathol 2007; 26 : 248–253.
25. Mulvany NJ, Allen DG. Differentiated intraepithelial neoplasia of the vulva. Int J Gynecol Pathol 2008; 27 : 125–135.
26. Micheletti L, Barbero M, Preti M, et al. Vulvar intraepithelial neoplasia of low grade: a challenging diagnosis. Eur J Gynaecol Oncol 1994; 15 : 70–74.
27. Sideri M, Jones RW, Wilkinson EJ, et al. Squamous vulvar intraepithelial neoplasia: 2004 modified terminology, ISSVD Vulvar Oncology Subcommittee. J Reprod Med 2005; 50 : 807–810.
28. Wilkinson EJ. Premalignant and malignant tumors of the vulva. In: Kurman RJ, Ellenson LH, Ronnett BM, eds. Blaustein’s pathology of the female genital tract (6th ed). New York, NY: Springer; 2011 : 55–103.
29. Castle PE, Schiffman M, Wheeler CM, Solomon D. Evidence for frequent regression of cervical intraepithelial neoplasia-grade 2. Obstet Gynecol 2009; 113 : 18–25.
30. Wright TC, Massad LS, Dunton CJ, et al. 2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ. Am J Obstet Gynecol 2007; 197 : 340–345.
31. Medeiros F, Nascimento AF, Crum CP. Early vulvar squamous neoplasia: advances in classification, diagnosis, and differential diagnosis. Adv Anat Pathol 2005; 12 : 20–26.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2012 Issue 1-
All articles in this issue
- Gynekologické prekancerózy z pohledu klinika dnes a zítra
- Prekancerózní léze vulvy
- Co je nového v cytodiagnostice cervikálních prekanceróz?
- Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky
- Primární neuroendokrinní karcinom jater
- Neuroendokrinní adenom středouší s prorůstáním do zevního zvukovodu
- Vaginálny myofibroblastóm so žliazkami exprimujúcimi mamárne a prostatické antigeny
- Recidivujúci multifokálny leiomyosarkóm močového mechúra 22 rokov po liečbe bilaterálneho (hereditárneho) retinoblastómu: popis prípadu a prehľad literatúry
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Gynekologické prekancerózy z pohledu klinika dnes a zítra
- Prekancerózní léze vulvy
- Co je nového v cytodiagnostice cervikálních prekanceróz?
- Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

















