-
Medical journals
- Career
5. edice WHO klasifikace karcinomu prostaty z roku 2022: změny a novinky v „Blue Book“
Authors: Hana Sedláčková 1; Ivan Trávníček 1; Adriena Bartoš Veselá 1; Tomáš Pitra 1; Milan Hora 1; Ondřej Fiala 2; Kristýna Pivovarčíková 3,4
Authors‘ workplace: Urologická klinika, Fakultní nemocnice Plzeň 1; Onkologická a radioterapeutická klinika, Fakultní nemocnice Plzeň 2; Šiklův ústav patologie, Fakultní nemocnice Plzeň 3; Bioptická laboratoř, s. r. o., Plzeň 4
Published in: Ces Urol 2023; 27(2): 78-85
Category: Review article
Overview
Recentně (polovina roku 2022) byla publikována nová WHO klasifikace urogenitálních tumorů. Tato 5. edice tzv. „Blue Book“ přináší aktualizaci terminologie, epidemiologie, patogeneze, histopatologie, molekulární znaků a novinky prognosticko‑prediktivních znaků urogenitálních nádorů. Zde publikovaný přehledový článek pak adresně shrnuje hlavní změny v klasifikaci tumorů prostaty.
Klíčová slova:
karcinom prostaty – histopatologie – WHO klasifikace – Blue Book – intraduktální karcinom prostaty – Gleason skóre.
ÚVOD
V roce 2022 WHO představila novou verzi „Blue Book“ klasifikace tumorů močového a genitálního traktu po šesti letech od předchozí verze. Kapitoly o prostatických tumorech se změny dotkly relativně minimálně. Vlastní tvorbě WHO předcházela řada jednání odborných patologických genitourinárních společností (International Society of Urological Pathology/ISUP a Genitourinary Pathology Society/GUPS), které vedly k vydání odborných doporučení. Bohužel, v mnohých tématech se tyto dvě společnosti a jejich doporučení neshodly, což výrazně zkomplikovalo jak tvorbu WHO klasifikace (která z těchto doporučení vychází), tak v současné době bohužel též ztěžuje i rutinní diagnostiku.
Cílem této práce není do detailu popsat jednotlivé jednotky WHO tumorů prostaty – v následujícím textu budou komentovány zejména změny klasifikace neoplazií prostaty oproti dřívější klasifikaci z roku 2016 (1) a též některá stěžejní témata.
ZMĚNY OBECNÉ TERMINOLOGIE A ČLENĚNÍ
Stejně jako v jiných kapitolách 5. vydání WHO (a v souladu s WHO klasifikacemi jiných orgánových systémů) došlo k lehké úpravě terminologie. Označení „podtypy“/„subtypes“ nahrazuje původní varianty/„variants“ pro odlišné morfologické subkategorie konkrétních tumorů/lézí, u nichž je žádoucí tuto morfologickou heterogenitu v rámci jednotky/ kategorie rozpoznávat. Toto členění na subtypy je důležité zejména pro patologickou diagnostiku a schopnost patologa daný subtyp správně zaklasifikovat do nadřazené jednotky, některé subtypy však též mohou vykazovat odlišnosti v biologickém chování či klinické manifestaci. Termín „varianta“ je současnými WHO klasifikacemi rezervovaný pro popis genetických alterací/variant tumorů.
V nové WHO též dochází ke změně celkového členění a několika přesunům. Jako samostatné hlavní kapitoly byly v 5. vydání WHO klasifikace tumorů močového a mužského pohlavního systému vyčleněny kapitoly pojednávající o metastázách, hematologických malignitách, mezenchymálních tumorech, neuroendokrinních nádorech, melanocytárních lézích a samostatná kapitola též komentuje genetické syndromy predisponující ke vzniku nádorů v genitourinárním (GU) traktu jako celku (ne jen v prostatě). V „prostatické kapitole“ byly naopak ponechány mezenchymální nádory specifické pro prostatu (prostatický stromální tumor nejistého maligního potenciálu, stromální sarkom prostaty) a nově vyčleněna jednotka neuroendokrinní karcinom prostaty související s léčbou (treatment‑related neuroendocrine prostatic carcinoma – t‑NEPC).
Přesuny se týkají i uroteliálních karcinomů prostaty a prostatické uretry, které jsou komentovány v kapitole tumorů vývodného traktu. Nemění se však přístup ke stagingu těchto karcinomů – uroteliální karcinom vznikající v prostatické uretře a infiltrující stroma prostaty je hodnocen jako pT2. Pokud je prostata infiltrována uroteliálním karcinomem původně vznikajícím ve sliznici močového měchýře a per continuitatem prorůstajícím do stromatu prostaty, nález je hodnocen jako pT4.
Další přesun se dotknul tzv. PIN‑like adenokarcinomu prostaty (tj. morfologického subtypu adenokarcinomu prostaty, který byl v dřívější WHO považován za variantu duktálního adenokarcinomu). PIN‑like adenokarcinom prostaty je nově přesunut do kapitoly „acinární prostatický adenokarcinom“, neboť klinické a molekulárně‑genetické důkazy prokázaly odlišnosti v porovnání s duktálním karcinomem (2).
Jiné jednotky naopak ve WHO nenajdeme. Prostatická intraepiteliální neoplazie nízkého maligního potenciálu (LGPIN) již není uznávanou entitou (což však není novinkou tohoto vydání WHO, ale pozůstatek změn dřívějších). Absence LGPIN je primárně dána neschopností histologicky identifikovat LGPIN jako lézi odlišnou od benigní glandulární hyperplazie prostaty. Užití termínu prostatické intraepiteliální neoplazie (PIN) je tak omezeno pouze na high‑grade prostatickou intraepiteliální neoplazii (HGPIN). V rámci HGPIN jsou patology rozlišovány různé histologické subtypy (mikropapilární, plochý, trsovitý/tufting, malobuněčný, „signet‑ring“, „foamy“, mucinózní, invertovaný patern, HGPIN se skvamózní diferenciací) (3). Z klinického hlediska nemá toto členění význam. Z pohledu patologa je však znalost morfologického spektra důležitá pro správné stanovení diagnózy. Jeden z dříve popisovaných podtypů HGPIN, tzv. kribriformní podtyp, dle současné klasifikace již není řazen mezi HGPIN, ale nově inkorporován do tzv. atypických intraduktálních proliferací. Označení „atypická intraduktální profilerace“ je kategorie vágní definice i významu s otazným vztahem k intraduktálnímu karcinomu prostaty (IDC‑P) (3) (viz níže).
INTRADUKTÁLNÍ KARCINOM PROSTATY (IDC‑P)
Nová WHO klasifikace se výrazněji věnuje otázce intraduktálního karcinomu prostaty (IDC‑P). Základní definicí IDC‑P je přítomnost nádorové proliferace postihující preformované duktální a acinární struktury, kde tato neoplastická proliferace je cytologicky a architektonicky „až příliš“ na pouhý HGPIN. Tato definice je krkolomná nejen z pohledu urologa, ale i pro diagnostikující patology. V drtivé většině případů je přítomnost IDC‑P asociována s přítomností high grade a high stage prostatického adenokarcinomu (4). U většiny případů IDC‑P je tak předpokládáno, že IDP‑C se vyvine jako pozdní progrese tumoru, kde se high‑grade invazivní karcinom prostaty šíří (kolonizuje) benigními prostatickými dukty nebo aciny, které tapetuje (4, 5). U minoritní části IDC‑P se však ani v materiálu z radikální prostatektomie neprokáže současně se vyskytující přítomnost invazivního karcinomu a v těchto případech je pak polemizováno, zda IDC‑P nemůže mít v některých případech pouze povahu jakéhosi prekurzoru či „in situ“ karcinomu. Tyto dvě literaturou dobře zdokumentované situace výskytu IDC‑P pak podporují současnou domněnku, že IDC‑P může představovat dvě biologicky odlišné entity (tj. majoritní část IDC‑P asociovaná s invazivním high grade karcinomem a minoritní část IDC‑P bez přítomnosti invazivního karcinomu prostaty) (6). Obecně však panuje shoda o IDC‑P jako negativním prognostickém faktoru a tedy o nutnosti jeho přítomnost reportovat v patologické zprávě (jak v punkční biopsii, tak v preparátech radikální prostatektomie) (3, 7). Přítomnost IDC‑P koreluje s vyšším gradem tumoru, větším objemem nádorové tkáně, vyšší pravděpodobností extraprostatického šíření a invaze do semenných váčků, i s rizikem metastáz do lymfatických uzlin (8). Je také spojen s biochemickou recidivou a mortalitou specifickou pro karcinom po radikální prostatektomii (8).
Velkou kontroverzi v patologii IDC‑P představuje neshoda odborných patologických společností (ISUP/GUPS), zda má být přítomnost IDC‑P zahrnuta do určování Gleasonovo gradu a celkového skóre. V roce 2014 ISUP doporučil IDC‑P bez invazivního karcinomu nepřidělovat Gleason grade (9). V roce 2016 4. edice WHO klasifikace sdílela identický přístup, IDC‑P do Gleason skóre nezahrnovat. V posledních letech je živě diskutováno začlenění IDC‑P do Gleasonova skóre (GS)/ WHO gradingu (tzv. grade group/GG) v případě, že je spojen s nálezem invazivního karcinomu. Stěžejní limitací je však fakt, že identifikace IDC‑P a odlišení od invazivního adenokarcinomu prostaty v základním barvení hematoxylinem‑eosinem (HE) je bez použití imunohistochemických barvení (které však zvyšují celkové náklady na vyšetření) často velmi náročné, někdy až nemožné. Přítomnost IDC‑P je však jednoznačně považována za negativní prognostický znak, je tedy nutno jeho přítomnost minimálně reportovat (10). To, jestli IDC‑P bude v histologickém nálezu zahrnuto v GS a GG, však už víceméně záleží pouze na hodnotícím patologovi, neboť WHO 2022 mu v tomto ohledu dává relativně volnou ruku, ovšem s jasnými pravidly. WHO zavádí nutnost používat doporučení jedné z GU patologických společností (GUPS, ISUP) z roku 2019. Doporučení ISUP pak inkorporují IDC‑P do GS v případě, že je asociován se současnou přítomností invazivního adenokarcinomu ve vzorcích (7), naopak doporučení GUPS zastávají názor, že IDC‑P nemá být začleněn do GS a tedy i GG (3). Patolog by měl vždy ve svém histologickém reportu uvádět, podle kterého doporučení při určování GS a GG postupoval.
ATYPICKÁ INTRADUKTÁLNÍ PROLIFERACE (AIP)
Atypická intraduktální proliferace (AIP) je 5. vydáním WHO a ve „white paper“ z roku 2019 (doporučení společnosti GUPS) zavedený vágní deskriptivní termín, kterým by měly být označovány léze u nichž míra cytologických a architektonických atypií ještě nedosahuje kvalit IDC‑P, na stranu druhou, jsou „až příliš na pouhou“ diagnózu HGPIN (3). Nově jsou tak pod tento název řazeny jednak kribriformní proliferace bez výrazných jaderných atypií a nekróz a též léze v minulé WHO klasifikaci označovaná jako kribriformní pattern HGPIN. Z praktického pohledu na věc – existují domněnky, že AIP může být potenciální marker „unsampled“ HG prostatického adenokarcinomu (3, 11, 12) a možná i jakýsi mezikrok k rozvoji IDC‑P (5, 12). I proto je asi nejlepším klinickým přístupem u případů s AIP sledování pacienta a brzká rebiopsie (12, 13).
ACINÁRNÍ ADENOKARCINOM PROSTATY
5. vydání WHO klasifikace v rámci skupiny acinárního prostatického adenokarcinomu rozpoznává několik morfologických/patologických patternů a subtypů. Pro urologickou praxi nemá jejich rozlišování přílišný význam, neboť pouze ojedinělé velmi vzácné subtypy jsou asociovány s agresivním chováním (např. pleomorfní obrovskobuněčný adenokarcinom, sarkomatoidní adenokarcinom). Nově je do skupiny acinárního prostatického adenokarcinomu inkorporován morfologický subtyp adenokarcinomu – tzv. PIN‑like adenokarcinom, který byl dříve považován za podtyp duktálního karcinomu prostaty (11). Jiné výraznější změny v rámci této entity nová „modrá kniha“ nepřináší.
DUKTÁLNÍ ADENOKARCINOM PROSTATY
Téma duktálního adenokarcinomu prostaty je z některých autorů lehce kontroverzní. Diskuzi vyvolává zejména možnost reklasifikace a event. zahrnutí duktálního adenokarcinomu do skupiny „acinárního prostatického adenokarcinomu prostaty“ (jako jeden z jeho dalších možných podtypů). To je primárně podmíněno i skutečností, že v drtivé většině případů je duktální adenokarcinom přítomen v materiálu současně s acinárním adenokarcinomem (14). Zároveň bylo některými studiemi prokázáno, že duktální a acinární adenokarcinom vznikající u jednoho pacienta jsou klonálně příbuzné (15). Existují však též studie prokazující, že v přítomnosti a frekvenci některých specifických molekulárních alterací se obě jednotky mohou lišit (11). Proti slučování obou jednotek nicméně hovoří i fakt, že duktální adenokarcinom má odlišné klinické chování (často vytváří intrauretrální masu, je asociován s více agresivním průběhem a má sklon k lehce odlišnému metastazování – do plic, jater, mozku a kůže) a vykazuje nižší odpověď na androgen deprivační terapii (ADT) (16, 17). Hladiny PSA jsou u pacientů s duktálním adenokarcinomem variabilní, většinou nižší (18).
V 5. vydání WHO klasifikace tak byl duktální adenokarcinom prostaty zatím stále ponechán jako samostatný typ karcinomu prostaty. Diagnóza „duktálního prostatického adenokarcinomu“ je rezervována pouze pro radikální prostatektomie, kde duktální komponenta/morfologie tvoří > 50 % (procento duktální komponenty by mělo být reportováno). V případě záchytu duktální komponenty v punkční biopsii prostaty je doporučováno reportovat spíše jako „adenokarcinom s duktálními rysy“.
Gleason grade přisuzovaný duktálnímu adenokarcinomu je 4 a 5 (Gleason grade 5 u případů s komedonekrózou) (19). Duktální adenokarcinom má sklon k šíření prostatickými dukty a současně se vyskytující přítomnost intraduktálního adenokarcinomu je referována až v 90 % případů (15).
NEUROENDOKRINNÍ KARCINOM PROSTATY SPOJENÝ S LÉČBOU
V novém vydání WHO klasifikace je s léčbou asociovaný neuroendokrinní karcinom prostaty (t‑NEPC) samostatnou kategorií (Tab. 1). Jedná se o tumory vznikající dediferenciací kastračně rezistentního karcinomu prostaty. T‑NEPC se vyvine u pacientů na ADT (nejčastěji ARTA jako je abirateron‑acetát nebo enzalutamid) v průměru méně než za 24 měsíců po zahájení terapie a tvoří pak 10,5–17 % pacientů s metastatickým kastračně rezistentním prostatickým karcinomem (20–22). Bohužel, tito pacienti mají medián přežití méně než 12 měsíců (23). Zdá se, že k dediferenciaci v t‑NEPC dochází na pozadí specifické genomické alterace (24, 25). Neuroendokrinní komponenta se nezapočítává do GG/GS(1).
Table 1. Přehled klasifikace tumorů prostaty
Tab. 1. Summary of the classification of prostate tumors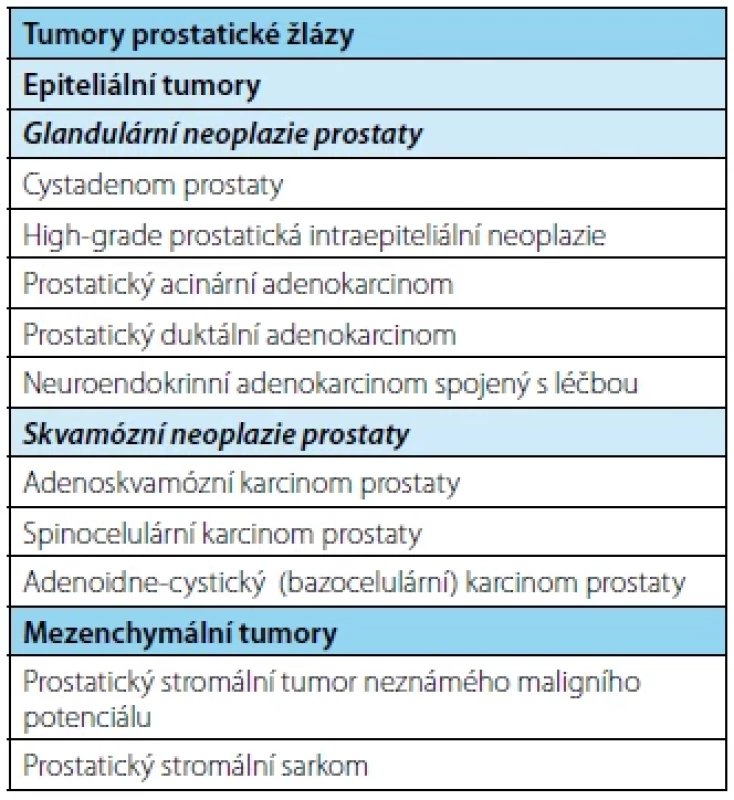
ADENOIDNĚ‑CYSTICKÝ (BAZOCELULÁRNÍ) KARCINOM PROSTATY
Adenoidně cystický (bazocelulární) karcinom prostaty je patrně odvozen od bazálních buněk prostatických žlázek. Jedná se o potenciálně agresivní malignitu (11). Název této entity byl revidován 5. edicí WHO klasifikace na základě jednak blízké morfologické a molekulární podobnosti mezi tímto typem prostatického karcinomu a nádory slinných žláz na jedné straně a zároveň z důvodu lehce zavádějícího původního názvu (původně „bazocelulární karcinom prostaty“). Původní název „bazocelulární karcinom“ mohl u některých pacientů budit dojem z podobnosti s bazocelulárním karcinomem kůže (11), se kterým však nemá společného vůbec nic. Část těchto tumorů má stejnou genetickou fúzi jako nádory slinných žláz (26).
GLEASON SKÓRE (GS) A GRADE GROUP (GG)
Je základní informací, že pravidla pro grading prostatického adenokarcinomu se lehce liší v materiálu biopsie a radikální prostatektomie. Každá z odborných patologických GU společností (GUPS i ISUP) má pak odlišná pravidla pro grading a určování GS. WHO definitivně nestanovuje, jak při gradingu prostatického karcinomu postupovat, ale doporučuje aplikovat jedno z doporučení výše zmíněných společností (1, 3, 7) a v patologické zprávě specifikovat, které doporučení bylo pro grading použito.
Konkrétně společnost ISUP doporučuje v jehlové biopsii vždy inkorporovat vyšší terciální Gleason grade do GS i GG bez ohledu na jeho rozsah/ procentuální zastoupení. Zároveň by vždy mělo být reportováno procentuální zastoupení Gleason patternu 4 u všech GS 7 (tj. GG 2 a 3). Pro preparáty z radikální prostatektomie pak ISUP stanovuje předpis inkorporace terciálního Gleason gradu 4 a 5 do GS pouze pokud procentuální zastoupení těchto gradů činní > 5 % z celkového objemu tumoru. Pokud Gleason pattern 4 / 5 představuje v radikální prostatektomii ≤ 5 %, pak má být reportován jako terciální/minoritní Gleason patterns 4 a 5 a nemá být započítán v konečném GS a GG. Jak už bylo řečeno výše – ISUP doporučuje inkorporovat IDC‑P se současně přítomným invazivním prostatickým adenokarcinomem do GS a GG, IDC‑P bez současně se vyskytujícího invazivního adenokarcinomu naopak negradovat. GS a GG by měl být reportován pro každou lokalitu souhrnně (tj. např. souhrnně pro levý a pravý lalok prostaty u systematických biopsií či souhrnně pro každé ložisko na MRI při cílené fuzní biopsii). Zároveň by jak v punkcích, tak i v radikálních prostatektomiích měla být v histologické zprávě explicitně zmíněna přítomnost IDC‑P a invazivního adenokarcinomu s kribriformním patternem Gleason gradu (7).
GUPS při stanovování Gleasonova gradu 4 v rámci punkčních biopsií doporučuje udávat procento zastoupení tohoto patternu u GG 2 a 3. Preferovanou metodou je udávat procentuální zastoupení v pevně stanovených rozmezích (≤ 5 %, ≤ 10 % a dále pak v násobcích 10 %). Terciální/minoritní (3. nejčastější) Gleason pattern 5 v biopsii by měl být vždy započítán do celkového GS společně s primárním patternem. GUPS zároveň v radikálních prostatektomiích upřednostňuje termín „minoritní terciální pattern 5“ před pojmem „terciální grade 5“. Tento „minoritní terciální pattern 5“ má být užíván jen u radikálních prostatektomií pouze pro GG 2 a 3 (3 + 4 = 7, 4 + 3 = 7). Jako cut off pro „minoritní terciální pattern 5“ je v těchto případech opět užívána hranice 5 % (přítomnost > 5 % Gleason patternu 5 je považována za sekundární Gleason pattern a započítána do GS, Gleason pattern ≤ 5% je udáván jako minoritní terciální pattern 5). Dle GUPS u GS 3 + 3 = 6 a 4 + 4 = 8 „minoritní terciální pattern“ neexistuje, neboť GUPS vyžaduje pro diagnózu „minoritního terciálního patternu“ přítomnost tří různých Gleason gradů (tj. lze ho užít jen v kategorii 3 + 4 = 7 a 4 + 3 = 7). Stejně jako ISUP i GUPS doporučuje explicitně reportovat přítomnost kribriforního subtypu Gleason gradu 4. IDC‑P nemá být dle GUPS doporučení započítáván do celkového GS a GG (3).
ZÁVĚR
Páté vydání WHO klasifikace tumorů urogenitálního traktu v klasifikaci karcinomu prostaty zahrnuje několik významných změn. Docházi k expanzi kapitoly o IDC‑P, kde jsou popsány dvě odlišné entity (IDC‑P asociován s invazivním karcinomem prostaty a IDC‑P bez přítomnosti invazivního karcinomu prostaty). IDC‑P je považován za negativní prognostický faktor a je nutné jeho přítomnost v patologické zprávě reportovat. Mezi další změny, které mají dopad na klinickou praxí patří termín prostatická intraepiteliální neoplazie (PIN), který je rezervovaný pouze pro high grade léze, tudíž termín LGPIN již v klasifikaci nenajdeme. Nově je do kapitoly o atypické intraduktální proliferaci (AIP) zařazený kribriformní pattern (dříve jako podtyp HGPIN) a pro klinika‑urologa nejlepším postupem u případů AIP je pacienta indikovat k časné re‑biopsii prostaty, jelikož tato léze může značit jakýsi mezikrok k rozvoji IDC‑P. Další recentně popsanou entitou je neuroendokrinní karcinom prostaty spojený s léčbou (t‑NEPC), který se rozvine u pacientů na androgen deprivační terapii (ADT) (nejčastěji ARTA preparátech, jako je abirateron‑acetát nebo enzalutamid), a to v průměru < 24 měsíců po zahájení terapie, postihuje až 17 % pacientů v mCRCP. Tvorbu 5. edice WHO klasifikace i rutinní diagnostiku komplikuje neshoda odborných patologických genitourinárních společností (ISUP, GUPS), které mají v mnoha ohledech odlišná pravidla, a to i pro určování gradingu (GS a GG). Z tohoto hlediska WHO nedává jasná doporučení, patolog zde má prakticky volnou ruku, podle které výše zmíněné odborné společnosti bude popisovat a reportovat, jen je nutné specifikovat, které doporučení bylo pro grading použito.
Některá kontroverzní témata však nelze na základě aktuálně dostupných dat zcela uzavřít. Je však pravděpodobné, že budoucí studie poskytnou další důkazy a podepíší se na vzhledu následující „Blue Book“. I přes rozvíjející se zobrazovací technologie (magnetická rezonance, specifické radiotracery pro prostatu) je diagnostika prostatického adenokarcinomu stále založena na histologické verifikaci.
Střet zájmů: Žádný.
Prohlášení o podpoře: Karlova univerzita Praha, Lékařská fakulta Plzeň (Cooperation Program, SURG), Institucionální výzkum Fakultní nemocnice Plzeň (FNPl 00669806).
Došlo: 22. 3. 2023
Přijato: 25. 4. 2023Kontaktní adresa:
MUDr. Hana Sedláčková, Ph.D.
Urologická klinika FN Plzeň
E. Beneše 13, 301 00 Plzeň
e-mail: sedlackovah@fnplzen.czCes Urol 2023; 27(2): 78-85
Sources
1. Amin MB, Kench JG, Rubin MA, Srigley JR, Tsuzuki T. Chapter 4: Tumours of the prostate. In: WHO Classification of Tumours Editorial Board. Urinary and male genital tumours. Lyon (France): International Agency for Research on Cancer; 2022. (WHO classification of tumours series, 5th ed.; vol. 8). https://publications. iarc.fr/610.
2. Kaur HB, Salles DC, Paulk A, Epstein JI, Eshleman JR, Lotan TL. PIN‑like ductal carcinoma of the prostate has frequent activating RAS/RAF mutations. Histopathology. 1. leden 2021; 78(2): 327–33.
3. Epstein JI, Amin MB, Fine SW, et al. The 2019 Genitourinary Pathology Society (GUPS) White Paper on Contemporary Grading of Prostate Cancer. Arch Pathol Lab Med. 1. duben 2021; 145(4): 461–93.
4. McNeal J, Yemoto C. Spread of adenocarcinoma within prostatic ducts and acini. Morphologic and clinical correlations. Am J Surg Pathol. 1996; 20(7): 802–14.
5. Lotan TL, Gumuskaya B, Rahimi H, et al. Cytoplasmic PTEN protein loss distinguishes intraductal carcinoma of the prostate from high‑grade prostatic intraepithelial neoplasia. Mod Pathol. 2013; 26(4): 587–603.
6. Dinerman BF, Khani F, Golan R, et al. Population‑based study of the incidence and survival for intraductal carcinoma of the prostate. Urol Oncol Semin Orig Investig. 2017; 35(12): 673.e9-673.e14.
7. van Leenders GJLH, van der Kwast TH, Grignon DJ, et al. The 2019 International Society of Urological Pathology (ISUP) Consensus Conference on Grading of Prostatic Carcinoma. Am J Surg Pathol [Internet]. 2020; 44(8). Available from: https://journals.lww.com/ajsp/Fulltext/2020/08000/The_2019_International_Society_ of_Urological.1.aspx.
8. Sæter T, Vlatkovic L, Waaler G, et al. Intraductal Carcinoma of the Prostate on Diagnostic Needle Biopsy Predicts Prostate Cancer Mortality: A Population‑Based Study. The Prostate. 2017; 77(8): 859–65.
9. Epstein JI, Egevad L, Amin MB, et al. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol [Internet]. 2016; 40(2). Available from: https://journals. lww.com/ajsp/Fulltext/2016/02000/The_2014_International_Society_of_Urological.10.aspx.
10. Kato M, Tsuzuki T, Kimura K, et al. The presence of intraductal carcinoma of the prostate in needle biopsy is a significant prognostic factor for prostate cancer patients with distant metastasis at initial presentation. Mod Pathol. 2016; 29(2): 166–73.
11. Netto GJ, Amin MB, Berney DM, et al. The 2022 World Health Organization Classification of Tumors of the Urinary System and Male Genital Organs – Part B: Prostate and Urinary Tract Tumors. Eur Urol. 2022; 82(5): 469–82. 12
ckman RA, Yu H, Li J, et al. Atypical Intraductal Cribriform Proliferations of the Prostate Exhibit Similar Molecular and Clinicopathologic Characteristics as Intraductal Carcinoma of the Prostate. Am J Surg Pathol [Internet]. 2017; 41(4). Available from: https://journals.lww.com/ajsp/Fulltext/2017/04000/Atypical_Intraductal_ Cribriform_Proliferations_of.14.aspx.
13. Destouni M, Lazaris AC, Tzelepi V. Cribriform Patterned Lesions in the Prostate Gland with Emphasis on Differential Diagnosis and Clinical Significance. Cancers. 2022; 14(13).
14. Seipel AH, Wiklund F, Wiklund NP, Egevad L. Histopathological features of ductal adenocarcinoma of the prostate in 1,051 radical prostatectomy specimens. Virchows Arch. 2013; 462(4): 429–36.
15. Vinceneux A, Bruyère F, Haillot O, et al. Ductal adenocarcinoma of the prostate: Clinical and biological profiles. The Prostate. 2017; 77(12): 1242–50.
16. Lotan TL, Toubaji A, Albadine R, et al. TMPRSS2-ERG gene fusions are infrequent in prostatic ductal adenocarcinomas. Mod Pathol Off J U S Can Acad Pathol Inc. 2009/01/16 vyd. 2009; 22(3): 359–65.
17. Schweizer MT, Antonarakis ES, Bismar TA, et al. Genomic Characterization of Prostatic Ductal Adenocarcinoma Identifies a High Prevalence of DNA Repair Gene Mutations. JCO Precis Oncol. 2019; (3): 1–9.
18. Morgan TM, Welty CHJ, Funda VL, Lin DW, Wright. Ductal Adenocarcinoma of the Prostate: Increased Mortality Risk and Decreased Serum Prostate Specific Antigen. J Urol. 2010; 184(6): 2303–7.
19. Epstein JI, Allsbrook WCJ, Amin MB, Egevad LL, and the ISUP Grading Committee. The 2005 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol [Internet]. 2005; 29(9). Available from: https://journals.lww.com/ajsp/Fulltext/ 2005/09000/The_2005_International_Society_of_Urological.15.aspx.
20. Conteduca V, Oromendia C, Eng KW, et al. Clinical features of neuroendocrine prostate cancer. Eur J Cancer Oxf Engl 1990. 2019; 121 : 7–18.
21. Aggarwal R, Huang J, Alumkal JJ, et al. Clinical and Genomic Characterization of Treatment‑Emergent Small‑Cell Neuroendocrine Prostate Cancer: A Multi‑institutional Prospective Study. J Clin Oncol. 2018; 36(24): 2492–503.
22. Bluemn EG, Coleman IM, Lucas JM, et al. Androgen Receptor Pathway‑Independent Prostate Cancer Is Sustained through FGF Signaling. Cancer Cell. 2017; 32(4): 474–489.e6.
23. Wang HT, Yao YH, Li BG. Neuroendocrine Prostate Cancer (NEPC) Progressing From Conventional Prostatic Adenocarcinoma: Factors Associated With Time to Development of NEPC and Survival From NEPC Diagnosis – A Systematic Review and Pooled Analysis. J Clin Oncol. 2014; 32(30): 3383–90.
24. Park JW, Lee JK, Sheu KM, et al. Reprogramming normal human epithelial tissues to a common, lethal neuroendocrine cancer lineage. Science. 2018; 362(6410): 91–5.
25. Epstein JI, Amin MB, Beltran H, et al. Proposed Morphologic Classification of Prostate Cancer With Neuroendocrine Differentiation. Am J Surg Pathol. 2014; 38(6): 756–67.
26. Magers MJ, Iczkowski KA, Montironi R, et al. MYB‑NFIB gene fusion in prostatic basal cell carcinoma: clinicopathologic correlates and comparison with basal cell adenoma and florid basal cell hyperplasia. Mod Pathol. 2019; 32(11): 1666–74.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2023 Issue 2-
All articles in this issue
- Urologie a elektronizace zdravotnictví
- Robotic laparoscopic pyeloplasty
- The WHO Classification of Urinary and Male Genital Tumours 2022: renal tumours classification
- 5th edition of the 2022 WHO classification of prostate cancer: changes and novelties in the "Blue Book"
- Prognostic factors in metastatic prostate cancer
- The results of percutaneous nephrostomy tube placement under ultrasound guidance
- Long-term follow-up of living kidney donors – a single center experience
- Early complications after radical cystectomy before implementation of the ERAS concept (Enhanced Recovery After Surgery)
- Priapism durning testosterone replacement therapy of the central hypogonadism
- Postřehy z CEM23 (Central European Meeting 2023)
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostic factors in metastatic prostate cancer
- 5th edition of the 2022 WHO classification of prostate cancer: changes and novelties in the "Blue Book"
- Early complications after radical cystectomy before implementation of the ERAS concept (Enhanced Recovery After Surgery)
- The results of percutaneous nephrostomy tube placement under ultrasound guidance
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

