-
Medical journals
- Career
ROLE MULTIPARAMETRICKÉ MAGNETICKÉ REZONANCE V REŽIMU ACTIVE SURVEILLANCE KARCINOMU PROSTATY
: Šárka Kudláčková 1; Milan Král 1; Daniela Kurfürstová 2; František Záťura 1; František Hruška 1; Igor Hartmann 1; Vladimír Študent 1
: Urologická klinika LF UP a FN Olomouc 1; Ústav klinické a molekulární patologie LF UP a FN Olomouc 2
: Ces Urol 2017; 21(3): 225-230
: Original Articles
Cíl:
Vyhodnocení výsledků cílené biopsie pomocí MRI u pacientů zařazených v režimu active surveillance a zhodnocení přínosu zavedení MRI do protokolu režimu AS.Materiál a metodika:
Od roku 2009 bylo do režimu active surveillance zařazeno 69 pacientů splňujících Epsteinova kritéria. Třicet pacientů podstoupilo v průběhu sledování multiparametrickou magnetickou rezonanci prostaty (mp‑MRI). K vyhodnocení byl použit strukturovaný skórovací systém PI‑RADS v.2. Následovala cílená biopsie ložisek popsaných jako PIRADS skóre 4 či skóre 5. Vyhodnocen byl záchyt karcinomu v rebiopsii, shoda mezi ložisky popsanými jako PIRADS skóre 4 a PIRADS skóre 5 a pozitivitou válečku. Pokud nebyla splněna Epsteinova kritéria pak byla pacientovi navržena radikální léčba. Pro pokračování v režimu AS jsme nepřipouštěli ani minimální postižení GS 3+4 ani vyšší počet postižených bioptických vzorků než 2. Byla vyhodnocena změna strategie směrem k radikální léčbě a vyhodnocení definitivních preparátů po radikální robotické prostatektomii (RARP). Hodnotili jsme četnost podhodnocení definitivního GS a definitivního T‑stadia a také celkové prognostické zhodnocení.Výsledky:
Průměrná doba sledování byla 3,37 (1–9) roku. Průměrný věk pacienta byl 65,8 (55–74) let, průměrné PSA bylo 6,08 (2,54–9,58) ng/ml, průměrný objem prostaty 59 (16–113) ml a průměrná denzita 0,17 (0,04–0,44) ng/ml/ml. V cílených biopsiích byl potvrzen karcinom u 19 pacientů (záchyt 63 %). Frekvence záchytu karcinomu při pozitivním MRI s ložiskem PIRADS 4 byla 32 % a s ložiskem PIRADS 5 76 %. Třináct pacientů (43 %) na základě výsledků cílené biopsie ukončilo režim aktivního sledování pro nesplnění kritérií protokolu aktivního sledování a byla navržena radikální léčba (devět podstoupilo RARP, u dvou je RARP v plánu a dva podstoupili RT). Ve srovnání s definitivním preparátem po RARP došlo k upgradingu u 33 % pacientů a k upstagingu u 22 % pacientů. U pacientů, kteří podstoupili radikální prostatektomii, bylo dosaženo příznivého stadia u pěti pacientů (55 %) a nepříznivého stadia u čtyř pacientů (45 %). Všichni pacienti, kteří podstoupili radikální léčbu, jsou dosud v remisi.Závěr:
Cílená biopsie pomocí mp‑MRI zvýšila záchyt rizikového karcinomu prostaty ve 43 %, což směřovalo k ukončení režimu active surveillance a podstoupení radikální terapie. Mp‑MRI může pomoci v identifikaci agresivního onemocnění v průběhu active surveillance, a tím zvýšit bezpečnost této strategie pro pacienty. Pro využití MRI v průběhu režimu aktivního sledování bude potřeba definovat signifikantnost radiologického nálezu a také definovat radiologickou progresi.KLÍČOVÁ SLOVA:
Aktivní sledování, cílená biopsie, karcinom prostaty, magnetická rezonance prostaty.ÚVOD
Za základní léčebné modality u léčby karcinomu prostaty jsou považovány radikální prostatektomie a radikální radioterapie. Mají ovšem nezanedbatelné nežádoucí účinky a taktéž vysokou socioekonomickou zátěž. Proto byly vyvinuty další strategie mj. active surveillance a watchfull waiting spočívající ve vyčkávání se započetím léčby. U nízkorizikového karcinomu prostaty je vhodná strategie active surveillance, kdy odsouváme radikální řešení na období, kdy dojde k progresi onemocnění do rizikovější formy (1, 2). Tímto zároveň snižujeme riziko zbytečné léčby u indolentních karcinomů. U nově diagnostikovaných pacientů je udávána incidence nízkorizikových karcinomů až v 48 % (3). Úspěch aktivního sledování je založen na přesné identifikaci pacientů s nízkorizikovým karcinomem prostaty, který nebude progredovat (4). Proto je snaha o další zpřesnění kritérií pro výběr pacienta vhodného pro aktivní sledování. Originální vstupní Epsteinova kritéria pro režim AS byla PSA ≤10 ng/ ml, staging T1c-2a, Gleasonovo skóre (GS) ≤3+3, ≤2 pozitivní vzorky, ≤50 % postižení válečku (1). Tato byla postupně v PRIAS protokolu modifikována: akceptováno je minimální postižení GS 3+4 a více jak dva vzorky mohou být postiženy, pokud byla provedena MRI cílená biopsie. Dále pak pokud nebyla provedena cílená biopsie a jsou pozitivní více jak dva vzorky, je zvažováno doplnění cílené biopsie před okamžitým ukončením aktivního sledování a provedení radikální léčby. MRI je tedy již jako volitelná diagnostická metoda přímo zahrnuta do protokolu (5). V současnosti je MRI považována za jednu z nejlepších zobrazovacích metod pro detekci a staging prostatického karcinomu. Poskytuje excelentní anatomické zobrazení prostatické žlázy a dosahuje 88% senzitivity a 74% specificity v detekci ložiska karcinomu (6). Jednou z veličin, kterou lze při aktivním sledování zpřesnit pomocí magnetické rezonance, je identifikace ložiska tumoru v prostatě, zhodnocení jeho velikosti ev. jeho zacílení při biopsii pomocí cílené biopsie s fúzí MRI s cílem snížit riziko podhodnocení gradingu tumoru (7). Dá se tedy sledovat ev. progrese tumorózního ložiska, ale také při zacílení jehly do centra tumoru při biopsii lépe odpovídá reálnému GS (9).
MATERIÁL A METODA
V období od roku 2009 bylo na našem pracovišti do režimu active surveillance zařazeno 69 pacientů splňujících Epsteinova kritéria. Od roku 2012 jsme začali do protokolu sledování zařazovat i vyšetření pomocí mp‑MRI. Třicet pacientů podstoupilo v průběhu sledování multiparametrickou magnetickou rezonanci prostaty na přístroji 1,5 T bez použití endorektální cívky. Vyšetřovací protokol zahrnoval T2 vážený obraz, DWI a DCE zobrazení. K vyhodnocení byl od října 2015 použit strukturovaný skórovací systém dle doporučení ESUR tzv. PI‑RADS verze 2 (10). Vyšetření provedená před tímto datem byla zpětně podle tohoto systému přehodnocena. Záznamy byly vyhodnoceny jedním radiologem specializovaným na vyšetření prostaty. Následovala cílená biopsie ložisek popsaných jako PIRADS skóre 4 či skóre 5. Z každého ložiska byly odebrány dva bioptické vzorky. Cílená biopsie byla provedena pomocí kognitivní či softwarové fúze (Uronav) transrektálně. Kognitivní fúze byla provedena u 21 pacientů (70 %) a softwarová fúze u 9 pacientů (30 %). Vyhodnocen byl záchyt karcinomu v rebiopsii, shoda mezi ložisky popsanými jako PIRADS skóre 4 a PIRADS skóre 5 a pozitivitou válečku. Pozitivní výsledek v histologii byl počítán jen pokud byl nález hodnocen jako adenokarcinom. Histologické nálezy HGPIN a ASAP byly počítány jako negativní. Pokud nebyla splněna Epsteinova kritéria, pak byla pacientovi navržena radikální léčba. Pro pokračování v režimu AS jsme nepřipouštěli ani minimální postižení GS 3+4 ani vyšší počet postižených bioptických vzorků než dva. Byla vyhodnocena změna strategie směrem k radikální léčbě a vyhodnocení definitivních preparátů po radikální robotické prostatektomii (RARP). Hodnotili jsme četnost podhodnocení definitivního GS a definitivního T‑stadia a také celkové prognostické zhodnocení. Jako příznivý pooperační nález bylo hodnoceno stadium pT ≤2 a GS ≤3+4. Jako nepříznivý pooperační nález pak stadium pT 3–4 a GS ≥4+3.
VÝSLEDKY
Ve sledovaném období bylo zařazeno do studie 69 pacientů splňujících indikační kritéria. Průměrná doba sledování pacientů v režimu active surveillance byla 3,37 (1–9) roku. Průměrný věk pacienta byl 65,8 (55–74 let) resp. medián 65 let, průměrné PSA bylo 6,08 (2,54–9,58 ng/ml) resp. medián 5,6 ng/ml, průměrný objem prostaty 59 (16–113 ml) resp. medián 36 ml a průměrná denzita 0,17 (0,04–0,44 ng/ml/ml) resp. medián 0,14 ng/ ml/ml. V cílených biopsiích byl potvrzen karcinom u 19 pacientů (záchyt 63 %). Frekvence záchytu karcinomu při pozitivním MRI s ložiskem PIRADS 4 byl 32 % a s ložiskem PIRADS 5 76 % (tab. 1). Celkem 13 pacientů (43 %) na základě výsledků cílené biopsie ukončilo režim aktivního sledování pro nesplnění kritérií protokolu AS a byla navržena radikální léčbu (devět pacientů podstoupilo RARP, u dvou je RARP v plánu a dva podstoupili radioterapii) (tab. 2). U žádného pacienta nebyla indikována současně lymfadenektomie. Ve srovnání s definitivním preparátem po RARP došlo k upgradingu u 33 % pacientů (3/9) a k upstagingu u 22 % pacientů (2/9). U pacientů, kteří podstoupili radikální prostatektomii bylo dosaženo příznivého stadia u pěti pacientů (55 %) a nepříznivého stadia u čtyř pacientů (45 %) (tab. 3). Všichni pacienti, kteří podstoupili radikální léčbu, jsou dosud v remisi.
1. Charakteristika souboru mužů zařazených v AS v čase cílené biopsie Tab. 1. Characteristics of the group of men included in AS at the time of targeted biopsy 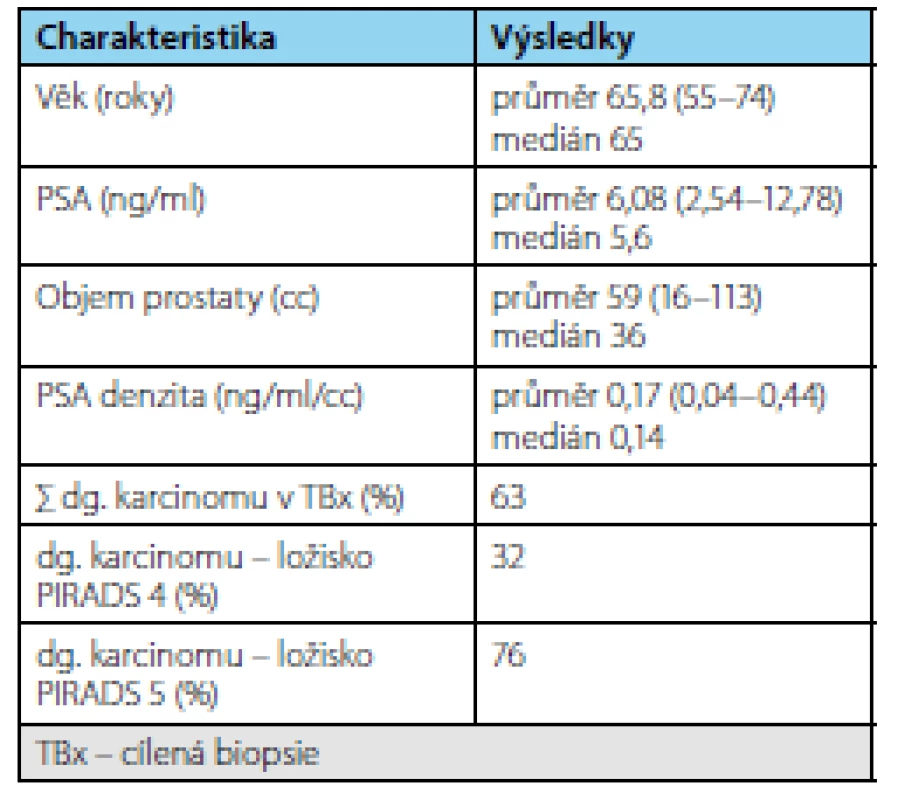
2. Důvody ukončení AS a léčba po ukončení AS (n=13) Tab. 2. Reasons for AS termination and treatment following AS termination (n=13) 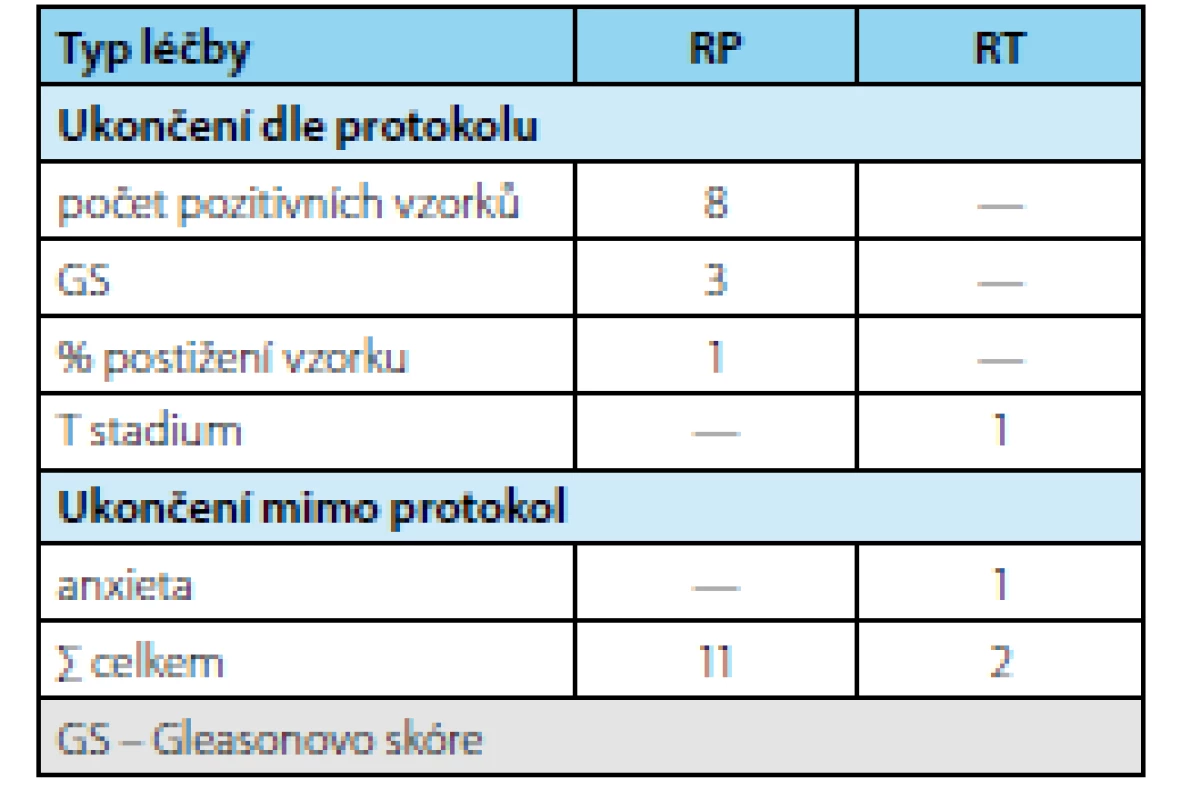
3. Výsledky po radikální prostatektomii po ukončení AS (n = 9) Tab. 3. Results after radical prostatectomy following AS termination (n=9) 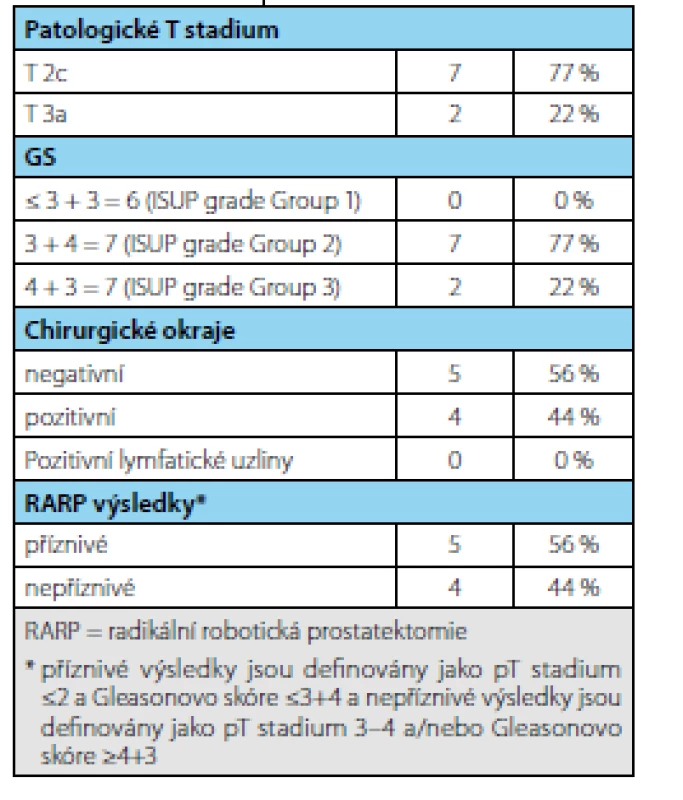
DISKUZE
Režim aktivního sledování je uznávaným postupem v terapii nízkorizikového karcinomu prostaty, neboť umožňuje snížit zbytečnou léčbu u pacientů s nesignifikantním onemocněním. Od jeho zavedení do terapie je snaha o zpřesnění indikačních kritérií a protokolu následných kontrol s cílem zajistit bezpečnou strategii s minimalizací rizika progrese do lokálně pokročilých stadií. Zavedení multiparametrické magnetické rezonance do protokolu sledování nabízí možnost zhodnocení velikosti ložiska, možnost jeho přesného zacílení při biopsii ev. možnost sledovat progresi velikosti daného ložiska. V současnosti je diskutováno několik otázek:
1. Jaká je četnost pozitivního či negativního MRI u pacientů v režimu aktivního sledování?
V našem souboru všichni pacienti zařazení v režimu aktivního sledování měli pozitivní MRI tzn. měli popsáno nejméně jedno ložisko PIRADS skóre 4 nebo 5. V literatuře je uváděna pozitivita MRI v 73 % (11). Univariantní analýzou bylo prokázáno, že viditelnost ložiska na MRI je silným prediktorem pro nepříznivé pooperační stadium (12).
2. Jaké je procento pacientů, kteří po cílené biopsii nesplňují kritéria pro pokračování v režimu active surveillance?
V našem souboru jsme na základě cílené biopsie překlasifikovali 43 % pacientů, což odpovídá souhrnným výsledků uváděným v literatuře (11). Přitom k upgradingu došlo v našem souboru v 10 % a k upstagingu ve 3 %, u zbývajících šlo o navýšení počtu pozitivních vzorků (tab. 2). To je ve shodě se zjištěním, že u MRI pozitivních nálezů dochází signifikantně častěji k upgradingu, zatímco rozdíl v upstagingu je nesignifikantní (11). Pro srovnání – k reklasifikaci na základě samotných indikačních kritérií včetně rebiopsie dochází v 20–30 % pacientů (13, 14, 15). Je tedy zřejmé, že MRI zvyšuje procento pacientů, u nichž je indikováno započetí radikální terapie.
3. Jaká je přesnost stanovení předoperačního stadia ve srovnání s definitivním preparátem?
Ve srovnání s definitivním preparátem po RARP došlo k upgradingu u 33 % pacientů (3/9) a k upstagingu u 22 % pacientů (2/9), což odpovídá výsledkům uváděným v literatuře (16, 17). Jako příznivé stadium pro pokračování v režimu active surveillance je považováno stadium pT≤2 a Gleasonovo skóre ≤3+4. Z našeho souboru pooperačně mělo pět pacientů příznivé stadium (55 %) vs. čtyři pacienti stadium nepříznivé (45 %). Toto je ve shodě s publikovanými výsledky (12). Všichni pacienti z našeho souboru jsou v průběhu dalšího sledování v remisi. Park uvádí viditelné ložisko na MRI jako silný prediktor progrese do nepříznivého stadia (12). Je tedy otázkou, zda viditelnost či velikost ložiska bude zařazena jako jedno z kritérií pro hodnocení pokračování režimu AS. Z těchto výsledků vyplývá, že v současnosti může MRI napomoci vyhledat pacienty vhodné pro režim active surveillance ev. v průběhu sledování pak nasměřovat směrem k radikální léčbě na základě zpřesňujících údajů získaných pomocí MRI či MRI navigované biopsie (18, 19, 20, 21).
ZÁVĚR
Cílená biopsie pomocí multiparametrické magnetické rezonance v našem souboru zvýšila záchyt rizikového karcinomu prostaty ve 43 %, což směřovalo k ukončení režimu active surveillance a podstoupení radikální terapie. Mp‑MRI může pomoci v identifikaci agresivního onemocnění v průběhu active surveillance, a tím zvýšit bezpečnost této strategie pro pacienty. Pro využití MRI v průběhu režimu aktivního sledování bude potřeba definovat signifikantnost radiologického nálezu a také definovat radiologickou progresi.
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Došlo: 6. 9. 2017
Přijato: 30. 9. 2017
Kontaktní adresa:
MUDr. Šárka Kudláčková
Urologická klinika LF UP a FN Olomouc
I. P. Pavlova 6,
779 00 Olomouc
e-mail: sarka.kudlackova@fnol.cz
Sources
1. Prostate Cancer Research International: Active Surveillance. Active surveillance of early prostate cancer. PRIAS Web site. http://www.prias‑project. org. Accessed November 14, 2011.
2. Král M, Študent V ml, Grepl M, et al. Aktivní sledování u karcinomu prostaty. Ces Urol 2014; 18(3): 208–215.
3. Draisma G, Boer R, Otto SJ, et al. Lead times and overdetection due to prostate‑specific antigen screening: estimates from the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst. 2003; 95 : 868–878.
4. Vargas HA, Akin O, Afaq A, et al. Magnetic resonance imaging for predicting prostate biopsy findings in patients considered for active surveillance of clinically low risk prostate cancer. J Urol 2012; 188 : 1732–1738.
5. Bokhorst LP, Valdagni R, Rannikko A, et al. A decade of active surveillance in the PRIAS study: an update and evaluation of the criteria used to recommend a switch to active treatment. Eur Urol 2016; 70 : 954–960.
6. de Rooij M, Hamoen EH, Fütterer JJ, Barentsz JO, Rovers MM. Accuracy of multiparametric MRI for prostate cancer detection: a meta‑analysis. Am J Roentgenol 2014; 202 : 343–351.
7. Wysock JS, Rosenkrantz AB, Huang WC, et al. A prospective, blinded comparison of magnetic resonance (MR) imaging – ultrasound fusion and visual estimation in the performance of MR‑targeted prostate biopsy: the PROFUS trial. Eur Urol 2014; 66 : 343–351.
8. The National Institute for Health and Care Excellence. Nice guidelines. Available from: http: //www. nice.org.uk/guidance/cg175/chapter/key‑priorities‑for‑implementation.
9. Tosoian JJ, Loeb S, Epstein JI, et al. Active surveillance of prostate cancer: use, outcomes, imaging, and diagnostic tools. In American Society of Clinical Oncology educational book/ASCO. American Society of Clinical Oncology. Meeting (Vol. 35, p. e235). NIH Public Access.2016.
10. Radiology ACo. PI‑RADS™Prostate Imaging and Reporting and Data System v2.http://wwwacrorg/~/ media/ACR/Documents/PDF/QualitySafety/Resources/PIRADS/PIRADSV2pdf. 2015.
11. Schoots IG, Petrides N, Giganti F, et al. Magnetic resonance imaging in active surveillance of prostate cancer: a Systematic review. Eur Urol 2015; 67 : 627–636.
12. Park BH, Jeon HG, Choo SH, et al. Role of multiparametric 3.0-Tesla magnetic resonance imaging in patients with prostate cancer eligible for active surveillance. BJU Int 2014; 113 : 864–870.
13. Berglund RK, Masterson TA, Vora KC, et al. Pathological upgrading and up staging with immediate repeat biopsy in patients eligible for active surveillance. J Urol 2008; 180 : 1964–1968.
14. Bul M, Zhu X, Valdagni R, et al. Active surveillance for low‑risk prostate cancer worldwide: the PRIAS study. Eur Urol 2013; 63 : 597–603.
15. Hu JC, Chang E, Natarajan S, et al. Targeted prostate biopsy in select men for active surveillance – do the Epstein criteria still apply? J Urol 2014; 192 : 385–390.
16. Čapoun O, Babjuk M, Dvořáček J, et al. Predikce patologické klasifikace karcinomu prostaty. Ces Urol 2008; 12(1): 31–36.
17. Král M, Študent V, Vidlář A, Hrabec M, Marek D. Nomogram predikce up‑gradingu Gleasonova skóre v biopsii prostaty. Ces Urol 2007; 11 : 159–163.
18. Dall’Era MA, Cowan JE, Simko J, et al. Surgical management after active surveillance for low‑risk prostate cancer: pathological outcomes compared with men undergoing immediate treatment. BJU Int. 2011; 107 : 1232–1237.
19. Bul M, Zhu X, Rannikko A, et al. Radical prostatectomy for low‑risk prostate cancer following initial active surveillance: Results from a prospective observational study Eur Urol 2012; 62(2): 95–200.
20. Moldovan PC, Van den Broeck T, Sylvester R, et al. What Is the negative predictive value of multiparametric magnetic resonance imaging in excluding prostate cancer at biopsy? a systematic review and meta‑analysis
from the European Association of Urology Prostate Cancer Guidelines Panel. Eur Urol 2017.
21. Fütterer JJ, Briganti A, De Visschere P, et al. Can clinically significant prostate cancer be detected with multiparametric magnetic resonance imaging? a systematic review of the literature. Eur Urol 2015; 68 : 1045–1053.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2017 Issue 3-
All articles in this issue
- THE CLINICAL VALUE OF 99MTC‑MAG3 RENAL SCINTIGRAPHY IN THE FOLLOW‑UP OF PATIENTS AFTER PYELOPLASTY FOR UNILATERAL PELVIC‑URETERIC JUNCTION OBSTRUCTION
- LAPAROSCOPIC RESECTION OF STENOSIS OF URETER – VIDEO
- INFORMED CONSENT IN UROLOGY
- THE ROLE OF MULTIPARAMETRIC MAGNETIC RESONANCE IMAGING IN ACTIVE SURVEILLANCE OF PROSTATE CANCER
- ILICOURETERAL FISTULA AS A CAUSE OF LIFE-THREATENING HAEMATURIA
- HERNIATION OF THE URINARY BLADDER
- RARE HISTOLOGICAL FINDING OF INVASIVE UROTHELIAL CARCINOMA OF URINARY BLADDER
- LEIOMYOMA OF THE URINARY BLADDER AS AN INCIDENTAL FINDING DURING ULTRASONOGRAPHY EXAMINATION OF A PREGNANT PATIENT
- THE SIGNIFICANCE OF MRI IN DIAGNOSING PENILE FRACTURE IN A CASE REPORT OF A 16-YEAR-OLD BOY
- SIGNIFICANT PERSONALITY OF THE CZECH AND SLOVAK UROLOGY PROF. MUDR. JOZEF ŠVÁB, CSC.
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- THE SIGNIFICANCE OF MRI IN DIAGNOSING PENILE FRACTURE IN A CASE REPORT OF A 16-YEAR-OLD BOY
- THE ROLE OF MULTIPARAMETRIC MAGNETIC RESONANCE IMAGING IN ACTIVE SURVEILLANCE OF PROSTATE CANCER
- ILICOURETERAL FISTULA AS A CAUSE OF LIFE-THREATENING HAEMATURIA
- LAPAROSCOPIC RESECTION OF STENOSIS OF URETER – VIDEO
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

