-
Medical journals
- Career
KABAZITAXEL V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
: Igor Richter 1,2; Josef Dvořák 2; Věra Hejzlarová 1; Eva Čermáková 3; Jiří Bartoš 1
: Onkologické oddělení, Krajská nemocnice Liberec, a. s. 1; Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha 2; Ústav informatiky a biofyziky, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové 3
: Ces Urol 2016; 20(3): 214-220
: Original Articles
Hlavní stanovisko práce:
Kabazitaxel patří mezi nové léčebné možnosti u pacientů s metastatickým kastračně rezistentním karcinomem prostaty (mCRPC). Prezentujeme retrospektivní analýzu tolerance a účinnosti kabazitaxelu u 14 pacientů léčených pro mCRPC.Cíl:
retrospektivní zhodnocení účinnosti a tolerance kabazitaxelu v léčbě metastatického kastračně rezistentního karcinomu prostaty (mCRPC).Metody:
celkem bylo hodnoceno 14 pacientů s mCRPC po předchozí terapii docetaxelem. Kabazitaxel byl podáván v dávce 25 mg/m2 v třítýdenních intervalech. Současně byl podáván prednison 10 mg/den po celou dobu léčby kabazitaxelem. Hodnotili jsme celkové přežití (OS) i přežití bez známek progrese (PFS).Výsledky:
Medián sledování byl 16,5 měsíce. Medián OS činil 9,6 měsíce (95 % CI 7,5–22 měsíců). Dvouleté celkové přežití bylo popsáno u 23,45 % (95 % CI 0–59 %) pacientů. Medián PFS činil 5,5 měsíce (95 % CI 2,7–10,8 měsíců). Převažovala toxicita I. a II. stupně. Toxicita stupně III a IV: anémie u dvou pacientů, leukopenie u jednoho pacienta, hematurie u jednoho pacienta, jeden pacient měl akutní srdeční selhání.Závěr:
Kabazitaxel prokázal příznivý profil toxicity a účinnost v léčbě metastatického kastračně rezistentního karcinomu prostaty v klinické praxi.KLÍČOVÁ SLOVA :
Karcinom prostaty, metastázy, chemoterapie, docetaxel, kabazitaxel.ÚVOD
Incidence karcinomu prostaty v posledních 20 letech výrazně stoupla. Prakticky u všech pacientů s pokročilým karcinomem prostaty dochází k progresi onemocnění, i přes kastrační hodnoty testosteronu. Onemocnění se definuje jako kastračně rezistentní karcinom prostaty (1). V minulosti byla standardem léčby metastatického kastračně rezistentního karcinomu prostaty (mCRPC) chemoterapie mitoxantronem v kombinaci s prednisonem, která neprodlužovala přežití, ale měla příznivý vliv na ovlivnění symptomatologie onemocnění (2). Na podkladě klinických studií se stal od roku 2004 standardem léčby první linie docetaxel, který prodloužil i celkové přežití u pacientů s mCRPC (3, 4). Druhá a další linie léčby po progresi na léčbě docetaxelem nebyla standardně definovaná. Používala se různá cytostatika (mitoxantron, vinorelbin a jiná) bez výraznějšího efektu na celkové přežití nemocných. Až v posledních letech došlo k dalšímu rozšíření léčebných možností u pacientů s mCRPC. Jedním z nových cytostatik je kabazitaxel (Jevtana®, Sanofi, Paříž, Francie) patřící do skupiny taxanů druhé generace. V roce 2010 byly publikovány výsledky randomizované klinické studie III. fáze, která hodnotila kabazitaxel a mitoxantron v kombinaci s prednisonem u 755 pacientů s mCRPC, kteří byli předléčení docetaxelem. Studie prokázala významné prodloužení celkového přežití u pacientů léčených kabazitaxelem (15,1 versus 12,7 měsíce), byla popsána 30% redukce relativního rizika úmrtí (HR 0,7, 95 % CI 0,59–0,83; p 0,0001) (5). Na podkladě těchto prezentovaných dat byl kabazitaxel schválen k léčbě mCRPC u nemocných po předchozí terapii docetaxelem. V rámci našeho onkologického centra jsme začali kabazitaxel používat u pacientů od roku 2013. Cílem předkládané práce je retrospektivní analýza klinických zkušeností, léčebných výsledků a toxicity celkem u 14 pacientů s mCRPC léčených kabazitaxelem pro mCRPC.
PACIENTI A METODY
Celkem jsme kabazitaxelem léčili od října 2013 do 10. 2. 2016 (datum hodnocení) celkem 14 mužů s metastatickým kastračně rezistentním karcinomem prostaty. Medián věku všech pacientů byl 68 let, rozmezí 57–72 let. Osm pacientů bylo primárně generalizováno, u šesti pacientů došlo k rozvoji metastatického onemocnění v rozmezí 19 až 78 měsíců od diagnózy lokálního onemocnění. Lokální terapii (radikální prostatektomie nebo radioterapie) byla indikovaná u sedmi pacientů. U všech 14 pacientů při prokázaní metastatického postižení jsme indikovali hormonální léčbu (12 pacientů aplikace analog LHRH, dva pacienti absolvovali chirurgickou kastraci). Nejčastěji se vyskytovaly kostní metastázy u 12 pacientů, dále u čtyřech pacientů bylo popsáno metastatické postižení lymfatických uzlin pánve nebo retroperitonea. Medián délky vzniku kastračně rezistentního karcinomu prostaty byl 16 měsíců (rozmezí 9 až 60 měsíců) od doby zahájení hormonální terapie pro metastatické onemocnění. Všech 14 nemocných absolvovalo systémovou chemoterapii docetaxelem v první linii léčby mCRCP. Medián počtu cyklů docetaxelu byl sedm, rozmezí 3–10 cyklů. Kabazitaxel jsme indikovali u pacientů s progresí onemocnění v průběhu terapie docetaxelem nebo do tří měsíců od ukončení léčby docetaxelem (ve smyslu tehdejší úhradové vyhlášky). Kabazitaxel jsme podávali ve standardní dávce 25 mg/m2 tělesného povrchu ve třítýdenních intervalech. Maximální počet aplikovaných cyklů kabazitaxelu byl omezen plátcem zdravotní péče na deset. Společně s kabazitaxelem jsme aplikovali prednison po celou dobu léčby kabazitaxelem v dávce 10 mg/den ve dvou denních dávkách. U hodnocených nemocných byl medián vstupní koncentrace hemoglobinu 126 (91–128) g/l, medián vstupní koncentrace leukocytů byl 8,9 (3,9–11,8) 109/l, medián vstupní koncentrace trombocytů 182 (138–407) 109/l. Medián vstupní hodnoty PSA byl 54 (17–913) ng/ml. Pacienti byli v celkovém výkonnostním stavu 0–1 podle škály ECOG. Demografická data jsou uvedena v tabulce 1. V rámci statistického hodnocení jsme definovali dva ukazatele. Celková doba přežití (OS) = doba od zahájení terapie kabazitaxelem do doby úmrtí nebo do dne poslední kontroly u přeživších pacientů (cenzorovaná data). Přežití bez známek progrese (PFS) = doba od zahájení terapie kabazitaxelem do progrese onemocnění nebo do poslední kontroly u pacientů bez progrese (cenzorovaná data). Progresi onemocnění jsme definovali buď na podkladě RECIST 1.1 kritérii při použití zobrazovacích vyšetření (CT vyšetření nebo scintigrafie skeletu), nebo při klinickém zhoršení stavu se současnou elevací PSA. Samotné zvýšení hodnot PSA nebylo hodnoceno jako progrese onemocnění. Celkové přežití a přežití bez známek recidivy bylo vypočteno pomocí Kaplan-Meierovy analýzy. Statistická analýza byla vypracována s využitím statistického programu NCSS 9 (Kaysville, Utah, USA).
1. <i>Demografické údaje souboru pacientů</i> Table 1. <i>Demographic dates of group of patients</i> 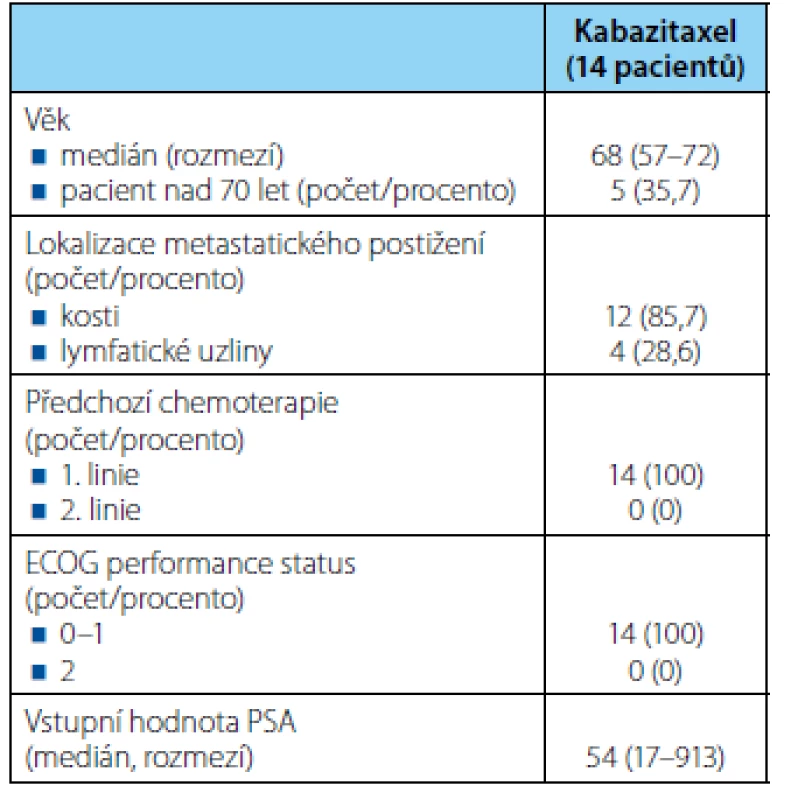
VÝSLEDKY
Medián sledování pacientů v době zhodnocení byl 16,5 měsíce. Medián délky trvání terapie kabazitaxelem byl sedm cyklů (rozmezí 1–10 cyklů). Medián nadiru koncentrace hemoglobinu byl 111 (75–124) g/l , medián nadiru koncentrace leukocytů byl 8,9 (3–9,6) 109/l, medián nadiru koncentrace trombocytů 159 (108–407) 109/l. Při hodnocení hematologické toxicity jsme srovnávali vstupní hodnoty krevního obrazu před zahájením terapie kabazitaxelem a hodnoty nadiru v průběhu terapie. Dva pacienti měli sníženou koncentraci hemoglobinu a v jednom případě jsme pozorovali pokles leukocytů pod normu před zahájením terapie kabazitaxelem. V případě, že nedošlo k dalšímu poklesu hodnot v krevním obraze v průběhu terapie, nehodnotili jsme to jako toxicitu způsobenou kabazitaxelem. V rámci hematologické toxicity jsme pozorovali výskyt anémie stupně I u třech (21,4 %), anémie stupně II u čtyř (28,6 %) a anémie stupně III u dvou pacientů (14,3 %). Leukopenie stupně I u dvou (14,3 %) a leukopenie stupně III u jednoho nemocného (7,1 %). Trombocytopenie stupně I jsme pozorovali ve třech případech (21,4 %). V rámci nehematologické toxicity jsme pozorovali převážně toxicitu mírného stupně I.–II. Přehled nehematologické toxicity stupně I a II je uveden v tabulce 2. Nejčastěji se vyskytovala únava, celkem u sedmi pacientů. Ze závažných nežádoucích účinků (grade III a IV) se objevilo srdeční selhání s plicním edémem po první aplikaci kabazitaxelu u jednoho nemocného. Pacient již následně v léčbě kabazitaxelem nepokračoval. U jednoho pacienta se vyskytla 2x hematurie s nutností hospitalizace. V cystoskopickém nálezu nebyl nalezen zdroj krvácení. Hodnoty krevního obrazu a koagulace byly v normě. Po symptomatické terapii se stav upravil a již se neopakoval v průběhu další léčby kabazitaxelem. Léčebná odpověď byla hodnocena celkem u 13 pacientů, u jednoho nemocného jsme léčebnou odpověď nehodnotili z důvodu výše zmíněného selhání srdce s plicním edémem po první aplikaci kabazitaxelu. Kompletní remisi onemocnění jsme nepozorovali ani v jednom případě, parciální remisi jsme pozorovali u sedmi pacientů (53,8 %), stabilizaci u jednoho nemocného (7,7 %) podle RECIST 1,1 kritérii. Progresi jsme popsali u pěti nemocných (38,5 %). Dva pacienti progredovali na podkladě zhoršení klinického stavu se současnou elevací PSA, tři nemocní měli progresi podle zobrazovacích vyšetření. K datu hodnocení žilo celkem sedm pacientů, stejný počet nemocných zemřelo. Medián celkového přežití činil 9,6 měsíce (95 % CI 7,5–22 měsíců). Dvouleté celkové přežití bylo popsáno u 23,45 % (95 % CI 0–59 %) pacientů (obrázek 1).
U dvou pacientů probíhá terapie kabazitaxelem doposud. Medián přežití bez známek progrese činil 5,5 měsíce (95 % CI 2,7–10,8 měsíců, obrázek 2).
2. <i>Přehled nehematologické toxicity stupně I–II</i> Table 2.<i> Non-hematologic toxicity grade I–II</i> 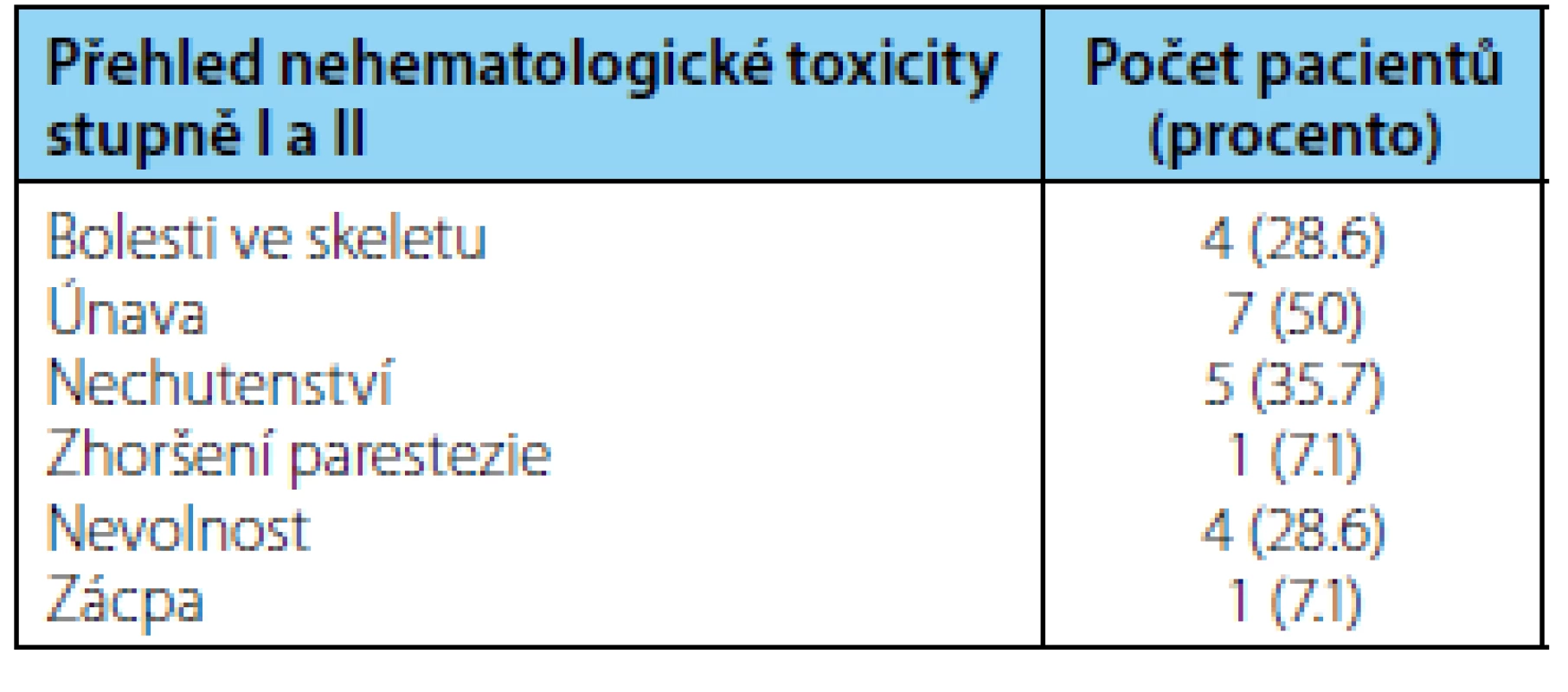
1. <i>Celkové přežití pacientů (plná čára). Osa: x – čas (dny), osa y – relativní přežití (%), přerušovaná čára – 95 % interval spolehlivosti</i> Fig. 1. <i>Overall survival (solid line). Axis x – time (days), axis y – relative survival (%). Dotted line – 95 % confidence interval</i> 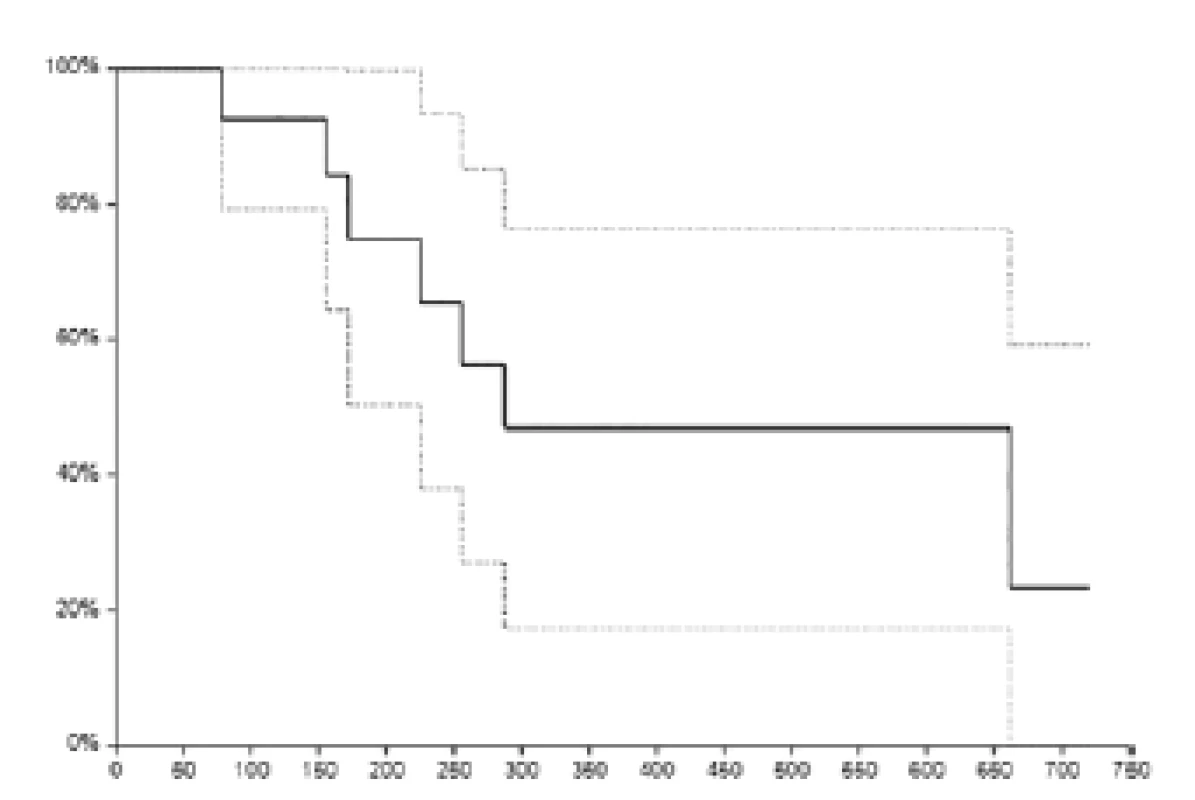
2. <i>Přežití bez progrese (plná čára). Osa: x – čas (dny), osa y – relativní přežití (%), přerušovaná čára – 95 % interval spolehlivosti.</i> Fig. 2.<i> Progression free survival (solid line). Axis x – time (days), axis y – relative survival (%). Dotted line – 95 % confidence interval</i> 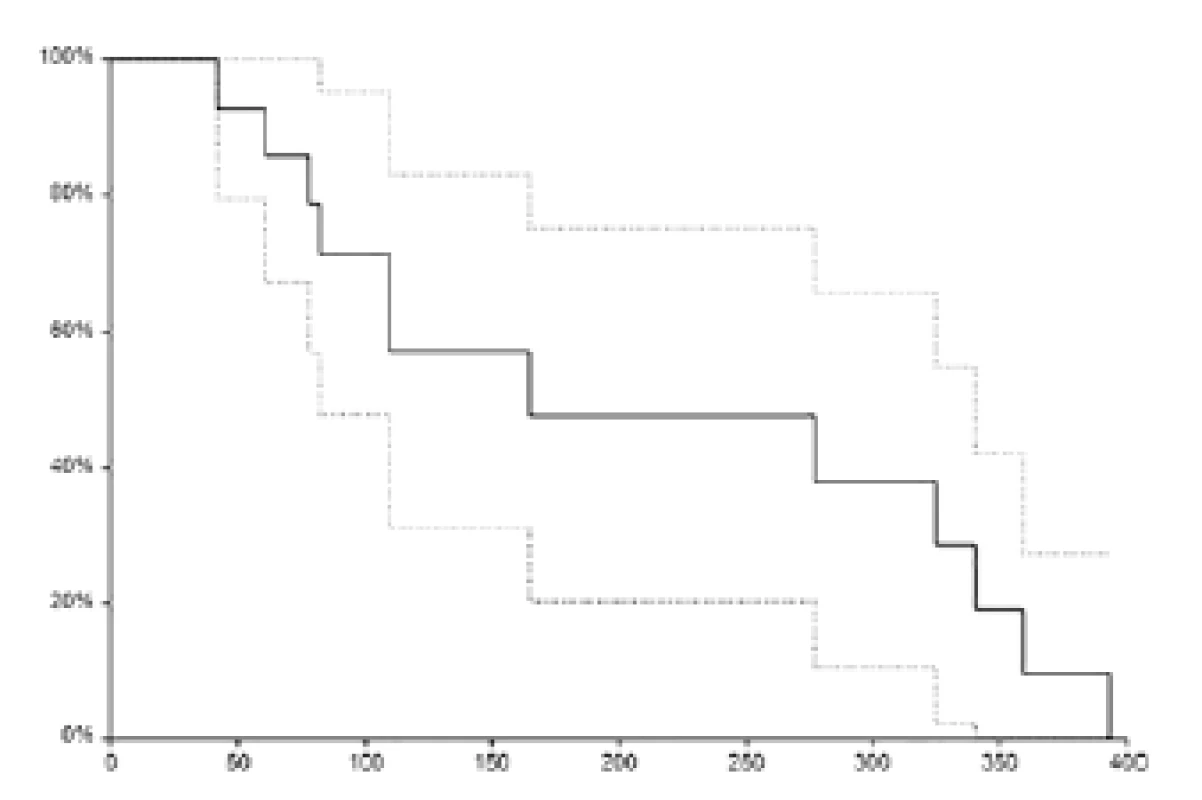
DISKUZE
Prezentované výsledky hodnotí naše první zkušenosti s kabazitaxelem v terapii mCRPC po předchozí léčbě docetaxelem. Vzhledem k novému cytostatiku jsme se snažili indikovat k léčbě kabazitaxelem nemocné v dobrém výkonnostním stavu a bez závažné toxicity způsobené předchozí onkologickou léčbou. K léčbě kabazitaxelem jsme indikovali mladší spektrum pacientů než k léčbě abirateronem či enzalutamidem v podobné indikaci (6). I přes pečlivý výběr pacientů byl medián celkového přežití našeho souboru kratší než v registrační studii TROPIC (9,6 versus 15,1 měsíce) (5). Příčinou kratšího celkového přežití při hodnocení našeho souboru ve srovnání s výsledky studie TROPIC může být malý počet pacientů a krátká doba sledování. V roce 2013 byla publikována další analýza dat ze studie TROPIC, která hodnotila dvouleté přežití u pacientů léčených kabazitaxelem nebo mitoxantronem. Podle Kaplan-Meierovy analýzy bylo přežití delší než dva roky u 27 % (95 % CI 23–32 %) pacientů léčených kabazitaxelem a u 16 % (95 % CI 12–20 %) případů léčených mitoxantronem (7). V rámci našeho souboru jsme dosáhli podobné hodnoty dvouletého přežití (23,45 %). Podle výsledků se zdá, že přibližně u 25 % nemocných léčených kabazitaxelem lze očekávat déletrvající celkové přežití. Výzvou aktuálního výzkumu je identifikovat tuto skupinu pacientů, která by měla výraznější benefit z léčby kabazitaxelem. Při indikaci cytostatické léčby je nutno předpokládat i výskyt možných nežádoucích účinků. V rámci hodnocení nehematologické toxicity jsme pozorovali převážně nežádoucí účinky mírného stupně odpovídající spektru nežádoucích účinků v klinické studii TROPIC. Problémem delšího trvání léčby chemoterapií může být kumulativní toxicita, která může vést k předčasnému ukončení dosud účinné léčby a je obtížně léčebně ovlivnitelná. Pro taxany je typickým příkladem kumulativní toxicity vznik periferní neuropatie (8). Při hodnocení incidence závažné periferní neuropatie po kabazitaxelu byl prokázán její nižší výskyt než ve studiích hodnotících první generaci taxanů (docetaxel, paklitaxel). V rámci studie TROPIC byla incidence závažné periferní neuropatie u 0,8 % léčených pacientů. V rámci našeho souboru 14 nemocných léčených kabazitaxelem jsme pozorovali zhoršení či objevení neuropatie jenom v jednom případě. Při hodnocení hematologické toxicity ve studii TROPIC byl výskyt neutropenie v 94 % případů. Až 82 % pacientů mělo vyjádřen stupeň neutropenie III–IV, z toho u osmi procent nemocných se vyskytla febrilní neutropenie. Při hodnocení našeho souboru jsme u prvního léčeného pacienta pozorovali po prvním cyklu kabazitaxelu rozvoj neutropenie stupně III s nutným odkladem dalšího cyklu terapie o týden. Proto jsme dále u všech pacientů léčených kabazitaxelem používali profylakticky pegfilgrastim. U pacientů jsme pak neutropenii stupně III a IV, která by limitovala podání léčby, již nepozorovali. Profylaktická aplikace růstových faktorů významně redukuje riziko vzniku neutropenie a její komplikaci (HR 0,7, p 0,04) (9). Mezi rizikové faktory vzniku neutropenie stupně III a IV patří věk nad 75 let, aplikace prvního cyklu chemoterapie a počet neutrofilů méně než 4 000/mm3 před podáním kabazitaxelu (10). S cílem redukovat toxicitu kabazitaxelu se často diskutuje i použití nižší dávky kabazitaxelu než standardní dávka 25 mg/m2. Aktuálně probíhá klinická studie PROSELICA, která hodnotí dávku kabazitaxelu 20 mg/m2 po předchozí terapii docetaxelem a studie FIRSTANA, která hodnotí podobnou dávku kabazitaxelu v první linii léčby mCRPC. Tady navíc dochází i ke srovnání s docetaxelem. Tato studie si tedy položila i otázku, zda není kabazitaxel lepší než docetaxel v první linii mCRPC. Vychází z dříve prezentovaných dat, které hodnotily kabazitaxel jako účinnější než docetaxel z důvodu vlivu na p-glykoprotein s následnou redukcí vyplavení cytostatika z nádorových buněk (11). Dále se diskutuje i vliv kabazitaxelu v léčbě metastatického hormonálně senzitivního karcinomu prostaty v kombinaci s androgenní deprivací. Docetaxel již v této indikaci podle klinické studie CHAARTED prokázal účinnost (12). Ve smyslu tehdejší úhradové vyhlášky jsme kabazitaxel aplikovali u pacientů, kde došlo k progresi v průběhu léčby docetaxelem nebo do tří měsíců od ukončení léčby docetaxelem. Toto časové omezení již není v současných indikačních kritériích. Do popředí se proto nabízí i otázka, zda u nemocných po předchozí odpovědi na terapii docetaxelem opětovně indikovat léčbu docetaxelem nebo podat kabazitaxel či nové možnosti hormonální léčby (5, 13, 14). Výhodou opětovného podání docetaxelu je nižší cena léčby. Nevýhodou je riziko zvýšené incidence kumulativní toxicity docetaxelu. Proběhlo několik menších studií, které se snažily specifikovat nemocné s mCRPC, kteří by profitovali z reindukce docetaxelu (15–17). Petrioli ve svém přehledu udává kritéria, kdy lze zvážit opětovné podání docetaxelu: interval bez progrese po předchozí léčbě docetaxelem delší než 3–6 měsíců, větší než 50 % pokles koncentrace PSA po první linii léčby docetaxelem, nepřítomnost kumulativní toxicity docetaxelu, u pacientů mladších než 75 let a výkonnostní stav 0–1 dle ECOG (18). Není jasno, zda lze tuto reindukci docetaxelu u pacientů s mCRPC považovat za pokračování první linie nebo se jedná již o linii druhou (zvláště ke vztahu k plátci zdravotní péče). Další otázkou do diskuze u pacientů léčených docetaxelem pro kastračně senzitivní metastatický karcinom prostaty podle studie CHARTEED je, zda by následné podání docetaxelu při vzniku mCRPC bylo účinné. V rámci systémové terapie první linie u nemocných s mCRPC lze kromě aplikace chemoterapie zvážit i možnost podání enzalutamidu či abirateronu s vyšší účinností než placebo (19, 20). Jedná se o skupinu asymptomatických či minimálně symptomatických pacientů nebo u nemocných nevhodných k podání chemoterapie pro komorbidity.
ZÁVĚR
Prezentované retrospektivní zhodnocení našeho souboru pacientů s mCRPC léčených kabazitaxelem po předchozí terapii docetaxelem prokázalo dobrou toleranci a podobné dvouleté přežití jako registrační klinická studie. Kabazitaxel se stal pevnou součástí léčby pacientů mCRPC v rámci našeho onkologického oddělení.
Došlo: 6. 3. 2016
Přijato: 15. 6. 2016
Kontaktní adresa:
MUDr. Igor Richter, Ph.D.
Onkologické oddělení, Krajská nemocnice Liberec, a.s.
Husova 10,
460 01 Liberec
e-mail: igor.richter@seznam.cz
Střet zájmů: žádný
Prohlášení o podpoře:
Autor prohlašuje, že se jedná o nezávislý článek.
Sources
1. Ondruš D, Ondrušová M. Manažement pacientov s kastračne rezistentným metastatickým karcinómom prostaty. Klin Onkol 2015; 28 : 24–29.
2. Tannock IF, Osoba D, Stockler MR, et al. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points. JCO 1996; 14 : 1756–1764.
3. Tannock IF, de Wit R, Berry WR, et al. Docetaxel plus prednisone or mitoxantron plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351 : 1502–1512.
4. Petrylak DP, Tangen CM, Hussain MH, et al. Docetaxel and estramustine compared with mitoxantrone plus prednisone for advanced refractory prostatae cancer. N Engl J Med 2004; 351 : 1513–1520.
5. de Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostatae cancer progressing after docetaxel treatment: a randimised open-label trial. Lancet 2010; 376 : 1147–1154.
6. Richter I, Dvořák J, Hejzlarová V, et al. Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii. Klin Onkol. 2016; 29 : 127–132.
7. Bahl A, Oudard S, Tombal B, et al. Impact of cabazitaxel on 2-year survival anp palliation of tumour-related pain in men with metastatic castration-resistant prostate cancer treated in the TROPIC trial. Annals of Oncol 2013; 24 : 2402–2408.
8. Lee JJ, Swain SM. Peripheral neuropathy induced by microtubule-stabilizing agents. J clin Oncol 2006; 24 : 1633–1642.
9. Tsao CK, Cutting E, Martin J, Oh WK. The role of cabazitaxel in the treatment of metastatic castration-resistant prostate cancer. Ther Adv Urol 2014; 6 : 97–104.
10. Heidenreich A, Bracarda S, Mason M, et al. Safety of cabazitaxel in senior adults with metastatic castration-resistant prostatae cancer: results of the European compassionate-use programme. Eur J Cancer.
11. Mita A, Denis L, Rowinski E, et al. Phase I and pharmacokinetic study of XRP6258 (RPR 116258A), a novel taxane, administered as 1-hour infusion every 3 weeks in patients with advanced solid tumors. Clin Cancer Res 2009; 15 : 723.
12. Sweeney CJ, Chen YH, Carducci M, et al. Chemohormonal therapy in metastatic hormon-senzitive prostate cancer. N Eng J Med 2015; 373 : 737–746.
13. Scher HI, Fizazi K, Saad F, et al. Increased survival with enzalutamide in prostatae cancer after chemotherapy. N Engj J Med 2012; 367 : 1187–1197.
14. de Bono JS, Logothesis CJ, Molina A, et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364 : 1995–2005.
15. Caffo O, Pappagallo G, Brugnara S, et al. Multiple rechallenges for castration-resistant prostate cancer patients responding to first-line docetaxel: assesment of clinical outcomes and predictive factors. Urology 2012; 79 : 644–649.
16. Oudard S, Kramer G, Caffo O, et al. Docetaxel rechallenge after an initial good response in patients with metastatic castration-resistant prostate cancer. BJU Int 2015; 115 : 744–752.
17. Loriot Y, Massard C, Gross-Goupil M, et al. The interval form the last cycle of docetaxel-based chemotherapy to progression is associated with efficacy of subsequent docetaxel in patients with prostatae cancer. Eur J Cancer 2010; 46 : 1770–1772.
18. Petrioli R, Francini E, Roviello G, et al. Is there still a place for docetaxel rechallenge in prostate cancer? World J clin Oncol 2015; 6 : 99–103.
19. Ryan CJ, Smith MR, de Bono JS, et al. Abirateron in metastatic prostatae cancer without previous chemotherapy. N Engl J Med 2013; 368 : 138–148.
20. Beer TM, Amstrong AJ, Rathkof DE, et al. Enzalutamide in metastatic prostatae cancer before chemotherapy. N Engl J Med 2014; 371 : 424–433.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2016 Issue 3-
All articles in this issue
- LAPAROSCOPIC NEPHROPEXY
- OPEN RESECTION OF PAPILLARY RENAL CELL CARCINOMA CATEGORY cT2a
- A KNOWN (AND UNKOWN) HIV-POSITIVE PATIENT IN CLINICAL UROLOGICAL PRACTICE
- CYSTIC TUMORS OF THE KIDNEY
- CABAZITAXEL FOR THE TREATMENT OF METASTATIC CASTRATION-RESISTANT PROSTATE CANCER
- NEOADJUVANT CHEMOTHERAPY IN MUSCLE-INVASIVE UROTHELIAL BLADDER CANCER: CORRELATION OF RESPONSE WITH PATIENTS SURVIVAL
- URINARY INCONTINENCE IN A CHILD WITH A TRIPLEX URETER AND ECTOPIC URETER
- MINIMALLY INVASIVE TREATMENT OF A HEMORAGIC COMPLICATION AFTER ROBOTIC-ASSISTED RADICAL PROSTATECTOMY
- THE 23RD ANNUAL CONFERENCE OF THE SLOVAK UROLOGICAL SOCIETY IN ŽILINA, SLOVAKIA, 15–17 JUNE 2016.
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- CYSTIC TUMORS OF THE KIDNEY
- A KNOWN (AND UNKOWN) HIV-POSITIVE PATIENT IN CLINICAL UROLOGICAL PRACTICE
- CABAZITAXEL FOR THE TREATMENT OF METASTATIC CASTRATION-RESISTANT PROSTATE CANCER
- LAPAROSCOPIC NEPHROPEXY
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

