-
Medical journals
- Career
VLIV VOLNÝCH RADIKÁLŮ NA FERTILITU MUŽE A MOŽNOSTI LÉČBY
Authors: Lukáš Bittner 1,4; Matúš Chocholatý 2; Marcela Čechová 2; Tomáš Zima 3; Robert Grill 1
Authors‘ workplace: Urologická klinika 3. LF UK a FNKV, Praha 1; Urologická klinika 2. LF UK a FN Motol, Praha 2; Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN, Praha 3; Iscare IVF, Praha 4
Published in: Ces Urol 2015; 19(1): 11-18
Category: Review article
Overview
Příčina neplodnosti infertilního páru v polovině případů stojí na straně muže. Oxidační stres je jedním z důvodů zhoršené plodnosti muže. Článek rozebírá etiologii a mechanizmus vzniku oxidačního stresu a shrnuje současné poznatky o možnostech diagnostiky a léčby oxidačního stresu spermií.
KLÍČOVÁ SLOVA:
Antioxidanty, mužská neplodnost, spermie, oxidační stres, volné radikály.ÚVOD
V rozvinutých zemích je možno 10–17 % párů označit za neplodné (1), s tím, že neplodnost je definována jako »Neschopnost sexuálně aktivního páru,bez použití antikoncepce, spontánně počít těhotenství během jednoho roku«. Jeden z osmi párů má obtíže s početím prvního potomka a jeden z šesti párů zažívá obtíže s početím následujícího dítěte. Tři procenta žen zůstávají nedobrovolně bezdětné a 6 % žen žijících v páru nemůže mít tolik dětí, kolik by si přálo (2). Při hledání příčiny neplodnosti, je u 50 % párů identifikován čistě mužský faktor neplodnosti nebo kombinace mužského a ženského faktoru (3).
Existuje mnoho prokázaných a dobře definovaných příčin mužské subfertility a oxidační stres je jednou z nich. První, kdo poukázal na možnost poškození spermií oxidačním stresem, byl MacLeod v roce 1943. Publikoval svá pozorování, při kterých ztrácely spermie motilitu za kultivace s vysokou koncentrací kyslíku a po přidání antioxidační katalázy byla motilita spermií v tomto prostředí ochráněna (4). Teprve až Jones a jeho spolupracovníci v roce 1979 objasnili mechanizmus, kterým byla pohyblivost spermií redukována. Prokázali pokles flexibility spermatických membrán způsobený peroxidací volnými kyslíkovými radikály (5). Dle současných poznatků je u 30–80 % neplodných mužů oxidační stres identifikován jako hlavní nebo přispívající faktor infertility (6).
REAKTIVNÍ FORMY KYSLÍKU
Volné kyslíkové radikály a „Reaktivní formy kyslíku“ (Reactive Oxygen Species – ROS) jsou definovány jako molekuly či atomy, které mají alespoň jeden nepárový elektron a jsou schopny oxidovat biomolekuly. Zdroje kyslíkových radikálů ve spermatu mohou být jak vnitřní, jejichž producenty jsou spermatozoa, tak zevní, které jsou například produkovány leukocyty.
Volné radikály jsou běžnou součástí aerobního metabolizmu, jsou vytvářeny třeba během oxidativní fosforylace v mitochondriích. Jejich nepárový elektron může přispět k oxidaci biomolekul, jako jsou aminokyseliny, proteiny a lipidy, v buněčných membránách. Mezi primární formy kyslíkových radikálů patří superoxid O2.–, který vzniká přidáním elektronu k molekule kyslíku O2. Superoxid může být konvertován do sekundárních forem, jakými jsou peroxylový radikál ROO., hydroxylový radikál .OH a peroxid vodíku H2O2. Zde je nutno poukázat na to, že ne všechny reaktivní formy kyslíku jsou volnými radikály. Peroxid vodíku postrádá volný elektron, tedy nevyhovuje definici „radikálu“, ale patří mezi ROS. Kromě již zmíněných kyslíkových radikálů známe i mnohé další, jako jsou hydroperoxyl HO2., alkoxyl RO.. Ne všechny volné radikály musejí být odvozeny od kyslíku, existuje celá skupina molekul odvozených od dusíku, které jsou nazývány reaktivní formy dusíku (reactive nitrogen species – RNS).
MOŽNOSTI STANOVENÍ PŘÍTOMNOSTI VOLNÝCH RADIKÁLŮ V EJAKULÁTU
Existuje několik metod přímého či nepřímého stanovení přítomnosti volných radikálů v ejakulátu. Mezi nejvíce rozšířené modality patří chemiluminiscenční značení, které je schopno vyjádřit oxidačně-redukční potenciál spermatozoí (7). Tato technika za použití luminolu jako sondy je schopna kvantifikovat jak extracelulární, tak intracelulární množství volných radikálů. Luminol je nenabitá částice, která je schopna volně procházet buněčnou membránou a reaguje s peroxidem vodíku, hydroxylovými anionty i superoxidovými anionty. Při použití lucigeninu, což je pozitivně nabitá částice nepermeabilní pro buněčnou membránu, je možno kvantifikovat pouze přítomnost superoxidových aniontů v extracelulárním prostoru.
OCHRANA PŘED VOLNÝMI RADIKÁLY A VZNIK OXIDAČNÍHO STRESU
K ochraně tkání před působením volných radikálů lidské tělo disponuje četnými enzymatickými a neenzymatickými antioxidačními mechanizmy.Mezi nejšířeji zastoupené antioxidační enzymy v mužském ejakulátu patří superoxid dismutáza a kataláza, což jsou metaloenzymy schopné deaktivovat superoxidové radikály a peroxid vodíku na kyslík a vodu. Glutathion peroxidáza přispívá k redukci peroxidu vodíku a využívá glutathion jako donora elektronů. Neenzymatické antioxidanty přítomné v seminální tekutině jsou vitaminy E a C, glutathion, flavonoidy a albumin (8). Ochranu před peroxidací lipidů buněčných membrán přechodnými kovy poskytují chelační látky, jako je transferin, laktoferin a ceruloplazmin, které jsou taktéž zastoupeny v seminální plazmě (9).
Během spermatogeneze je určitá koncentrace volných radikálů nutností. Jejichž působení je součástí přípravy spermií ke kapacitaci. Reaktivní formy kyslíku stimulují akrosomální reakci a hyperaktivaci spermií a fosforylaci tyrosinu nutnou k vazbě na zona pellucida (10). Oxidační stres tedy nastává jen v případech nevyrovnaného poměru mezi koncentrací volných radikálů a antioxidačních mechanizmů.
Oxidační stres vede i k aktivaci transkripčních faktorů a signálních cest a k uvolňování cytokininů a chemokininů v rámci imunitní odpovědi. Ale i naopak oxidační stres spermií může být vyvolán působením zánětu. Nejčastěji přítomností leukocytů, a jak mnohé studie dokládají, i zvýšenou přítomností prozánětlivých cytokininů v seminální plazmě, které předcházejí zvýšení koncentrace volných radikálů. Mezi tyto molekuly patří TNF-α, IL-8 a IL-6. Prokázané příčiny oxidačního stresu spermií potenciálně vedoucí k mužské infertilitě shrnuje tabulka 1.
Table 1. Prokázané příčiny oxidačního stresu spermií, převzato z (40) Table 1. Established causes od sperm oxidative stress potentially leading to male factor infertility, adopted from (40) 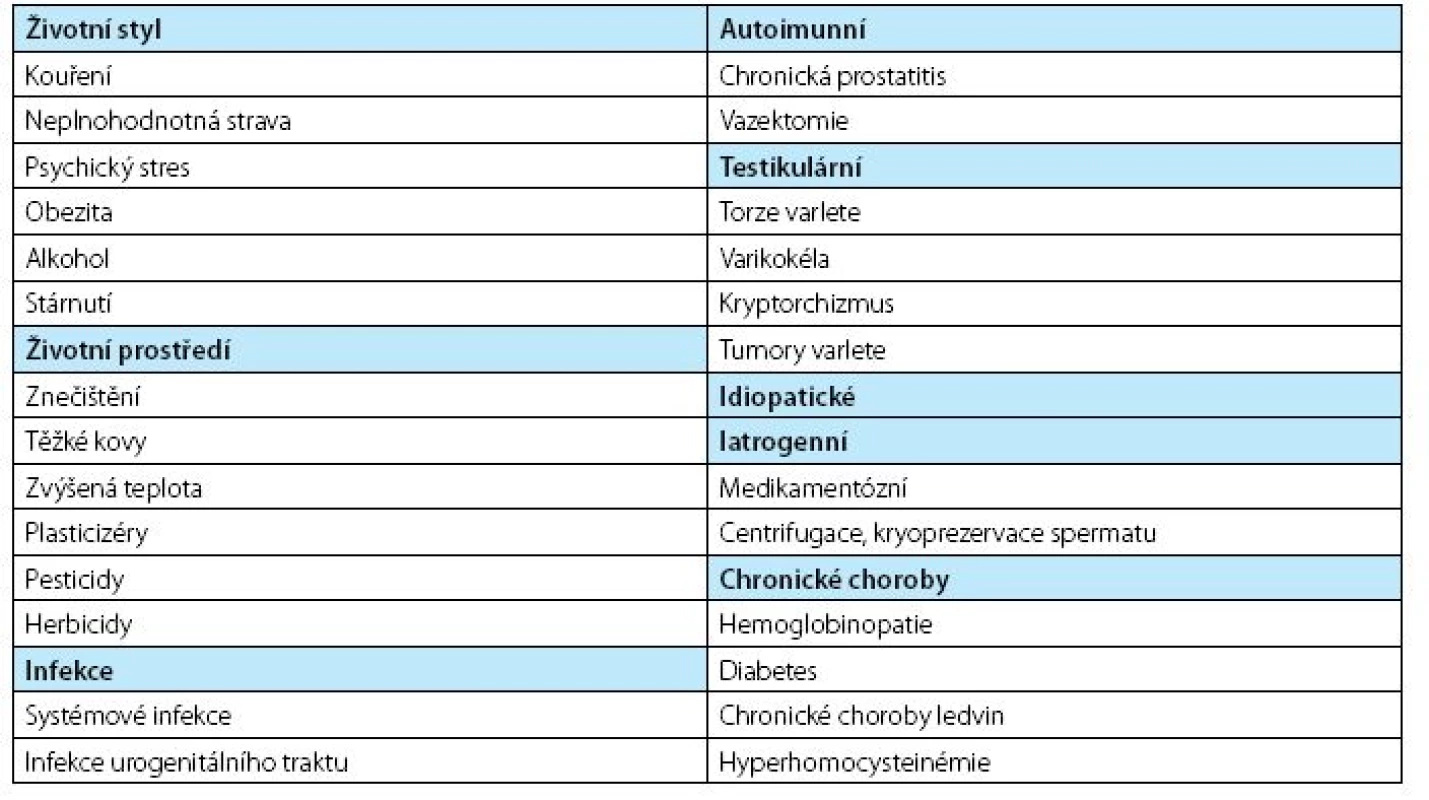
DŮSLEDKY PŮSOBENÍ OXIDAČNÍHO STRESU NA LIDSKÉ SPERMIE
Peroxidace lipidů
Lipidové složení plazmatických membrán savčích spermií se významně liší od složení somatických buněk. U spermií je velmi vysoké zastoupení fosfolipidů, sterolů, nasycených mastných kyselin a polynenasycených mastných kyselin. Membránové lipidy jsou zodpovědné za změny probíhající v buněčné stěně spermií od maturace v nadvarleti až po kapacitaci v reprodukčním ústrojí ženy. A právě peroxidace lipidů buněčné stěny je považována za klíčový mechanizmus, kterým oxidační stres ovlivňuje spermie, snižuje jejich motilitu, znesnadňuje fúzi s oocytem, a tím způsobuje neplodnost (11).
Poškození DNA
Základními mechanizmy ochrany spermatické DNA před poškozením volnými radikály je její zahuštěné sbalení a přítomnost antioxidantů v seminální plazmě (12). V důsledku oxidačního stresu však může dojít k poškození DNA, které se nejčastěji projevuje jako zlomy šroubovice, modifikace bází a zkracování telomer. Publikované studie ukazují, že až 80 % de novo vzniklých strukturních chromozomálních aberací embryí je lokalizováno v otcovských chromozomech (13).
Indukce apoptózy
Míra programované buněčné smrti zralých spermatozoí souvisí s hladinou volných radikálů. A hladiny kaspázy 3 a 9, což jsou cysteinproteázy podílející se na řízení apoptózy, jsou zvýšené v seminální plazmě u pacientů se sníženou plodností a jejich hladiny pozitivně korelují s koncentrací volných radikálů (14).
Vliv varikokély na oxidační stres spermií
Incidence varikokély se zvyšuje s věkem. 7 % prepubertálních a 10–25 % postpubertálních mladých mužů trpí varikokélou (15). V dospělém věku může být identifikována až u 43 % mužů (16). Varikokélu je možné prokázat u 35 % mužů s primární infertilitou a až u 80 % mužů s infertilitou sekundární (17). Varikokéla signifikantně zvyšuje míru oxidačního stresu varlat a stejně tak byla mataanalýzou dat prokázána i nižší hladina antioxidační enzymatické aktivity postižených varlat (18).
Několik studií potvrdilo, že chirurgické řešení varikokély je velmi efektivní a že je schopno redukovat hladinu seminálních volných radikálů a zlepšit integritu DNA spermií (19, 20). Velká metaanalýza studií hodnotících přínos varikokélektomie provedená Marmarem v roce 2007 prokázala, že pacientům po operaci se sníží hladina volných radikálů ve spermatu a získají signifikantně vyšší šanci na spontánní koncepci (21).
Antioxidanty, mechanizmus jejich působení a vliv na fertilitu muže
Dosud nebyly zavedeny žádné standardizované markery, které by byly schopny identifikovat pacienty, jež by profitovali z léčby antioxidanty, stejně tak neexistují ani běžně dostupná klinická vyšetření, která by byla schopna stanovit celkovou antioxidační kapacitu pacienta. Proto léčba antioxidanty zůstává stále léčbou empirickou, ať už se jedná o podávání skavengerů volných radikálů ve formě léků či výživových doplňků. Užívané látky s prokázaným antioxidačním potenciálem jsou následující:
Kyselina askorbová, vitamin C
Jedná se o monosacharid, který slouží jako substrát antioxidačnímu enzymu askorbát peroxidáze. Chrání lipoproteiny od poškození peroxylovým radikálem a taktéž napomáhá obnovování vitaminu E.Kyselina askorbová hraje důležitou antioxidační roli ve fyziologických koncentracích, ale při zvýšení koncentrace může docházet k její autooxidaci, a tím i zvýšení počtu volných radikálů (22).
Koncentrace vitaminu C je v seminální plazmě desetkrát vyšší než v séru (23), což nejspíše nasvědčuje jeho důležité úloze v mužské reprodukci. Taktéž bylo prokázáno, že koncentrace seminálního vitaminu C signifikantně klesá při vzestupu množství volných radikálů (24). Studie se 75 kuřáky, kteří byli náhodně rozděleni do 3 skupin užívajících placebo, 200 mg a 1 000 mg vitaminu C denně, prokázala signifikantní zlepšení morfologie spermií v podskupině s 1 000 mg vitaminu, ale beze změny v ostatních skupinách. Limitem této studie je, že se nejednalo jen o infertilní muže (25).
α tokoferol, vitamin E
Ze všech tokoferolů má α tokoferol nejvyšší biologickou aktivitu a je jedním z nejdůležitějších antioxidantů schopných přímo neutralizovat superoxidové anionty hydroperoxylové a hydroxylové radikály. Má se za to, že vitamin E hraje zásadní roli v ochraně membrán spermií, jež jsou velmi náchylné k poškození oxidačním stresem. Vitamin E má i protizánětlivé účinky a tak je schopen redukovat i oxidační stres způsobený leukocyty.
Je možno nalézt studie, které hodnotily schopnost vitaminu E ochránit spermatickou membránu před oxidačním stresem, stanovením koncentrace malondialdehydu (MDA), markeru poškození buněčných membrán, v závislosti na podávání vitaminu E. Například Geva popsal, že 200 mg vitaminu denně znatelně snížilo hladiny MDA ve spermatu již po měsíčním užívání a že došlo ke zlepšení fertilizačního potenciálu těchto spermií v IVF procesu (26).
Koenzym Q10
Je v tucích rozpustná molekula, která je běžnou součástí dýchacího řetězce a působí jako účinný scavanger volných radikálů zejména buněčných membrán. Koenzym Q10 (CoQ10) existuje ve dvou formách, v redukované, nazývaný ubiquinol a v oxidované – ubiquinon. Poměr ubiquinol/ubiquinon v seminální plazmě byl identifikován jako spolehlivý marker oxidačního stresu a byla prokázána jeho pozitivní korelace se sníženou motilitou spermií a jejich abnormální morfologií (27). A taktéž byla již dříve prokázána snížená hladina CoQ10 u patospermiků (28).
Studie na 22 idiopatických astenozoospermicích zdokumentovala signifikantní zvýšení seminální hladiny CoQ10 a zlepšení motility spermií po šesti měsících podávání 200 mg CoQ10 denně. Ke změnám v počtu a morfologii spermií nedošlo (29). Identické výsledky byly pozorovány i ve dvojitě zaslepené, placebem kontrolované studii z roku 2009 (30).
Selen a zinek
Selen (Se) a zinek (Zn) jsou často řazeny mezi antioxidanty, ale samy o sobě nemají žádnou antioxidační aktivitu, ale jsou součástí antioxidačních metaloenzymů. Selen je nutný k funkci glutathion peroxidázy (GPX) a je i součástí thiol peroxidázy, jež zvyšuje stabilitu spermatického chromatinu. Zinek spolu s mědí jsou součástí superoxid dismutázy. Dodávání těchto mikronutrientů má opodstatnění jen v oblastech, které trpí karencí Se a Zn, při jejich nadměrném příjmu může paradoxně docházet ke zhoršování spermiogramu (31). Ač Evropa celkově nepatří mezi oblasti s nedostatkem selenu, v některých státech je příjem selenu nízký a mezi ně patří i Česká republika. Doporučená plazmatická hladina selenu je 70–90 μg/l a dle výzkumů Klíčaly a spol. se hladina selenu v plazmě v ČR pohybuje mezi 42–65 μg/l (32).
Safarinejad ve své placebem kontrolované dvojitě zaslepené studii podával 200 μg selenu denně skupině 468 mužů s idiopatickou oligoastenoteratozoospermií. Za šest měsíců terapie došlo k signifikantnímu zvýšení hladiny selenu v seminální plazmě i zvýšené aktivity GPX a ke zlepšení všech parametrů spermiogramu s jasnou pozitivní korelací k hladině seminálního selenu (33).
Terapeutický přínos podávání Zn popisuje Omu. Skupina 11 astenozoospermiků, kterým bylo podáváno 400 mg sulfátu zinku denně, po třech měsících prokazovala zlepšení parametrů spermiogramu, snížení hladiny oxidačního stresu a snížení fragmentace spermatické DNA (34).
Glutathion, N-acetylcystein
Glutathion je cystein obsahující tripeptid, jehož thiolová skupina mu dává možnost být reverzibilně oxidován a redukován. Je produkován ve zvýšeném množství v nadvarleti. Při perorálním užívání se špatně vstřebává v trávicím traktu a i při podávání vysoké dávky 3 g denně nedochází ke zvýšení jeho cirkulujících hladin (35). Na endogenní hladinu glutathionu pozitivně působí zvýšený perorální příjem cysteinu, který může být podáván ve formě N-acetylcysteinu (NAC).
Placebem kontrolovaná studie, která hodnotila parametry spermiogramu po třech měsících užívání 600 mg NAC denně, prokázala jen malé zlepšení v motilitě spermií, ale žádnou změnu v jejich koncentraci a morfologii (36).
Při intramuskulárním podávání glutathionu v dávce 600 μg ob den bylo v placebem kontrolované, dvojitě zaslepené studii po dvou měsících užívání zjištěno zlepšení motility a morfologie spermií, ale beze změny v jejich koncentraci (37).
Kombinované přípravky
Vzhledem k faktu, že jednotlivé antioxidační mechanizmy se vzájemně doplňují, je vhodné ke zlepšení celkové antioxidační kapacity podávat více antioxidačních látek najednou. Z tohoto předpokladu vychází většina výrobců výživových doplňků, kteří produkují přípravky na podporu mužské plodnosti. Přehled těchto výživových doplňků na českém trhu i s jejich složením uvádí tabulka 2.
Table 2. Název přípravku / Množství účinných látek v denní dávce udávané výrobcem Table 2. Name of remedy / Composition reported by manufacturer 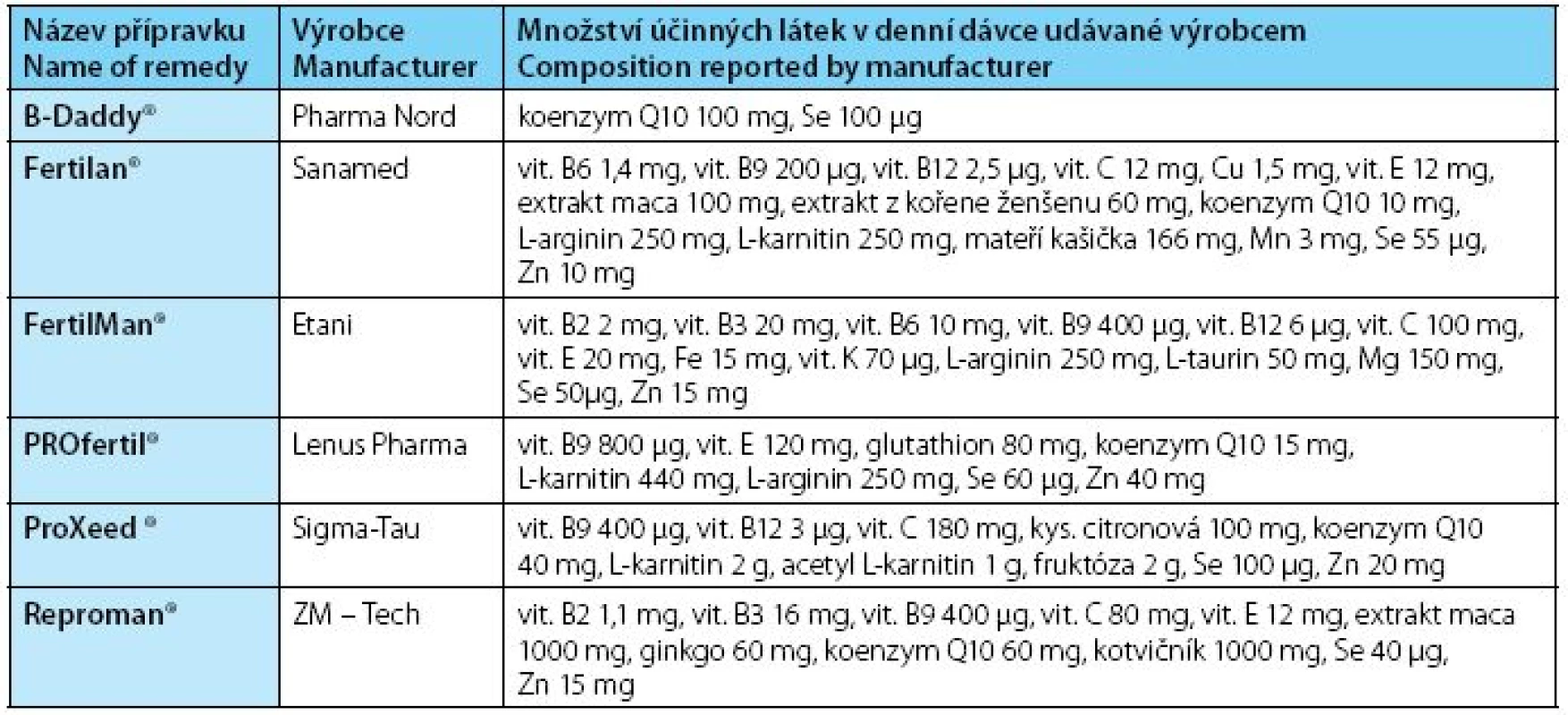
Nejčastěji studovanou kombinací antioxidantů je spojení vitaminů C a E. V placebem kontrolované studii, při podávání 1 g vitaminu C a 1 g vitaminu E denně po dobu dvou měsíců, nebyly zjištěny změny v základních parametrech spermiogramu, ale došlo k signifikantnímu snížení fragmentace DNA spermatozoí a ke zvýšení počtu těhotenství v léčené skupině (38).
U nás často používaný přípravek PROfertil® (složení tabulka 2) byl testován v placebem kontrolované studii s léčenou skupinou 132 subfertilních mužů. Po třech měsících užívání bylo popsáno zvýšení jak objemu ejakulátu, tak koncentrace spermií i zlepšení motility a morfologie spermií. V léčené skupině za dobu šesti měsíců bylo dokumentováno těhotenství u 25,8 % párů oproti 15 % párů v neléčené skupině (39).
ZÁVĚR
Oxidační stres je jedním z mechanizmů snižujících mužskou fertilitu. Kauzální léčbou je odstranění vyvolávajících příčin oxidačního stresu, což se v některých případech může podařit, jako při změně životního stylu, chirurgické korekci varikokély, léčbě infekce či změně životního prostředí. Ale mnohdy je vyvolávající příčina neodstranitelná či neidentifikovatelná a poté přichází ke slovu antioxidační léčba. V současné době neexistuje žádné jednoznačné doporučení kombinace antioxidačních látek na podporu mužské fertility. Na tomto poli byly publikovány již mnohé vědecké poznatky, ale další výzkum je stále nutný.
Došlo: 7. 10. 2014
Přijato: 13. 11. 2014
Kontaktní adresa:
MUDr. Lukáš Bittner, FEBU, FECSM
Urologická klinika 3. LF UK a FNKV
Šrobárova 50, 100 34
Praha 10
e-mail: lukas.bittner@fnkv.cz
Střet zájmů: žádný.
Prohlášení o podpoře:
Zpracování tohoto sdělení nebylo podpořeno žádnou společností.
Sources
1. Snick H, Snick T, Evers J, Collins J. The spontaneous pregnancy prognosis in untreated subfertile couples: the Walcheren primary care study. Human Reproduction 1997; 12(7): 1582–1588.
2. Greenhall E, Vessey M. The prevalence of subfertility – a review of the current confusion and a report of 2 new studies. Fertility and Sterility 1990; 54(6): 978–983.
3. Tielemans E, Burdorf A, te Velde E, et al. Sources of bias in studies among infertility clients. American Journal of Epidemiology 2002; 156(1): 86–92.
4. MacLeod J. The role of oxygen in the metabolism and motility of human spermatozoa. Am J Physiol 1943; 138(3): 512–518.
5. Jones R, Mann T, Sherins R. Peroxidative breakdown of phospholipids in human-spermatozoa, spermicidal properties of fatty-acid peroxides, and protective action of seminal plasma. Fertility and Sterility 1979; 31(5): 531–537.
6. Tremellen K. Oxidative stress and male infertility – a clinical perspective. Human Reproduction Update 2008; 14(3): 243–258.
7. Baker M, Aitken R. Reactive oxygen species in spermatozoa: methods for monitoring and significance for the origins of genetic disease and infertility. Reproductive Biology and Endocrinology 2005; 3.
8. Twigg J, Fulton N, Gomez E, Irvine D, Aitken R. Analysis of the impact of intracellular reactive oxygen species generation on the structural and functional integrity of human spermatozoa: lipid peroxidation, DNA fragmentation and effectiveness of antioxidants. Human Reproduction 1998; 13 (6): 1429–1436.
9. Sanocka D. Reactive oxygen species and sperm cells. Reproductive Biology & Endocrinology 2004; 12–17.
10. Aitken R, Buckingham D, Brindle J, et al. Analysis of sperm movement in relation to the oxidative stress created by leukocytes in washed sperm preparations and seminal plasma. Human Reproduction 1995; 10(8): 2061–2071.
11. Alvarez J, Storey B. Differential incorporation of fatty-acids into and peroxidative loss of fatty-acids from phospholipids of human spermatozoa. Molecular Reproduction and Development 1995; 42(3): 334–346.
12. Twigg J, Irvine D, Aitken R. Oxidative damage to DNA in human spermatozoa does not preclude pronucleus formation at intracytoplasmic sperm injection. Human Reproduction 1998; 13(7): 1864–1871.
13. Thomas N, Durkie M, Van Zyl B, et al. Parental and chromosomal origin of unbalanced de novo structural chromosome abnormalities in man. Human Genetics 2006; 119(4): 444–450.
14. Agarwal A, Saleh R, Bedaiwy M. Role of reactive oxygen species in the pathophysiology of human reproduction. Fertility and Sterility 2003; 79(4): 829–843.
15. Akbay E, Cayan S, Doruk, E, Duce M, Bozlu M. The prevalence of varicocele and varicocele-related testicular atrophy in Turkish children and adolescents. Bju International 2000; 86(4): 490–493.
16. Canales B, Zapzalka D, Ercole C, et al. Prevalence and effect of varicoceles in an elderly population. Urology 2005; 66(3): 627–631.
17. Raman J, Walmsley K, Goldstein M. Inheritance of varicoceles. Urology 2005; 65(6): 1186–1189.
18. Agarwal A. Relationship between oxidative stress, varicocele and infertility: a meta-analysis. Reproductive
Biomedicine Online 2006; 12(5): 630–633.
19. Zini A, Blumenfeld A, Libman J, Willis J. Beneficial effect of microsurgical varicocelectomy on human sperm DNA integrity. Human Reproduction 2005; 20(4): 1018–1021.
20. Werthman P, Wixon R, Kasperson K, Evenson D. Significant decrease in sperm deoxyribonucleic acid fragmentation after varicocelectomy. Fertility and Sterility 2008; 90(5): 1800–1804.
21. Marmar J, Agarwal A, Prabakaran S, et al. Reassessing the value of varicocelectomy as a treatment for male subfertility with a new meta-analysis. Fertility and Sterility 2007; 88(3): 639–648.
22. Wayner D, Burton G, Ingold, K. The antioxidant efficiency of vitamin-C is concetration-dependent. Biochimica Et Biophysica Acta 1986; 884(1): 119–123.
23. Jacob R, Pianalto F, Agee R. Cellular ascorbate depletion in healthy-men. Journal of Nutrition 1992; 122(5): 1111–1118.
24. Lewis S, Sterling E, Young, I, Thompson W. Comparison of individual antioxidants of sperm and seminal plasma in fertile and infertile men. Fertility and Sterility 1997; 67(1): 142–147.
25. Dawson E, Harris W, Teter M, Powell L. Effect of ascorbic-acid supplementation on the sperm quality of smokers. Fertility and Sterility 1992; 58(5): 1034–1039.
26. Geva E, Lessing J, Bartoov B, et al. The effect of antioxidant treatment on human spermatozoa and fertilization rate in an in vitro fertilization program. Fertility and Sterility 1996; 66(3): 430–434.
27. Alleva R, Scararmucci A, Mantero F. The protective role of ubiquinol-10 against formation of lipid hydroperoxides in human seminal fluid. Molecular Aspects of Medicine 1997; 18 : 221–228.
28. Mancini A, Demarinis L, Oradei A, et al. Coenzyme Q-10 concentrations in normal and pathological human seminal fluid. Journal of Andrology 1994; 15(6): 591–594.
29. Balercia G, Mosca F, Mantero F, et al. Coenzyme Q 10 supplementation in infertile men with idiopathic asthenozoospermia: an open, uncontrolled pilot study. Fertility and Sterility 2004; 81(1): 93–98.
30. Balercia G, Buldreghini E, Vignini A, et al. Coenzyme Q10 treatment in infertile men with idiopathic asthenozoospermia: a placebo-controlled, double-blind randomized trial. Fertility and Sterility 2009; 91(5): 1785–1792.
31. Bleau G, Lemarbre J, Faucher G, Roberts K, Chapdelaine A. Semen selenium and human-fertility. Fertility and Sterility 1984; 42(6): 890–894.
32. Kvíčala J. Zvýšení příjmu mikronutrientu selenu – utopie, fikce, prozřetelnost či nutnost? – II. část. Interní med. 2003; 7 : 354–359.
33. Safarinejad M, Safarinejad S. Efficacy of Selenium and/or N-Acetyl-Cysteine for Improving Semen Parameters in Infertile Men: A Double-Blind, Placebo Controlled, Randomized Study. Journal of Urology 2009; 181(2): 741–751.
34. Omu A, Al-Azemi M, Kehinde E, et al. Indications of the mechanisms involved in improved sperm parameters by zinc therapy. Medical Principles and Practice 2008; 17(2): 108–116.
35. Witschi A, Reddy S, Stofer B, Lauterburg B. The systemic availability of oral glutathione. European Journal of Clinical Pharmacology 1992; 43(6): 667–669.
36. Ciftci H, Verit A, Savas M, Yeni E, Erel O. Effects of N-acetylcysteine on Semen Parameters and Oxidative/Antioxidant Status. Urology 2009; 74(1): 73–76.
37. Lenzi A, Culasso F, Gandini L, Lombardo, F, Dondero, F. Placebo-controlled, double-blind, cross-over trial of glutathione therapy in male-infertility. Human Reproduction 1993; 8(10): 1657–1662.
38. Ermanno G. ICSI in cases of sperm DNA damage: beneficial effect of oral antioxidant treatment. Human Reproduction 2005; 20(9): 2590–2594.
39. Imhof M, Lackner J, Lipovac M, Chedraui P, Riedl C. Improvement of sperm quality after micronutrient supplementation. e-SPEN Journal 2012; 7(1): 50–53.
40. Parekattil SJ, Agarwal A. Male Infertility: Contemporary Clinical Approaches, Andrology, ART & Antioxidants. Springer 2012 : 228.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2015 Issue 1-
All articles in this issue
- VLIV VOLNÝCH RADIKÁLŮ NA FERTILITU MUŽE A MOŽNOSTI LÉČBY
- ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
- IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
- VÝZNAM STANOVENÍ MOČOVÉ HLADINY TATI (TUMOUR ASSOCIATED TRYPSIN INHIBITOR) PRO DIAGNOSTIKU A PROGNÓZU TUMORŮ MOČOVÉHO MĚCHÝŘE
- KOMUNIKACE MEZI UROLOGEM A PACIENTEM S RAKOVINOU PROSTATY V PRŮBĚHU LÉKAŘSKÉ KONZULTACE
- KOMPLIKACE PO RADIKÁLNÍ PROSTATEKTOMII OTEVŘENÝM A LAPAROSKOPICKÝM PŘÍSTUPEM, SROVNÁNÍ VÝSLEDKŮ PODLE CLAVIENOVA SYSTÉMU KLASIFIKACE
- KOMPLIKACE PO LOKÁLNÍ APLIKACI CIZORODÉHO MATERIÁLU DO PODKOŽÍ PENISU
- EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
- RYCHLE PROGREDUJÍCÍ UROTELIÁLNÍ TUMOR PÁNVIČKY LEVÉ LEDVINY S TROMBÓZOU VENA CAVA INFERIOR
- JEDNOPORTOVÁ LAPAROSKOPICKÁ (LESS-LAPARO-ENDOSCOPIC SINGLE-SITE SURGERY) NEFREKTOMIE
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
- KOMPLIKACE PO LOKÁLNÍ APLIKACI CIZORODÉHO MATERIÁLU DO PODKOŽÍ PENISU
- ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
- EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

