-
Medical journals
- Career
ČASNÉ ZKUŠENOSTI S ROBOTICKY ASISTOVANOU LAPAROSKOPICKOU RADIKÁLNÍ PROSTATEKTOMIÍ - PRVNÍCH 153 PACIENTŮ
Authors: Jan Doležel 1,2; Jaroslav Tvarůžek 2; Michal Staník 1; Radek Zachoval 2; Igor Šimoník 2; Milan Korsa 2; Václav Vagunda 3
Authors‘ workplace: Robotické centrum Vysočina, Nemocnice sv. Zdislavy a. s., Velké Meziříčí 1; Masarykův onkologický ústav, oddělení onkourologie, Brno 2; Cedelab s. r. o., oddělení patologie, Velké Meziříčí 3
Published in: Ces Urol 2009; 13(2): 168-177
Category: Original article
Overview
Cíl:
Prezentace časných zkušeností s prováděním roboticky asistované laparoskopické radikální prostatektomie (RoLRP) v jednom ze čtyř robotických center v České republice.Materiál a metoda:
Od 1. 5. 2007 do 30. 9. 2008 bylo provedeno v Robotickém centru Vysočina, Nemocnice sv. Zdislavy a.s., Mostiště, 153 RoRLP pomocí 3-ramenného systému Da Vinci (Intuitive Surgical). K operaci byli indikováni pacienti s karcinomem prostaty, klinické stadium cT1c v 78,1 %, cT2 v 20,4 % a v 1,5 % pacienti s lokálně pokročilým onemocněním cT3a. Průměrná hodnota prostatického specifického antigenu (PSA) před operací činila 7,2 ng/ml (2 až 19 ng/ml). Předoperační Gleasonovo skóre (GS) 6 a méně mělo 69,3 % pacientů, GS 7 27,1 % a GS 8–10 3,6 % pacientů. Průměrný věk nemocných byl 63 let. Ve studii hodnotíme délku operace, krevní ztráty, peroperační a pozdní komplikace, definitivní histopatologický nález a funkční výsledky se zaměřením se na kontinenci pacientů. Průměrná délka sledování představuje 8,5 měsíců.Výsledky:
Průměrný operační čas „skin-to-skin“ byl 148 (72–540) minut a průměrná krevní ztráta činila 329 (50–1500) ml. U 52 % pacientů bylo diagnostikováno pT2 stadium, u 48 % pT3 stadium. Pozitivní chirurgické okraje mělo 18,7 % pacientů, dle stadií 13,6 % u pT2 a 24,6 % u pT3. Celkově se vyskytly komplikace u 15 %, žádný pacient nezemřel. Propuštěno bylo 84 % pacientů 4. pooperační den a dříve. Močový katétr byl extrahován při nekomplikovaném průběhu 8.–14. den. Plně kontinentních (0–1 vložka) bylo ihned po vytažení katétru 25 % pacientů, 6 měsíců od operace 92 %. Biochemická recidiva byla zaznamenána u 9,2 % pacientů.Závěr:
Naše výsledky potvrzují schůdnost a bezpečnost roboticky asistované radikální prostatektomie. I přes počáteční nezkušenost operujícího týmu je možné v krátké době dosáhnout slibné funkční a onkologické výsledky.Klíčová slova:
karcinom prostaty, roboticky asistovaná laparoskopická radikální prostatektomie.ÚVOD
Karcinom prostaty patří mezi nejčastěji diagnostikované solidní nádory u mužů v rozvinutých zemích. V České republice má incidence stoupající tendenci, v roce 2005 činila 97,1/100 000 obyvatel (1). Zlatým standardem u pacientů s lokalizovaným a u selektované skupiny lokálně pokročilých onemocnění je radikální retropubická prostatektomie (RRP) (2–4). Technika RRP prošla za posledních 25 let četnými modifikacemi, které snížily morbiditu spojenou s operací a zlepšily onkologické výsledky. Přesto zůstává náročnou operací s rizikem vysokých krevních ztrát a funkčních následků v podobě inkontinence moči a erektilní dysfunkce. S nástupem minimálně invazivních technik se hledaly alternativy k otevřené operaci. V devadesátých letech 20. století se objevila laparoskopická radikální prostatektomie (LRP) (5) a v roce 2000 byla provedena první RoLRP pomocí systému Da Vinci (6). Publikované výsledky rozsáhlých souborů pacientů ukazují, že LRP a RoLRP mají potenciál omezit morbiditu otevřené operace, snížit krevní ztráty, urychlit rekonvalescenci pacientů, zlepšit návrat kontinence a erekce při zachování onkologické radikality (7–9). Je ovšem nutná delší doba sledování.
MATERIÁL A METODA
Za období 1. 5. 2007 – 30. 9. 2008 bylo provedeno v robotickém centru Vysočina, Nemocnice svaté Zdislavy, a.s., Mostiště u Velkého Meziříčí 300 roboticky asistovaných operací pomocí 3-ramenného systému Da Vinci (Intuitive Surgical) (obr. 1). Z urologické indikace bylo 187 operací, z toho 168 RoLRP. V této prospektivní studii hodnotíme naše zkušenosti s prvními 153 pacienty. Přístup byl u 138 pacientů transperitoneální, v 15 případech extraperitoneální. Všechny operace byly provedeny jedním operatérem (J. D.), u stolu asistoval chirurg – zkušený laparoskopista (J. T., případně I. Š.) a posléze i zaškolující se urolog (R. Z.).
Image 1. Robotický systém Da Vinci, 3-ramenný Fig. 1. Three-armed robotic system Da Vinci 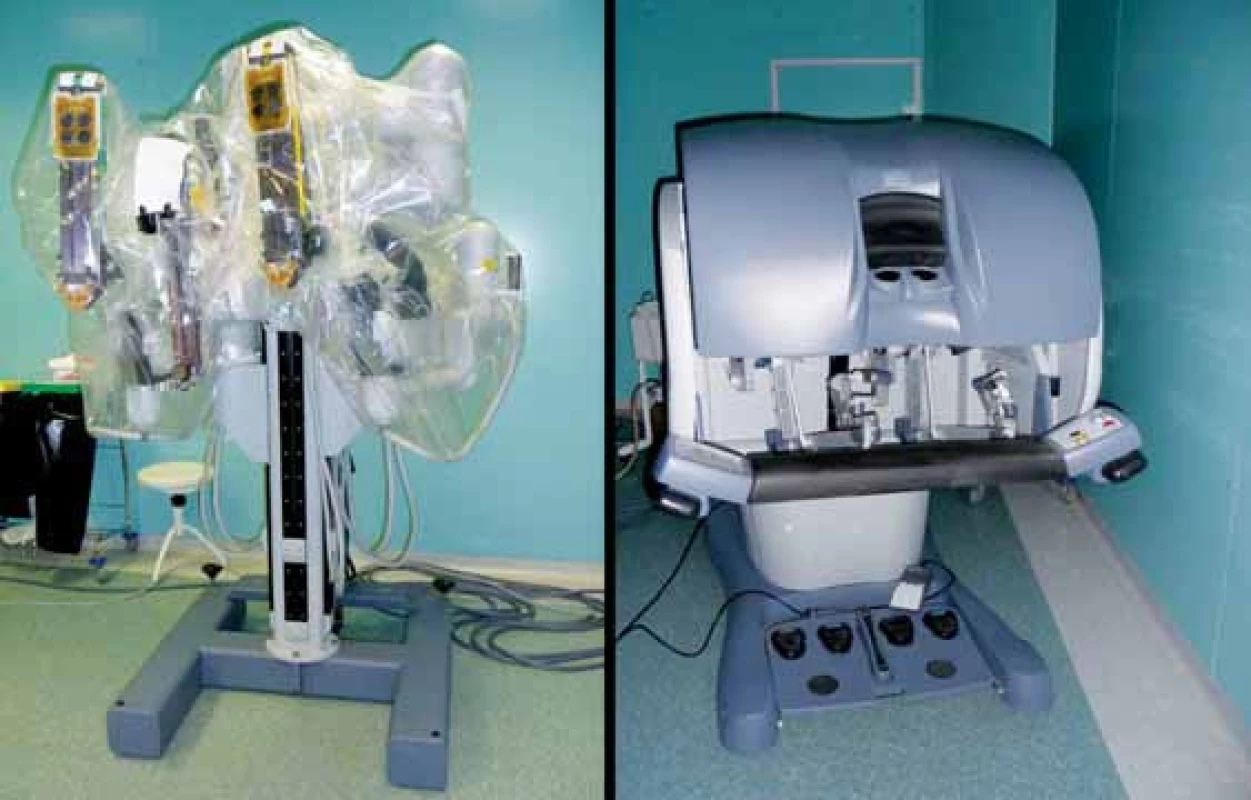
K operaci byli indikováni pacienti s klinicky lokalizovaným karcinomem prostaty verifikovaným biopsií. Ve velké většině se jednalo o pacienty s nízce rizikovým karcinomem prostaty: stadium cT1c mělo 78 % a bioptické GS ≤ 6 69 % operovaných. Pouze v 1,5 % případů byli indikováni k RoLRP nemocní s lokálně pokročilým onemocněním. Průměrná hodnota PSA před operací byla 7,2 (2–19) ng/ml a průměrný věk nemocných byl 63 (50–76) let (tab. 1). Předchozí operace v dutině břišní, úrazy v oblasti pánve, endoskopické operace prostaty či obezita nebyly kontraindikací k provedení RoLRP (obr. 2). Oboustranně nervy-šetřící postup byl indikován u pacientů s klinickým stadiem cT1c, PSA < 10 ng/ml a GS ≤ 6. U GS 7–8 bylo zvažováno šetření nervů na kontralaterální straně (tab. 7). Pacienti byli sledováni 3, 6 a 12 měsíců od operace, kontinence byla hodnocena pomocí modifikovaného dotazníku Expanded Prostate Cancer Index Composite (EPIC) a na posouzení erektilní funkce byl použitý dotazník International Index of Erectile Function (IIEF). Dále byla hodnocena délka operace (doba od první incize pro první – optický – port po ukončení sutury posledního portu, tzv. „skin-to-skin time“), krevní ztráty, peroperační a pozdní komplikace, definitivní histopatologický nález, pozitivní chirurgické okraje a biochemická progrese po operaci. Během operace byli pacienti uloženi na zádech v Trendelenburgově poloze 30° s lehce abdukovanými dolními končetinami. Subumbilikálně byl zaveden 12 mm port pro optiku, dva 8 mm porty pro robotické nástroje pararektálně bilaterálně a dva asistentské porty vpravo: 5 mm port 3–4 cm laterálně vpravo od optického portu a 10 mm port 4–5 cm laterálně a 3–4 cm kraniálně od crista ilica (obr. 3). Operační technika je kombinací antegrádního a retrográdního postupu. Obloukovitou incizi nástěnného peritonea nad močovým měchýřem je zpřístupněn Retziův prostor, poté následuje incize endopelvické fascie, přerušení pubouretrálních vazů, disekce apexu a ligace dorzálního venózního komplexu. Operace pokračuje incizí hrdla močového měchýře, odpreparováním zadní porce hrdla od prostaty, incizí předního listu Denonvilliersovy fascie, mobilizací semenných váčků a přerušením prostatických pediklů a uvolňujeme proximální část prostaty s oběma přilehlými listy Denonvilliersovy fascie od prerektálního tuku. Poté je přerušen dorzální venózní komplex, svěrač i s uretrou a prostata je mobilizována od rekta z distálního směru, opět spolu s oběma listy Denonvilliersovy fascie. Při nervy-šetřící operaci je incize prostatické fascie vedena anteriorně a nervověcévní svazky jsou uvolněny do báze prostaty k apexu. V ojedinělých případech (při „hluboké“ poloze uretry) byla provedena fixace dorzálního cévního komplexu k periostu symfýzy závěsným stehem ještě před jeho přerušením (7). Vezikouretrální anastomóza je šita pokračovacím stehem, jak popsal Van Velthoven (10), jedním vláknem se dvěma jehlami. Dorzálně jsou „vypíchnutím“ této sutury současně zabírány i oba okraje (suburetrálně/subvezikálně) přerušené Denonvilliersovy fascie. Do pánve je založen trubicový drén. Operační prostor je extraperitonealizován fixací nástěnného peritonea ke stěně břišní pomocí kýlních spirálních klipů. Na závěr je prostata v plastikovém sáčku extrahována rozšířeným optickým portem (prodloužení původní jednocentimetrové incize rozšíření na tří - až čtyřcentimetrovou (obr. 3).
Table 1. Předoperační údaje o pacientech Table 1. Preoperative patient data 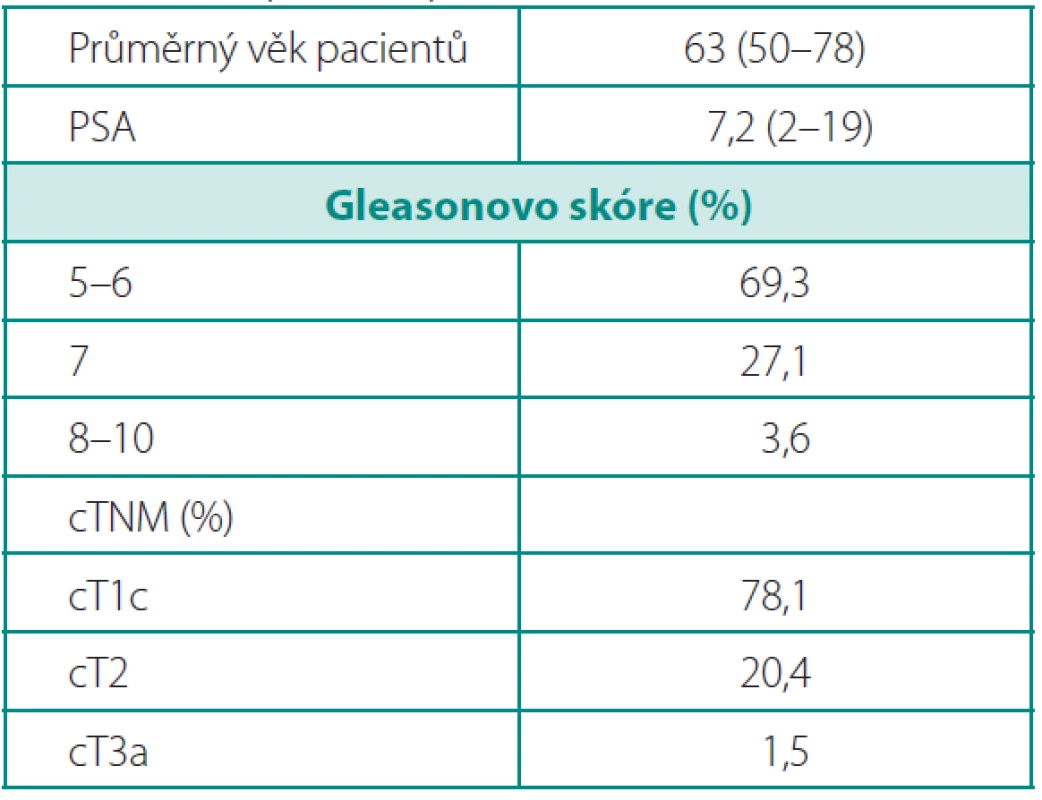
Image 2. Obézní pacient po RoLRP transperitoneálním přístupem, patrné jizvy po portech Fig. 2. Obese patient after RALP, transperitoneal access has been used. The scars after suturing the ports indicate the placement of instruments during operation. 
Image 3. Pacient po břišní operaci pro akutní pankreatitidu Fig 3. Patient after abdominal surgery dute to acute pancreatitis 
Bioptický materiál byl zhodnocen jedním patologem (V. V.). Chirurgický okraj byl označen jako pozitivní, pokud tumor dosahoval barveného okraje preparátu.
Rizikovým pacientům (s pT3 nádory či s pozitivními chirurgickými okraji) byla po operaci vždy nabízena adjuvantní radioterapie (11, 12).
VÝSLEDKY
Průměrná délka operace (tab. 2) byla 148 min (72–540), operační čas se zkracoval s nabývanými zkušenostmi. Ze 186 minut u prvních 50 pacientů došlo k zkrácení na 122 minut u 101.–150. pacienta (obr. 4). U žádného pacienta nebyla nutná konverze na otevřenou operaci. Krevní ztráta byla v průměru 329 (50–1500) ml (tab. 2).
Table 2. Operační údaje Table 2. Intraoperative data 
Image 4. Operační čas („skin-to-skin“) Fig. 4. Operative time (skin-to-skin) 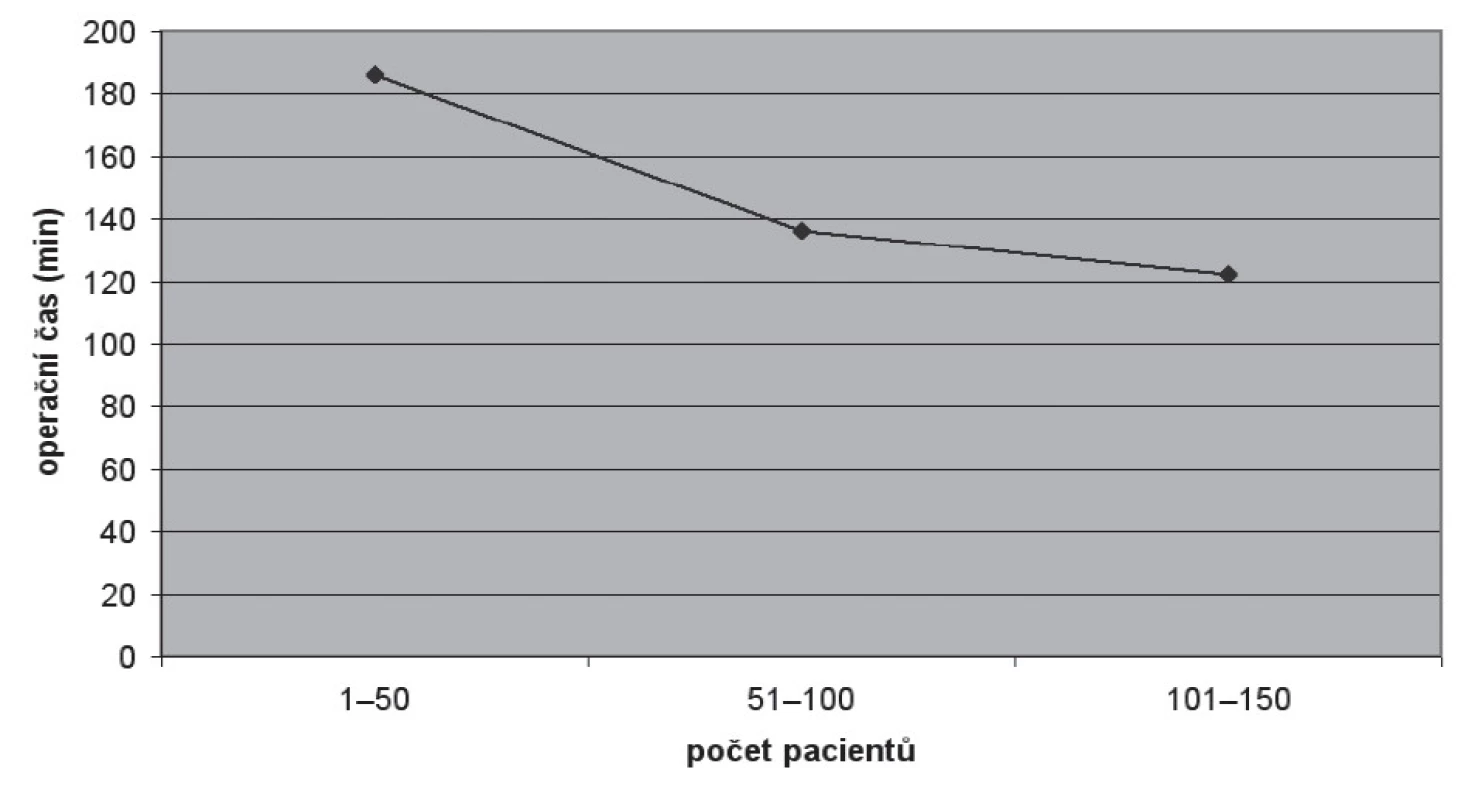
Histopatologickým vyšetřením bylo diagnostikováno GS 4–5 u 11,4 %, GS 6 u 27,3 %, GS 7 u 49,3 % a GS 8–10 u 12 % pacientů (tab. 3). Patologické stadium pT2 bylo u 52 %, pT3 u 48 % nemocných, z toho pT3a u 38,7 % a pT3b u 9,8 %. Pozitivní chirurgické okraje byly u 18,7 % pacientů, podle stadií 13,6 % u pT2 a 24,6 % u pT3 (tab. 4).
Table 3. Pooperační komplikace Table 3. Postoperative complications 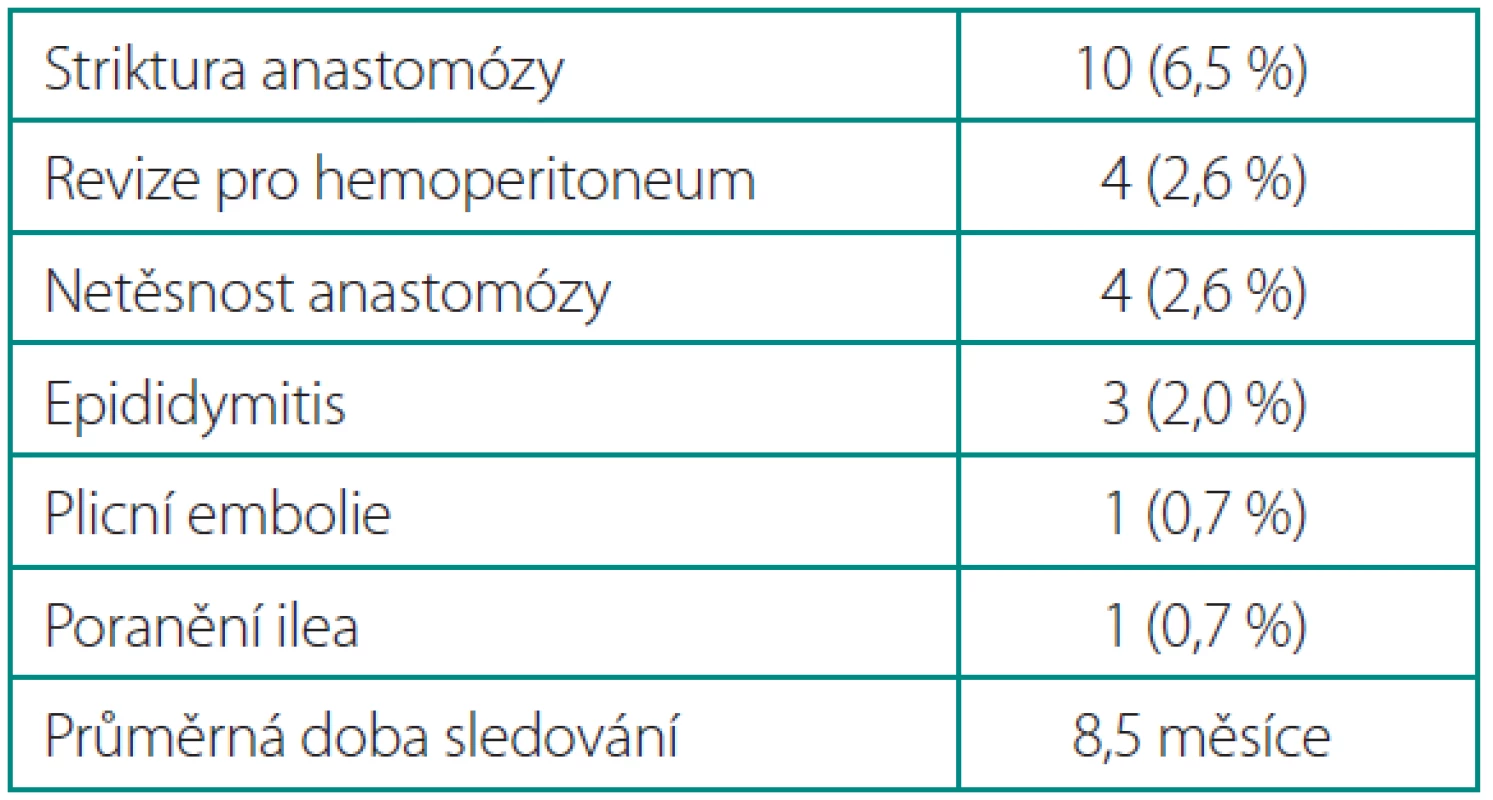
Table 4. Histopatologické údaje Table 4. Histopathology data 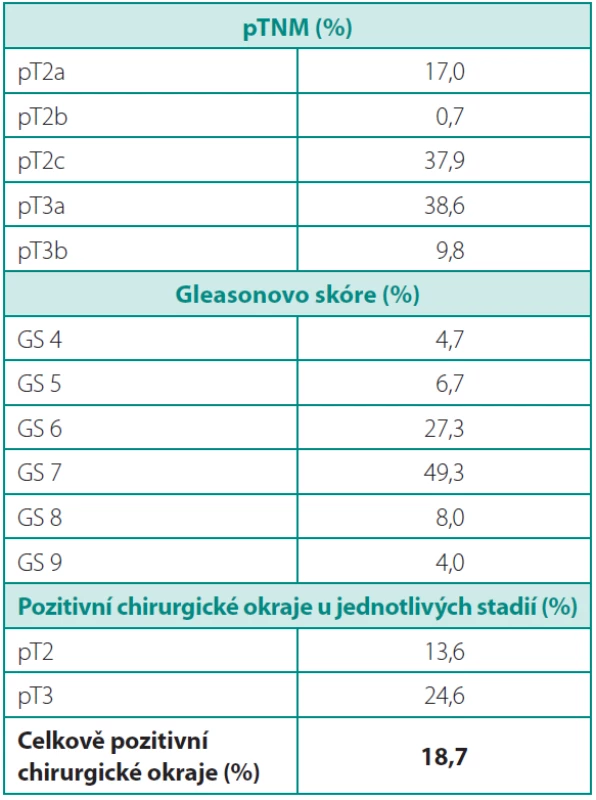
Pánevní (rozšířená) lymfadenektomie (13) byla provedena u jednoho pacienta, v rozsahu externích, interních ilických a obturátorových uzlin, operační čas byl prodloužen o 60 minut. Histologicky byly uzliny negativní. Ve stejném období bylo v Masarykově onkologickém ústavu provedeno 78 otevřených radikálních prostatektomií u pacientů se středně a vysoce rizikovým karcinom prostaty dle D’Amica (14):
s GS 7–10 a/nebo PSA >10 ng/ml a/nebo klinickým stadiem ≥ cT2b. U těchto operovaných pacientů byla indikována i rozšířena pánevní lymfadenektomie (13).
Celkově se vyskytly komplikace u 15 % operovaných (tab. 2), žádný pacient nezemřel. Čtyři pacienti byli revidováni (2,6 %) pro hemoperitoneum, 1× bylo zjištěno poranění v. epigastrica inferior trokárem, 3× krvácení z malé pánve. Jedenkrát se vyskytlo poranění ilea, které bylo ošetřeno suturou. Čtyřikrát byl z důvodu protrahované urinózní sekrece ponechaný katétr déle (3, resp. 4 týdny). U 10 pacientů došlo ke stenotizaci anastomózy v časném období (6,5 %). Po ukončení hospitalizace se vyskytla 1× plicní embolie a 3× epididymitis (tab. 3).
Propuštěno bylo 84 % pacientů 4. pooperační den a dříve. Močový katétr byl extrahován při nekomplikovaném průběhu 8.–14. den. U prvních pěti pacientů jsme zkoušeli odstranit katétr již 5. pooperační den při propuštění, ale tři pacienti měli retenci moče a katétr jim byl opětovně zaveden.
Průměrná doba sledování činí 8,5 měsíce. Plně kontinentních (0–1 vložka) bylo ihned po vytažení katétru 25 % pacientů, 6 měsíců od operace 92 % (tab. 7). Schopnost dosažení erekce jsme zatím nehodnotili pro krátkou dobu sledování.
Table 5. Šetření nervově-cévních svazků a funkční výsledky Table 7. Nerve-sparing operations and the functional outcomes 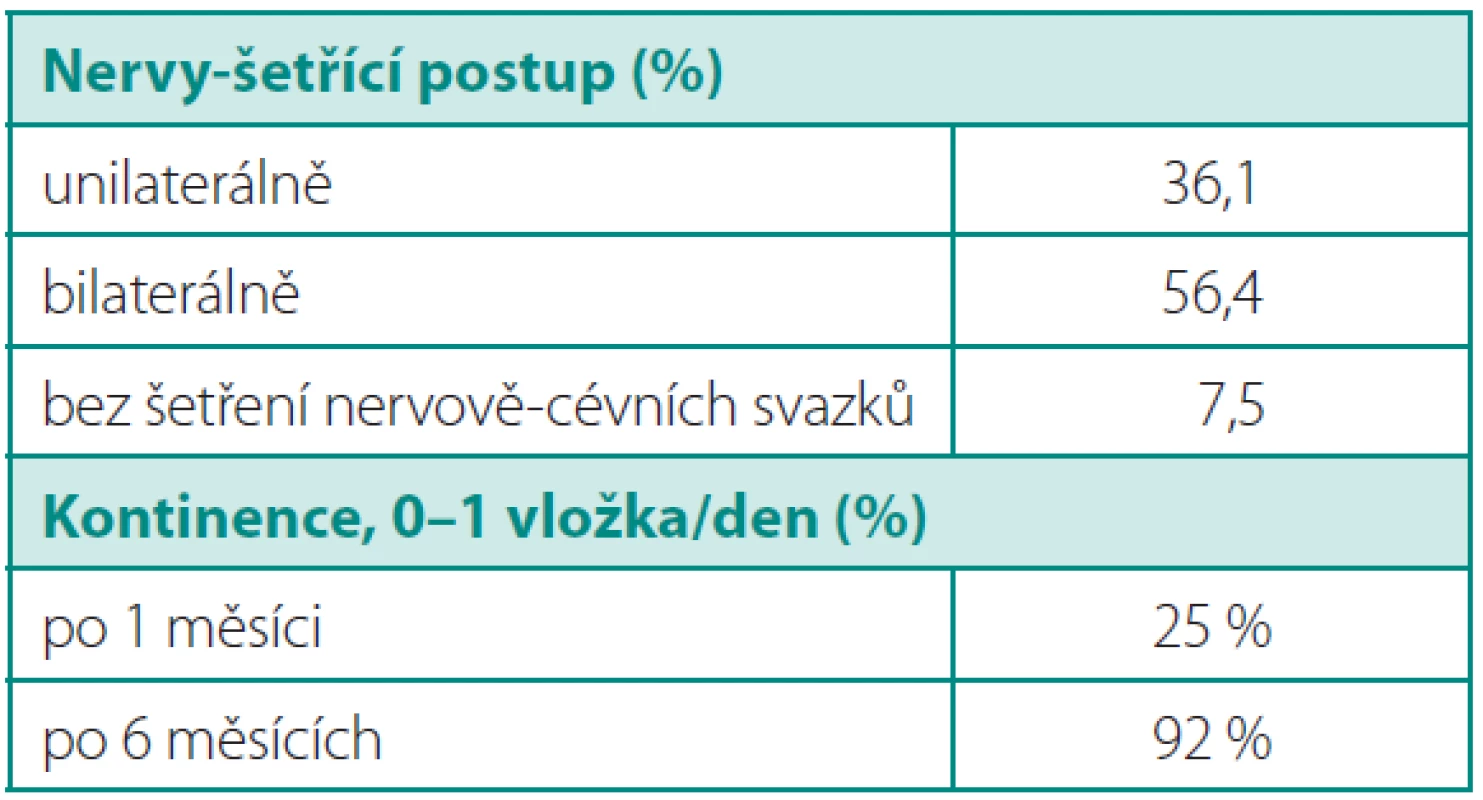
Biochemická recidiva (PSA > 0,2 ng/ml) byla zaznamenána u 14 (9,2 %) pacientů. Adjuvantní radioterapii podstoupilo 18,3 % operovaných a salvage radioterapii 5,9 %.
DISKUSE
Retropubická radikální prostatektomie zůstává operací se značnou morbiditou. S rozvojem minimálně invazivních technik se objevily pokusy o napodobení otevřené techniky laparoskopickou cestou s cílem snížit krevní ztráty, omezit dopad na kontinenci a erekci pacientů a zrychlit rekonvalescenci při zachování onkologických výsledků. V roce 1992 Schuessler provedl první laparoskopickou radikální prostatektomii (LRP), ale po sérii devíti pacientů došel k závěru, že LRP nepředstavuje výhodu oproti RRP (5). Až v roce 1998 skupina z Montsouris standardizovala techniku (17) a operace se rozšířila v evropských specializovaných centrech. Ve Spojených státech amerických se LRP ve větší míře prosadila až s nástupem robotického systému Da Vinci. První zkušenosti publikovali Binder a Kramer v roce 2000 (6). Od té doby prošla technika operace četnými modifikacemi. V roce 2001 se provedlo ve Spojených státech amerických 250 RoRLP, v roce 2007 se již odhadovaný počet blížil 50 000, a tedy poprvé překročil počet otevřených operací (18).
Robotický systém umožňuje rychlejší přechod z otevřené operativy na laparoskopickou, poskytuje větší svobodu pohybu a ovládaní díky zařízeni Endowrist (6 stupňů volnosti). Oproti konvenční laparoskopii nabízí 3-dimenzní obraz s vnímáním hloubky, ergonomicky výhodnou polohu pro operatéra a filtruje tremor. Ke snížení krevních ztrát přispívá i tamponádový efekt kapnoperitonea na drobné venózní krvácení. Oproti otevřené operaci a částečně i vůči LRP jsou výrazně vyšší náklady na jednoho pacienta, na čemž se podílí i vysoká pořizovací cena robotického systému, jeho údržby a limitované životnosti specifických nástrojů. Nevýhodou je také chybění taktilního vněmu.
Ze začátku byl při LPR preferován transperitoneální přístup, nejdříve se dvěma incizemi peritonea – v Douglasově prostoru s disekcí semenních váčků a nad močovým měchýřem ke vstupu do Retziova prostoru. Časem byla časná disekce semenních váčků opuštěna. Alternativou se stal extraperitoneální přístup, který se více přibližoval otevřené technice a poskytoval několik výhod: usnadňoval operaci u pacientů po předchozích břišních operacích nebo morbidně obézních, zamezoval kontaktu se střevem, a teoreticky tak snižoval riziko poranění střev a pooperačního ileu. Naopak transperitoneální přístup nabízí větší pracovní a především insufl ační prostor, a tedy snadnější operační manipulaci, snadnější udržování konstantního insufl ačního tlaku a průzračného prostředí. Ulehčuje též provedení rozšířené pánevní lymfadenektomie a minimalizuje riziko lymfokély. V současnosti většina robotických chirurgů proto využívá transperitoneálního přístupu (19). Otázka ideálního přístupu není ale zatím stále uzavřena. V naší sestavě bylo 15 pacientů operovaných extraperitoneální cestou, ale z výše uvedených důvodů jsme se vrátili k transperitoneálnímu přístupu.
V literatuře se udává „learning curve“ RoLRP kolem 25 pacientů (7) pro operatéry rutinně provádějící otevřené RRP. Tomu odpovídají i naše zkušenosti. U LRP je doba zvládnutí operace delší, minimálně kolem 50 pacientů (20). V našem souboru se s přibývajícími operacemi podstatně zkracoval operační čas (obr. 4), u posledních 50 pacientů byl 122 minut. Krevní ztráta byla v průměru 329 ml, což je na horní hranici publikovaných sérii, ale výrazně nižší než při běžné otevřené RRP. RoLRP umožňuje i v našich podmínkách výrazné zkrácení doby hospitalizace, 84 % operovaných bylo propuštěno do 4. pooperačního dne.
S nabývajícími zkušenostmi jsme prováděli RoLRP i u komplikovaných pacientů. Předchozí operace v dutině břišní (např. resekce sigmatu), v malé pánvi (např. laparoskopické síťkové plastiky tříselných kýl), stavy po úrazech (průstřel pánve, resorbovaný hematom po fraktuře pánevního kruhu) nebo po endoresekci prostaty či obezita nebyly kontraindikací k operaci. V podskupině pěti pacientů, kteří byli po transuretrální resekci prostaty (TURP), jsme dosáhli obdobných výsledku jako u skupiny posledních 50 operovaných pacientů. Průměrná doba operace byla 150 minut, krevní ztráty 187 ml a nezaznamenali jsme vážnější komplikaci (tab. 6).
Table 6. Pacienti po předchozí transuretrální resekci prostaty (TURP) Table 6. Patients after previous transurethral resection of the prostate (TURP) 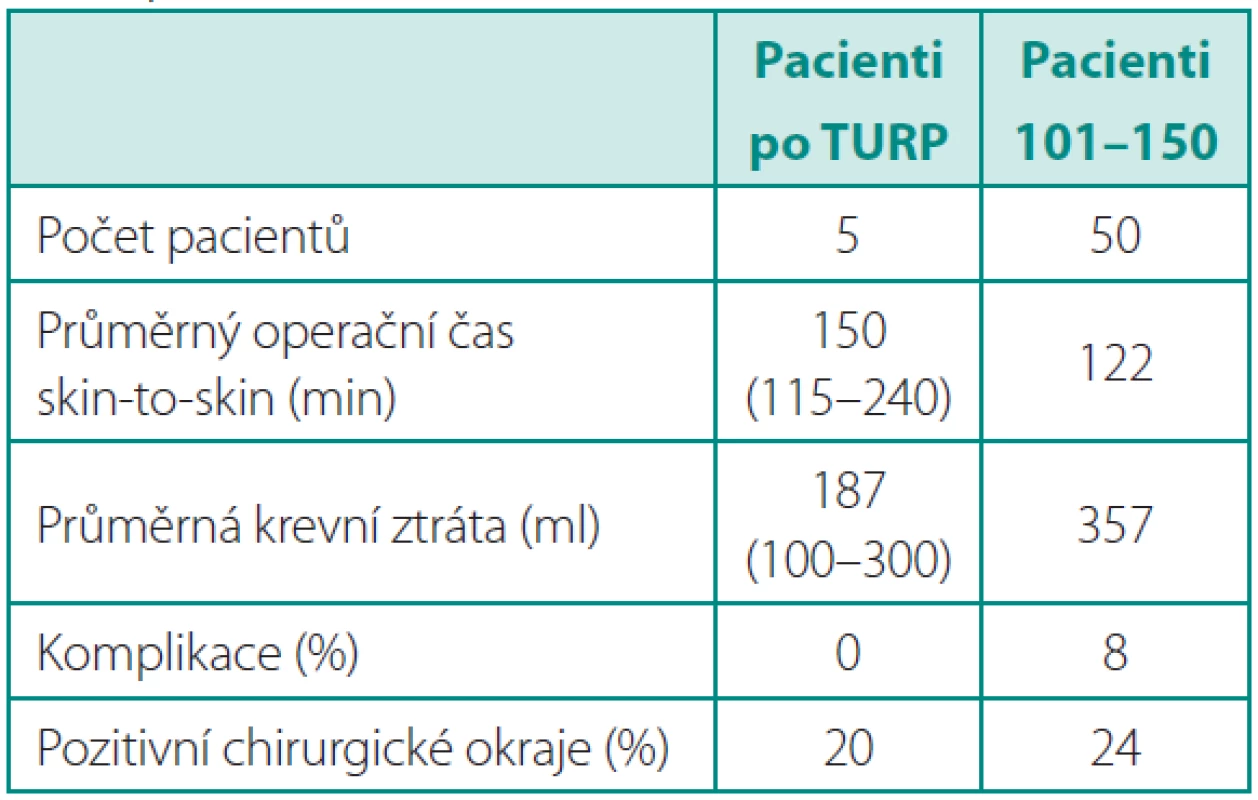
V naší sestavě pacientů mělo celkově 18,7 % pozitivní chirurgické okraje, což je vyšší číslo než ve velkých publikovaných souborech (7, 8). Tento údaj má vyšší výpovědní hodnotu, pokud je rozdělen na pozitivitu okrajů u jednotlivých stadií. V naší studii zřejmě souvisí s vysokým počtem (48 %) pacientů, u kterých bylo diagnostikováno pT3 stadium, zatímco jiné studie udávají pouze 15–22 % (tab. 5). Pozitivita okrajů v této podskupině byla 24,6 %, u stadia pT2 13,6 %, což již odpovídá vybraným studiím uvedeným v tabulce 5.
Table 7. Publikované série RoLRP Table 5. Published series of RALP 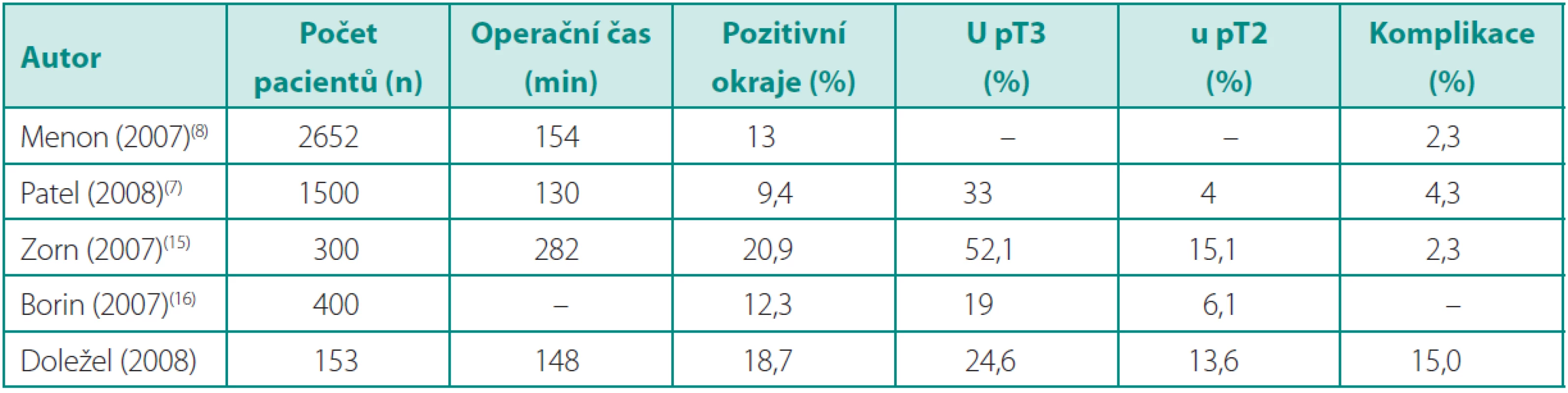
RoLRP – roboticky asistovaná laparoskopická radikální prostatektomie; RALP – robot-assisted laparoscopic radical prostatectomy. Vysoký podíl pacientů s prokázaným lokálně pokročilým onemocněním souvisí pravděpodobně se špatně provedeným stagingem klinikem a podhodnoceným gradingem z punkční biopsie patologem. Gleasonovo skóre bylo podhodnoceno předoperačně u 49 %, nadhodnoceno u 9 % a shodovalo se ve 42 % případů. Obdobně byly i výrazné rozdíly v stagingu onemocnění. Dle klinického vyšetření 1,5 % pacientů mělo stadium onemocnění cT3, v definitivním preparátu 48 % pT3. Pacienti s klinickým stadiem cT1c měli ve 41 % nález lokálně pokročilého onemocnění. K výše uvedeným skutečnostem nutno ovšem poznamenat, že ani hodnocení prostatické kapsuly – jako anatomického pojmu – není z hlediska patologa zcela jednoduché a jednoznačné (21).
V naší sestavě pacientů podstoupil pouze jeden pacient pánevní lymfadenektomii. Většina nemocných spadala do skupiny s nízkým rizikem lymfadenopatie (definovaná GS ≤ 6, PSA < 10 ng/ml a cT1c – cT2a), ve které je záchyt pozitivních uzlin 3–8 % (22). Těmto pacientům nenabízíme pánevní lymfadenektomii. U ostatních pacientů je riziko lymfadenopatie vyšší a je indikovaná pánevní lymfadenektomie k upřesnění stagingu. Její terapeutický přínos zůstává kontroverzní otázkou, i když některé studie prokázaly zlepšení přežití bez biochemické progrese u pacientů s minimálním postižením lymfatických uzlin (23). U laparoskopické ale i otevřené techniky, se problematicky – z hlediska možných komplikací – jeví především požadavek na skeletizaci vnitřních ilických cév po celém jejich obvodu, nikoliv disekce v oblasti zevních ilických cév, jak uvádí Heidenreich et al. (22). Naopak omezení preparace v této lokalitě by výrazně snížilo kvalitu lymfadenektomie: Dle topografické studie využívající radiokoloidu Mattei et al. se zjistilo, že u nejčastěji prováděné limitované pánevní lymfadenektomie (podél zevní ilické vény a obturátorová skupina) se zachytí pouze 38 %, zato u rozšířené lymfadenektomie (navíc vnitřní a společné ilické uzliny po křížení ilických cév s uretery) maximálně 75 % spádových uzlin (13). Alternativou může být ozáření lůžka po prostatektomii a malé pánve u vyselektované skupiny.
Možnost adjuvantní radioterapie na lůžko po prostatektomii a pánev nabízíme všem pacientům s pozitivními chirurgickými okraji a všem pacientům se stadiem pT3 (11, 12, 24). U těch je totiž popisováno pouze 37–70% přežívání bez onemocnění, zřejmě z důvodu subklinického reziduálního nádoru mimo chirurgické lůžko (11, 12). Tito pacienti mají i zřejmě vyšší riziko regionální lymfadenopatie (25). Plošné ozáření pánve pak může sanovat prostor spádových uzlin dokonaleji, než je schopna rozšířená lymfadenektomie, protože není limitovaná operační nepřístupností. Analogicky by radioterapie cílená na okolí „lůžka po prostatektomii“ mohla efektně likvidovat eventuálně přítomný reziduální nádor v oblasti prostatických pediklů, které svou komplexností představují v tomto smyslu chirurgický problém. Pro pacienty, kteří si přejí konzervativnější postup, zůstává záchranná („salvage“) radioterapie volbou až při eventuální biochemické progresi, i když zřejmě méně účinnou: Výsledky 2 studií (26, 27) prokázaly, že adjuvantní radioterapie, ve srovnání s odloženou radioterapií, zvyšuje pětileté přežití bez recidivy ze 40–70 % na 60–90 % (11, 24). Riziko nadbytečné léčby u pacientů s pT3 stadiem je sice při adjuvantním režimu 30–60 % (28, 29), nicméně vzhledem ke stáletrvající nexistenci účinné kurativní chemoterapie diseminovaného karcinomu prostaty a nižším dávkám záření (60–70 Gy) v adjuvantním režimu (a tím menšímu nebezpečí poškození), jej velká část pacientů akceptuje. Krom toho nově bylo prokázáno, že adjuvantní radioterapie pacientů s pT3 nádory signifikantně snižuje nejenom biochemickou, lokální a metastatickou recidivu, ale i signifikantně zvyšuje celkové přežívání ze 37 % na 47 % při sledování 11,5 roku, ve srovnání se salvage radioterapií (12).
Celkově jsme měli 15 % komplikací, což je v horním rozmezí publikovaných údajů (tab. 5). Největší podíl mají striktury anastomózy u 10 pacientů (7 %), ke kterým docházelo u prvních operovaných pravděpodobně pro nevhodnou techniku sutury anastomózy. Používali jsme pokračovací steh s malým počtem záběrů (6×), který mohl obvod anastomózy při dotahování snadno zkracovat. U prvních pacientů jsme též nefixovali centrální uzel stehu, takže při nesymetrickém dotahování mohlo docházet k proniknutí uzlu do lumina, a tím způsobit netěsnost a poruchu hojení. Příslušně jsme proto techniku anastomózy modifikovali zvýšením počtu záběrů (8–12×) a fixací centrálního uzlu. Poté se již tato komplikace nevyskytla. Striktura anastomózy byla úspěšně řešena v první linii optickou uretrotomii (řez na č. 6) v 9 případech (30). V jednom případě byla nutná uretroplastika bukálním štěpem (30).
Údaje o kontinenci ukazují trend k postupné úpravě během doby sledování jednoho roku. Ihned po vytažení katétru bylo kontinentních 25 %, pacientů, půl roku od operace 92 % (spotřeba 0–1 vložky). V největší publikované sérii Menon uvádí u stejných parametrů 25 % a 95 %. Operační technika ve vztahu ke kontinenci též zaznamenává změny: V poslední době se někteří autoři pokoušejí stabilizovat močový měchýř obnovením kontinuity Denonvilliersovy fascie (31), popřípadě o prezervaci puboprostatických ligament a fixaci měchýře k arcus tendineus (32), či periostu symfýzy (19). I my se snažíme obnovovat kontinuitu Denonvilliersovy fascie svou technikou sutury a ve zvláštních případech zavěšujeme komplex uretry za periost symfýzy.
Po RRP přetrvává neurapraxie kavernózních nervů a je vhodná časná rehabilitace penisu: Přínosem je užívaní inhibitorů 5-fosfodiesterázy v pooperačním období nebo intrakavernózní aplikace vazoaktivních látek. Pro maximální prezervaci nervově-cévních svazků je nutné postupovat atermálně při uvolňovaní nervů, disekci pediklů, preparaci semenních váčků a apexu prostaty. Erektilní dysfunkci jsme v naši sérii nehodnotili z důvodu krátké doby sledování.
ZÁVĚR
Naše zkušenosti potvrzují schůdnost a bezpečnost RoLRP. Robotický systém Da Vinci umožňuje rychlé přeorientování se z otevřené na laparoskopickou operativu a v krátké době je zřejmě možné dosáhnout slibné funkční a onkologické výsledky.
Došlo: 1. 12. 2009.
Přijato: 18. 1. 2009.
Kontaktní adresa
MUDr. Jan Doležel, PhD.
Masarykův onkologický ústav, oddělení onkourologie
Žlutý Kopec 7, 656 53 Brno
e-mail: dolezel@mou.cz
Sources
1. Ústav zdravotnických informací a statistiky ČR. Novotvary 2005 ČR. 2008, s. 83.
2. Catalona WJ, Han M. Definitive therapy for localized prostate cancer – an overview. In: Wein AJ, Kavoussi LR, Novick AC, PArtin AW, Peters CA. Campbell-Walsh Urology. 9.ed. Philadelphia: Saunders 2007; 2932–2946.
3. Bill-Axelson A, Holmberg L, Ruutu M, et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 2005; 352 : 1977–1984.
4. Tewari A, Raman JD, Chang P, et al. Long-term survival probability in men with clinically localized prostate cancer treated either conservatively or with definitive treatment (radiotherapy or radical prostatectomy). Urology 2006; 68 : 1268–1274.
5. Schuessler WW, Schulman PG, Clayman RV, Kavoussi LR. Laparoscopic radical prostatectomy: initial short-term experience. Urology 1997; 50 : 854.
6. Binder J, Kramer W. Robotically-assisted laparoscopic radical prostatectomy. BJU 2001; 87 : 408–410.
7. Patel VR, Palmer KJ, Coughlin G, Samavedi S. Robot-assisted laparoscopic radical prostatectomy: Perioperative outcomes of 1500 cases. J Endourol 2008; 22 : 2299–2305.
8. Menon M, Shrivastava A, Kaul S, et al. Vattikuti institute prostatectomy: Contemporative technique and analysis of results. Eur Urol 2007; 57 : 648–658.
9. Stolzenburg J, Rabenalt R, Do M, Kallidonis P, Liatsikos EN. Endoscopic extraperitoneal radical prostatectomy: Th e university of Leipzig experience of 2000 cases. J Endourol 2008; 22 : 2319–2325.
10. Van Velthoven RF, Ahlering TE, Peltier A, et al. Technique for laparoscopic running urethrovesical anastomosis: the single knot method. Urology 2003; 61 : 699–702.
11. Bossi A. Modern esternal-beam radiation therapy for prostate cancer: How and when. Eur Urol Suppl 2008; 7 : 22–28.
12. Swanson G, Th ompson I, Tangen C, et al. Updated results of SWOG 8794: Adjuvant radiation for high risk prostate cancer. Radiother Oncol 2008; 88(Suppl 2): 148.
13. Mattei A, Fuechsel F, Bhatta Dhar N, et al. Th e template of the primary lymphatic landing site of the prostate should be revisited: results of multimodality mapping study. Eur Urol 2008; 53 : 118–125.
14. D’Amico AV, Whittington R, Malkowicz B, et al. Biochemical outcome aft er radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for localised prostate cancer. JAMA 1998; 280 : 969–974.
15. Zorn KC, Gofrit ON, Orvieto MA, et al. Robotic-assisted radical prostatectomy: functional and pathologic outcomes with interfascial nerve preservation. Eur Urol 2007; 51 : 755–762.
16. Borin JF, Skarecky DW, Narula N, Ahlering TE. Impact of urethral stump length on continence and positive surgical margins in robot–assisted radical prostatectomy. Urology 2007; 70 : 173–177.
17. Guillonneau B, Vallancien G. Laparoscopic radical prostatectomy: the Montsouris experience. J Urol 2000; 163 : 418–422.
18. Box GN, Ahlering TE. Robotic radical prostatectomy: long-term outcomes. Curr Opin Urol 2008; 18 : 173–179.
19. Patel VR. European robotic urology symposium – Praha 2008. Osobní sdělení.
20. Bollens R, Sandhu S, Roumeguere T, Quackels T, Schulman C. Laparoscopic radical prostatectomy: the learning curve. Curr Opin Urol 2005; 15 : 1–4.
21. Algaba F. Pitfalls of pathologic staging in prostate cancer. Eur Urol Suppl 2008; 7(1): 6–14.
22. Heidenreich A, Ohlmann CH, Polyakov S. Anatomical extent of pelvic lymphadenectomy in patients undergoing radical prostatectomy. Eur Urol 2007; 52 : 29–37.
23. Bader P, Burkhard FC, Markwalder R, et al. Disease progression and survival of patients with positive lymph nodes after radical prostatectomy. Is there a chance for cure? J Urol 2003; 169 : 849–854.
24. Čoupková I, Čoupek P, Šlampa P, Ondrová B, Doležel J. Adjuvantní radioterapie po radikální prostatektomii. Sborník přednášek. XV. jihočeské onkologické dny, Český Krumlov, 9.–11. 10. 2008. s. 42–43.
25. Spiotto MT, Hancock SL, King CR. Radiotherapy aft er prostatectomy:Improved biochemical relapse-free survival with whole pelvic compared with prostate bed only for high-risk patients. Int J Radiat Oncol Biol Phys 2007; 69 : 54–61.
26. Bolla M, Van Poppel H, Collette L, et al. Postoperative radiotherapy aft er radical prostatectomy: a randomized controlled trial (EORTC trial 22911). Lancet 2005; 366 : 572–577.
27. Thompson IM, Tangen CM, Paradelo J, et al. Adjuvant radiotherapy for pathologically advanced prostate cancer. A randomized clinical trial. JAMA 2006, 296 : 2329–2335.
28. Van Poppel H, Goethuys H, Callewaert P, et al. Radical prostatetomy can provide a cure for a well–selected clinical stage pT3 prostate cancer. Eur Urol 2000; 38 : 372–379.
29. Van Der Kwast TH, Collette L, Bolla M. Adjuvant radiotherapy aft er surgery for pathologically advanced prostate cancer. J Clin Oncol 2007; 25 : 5671–5672.
30. Doležel J, Čapák I, Miklánek D, Macík D, Tvarůžek J, Šustr M, Staník M. Taktika operační léčby iatrogenních striktur membranózní uretry při ztracené sfinkterické funkci hrdla močového měchýře. Výroční konference ČUS, Hradec Králové, 8.–10. 10. 2008. Česká Urologie 2008; 12 : 107 (abstrakt 41).
31. Rocco F, Carmignani L, Acquati P, et al. Restoration of posterior aspect of rhabdosphincter shortens continence time aft er radical retropubic prostatectomy. J Urol 2006; 175 : 2201–2206.
32. Tewari AK, Bigelow K, Rao SR, et al. Anatomic restoration technique of continence mechanism and preservation of puboprostatic collar: a novel modification to achieve early urinary
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2009 Issue 2-
All articles in this issue
- VÝVOJ A KLINICKÉ HODNOCENÍ NOVÝCH LÉČIV
- MODERNÍ ŘEŠENÍ MEZIOBOROVÉ KOMUNIKACE UROLOGŮ A ONKOLOGŮ A JEHO IMPLEMENTACE NA PŘÍKLADU HORMONÁLNĚ REFRAKTERNÍHO KARCINOMU PROSTATY
- PROGNOSTICKÝ VÝZNAM EXPRESE p53, Ki-67 VE TKÁNI UROTELIÁLNÍHO KARCINOMU A NENÁDOROVÉ SLIZNICI MOČOVÉHO MĚCHÝŘE
- ČASNÉ ZKUŠENOSTI S ROBOTICKY ASISTOVANOU LAPAROSKOPICKOU RADIKÁLNÍ PROSTATEKTOMIÍ - PRVNÍCH 153 PACIENTŮ
- ATYPICKÝ PRŮBĚH TORZE PŘÍVĚSKU VARLETE
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ATYPICKÝ PRŮBĚH TORZE PŘÍVĚSKU VARLETE
- PROGNOSTICKÝ VÝZNAM EXPRESE p53, Ki-67 VE TKÁNI UROTELIÁLNÍHO KARCINOMU A NENÁDOROVÉ SLIZNICI MOČOVÉHO MĚCHÝŘE
- VÝVOJ A KLINICKÉ HODNOCENÍ NOVÝCH LÉČIV
- ČASNÉ ZKUŠENOSTI S ROBOTICKY ASISTOVANOU LAPAROSKOPICKOU RADIKÁLNÍ PROSTATEKTOMIÍ - PRVNÍCH 153 PACIENTŮ
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

