-
Medical journals
- Career
Chemická pleurodéza s použitím jodovaného povidonu (Betadine) u vrozeného chylothoraxu: vlastní zkušenost a přehled literatury
Authors: Náhlovský Jiří 1; Štichhauer Radek 2; Lešková Jana 2; Malý Jan 1; Matějek Tomáš 1
Authors‘ workplace: Klinika dětské chirurgie a traumatologie, Lékařská fakulta v Hradci Králové, Univerzita Karlova a Fakultní nemocnice Hradec Králové 2
Published in: Čes-slov Pediat 2024; 79 (1): 46-52.
Category: Original Papers
doi: https://doi.org/10.55095/CSPediatrie2023/055Overview
Vrozený chylothorax je závažné a obtížně léčitelné onemocnění s vysokou mortalitou. Použitím chemické pleurodézy lze omezit nutnost chirurgické léčby, avšak dosud není kvůli nedostatku důkazů jednoznačná shoda nad optimální chemickou látkou. Ve dvou kazuistikách popisujeme vlastní zkušenost s chemickou pleurodézou jodovaným povidonem u novorozenců s vrozeným chylothoraxem. Pacientům jsme podali 2 ml/kg roztoku 4% jodovaného povidonu intrapleurálně cestou hrudního drénu, který byl po podání na 4 hodiny zasvorkován. V obou případech bylo nutné opakované podání k úplnému potlačení tvorby chylu. Podle našich zkušeností použití chemické pleurodézy jodovaným povidonem rychle, účinně a bez nežádoucích účinků zabrání další tvorbě pleurálního výpotku. Od prvního použití této metody v roce 2003 bylo publikováno 20 případů aplikace novorozencům v léčbě kongenitálního chylothoraxu. Jejich přehled a zhodnocení jsou součástí sdělení. Celková úspěšnost i procento přežití dosahují 80 %.
ÚVOD
Vrozený chylothorax (VCT) je nejčastější příčinou fluidothoraxu u novorozenců. Na rozdíl od sekundárního chylothoraxu není způsoben iatrogenním poškozením hrudního mízovodu, jeho obstrukcí v důsledku tumoru ani žilní trombózou v místě, kam mízovod ústí. V etiologii VCT hrají roli některé genetické syndromy (zejména Downův, Turnerův a Noonanové), nicméně část případů je idiopatická.(1–4) I přes pokroky v novorozenecké ventilaci a terapii VCT zůstává mortalita vysoká (přes 20 %), zejména v důsledku septických komplikací.(3,4) Vrozený chylothorax lze diagnostikovat prenatálně či postnatálně ze vzorku pleurální tekutiny. V případě chylothoraxu vzorek obsahuje více než 80 % lymfocytů, a pokud již pacient přijímal tuk enterálně, pak obsahuje triglyceridy s hodnotami přes 110 mg/dl (1,24 mmol/l).(5,6) Vzhledem k relativně nízké incidenci (1 : 10 000 – 24 000) je získání dostatečné zkušenosti s léčbou VCT obtížné.(3,7)
Prenatální léčba VCT zahrnuje transabdominální torakocentézu,(8) pleuro-amniální drenáž,(9) případně podání látky OK-432 intrapleurálně.(4) V rámci postnatální léčby je nutná pleurální punkce či drenáž, terapie respiračního selhání v rozsahu od oxygenoterapie přes konvenční umělou plicní ventilaci až po vysokofrekvenční ventilaci, případně i s léčbou perzistující plicní hypertenze novorozence oxidem dusnatým či sildenafilem. Pro snížení produkce chylu se doporučuje totální parenterální výživa.(3,4) Jakmile se produkce chylu sníží a stabilizuje, doporučuje se zahájit krmení mlékem obsahujícím tuky jen ve formě triglyceridů se středně dlouhým řetězcem.(1,10,11) Další možností léčby je použití oktreotidu (analog somatostatinu),(12,13) ale jeho účinek na redukci produkce chylu dosud nebyl v případě VCT přesvědčivě prokázán.(14,15)
Při selhání konzervativní léčby je často nutné řešení chirurgické ve formě pleurodézy či jiného postupu omezujícího přívod lymfy do hrudníku.(1,4,10,16) Cílem je snížit přetrvávající vysokou denní produkci chylu, která vede nejen k depleci tekutin, ale též lymfocytů a imunoglobulinů. Tyto ztráty činí pacienta vnímavějším k infekčním komplikacím, které bývají hlavní příčinou úmrtí při VCT.(3) Snaha vyhnout se chirurgickému výkonu vedla k pokusům o chemickou pleurodézu.(4)
Za posledních 20 let byl kromě jiných látek (například bleomycin, minocyklin, fibrinové lepidlo, krev) použit opakovaně také jodovaný povidon (JP).(17–27)Cílem tohoto sdělení je informovat o dvou pacientech s VCT s vysokou produkcí chylu, u kterých se použitím chemické pleurodézy JP podařilo ukončit plicní drenáž, a vyhnout se tak chirurgickému výkonu. Součástí sdělení je shrnutí všech dosavadních literárních údajů o aplikaci JP v léčbě VCT od jeho prvního použití Brissaudem v roce 2003.(18)
METODY
Popisujeme dva vlastní recentní případy VCT, u nichž byla použita chemická pleurodéza s použitím JP. S použitím databáze Medline jsme poté vyhledali všechny dostupné relevantní práce publikované mezi 1. lednem 2003 a 31. prosincem 2022. V zadání vyhledávacího řetězce byla použita následující klíčová slova: „Povidone-iodine“, „Chylothorax, Congenital“ a „Pleurodesis“. Výsledkem bylo 7 kazuistických sdělení(18–21,24–26) a jeden přehledový článek bez vlastní kazuistiky.(4) Při podrobném pročtení článků a v nich uvedené literatury byla dohledána další čtyři (v Medline původně nenalezená) kazuistická sdělení.(17,22,23,27) Pro analýzu byly vybrány všechny takto získané kazuistiky uvádějící podání JP u novorozenců s VCT. V případě, že nebyl jasně uveden věk pacienta při aplikaci JP nebo pokud nebyla aplikace provedena v novorozeneckém věku, nebyl takový pacient do naší analýzy zahrnut. Celkem se jednalo o osmnáct jednotlivých případů, které byly popsány v 11 článcích.(17–27)
KAZUISTIKA 1
Dívka s prenatálně diagnostikovaným významným bilaterálním chylothoraxem se narodila císařským řezem ve věku 35 dokončených gestačních týdnů s porodní hmotností 1900 gramů. Po narození byla neodkladně zahájena bilaterální hrudní drenáž, pacientka vyžadovala umělou plicní ventilaci. I přes konzervativní léčbu chylothoraxu s vysokými odpady (totální parenterální výživa, restrikce tekutin, substituce albuminem k udržení sérového hladiny nad 30 g/l, podávání oktreotidu ve druhém týdnu života) nedocházelo ke snížení produkce drénované tekutiny (obr. 1). Bylo proto rozhodnuto o provedení chemické pleurodézy s použitím JP. Ve stáří 31 dnů byl u ventilované pacientky pravostranným hrudním drénem podán 4% roztok (Betadine, Egis Pharmaceuticals PLC, 1106 Budapešť, Keresztúri út. 30-38, Maďarsko) v dávce 2 ml/kg. Drén byl po podání uzavřen na 4 hodiny svorkou. Po podání nedošlo k žádné nutnosti změny ventilačního režimu, pacientka však přechodně potřebovala navýšit analgezii. Bezprostředně po provedení chemické pleurodézy došlo k poklesu tvorby chylu o 85 % (obr. 1). Ultrazvuk hrudníku provedený 4 dny po pleurodéze odhalil opouzdřenou kolekci při bazi pravé plíce. Do kolekce byl zaveden nový hrudní drén a po 4 hodinách drenáže byla podána na 4 hodiny další dávka pleurodézy JP (2 ml/kg, 4% koncentrace). O tři dny později (38. den života) byla pacientce podána poslední dávka pleurodézy JP, a to vlevo. Důvodem byl vzestup odpadů z levostranného drénu mírně nad 50 ml na kilogram a den. Provedení chemické pleurodézy a stejně tak další hospitalizace byly bez komplikací, bilaterální hrudní drenáž byla pro nepotřebnost ukončena 42. den života (11 dní po první chemické pleurodéze). Po podání pleurodézy nebyla zaznamenána reakce parametrů zánětu – hodnota CRP byla před podáním i po podání všech dávek minimální, stejně tak nedošlo k elevaci leukocytů nad bazální hodnotu (pacientka měla dlouhodobě kolem 5×109/l). Objevila se však přechodná reakce hladiny TSH, která byla sice nadále v referenčním rozmezí (na našem pracovišti 0,72–11 mU/l), ale zvýšila se o řád (0,8 před podáním JP – 10,8 mU/l dva dny po podání). Během tří týdnů po pleurodéze byl zaznamenán postupný pokles (8,16–2,24 mU/l). Hodnoty fT4 na podání nijak nezareagovaly. Pacientka byla propuštěna do domácí péče 71. den hospitalizace. Při dvouletém sledování prospívala dobře, neměla žádné narušení psychomotorického vývoje a nebyl zaznamenán relaps.
Image 1. Denní množství chylu odváděného drény u pacientky z kazuistiky 1. Terapeutické intervence jsou vyznačeny v grafu či pod grafem, šipka značí podání chemické pleurodézy jodovaným povidonem. 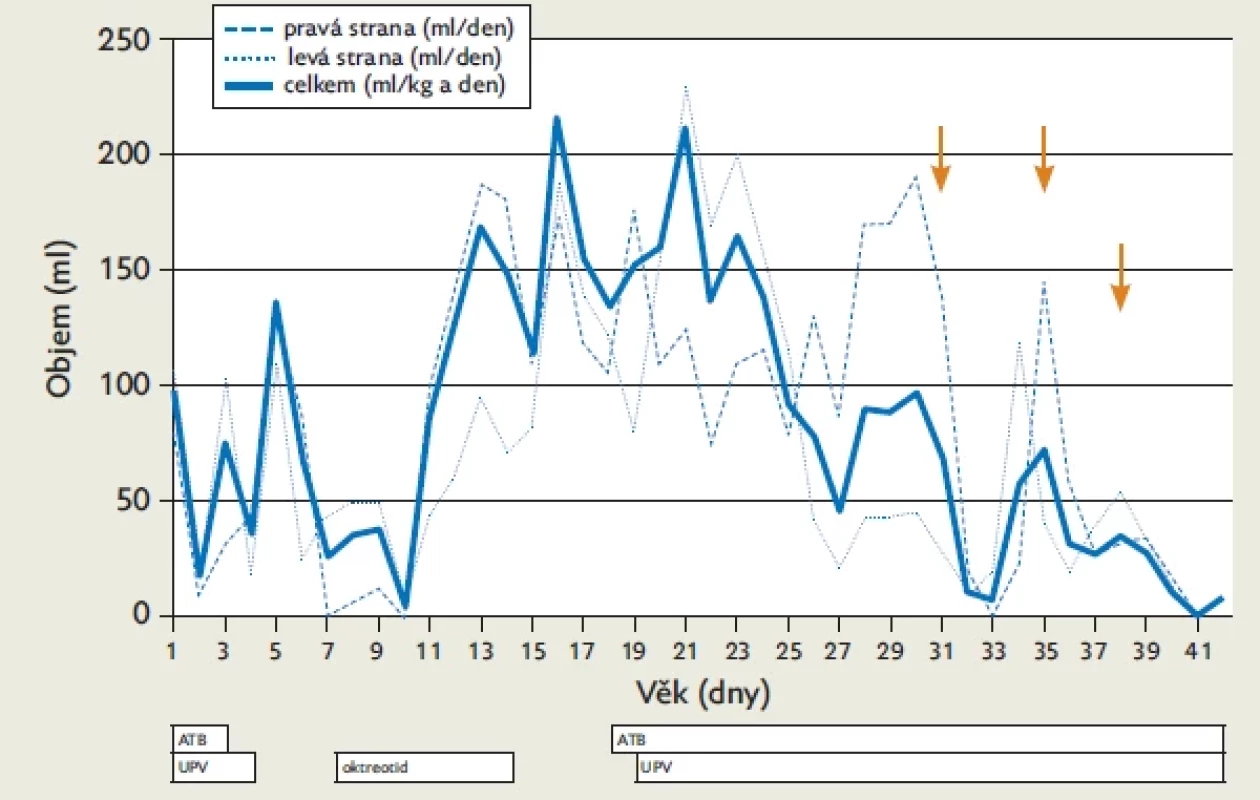
AT B – antibiotická léčba; UPV – umělá plicní ventilace Image 2. Denní množství chylu odváděného drény u pacienta z kazuistiky 2. Terapeutické intervence jsou vyznačeny v grafu či pod grafem, šipka značí podání chemické pleurodézy jodovaným povidonem. 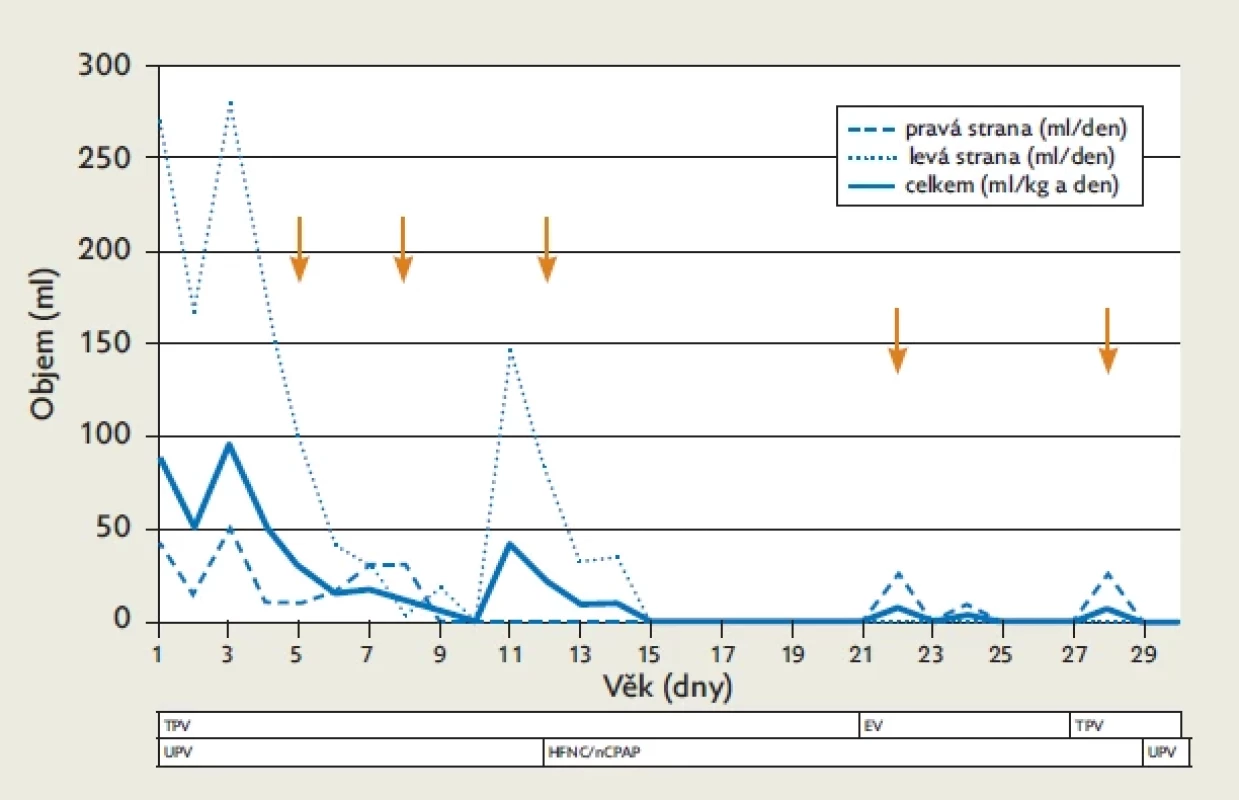
EV – enterální výživa; HFNC/nCPAP – vysokoprůtoková nosní kanyla nebo nazální podpora s trvalým přetlakem (neinvazivní dechová podpora); TPV – totální parenterální výživa; UPV – umělá plicní ventilace KAZUISTIKA 2
Chlapec s prenatálně diagnostikovanou translokační formou trizomie 21. chromozomu (46, XY, +21, der (21;21) (q10;q10)) se narodil císařským řezem v dokončeném 36. týdnu gravidity s hmotností 3420 gramů. Prenatálně u něj byl odhalen bilaterální fluidothorax a vrozená srdeční vada (defekt komorového septa). Ihned po porodu dítě vyžadovalo oboustrannou drenáž hrudníku. Množství pleurálního výpotku (chylu) dosahovalo v prvních čtyřech dnech 80–100 ml/kg/den, u pacienta se rychle rozvinula anasarka. Od pátého dne života byla provedena opakovaná chemická pleurodéza s použitím JP (třikrát vpravo, dvakrát vlevo, poslední aplikace 28. den) stejným způsobem jako u pacientky z první kazuistiky (2 ml na kilogram a dávku, 4% ředění, uzávěr hrudního drénu na 4 hodiny). Podařilo se prakticky zastavit pleurální produkci chylu, od 16. dne života nebyla nutná kontinuální hrudní drenáž (obr. 2). Opakovaná pravostranná podání JP (den 22 a den 28) byla provedena pro doplnění výpotku (dokumentované v prvním případě na CT a v druhém případě ultrazvukem) a související tvorbu atelektázy s přechodným respiračním zhoršením. Bezprostředně po podání žádné dávky nebyly zaznamenány zásadnější nežádoucí účinky až na přechodný pokles diurézy. S odstupem několika dnů po 3. a 5. dávce došlo k přechodné elevaci CRP (maximální hodnota 54,5, respektive 31,9 mg/l) s rychlou úpravou, po 3. dávce byla zaznamenána i přechodná leukocytóza. Pacient měl na konci prvního týdne života vyšší hodnotu TSH (15,94 mU/l, jednalo se o první odběr), která však postupně klesala do normy, hodnoty fT4 byly po celou dobu v normálním rozmezí. Celkový stav pacienta však ve druhém měsíci života postupně deterioroval s epizodickým zhoršováním hepatopatie a pneumopatie spojených s periodickým alveolárním krvácením, pacient měl tendenci k retenci tekutin bez laboratorních známek renálního selhání. Pleurální výpotek byl v tomto období minimální až nulový a neměl na celkový stav vliv. Pátý týden života došlo k rozvoji chylózního ascitu. Pacient zemřel ve stáří dvou měsíců na multiorgánové selhání, z pitvy bylo vyjádřeno podezření na globální dysfunkci lymfatických cév, která byla očekávána vzhledem k základní diagnóze a klinickému průběhu onemocnění. Během pitvy byla dobře patrná oboustranná skarifikace pleury jako výsledek chemické pleurodézy (obr. 3).
Image 3. Pleurální srůsty po pleurodéze u pacienta z kazuistiky 2 (pitevní nález) 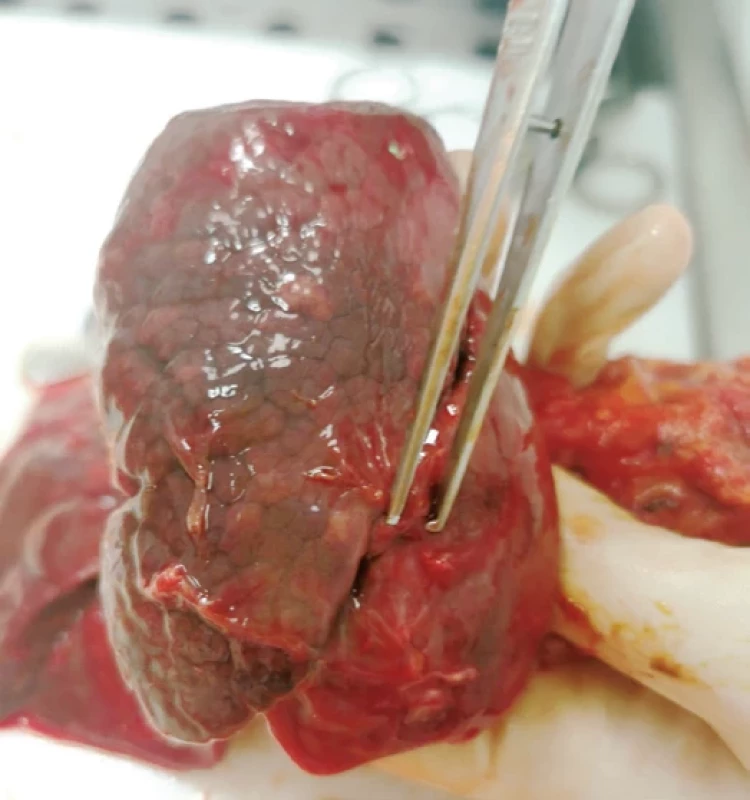
DISKUSE
Intrapleurální použití jodovaného povidonu bylo poprvé popsáno v roce 1991 v léčbě dospělých s maligním výpotkem.(28) Od té doby bylo jednoznačně prokázáno, že použití JP u dospělých má vysokou úspěšnost (90 %) k dosažení plné remise u maligních i nemaligních plicních výpotků a spontánního pneumothoraxu. Podle dvou randomizovaných studií je JP stejně bezpečný a účinný jako talek, který je považován za zlatý standard chemické pleurodézy.(29,30) V obou studiích jsou jedinými popsanými komplikacemi bolest hrudníku a empyém.(29)
Mechanismus účinku jodovaného povidonu je zřejmě spojen s jeho schopností vyvolat sklerózu tkání, nicméně přesný způsob, jak je tohoto účinku dosaženo, není jasný. Jód má velmi silné oxidativní a cytotoxické vlastnosti, které vedou k rozvoji intenzivní zánětlivé odpovědi ve stěně jakékoliv struktury obsahující tekutinu. Jodovaný povidon navíc zřejmě také potlačuje tvorbu exsudátu, což souvisí s jeho schopností chelace bílkovin.(27) Pitevní nález u pacienta z kazuistiky číslo dvě dokladuje lokální podpoření sklerózy, tento pacient také na opakovanou aplikaci reagoval přechodným zvýšením CRP a leukocytózou.
Chemická pleurodéza JP u dětí byla poprvé popsána Brissaudem a kolegy u čtyř novorozenců s vrozeným chylothoraxem.(18) Od té doby bylo v literatuře popsáno několik dalších případů. Na podkladě naší zkušenosti s touto léčbou jsme posbírali dostupné publikované případy chemické pleurodézy JP u novorozenců s VCT,(17,19–27) abychom zhodnotili použité postupy se zřetelem na použitou dávku a koncentraci, dobu uzavření drénu, účinnost, komplikace a případné další faktory, které mohou přispět k úspěchu či neúspěchu této léčby. V tabulce 1 jsou shrnuty detaily o klinických projevech a podání pleurodézy u publikovaných případů.
Dle světové literatury dosud chybí shoda nad technikou podání JP při pleurodéze. Rozmezí použité koncentrace je od 0,05 % do 10 %, nicméně nejčastěji je uváděna 4% koncentrace (téměř 65 % všech případů).(17,19–23,25–27) Rozmezí dávky je také poměrně široké (1–4 ml/kg), avšak nejčastěji byly použity 2 ml/kg (viz tab. 1). Doba uzavření drénu se pohybuje mezi jednou a pěti hodinami. U obou našich pacientů jsme použili ředěný 4% (magistraliter) roztok v dávce 2 ml/kg ponechaný in situ 4 hodiny. Nejprve jsme jej podali na více postiženou stranu. Pokud tvorba chylu neustala, tak jsme po uplynutí 3–5 dnů podali další dávku. Teprve poté, pokud to bylo nutné, jsme zahájili léčbu na druhé straně. U dvaceti dosud popsaných případů byl medián podání první dávky 30 dnů (IQR 19–35) (tab. 1). Tento interval odpovídá času potřebnému k obvyklé konzervativní léčbě (hrudní drenáž, totální parenterální výživa a oktreotid). U pacienta referovaného v druhé kazuistice jsme pokročili k provedení chemické pleurodézy mnohem dříve (pátý den života), než bylo dosud v literatuře publikováno. Důvodem, který nás k tomu vedl, byla vysoká produkce chylu a velmi dobrá předchozí zkušenost s touto léčbou. V dosud publikovaných případech byla většinou jediná dávka JP dostatečná k dosažení remise, zejména v případě jednostranných VCT. Medián počtu podání JP byl v uvedených případech 1 (IQR 1,0–2,0) (tab. 1). U šesti pacientů (včetně obou našich) byly nezbytné opakované aplikace. Zdá se, že opakované podání samotné není spojeno s vyšším rizikem komplikací – čtyři z těchto pacientů přežili bez patrných následků. Zbylí zemřeli na vrozenou malformaci lymfatického systému. Ve skupině všech dosud publikovaných případů VCT léčených chemickou pleurodézou s použitím JP byly celková úspěšnost léčby i přežití shodně velmi vysoké a dosáhly v obou případech 80 %. Důvody selhání léčby JP ve všech případech, které popisuje Le Nué et al.(21) lze obtížně zhodnotit, protože autoři neuvádí nezbytné detaily aplikace, jako je dávka, koncentrace roztoku a doba uzavření drénu. Práce je navíc primárně zaměřena na chirurgickou léčbu a při neúplném efektu první dávky bylo přistoupeno k chirurgické pleurodéze. V jednom případě byl JP navíc podáván peroperačně (s následujícím oběhovým a respiračním selháním).
U novorozenců jsou nežádoucí účinky pleurodézy JP vzácné a zahrnují zejména přechodné respirační zhoršení, pravděpodobně způsobené přechodným kolapsem plíce v důsledku lokální zánětlivé odpovědi.(21,27) Mezi další uváděné komplikace patří generalizovaný edém(17,18) a rozvoj renálního selhání.(18,24,26) Generalizovaný edém vymizel u jednoho pacienta spontánně, ve druhém případě pomohla léčba propranololem. Rozvoj renálního selhání byl spojen s již předcházející jinou renální komplikací (například trombóza renální žíly) nebo s histologicky prokázanou(18,26) nebo suspektní vrozenou malformací lymfatického systému.(24) Rozvoj renálního selhání při expozici větší dávce jodovaného povidonu je uveden i v dokumentaci přípravku (například u pacientů s rozsáhlými popáleninami). Mitanchez et al.(24) dovozují, že v případě vrozených lymfangiektazií je vstřebání JP z pleurální dutiny vyšší, a snáze tak způsobí poškození ledvin. V souladu s pitevním nálezem a klinickým průběhem (retence tekutin, respirační a kardiovaskulární selhání) se domníváme, že náš pacient referovaný v kazuistice 2 měl malformaci lymfatického systému. Po podání chemické pleurodézy však u něj nedošlo k elevaci kreatininu, který byl až do posledního týdne hospitalizace v normě. Hepatopatie a pneumopatie, které u pacienta byly dominujícími projevy ve druhém měsíci hospitalizace, nejsou v dostupné literatuře uváděny jako komplikace podání JP, avšak souvislost s jistotou vyloučit nemůžeme. Borcyk et al.(17) publikovali případ VCT s vysokými odpady z drénů a podezřením na lymfangiektazii, který se podařilo úspěšně zvládnout s pomocí intenzivní podpůrné léčby, chemické pleurodézy 4% JP a podáváním propranololu. Propranolol je dobře známé antihypertenzivum s náhodou zjištěným vlivem na regresi hemangiomů, které se v ústním podání pro svou účinnost a bezpečnost stalo lékem volby v léčbě hemagiomů u dětí.(17) Propranolol blokuje β2-adrenergní receptory v hemangiomu a tím snižuje syntézu proangiogenních faktorů.(31) Literatura je ohledně použití propranololu u lymfangiomů stále nejednotná, avšak v mnoha sděleních byla dokladována účinnost, kterou autoři dávají do souvislosti právě s expresí β2-adrenergních receptorů v malformovaných lymfatických cévách.(17,31)
Na podkladě těchto informací a ve světle zkušeností s naším případem a s předchozími literárními případy úmrtí při léčbě VCT spojeného s lymfangiektazií(18,24) se domníváme, že je vhodné zvážit léčebné podání propranololu, pokud se u pacienta vyskytne podezření na malformaci lymfatických cév.Vysoké koncentrace exogenního jódu v organismu mohou způsobit blokádu reakcí k navázání a udržení jódu, a tím snížit syntézu hormonů štítné žlázy. Nadbytečné jodidy mohou u vnímavých jedinců navíc způsobit rozvoj tyreotoxikózy.(23) Proto je po podání pleurodézy JP nadále doporučeno až tři týdny monitorovat funkce štítné žlázy (TSH, T4, T3). Nicméně u žádného z našich pacientů ani u pacientů z předchozích sdělení nebyla zachycena žádná zásadní alterace ve funkci štítné žlázy kromě přechodné elevace TSH.(18,20,23)
Table 1. Přehled jednotlivých případů vrozeného chylothoraxu u novorozenců léčeného chemickou pleurodézou jodovaným povidonem 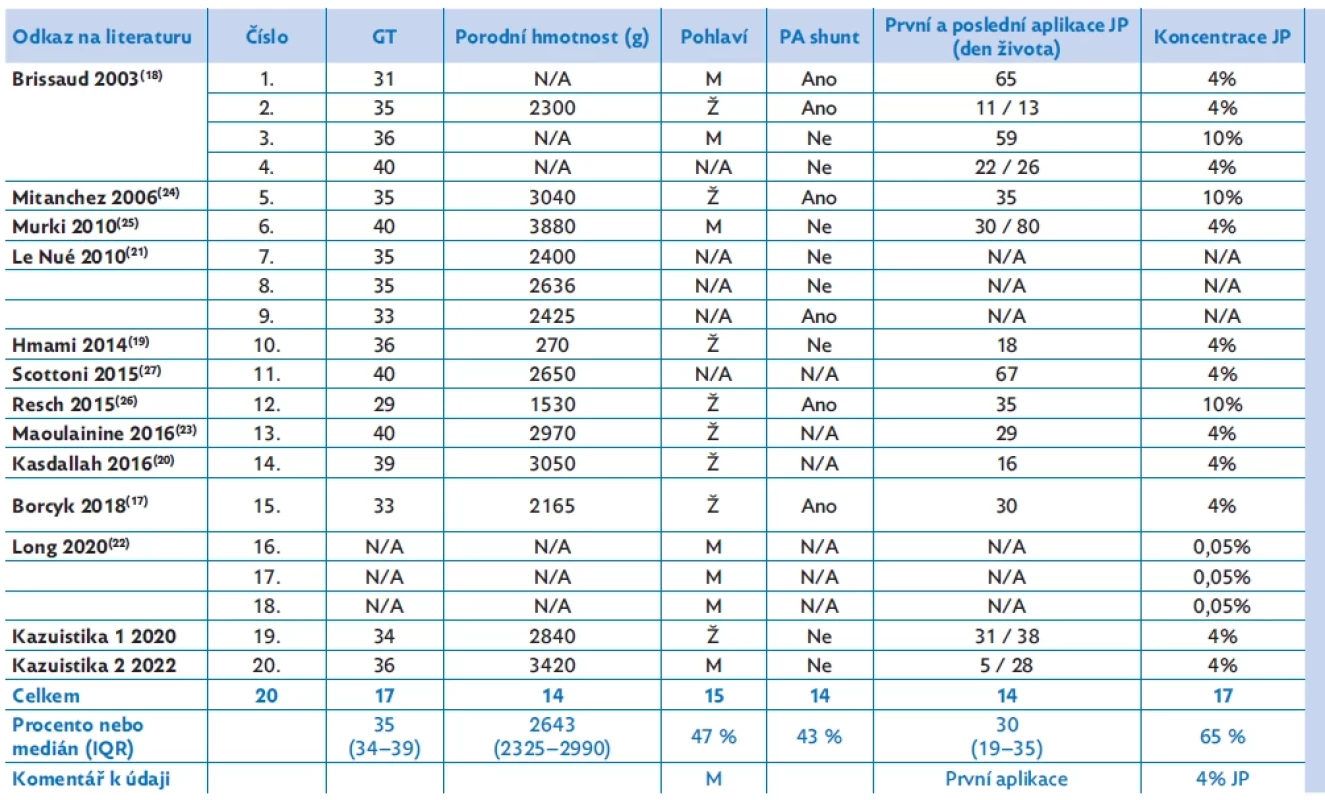
GT – gestační týden; Ž – žena; M – muž; PA shunt – pleuro-amniální shunt; JP – jodovaný povidon; B/L/P – bilaterální/levá/pravá; N/A – údaj není k dispozici; IQR – interkvartilové rozmezí. * Úspěch je definován jako alespoň jednostranný ústup chylothoraxu. ** Dávka byla odhadnuta podle porodní hmotnosti. ZÁVĚR
V práci popisujeme dva případy vrozeného chylothoraxu s vysokou produkcí chylu, které byly úspěšně vyřešeny pomocí chemické pleurodézy s použitím 4% roztoku jodovaného povidonu. Byla použita dávka 2 ml na kilogram hmotnosti, podání bylo opakováno až do kompletního vyléčení chylothoraxu. Kromě přechodné elevace TSH a dočasné mírné zánětlivé reakce jsme nezaznamenali žádné přesvědčivé komplikace sdružené s podáním chemické pleurodézy. Projevy hepatopatie a pneumopatie pozorované u pacienta referovaného v kazuistice 2 dosud v literatuře zmíněny nebyly, navíc jejich rozvoj následoval až s odstupem po podání pleurodézy. V dosud publikovaných kazuistikách jsou popisovány očekávatelné nežádoucí účinky, které jsou ve většině případů dobře zvládnutelné bez dlouhodobých následků. V případě pacientů s preexistující zhoršenou funkcí ledvin je namístě opatrnost. Terapii propranololem je vhodné zvážit, pokud panuje podezření na vrozenou poruchu lymfatického systému. Na podkladě soudobých poznatků zatím nelze navrhnout jednoznačné doporučení pro léčbu vrozeného chylothoraxu. Dostupné informace však naznačují, že lze chemickou pleurodézu s použitím jodovaného povidonu považovat za účinnou a relativně bezpečnou možnost v léčbě chylothoraxu u novorozenců.
Korespondenční adresa:
MUDr. Jiří Náhlovský
Dětská klinika, Lékařská fakulta v Hradci Králové, UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
jiri.nahlovsky@gmail.com
Sources
1. Attar MA, Donn SM. Congenital chylothorax. Semin Fetal Neonatal Med 2017; 22(4): 234–9.
2. Bellini C, Ergaz Z, Boccardo F, et al. Dynamics of pleural fluid effusion and chylothorax in the fetus and newborn: role of the lymphatic system. Lymphology 2013; 46(2): 75–84.
3. Bialkowski A, Poets CF, Franz AR, et al. Congenital chylothorax: a prospective nationwide epidemiological study in Germany. Arch Dis Child Fetal Neonatal Ed 2015; 100(2): F169–72.
4. Resch B, Sever Yildiz G, Reiterer F. Congenital chylothorax of the newborn: a systematic analysis of published cases between 1990 and 2018. Respiration 2022; 101(1): 84–96.
5. Buttiker V, Fanconi S, Burger R. Chylothorax in children: guidelines for diagnosis and management. Chest 1999; 116(3): 682–7.
6. van Straaten HL, Gerards LJ, Krediet TG. Chylothorax in the neonatal period. Eur J Pediatr 1993; 152(1): 2–5.
7. Faul JL, Berry GJ, Colby TV, et al. Thoracic lymphangiomas, lymphangiectasis, lymphangiomatosis, and lymphatic dysplasia syndrome. Am J Respir Crit Care Med 2000; 161(3 Pt 1): 1037–46.
8. Chen CP, Chang TY, Wang W. Resolution of fetal bilateral chylothorax and ascites after two unilateral thoracocenteses. Ultrasound Obstet Gynecol 2001; 18(4): 401–2.
9. Chon AH, Chmait HR, Korst LM, et al. Long-term outcomes after thoracoamniotic shunt for pleural effusions with secondary hydrops. J Surg Res 2019; 233 : 304–9.
10. De Angelis LC, Bellini T, Witte MH, et al. Congenital chylothorax: Current evidence based prenatal and post-natal diagnosis and management. Lymphology 2019; 52(3): 108–25.
11. Krishnamurthy Mohan Bagur, Atul M. Congenital chylothorax: current perspectives and trends. Res Report Neonatol 2017; 7 : 53–63.
12. Moreira-Pinto J, Rocha P, Osorio A, et al. Octreotide in the treatment of neonatal postoperative chylothorax: report of three cases and literature review. Pediatr Surg Int 2011; 27(8): 805–9.
13. Rimensberger PC, Muller-Schenker B, Kalangos A, et al. Treatment of a persistent postoperative chylothorax with somatostatin. Ann Thorac Surg 1998; 66(1): 253–4.
14. Das A, Shah PS. Octreotide for the treatment of chylothorax in neonates. Cochrane Database Syst Rev 2010(9): Cd006388.
15. Church JT, Antunez AG, Dean A, et al. Evidence-based management of chylothorax in infants. J Pediatr Surg 2017; 52(6): 907–12.
16. Clark ME, Woo RK, Johnson SM. Thoracoscopic pleural clipping for the management of congenital chylothorax. Pediatr Surg Int 2015; 31(12): 1133–7.
17. Borcyk K, Kamil A, Hagerty K, et al. Successful management of extremely high output refractory congenital chylothorax with chemical pleurodesis using 4% povidone-iodine and propranolol: a case report. Clin Case Rep 2018; 6(4): 702–8.
18. Brissaud O, Desfrere L, Mohsen R, et al. Congenital idiopathic chylothorax in neonates: chemical pleurodesis with povidone-iodine (Betadine). Arch Dis Child Fetal Neonatal Ed 2003; 88(6): F531–3.
19. Hmami F, Oulmaati A, Bouchikhi C, et al. [Congenital chylothorax: rapid and complete response to polyvidone iodine]. Arch Pediatr 2014; 21(9): 1002–5.
20. Kasdallah N, Kbaier H, Ben Salem H, et al. Povidone iodine pleurodesis for refractory congenital chylothorax: a review of literature. Tunis Med 2016; 94(12): 834.
21. Le Nué R, Molinaro F, Gomes-Ferreira C, et al. Surgical management of congenital chylothorax in children. Eur J Pediatr Surg 2010; 20(5): 307–11.
22. Long WG, Cai B, Liu Y, et al. Povidone-iodine chemical pleurodesis in treating spontaneous chylothorax in pediatric patients. Ann Palliat Med 2020; 9(3): 1004-12.
23. Maoulainine F, Erguig L. Congenital chylothorax: rapid and effective response to polyvidone iodine. Open J Pediatrics 2016; 6 : 10–3.
24. Mitanchez D, Walter-Nicolet E, Salomon R, et al. Congenital chylothorax: what is the best strategy? Arch Dis Child Fetal Neonatal Ed 2006; 91(2): F153–F4.
25. Murki S, Faheemuddin M, Gaddam P. Congenital chylothorax--successful management with chemical pleurodesis. Indian J Pediatrics 2010; 77(3): 332–4.
26. Resch B, Freidl T, Reiterer F. Povidone-iodine pleurodesis for congenital chylothorax of the newborn. Arch Dis Child Fetal Neonatal Ed 2016; 101(1): F87–8.
27. Scottoni F, Fusaro F, Conforti A, et al. Pleurodesis with povidone-iodine for refractory chylothorax in newborns: Personal experience and literature review. J Pediatr Surg 2015; 50(10): 1722–5.
28. Echavarría A, Pinzón V, Barés JP, et al. [Intracavitary treatment of malignant pleural effusion with iodine-povidone]. Rev Med Panama 1991; 16(1): 69–74.
29. Agarwal R, Khan A, Aggarwal AN, et al. Efficacy & safety of iodopovidone pleurodesis: a systematic review & meta-analysis. Indian J Med Res 2012; 135(3): 297–304.
30. Mohsen TA, Zeid AA, Meshref M, et al. Local iodine pleurodesis versus thoracoscopic talc insufflation in recurrent malignant pleural effusion: a prospective randomized control trial. Eur J Cardiothorac Surg 2011; 40(2): 282–6.
31. Chisholm KM, Chang KW, Truong MT, et al. β-Adrenergic receptor expression in vascular tumors. Mod Pathol 2012; 25(11): 1446–51.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2024 Issue 1-
All articles in this issue
- Z Lobkowiczké sbírky na Pražském hradě
- Co jsme psali
- Editorial
- Preventivní kardiologie v pediatrii
- Prenatální kardiologie
- Prevence poškození zdraví při sportu
- Současný pohled na prevenci infekční endokarditidy v dětství v České republice
- Porucha příjmu potravy kojenců a batolat
- Diferenciální diagnostika polyurie-polydipsie
- Úrazy břicha u dětí – identifikace, základní principy klinické rozvahy a léčby
- Chemická pleurodéza s použitím jodovaného povidonu (Betadine) u vrozeného chylothoraxu: vlastní zkušenost a přehled literatury
- Cena ministra zdravotnictví za zdravotnický výzkum a vývoj
- 70 let Fakulty dětského lékařství Univerzity Karlovy v Praze
- Humor & poezie
- Zemřel profesor MUDr. Bohumil Hučín, DrSc.
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika polyurie-polydipsie
- Úrazy břicha u dětí – identifikace, základní principy klinické rozvahy a léčby
- Současný pohled na prevenci infekční endokarditidy v dětství v České republice
- Porucha příjmu potravy kojenců a batolat
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


