-
Medical journals
- Career
Gastrointestinálne nežiaduce účinky metotrexátu v liečbe pacientov s juvenilnou idiopatickou artritídou – vieme ich správne hodnotiť?
Authors: P. Mrážik; V. Vargová
Authors‘ workplace: Klinika detí a dorastu LF UPJŠ a DFN, Košice, prednostka doc. MUDr. I. Schusterová, PhD.
Published in: Čes-slov Pediat 2015; 70 (4): 215-219.
Category: Original Papers
Overview
Účel štúdie:
Pod pojem juvenilná idiopatická artritída zahŕňame všetky formy artritídy, ktoré sa zjavili pred 16. rokom života, pretrvávajú minimálne šesť týždňov a ich etiológia je neznáma. Liečba metotrexátom u pacientov s juvenilnou idiopatickou artritídou je vo všeobecnosti považovaná za účinnú, bezpečnú a dobre tolerovanú.Metódy:
Retrospektívne sme vyhodnocovali výskyt gastrointestinálnych nežiaducich účinkov metotrexátu v súbore 88 pacientov s juvenilnou idiopatickou artritídou liečených v reumatologickej ambulancii Detskej fakultnej nemocnice Košice. Nežiaduce gastrointestinálne účinky sme rozdelili na základe ich intenzity a trvania (ľahké, stredné, ťažké) a na základe pravdepodobnosti ich kauzálneho vzťahu (možné, pravdepodobné, potvrdené) k liečbe metotrexátom.Výsledky:
Výskyt gastrointestinálnych nežiaducich účinkov sme zistili u 20 pacientov, čo predstavovalo 22,7 %, v celkovom počte 21. Kauzálny vzťah k liečbe metotrexátom bol potvrdený v 90 %. Najčastejšie sa vyskytovali ľahké príznaky.Závery:
Výskyt gastrointestinálnych nežiaducich účinkov metotrexátu vedie k nedodržiavaniu liečebného režimu alebo odmietnutiu liečby u signifikantnej skupiny detských pacientov či ich rodičov. Zavedenie používania štandardizovaného dotazníka pre hodnotenie gastrointestinálnej intolerancie metotrexátu v bežnej ambulantnej praxi a správna interpretácia ťažkostí pomôže podchytiť problém a umožní použiť protiopatrenia ešte pred stratou dôvery medzi pacientom a lekárom.Kľúčové slová:
juvenilná idiopatická artritída, metotrexát, nežiaduci účinok, intoleranciaÚVOD
Juvenilná idiopatická artritída (JIA) zahŕňa všetky formy artritídy postihujúce deti pred 16. rokom života, ktoré pretrvávajú minimálne 6 týždňov a sú neznámej etiológie. S ročnou incidenciou 2–20 prípadov na 100 000 detí a prevalenciou 16–150 prípadov na 100 000 detí patrí JIA medzi najčastejšie chronické choroby v detskom veku [1]. Podľa údajov z Národného centra zdravotníckych informácií prevalencia juvenilnej artritídy v SR v roku 2012 bola 93 prípadov na 100 000 detí vo vekovej skupine 0 až 18-ročných, s pomerom chlapci : dievčatá 1 : 1,27 [2, 3]. V súčasnosti platná ILAR (The International League of Associations of Rheumatology) klasifikácia člení JIA na 7 základných foriem: systémová artritída; oligoartritída; polyartritída s negativitou reumatoidného faktora (RF); polyartritída s pozitivitou RF; artritída asociovaná s entezitídou; psoriatická artritída; nediferencovaná artritída [4]. V bežnej klinickej praxi je zaužívané jednoduchšie rozdelenie na 2 základné typy podľa počtu postihnutých kĺbov: oligoartikulárny typ (≤4 kĺby) a polyartikulárny typ (≥5 kĺbov). Toto rozdelenie zohľadňujú aj súčasné liečebné odporúčania, v ktorých metotrexát (MTX) dominuje ako liek prvej voľby pri polyartikulárnom priebehu alebo pri neúspechu liečby oligoartritídy intraartikulárnymi injekciami kortikoidov [5]. Pediatrickí pacienti a aj ich rodičia oceňujú spôsob jeho dávkovania, keď sa týždenná dávka užíva spolu, teda raz týždenne. Liečba MTX v dávke 10–15 mg/m2/týždeň je účinná približne u 70 % pacientov [6, 7, 8]. Zvyšovanie dávky nad 15 mg/m2/týždeň nevedie k zvýšeniu účinnosti lieku. Tejto skupine pacientov môže priniesť benefit zmena spôsobu podávania z perorálneho (p.o.) na parenterálny (s.c.) [8].
Liečba MTX u pacientov s JIA je vo všeobecnosti považovaná za nielen účinnú, ale aj dobre tolerovanú. Závažné nežiaduce účinky, napr. pneumonitída ako prejav precitlivenosti na MTX, sú raritné. Pri dodržaní dávkovania sú zriedkavé aj nežiaduce účinky spôsobené vplyvom MTX na rýchlo množiace sa bunky, ako sú precitlivenosť na slnečné žiarenie, vypadávanie vlasov, zníženie krvotvorby alebo zvýšenie sérovej koncentrácie pečeňových trans-amináz. Potenciálne nežiaduce účinky monitorujeme na základe platných publikovaných odporúčaní [5] v pravidelných intervaloch (tab. 1). Medzi najčastejšie nežiaduce účinky v bežnej ambulantnej praxi reumatológa patria u detí bolesti brucha, nevoľnosť, vracanie a afty v dutine ústnej. U niektorých pacientov pozorujeme spojenie týchto problémov s psychickými prejavmi (podráždenosť, plač) v priebehu 24 hodín po užití MTX. Označujeme ich ako „podávkové“ reakcie (post-dosing reaction). Na odstránenie alebo aspoň zmiernenie týchto prejavov sa používa viacero stratégií. Odporúča sa napríklad rozdelenie celkovej dávky MTX na dve dávky, podanie MTX tesne pred spaním, prechod na s.c. formu podávania, či vynechanie nesteroidových antiflogistík v deň užívania MTX. Vo väčšine prípadov však nie sú tieto opatrenia účinné [7]. Uvedené problémy vedú často k strachu dieťaťa z užívania MTX a ťažkosti sa začnú zjavovať ešte pred podaním lieku – anticipačné, alebo už pri pomyslení na liek – asociované. V konečnom dôsledku sú dôvodom pre ukončenie liečby, napriek jej dobrej účinnosti.
Table 1. Laboratórne parametre sledované počas liečby metotrexátom. 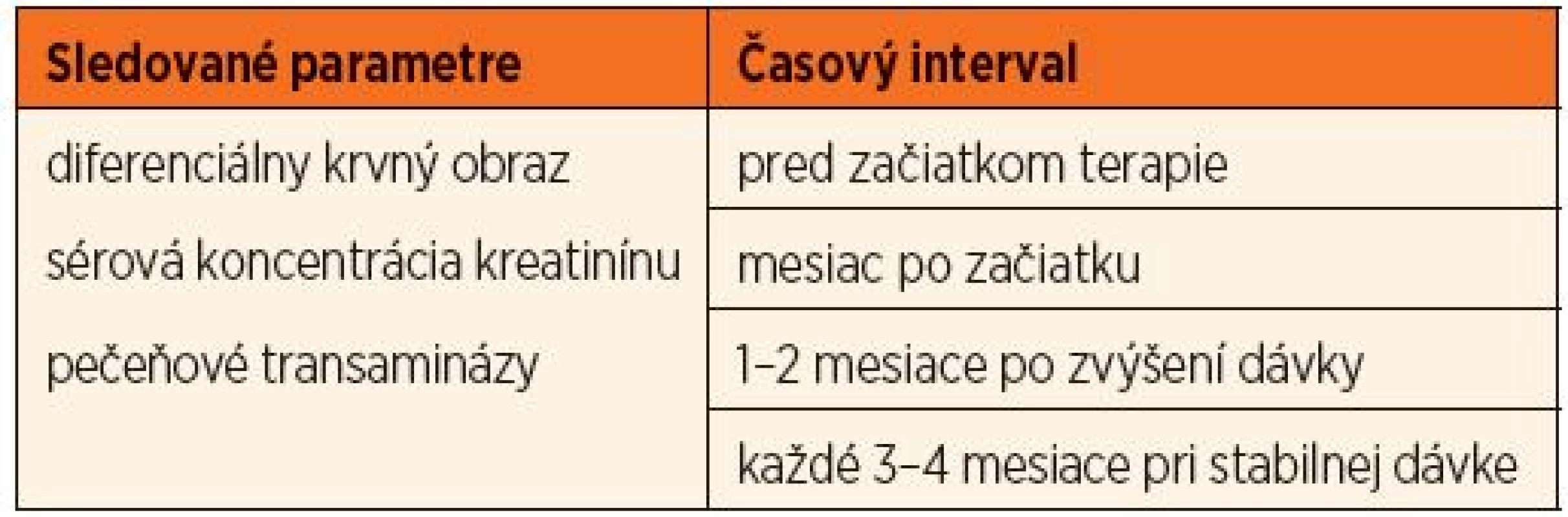
METÓDY
Cieľom našej práce je retrospektívne zhodnotiť výskyt gastrointestinálnych nežiaducich účinkov u pacientov s JIA užívajúcich MTX liečených v reumatologickej ambulancii Detskej fakultnej nemocnice Košice. Vstupné kritéria pre zaradenie pacientov do súboru boli nasledovné: diagnóza JIA stanovená na základe platných ILAR kritérií; liečba metotrexátom v minimálnej dĺžke 1 mesiac. Vzhľadom k charakteru štúdie (neintervenčná, retrospektívna analýza dát) etická komisia nevyžadovala informovaný súhlas pacienta.
V období od júla do decembra 2013 sme spracovali písomné záznamy v ambulantných kartách pacientov s diagnózou JIA z pravidelných kontrol, ktoré boli vykonávané po prvom, treťom, šiestom mesiaci liečby MTX a následne podľa individuálnych potrieb pacienta. Potenciálne nežiaduce účinky sme monitorovali i prostredníctvom laboratórnych parametrov v pravidelných časových intervaloch podľa platných odporúčaní (tab. 1).
Nežiaduce udalosti zo strany gastrointestinálneho traktu boli zaznamenávané pri každej kontrole pacienta prostredníctvom cielených otázok lekára o výskyte príznakov (tráviaci diskomfort, bolesti brucha, nausea, vracanie, afty) rodičovi aj pacientovi. Doplňujúce otázky o trvaní (do 24 hodín/viac ako 24 hodín) a intenzite (neobmedzuje/obmedzuje/zabraňuje vykonávaniu bežných denných aktivít) príznakov boli kladené následne po pozitívnej odpovedi na cielené otázky o výskyte. Pri ostatných menej častých nežiaducich udalostiach bol záznam vykonaný po otvorenej otázke na prípadné sťažnosti pacienta a následnej špecifikácii problému.
Nežiaduce gastrointestinálne účinky sme následne rozdelili v zhode so zaužívanou praxou hodnotenia na základe ich intenzity a trvania (ľahké, stredné, ťažké) a na základe pravdepodobnosti ich kauzálneho vzťahu (možné, pravdepodobné, potvrdené) k liečbe MTX (tab. 2).
Table 2. Rozdelenie nežiaducich účinkov metotrexátu. 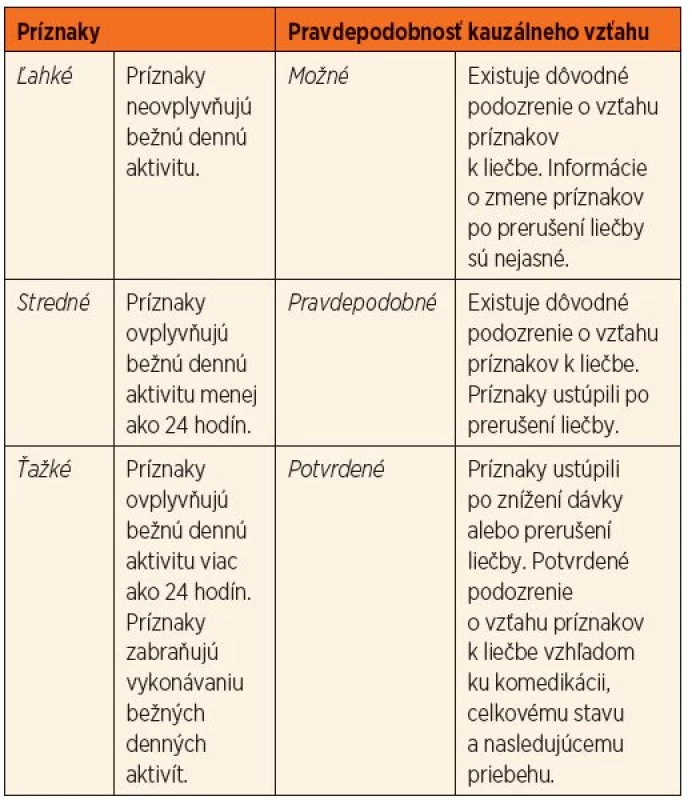
V štatistickej analýze boli podľa potreby využité nasledujúce testy: Studentov nepárový t-test, Studentov párový t-test, Chi-kvadrát test, Fisherov presný test.
VÝSLEDKY
Celkovo sme dohľadali 109 pacientov s diagnózou JIA, z ktorých 88 v priebehu choroby užívali MTX v monoterapii alebo v kombinácii s inými liekmi zo skupiny konvenčných alebo biologických DMARDs (chorobu modifikujúce antireumatické lieky). Základné demografické charakteristiky hodnoteného súboru zobrazuje tabuľka 3.
Table 3. Hlavné demografické charakteristiky hodnoteného súboru pacientov. 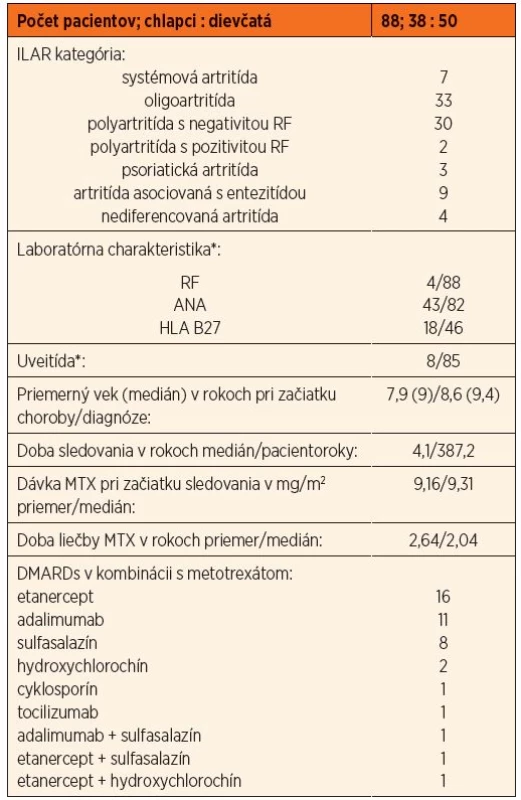
*pacienti s pozitívnym nálezom/vyšetrovaní pacienti; ILAR – The International League of Associations of Rheumatology, RF – reumatoidný faktor, ANA – antinukleárne protilátky, HLA B27 – human leukocyte antigen alela B27, MTX – metotrexát, DMARDs – chorobu modifikujúce antireumatické lieky V analyzovanom súbore 88 detí s JIA sa gastrointestinálne nežiaduce účinky zjavili celkom u 20 pacientov, t.j. 22,7 %. Súčasný výskyt viac ako jedného nežiaduceho účinku sme pozorovali len u jedného pacienta (diskomfort sprevádzaný prechodným zvýšením koncentrácií pečeňových transamináz a aftózna stomatitída). Na základe údajov získaných z dokumentácie nebolo možné definovať rozdiel medzi ťažkosťami udávanými rodičom a dieťaťom.
Podskupina detí s nežiaducimi účinkami bola v čase prvých príznakov JIA staršia ako podskupina detí bez výskytu nežiaducich účinkov (priemer: 9,7 vs. 7,3; medián: 9,9 vs. 8,1). Tento rozdiel je na hranici štatistickej signifikancie (p = 0,05). Následná analýza ale nepotvrdila štatisticky signifikantný rozdiel vo veku pacientov v čase stanovenia diagnózy (priemer: 10 vs. 8,2; p = 0,13), či vo veku v čase zavedenia MTX do liečby (priemer: 10,5 vs. 9,6; p = 0,49). Rovnako štatistická analýza neodhalila rozdiel medzi podskupinami s nežiaducimi účinkami a bez nich v trvaní choroby do zavedenia liečby MTX (priemer: 0,76 vs. 2,25; p = 0,06), pohlaví (chlapci : dievčatá 6 : 14 vs.32 : 34; p=0,18), aplikačnej forme MTX (p.o. : s.c. 18 : 2 vs. 63 : 5; p = 0,66), týždennej dávke MTX v čase jeho zaradenia do liečby (priemer: 9,04/m2 vs. 9,20/m2; p = 0,79), či v trvaní liečby (priemer: 3,1 vs. 2,5; p = 0,29). Rovnako rozdiel v dávke MTX u pacientov s výskytom nežiaducich účinkov na začiatku terapie a v čase manifestácie príznakov (priemer: 9,04/m2 vs. 8,90/m2; p = 0,81) nebol štatisticky významný.
Pri hodnotení intenzity príznakov sme konštatovali, že najčastejšími boli príznaky klasifikované ako ľahké (diskomfort) – v 10 prípadoch. U 2 pacientov boli sprevádzané prechodným zvýšením koncentrácií pečeňových transamináz. Osem detí udávalo gastrointestinálny diskomfort počas monoterapie MTX, 2 počas kombinovanej liečby s biologickými DMARDs. Stredne intenzívne gastrointestinálne nežiaduce príznaky komplikovali liečbu MTX celkom u 8 detí (3x vracanie, 2x nausea do 24 hodín po podaní, 2x „podávková“ reakcia, 1x aftózna stomatitída). V čase ich zjavenia sa 5 pacientov užívalo MTX v monoterapii a 3 v kombinácii s biologickými DMARDs. Nauseu trvajúcu viac ako 24 hodín po užití lieku sme hodnotili ako ťažký nežiaduci účinok a vyskytla sa u 3 pacientov počas monoterapie MTX. V prípade ľahkých príznakov nie je možné sa na základe záznamov vyjadriť k časovej súvislosti s užitím MTX. V prípade stredných a ťažkých príznakov je možné ich označiť za prejavy „toxicity“, nakoľko sa jednoznačne zjavovali až po užití MTX.
Pri analýze pravdepodobnosti kauzálneho vzťahu nežiaducich gastrointestinálnych prejavov k liečbe MTX sme 19-krát väzbu označili ako potvrdenú (na základe ústupu prejavov po znížení dávky alebo ukončení terapie). V dvoch prípadoch (diskomfort spojený s prechodným zvýšením koncentrácií pečeňových transamináz a aftózna stomatitída) sme väzbu označili za možnú vzhľadom k nasledujúcemu priebehu, komedikácii a celkovému stavu pacienta (graf 1).
Graph 1. Rozdelenie nežiaducich účinkov metotrexátu na základe intenzity a kauzality. 
Z časového hľadiska sa príznaky manifestovali počas prvých troch mesiacov liečby u 5 pacientov, do konca prvého roka liečby u ďalších 4 pacientov. Sedem pacientov malo prvú manifestáciu počas druhého roka liečby. V prípade pacienta s 2 nežiaducimi účinkami MTX sa diskomfort sprevádzaný prechodným zvýšením koncentrácií pečeňových transamináz manifestoval po 8 mesiacoch a dobre reagoval na zníženie dávky, zatiaľ čo aftózna stomatitída sa objavila až po 3 rokoch liečby. Ako dokumentuje graf 2, najčastejší bol výskyt v priebehu prvého roka liečby. Pozorované nežiaduce účinky viedli k definitívnemu ukončeniu liečby v 15 prípadoch. Dočasné prerušenie liečby bolo dostatočné v jednom prípade. V štyroch prípadoch prejavy ustúpili už pri znížení dávky a v jednom prípade po zmene aplikačnej formy.
Graph 2. Rozdelenie nežiaducich účinkov metotrexátu na základe času výskytu. 
DISKUSIA
Analýza získaných dát nepreukázala, okrem veku pacientov pri prvých príznakoch JIA, štatisticky signifikantný rozdiel medzi skupinami pacientov s a bez gastrointestinálnych nežiaducich účinkov liečby MTX.
Pri retrospektívnej forme získavania údajov zo zdravotných záznamov pacientov sú výsledky skreslené subjektívnym vnímaním pacienta a zručnosťou lekára pri komunikácii s dieťaťom a rodičom počas odoberania anamnézy pri vyšetrení, rovnako ako kvalitou vedenia dokumentácie. Najslabšou stránkou našej práce bolo, že sme nemali možnosť hodnotiť prítomnosť gastrointestinálnych nežiaducich účinkov jednotným hodnotiacim nástrojom. Napriek tomu, ako ukazuje graf 3, výskyt nausey v našom súbore je podobný ako v randomizovanej časti štúdie zameranej primárne na účinnosť MTX (19,3 % vs. 21 % pacientov) [8]. Výskyt vracania, nechutenstva či áft bol v porovnaní s uvedenou štúdiou v našom súbore nižší. Zodpovedne sa vyjadriť k rozdielom vo výskyte gastrointestinálnych nežiaducich účinkov je ale veľmi problematické. Rovnako je to pri porovnaní našich výsledkov s ďalšími publikovanými štúdiami [9, 10], ktoré sa napriek porovnateľnej veľkosti vzorky pacientov výrazne odlišujú od nášho súboru v zložení (zastúpenie jednotlivých ILAR kategórií) a podávanej dávke MTX (nízke vs. vysoké dávky). Hlavným problémom spomínaných štúdií, vrátane našej práce, ostáva absencia jednotného hodnotiaceho nástroja príznakov.
Graph 3. Porovnanie výskytu jednotlivých nežiaducich účinkov metotrexátu. 
Vytvoriť hodnotiaci nástroj pre hodnotenie gastrointestinálnych nežiaducich účinkov MTX zahŕňajúci aj anticipačné a asociované ťažkosti sa pokúsili holandskí autori v publikácii z roku 2011. Nimi vytvorený dotazník MISS (Methotrexate intolerance severity score) obsahuje v štyroch častiach (bolesti brucha, nevoľnosť, vracanie a zmeny správania) spolu 12 otázok. Odpovede na otázky sú hodnotené 0 až 3 bodmi, teda maximálny počet bodov je 36. Najvýhodnejší súčet senzitivity (88 %) a špecificity (80 %) pre hodnotenie intolerancie dosiahli pri použití hranice 6 bodov. Intoleranciu MTX definovali ako dosiahnutie minimálne 6 bodov, z čoho aspoň 1 bod je pri anticipačných alebo asociovaných prejavoch alebo zmenách správania. Do štúdie zaradili 297 pacientov s JIA, z ktorých trpelo intoleranciou MTX až 50,5 %! Takúto vysokú miera intolerancie autori odôvodňujú práve zaradením anticipačných a asociovaných príznakov, ako aj zmien správania do dotazníka. Potvrdzuje to aj vyšší výskyt intolerancie v skupine detí užívajúcich MTX parenterálne (67,5 %) oproti skupine detí užívajúcich MTX p.o. (44,5 %), a teda „strach z ihly“, ktorý sa prejavil vyšším bodovaním v časti o zmenách správania. V intenzite príznakov ale rozdiel medzi týmito dvoma skupinami nepozorovali [11]. Skúsenosti s dotazníkom MISS pre hodnotenie gastrointestinálnych nežiaducich účinkov MTX s porovnateľným výsledkom publikovali aj ďalší autori tak u detí s JIA [12, 13], ako aj u dospelých pacientov s reumatoidnou artritídou a psoriatickou artritídou [14].
Anglickí autori (Mulligan a spol.) v práci publikovanej v roku 2013 použili na hodnotenie gastrointestinálnych ťažkostí vlastný dotazník pre matky pacientov, zahŕňajúci aj anticipačné prejavy. Výskyt nausey, vracania alebo diskomfortu konštatovali u viac ako polovice pacientov zaradených do ich štúdie, pričom anticipačnou nauseou trpela podľa udania matiek až štvrtina detí. Výskyt strachu z injekcií, anticipačného diskomfortu a vracania po užití bol signifikantne vyšší u detí užívajúcich MTX formou s.c. injekcií [15].
Liečba MTX prináša pacientom s JIA nesporne benefity. Výskyt gastrointestinálnych nežiaducich účinkov a ich negatívny vplyv na kvalitu života dieťaťa je často dôvodom na prerušenie účinného liečebného postupu. V snahe pomôcť by prvým krokom malo byť odlíšenie skutočných nežiaducich účinkov lieku od psychicky podmienených prejavov. V prípade anticipačných prejavov by rozhodnutiu o ukončení liečby mala predchádzať pomoc psychológa či behaviorálna terapia. Zavedenie dotazníka MISS či iného štandardizovaného postupu pre hodnotenie gastrointestinálnych nežiaducich účinkov MTX pacientov s JIA do bežnej klinickej praxe, vnímame ako spôsob na zlepšenie komplexnej starostlivosti o túto skupinu chronicky chorých detí.
ZÁVERY
Metotrexát je liekom prvej voľby zo skupiny DMARDs u pacientov s JIA nielen pre svoju nízku cenu, ale hlavne pre svoju vysokú účinnosť a dobrý bezpečnostný profil. Závažné nežiaduce reakcie sú vzácne. Stále viac diskutovaným problémom je výskyt gastrointestinálnej intolerancie, ktorá vedie k nedodržiavaniu liečebného režimu, alebo odmietnutiu liečby u signifikantnej skupiny detských pacientov či ich rodičov. Presná prevalencia intolerancie nie je známa. Jedným z riešení problému je zavedenie používania štandardizovaného dotazníka pre hodnotenie gastrointestinálnej intolerancie v bežnej ambulantnej praxi. Správna interpretácia ťažkostí pomôže podchytiť problém včas a umožní použiť protiopatrenia ešte pred stratou dôvery medzi pacientom a lekárom.
Došlo: 22. 11. 2014
Přijato: 10. 4. 2015
MUDr. Pavol Mrážik
Klinika detí a dorastu LF UPJŠ a DFN
Trieda SNP 1
040 11 Košice
Slovenská republika
e-mail: pavol.mrazik@student.upjs.sk
Sources
1. Ravelli A, Martini A. Juvenile idiopathic arthritis. Lancet 2007; 9563 : 767–778.
2. Ambulantná starostlivosť o deti a dorast v SR 2012. Bratislava: Národné centrum zdravotníckych informácií, 2013 : 1–35.
3. Zdravotnícka ročenka Slovenskej republiky 2012. Bratislava: Národné centrum zdravotníckych informácií, 2014 : 1–256.
4. Petty RE, Southwood TR, Manners P, et al. International league of Associations for Rheumatology classification of juvenile idiopathic arthritis: 2nd revision, Edmonton: 2001. J Rheumatol 2004; 2 : 390–-392.
5. Beukelman T, Patkar NM, Saag KG, et al. American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features. Arthritis Care & Research 2011; 4 : 465–482.
6. Giannini EH, Brewer EJ, Kuzmina N, et al. Methotrexate in resistant juvenile rheumatoid arthritis. Results of the U.S.A. – U.S.S.R. double-blind, placebo-controlled trial. N Engl J Med 1992; 16 : 1043–1049.
7. Ravelli A, Martini A. Methotrexate in juvenile idiopathic arthritis: answers and questions. J Rheumatol 2000; 8 : 1830–1833.
8. Ruperto N, Murray KJ, Gerloni V, et al. A randomized trial of parenteral methotrexate comparing an intermediate dose with a higher dose in children with juvenile idiopathic arthritis who failed to respond to standard doses of methotrexate. Arthritis Rheum 2004; 7 : 2191–2201.
9. Giannini EH, Brewer EJ, Kuzmina N, et al. Methotrexate in resistant juvenile rheumatoid arthritis: results of the U.S.A. – U.S.S.R. double-blind, placebocontrolled trial. The Pediatric Rheumatology Collaborative Study Group and The Cooperative Children’s Study Group. N Engl J Med 1992; 326 : 1043–1049.
10. Woo P, Southwood TR, Prieur AM, et al. Randomized, placebo-controlled, crossover trial of low-dose oral methotrexate in children with extended oligoarticular or systemic arthritis. Arthritis Rheum 2000; 8 : 1849–1857.
11. Bulatović M, Heijstek MW, Verkaaik M, et al. High prevalence of methotrexate intolerance in juvenile idiopathic arthritis. Arthritis Rheum 2011; 7 : 2007–2013.
12. Babur S, Sadia A, Asif RB. Frequency of methotrexate intolerance in juvenile idiopathic arthritis (JIA): An experience using methotrexate intolerance severity score (MISS). Pak Armed Forces Med J 2013; 1. Dostupné na: http://pafmj.org/showdetails.php?id=657&t=o.
13. Van Dijkhuizen P, Pouw J, Scheuern A, et al. Intolerance in oral versus subcutaneous administration of methotrexate in patients with juvenile idiopathic arthritis: a cross-sectional, observational study. Pediatric Rheumatology 2014; 12 (Suppl 1): P131.
14. Bulatović Ćalasan M, van den Bosch OFC, Creemers MCW, et al. Prevalence of methotrexate intolerance in rheumatoid arthritis and psoriatic arthritis. Arthritis Research & Therapy 2013; 6: R217.
15. Mulligan K, Kassoumeri L, Etheridge A, et al. Mothers’ reports of the difficulties that their children experience in taking methotrexate for juvenile idiopathic arthritis and how these impact on quality of life. Pediatric Rheumatology 2013; 11 : 23.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 4-
All articles in this issue
- Screening sluchu novorozenců ve FN Brno
- Hyperbarická oxygenoterapie u pediatrických pacientů v Centru hyperbarické medicíny Ostrava v letech 2007–2011
- Matematické modelovanie infekčných ochorení detského veku
- Gastrointestinálne nežiaduce účinky metotrexátu v liečbe pacientov s juvenilnou idiopatickou artritídou – vieme ich správne hodnotiť?
- Vodní dýmka není bezpečnou alternativou klasických cigaret!
- Enzymová substituční terapie u lysosomálních onemocnění
- Možnosti zmierňovania detskej bolesti na psychosociálnej úrovni
- Specifika bolestivého chování u dětí s těžkým kombinovaným postižením
- Úskalia diagnostiky a liečby feochromocytómu u detí
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Enzymová substituční terapie u lysosomálních onemocnění
- Úskalia diagnostiky a liečby feochromocytómu u detí
- Gastrointestinálne nežiaduce účinky metotrexátu v liečbe pacientov s juvenilnou idiopatickou artritídou – vieme ich správne hodnotiť?
- Možnosti zmierňovania detskej bolesti na psychosociálnej úrovni
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

