-
Medical journals
- Career
Alveolární kapilární dysplazie s vychýlením plicních žil jako příčina hypoxeamického respiračního selhání donošeného novorozence
Authors: T. Matějek 1; A. Matějková 2; P. Solařová 3; Z. Kokštein 1; J. Malý 1
Authors‘ workplace: Dětská klinika LF UK a FN, Hradec Královépřednosta prof. MUDr. M. Bayer, CSc. 1; Fingerlandův ústav patologie LF UK a FN, Hradec Královépřednosta prof. MUDr. A. Ryška, Ph. D. 2; Oddělení lékařské genetiky FN, Hradec Královéprimářka MUDr. M. Šenkeříková 3
Published in: Čes-slov Pediat 2014; 69 (5): 295-300.
Category: Case Report
Overview
Alveolární kapilární dysplazie s vychýlením plicních žil (ACD/MPV) je velmi vzácná a fatální porucha plicního vývoje. Toto onemocnění se pojí s perzistující plicní hypertenzí (PPHN) refrakterní ke konvenční terapii, která vede k hypoxemickému respiračnímu selhání a k úmrtí pacienta. ACD/MPV se často sdružuje s mnohočetnými vrozenými vadami napříč orgánovými systémy, postižen bývá zejména gastrointestinální, kardiovaskulární a urogenitální systém.
Autoři prezentují případ donošeného novorozence, který zemřel ve stáří 21 hodin na respirační selhání při farmakorezistentní PPHN. U pacienta byly prokázány mnohočetné vrozené vývojové vady: hypoplazie levostranných srdečních oddílů, inkompletní AV kanál s dysplazií mitrální chlopně, arteria lusoria, zdvojená levá renální tepna, anomální rozdělení pravé plíce (2 laloky), mesenterium commune, pancreas annulare, hypoplazie žlučníku, hydronefróza s hydroureterem a hemivertebra Th10. Zlatým standardem v diagnostice ACD/MPV je histologické vyšetření plicní tkáně dětským patologem obeznámeným s touto jednotkou. Genetický podklad onemocnění představují změny na 16. chromozomu, které byly v prezentovaném případě způsobeny delecí 11 genů, včetně klíčových FOXF1, FOXC2 a FOXL1.
Klíčová slova:
alveolární kapilární dysplazie, farmakorezistentní perzistující plicní hypertenze, hypoxemické respirační selhání, novorozenec, FOXF1Úvod
Alveolární kapilární dysplazie s vychýlením plicních žil (ACD/MPV) je vzácná porucha vývoje plic řazená mezi dětské intersticiální plicní choroby (chILD), kam patří také neuroendokrinní buněčná hyperplazie, plicní intersticiální glykogenóza a poruchy tvorby surfaktantu [1]. Tato skupina onemocnění se vyznačuje obtížnou diagnostikou a vysokou mortalitou. ACD/MPV byla prvně popsána Janneyem v roce 1981 [2] jako perzistence fetální cirkulace s abnormálním vývojem plicní vaskularizace. Doposud bylo popsáno více než 200 případů [3], přičemž v 90 % se jedná o onemocnění se sporadickým výskytem. Ve zbývajících 10 % je doloženo postižení sourozenců [4]. Vlastní incidence a prevalence onemocnění není známá, ale jistě bude vyšší než počet popsaných případů. Naprostá většina postižených novorozenců se rodí v termínu, poněkud častěji bývají postiženi chlapci (60 %).Onemocnění se projeví záhy po narození respiračním selháním provázeným refrakterní plicní hypertenzí se 100% mortalitou.
Kazuistika
Autoři prezentují případ donošeného novorozence ženského pohlaví (3970 g/53 cm) z fyziologické gravidity po nekomplikovaném spontánním porodu v 39. gestačním týdnu. Po dobré bezprostřední adaptaci (Apgar skóre 9-9-10 bodů) došlo během dvou hodin k rozvoji hypoxemického respiračního selhání asociovaného s farmakorezistentní suprasystémovou plicní hypertenzí (PPHN). Vstupní rentgenový (RTG) snímek hrudníku byl kromě levostranného pláštového pneumothoraxu hodnocen jako normální. Echokardiografickým vyšetřením byly diagnostikovány vícečetné vrozené srdeční vady, které však tíži PPHN nevysvětlovaly (inkompletní AV kanál, hypoplazie levostranných srdečních oddílů, dysplazie mitrální chlopně). Přes agresivní terapii plicní hypertenze a progredujícího respiračního a oběhového selhání (HFOV, iNO, katecholaminy, milrinon, surfaktant) došlo mezi 6.–12. hodinou života k těžkému rozvratu vnitřního prostředí a následnému úmrtí ve stáří 21 hodin. Při pitvě byly odhaleny další vrozené vývojové vady napříč orgánovými systémy. Kromě již výše popsaných srdečních vad byly přítomny: anomální rozdělení pravé plíce (2 laloky), zdvojená levá renální tepna, arteria lusoria, mesenterium commune, pancreas annulare, hypoplazie žlučníku, hydronefróza s hydroureterem a hemivertebra Th10. Histologický nález v plicním parenchymu vykazoval rysy spadající do obrazu alveolární kapilární dysplazie s vychýlením plicních žil (obr. 1, tab. 1). Vzhledem k vysokému klinickému a histologickému podezření na ACD/MPV bylo ve spolupráci s Ústavem biologie a lékařské genetiky UK 2. LF a FN Motol provedeno cílené genetické vyšetření. Metodou FISH s lokus specifickou sondou pro oblast 16q24 (= oblast obsahující geny FOXF1, FOXC2 a FOXL1) byla zjištěna absence signálu na jednom z chromozomů 16, která odpovídá heterozygotní deleci. Následně byl metodou arrayCGH (comparative genomic hybridization) upřesněn rozsah delece – patologická oblast zasahovala 11 genů, včetně klíčových genů FOXF1, FOXC2 a FOXL1.
Image 1. Nekroptický vzorek plicní tkáně s charakteristickými změnami pro ACD/MPV: anomální uspořádání bronchovaskulárního svazku – vychýlené plicní žíly (v) probíhající společně s tepnou (a) a bronchiolem (b). Dále patrná výrazná venostáza, formování žilních prstenců kolem bronchiolů a široká alveolární septa s redukovaným počtem kapilár, v centru alveolárních sept lokalizovány ektatické cévní prostory (HE 100x). Ve výřezu vlevo dole vzorek normálně anatomicky uspořádané plicní tkáně s plicní žilou (v) probíhající odděleně od bronchovaskulárního svazku (arterie (a), bronchus (b)). (HE 40x) 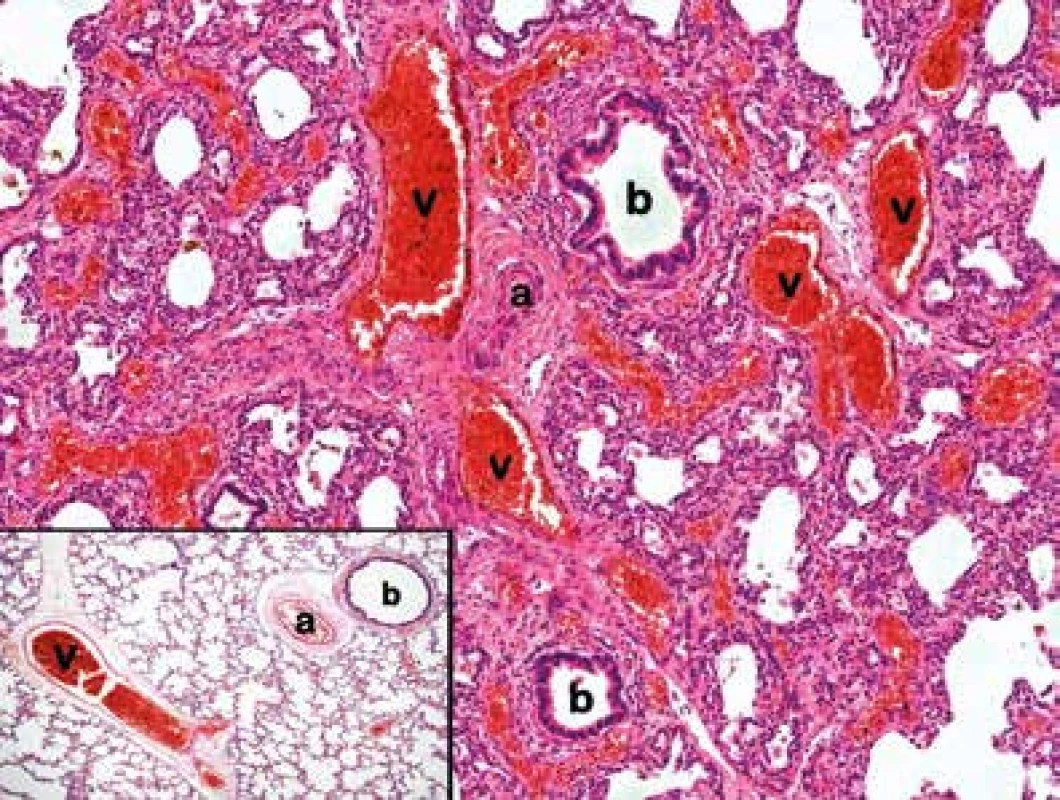
Table 1. ACD/MPV – histologický nález [4]. ![ACD/MPV – histologický nález [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a5885a66f235c039dbefe0da338596ea.png)
Diskuse
Patofyziologie ACD/MPV nebyla doposud zcela objasněna. Zdá se však, že spočívá v poruše vývoje alveolárních kapilár, jejichž počet je dramaticky snížen a navíc je narušen jejich kontakt s alveolárním epitelem. V důsledku toho se anomálně vyvíjí žilní část řečiště, kde se formují tzv. vychýlené žíly. V přívodných tepnách vznikají v důsledku obstrukce okluzivní změny, což následně po narození vede k rozvoji těžké plicní hypertenze [4].
V klinickém průběhu dominuje těžká hypoxémie, metabolická acidóza a pravostranné srdeční selhání při suprasystémové PPHN. Léčba PPHN i asociované hypotenze je neúčinná. Kardiotonika i veškeré v současnosti dostupné plicní vazodilatátory mají jen minimální a přechodný efekt. U více než 60 % novorozenců se onemocnění manifestuje v průběhu 24–48 hodin po narození a obvykle vede k úmrtí do konce prvního měsíce života [5]. U části novorozenců s ACD/MPV je v léčbě použita i extrakorporální membránová oxygenace (ECMO), která však ke zlepšení nevede. ACD/MPV bývá diagnostikována až u 30 % pacientů s idiopatickou PPHN nereagující na ECMO [4]. V současnosti není k dispozici žádné rutinní laboratorní či zobrazovací vyšetření, které by odlišilo ACD/MPV od ostatních příčin PPHN. Na RTG hrudníku u takto postižených novorozenců nacházíme jen minimální parenchymové změny plic, výjimkou není ani zcela normální nález. U fulminantně probíhajících forem (nástup onemocnění v řádu hodin) se setkáváme s pneumothoraxem, který jsme diagnostikovali i v našem případě; k úmrtí v těchto případech dochází obvykle během několika dnů [6, 7, 8].
Typickým nálezem u ACD/MPV je současný výskyt mimoplicních anomálií, které jsou přítomny až v 80 % případů [4–9]. Jedná se o změny napříč orgánovými soustavami, často mnohočetné (tab. 2; vrozené vady přítomné u našeho pacienta jsou zvýrazněny). Zejména kombinace nevysvětlitelného respiračního selhání s PPHN a strukturálních abnormalit urogenitálního, gastrointestinálního nebo kardiovaskulárního systému by měla vést k podezření na ACD/MPV.
Table 2. Extrapulmonální anomálie asociované s ACD/MPV [4] (vrozené vady přítomné u našeho pacienty jsou zvýrazněny). ![Extrapulmonální anomálie asociované s ACD/MPV [4] (vrozené vady přítomné u našeho pacienty jsou zvýrazněny).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/786b0ab5b755c6a34a06da4653d04f7e.png)
Zlatým standardem v diagnostice tohoto onemocnění je histologické vyšetření plicní tkáně patologem obeznámeným s touto jednotkou [4, 10, 11]. Nejnápadnějším histologickým nálezem u ACD/MPV bývá anomální uspořádání bronchovaskulárních svazků, ve kterých společně probíhají tepny, bronchy a vychýlené žíly. V normálně anatomicky uspořádaném plicním parenchymu naproti tomu probíhají plicní žíly mimo bronchovaskulární svazky tvořené tepnou a bronchem, a to odděleně v interlobulárních septech (obr. 1). Zásadním diagnostickým znakem je přítomnost výrazně redukovaného počtu alveolárních kapilár s narušeným efektivním kontaktem s alveolárním epitelem. Další histologické změny jsou uvedeny v tabulce 1. Strukturální změny plicního parenchymu nemusí být vždy ve stejné míře vyjádřeny v celé plíci, což může limitovat zejména bioptické vyšetření plicní tkáně, kdy je ještě za života vyšetřován jen drobný fragment tkáně. V naprosté většině dokumentovaných případů byla diagnóza stanovena až posmrtně [4]. Vzhledem k raritnosti onemocnění byly histologické nálezy konzultovány s Michaelem L. Bakerem, MD (Department of Pathology, Texas Children´s Hospital, Houston), který diagnózu jednoznačně potvrdil.
Etiologie ACD/MPV je dávána do souvislosti se změnami v genu FOXF1, který se nalézá na 16. chromozomu [4, 5, 12–14]. Gen FOXF1 hraje roli v regulaci pulmonálních genů. Mutace vede k tvorbě inaktivního proteinu FOXF1, který nemůže regulovat normální vývoj plicních cév. V souvislosti s mutací v genu FOXF1 je popisována i přítomnost gastrointestinálních abnormalit. U pacientů s ACD/MPV, u nichž byly zjištěny i další přidružené malformace – vrozená srdeční vada (zvláště hypoplazie levého srdce), atrézie gastrointestinálního traktu, malformace urogenitálního traktu a jiné vady, byla nalezena delece úseku 16q24.1, který zahrnuje kromě genu FOXF1 i geny FOXC2 a FOXL1 [5, 12–14]. Předpokládá se, že ACD/MPV je podmíněna haploinsuficiencí (tj. přítomností pouze jedné funkční alely) genu FOXF1. Haploinsuficience sousedících genů FOXC2 a FOXL1 se podílí na přítomnosti přidružených anomálií. V prezentovaném případě byla zjištěná delece 11 genů příčinou dysplazie alveolárních kapilár i přidružených malformací. Většina případů ACD/MPV podmíněných mutací genu FOXF1 se vyskytuje sporadicky, asi v 10 % byl prezentován familiární výskyt [5, 12–14]. U obou rodičů zemřelého dítěte bylo následně provedeno cílené vyšetření oblasti 16q24 metodou FISH, přičemž nebyla zjištěna delece vyšetřovaného úseku. Na základě výsledků provedených vyšetření předpokládáme, že se u dítěte jednalo o sporadickou formu ACD/MPV (de novo vzniklou mutaci). Studie publikovaná r. 2009 prokázala bodové mutace nebo delece zahrnující FOXF1 gen ve 40 % sledovaných případů [12]. Recentní práce autorů Sena P. et al. uvádí, že mutace či delece genu FOXF1 je možné odhalit až v 70 % případů ACD/MPV. Z uvedeného vyplývá, že haploinsuficience genu FOXF1 je zásadní příčinou ACD/MPV a hraje důležitou roli ve vývoji plic i jiných orgánů [5].
V diferenciálně diagnostické rozvaze je třeba odlišit:
- Septické stavy, pneumonie a jiné infekční etiologie.
- Kardiopulmonální vady spojené s těžkou cyanózou a/nebo plicní hypertenzí (např. totální anomální plicní návrat, stenóza plicních žil). Je třeba myslet na to, že u více než 25 % případů ACD/MPV jsou současně přítomny významné srdeční vady.
- Idiopatickou PPHN, která se od ACD/MPV liší zejména svojí reverzibilitou při použití běžně dostupné léčby (dechová podpora, plicní vazodilatátory).
- Primárně plicní poruchy včetně poruch v produkci surfaktantu (deficit proteinového surfaktantu B, abnormality transportéru) [15] a plicní hypoplazie či vrozená brániční kýla, která by však měla být poměrně snadno odlišitelná.
Závěr
Alveolární kapilární dysplazie s vychýlením plicních žil je velmi vzácné a 100% letální onemocnění patřící do skupiny dětských plicních intersticiálních chorob. Na tuto jednotku je nutné pomýšlet zejména u novorozenců, kde se kombinuje farmakorezistentní plicní hypertenze a mnohočetné vrozené vývojové vady. Základem při diagnostice je vysoké klinické podezření a zlatým standardem pak histologické vyšetření plicní tkáně erudovaným patologem. V ČR lze nově využít i cílené genetické vyšetření; podle posledních studií byla mutace či delece genu FOXF1 prokázána až u 70 % pacientů s ACD/MPV.
Poděkování:
Poděkování za spolupráci patří doktoru M. L. Bakerovi z Dept. of Pathology, Texas Children´s Hospital, Houston, dále profesoru P. Senovi z Dept. of Pediatrics, Baylor College of Medicine, Houston, a kolegům z Ústavu biologie a lékařské genetiky UK 2. LF a FN Motol, Praha.
Podpořeno programem PRVOUK P37/12.
Došlo: 29. 8. 2013
Přijato: 13. 6. 2014
Korespondující autor
MUDr. Jan Malý, Ph.D.
Dětská klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: malyj@lfhk.cuni.cz
Sources
1. Popler J, Lesnick B, Dishop KM, et al. New coding in the International Classification of Diseases, Ninth Revision for Children’s Interstitial Lung Disease. Chest 2012; 142 (3): 774–780.
2. Janney CG, Askin FB, Kuhn G. Congenital alveolar capillary dysplasia – an unusual cause of respiratory distress in the newborn. Am J Clin Pathol 1981; 76 : 722–727.
3. Sen P, Choudhury T, Smith EO, et al. Expression of angiogenic and vasculogenic proteins in the lung in alveolar capillary dysplasia/misalignment of pulmonary veins: an immunohistochemical study. Pediatr Dev Pathol 2010; 13 : 354–361.
4. Bishop NB, Stankiewicz P, Steinhorn RH. Alveolar capillary dysplasia. Am J Respir Crit Care Med 2011; 184 : 172–179.
5. Sen P, Yang Y, Navarro C, et al. Novel FOXF1 mutations in sporadic and familial cases of alveolar capillary dysplasia with misaligned pulmonary veins imply a role for its DNA binding domain. Hum Mutat 2013; 34 (6): 801–811.
6. Roth W, Bucsenez D, Blaker H. Misalignment of pulmonary vessels with alveolar capillary dysplasia: association with atrioventricular septal defect and quadricuspid pulmonary valve. Wirchow Arch 2006; 448 : 375–378.
7. Shimizu T, Fukuda T, Inomata S, et al. A novel association of alveolar capillary dysplasia, atypical duodenal atresia and subglottic stenosis. J Anesth 2011; 25 : 298–300.
8. Usui N, Kamiyama M, Kamata S, et al. A novel association of alveolar capillary dysplasia and duodenal atresia with paradoxical dilatation of the duodenum. J Pediatr Surg 2004; 39 : 1808–1811.
9. Sen P, Thakur N, Stockton DW, et al. Expanding the phenotype of alveolar capillary dysplasia (ACD). J Pediatr 2004; 145 : 646–651.
10. Antao B, Samuel M, Kiely E, et al. Congenital alveolar capillary dysplasia and associated gastrointestinal anomalies. Fetal Pediatr Pathol 2006; 25 : 137–145.
11. Gilbert-Barness E, Kapur RP, Oligny LL, et al. Potter’s Pathology of the Fetus, Infant and Child. 2nd ed. Mosby Elsevier, 2007 : 1121–1123.
12. Stankiewicz P, Sen P, Bhatt SS, et al. Genomic and genic deletions of the FOX gene cluster on 16q24.1 andinactivating mutations of FOXF1 cause alveolar capillary dysplasia and other malformations. Am J Hum Genet 2009; 84 : 780–791.
13. Yu S, Shao L, Kilbride H, et al. Haploinsufficiency of FOXF1 and FOXC2 genes associated with lethal alveolar capillary dysplasia and congenital heart disease. Am J Med Genet 2010; 152A: 1257–1262.
14. Sen P, Gerychova R, Janků P, et al. A familial case of alveolar capillary dysplasia with misalignment of pulmonary veins supports paternal imprinting of FOXF1 in human. Eur J Hum Genet 2013; 21 (4): 474–477.
15. Navrátilová M, Hornychová H, Kokštein Z, Malý J. Kongenitální deficit surfaktantu v důsledku mutace v genu pro ABCA3 jako příčina fatálního respiračního selhání. Čes-slov Pediat 2013; 68 (3): 173–178.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2014 Issue 5-
All articles in this issue
- Využitie zobrazovacích metód pri diagnostike intestinálnych malrotácií
- Betablokátory v léčbě hemangiomů dětského věku
- Význam klasického cytogenetického vyšetření v pediatrické praxi: zhodnocení 384 indikací
- Závažné spontánní intrakraniální krvácení u 11měsíčního chlapce s vrozenou afibrinogenémií
- Alveolární kapilární dysplazie s vychýlením plicních žil jako příčina hypoxeamického respiračního selhání donošeného novorozence
- Úloha hepcidinu v regulaci metabolismu železa
- Etické problémy péče o rizikové novorozence
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Betablokátory v léčbě hemangiomů dětského věku
- Etické problémy péče o rizikové novorozence
- Úloha hepcidinu v regulaci metabolismu železa
- Význam klasického cytogenetického vyšetření v pediatrické praxi: zhodnocení 384 indikací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

