-
Medical journals
- Career
Autoimunitní onemocnění jater v dětském věku – část II
Authors: P. Dědek
Authors‘ workplace: Dětská klinika Fakultní nemocnice, Hradec Králové, přednosta prof. MUDr. M. Bayer, CSc.
Published in: Čes-slov Pediat 2011; 66 (1): 26-33.
Category: Review
Overview
Autoimunitní onemocnění jater představují skupinu chronických zánětlivých postižení jater se závažnou prognózou. Mezi nejčastější autoimunitní onemocnění jater v dětském věku patří autoimunitní hepatitida, autoimunitní sklerózující cholangitida a primární sklerózující cholangitida. Klinický obraz jaterního postižení je necharakteristický. Onemocnění může probíhat i asymptomaticky. U samotných nemocných nebo v přímém příbuzenstvu často diagnostikujeme další nemoci s imunopatologickou patogenezí. V laboratorním vyšetření prokazujeme přítomnost různých typů autoprotilátek, hypergamaglobulinémii a zvýšenou hodnotu IgG. Nezastupitelnou úlohu plní v diagnostice jaterní biopsie a zobrazovací vyšetření velkých žlučových cest.
Včasná a správná diagnóza následovaná bezprostředním zahájením terapie významným způsobem ovlivňuje prognózu pacientů. Prokázána je účinnost terapie samotnými kortikoidy nebo kombinované terapie kortikoidy s azathioprinem. Úloha kyseliny ursodeoxycholové není dosud uzavřena. U významné části pacientů, především u nemocných se sklerózující cholangitidou, však onemocnění progreduje do obrazu chronického jaterního selhání vyžadujícím transplantaci jater.Klíčová slova:
autoimunitní onemocnění jater, autoimunitní hepatitida, primární sklerózující cholangitida, autoimunitní sklerózující cholangitida, primární biliární cirhóza, překryvný syndromDokončení z č. 12/2010
2. PRIMÁRNÍ SKLERÓZUJÍCÍ CHOLANGITIDA
Charakteristika
Primární sklerózující cholangitida (PSC) je progresivní cholestatické onemocnění jater a žlučových cest, podmíněné zánětlivě-fibrotickým postižením intra - a/nebo extrahepatálních žlučových cest, které vede k jejich zúžení, dilataci či obliteraci. Chronická cholestáza je u většiny nemocných sledována rozvojem biliární cirhózy a chronického jaterního selhání. Konzervativní léčba je z hlediska ovlivnění přirozeného vývoje onemocnění neúčinná a jediným řešením prodlužujícím život nemocných je jaterní transplantace. Dalším charakteristickým rysem je přítomnost nespecifického střevního zánětu (NSZ) u více než poloviny nemocných.
Incidence a prevalence dětských pacientů s PSC není přesně známa. Recentní práce uvádějí výskyt 0,23 případů/100 000 paciento-roků, což je asi 5krát méně než u dospělých [1]. Zvyšující se počet diagnostikovaných případů u dětí v poslední době je pravděpodobně spojen s narůstajícími znalostmi o tomto onemocnění a s častější indikací k neinvazivnímu vyšetření žlučových cest magnetickou rezonancí [2, 3, 4].
Poznámky k terminologii
Terminologie sklerózující cholangitidy v dětském věku není zcela jednotná a přehledná. Nejčastěji je citována klasifikace autorů z londýnského pracovistě King´s College Hospital [5]. U dětí je sklerózující cholangitida asociována s některými chorobami, jako jsou histiocytóza z Langerhansových buněk, primární či sekundární imunodeficity (hyper-IgM syndrom 1 – deficit ligandy CD40), psoriáza, cystická fibróza, trauma, tumor, portální biliopatie, hemolyticko-uremický syndrom či srpkovitá anémie. Hovoříme o tzv. „asociované či sekundární sklerózující cholangitidě“. Sklerózující cholangitida může být diagnostikována v novorozeneckém a kojeneckém věku buď jako samostatná jednotka („neonatální sklerózující cholangitida“), nebo jako součást některých syndromů (např. syndrom neonatální ichtyózy, alopecie a sklerózující cholangitidy). V nedávné době byly publikovány soubory pacientů s takzvanou „IgG4-asociovanou cholangitidou“ probíhající společně s autoimunitní pankreatitidou [6]. Vzácně se tato nozologická jednotka diagnostikuje i v dětském věku [7].
O primární sklerózující cholangitidě, u které je biliární systém postižen primárně na podkladě předpokládaného imunopatologického procesu, hovoříme až po vyloučení výše uvedených onemocnění. Primární sklerózující cholangitida v dětském věku je na rozdíl od dospělých často provázena klinickými, laboratorními a histologickými nálezy charakteristickými pro autoimunitní hepatitidu. Jedná se o překryvný syndrom AIH/PSC či takzvanou autoimunitní sklerózující cholangitidu (ASC). Termín autoimunitní sklerózující cholangitida byl poprvé uveden ve světovém písemnictví právě u dětí [8]. Je obtížné se vyjádřit ke vztahu mezi autoimunitní a primární sklerózující cholangitidou. Autoimunitní sklerózující cholangitida může být samostatnou klinickou jednotkou, může se jednat o kombinaci dvou nemocí (PSC a AIH), nebo představuje PSC s více vyjádřenými laboratorními a histologickými známkami zánětlivé aktivity. Bez ohledu na etiopatogenetické souvislosti obě formy představují v praxi dětského hepatologa téměř všechny nemocné se sklerózující cholangitidou.
Klinický obraz
Klinický obraz je necharakteristický. Průměrný věk v době stanovení diagnózy je 13–14 let (rozmezí 1,5–18 roků). Na rozdíl od autoimunitní hepatitidy převažují u PSC chlapci v poměru 2 : 1, v případě ASC je poměr pohlaví vyrovnán [2, 9].
Onemocnění se manifestuje nespecifickými potížemi, jako jsou bolesti břicha (40 %), únava (25 %), pruritus (15 %) a nechutenství (10 %). U významné skupiny pacientů je v popředí klinického obrazu kolitický syndrom (průjem 28 %) a jaterní léze je diagnostikována druhotně v rámci vyšetřovacího plánu nespecifických střevních zánětů. Asi u třetiny pacientů probíhá onemocnění asymptomaticky a je pak odhaleno náhodně nebo v průběhu pravidelných kontrol dětí s NSZ. Asymptomatický průběh nevylučuje již pokročilé jaterní onemocnění. Vzácně je klinický obraz nerozeznatelný od obrazu akutní hepatitidy s ikterem jako hlavním příznakem (10–20 %). Tato akutní iniciální symptomatologie je častější u dětí s překryvným syndromem AIH-PSC.
Primární sklerózující cholangitida je provázena výskytem nespecifického střevního zánětu u 50–80 % pacientů [2, 9]. V 90 % případů se jedná o ulcerózní kolitidu s postižením celého tlustého střeva (pankolitidu), často s relativním šetřením rekta. Za zbylou část je zodpovědná Crohnova choroba tlustého střeva či blíže neurčená (indeterminovaná) kolitida. Diagnóza NSZ předchází, nebo je střevní onemocnění diagnostikováno současně s jaterním onemocněním u 85 % dětí, méně frekventní je rozvoj NSZ až v průběhu sledování jaterního onemocnění (15 %). V sestavách pacientů s nespecifickými střevními záněty se primární či autoimunitní sklerózující cholangitida diagnostikuje u 3–4 % pacientů s ulcerózní kolitidou a 0,6 % nemocných s Crohnovou kolitidou [10]. Klinický průběh jaterního onemocnění je na střevním postižení nezávislý. K rozvoji primární sklerózující cholangitidy může dojít i po proktokolektomii. Jsou také popsány případy s významným zhoršením klinického průběhu ulcerózní kolitidy po transplantaci jater [9]. Jelikož přítomnost NSZ je možná i u asymptomatických pacientů, doporučuje se provedení koloskopie s etážovým odběrem bioptických vzorků u všech dětí s prokázanou autoimunitní či primární sklerózující cholangitidou. Ve srovnání s autoimunitní hepatitidou je výskyt dalších imunopatologických onemocnění u dětí s PSC méně frekventní (v 15–20 %). Mezi nejčastější asociovaná onemocnění patří např. autoimunitní tyreoiditida, diabetes mellitus, celiakální sprue, systémová onemocnění pojiva či urticaria pigmentosa [2, 8, 9].
Při fyzikálním vyšetření zjišťujeme hepatomegalii (14 až 56 %), splenomegalii (19–52 %), ikterus (17–56 %), horečku (13–17 %), úbytek na hmotnosti (17–19 %) či projevy pokročilé jaterní léze, jako jsou pavoučkové névy (18 %) či ascites (7 %) [2, 8, 9]. Objektivní nález může být také normální.
Laboratorní vyšetření
V laboratorním vyšetření pravidelně prokazujeme známky cholestázy. Nejpřínosnějším screeningovým vyšetřením je hodnota GGT, která je zvýšena u více než 95 % dětí (ALP jen asi u 50 %) [10, 11]. Aktivita aminotransferáz je zvýšená v 95 % případů, většinou se jedná o středně zvýšené hodnoty (3–5krát nad horní hranici normy). Hodnota bilirubinu je u více než 80 % případů normální. S vyššími hodnotami aminotransferáz a bilirubinu se častěji setkáváme u autoimunitní formy SC [8, 9]. Trombocytopenie a leukopenie, popisovaná až u 30–40 % případů, již svědčí pro pokročilé jaterní onemocnění s portální hypertenzí [2].
Existuje všeobecně známá asociace mezi primární či autoimunitní sklerózující cholangitidou a protilátkami proti cytoplazmě neutrofilů (ANCA), které se vyskytují až u 80–90 % nemocných. Někdy jsou označovány jako atypické pANCA pro odlišné imunofluorescenční obrazy dané různou fixací neutrofilů, nebo nověji jako periferní anti-nukleární neutrofilní protilátky (pANNA – peripheral anti-nuclear neutrophil antibody), jelikož pravděpodobně reagují s jadernými membránovými antigeny [12]. Ve vztahu k diagnóze PSC či ASC je však specificita protilátek nízká, protože frekvence výskytu je srovnatelná s autoimunitní hepatitidou 1. typu či ulcerózní kolitidou.
U významné části pacientů jsou v laboratorním vyšetření přítomné změny charakteristické pro autoimunitní hepatitidu, jako je hypergamaglobulinémie (34 %) a přítomnost dalších autoprotilátek (antinukleární protilátky – 43 %, protilátky proti hladkému svalu – 28 %, výjimečně protilátky proti mikrozomálním antigenům jater a ledvin).
Histologický nález jaterní tkáně
Histologický nález je charakterizován chronickým destruujícím zánětem drobných interlobulárních a septálních žlučovodů s intrahepatální cholestázou a fibrózou. Patognomonický nález, tzv. koncentrická periduktální fibróza („onion-skin“), je nalézán vzácně (v 10–25 %) [9] (obr. 10). Většinou jsou zachyceny nespecifické zánětlivé změny portálního pole obstrukčního rázu s postižením žlučovodů a fibrózou (obr. 11). Podle některých literárních zdrojů je pokročilá fibróza přítomna v době diagnózy až u poloviny nemocných [9, 11]. Až u 35 % dětí je při biopsii jater nalézán obraz periportální („interface“) hepatitidy [2] (obr. 12). Absence postižení žlučovodů při histologickém vyšetření nevylučuje změny při cholangiografickém vyšetření. Nesouhlas mezi bioptickými nálezy a morfologickým vyšetřením žlučového stromu, který vídáme až u třetiny pacientů, je pravděpodobně způsoben nehomogenitou postižení žlučových cest [8].
Image 1. Obraz periportální fibrózy biliárního typu s přítomností charakteristické koncentrické periduktální fibrózy („onion-skin“) u 11leté dívky s primární sklerózující cholangitidou. Fig. 10. A picture of periportal fibrosis of biliary type with presence of characteristic concentric periductal fibrosis („onion-skin“) in an 11-year old girl with primary sclerosing cholangitis. 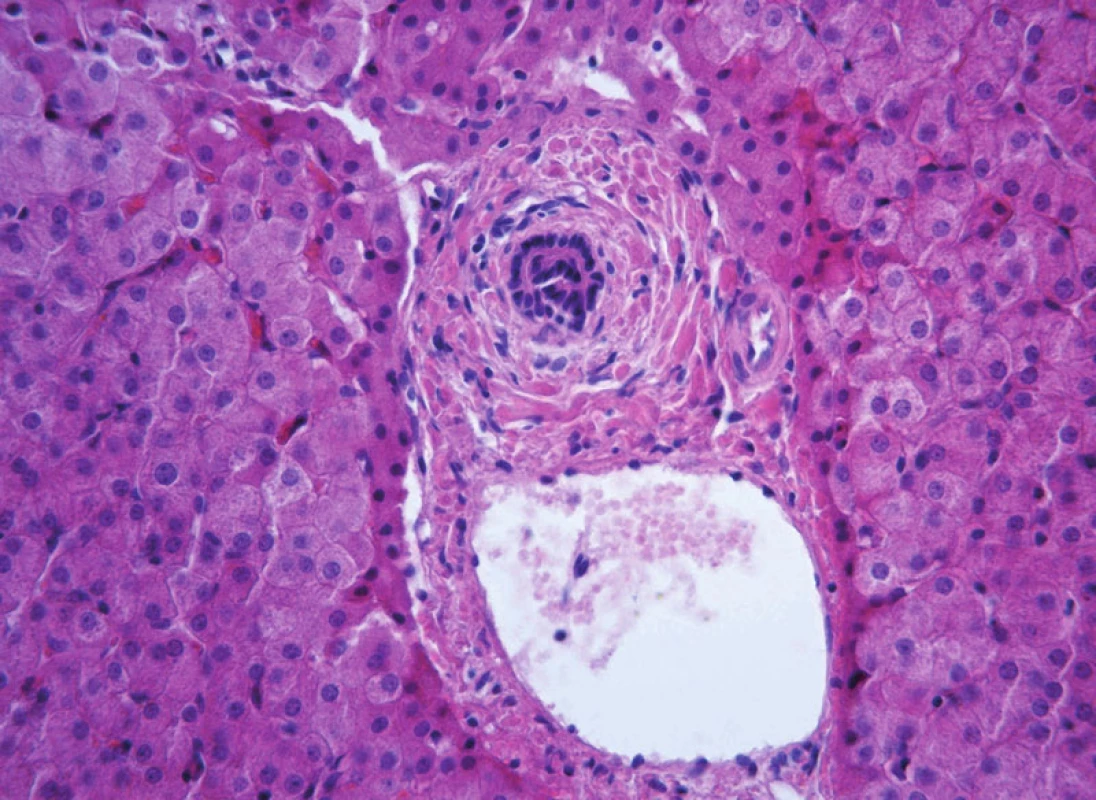
Image 2. Obraz subakutní biliární obstrukce v podobě periportální fibrózy s výrazným edémem a zvýšenou smíšeně zánětlivou celulizací v oblasti portálních polí a typickou duktulární proliferací (ozn. hvězdičkami) u 12letého chlapce s primární sklerózující cholangitidou. Fig. 11. A picture of subacute biliary obstruction in the form of periportal fibrosis with expressive oedema and increased mixed inflammatory infiltration in portal tracts and typical ductular proliferation (marked with asterisks) in 12-year old boy with primary sclerosing cholangitis. 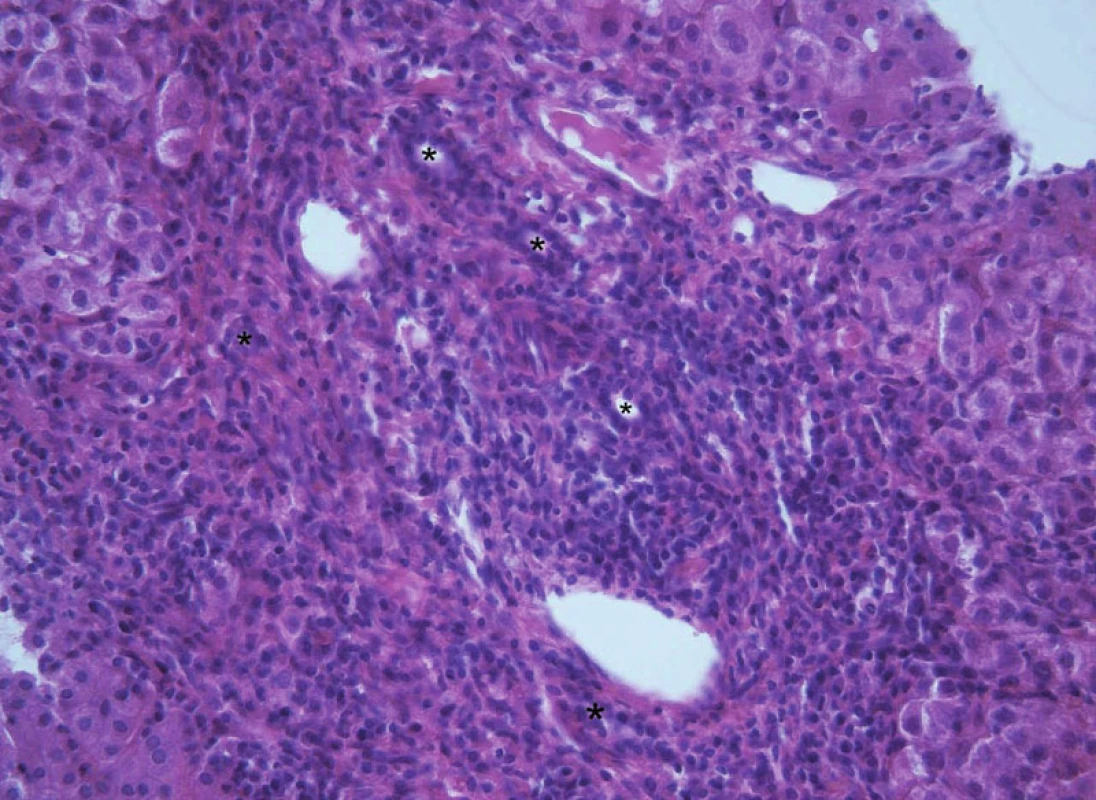
Image 3. Obraz těžké chronické aktivní hepatitidy s výraznou interface aktivitou zánětu a navíc s duktulární proliferací u 15leté dívky s překryvným syndromem AIH-PSC. Fig. 12. A picture of severe chronic active hepatitis with expressive interface activity and in addition with ductular proliferation in 15-year old girl with overlap syndrome AIH-PSC. 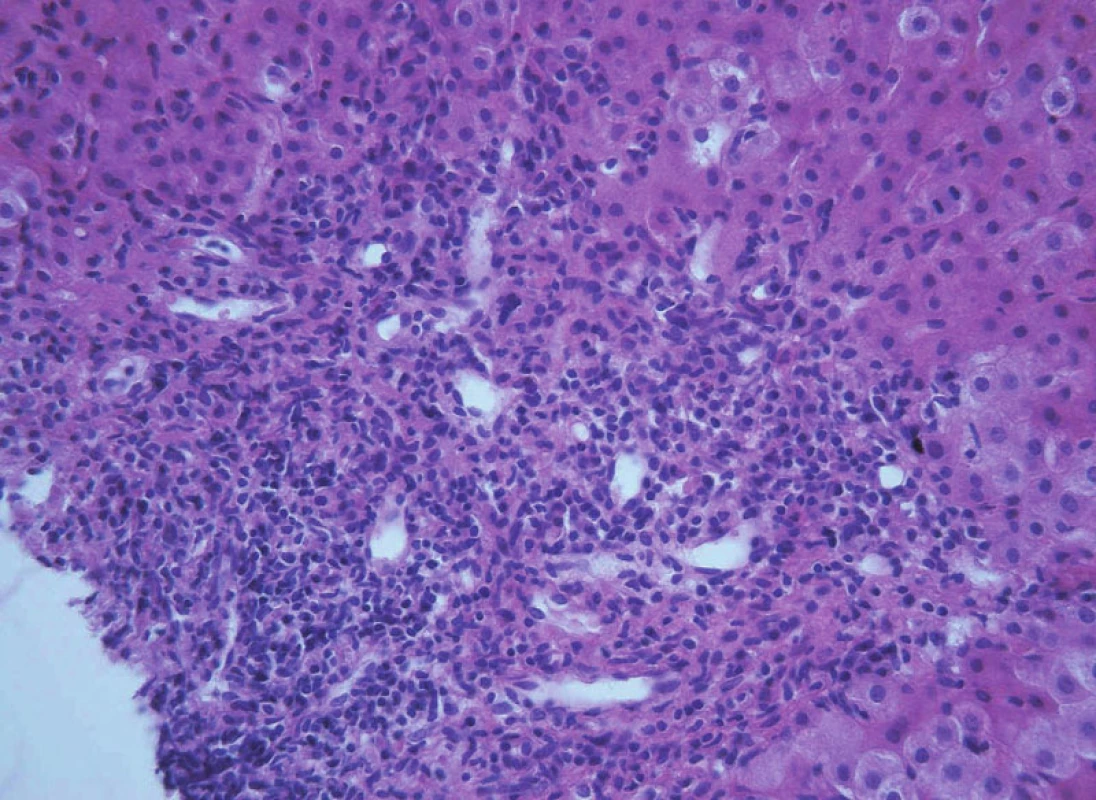
Diagnostika
Podezření na primární sklerózující cholangitidu máme u každého dítěte s klinicko-laboratorním obrazem cholestázy nejasné etiologie. Pravděpodobnost onemocnění zvyšuje přítomnost nespecifického střevního zánětu. Rozhodující diagnostickou metodou je zobrazovací vyšetření velkých žlučových cest. Sonografické vyšetření žlučových cest je málo senzitivní, a proto nedostatečné. Suverénní metodou je endoskopická retrográdní cholangiopankreatografie (ERCP) prokazující významné nerovnosti s kolísáním kalibru žlučovodů, kde stenotické úseky se střídají s dilatacemi. Toto vyšetření je však invazivní, spojené s radiační zátěží, a u dětí je k jeho provedení obvykle nezbytná celková anestezie. V současné době je proto tato metoda nahrazována magnetickou rezonancí žlučových cest (MR cholangiografie) [13] (obr. 13). Ve srovnání s ERCP má vyšetření mangetickou rezonancí 80–90% senzitivitu (horší zobrazení žlučovodů 3. a 4. řádu) a 90–100% specificitu. Endoskopickou retrográdní cholangiografii indikujeme vzhledem k dostatečné senzitivitě a specificitě MR cholangiografie prakticky jen v případě předpokládaného terapeutického výkonu. V době stanovení diagnózy jsou u dětí popisovány změny buď intrahepatálně (14–42 %), nebo se jedná o pokročilejší kombinované postižení intra - a extrahepatálních žlučovodů (40–70 %), izolované extrahepatální léze jsou vzácné (2–10 %) [2, 9].
Image 4. MRCP s obrazem multisegmentárního postižení obou hepatiků ve smyslu mírných dilatací a zúžených segmentů u 15leté dívky s překryvným syndromem AIH-PSC. Morfologický korelát jaterní tkáně u téže pacientky ukazuje obrázek 12. Fig. 13. MRCP with a picture of multisegmental involvement of both ductus hepaticus with mild dilatations and stenotic segments in 15-year old girl with overlap syndrome AIH-PSC. Histological picture of liver tissue in the same patient is shown in Fig. 12. 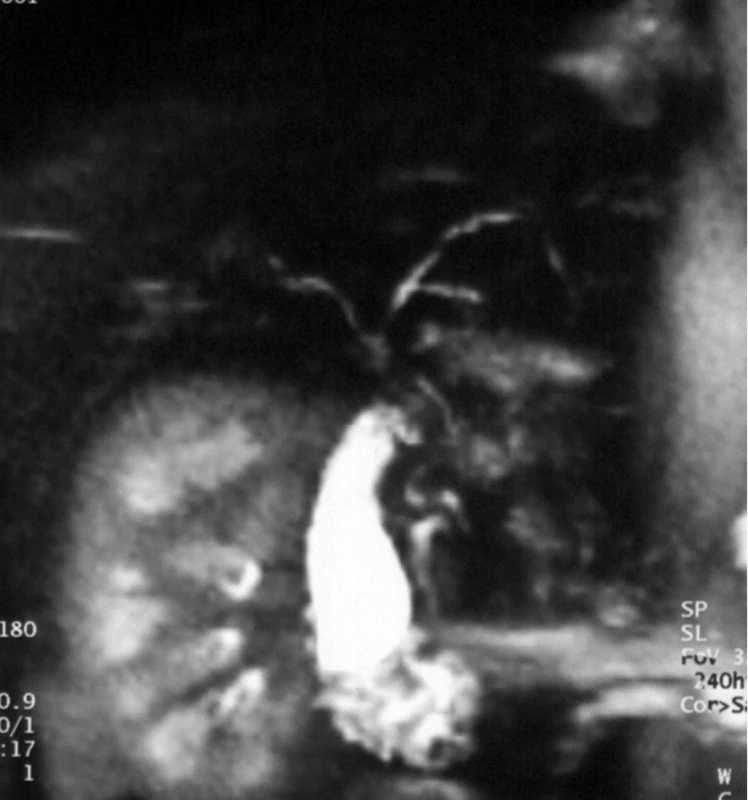
Diagnózu sklerózující cholangitidy podporuje histologický nález jaterní tkáně. Patognomonický nález koncentrické periduktální fibrózy je však vzácný. Výsadou biopsie jater je zhodnocení přítomnosti interface hepatitidy, pokročilosti fibrózy a diagnostika takzvané primární sklerózující cholangitidy malých žlučovodů („small-duct“ PSC). PSC malých žlučovodů je charakterizována klinickými a laboratorními známkami cholestázy, histologickým nálezem kompatibilním se sklerózující cholangitidou a normálním morfologickým vyšetřením velkých žlučových cest. V dosud největším publikovaném souboru 47 dětí se PSC malých žlučovodů diagnostikovala ve 36 % případů [9]. Na rozdíl od dospělých nebyla prokázána progrese PSC malých žlučovodů do klasického obrazu s postižením velkých žlučovodů.
Jak již bylo konstatováno, současná přítomnost PSC a laboratorních a histologických známek charakteristických pro autoimunitní hepatitidu (hypergamaglobulinémie, přítomnost autoprotilátek – ANA, SMA, histologický obraz interface hepatitidy) definuje překryvný syndrom AIH/PSC či autoimunitní sklerózující cholangitidu. Podle literárních odkazů se na celkovém počtu dětí s PSC (včetně PSC malých žlučovodů) podílí překryvný syndrom AIH/PSC asi 50 % (25–70 %) [2, 8, 9]. U dospělých je frekvence PSC s autoimunitními rysy nápadně nižší (7 až 11 %). V domácím písemnictví referují o primární i autoimunitní sklerózující cholangitidě v dětském věku Smolka et al. [14, 15].
Léčba
Překryvný syndrom AIH/PSC léčíme podle stejných zásad jako autoimunitní hepatitidu, tzn. nejčastěji kortikoidy v kombinaci s azathioprinem (viz část I). Terapii doplňujeme o léčbu kyselinou ursodeoxycholovou (UDCA) v dávce 15–20 mg/kg/den. V léčbě PSC vystačíme s monoterapií UDCA. I když je léčba UDCA provázena zlepšením či normalizací klinických a laboratorních známek cholestázy, o jejím vlivu na přirozený průběh onemocnění a prodloužení doby do transplantace jater se pochybuje [9]. Jako nadějná se jevila léčba vysokými dávkami UDCA (28–30 mg/kg/den), výsledky studií u dospělých jsou však rozporuplné [16]. Vzhledem k tomu, že není otázka terapie UDCA dosud uzavřena a není možné vyloučit její příznivý vliv u méně pokročilých forem onemocnění, léčbu UDCA u dětí s PSC či ASC indikujeme vždy. Další indikací k terapii UDCA je chemoprevence cholangiogenního a kolorektálního karcinomu [17].
Nezbytnou součástí péče o pacienta je léčba dalších projevů či komplikací onemocnění, k nimž patří pruritus, rozvoj dominantních striktur, bakteriální cholangitida, pankreatitida či nutriční deficit. K problematice dominantních striktur, které se vyskytují v dětském věku vzácně, přistupujeme stejně jako u dospělých (endoskopická biliární dilatace, zavedení biliárního stentu, resekce, event. transplantace jater).
Z etiopatogenetického hlediska je zajímavá a ojedinělá publikace s tříměsíční léčbou vankomycinem u 14 dětských pacientů s PSC a nespecifickým střevním zánětem s úpravou laboratorních ukazatelů cholestázy u všech dětí a s regresí histologického nálezu u 3 rebioptovaných dětí [18].
Prognóza
Prognóza primární i autoimunitní sklerózující cholangitidy je ve srovnání s autoimunitní hepatitidou horší. V průběhu čtyřletého sledování dochází asi u poloviny pacientů k progresi nálezu na žlučových cestách, u zbylé části je postižení stacionární, k regresi nedochází [8]. Oproti kontrolní zdravé populaci je v několikaletém horizontu statisticky významně kratší doba přežívání (interval od diagnostiky do úmrtí nebo do transplantace jater) [2]. Prognóza ASC a PSC se podle literárních odkazů zásadně neliší [2, 9]. Podobně jako u dospělých má lepší prognózu PSC malých žlučovodů, ale také tato diagnóza nevylučuje progresi do jaterního selhání. Mezi nepříznivé prognostické ukazatele u dětí v době diagnostiky patří vyšší věk, trombocytopenie, zvýšená hodnota bilirubinu a prodloužená hodnota INR [2, 11]. V dospělosti je onemocnění provázeno zvýšeným rizikem rozvoje cholangiogenního karcinomu a u nemocných s NSZ vznikem kolorektálního karcinomu, což dlouhodobou prognózu významně zhoršuje. U dětí tyto komplikace nebyly popsány, a proto se jejich aktivní screening nedoporučuje.
Ve skupině 52 dětí s PSC a ASC je mediánová doba do transplantace jater 12,7 let [2]. V jiném souboru 47 dětí (včetně dvou ze 16 dětí s PSC malých žlučovodů) byla transplantace jater indikována v 19 % případů po průměrné době sledování 7 let (4–19 roků) [9]. Primární a autoimunitní sklerózující cholangitida se na celkovém počtu transplantací jater v dětském věku podílí 3,5 % [10].
Riziko rekurence onemocnění po jaterní transplantaci se pohybuje v intervalu 10–27 % [2, 9]. Výsledky po transplantaci jater jsou však v současnosti velmi dobré, recentní publikace udávají desetileté přežití v 89 % [9].
Poznámky k diferenciální diagnostice AIH, AIH-PSC a PSC
Klinický obraz, laboratorní vyšetření a histologický nález jaterní tkáně AIH a ASC spolehlivě nerozliší. Použití skórovacího systému pro autoimunitní hepatitidu také selhává [19]. Je vždy indikováno zobrazovací vyšetření žlučových cest. Pokud se toto vyšetření neprovede, jak dříve bývala běžná praxe vzhledem k invazivitě ERCP vyšetření, nemocní jsou sledováni pod diagnózou autoimunitní hepatitidy a teprve přetrvávající cholestatický obraz nebo progrese onemocnění vede ke stanovení správné diagnózy. Představa o vývoji autoimunitní hepatitidy do sklerózující cholangitidy je až na výjimky chybná. V tomto ohledu je unikátní práce autorů Gregoria et al., ve které bylo u 52 dětí s autoimunitním onemocněním jater provedeno ERCP vyšetření již v době úvodní diagnostiky [8]. V této publikaci byl vývoj autoimunitní hepatitidy do sklerózující cholangitidy popsán pouze v jednom případě, dosud byl podobný průběh pozorován u dalších dvou pacientů.
Obtížná diferenciální diagnostika mezi ASC a PSC souvisí s absencí všeobecně akceptovaných diagnostických kritérií překryvného syndromu, i když v porovnání s dalšími překryvnými syndromy v hepatologii je jeho existence nejméně sporná. Tato skutečnost vysvětluje rozdílnou frekvenci výskytu AIH-PSC v souborech dětí s PSC. Většinou je definice překryvného syndromu AIH-PSC založena na histologickém průkazu interface hepatitidy u pacienta s prokázanou primární sklerózující cholangitidou. Přítomnost autoprotilátek není podmínkou překryvného syndromu AIH-PSC, ani vylučujícím kritériem PSC. Existují tedy nemocní s ASC a absencí autoprotilátek a naopak může být PSC provázena výskytem antinukleárních protilátek či protilátek proti hladkému svalu. V diagnostice se nabízí skórovací systém pro autoimunitní hepatitidu, ale ten diferencuje obě skupiny pacientů jen částečně. Někdy je správné zařazení umožněno až v delším časovém horizontu, kdy zhodnotíme efekt imunosupresivní léčby či monoterapie UDCA. Vycházíme z předpokladu, že u překryvného syndromu s monoterapií UDCA nevystačíme, ale je nezbytná léčba imunosupresivy. Přítomnost autoprotilátek efekt monoterapie UDCA na laboratorní ukazatele jaterního onemocnění nevylučuje. V praxi postupujeme tak, že u nezařazených dětí zahajujeme léčbu UDCA a v případě přetrvávání zvýšených hodnot aminotransferáz přistupujeme k imunosupresivní léčbě. Je nutno poznamenat, že diferenciální diagnostiku někdy „ztěžuje“ zahájení imunosupresivní terapie pro zvýšenou aktivitu nespecifického střevního zánětu, i když pro obvykle mírnější průběh pankolitidy u pacientů s PSC vystačíme většinou s monoterapií mesalazinem.
3. PRIMÁRNÍ BILIÁRNÍ CIRHÓZA
Primární biliární cirhóza (PBC) je chronické jaterní onemocnění s cholestatickými rysy. Nejčastěji se onemocnění manifestuje svěděním kůže a ikterem u žen středního věku. Mezi PBC a přítomností antimitochondriálních protilátek (AMA) je těsná korelace. U nemocných s PBC lze prokázat pozitivitu AMA v 90–95 % [20]. Bylo prokázáno, že AMA jsou podobně jako antinukleární protilátky a protilátky proti hladkému svalu heterogenní skupinou protilátek. Rozeznává se celkem 9 typů (anti-M1 až anti-M9). Pouze část z nich je prokazatelná imunofluorescenční technikou, k průkazu ostatních je nutno využít ELISA techniky či metody imunoblotu. Pro autoimunitní onemocnění jater je specifický M2 antigen. Diagnóza PBC se opírá o histologické vyšetření. Morfologický nález, v jehož popředí je převaha destrukce žlučovodů nad destrukcí hepatocytů, je proměnlivý podle pokročilosti onemocnění (stadium I–IV) [21]. Z léků se nejvíce osvědčila UDCA v dávce 15 mg/kg/den. Léčba je především účinná v časných fázích vývoje onemocnění. Výskyt primární biliární cirhózy je v dětském věku raritní. Sami jsme diagnostikovali klasický obraz PBC pouze u jedné osmnáctileté dívky.
Ve vztahu k AIH hovoříme o dvou obtížně definovaných variantách: překryvný syndrom AIH/PBC a autoimunitní cholangitida.
Překryvný syndrom AIH/PBC je definován přítomností charakteristických známek obou nemocí [22, 23]. Pro PBC svědčí přítomnost pruritu, pozitivita AMA a/nebo anti-M2, vyšší hodnota IgM, významné zvýšení aktivity GGT nebo ALP a histologický obraz s nálezem floridních lézí žlučovodů. Pro AIH svědčí vysoké hodnoty aminotransferáz, IgG, pozitivita ANA a/nebo SMA a morfologický obraz interface hepatitidy. V literatuře jsou nejčastěji citována diagnostická kritéria autorů Chazouilleres et al. (tab. 3). Samotná terapie s kyselinou ursodeoxycholovou či kortikoidy je účinná jen částečně. Naopak kombinovaná imunosupresivní léčba s UDCA je provázena normalizací klinického stavu a laboratorních výsledků podobně jako při léčbě AIH. V současné době je pohlíženo na překryvný syndrom jako na formu PBC s více vyjádřenou zánětlivou komponentou danou genetickou predispozicí. Podle vlastních zkušeností se s takto definovaným autoimunitním onemocněním jater setkáváme i u dětí.
Table 1. Diagnostická kritéria překryvného syndromu AIH/PBC. (AIH – autoimunitní hepatitida, PBC – primární biliární cirhóza) 
nejméně 2 ze 3 kritérií PBC a AIH by měla být splněna [Chazouilleres et al, Hepatology 1998; 28: 296–301] Autoimunitní cholangitida (autoimunitní cholangiopatie, imunocholangitida) je chronické cholestatické onemocnění, které se projevuje v klinickém a histologickém obraze jako PBC [24]. Jsou však negativní AMA, včetně protilátek proti M2 antigenu (AMA-negativní PBC). Cholangiografický obraz je normální. Někteří autoři uvádějí u autoimunitní cholangitidy nižší hodnoty IgM a aktivitu AST. Imunologické vyšetření prokazuje přítomnost autoprotilátek ANA a/nebo SMA obvykle o vysokém titru. Ve světovém písemnictví se také objevují termíny jako překryvný syndrom autoimunitní cholangitida – autoimunitní hepatitida [25]. Je nutno poznamenat, že diagnostická kritéria autoimunitní cholangitidy neexistují a že mezinárodní komise expertů při přípravě nomenklatury chronických hepatitid pojem autoimunitní cholangitida zavrhla [26]. Na onemocnění pohlížíme jako na obtížně klasifikovatelný cholestatický stav mající možný vztah k AIH, AMA negativní PBC, PSC malých žlučovodů či také idiopatické duktopenii. Dokud nebude objasněna etiopatogeneze těchto nemocí, nelze očekávat jednoznačnou odpověď. Léčba je individuální a odpovídá převládajícímu typu postižení. Vzácně se s takto popsanými případy setkáváme i v dětském věku.
4. AUTOIMUNITNÍ HEPATITIDA S NEGATIVNÍMI AUTOPROTILÁTKAMI
Všeobecně dostupné je vyšetření těchto autoprotilátek – ANA, SMA, LKM1 a AMA. V praxi to znamená, že je možno rutinně diagnostikovat AIH 1. a 2. typu. Asi 13 až 20 % dospělých pacientů s klinickými, laboratorními a histologickými rysy AIH však tyto klasické autoprotilátky nemá prokazatelné [27]. V tomto smyslu se hovoří o kryptogenní hepatitidě s autoimunitními rysy či o autoimunitní hepatitidě s negativními autoprotilátkami („autoantibody-negative“ AIH, séronegativní AIH). Jelikož titr protilátek v průběhu onemocnění kolísá, je možné identifikovat autoprotilátky později. Vychází se z představy, že v akutním stadiu onemocnění mohou být všechny protilátky vysycené antigenem a tak nezjistitelné. U části nemocných, u kterých se opakovaně nedaří zachytit klasické autoprotilátky, je možné prokázat jiné typy autoprotilátek (anti-SLA/LP, anti-ASGPR, anti-LC1). Diagnóza AIH je v případě negativity klasických autoprotilátek oprávněná tehdy, jsou-li splněna další kritéria AIH a pokud není podrobným vyšetřením prokázána jiná příčina onemocnění. V diagnostice se nabízí skórovací systém AIH. Sami jsme séronegativní AIH s obvyklou odpovědí na imunosupresivní léčbu nediagnostikovali, vždy jsme prokázali přítomnost klasických autoprotilátek.
ZÁVĚR
Autoimunitní onemocnění jater u dětí představují skupinu prognosticky závažných onemocnění. Včasná a správná diagnóza sledovaná bezprostředním zahájením terapie významným způsobem ovlivňuje další osudy pacientů. Je nutno zdůraznit heterogenní povahu onemocnění projevující se v klinickém obraze, v laboratorním a histologickém vyšetření jaterní tkáně i v odpovědi na léčbu.
Z pohledu pediatra je důležitý fakt, že onemocnění v dětském věku často probíhají agresivněji ve srovnání s dospělými. Každé nové poznatky v oblasti etiopatogeneze, diagnostiky i terapie mají v péči o dětské pacienty velký význam.
Poděkování
Autor vyslovuje poděkování za laskavé poskytnutí obrazové dokumentace MUDr. M. Podholovi, Ph.D., z Fingerlandova ústavu patologie FN v Hradci Králové. Za popisky k histologickým obrázkům jaterní tkáně děkuje MUDr. J. Nožičkovi, Ph.D.
Došlo: 31. 10. 2010
Přijato: 25. 11. 2010
MUDr. Petr Dědek, Ph.D.
Dětská klinika
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
e-mail: dedek@fnhk.cz
Sources
1. Kaplan GG, Laupland KB, Butzner D, et al. The burden of large and small duct primary sclerosing cholangitis in adults and children: a population-based analysis. Am J Gastroenterol 2007; 102 : 1042–1049.
2. Feldstein AE, Perrault J, El-Youssif, et al. Primary sclerosing cholangitis in children: a long-term follow-up study. Hepatology 2003; 38 : 210–217.
3. Kerkar N, Miloh T. Sclerosing cholangitis: pediatric perspective. Curr Gastroenterol Rep 2010; 12 : 195–202.
4. Mieli-Vergani G, Vergani D. Unique features of primary sclerosing cholangitis in children. Curr Opin Gastroenterol 2010; 26 : 265–268.
5. Mieli-Vergani G, Vergani D. Sclerosing cholangitis in the paediatric patient. Best Pract Res Clin Gastroenterol 2001; 15 : 681–690.
6. Mendes FD, Jorgensen R, Keach J, et al. Elevated serum IgG4 concentration in patients with primary sclerosing cholangitis. Am J Gastroenterol 2006; 101 : 2070–2005.
7. Miglani RK, Murthy D, Bhat R, et al. Immunoglobulin G4-associated cholangitis mimicking cholangiocarcinoma in a young boy. J Postgrad Med 2010; 56 : 140–142.
8. Gregorio GV, Portmann B, Karani J, et al. Autoimmune hepatitis/sclerosing cholangitis overlap syndrome in childhood: a 16-year prospective study. Hepatology 2001; 33 : 544–553.
9. Miloh T, Arnon R, Shneider B, et al. A retrospective single-center review of primary sclerosing cholangitis in children. Clin Gastroenterol Hepatol 2009; 7 : 239–245.
10. Alvarez F. Autoimmune hepatitis and primary sclerosing cholangitis. Clin Liver Dis 2006; 10 : 89–107.
11. Wilschanski M, Chait P, Wade JA, et al. Primary sclerosing cholangitis in 32 children: clinical, laboratory, and radiographic features, with survival analysis. Hepatology 1995; 22 : 1415–1422.
12. Vergani D, Alvarez F, Bianchi FB, et al. Liver autoimmune serology: a consensus statement from the committee for autoimmune serology of the International Autoimmune Hepatitis Group. J Hepatol 2004; 41 : 677–683.
13. Tipnis NA, Dua KS, Werlin SL. A retrospective assessment of magnetic resonance cholangiopancreatography in children. J Pediatr Gastroenterol Nutr 2008; 46 : 59–64.
14. Smolka V, Kolek A, Procházka V, et al. Primární sklerózující cholangitida u dětí a mladistvých. Čes-slov Pediat 2000; 9 : 552–557.
15. Smolka V, Konečný M, Ehrmann J, et al. Společné autoimunní fenomény primární sklerozující cholangitidy a autoimunní hepatitidy v dětském věku. Čes slov Gastroent a Hepatol 2003; 57 : 61–66.
16. Lindor KD, Kowdley KV, Luketic VA, et al. High-dose ursodeoxycholic acid for the treatment of primary sclerosing cholangitis. Hepatology 2009; 50 : 808–814.
17. Kitiyakara T, Chapman RW. Chemoprevention and screening in primary sclerosing cholangitis. Postgrad Med J 2008; 84 : 228–237.
18. Davies YK, Cox KM, Abdullah BA, et al. Long-term treatment of primary sclerosing cholangitis in children with oral vancomycin: an immunomodulating antibiotic. J Pediatr Gastroenterol Nutr 2008; 47 : 61–67.
19. Vergani D, Mieli-Vergani G. Autoimmune hepatitis and PSC connection. Clin Liver Dis 2008; 12 : 187–202.
20. Invernizzi P, Crosignani A, Battezzati PM, et al. Comparison of the clinical features and clinical course of antimitochondrial antibody -positive and -negative primary biliary cirrhosis. Hepatology 1997; 25 : 1090–1095.
21. Nožička Z. Patologicko-anatomický příspěvek k protilátkové diagnostice imunopatologických onemocnění. Suppl. Sbor věd Prací LF UK Hradec Králové 1991; 33(1).
22. Chazouilleres O, Wendum D, Serfaty L, et al. Primary biliary cirrhosis-autoimmune hepatitis overlap syndrome: clinical features and response to therapy. Hepatology 1998; 28 : 296–301.
23. Lohse AW, Meyer zum Büschenfelde K-H, Franz B, et al. Characterization of the overlap syndrome of primary biliary cirrhosis (PBC) and autoimmune hepatitis: evidence for it being a hepatitic form of PBC in genetically susceptible individuals. Hepatology 1999; 29 : 1078–1084.
24. Czaja AJ, Carpenter HA, Santrach PJ, et al. Autoimmune cholangitis within the spectrum of autoimmune liver disease. Hepatology 2000; 31 : 1231–1238.
25. Rust C, Beuers U. Overlap syndromes among autoimmune liver diseases. World J Gastroenterol 2008; 14 : 3368–3373.
26. Horák J, Vaňásek T. Autoimunitní postižení jater. In: Ehrmann J, Hůlek P. Hepatologie. 1. vyd. Praha: Grada, 2010.
27. McFarlane IG. The relationship between autoimmune markers and different clinical syndromes in autoimmune hepatitis. Gut 1998; 4 : 599–602.
Labels
Neonatology Paediatrics Pneumology and ftiseology General practitioner for children and adolescents General practitioner for adults
Article was published inCzech-Slovak Pediatrics

2011 Issue 1-
All articles in this issue
- Očkování proti pneumokokům u dětí v ČR v letech 2010–2011
- Screening nutričního stavu při přijetí dětského pacienta k hospitalizaci
- Prof. MUDr. Jan Janda, CSc. – sedmdesátiletý, stále mladý
- Výsledky pětileté činnosti dětské obezitologické ambulance Dětské polikliniky FN Motol a UK 2. LF, Praha
- Chuť první cigarety: ovlivňuje vývoj kuřáckého chování?
- Poruchy kŕmenia v detskom veku
- Autoimunitní onemocnění jater v dětském věku – část II
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poruchy kŕmenia v detskom veku
- Autoimunitní onemocnění jater v dětském věku – část II
- Chuť první cigarety: ovlivňuje vývoj kuřáckého chování?
- Prof. MUDr. Jan Janda, CSc. – sedmdesátiletý, stále mladý
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

