-
Medical journals
- Career
Rychle progredující komplikace chřipky typu A u dětí
: J. Kobr 1; K. Pizingerová 1; L. Šašek 1; J. Fremuth 1; P. Honomichl 1; R. Vondráková 2; J. Kudová 3; T. Bergerová 3; J. Racek 4
: Dětská klinika, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň přednosta doc. MUDr. J. Kobr, PhD. 1; Klinika zobrazovacích metod, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň přednosta doc. MUDr. B. Kreuzberg, CSc. 2; Ústav mikrobiologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň vedoucí RNDr. K. Fajfrlík, PhD. 3; Ústav klinické biochemie a hematologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň vedoucí prof. MUDr. J. Racek, DrSc. 4
: Čes-slov Pediat 2010; 65 (6): 386-393.
: Original Papers
Úvod:
Cílem studie byla aktivní prevence následků a zkrácení celkové doby hospitalizace zvýšením účinnosti léčby plicních komplikací chřipky typu A u dětí.Typ a místo studie:
Klinická, prospektivní studie, Dětská klinika – JIRP, Fakultní nemocnice v Plzni.Materiál a metodika:
Zařazovacím kritériem bylo akutní poškození plic (ALI) a probíhající infekce chřipkou typu A, vyřazeny byly děti bez průkazu této infekce. Do studie bylo od října do prosince 2009 zařazeno 9 dětí, průměrného věku 6,2 roku (rozmezí 0,3–15 let). Protiinfekční léčba kombinovala antibiotikum s antivirotikem.Výsledky:
Izolace viru chřipky A i detekce RNA v tracheálním aspirátu prokázaly probíhající infekci u 9 pacientů, u 6 dětí podtypem Pandemic A (H1N1) 2009. Sekundární bakteriální infekce byla zjištěna u 8 dětí (89 %). Akutnímu poškození plic odpovídala hodnota Lung Injury Score souboru (LIS; 1,9 ± 0,76 bodů). Predicted Risk Index Score of Mortality (PRISM; 14,7 ± 8,67 bodů) předpovídalo 12% mortalitu souboru. Chronickým rizikem bylo zatíženo 6 dětí, vakcinovány proti chřipce typu A nebyly. Umělá plicní ventilace 5 dětí trvala průměrně 11,2 ± 3,29 dnů, neinvazivní ventilace 3 dětí 1,9 ± 0,85 dne. Empyém hrudníku měly 4 a pneumotorax 3 děti. Hrudní drenáž trvala průměrně 7,8 ± 5,56 dnů. Analýzou dat byla potvrzena souvislost absence vakcinace (r = 0,989; p <0,001), bakteriální superinfekce (r = 0,543; p <0,01) a chronického rizika (r = 0,425; p <0,05) s akutním poškozením plic. Všech devět dětí souboru se klinicky uzdravilo s minimálním plicním reziduálním nálezem. Průměrná délka hospitalizace souboru byla 17,33 ± 3,27 dnů.Závěry:
Absence vakcinace, bakteriální infekce a chronické riziko byly faktory rozvoje závažných plicních komplikací v průběhu chřipky typu A u dětí. Účinnou prevencí trvalých následků bylo časné zahájení komplexní léčby.Klíčová slova:
chřipka typu A, akutní poškození plic, bakteriální infekce, empyém hrudníku, chronické riziko, vakcinaceÚvod
Virové pneumonie mají tzv. atypický průběh s minimálním poslechovým nálezem na hrudníku pacienta a rozsáhlým nálezem intersticiální plicní infiltrace na přehledném RTG snímku hrudníku. Imunologicky kompetentní pacient se uzdraví bez komplikací během několika dní. Naopak virové pneumonie u dětí z rizikových skupin nebo s oslabenou imunitou mají téměř pravidelně komplikovaný průběh. Sekundární infekce invazivními bakteriálními kmeny rizika zvyšuje [1]. Závažné funkční i strukturální poškození plic ve smyslu Acute Lung Injury (ALI), případně Acute Respiratory Distress Syndrome (ARDS) vede k akutní respirační nedostatečnosti nebo selhání a ve všech případech vyžaduje léčbu na specializovaných jednotkách [2].
Primárním cílem klinické studie byla aktivní prevence trvalých následků onemocnění, sekundárním cílem bylo zkrácení celkové doby hospitalizace časným zahájením účinné léčby. V aktuální epidemiologické situaci předkládáme odborné veřejnosti prvé výsledky studie.
Materiál a metodika
V souladu s platnými právními předpisy a etickými pravidly probíhá od října 2009 na Dětské klinice – JIRP, Lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Plzni klinická, prospektivní studie [3].
Do studie byly zařazeny děti s akutním poškozením plic (ALI) a prokázanou infekcí virem chřipky typu A. Pacienti s ALI bez jasného průkazu této infekce byli ze studie vyřazeni.
Klinické a laboratorní vyšetření
Pozitivní epidemická situace v rodině a rychlý nástup teplot, únavy, svalových bolestí, kašle nebo dušnosti byly typickými úvodními informacemi. Chronická rizika pacientů byla uvedena ve zdravotní dokumentaci a dobře známa. Podrobné klinické vyšetření s hodnocením prokrvení sliznic, frekvence a hloubky dechu, dechového úsilí, pohybů hrudníku během dechového cyklu, poslechového nálezu a pulzní oxymetrie odkrylo závažnou respirační poruchu pacienta. Vyšetření krevních plynů v arteriální krvi s nižší tenzí kyslíku, koncentrací oxyhemoglobinu, saturací hemoglobinu kyslíkem a poklesem hypoxemického indexu (PaO2/FiO2; mm Hg) v kombinaci s normální nebo vyšší tenzí kysličníku uhličitého kvalifikovala funkční změny ve smyslu respirační nedostatečnosti nebo selhání.
Soubor laboratorních testů standardně doplnila tato další vyšetření: krevní obraz s diferenciálním rozpočtem leukocytů v periferní krvi, C-reaktivní protein, prokalcitonin, jaterní aminotransferázy v séru; laktát v plazmě, ionogram, urea a kreatinin v séru i moči, cytologické a chemické vyšetření moči. U ventilovaných pacientů s ALI byly odebírány vzorky krve a tracheálního aspirátu pro imunoanalytické stanovení cytokinů (TNF-α, IL-6), matrixové methaloproteinázy-9 (MMP-9) a jejího tkáňového inhibitoru (TIMP-1).
Rentgenové a sonografické vyšetření hrudníku
Přehledný RTG skiagram a CT vyšetření hrudníku s vysokým rozlišením (HR-CT) byly použity k hodnocení morfologie plicního parenchymu a pleurálního prostoru [4, 5]. Rozsah kolekce pleurální tekutiny byl kontrolován opakovaným transtorakálním sonografickým vyšetřením hrudníku (sonda 5 MHz; MicroMaxx; SonoSite Inc.; USA) v sedu nebo supinační poloze pacienta.
Hodnocení plicního poškození
Kvalitativně-kvantitativní skórovací systém Lung Injure Score (LIS) přiděluje body vybraným klinickým příznakům, rozsahu infiltrace nebo kongesce plicní tkáně na přehledném RTG snímku hrudníku a hodnotě hypoxemického indexu. Výsledná hodnota skóre v rozsahu 1,5–2,0 body odpovídá ALI, skóre LIS >2,0 body svědčí pro ARDS [6].
K vyjádření aktuálního rizika časné mortality hospitalizovaného pacienta byl použit prospektivní bodový skórovací systém Predicted Risk Index Score of Mortality (PRISM) s pediatrickou modifikací, který boduje vybrané klinické příznaky a laboratorní testy [7]. Výsledný počet bodů je přímo úměrný riziku časné mortality (%).
Mikrobiologická vyšetření
Virologická diagnostika se opírala o kombinaci několik metod: komplement fixační reakci séra (KFR) a test inhibice hemaglutininu (HIT) pro stanovení typově až kmenově specifických imunoglobulinů proti antigenům chřipky typu A, B; v tracheálním aspirátu izolace viru na buněčné kultuře psí ledviny (MDCK) a polymerázová řetězová reakce v reálném čase (RT-PCR) k detekci RNA viru a určení podtypů.
Pro kultivační bakteriologické vyšetření byl pacientům odebrán relevantní biologický materiál: tracheální aspirát, krev, moč, případně pleurální tekutina. Moč dětí byla vyšetřena na přítomnost antigenu Streptococcus pneumoniae.
Základní léčba
Protiinfekční léčba byla zahájena empiricky podáním penicilinu-G (300 000 j/kg/24 hod) intravenózně. Na základě informací o citlivosti bakteriálního kmene z tracheálního aspirátu byla provedena změna za cefotaxim (100 mg/kg/24 hod), klindamycin (40 mg/kg/24 hod), oxacillin (200 mg/kg/24 hod), meropenem (60 mg/kg/24 hod) nebo ampicilin-sulbactam (60 mg/kg/24 hod). U probíhající infekce virem chřipky podtypu Pandemic A (H1N1) byl podáván enterálně oseltamivir (30–75 mg/12 hod), u závažnějšího průběhu onemocnění v kombinaci se zanamivirem (4krát denně 5 mg inhal. plv.) mikronebulizátorem do dýchacího okruhu.
Umělá plicní ventilace (Avella; USA, Servo-i Maquet; Sveden) trvalým pozitivním tlakem byla vedena v konvenčním, tlakem kontrolovaném režimu a protektivním nastavení. Nekonvenční doplňky umělé plicní ventilace, jako tracheální insuflace plynu (TGI; průtok <1 litr/min), inhalace oxidu dusnatého (i-NO; 30 ppm; Pulmonox mini; USA) a ventilace v pronační poloze (PPV) nebo nekonvenční vysokofrekvenční oscilační ventilace (HFOV; SensorMedix; Netherland), byly indikovány u nejtěžších forem plicního postižení. Neinvazivní ventilace byla realizována nosní kanylou, kontinuálním pozitivním tlakem 4 cmH2O (nasal-CPAP; Servo-i Maquet). Hrudní interkostální drén zaváděl intenzivista pacientům v celkové anestezii pod sonografickou navigací. Permanentní hrudní sání v uzavřeném systému (PleurEvac; USA) bylo vedeno podtlakem –20 cmH2O. Pokles denního množství odvedené pleurální tekutiny pod 3,0 ml/kg/24 hod, sonograficky měřená pleurální distance přesahující 10 mm s viditelnými pleurálními adhezemi byly indikací pro intrapleurální fibrinolýzu s instilací fibrinolytika hrudním drénem do pleurálního prostoru (streptase 250 000 I.U./dávku, resp. alteplase 25 mg/dávku ve 40 ml temperovaného fyziologického roztoku).
Po prodělaném onemocnění a ukončení akutní léčby byly děti souboru zařazeny do dlouhodobé dispenzární péče pneumologické ordinace Dětské kliniky LF UK a FN Plzeň.
Statistická analýza
Získaná data byla zaznamenána do PC databáze. Vypočteny byly základní parametrické hodnoty: průměr (mean), směrodatná odchylka (± SD). Studentův t-test a Pearsonova regresní analýza byly použity pro porovnání rozdílu ve skupinách a korelaci proměnných veličin (software Statistika 08).
Výsledky
Základní charakteristika pacientů při zahájení léčby je uvedena v tabulce 1. Celkem 6 pacientů (67 %) souboru bylo zatíženo chronickým rizikem. Rizikové děti nebyly vakcinované proti sezonní chřipce A ani proti pandemickému podtypu A (H1N1) 2009. Dvě děti souboru (22 %) byly vakcinované nekompletně proti Streptococcus pneumoniae. Jednostrannou pneumonii mělo 7 dětí (78 %), oboustrannou 2 děti souboru. Jednostranný empyém hrudníku měly 4 děti (44 %) s intrapleurální fibrinolýzou průměrně 2,0 ± 1,0 dávkami fibrinolytika. Dítě č. 4 mělo pneumonii s komunikujícím abscesem, empyém hrudníku s kolapsem plicního křídla, pacienti č. 5 a č. 9 měli spontánní tenzní pneumotorax.
1. Charakteristika pacientů. 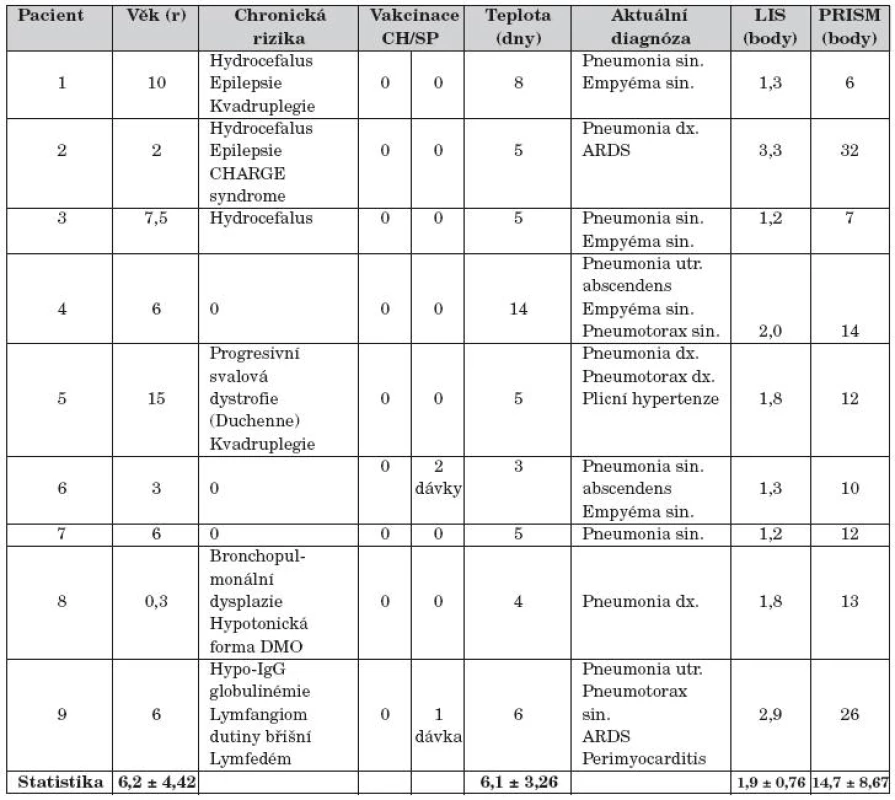
LIS – Lung Injure Score; PRISM– pediatrická varianta Predicted Risk Index Score ofMortality; CH – sezonní vakcína 2009 proti chřipce typu A; SP – polysacharidová, konjugovaná vakcína proti Streptococcus pneumoniae; ARDS – Acute Respiratory Distress Syndrome; CHARGE syndrom – oční coloboma, srdeční vada, atrézie nosních choan, retardace růstu a vývoje, abnormity genitálu a močového ústrojí, ušní abnormity a hluchota; DMO – dětská mozková obrna
Statistika uvádí průměr a směrodatnou odchylku (mean ± SD)Ve standardních laboratorních testech souboru byl zvýšen C-reaktivní protein v séru (CRP; 176 ± 98,35; p <0,01) a celkový počet leukocytů v periferní krvi (WBC; 18,79 ± 3,22; p <0,05), naopak snížen absolutní počet lymfocytů v periferní krvi (B-Ly abs.; 0,045 ± 0,07; p <0,001) a hypoxemický index (PaO2/FiO2; 213 ± 57,43; p <0,001). Ostatní data nevykazovala významné odchylky od referenčních hodnot. Imunoanalýza s daty TNF-α, IL-6, MMP-9 a TIMP-1 nebyla pro publikaci kompletní.
Výsledky mikrobiologických nálezů u pacientů jsou uvedeny v tabulce 2. Infekce virem chřipky typu A byla prokázána metodou KFR v séru 9 dětí, v tracheálním aspirátu byl virus izolován metodou MDCK v 5 případech (56 %). Pandemický podtyp viru chřipky A (H1N1) 2009 byl prokázán u 6 dětí souboru (66 %), u jednoho dítěte podtyp A (H3N2) a u jednoho dítěte kombinovaná infekce virem chřipky A i chřipky B. Sekundární bakteriální infekce byla zjištěna u 8 dětí souboru (89 %). Z tracheálního aspirátu byl u 3 dětí kultivován Streptococcuspneumoniae, Klebsiella pneumoniae u 2 pacientů a u jednoho Staphylococcus aureus. V pleurální tekutině byl kultivačně jedenkrát prokázán Streptococcus pneumoniae. Antigen Streptococcus pneumoniae v moči byl pozitivní u 6 dětí.
2. Mikrobiologická vyšetření. 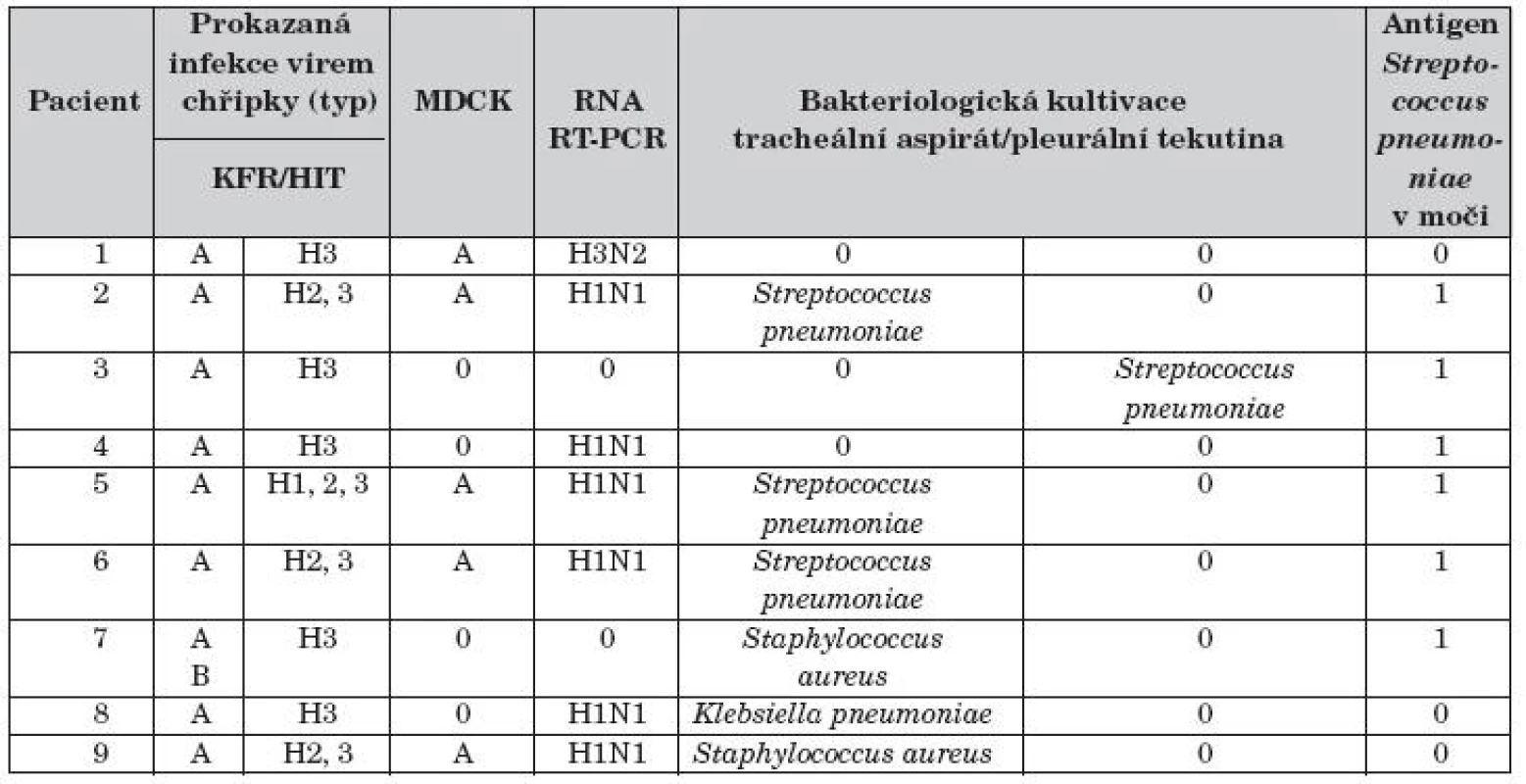
KFR – komplement fixační reakce k odlišení typově specifických imunoglobulinů proti antigenům virů chřipky; HIT – test inhibice hemaglutininu ke stanovení podtypově specifických imunoglobulinů proti antigenům virů chřipky; MDCK – izolace viru chřipky na buněčné kultuře psí ledviny; RNA RT-PCR – polymerázová řetězová reakce v reálném čase; H1N1 – pandemický podtyp viru chřipky A (Pandemic A/H1N1/2009)
Výsledek 0 – negativní; Výsledek 1 – pozitivníZákladní prostředky a výstupy léčby pacientů souboru jsou uvedeny v tabulce 3. Pět pacientů s respiračním selháním (56 %) bylo léčeno umělou plicní ventilací průměrně 11,2 dní (SD 3,29 dní), čtyři nekonvenčně: HFOV 5 dní u dítěte č. 2, TGI 2 dny u pacienta č. 8, PPV 2 dny u dítěte č. 9 a i-NO 28 hodin s přechodem na sildenafil (1,25 mg/kg/24 hod enterálně) u pacienta č. 5 s hypoxickou plicní arteriální hypertenzí (mPAP 60 mm Hg). Čtyři děti souboru s projevy respirační nedostatečnosti (44 %) byly léčené NIV průměrně 1,9 dne (SD 0,85 dne). Oseltamivir užívalo celkem 5 dětí (56 %) souboru, jeden pacient v kombinaci se zanamivirem 2 týdny. Antibiotiky bylo léčeno 9 dětí souboru (100 %), 4 pacienti podle aktuální citlivosti bakteriálních kmenů postupně několika antibiotiky. Žádné z dětí nemělo bakteriémii nebo sepsi.
3. Základní prostředky a výstupy léčby. 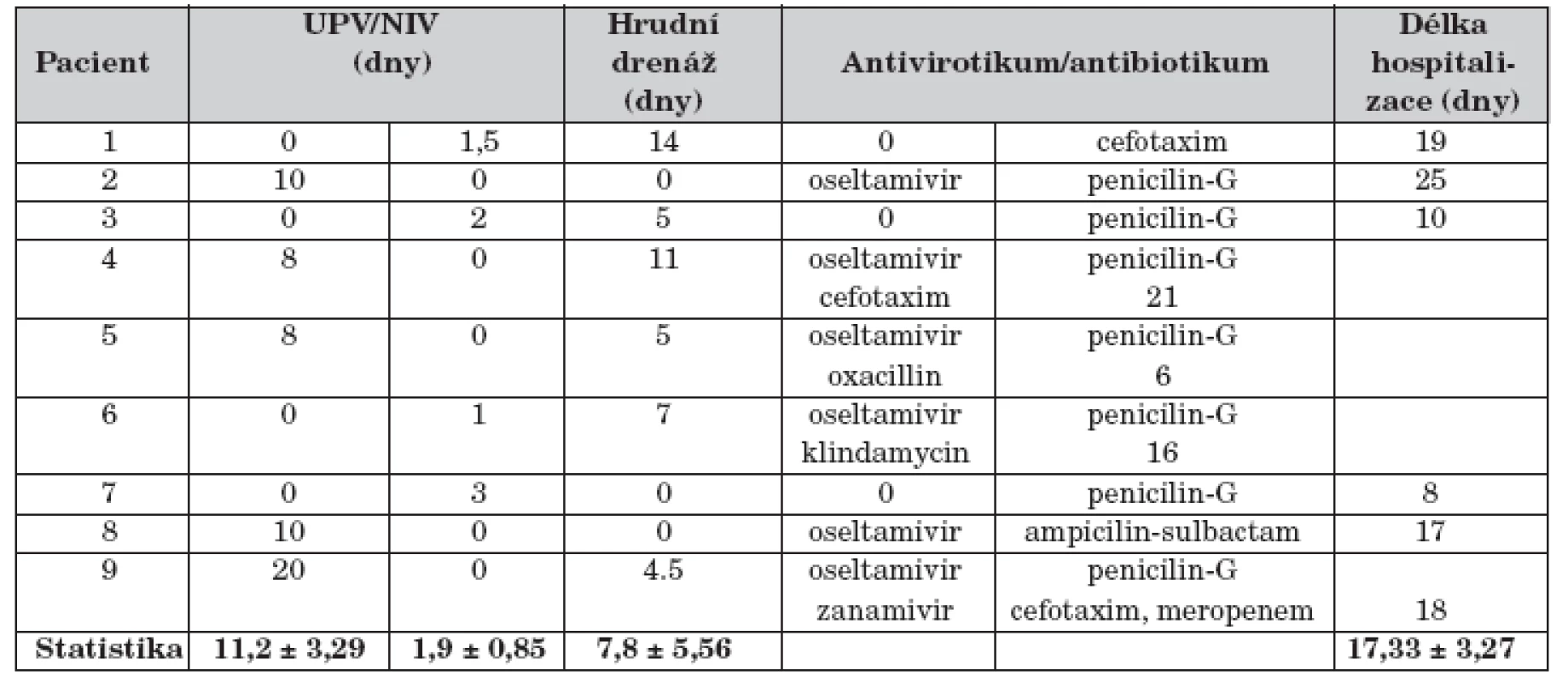
UPV – umělá plicní ventilace; NIV – neinvazivní ventilace
Statistika je uvedena jako průměr a směrodatná odchylka (mean ± SD)Hodnota LIS nepřímo korelovala s věkem pacienta souboru (r = –0,340; p <0,05) a přímo korelovala s hodnotou PRISM (r = 0,965; p <0,01) i trváním ventilační podpory (r = 0,256; p <0,05). Minimální rozptyl hodnot byl v datech PRISM (t = 2,553; p <0,05) a délky hospitalizace (t = 2,717; p <0,05). Z nezávislých proměnných byla regresní analýzou vybrána data s příčinným vztahem k hodnotě LIS: absence vakcinace (r = 0,989; p <0,001), sekundární bakteriální infekce (r = 0,543; p <0,01) a chronické riziko (r = 0,425; p <0,05).
Závažnost poškození plic v průběhu kombinované infekce dokumentují vstupní RTG nálezy pacientky č. 4 na obrázcích 1 a 2.
1. Přehledný RTG skiagram hrudníku pacientky č. 4 ze dne 27. 11. 2009 v A-P projekci na lůžku po přijetí, inzerci centrálního žilního katétru a interkostálního hrudního drénu. – Kompletní zastření levého plicního křídla s kompresí plicního parenchymu (šipka) a tekutinou v pleurálním prostoru. Pravé plicní křídlo s difuzně zmnoženou bronchovaskulární a intersticiální plicní kresbou. Centrální žilní katétr z levé podklíčkové žíly končí na počátku pravé srdeční síně, tracheální kanyla s koncem3 cmnad větvenímhlavních bronchů. Hrudní drén v 6.mezižebří vlevo leží nad bránicí.<br> Fig. 1. General chest X-ray of a female patient No. 4 fromNovember 27, 2009 in A-P projection in bed after admission, insertion of central venous catheter and intercostals thorax drain. – A complex blurred left lung wing with compressed lung parenchyma (arrow) and a fluid in the pleural space. The right lung wing displaying diffusely multiplied bronchovascular and interstitial lung lineation. The central venous catheter from the left subclavicular vein ends in the beginning of the right cardiac auricle and the tracheal cannula ends 3 cm above the ramification of the main bronchi. The thoracic drain in the 6th intercostals on the left is situated above the diaphragm. 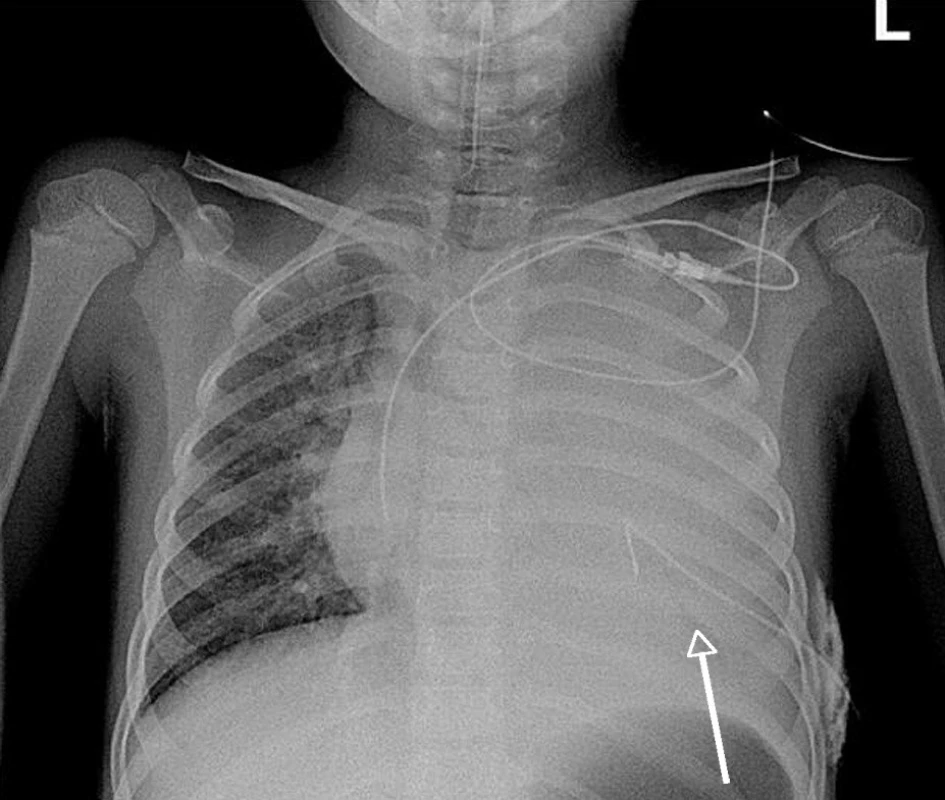
2. CT vyšetření hrudníku téže pacientky ze dne 30. 11. 2009. – Kompletní kolaps levého plicního křídla směrem k hilu (šipky), ventrálně pneumotorax, dorzálně ostrá hranice kolekce pleurální tekutiny, jejíž denzitometrie odpovídá empyému.<br> Fig. 2. CT examination of thorax from November 30, 2009 as observed in the same patient. – A complete collapse of the left lung wing in the direction of hilus (arrows), pneumothorax in ventral direction and a sharp border of collected pleural fluid dorsally, with densitometry character corresponding to empyema. 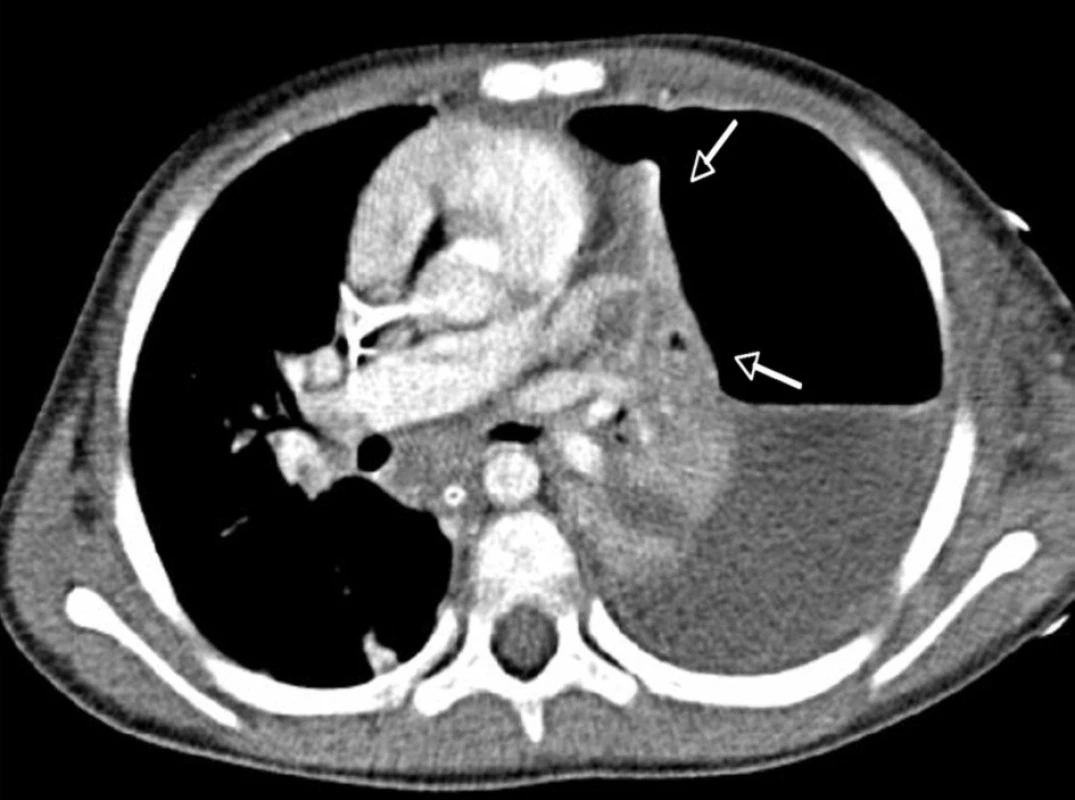
Diskuse
Virové pneumonie se řadí do skupiny infekcí získaných v komunitě (Community-Acquired Pneumonia; CAP) a u dětí se vyskytují s vysokou četností a závislostí, která prakticky kopíruje aktuální epidemiologickou situaci populace [1].
Aktivní formou prevence onemocnění chřipkou typu A je sezonní vakcinace, která u imunologicky kompetentního jedince navodí dostatečnou postvakcinační imunogenitu [8]. Proti pandemickému podtypu viru chřipky typu A byla vyvinuta vakcína s aktuálním antigenem (A/California/ /7/2009 (H1N1) v-like strain (X-179A) [9–10]. Polysacharidové vakcíny s obsahem antigenů bakterie Streptococcus pneumoniae jsou konjugované s mutantním difterickým proteinem CRM197. Po kompletní vakcinaci lze očekávat dostatečnou postvakcinační imunogenitu [11]. Rodiče dětí našeho souboru se obávali rizik a nepovinnou vakcinaci proti chřipce a infekci Streptococcus pneumoniae u dětí s chronickým rizikem odmítali. Dvě děti našeho souboru vakcinaci zahájily, ale v době onemocnění nebyla kompletní.
Prostředky pasivní prevence a léčby infekce virem chřipky typu A nebo B jsou léky, selektivně inhibující virovou neuraminidázu. Pro děti od 1 roku věku je doporučen oseltamivir (Tamiflu; suspenze s obsahem 12 mg/ml pro enterální aplikaci), pro pacienty nad 5 let věku zanamivir (Relenza; prášková forma v diskhaleru s obsahem 5 mg/dávku k inhalacím). Léčba musí být zahájena co nejdříve, nejlépe během prvých dvou dnů od nástupu příznaků chřipky. Bezpečnost a účinnost přípravků v léčbě i prevenci chřipky u pacientů se sníženou funkcí imunitního systému nebyly stanoveny [12, 13]. Závazné postupy pro prevenci a léčbu chřipky s primárně virovou pneumonií jsou dostupné na stránkách DHQP [14]. Žádný z našich pacientů neužíval ambulantně antivirotika.
Rychlá progrese komplikací primárně virových pneumonií byla objasněna. Replikace viru chřipky na sliznicích respiračního traktu vede k destrukci epiteliálních buněk dolních dýchacích cest a plicních sklípků. Poškozená tkáň aktivuje intersticiální makrofágový systém a vyvolává nadprodukci nitric oxide syntázy. Přestup monocytů z periferní krve a exprese alveolárních makrofágů vede k významné kumulaci silně potentních makrofágů v plicní tkáni. Makrofágy produkují cytokiny, chemokiny a leukotrieny, které aktivují apoptózu alveolárních buněk a potencují replikaci viru chřipky. Výsledkem rychle probíhajících reakcí je destrukce slizničních bariér, včetně životně důležité alveolo-kapilární membrány [15, 16, 17, 18]. Oxidativní stres v infikované plicní tkáni zvyšuje transkripci enzymů (mangan-superoxid-dysmutáza, indolamin-2,3-dioxygenáza, hem-oxygenázy-1 a glutathion-peroxidázy), která asociuje s vyšší mortalitou pacientů [19]. Virová infekce aktivně snižuje buněčnou imunitu hostitelského organismu snížením počtu lymfocytů v krvi.
V našem souboru byla průměrná hodnota absolutního počtu lymfocytů v periferní krvi extrémně nízká (p <0,001). Změna buněčné imunity organismu a lokální destrukce mukózních membrán respiračního systému zvyšují pravděpodobnost sekundární bakteriální infekce [20]. Retrospektivní klinické metaanalýzy uvádí až 35–58% mortalitu ventilovaných pacientů se sekundární bakteriální infekcí a podporují kombinovanou léčbu antivirotikem s antibiotikem [21, 22, 23, 24, 25, 26].
Interakcí mezi virem chřipky a bakteriálními respiračními patogeny se zabývala řada vědeckých prací [27, 28]. Al-Kabi et al. (2006) upozorňují na vysoký výskyt invazivních kmenů Streptococcus pneumoniae v souvislosti s chřipkou typu A. Uvádí, že současné diagnostické metody odhalí pouze 48 % reálné kolonizace plic tímto bakteriálním kmenem [29]. U 89 % pacientů našeho souboru byla prokázána sekundární infekce kryptogenními mikroorganismy Streptococcus pneumoniae, Klebsiella pneumoniae a Staphylococcus aureus. Predikovaná mortalita dětí našeho souboru byla 12 %, reálná mortalita byla 0 %. K úspěchu přispěla kombinovaná strategie léčby s účelně vedenou ventilační podporou.
Novou koncepci kombinované léčby s cílem ovlivnit intersticiální infiltraci plic, utlumit cytokinové bouře a fibroproliferaci přineslo několik klinických prací [30, 31]. Navrhují kombinovat oseltamivir s methyl-prednisolonem (1,0 mg/kg/24 hod i.v.) po dobu 10 až 16 dní. Výsledky studií jsou povzbudivé, ale s nízkou silou argumentace. Systémová léčba steroidy v této indikaci nebyla zařazena do závazných doporučení a v současné době je indikací „of label“ [14].
Autoři předložené práce si uvědomují limitaci ve smyslu nízkého počtu pacientů, který mohl ovlivnit statistické zpracování dat, ale neovlivnil klinické výstupy studie. Předběžné výsledky léčby jsou výrazně lepší ve srovnání se závěry rozsáhlých klinických studií u dospělých pacientů [21, 22, 23, 24].
Předložená práce poskytuje prvá zpracovaná data dětí se závažnými komplikacemi chřipky typu A v České republice.
Závěry
Absence vakcinace proti Streptococcus pneumoniae a sezonní chřipce typu A, sekundární bakteriální infekce a chronické riziko jsou faktory rozvoje rychle progredujících plicních komplikací v průběhu onemocnění u dětí. Život ohrožující komplikace vyžadují léčbu dětí na specializovaném pracovišti. Časné zahájení účinné léčby snížilo mortalitu, riziko komplikací a trvalých následků.
Finanční podpora: Výzkumný záměr MŠMT a Lékařské fakulty UK v Plzni č. MSM 0021620819-6096.
Doc. MUDr. Jiří Kobr, PhD.
Dětská klinika FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: jiri.kobr@lfp.cuni.cz
Sources
1. Zarocostas J. H1N1 pandemic flu found to cause viral pneumonia in severe case says WHO. Brit. Med. J. 2009;doi: 10.1136/bmj.b4313.
2. Perez-Padilla R, de la Rosa-Zamboni D, Ponce de Leon S, Hernandez M, Qiuňones-Falconi F, et al. Intensive-care patients with severe novel influenza A (H1N1) virus infection-Michigan. MMWR Morb. Mortal Wkly Rep. 2009; 58 : 749–752.
3. Trupy RD. Ethical assessment of pediatric research protocols. Intensive Care Med. 2008; 34 : 198–202.
4. Oikonomou A, Müller NL, Nentel S. Radiographic and high-resolution CT findings of influenza virus pneumonia in patients with hematologic malignancies. Am. J. Roentgenol. 2003 : 181 : 507–511.
5. Agarwal PP, Cinti S, Kayerooni EA. Chest radiographic and CT findings in novel Swine-origin influenza A (H1N1) virus (S-OIV) infection. Am. J. Roentgenol. 2009; http://ajponline.org/ahaedofprint/ 12_09_3599.pdf.
6. Lung Injury Score Download, upgrade 2009; http://www.pdacortex/Lung_Injury_Score_Down - load.htm.
7. ADO index may help Predict Risk for Mortality from COPD, upgrade 2009; http://www. medscape.com/viewarticle/708492.
8. VAXIGRIP® Data Sheet, upgrade 2009; http://www.influenza.org.nz/site_resources/influen-za%202009/vaxigrip_datasheet_2009.pdf.
9. European Medicines Agency Pandemic influenza (H1N1) vaccine information, Pandemrix, 2009; http://www.ema.eurpa.eu/influenza/vaccines/pande-mrix/pandemrix.html.
10. European Medicine Agency Pandemic influenza (H1N1) website, European strategy for influenza A/H1N1 vaccines benefit-risk monitoring. Vaccine information, 2009; http://www.ema.europa. eu/influenza/vaccines/home.htm.
11. Prevenar 13, pneumokoková polysacharidová konjugovaná vakcína (13-valentní, adsorbovaná), 2009; http://ema.europa.eu/humandocs/pdfs/epar/prevenar 13/h-1104-cs1.pdf.
12. Oseltamivir-Wikipedia, 2009; http.://en.wikipedia. org/wiki/oseltamivir.
13. Zanamivir-Wikipedia, free file, 2009; http://en.wikipedia.org/wiki/File:Zanamivir.png.
14. Influenza (Flu) in Healthcare Settings. Guideline Excerpt from: Guidelines for Preventing Healthcare Associated Pneumonia: Healthcare-Associated Influenza (Flu) Guidelines. Date last modified: April 15, 2009, Content source: Division of Healthcare Quality Promotion (DHQP), National Centre for Preparedness, Detection, and Control of Infectious Diseases; http://www.cdc.gov./ncidod/dhqp/id_ influenza_pneuExcerpt.html.
15. Herold S, Steinmueller M, von Wulffen W, Cakarova L, Pinto R, et al. Lung epithelial apoptosis in influenza virus pneumonia: the role of macrophage-expressed TNF-related apoptosis-including ligand. J. Exp. Med. 2008; 205(13): 3065–3077.
16. Martin TR, Hagimoto N, Nakanuta M, Matute-Bell G. Apoptosis and epithelial injury in the lungs. Proc. Am. Thorac. Soc. 2005; 2 : 214–220.
17. Lin KL, Sužuji Y, Nakano H, Ramsburg E, Guán MD. CCR2+ monocyte-derived dendritic cells and exudate macrophages produce influenza-induced pulmonary immune pathology and mortality. J. Immunol. 2008; 180 : 2562–2572.
18. Akaike T, Noguchi Y, Ujiti S, Setoguchi K, Suga M, et al. Pathogenesis of influenza virus-induced pneumonia: Involvement of both nitric oxide and oxygen radicals. Proc. Natl. Acad. Sci. USA 2009; 93 : 2448–2453.
19. Choi AM, Knobil K, Otterbein SL, Eastman DA, Jakoby DB. Oxydant stress response in influenza virus pneumonia: gene expression and transcription factor activation. Am. J. Physiol. Lung Cell Mol. Physiol. 1996; 272 : 383–391.
20. Medical News Today. Analysis of the Connection between Flu and pneumonia. Helmholtz Centre for Infection Research; upgrade 2009; http://www. medicalnewstoday.com/articles/142829.php.
21. Perez-Padilla R, de la Rosa-Zamboni D, Ponce de Leon S, Hernandez M, Qiuňones - Falconi F, et al. Pneumonia and respiratory failure from Swine-origin influenza A (H1N1) in Mexico. N. Engl. J. Med. 2009; 361 : 680–689.
22. Perez-Padilla R, de la Rosa-Zamboni D, Ponce de Leon S, Hernandez M, Qiuňones-Falconi F, et al. Intensive-care patients with severe novel influenza A (H1N1) virus infection-Michigan. MMWR Morb. Mortal. Wkly Rep. 2009; 58 : 749–752.
23. Dawood FS, Jain S, Finelli L, Shaw MW, Lindstrom S, et al. Emergence of a novel swine-origin influenza A (H1N1) virus in humans. N. Engl. J. Med. 2009; 360 : 2605–2615.
24. Dawood FS, Jain S, Finelli L, Shaw MW, Lindstrom S, et al. Hospitalized patients with novel influenza A (H1N1) virus infection-California. MMWR Morb. Mortal. Wkly Rep. 2009; 58 : 536–541.
25. Rello J, Rodrigez A, Ibanez P, Socias L, Cebrian J, group THNSw. Intensive care adult patients with severe respiratory failure cause by influenza A(H1N1)v in Spain. Crit. Care 2009; 13: R148.
26. Kuhn GJ. Pneumonia, Viral. eMedicine Emergency Medicine, 2009; http://emedicine. medscape.com/article/808013.
27. Gusta RK, Nguyen-Van-Tam RG, Nguyen-Van-Tam JS. Bacterial pneumonia and pandemic influenza planning. Emerg. Infect. Dis. upgrade 2008; http://www.cdc.gov/EID/content/14/8/1187.htm.
28. Brundage JF. Interactions between influenza and bacterial respiratory pathogens: implifications for pandemic preparedness. Lancet Infect. Dis. 2006; 6 : 303–312.
29. Al-Kaabi N, Solh Z, Pacheco S, Murray L, Gaboury I, Le Saoux N. A comparison of group A streptococcus versus Streptococcus pneumoniae pneumonia. Pediatr. Infect. Dis. J. 2006; 25 : 1008–1012.
30. Kawayama T, Fujiki R, Rikimaru T. Clinical study of severe influenza pneumonia that cause acute respiratory failure. Kurume Med. J. 2009; 48(4): 273–279.
31. Quispe-Laime AM, Bracco JD, Barberio PA, Rolfo VE, Umberger R, Meduri GU. H1N1 influenza A virus – associated acute lung injury: response to combination oseltamivir and prolonged corticosteroid treatment. Intensive Care Med. 2010; 36 : 33–41.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2010 Issue 6-
All articles in this issue
- Hydroa vacciniforme
- Risk of Hormonal Contraceptives in Adolescent Girls
- Thromboembolic Events in Girls and Young Women Taking Hormonal Contraception
- Inherited Thrombophilic Tendencies and Oral Contraceptive Pills
- Rapidly Progressive Complications of the Influenza A Type in Children
- Methotrexate in Children with Juvenile Idiopathic Arthritis
- Body Temperature and Thermoregulation in the Newborn
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Body Temperature and Thermoregulation in the Newborn
- Rapidly Progressive Complications of the Influenza A Type in Children
- Methotrexate in Children with Juvenile Idiopathic Arthritis
- Thromboembolic Events in Girls and Young Women Taking Hormonal Contraception
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

